Журнал неорганической химии, 2019, T. 64, № 7, стр. 690-699
Физико-химические свойства брушита и гидроксилапатита, синтезированных в присутствии хитина и хитозана
Т. В. Фадеева 1, *, О. А. Голованова 1
1 Омский государственный университет им. Ф.М. Достоевского
644077 Омск, пр-т Мира, 55а, Россия
* E-mail: tanya_14.63@mail.ru
Поступила в редакцию 06.09.2018
После доработки 09.01.2019
Принята к публикации 15.02.2019
Аннотация
Представлены результаты исследования свойств синтезированных композитов на основе дикальцийфосфата двухводного (брушита) и гидроксилапатита в полимерной матрице хитина и хитозана. Показано, что размер кристаллитов возрастает с увеличением содержания хитозана и хитина в составе композитов. Установлено, что при растворении образцов в изотоническом растворе скорость деградации композитов на основе брушита уменьшается с возрастанием содержания хитозана и хитина в составе образцов, а для композитов на основе гидроксилапатита характерна противоположная зависимость. Показано изменение массы образцов в результате термической обработки.
ВВЕДЕНИЕ
Современное материаловедение в области разработки биокомпозитов ставит перед собой задачу поиска новых полимеров, способных к разложению в природной среде, а также рассматривает возможность создания безопасных и экологичных процессов выделения полимеров из исходного сырья и их дальнейшую переработку, получение продукта, соответствующего нормам и требованиям при его использовании [1].
В связи с этим особое значение имеет создание новых биодеградируемых материалов медицинского назначения, предназначенных для контакта со средой живого организма и необходимых для разработки инновационных лекарственных форм, восстановления поврежденных тканей, повышения биосовместимости используемых материалов [1–3]. Такие материалы должны быть нетоксичными, а их структура характеризоваться высокой пористостью с размером пор до десятков микрометров и способностью иметь каналы для миграции необходимых веществ к матрице полимера [2, 4, 5].
С целью применения для создания новых материалов всестороннему исследованию подвергались такие биополимеры, как хитин и хитозан [6–12].
Данные соединения являются аморфно-кристаллическими полимерами, для которых характерно явление полиморфизма [6]. Хитин и хитозан – нерастворимые в воде полимеры. Отличительным химическим свойством хитозана является его способность растворяться в разбавленных растворах кислот, например уксусной или соляной, в то время как хитин не растворяется даже в концентрированных кислотах [7, 8].
Хитозан – простейшее производное хитина, образующееся при его деацетилировании, – обладает уникальными биологическими свойствами: может предотвращать развитие инфекций, снижать уровень холестерина в крови, проявляет иммуномодулирующее действие, а также бактерицидную и ранозаживляющую активность [7, 9].
Хитин, извлеченный в основном из моллюсков, представляет собой биополимер на основе мономера N-ацетилглюкозамина [10]. Это второй (после целлюлозы) по распространенности в природе полисахарид, строение которого создает предпосылки для успешного его применения в самых разнообразных областях. Хитин является основой скелетной системы в панцирях ракообразных, кутикуле насекомых, клеточной стенке грибов и бактерий [10–12].
Благодаря биосовместимости с тканями человека, способности усиливать регенеративные процессы при заживлении ран, наличию бактериостатических/бактерицидных свойств хитин и хитозан представляют большой интерес для использования их в качестве матриц при создании биокомпозитов на основе неорганических веществ.
Наиболее интересны в качестве неорганической компоненты в составе композиционных материалов фосфаты кальция – дикальцийфосфат двухводный (ДКФД, брушит) и гидроксилапатит (ГА) [13–20].
Считается, что образование брушита происходит на промежуточном этапе в процессе минерализации костной ткани и при разрушении эмали [13–17]. Гидроксилапатит – наименее растворимый из всех ортофосфатов кальция. Чистый ГА никогда не встречается в биологических системах, однако из-за схожести его химического состава с компонентами кости и зубного минерала композит широко применяется в ортопедии и травматологии [18–20].
Композиционные материалы, синтезированные на основе данных фосфатов кальция и природных полимеров хитозана и хитина, могут обладать высокой биосовместимостью и биоактивностью [21], остеоиндуктивностью [22], резорбируемостью [23].
Целью данной работы является синтез, исследование и сравнение физико-химических свойств композитов на основе фосфатов кальция (ГА, ДКФД) с полимерами хитин и хитозан.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Синтез композитов ДКФД-хитозан (хитин) и ГА-хитозан (хитин)
Проведено четыре эксперимента (табл. 1).
Таблица 1.
Объекты исследования
| Состав объекта | Масса добавляемого в раствор полимера, г | Са/Р | Масса синтезированного образца, г | |
|---|---|---|---|---|
| неорганический компонент | полимер | |||
| ДКФД | Хитозан | 0.02 | 1.0 | 2.3658 |
| ДКФД | Хитозан | 0.08 | 2.8490 | |
| ДКФД | Хитозан | 0.16 | 3.3224 | |
| ДКФД | Хитин | 0.02 | 1.0 | 2.6013 |
| ДКФД | Хитин | 0.08 | 2.8043 | |
| ДКФД | Хитин | 0.16 | 3.0144 | |
| ГА | Хитозан | 0.02 | 1.7 | 2.6625 |
| ГА | Хитозан | 0.08 | 2.7676 | |
| ГА | Хитозан | 0.16 | 2.8464 | |
| ГА | Хитин | 0.02 | 1.7 | 4.6329 |
| ГА | Хитин | 0.08 | 4.5826 | |
| ГА | Хитин | 0.16 | 4.8102 | |
Синтез композита ДКФД-хитозан проводили в присутствии хитозана высокомолекулярного (Крусхитозан С, ФГУП “ТИНРО-Центр”, М = = 38 000), при 25°С готовили растворы гидрофосфата аммония и нитрата кальция объемом 500 мл каждый. Концентрация растворов нитрата кальция Са(NO3)2 (х. ч.) и гидрофосфата аммония при синтезе ДКФД составляла 0.050 моль/л. В колбу с раствором NH4HPO4 (х. ч.) добавляли навеску хитозана массой 0.02, 0.08 или 0.16 г.
Раствор, содержащий нитрат кальция, смешивали с раствором, содержащим гидрофосфат аммония и взвесь полимера (общий объем раствора 1000 мл), и с помощью магнитной мешалки перемешивали в течение 15 мин. Значение рН поддерживали равным 5.5 ± 0.5, добавляя 15%-ный раствор HNO3. Реакция осаждения ДКФД может быть представлена схемой:
(1)
$\begin{gathered} {\text{С а }}{{({\text{N}}{{{\text{O}}}_{{\text{3}}}})}_{{\text{2}}}} + {\text{N}}{{{\text{H}}}_{{\text{4}}}}{\text{HP}}{{{\text{O}}}_{{{\text{4 }}}}} + {\text{2}}{{{\text{Н }}}_{{\text{2}}}}{\text{О }} = \\ {\text{ = }}\,\,{\text{С а Н Р }}{{{\text{О }}}_{{\text{4}}}}{\text{ }}\cdot{\text{ 2}}{{{\text{Н }}}_{{\text{2}}}}{\text{О }} + {\text{2N}}{{{\text{H}}}_{{\text{4}}}}{\text{N}}{{{\text{O}}}_{{\text{3}}}}. \\ \end{gathered} $Образовавшийся в ходе реакции сопутствующий продукт – нитрат аммония – является растворимым в воде соединением, для его удаления осадок несколько раз промывали дистиллированной водой.
Синтез композита ДКФД-хитин проводили аналогично, вместо хитозана использовали полимер хитин (Biochem, М = 400 000), который добавляли в колбу с раствором NH4HPO4 (СМ = = 0.050 моль/л). Масса добавляемого полимера составляла 0.02, 0.08 или 0.16 г.
Синтез композита ГА-хитозан (Са/Р = 1.70) проводили аналогично синтезу композита ДКФД-хитозан, но рН системы поддерживали на уровне 12.0 ± 0.5 добавлением концентрированного раствора аммиака. При синтезе ГА к раствору гидрофосфата аммония с концентрацией 0.040 моль/л добавляли раствор нитрата кальция с такой концентрацией, чтобы соотношение nисх = Са(NO3)2/(NH4)2HPO4 составляло 1.70. Взаимодействие реагентов происходило по реакции:
(2)
$\begin{gathered} \,\,{\text{1}}0{\text{С а }}{{({\text{N}}{{{\text{O}}}_{{\text{3}}}})}_{{\text{2}}}} + {\text{6N}}{{{\text{H}}}_{{\text{4}}}}{\text{HP}}{{{\text{O}}}_{{{\text{4 }}}}} + {\text{8N}}{{{\text{H}}}_{{\text{4}}}}{\text{OH}} = \hfill \\ {\text{ = }}\,\,{\text{С }}{{{\text{а }}}_{{{\text{1}}0}}}{{\left( {{\text{Р }}{{{\text{О }}}_{{\text{4}}}}} \right)}_{{\text{6}}}}{{({\text{OH}})}_{{\text{2}}}} + {\text{2}}0{\text{N}}{{{\text{H}}}_{{\text{4}}}}{\text{N}}{{{\text{O}}}_{{\text{3}}}} + {\text{6}}{{{\text{Н }}}_{{\text{2}}}}{\text{О }}. \hfill \\ \end{gathered} $При смешивании растворов, содержащих твердую взвесь полимера, происходило образование осадков белого цвета. После выдерживания каждого раствора в течение 72 ч осадок отфильтровывали, промывали от образовавшегося в ходе реакции нитрата аммония и сушили в камере при 80°С до полного удаления воды.
Синтез композита ГА-хитин проводили аналогично синтезу композита ГА-хитозан, вместо хитозана использовали полимер хитин. В колбу с гидрофосфатом аммония добавляли хитин массой 0.02, 0.08 или 0.16 г.
Полученные порошки исследовали физико-химическими методами.
Рентгенофазовый анализ (РФА) порошков проводили на рентгеновском дифрактометре ДРОН-3М методом Дебая–Шеррера, съемку дифрактограмм вели в интервале углов 2θ 10°–60°. Качественный анализ фазового состава образца проводили по данным порошковой дифрактометрии PDF-2. Предел обнаружения методики составляет 5%.
ИК-Фурье-спектроскопия. ИК-спектры снимали на спектрофотометре ФСМ 2202 (Инфраспек, Россия). В ходе исследования образец в виде порошка смешивали с KBr, наносили на германиевую кювету и прессовали. Регистрацию спектров проводили с разрешением 4 см–1, общее число сканирований 50. Спектры исследуемых образцов записывали в области от 400 до 4000 см–1.
Обработку данных осуществляли с использованием программы OriginPro8.0. Предел обнаружения составляет 5%.
Оптическая микроскопия. Изучение морфологии, определение формы частиц твердых фаз проводили методом оптической микроcкопии c помощью микроcкопa серии XSP-140. В качестве материала для исследования использовали осадок фосфатов кальция с добавкой хитозана и хитина. Пробы тонким слоем наносили на часовое стекло и изучали материал под микроскопом. Расчет размеров кристаллов проводили с помощью программы “Toup View”.
Термогравиметрический анализ. В эксперименте образцы композитов (в виде порошков) массой 0.2000 ± 0.0002 г прокаливали в муфельной печи (LF-7/13-G1, LOIPLF) при температурах 200, 400, 600 и 800°С (±2°С) в течение 2 ч после выхода печи на рабочий режим. Прокаленные образцы охлаждали на воздухе до комнатной температуры, затем взвешивали на аналитических весах и переносили в маркированные емкости. По разнице масс до и после прокаливания рассчитывали убыль массы вещества в результате термообработки.
Изучение растворения композитов в 0.9%-ном растворе NaCl. Для изучения кинетических параметров пассивной фазы резорбции 0.2 г композита помещали в 100 мл 0.9%-ного раствора NaCl при 25°С и перемешивали с постоянной скоростью. Значения pCa (единица I-160-MI, ООО “Измерительная техника”, Россия) и pH (единица измерения рН 150 MI, ООО “Измерительная техника”, Россия) фиксировали через регулярные промежутки времени до выхода значения аналитического сигнала на плато. Кинетические кривые обрабатывали в соответствии с алгоритмами, представленными в работах [24, 25].
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
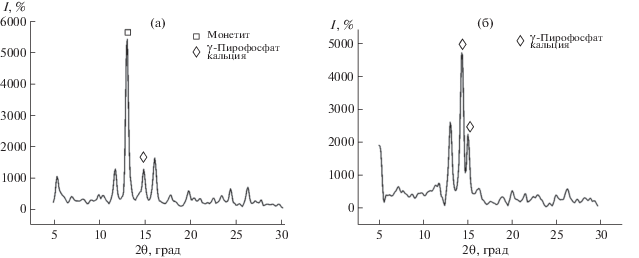
Методом РФА установлено, что полученные композиты ДКФД-хитозан и ДКФД-хитин представлены фазой ДКФД (рис. 1, кривые 1, 2). В изучаемых условиях происходит осаждение кристаллов ДКФД, принадлежащих моноклинной сингонии [26]. Исследование образцов ГА-хитозан и ГА-хитин методом РФА показало, что состав синтезированных образцов, полученных после высушивания, представлен ГА (2θ: 32.0°, 35.0°, 39.5°, 47.0°, 49.0°) с небольшими включениями аморфной фазы (рис. 1, кривые 3, 4).
Рис. 1.
Дифрактограммы образцов, полученных в присутствии 0.08 г/л хитозана и хитина: ДКФД-хитозан (1), ДКФД-хитин (2), ГА-хитозан (3), ГА-хитин (4).
Результаты исследования образцов методом ИК-Фурье-спектроскопии представлены на рис. 2. Для всех синтезированных композитов отмечены характерные полосы поглощения, обусловленные валентными асимметричными колебаниями (1024 и 1154 см–1) связей О–Р–О. Полосы при 530, 574 см–1 соответствуют колебаниям в тетраэдрах ${\text{Р О }}_{4}^{{3 - }}.$ Широкая полоса в области 3489–3583 cм–1 и пик при 3142 cм–1 могут быть отнесены к модaм валентных колебаний Н–О–Н и ОН– соответственно.
Рис. 2.
ИК-спектры образцов, полученных в присутствии 0.08 г/л хитозана и хитина: ДКФД-хитин, ДКФД-хитозан, ГА-хитин, ГА-хитозан.
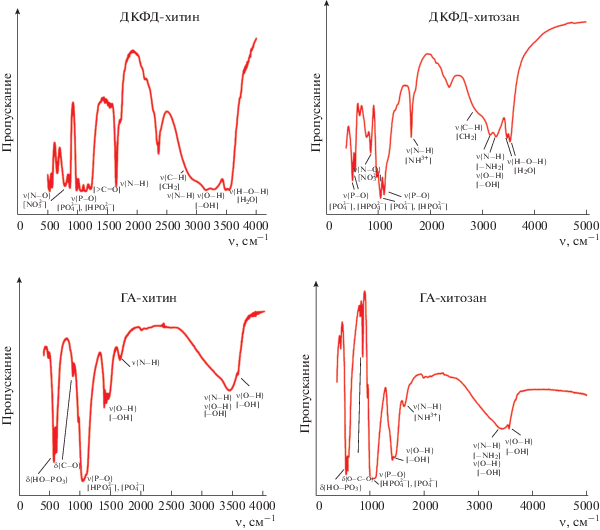
Для хитозана и хитина широкую полосу поглощения при 3290 cм–1 можно отнести к валентным и деформационным колебаниям –ОН- и –NH2-групп, участвующих в образовании внутри- и межмолекулярных связей. Валентные асимметричные колебания связи С–Н в метиленовых компонентах хитозана выявляются при 2876 cм–1. Деформационные колебания ассоциированной аминогруппы ${\text{NH}}_{{}}^{{3 + }}$ в молекулах хитозана соответствуют частоте 1663 cм–1. Для образца ДКФД-хитозан с массой хитозана 0.16 г в исходном растворе при 1239 cм–1 наблюдаются валентные колебания связи >С=О. Для образцов ГА-хитозан и ГА-хитин колебания связи О–С–О проявляются при 877 cм–1 (рис. 2).
Таким образом, структуры синтезированных образцов аналогичны друг другу, отличие в спектрах хитозана и хитина проявляется только в разной интенсивности пиков характерных групп. Анализ ИК-спектров образцов на основе хитозана позволяет предположить, что наиболее вероятным процессом взаимодействия между ДКФД и хитозаном в растворе является фосфорилирование хитозана фосфат-ионами раствора. Взаимодействие ГА и хитозана также протекает через ассоциированную аминогруппу [7].
Для образцов на основе хитина взаимодействие с ДКФД и ГА, вероятно, осуществляется через гидроксильную группу.
Исследование образцов методом оптической микроскопии показало, что образцы ДКФД-хитозан имеют одинаковую пластинчатую форму, характерную для этих кристаллов, в то время как образцы ДКФД-хитин представлены более мелкими кристаллитами неопределенной формы (рис. 3а, 3б). С увеличением содержания хитозана в составе композитов на основе ДКФД размеры кристаллитов увеличиваются (рис. 4а). Для композитов ГА-хитозан отмечена аналогичная закономерность (рис. 3в, 3г, рис. 4а). Такие зависимости объясняются тем, что с увеличением содержания хитозана в растворе увеличивается вязкость растворов, способствуя росту кристаллов за счет процессов диффузии.
Рис. 4.
Зависимость среднего размера агрегатов частиц (мкм) от массы хитозана (а) и хитина (б), г: 1 – ДКФД-хитозан; 2 – ГА-хитозан.
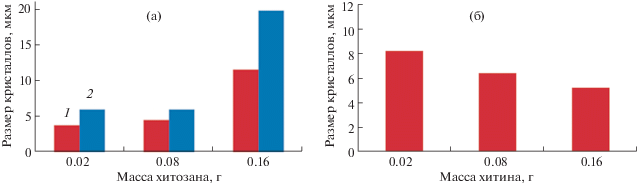
Для композитов ГА-хитин наблюдается уменьшение размеров кристаллов с увеличением содержания хитина в исходном растворе (рис. 4б).
Из полученных фотографий (рис. 3а, 3б) видно, что образцы на основе хитозана представлены только кристаллической фазой с ярко выраженной пластинчатой формой и большими размерами по сравнению с образцами на основе хитина.
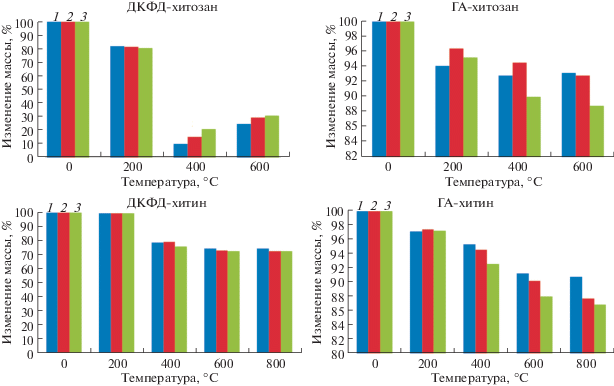
С целью изучения термических свойств и фазовых превращений продуктов кристаллизации проведен термогравиметрический анализ композитов. Для всех синтезированных образцов наблюдается убыль массы. В случае ДКФД-хитозан и ДКФД-хитин наибольшее уменьшение массы образцов соответствует диапазону температур 200–400°С, что вызвано удалением адсорбционной и кристаллизационной воды, а также деструкцией хитозана и хитина. Характерное преобразование ДКФД в монетит (400°С), а затем в γ-пирофосфат (600°С) подтверждено результатами РФА (рис. 5). При этом образцы на основе хитозана в составе ДКФД менее устойчивы, чем композиты на основе хитина.
Для образцов ГА-хитозан максимальное уменьшение массы зафиксировано для образца с содержанием хитозана 0.16 г (88.8%). Уменьшение массы композитов ГА-хитозан после прокаливания в соответствии с увеличением содержания хитозана наблюдается при 400°С, а для композита ГА-хитин уменьшение массы композита с увеличением содержания хитина наблюдается на температурном участке 300–800°С (рис. 6). Таким образом, образцы на основе хитозана в составе ГА более устойчивы, чем образцы на основе хитина и композитов на основе ДКФД.
Рис. 6.
Изменение массы образцов с содержанием хитозана/хитина (1 – 0.02, 2 – 0.08, 3 – 0.16 г/л) после термообработки при различных тепловых режимах для композитов ДКФД-хитозан, ГА-хитозан, ДКФД-хитин, ГА-хитин.
Изменения функционально-группового состава композитов при прокаливании фиксировали методом ИК-Фурье-спектроскопии (рис. 7). В спектрах композита ДКФД-хитозан исчезают полосы, соответствующие колебаниям кристаллизационной воды. В спектрах образцов после прокаливания при 600°С исчезает максимум, отвечающий колебаниям связей С–Н в метиленовых группировках хитозана. Для композитов ДКФД-хитин с увеличением температуры прокаливания наблюдается уменьшение интенсивности пиков, соответствующих колебаниям связей N–H и О–Н. Кроме того, увеличивается интенсивность пика, отвечающего колебаниям связи С–Н.
Рис. 7.
ИК-спектры образцов с содержанием хитозана и хитина 0.08 г/л после термической обработки при различных режимах: 1 – 200, 2 – 400, 3 – 600°С.
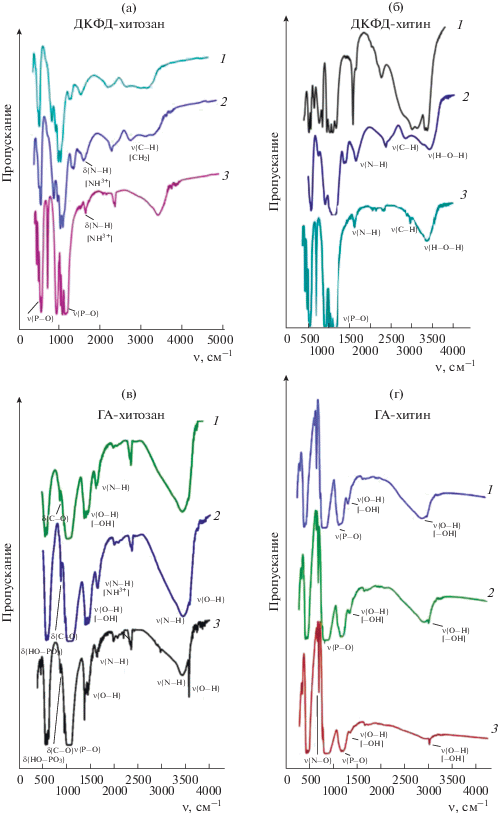
Для образцов ГА-хитозан и ГА-хитин при 200°С значительных изменений в функционально-групповом составе не происходит. При 600°С исчезают пики, отвечающие валентным и деформационным колебаниям –ОН- и –NH2-групп в структуре хитозана, а для композитов на основе хитина их интенсивность уменьшается с увеличением температуры. Также при 600°С исчезает пик, соответствующий колебаниям ассоциированной аминогруппы, в композитах на основе хитозана, а для композитов ГА-хитин интенсивность этого пика уменьшается.
Для определения биорезорбируемости синтезируемых композитов фиксировали изменение рН и концентрации ионов кальция в изотоническом растворе потенциометрическим методом.
Установлено, что в случае композитов ДКФД-хитозан с увеличением содержания хитозана в исходном растворе рН снижается, а концентрация ионов кальция увеличивается (рис. 8 ); для композитов ГА-хитозан получена противоположная зависимость. Аналогичная картина наблюдается и для композитов изучаемых фосфатов кальция с хитином.
Рис. 8.
Зависимости рН от времени растворения композитов ДКФД-хитозан, ГА-хитозан, ДКФД-хитин, ГА-хитин в 0.9%-ном растворе NaCl с содержанием хитозана и хитина: 1 – 0.02, 2 – 0.08, 3 – 0.16, 4 – 0 г/л.
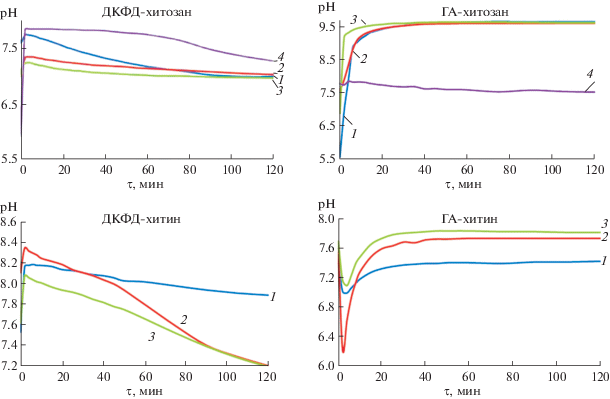
Поглощение протонов на начальном этапе растворения приводит к значительному росту рН, который фиксируется в виде максимума на кинетических кривых рН = f(τ). Это указывает на высокую интенсивность резорбции композитов за счет растворения неорганического компонента композита (фосфата кальция) уже на начальных этапах взаимодействия с растворителем. На основании полученных экспериментальных зависимостей рСа = f(τ) рассчитаны начальные значения скоростей выделения ионов кальция в раствор. По значениям начальных скоростей растворения композитов видно, что присутствие хитозана и хитина в составе твердой фазы уменьшает пассивную резорбцию для ДКФД и увеличивает для ГА (табл. 2, 3).
Таблица 2.
Значение начальных скоростей растворения композитов ДКФД-хитозан и ГА-хитозан
| Масса хитозана при синтезе, г | Кинетическое уравнение | Скорость, мин–1 | ||
|---|---|---|---|---|
| ДКФД-хитозан | ГА-хитозан | ДКФД-хитозан | ГА-хитозан | |
| 0 | y = –0.1178x + 3.952 | y = –0.0199x + 4.0769 | 0.1178 | 0.0199 |
| 0.02 | у = –0.0524х + 5.0430 | y = 0.0114x + 4.6044 | 0.0524 | 0.0114 |
| 0.08 | y = –0.0382х + 4.8342 | y = 0.0863x + 4.1164 | 0.0382 | 0.0863 |
| 0.16 | y = –0.009х + 4.4467 | y = 0.1187x + 3.9142 | 0.009 | 0.1187 |
Таблица 3.
Значение начальных скоростей растворения композитов ДКФД-хитин и ГА-хитин
| Масса хитина при синтезе, г | Кинетическое уравнение | Скорость, мин–1 | ||
|---|---|---|---|---|
| ДКФД-хитин | ГА-хитин | ДКФД-хитин | ГА-хитин | |
| 0.02 | y = –0.0238x + 2.5335 | y = –0.0051x + 4.8383 | 0.0238 | 0.0051 |
| 0.08 | y = –0.0077x + 2.634 | y = –0.0098x + 4.8182 | 0.0077 | 0.0098 |
| 0.16 | y = 0.0038x + 2.3632 | y = –0.0100x + 5.0126 | 0.0038 | 0.0100 |
Таким образом, образцы на основе ГА и ДКФД, синтезированные в присутствии хитина и хитозана, проявляют аналогичные свойства при растворении в изотоническом растворе. Сравнение скоростей растворения композитов фосфатов кальция, полученных на основе хитозана и хитина, показало, что большую скорость растворения в физиологическом растворе, имеют биокомпозиты, синтезированные в присутствии хитозана.
ЗАКЛЮЧЕНИЕ
Состав синтезированных образцов на основе ДКФД, ГА, хитина и хитозана постоянен, наличие функциональных групп ДКФД, ГА и исследуемых полимеров подтверждено методом ИК-спектроскопии, присутствие фаз ДКФД и ГА – методом РФА. Все композиты, кроме ДКФД-хитина, осаждаются в виде кристаллитов определенной формы, их размер увеличивается с ростом содержания биополимера в исходном растворе. С увеличением температуры прокаливания масса всех композитов уменьшается. Скорость растворения образцов на основе хитина в изотоническом растворе меньше, чем композитов на основе хитозана.
Список литературы
Кандырин К.Л. Введение в материаловедение полимеров. М.: ИПЦ МИТХТ, 2002.
Хоменко А.Ю., Попрядухин П.В., Богомолова Т.Б. // Российские нанотехнологии. 2013. Т. 8. № 9–10. С. 41.
Нудьга Л.А. Структурно-химическая модификация хитина, хитозана и хитин-глюкановых комплексов. Дис. … д-ра хим. наук. 2006. 361 с.
Jayakumar R., Chennazhi K., Srinivasan S. // Int. J. Mol. Sci. 2011. № 12. P. 1876.
Волова Т.Г. Материалы для медицины, клеточной и тканевой инженерии. Красноярск: ИПК СФУ, 2009.
Данильченко С.Н., Калинкевич О.В., Погорелов М.В. // Ортопедия, травматология и протезирование. 2009. № 1. С. 66.
Камская В.Е. Хитозан: структура, свойства и использование // Биологические науки. 2016. № 6. С. 36.
Elson Santiago de Alvarenga // Universidade Federal de Viçosa. 2011. P. 91.
Курченко В.П., Буга С.В., Петрашкевич Н.В. и др. // Тр. БГУ. 2016. Т. 11. Ч. 1. С. 110.
Муравьев А.А. Растворы смесей целлюлозы и хитина в ионных жидкостях и композиционные материалы на их основе. Дис. … канд. хим. наук. М., 2017. 111 с.
Wahl D.A. // European Cells and Materials. 2006. № 11. P. 43.
Bolarinwa A.O. // School Chem. Eng. 2010. 220 p.
Tas Cuneyt A. // J. Am. Ceram. Soc. 2016. P. 1200.
Parekh B.B., Joshi M.J. // J. Pure Appl. Phys. 2005. V. 43. P. 675.
Dorozhkin S.V. // Materials. 2009. № 2. P. 399.
Suryawanshi V.B., Chaudhari R.T. // J. Mater. Sci. V. 2014. P. 6.
Agrawal K., Gurbhinder S. // J. Minerals Materials Characterization Engineering. 2011. V. 10. № 8. P. 727.
Петракова Н.В. Влияние условий синтеза и спекания нанопорошков гидроксилапатита на формирование микроструктуры и свойств керамики. Дис. … канд. техн. наук. М., 2014. 143 с.
Князев А.В., Буланов Е.Н. // Вестник Нижегородского ун-та им. Н.И. Лобачевского. 2012. Т. 5. № 1. С. 88.
Бакунова Н.В., Баринов С.М., Комлев В.С. и др. // Научные ведомости. Сер. математика, физика. 2011. № 11 (106). С. 173.
Гурин А.Н. Сравнительная оценка влияния различных остеопластических материалов на основе фосфатов кальция на заживление костных дефектов. Дис. … канд. мед. наук. М., 2009. 161 с.
Сафронова Т.В., Сейченко П.А., Путляев В.И. // Стекло и керамика. 2012. № 8. С. 34.
Izmailov R.R., Golovanova O.A., Tserikh Y.V. et al. // Russ. J. Inorg. Chem. 2016. Т. 61. № 7. С. 817. [Измайлов Р.Р., Голованова О.А., Церих Ю.В. и др. // Журн. неорган. химии. 2016. Т. 61. № 7. С. 856.]https://doi.org/10.1134/S0036023616070081
Chandrasekar A., Sagadevan S. // J. Phys. Sci. 2013. V. 8. № 32. P. 1639.
Solonenko A.P., Golovanova O.A. // Russ. J. Inorg. Chem. 2013. V. 58. P. 1420. [Солоненко А.П., Голованова О.А. // Журн. неорган. химии. 2014. Т. 59. № 1. С. 12.]https://doi.org/10.1134/S0036023614010173
Jiang L. // Carbohydrate Polymers. 2008. V. 74. № 3. P. 680.
Дополнительные материалы отсутствуют.
Инструменты
Журнал неорганической химии