Журнал неорганической химии, 2019, T. 64, № 6, стр. 668-674
Экстракция редкоземельных элементов из солянокислых растворов карбамоилметилфосфиноксидами в присутствии динонилнафталинсульфонатов четвертичных аммониевых оснований
А. Н. Туранов 1, *, В. К. Карандашев 2, 3, А. Н. Яркевич 4, В. А. Хвостиков 2
1 Институт физики твердого тела РАН
142432 Черноголовка, Московской обл., ул. Акад. Осипьяна, 2, Россия
2 Институт проблем технологии микроэлектроники и особо чистых материалов РАН
142432 Черноголовка, Московской обл., Академика Осипьяна, 6, Россия
3 Национальный исследовательский технологический университет “МИСиС”,
119991 Москва, Ленинский пр-т, 4, Россия
4 Институт физиологически активных веществ РАН
142432 Черноголовка, Московской обл., Северный пр-д, 1, Россия
* E-mail: turanov@issp.ac.ru
Поступила в редакцию 27.09.2018
После доработки 11.10.2018
Принята к публикации 15.01.2019
Аннотация
Изучено межфазное распределение La, Ce, Pr, Nd, Sm, Eu, Gd, Tb, Dy, Ho, Er, Tm, Yb, Lu и Y между водными растворами HCl и растворами карбамоилметилфосфиноксидов в присутствии бинарных экстрагентов – динонилнафталинсульфонатов четвертичных аммониевых оснований. Показано, что эффективность экстракции РЗЭ(III) растворами карбамоилметилфосфиноксидов значительно возрастает в присутствии бинарного экстрагента в органической фазе. Определена стехиометрия экстрагируемых комплексов, рассмотрено влияние природы катиона бинарного экстрагента, органического растворителя, структуры карбамоилметилфосфиноксидов и концентрации HCl в водной фазе на эффективность извлечения РЗЭ(III) в органическую фазу.
Известно, что бидентатные нейтральные фосфорорганические соединения, в частности диарил(диалкилкарбамоилметил)фосфиноксиды (КМФО), обладают высокой экстракционной способностью по отношению к актинидам и редкоземельным элементам (РЗЭ) в азотнокислых средах и используются для извлечения и концентрирования этих элементов в экстракционных [1–4] и сорбционных [5] системах. Экстракционная способность таких соединений в хлоридных системах значительно ниже, чем в нитратных [6]. Для заметного перехода РЗЭ(III) в органическую фазу требуется значительный избыток ионов Cl– в водной фазе и высокая концентрация экстрагента в органической фазе. Для повышения степени извлечения ионов металлов при их экстракции используются смеси экстрагентов, дающие синергетический эффект – неаддитивное увеличение коэффициентов распределения ионов металлов [7–10]. Значительный синергетический эффект обнаружен при экстракции РЗЭ(III) смесями КМФО и теноилтрифторацетона [11], 4-бензоил-3-метил-1-фенил-5-пиразолона [12], хлорированного дикарболлида кобальта [13, 14], пикролоновой кислоты [15], а также ионной жидкости (ИЖ) – бис[(трифторметил)сульфонил]имида 1-бутил-3-метилимидазолия (C4mimTf2N) [16, 17] в органических растворителях. Причиной синергетических эффектов в таких системах является вхождение гидрофобных анионов в состав экстрагируемых комплексов РЗЭ(III). Источником гидрофобных анионов могут быть бинарные экстрагенты – соли четветричных аммониевых оснований (ЧАО) с анионами органических кислот [18]. Закономерности экстракции ионов металлов бинарными экстрагентами детально рассмотрены в [18–21].
Показано, что экстракция РЗЭ(III) нейтральными экстрагентами (триоктилфосфиноксидом или краун-эфирами) из слабокислых растворов возрастает в присутствии катионообменного экстрагента – динонилнафталинсульфокислоты (ДННСК) [22]. Однако сведения о влиянии бинарных экстрагентов с участием динонилнафталинсульфонатов на экстракцию ионов металлов растворами КМФО отсутствуют.
Цель работы – исследование влияния строения КМФО на их экстракционную способность по отношению к РЗЭ(III) в хлоридных средах в присутствии бинарных экстрагентов с анионом ДННСК [А–]. Для этого рассмотрено межфазное распределение РЗЭ(III) между растворами HCl и органической фазой, содержащей соединения I–V, различающиеся природой заместителей при атомах фосфора или азота и характером фрагмента, соединяющего координирующие группы, а также бинарные экстрагенты – динонилнафталинсульфонаты тетраэтиламмония (Et4NA), триэтилбензиламмония (Et3BnNA), тетрабутиламмония (Bu4NA) и триоктилметиламмония (Oct3MeNA).
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Соединения I–V получены известным методом [23]. Бинарные экстрагенты Et4NA, Et3BnNA, Bu4NA и Oct3MeNA) синтезировали обменной реакцией ДННСК с бромидами тетраэтиламмония, триэтилбензиламмония, тетрабутиламмония и хлорида триоктилметиламмония (Aliquat 336, Sigma-Aldrich) соответственно в щелочной среде по методу [24]. Динонилнафталинсульфокислоту (Sigma-Aldrich) очищали по методике [25]. В качестве органических растворителей использовали нитробензол, 1,2-дихлорэтан, о-ксилол и хлороформ марки “х. ч.” без дополнительной очистки. Растворы экстрагентов в органических растворителях готовили по точным навескам.
Исходные водные растворы с содержанием каждого из РЗЭ 2 × 10–6 моль/л готовили растворением соответствующих хлоридов в воде с последующим добавлением раствора HCl до требуемой концентрации. Используемые реактивы соответствовали марке “х. ч.”.
Опыты по экстракции проводили в пробирках с притертыми пробками при температуре 22 ± 2°С и соотношении объемов органической и водной фаз 1 : 1. Контакт фаз осуществляли на роторном аппарате для перемешивания со скоростью вращения 60 об/мин в течение 1 ч. Предварительно установлено, что этого времени достаточно для установления постоянных значений коэффициентов распределения РЗЭ (DLn).
Концентрацию РЗЭ в исходных и равновесных водных растворах определяли масс-спектральным методом с ионизацией пробы в индуктивно-связанной плазме (ИСП-МС) с использованием масс-спектрометра X-7 (Thermo Electron, США) по ранее описанной методике [26]. Концентрацию элементов в органической фазе определяли по уравнению материального баланса. Величины DLn рассчитывали как отношение концентраций элементов в равновесных органической и водной фазах. Погрешность определения DLn не превышала 5%. Концентрацию HCl в равновесных водных фазах определяли потенциометрическим титрованием раствором NaОН. Реэкстракцию ионов РЗЭ(III) проводили 0.1М раствором оксиэтилидендифосфоновой кислоты.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Предварительно было установлено, что 0.1 М растворы КМФО и бинарных экстрагентов в дихлорэтане практически не экстрагируют РЗЭ(III) из 3 М раствора HCl; величины DLn в таких системах не превышают 1 × 10–2. Однако при экстракции смесями КМФО Ι и Et4NA в дихлорэтане наблюдается значительное увеличение экстракции РЗЭ(III) (рис. 1). Наблюдаемый синергетический эффект может быть связан с вхождением гидрофобных анионов ДННСК в состав экстрагируемых комплексов, что приводит к увеличению их гидрофобности. Аналогичный эффект наблюдался ранее при экстракции РЗЭ(III) смесями ИЖ и КМФО из солянокислых растворов [17].
Рис. 1.
Экстракция Eu(III), Tb(III) и Er(III) из 3 М раствора HCl изомолярными смесями КМФО I и Et4NA в дихлорэтане в зависимости от мольной доли соединения I в органической фазе. [I] + [Et4NA] = 0.1 М.
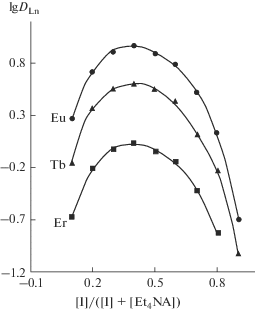
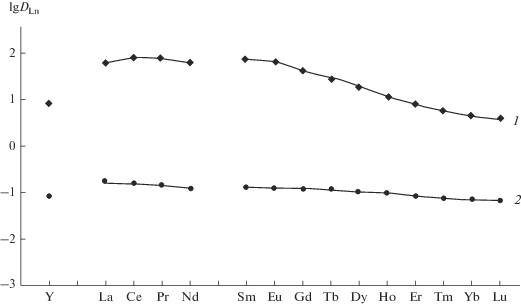
В ряду РЗЭ эффективность экстракции смесью КМФО и бинарного экстрагента снижается от La(III) к Lu(III) по мере увеличения атомного номера (Z) элемента (рис. 2), что связано с увеличением энергии гидратации ионов Ln3+ вследствие уменьшения их ионных радиусов с возрастанием Z [27]. Положение Y(III) в ряду РЗЭ(III) между Ho(III) и Er(III) соответствует близости их ионных радиусов [28]. Аналогичный характер зависимости lg DLn–Z наблюдался при экстракции РЗЭ(III) растворами КМФО в присутствии C4mimTf2N из солянокислых растворов [17]. Величина коэффициента разделения La(III) и Lu(III), βLa/Lu = DLa/DLu, при экстракции смесью КМФО и бинарного экстрагента в дихлорэтане (βLa/Lu = 16.2) превышает таковую в системе бинарный экстрагент–дихлорэтан (βLa/Lu = 2.5). Это свидетельствует о значительном повышении селективности экстракции РЗЭ(III) из солянокислых растворов растворами Et4NA в присутствии КМФО.
Рис. 2.
Экстракция РЗЭ(III) и Y(III) из 1 M растворов HCl 0.01 М раствором КМФО I в дихлорэтане, содержащем 0.1 М Et4NA (1), и 0.1 М раствором Et4NA в дихлорэтане (2).
Процесс экстракции РЗЭ(III) из хлоридных растворов растворами КМФО (L) в присутствии бинарного экстрагента (R4NA) может быть описан уравнением:
(1)
$\begin{gathered} {\text{Ln}}_{{{\text{(в )}}}}^{{{\text{3 + }}}} + {\text{3Cl}}_{{{\text{(в )}}}}^{ - } + s{{{\text{L}}}_{{{\text{(о )}}}}} + n{{{\text{R}}}_{{\text{4}}}}{\text{N}}{{{\text{A}}}_{{{\text{(о )}}}}} \leftrightarrows \\ \leftrightarrows \,\,{\text{Ln}}{{{\text{L}}}_{s}}{{{\text{A}}}_{n}}{\text{C}}{{{\text{l}}}_{{{\text{3 --}}n{\text{(о )}}}}} + n{{{\text{R}}}_{{\text{4}}}}{\text{NC}}{{{\text{l}}}_{{{\text{(о )}}}}}{,\;}{{K}_{{{\text{Ln}}}}}, \\ \end{gathered} $(2)
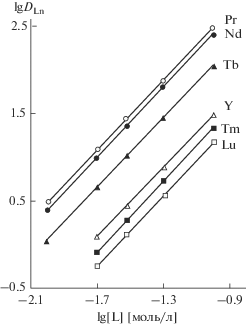
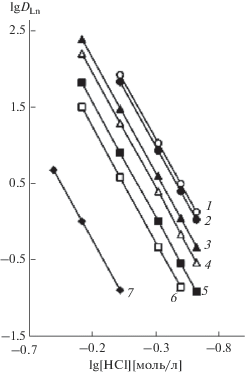
${{D}_{{{\text{Ln}}}}} = {{K}_{{{Ln\;}}}}[{\text{L}}]_{{{\text{(о )}}}}^{{\text{s}}}[{\text{C}}{{{\text{l}}}^{ - }}]_{{{\text{(в )}}}}^{3}[{{{\text{R}}}_{{\text{4}}}}{\text{NA}}]_{{{\text{(о )}}}}^{n}[{{{\text{R}}}_{{\text{4}}}}{\text{NCl}}]_{{{\text{(о )}}}}^{{ - n}}{\text{.}}$Выражение (2) в логарифмической форме использовано для оценки стехиометрических коэффициентов s и n при экстракции РЗЭ(III) из растворов HCl. При постоянных концентрациях HCl и КМФО в водной и органической фазе соответственно тангенсы угла наклона зависимостей lg DLn–lg [Et4NA] близки к 3 (рис. 3), что соответствует извлечению комплексов РЗЭ(III) с соотношением Ln : A– = 1 : 3. При постоянной концентрации Et4NA в органической фазе угловой наклон зависимостей lg DLn–lg[КМФО] близок к 2 (рис. 4), что указывает на экстракцию РЗЭ(III) из солянокислых растворов раствором КМФО в присутствии бинарного экстрагента в виде комплексов LnL2A3.
Рис. 3.
Зависимость коэффициентов распределения РЗЭ(III) от концентрации Et4NA в органической фазе, содержащей 0.05 М соединения I, при экстракции из 3 М раствора HCl.
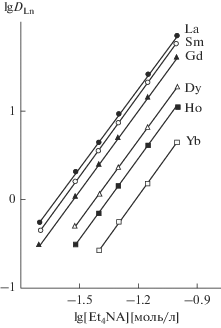
Рис. 4.
Зависимость коэффициентов распределения РЗЭ(III) от концентрации КМФО I в органической фазе, содержащей 0.1 М Et4NA, при экстракции из 3 М раствора HCl.
При постоянных исходных концентрациях КМФО и Et4NA в органической фазе увеличение концентрации HCl в равновесной водной фазе сопровождается снижением DLn (рис. 5). Это может быть связано с уменьшением равновесной концентрации бинарного экстрагента в органической фазе вследствие протекания реакции:
(3)
${{{\text{R}}}_{{\text{4}}}}{\text{N}}{{{\text{A}}}_{{{\text{(о )}}}}} + {\text{H}}_{{{\text{(в )}}}}^{ + } + {\text{Cl}}_{{{\text{(в )}}}}^{ - } \leftrightarrows {\text{H}}{{{\text{A}}}_{{{\text{(о )}}}}} + {{{\text{R}}}_{{\text{4}}}}{\text{NC}}{{{\text{l}}}_{{{\text{(о )}}}}}{\text{.}}$Рис. 5.
Зависимость коэффициентов распределения Ce (1), Eu (2, 7), Tb (3), Dy (4), Er (5) и Lu (6) от концентрации HCl в водной фазе при экстракции 0.01 М раствором КМФО I в дихлорэтане, содержащем 0.1 М Et4NA (1–6), и 0.1 М раствором Et4NA в дихлорэтане (7).
Природа катиона бинарного экстрагента оказывает существенное влияние на эффективность экстракции РЗЭ(III). Величина DEu при экстракции 0.05 М растворами КМФО I в дихлорэтане, содержащем 0.1 М R4NA, из 1 М раствора HCl возрастает в ряду Oct3MeNA (<10–2) < Bu4NA (1.2) < < Et3BnNA (49) < Et4NA (1740) по мере снижения гидрофобности катиона ЧАО. Аналогичная зависимость отмечалась при экстракции ионов металлов нейтральными экстрагентами в системах с ИЖ на основе аниона бис[(трифторметил)сульфонил]имида при уменьшении длины алкильной цепочки катиона алкилметилимидазолия [29].
Природа органического растворителя оказывает существенное влияние на экстракцию РЗЭ(III) растворами КМФО [30]. При экстракции РЗЭ(III) из 3 М раствора HNO3 0.05 М растворами КМФО I величина DEu возрастает в ряду органических растворителей о-ксилол (0.018) < 1,2-дихлорэтан (0.95) < нитробензол (19.1) по мере увеличения их полярности. В системе с Et4NA изменение полярности органического разбавителя оказывает значительно меньшее влияние на эффективность экстракции РЗЭ(III): при экстракции 0.05 М растворами КМФО I и 0.1 М Et4NA в органических растворителях из 3 М раствора HCl величина DEu возрастает в ряду хлороформ (1.71) < < о-ксилол (25.7) < 1,2-дихлорэтан (64.5) < нитробензол (73.2). Это может быть связано с более высокой гидрофобностью комплексов LnL2A3, чем у координационно-сольватированных нитратов РЗЭ(III). Подавление экстракции при использовании хлороформа в качестве растворителя связано, по-видимому, с сольватацией донорных центров молекулы экстрагента в результате образования водородных связей P=O…HCCl3, приводящей к снижению активности экстрагента в органической фазе.
Известно, что высокая экстракционная способность КМФО по отношению к РЗЭ(III) связана с их бидентатной координацией в процессе образования экстрагируемых комплексов [31]. Для сравнения экстракционной способности КМФО I–V по отношению к РЗЭ(III) в системах с R4NA определены значения DLn при экстракции из 3 М раствора HCl растворами этих соединений в дихлорэтане в присутствии Et4NA (рис. 6). Общие закономерности влияния строения КМФО на их экстракционную способность [32–34] сохраняются, по-видимому, для систем с R4NA. Соединения I–III с фенильными заместителями при атоме фосфора по своей экстракционной способности значительно превосходят свой диалкилзамещенный аналог IV. Такое влияние заместителя при атоме фосфора, наблюдавшееся ранее при экстракции Am(III) и РЗЭ(III) из азотнокислых растворов растворами этих соединений в дихлорэтане [33], связано с проявлением эффекта арильного упрочнения (ЭАУ) экстрагируемых комплексов, возможные причины которого неоднократно обсуждались в литературе [31, 35–37]. Величина ЭАУ, F = DLn(I)/DLn(IV), уменьшается в ряду РЗЭ(III) от La(229) к Lu(24.5) (рис. 6), что отмечалось и при экстракции нитратных комплексов РЗЭ(III) растворами этих КМФО [38]. При экстракции Eu(III) из азотнокислых растворов растворами КМФО в дихлорэтане F = 47 [38], тогда как в присутствии Et4NA F = 155, что указывает на усиление ЭАУ с увеличением гидрофобности анионов, входящих в состав экстрагируемых комплексов РЗЭ(III).
Рис. 6.
Экстракция РЗЭ(III) и Y(III) из 3 M растворов HCl 0.05 М растворами КМФО I–V в дихлорэтане, содержащем 0.1 М Et4NA.
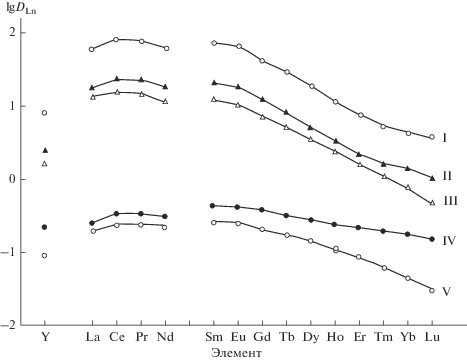
Природа заместителей при атоме азота в молекулах КМФО заметно влияет на экстракцию РЗЭ(III) этими соединениями в присутствии Et4NA (рис. 6). КМФО II с фенильными заместителями при атоме азота экстрагирует РЗЭ(III) менее эффективно, чем его алкилзамещенный аналог I, что связано со снижением донорной способности группы С=О при увеличении электроотрицательности заместителя [34]. Эффективность экстракции соединением II с изобутильными заместителями при атоме азота снижается по сравнению с соединением I, что может быть связано со стерическими препятствиями комплексообразованию с ионами РЗЭ(III), а также с влиянием заместителя на изменение торсионного угла между функциональными группами и на ширину области распространения молекулярных электростатических полей электронодонорных групп [39].
Замена атома Н в метиленовом мостике, соединяющем координирующие группы молекулы КМФО, на алкильный радикал приводит к резкому снижению DLn при экстракции соединением V. Это может быть связано как с действием стерических факторов [40], так и с уменьшением в молекуле этого соединения числа протонов в мостике, снижающим возможность стабилизации экстрагируемого комплекса за счет специфического взаимодействия с полярным разбавителем [30].
ЗАКЛЮЧЕНИЕ
Представленные данные показали, что эффективность экстракции РЗЭ(III) из солянокислых растворов растворами КМФО существенно возрастает в присутствии динонилнафталинсульфонатов четвертичных аммониевых оснований, что может быть использовано для извлечения и концентрирования этих элементов. Снижение гидрофобности катионной части бинарного экстрагента способствует повышению эффективности извлечения РЗЭ(III) в органическую фазу. Экстракционная способность КМФО в системах с бинарным экстрагентом изменяется в широких пределах в зависимости от природы заместителей при атомах фосфора и азота, а также характера фрагмента, соединяющего координирующие группы.
Список литературы
Медведь Т.Я., Чмутова М.К., Нестерова Н.П. и др. // Изв. АН СССР. Сер. хим. 1981. № 9. С. 2121.
Chmutova M.K., Litvina M.N., Pribylova G.A. et al. // Radiochem. 1999. V. 41. № 4. P. 349. [Чмутова М.К., Литвина М.Н., Прибылова Г.А. и др. // Радиохимия. 1999. Т. 41. № 4. С. 331.]
Alyapyshev M.Yu., Babain V.A., Ustynyuk Yu.A. // Russ. Chem. Rev. 2016. V. 85. № 9. P. 943. https://doi.org/ 10.1070/RCR4589 [Аляпышев М.Ю., Бабаин В.А., Устынюк Ю.А. // Успехи химии. 2016. Т. 85. № 9. С. 943.]
Leoncini A., Huskens J., Werboon W. // Chem. Soc. Rev. 2017. V. 46. P. 7229.
Мясоедова Г.В. // Рос. хим. журн. 2005. Т. 49. № 2. С. 72.
Turanov A.N., Karandashev V.K., Yarkevich A.N., Safronova Z.V. // Radiochem. 2007. V. 49. № 2. P. 166. doi 10.1134/S1066362207020129 [Туранов А.Н., Карандашев В.К., Яркевич А.Н., Сафронова З.В.// Радиохимия. 2007. Т. 49. № 2. С. 148.]
Atanassova M., Todorova S., Kurteva V. et al. // Sep. Purif. Technol. 2018. V. 204. P. 328.
Vantura P., Makrlic E., Selucky P. // J. Radioanal. Nucl. Chem. 2018. V. 317. P. 443.
Huang P.W., Wang C.Z., Wu Q.Y. et al. // Dalton Trans. 2018. V. 47. P. 5474.
Atanassova M., Kurteva V. // RSC Adv. 2016. V. 6. P. 11303.
Rao L., Xia Y., Rapko B.M., Martin P.F. // Solvent Extr. Ion Exch. 1998. V. 16. P. 913.
Turanov A.N., Karandashev V.K., Kharlamov A.V., Bondarenko N.A. // Solvent Extr. Ion Exch. 2014. V. 32. P. 492.
Rais J., Tachimori S. // J. Radioanal. Nucl. Chem. Lett. 1994. V. 188. № 2. P. 157.
Smirnov I.V. // Radiochem. 2007. V. 49. № 1. P. 44. doi 10.1134/S1066362207010080 [Смирнов И.В. // Радиохимия. 2007. Т. 49. № 1. С. 40.]
Туранов А.Н., Карандашев В.К., Шарова Е.В. и др. // Радиохимия. 2013. Т. 55. № 2. С. 156. [Turanov A.N., Karandashev V.K., Sharova E.V. et al. // Radiochem. 2013. V. 55. № 2. P. 203. doi 10.1134/ S1066362213020100]
Туранов А.Н., Карандашев В.К., Яркевич А.Н. // Радиохимия. 2013. Т. 55. № 4. С. 314. [Turanov A.N., Karandashev V.K., Yarkevich A.N. et al. // Radiochem. 2013. V. 55. № 4. P. 382. doi 10.1134/ S1066362213040073]
Turanov A.N., Karandashev V.K., Yarkevich A.N. // Russ. J. Inorg. Chem. 2018. V. 63. № 3. P. 406. doi 10.1134/S0036023618030221 [Туранов А.Н., Карандашев В.К., Яркевич А.Н. // Журн. неорган. химии. 2018. Т. 63. № 3. С. 382. doi 10.7868/S0044457X18030200]
Холькин А.И., Кузьмин В.И. // Журн. неорган. химии. 1982. Т. 27. № 8. С. 2070.
Kholkin A.I., Pashkov G.L., Fleitlich I.Yu. et al. // Hydrometallurgy. 1994. V. 36. P. 109.
Kholkin A.I., Belova V.V., Pashkov G.L. et al. // J. Mol. Liq. 1999. V. 82. P. 131.
Belova V.V., Voshkin A.A., Kholkin A.I., Payrtman A.K. // Hydrometallurgy. 2009. V. 97. P. 198.
Ramadan A., Mahmoud M., Khalifa S.M., Souka N. // J. Radioanal. Chem. Lett. 1993. V. 176. P. 457.
Turanov A.N., Karandashev V.K., Kharitonov A.V. et al. // Russ. J. Gen. Chem. 1999. V. 69. № 7. P. 1068. [Туранов А.Н., Карандашев В.К., Харитонов А.В. и др. // Журн. общей химии. 1999. Т. 69. № 7. С. 1109.]
Belova V.V., Kulichenkov S.A., Voshkin A.A. et al. // Russ. J. Inorg. Chem. 2007. V. 52. № 3. P. 460. doi 10.1134/S003602360703028X [Белова В.А., Куличенков С.А., Вошкин А.А. и др. // Журн. неорган. химии. 2007. Т. 52. № 3. С. 513.]
Danesi P.R., Chiarizia R., Scibona G. // J. Inorg. Nucl. Chem. 1973. V. 35. P. 3926.
Turanov A.N., Karandashev V.K., Baulin V.E., Tsvetkov E.N. // Russ. J. Inorg. Chem. 1995. V. 40. № 11. P. 1854. [Туранов А.Н., Карандашев В.К., Баулин В.Е., Цветков Е.Н. // Журн. неорган. химии. 1995. Т. 40. № 11. С. 1926.]
Яцимирский К.Б., Костромина Н.А., Шека З.А. и др. Химия комплексных соединений редкоземельных элементов. Киев.: Наук. думка, 1966. 494 с.
Shannon R.D. // Acta Crystallogr. 1976. № 32. P. 751.
Dietz M.L., Dzielawa J.A., Laszak I. et al. // Green Chem. 2003. V. 5. P. 682.
Розен А.М., Никифоров А.С., Николотова З.И., Карташева Н.А. // Докл. АН СССР. 1986. Т. 286. № 3. С. 667.
Розен А.М., Крупнов Б.В.// Успехи химии. 1996. Т. 65. № 11. С. 1052. [Rozen A.M., Krupnov B.V. // Russ. Chem. Rev. 1996. V. 65. № 11. P. 973. doi 10.1070/RC1996v065n11ABEH000241]
Horwitz E.P., Martin K.A., Diamond H., Kaplan L. // Solvent Extr. Ion Exch. 1986. V. 4. P. 449.
Чмутова М.К., Иванова Л.А., Кочеткова Н.Е. и др. // Радиохимия. 1995. Т. 37. № 5. С. 422.
Чмутова М.К., Литвина М.Н., Прибылова Г.А. и др. // Радиохимия. 1995. Т. 37. № 5. С. 430.
Розен А.М., Николотова З.И., Карташева Н.А., Юдина К.С. // Докл. АН СССР. 1975. Т. 222. № 5. С. 1151.
Кабачник М.И., Мясоедов Б.Ф., Мастрюкова Т.А. и др. // Изв. РАН. Сер. хим. 1996. № 11. С. 2624.
Tsvetkov E.N., Evreinov V.I., Bondarenko N.A. et al. // Russ. J. Gen. Chem. 1996. V. 66. № 7. P. 1054. [Цветков Е.Н., Евреинов В.И., Бондаренко Н.А. и др. // Журн. общей химии. 1996. Т. 66. № 7. С. 1081.]
Литвина М.Н., Чмутова М.К., Мясоедов Б.Ф., Кабачник М.И. // Радиохимия. 1996. Т. 38. № 6. С. 525.
Сударушкин С.К., Моргалюк В.П., Тананаев И.Г. и др. // Изв. РАН. Сер. хим. 2006. № 4. С. 609.
Кочеткова Н.Е., Койро О.Э., Нестерова Н.П. и др. // Радиохимия. 1986. Т. 28. № 3. С. 338.
Дополнительные материалы отсутствуют.
Инструменты
Журнал неорганической химии


