Журнал неорганической химии, 2019, T. 64, № 4, стр. 341-349
Получение, структура и высокотемпературное исследование висмут- и железозамещенного манганита лантана
О. С. Каймиева 1, *, Е. С. Буянова 1, С. А. Петрова 2, Н. В. Таракина 3
1 Уральский федеральный университет им. первого Президента России Б.Н. Ельцина,
Институт естественных наук и математики
620000 Екатеринбург, пр-т Ленина, 51, Россия
2 Институт металлургии УрО РАН
620016 Екатеринбург, ул. Амудсена, 101, Россия
3 The NanoVision Centre, School of Engineering and Materials Science, Queen Mary University of London
E1 4NS London, Mile End Road, United Kingdom
* E-mail: kaimi-olga@mail.ru
Поступила в редакцию 05.04.2018
После доработки 16.07.2018
Принята к публикации 06.08.2018
Аннотация
Впервые выполнено подробное исследование полученных методом твердофазного синтеза твердых растворов общего состава La1 –xBixMn1 –yFeyO3 + δ (x = 0.1–0.3, y = 0.1–0.3). Синтезированные образцы кристаллизуются в R-центрированной тригональной элементарной ячейке при комнатной температуре и имеют индекс кислородной нестехиометрии δ = 0.15. Методом просвечивающей электронной микроскопии высокого разрешения для La0.7Bi0.3Mn0.9Fe0.1O3 + δ установлено наличие двух типов кристаллитов с близкими, но различающимися пространственными группами. Для всех образцов характерно химическое расширение при температурах выше 650°C. Коэффициент термического расширения равен 11.6 × 10–6°С–1 в низкотемпературной (25–650°С) и 12.3 × 10–6°С–1 в высокотемпературной (650–1000°С) области. Электропроводность всех исследованных твердых растворов в температурной области 800–200°C немного ниже значения, полученного для недопированного манганита лантана.
ВВЕДЕНИЕ
Перовскитоподобные соединения на основе манганита лантана LaMnO3 широко известны как катодные материалы для твердооксидных топливных элементов [1–3], катализаторы для окисления монооксида углерода [4], компоненты нанокомпозитных смешанных ионно-электронных проводников [5], материалы мультиферроиков [6–10].
LaMnO3 ± δ имеет широкую область гомогенности по обеим катионным подрешеткам. Согласно [11], манганит лантана может находиться как в сверхстехиометричном по кислороду состоянии, так и в кислородо-дефицитном. Граница области гомогенности, обогащенной по лантану, зависит от температуры и уменьшается от LaMn0.83O3 ± δ при 900°C до LaMn0.91O3 ± δ при 1200°C. Граница области, обогащенной по марганцу, от температуры практически не зависит вплоть до 1700°C и соответствует составу La0.91MnO3 ± δ [12]. Структура манганита лантана во многом определяется концентрацией ионов Mn3+ и Mn4+. В случае, когда δ > 0, т.е. при повышении содержания Mn4+ до 24%, наблюдается изменение орторомбической структуры на ромбоэдрическую модификацию [13]. Такой переход также возможен при повышении температуры (для LaMnO3 при 737°C) [14] и обусловлен одновременным поворотом кислородных октаэдров MnО6 вдоль направления [111].
Замещение ионов La или Mn другими катионами может влиять на степень окисления марганца, способствовать магнитному обмену между ионами и, таким образом, изменять магнитное поведение LaMnO3 или его электропроводящие характеристики. Например, введение небольшого количества ионов висмута (x = 0.06) в LaMnO3 приводит к его ферромагнитному упорядочению [15]. Для системы, отвечающей номинальному составу твердых растворов La1 –xBixMn1 –yFeyO3 + δ, изучены отдельные представители: Bi1 –xLaxFe0.95Mn0.05O3 [10], Bi0.4La0.6Fe0.8Mn0.2O3 [9], La0.5Bi0.5Mn0.5Fe0.5O3 [6, 16], La1 –xBixMn1 –yFeyO3 ± δ (x = 0.5, 0.7, y = 0.3, 0.7 [7]; x = 0.5, y = 0.5 [6], x = 0.4, y = 0.4 [8]). Авторы [10] показали, что при концентрации лантана 0.2 < x < 0.5 происходит формирование твердых растворов с тетрагональной структурой. Образцы La1 –xBixMn1 –yFeyO3 + δ (x = 0.1–0.3, y = 0.1–0.3; x = 0.5–0.7, y = 0.3–0.5, 0.95) кристаллизуются в структуре перовскита с орторомбической элементарной ячейкой (пространственная группа (пр. гр.) Pnma) [6–10]. Имеются работы по исследованию железозамещенного манганита лантана, где в подрешетку лантана введен двухзарядный катион (например, стронций (составы La1 –xSrxMn1 –yFeyO3, x = 0.2, y = 0.2, 0.5, 0.8, 1 [17]; x = 0.2, 0.5, 0.7, y = 0.2, 0.5, 0.8 [18]). Показано, что введение железа в структуру манганита лантана улучшает его катодные характеристики: способствует росту электропроводности и механической совместимости с иттрийстабилизированным диоксидом циркония (yttria-stabilized zirconia) благодаря уменьшению значения коэффициента термического расширения (КТР) по сравнению с La1 –xSrxMnO3. Образцы La1 –xSrxMn1 –yFeyO3 (x = = 0.2, y = 0.2) [17, 18] имеют ромбоэдрическую структуру. Значение КТР для них составляет ~(9–11) × 10–6°C–1, что говорит об их хорошей механической совместимости с большинством твердых электролитов. В работе [19] изучена температурная зависимость КТР на примере образцов La1 –xSrxMn1 –yFeyO3 с плотностью меньше, чем 88%. Наблюдался постепенный рост величины КТР при повышении температуры до 850°C с последующим резким ее снижением вплоть до 1000°C, что может быть связано с дополнительным спеканием образца в течение термического цикла. La0.7Sr0.3Mn0.9Fe0.1O3 с ромбоэдрической структурой (а = 5.513(1), с = 13.374(4) Å, V = 352.11 Å3) был получен в [20]. Представленные в работах результаты согласуются с данными по LaMn1 –yFeyO3, для которого подтверждено существование ромбоэдрической структуры при содержании железа y = 0.0–0.2 [21], y = 0.0–0.3 [22], y = 0.05–0.4 [23]. Методами мессбауэровской спектроскопии [22] и спектроскопии рентгеновского поглощения [21] установлено, что валентное состояние ионов железа в LaMn1 –yFeyO3 стабильно и равно трем; при увеличении степени замещения марганца ионами Fe3+ происходит снижение доли Mn4+ [21]. Таким образом, интерес к замещенным манганитам лантана в литературе не спадает, однако составы La1 –xBixMn1 –yFeyO3 + δ с малым содержанием допантов при замещении одновременно в двух подрешетках (x ≤ 0.3, y ≤ 0.3) до сих пор практически не описаны.
Принципиальная возможность образования подобных твердых растворов La1 –xBixMn1 –yFeyO3 + δ показана в нашей предыдущей работе [24]. Для продолжения исследований кристаллической структуры, термической устойчивости и электропроводности La1 –xBixMn1 –yFeyO3 + δ выбран интервал концентраций по каждому из заместителей Bi3+ и Fe3+, равный x = 0.1–0.3, у = 0.1–0.3 с шагом внутри каждого из них Δх, Δу = 0.1.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Образцы La1 –xBixMn1 –yFeyO3 + δ (x = 0.1–0.3, у = 0.1–0.3; Δх, Δу = 0.1) получены с использованием многоступенчатого твердофазного синтеза с постепенным повышением температуры отжига сложных оксидов. Метод позволяет минимизировать потери ионов висмута в ходе высокотемпературного синтеза замещенного манганита лантана (~1200°C). В качестве исходных компонентов были взяты простые оксиды La2O3 (LaO-D), Bi2O3 (99.9%), Mn2O3 (>98%), Fe2O3 (99.9%). Синтез проводили в температурном интервале 600–1200°C с шагом 100°C. Образцы выдерживали на каждой стадии по 8 ч. При температурах выше 800°C проводили отжиг спрессованных в брикеты образцов. Фазовый состав порошков на различных стадиях синтеза контролировали с помощью рентгенофазового анализа (РФА) (дифрактометры DRON-3, Россия, D8 ADVANCE, Bruker, Германия и Equinox 3000, Enel, Франция). Высокотемпературные рентгеновские исследования выполнены на дифрактометре D8 ADVANCE (CuKα-излучение, β-фильтр, PSD VÅNTEC1), оснащенном высокотемпературной камерой HTK1200N (Anton Paar), в температурной области 30–1200°C со скоростью нагрева 0.5 град/с. Фазовый состав соединений определен по картотеке ICDD PDF2 [25]. Уточнение параметров элементарной ячейки и кристаллической структуры проведено с помощью программного обеспечения Celref [26] и TOPAS [27].
Элементный состав полученных образцов охарактеризован методами атомно-абсорбционной (ААС) и атомно-эмиссионной спектроскопии с индуктивно-связанной плазмой (АЭС-ИСП) на спектрометрах Solaar M6 и iCAP 6500 (Thermo Scientific, США) соответственно. Для анализа использовали растворенные в соляной кислоте порошки сложных оксидов массой ~0.02 г.
Содержание кислорода во всех образцах найдено методом окислительно-восстановительного (в иодометрическом варианте) потенциометрического титрования с использованием хлор–серебряного электрода сравнения и платинового индикаторного электрода (автоматический потенциометрический титратор АТП-2, АКВИЛОН, Россия). Исследуемые образцы были предварительно прокалены при 900°C с последующим медленным охлаждением до комнатной температуры. Точные навески порошкообразных образцов (~0.1 г) растворяли в соляной кислоте (1 : 2) с добавлением избытка иодида калия. Выделившийся иод титровали 0.01 н раствором Na2S2O3 согласно реакциям:
Измерения проводили в пяти параллелях. Среднюю степень окисления z+ ионов марганца и железа в сложном оксиде определяли по объему Na2S2O3, пошедшему на титрование:
где n = NV, z, n, ν, N(S2${\text{O}}_{3}^{{2 - }}$), V(S2${\text{O}}_{3}^{{2 - }}$) – средняя степень окисления, количество грамм-эквивалентов (г-экв) и количество (моль) металлов (марганец и железо), нормальность (г-экв/л) и объем (л) раствора тиосульфата натрия соответственно. Кислородная нестехиометрия образцов (δ) рассчитана с учетом электронейтральности кристалла как
Погрешность определения величины кислородной нестехиометрии не превышала 3%.
Термический анализ образцов проведен с помощью термоанализатора STA 409 PC Luxx (Netzsch, Германия) в температурной области 25–1000°C. В качестве стандарта использован Al2O3.
Исследование с помощью просвечивающей электронной микроскопии (ПЭМ, микроскоп JEOL 2010, Япония) выполнено согласно [28]. Морфология поверхности изучена с использованием сканирующей электронной микроскопии (СЭМ, сканирующий электронный микроскоп JEOL JSM6390 LA, оснащенный рентгеновским энергодисперсионным детектором, Япония) на порошкобразных образцах, спрессованных и спеченных при 1000°C в течение 6 ч в виде таблеток диаметром 10 мм и толщиной 3–4 мм.
Дилатометрические измерения выполнены на спрессованных и спеченных в виде брусков при 1000°C в течение 6 ч брикетах длиной 25 мм с использованием дилатометра DIL 402 C (Netzsch, Германия) с вакуумной печью в интервале 20–1000°C и скоростью нагрева 2 град/мин. Погрешность определения КТР составила 2%.
Для оценки значений электропроводности синтезированных образцов брали спрессованные и спеченные при 1000°C в течение 6 ч брикеты диаметром 10 мм и толщиной 3–4 мм. После спекания торцевые поверхности полировали и покрывали платиной для лучшего контакта с электродами. Измерение сопротивления образцов проводили с использованием двухконтактной ячейки с платиновыми электродами на постоянном токе в режиме охлаждения (800–200°C с шагом 25 град). По полученным данным построены температурные зависимости электропроводности, позволяющие оценить влияние допантов на транспортные свойства полученных соединений по сравнению с матрицей (LaMnO3).
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
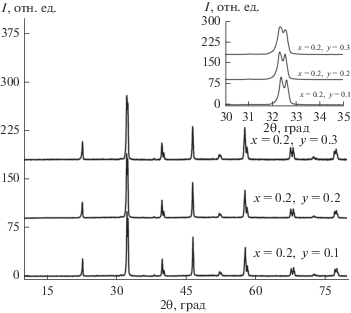
Для оценки последовательности фазообразования при синтезе La1 –xBixMn1 –yFeyO3 + δ после каждой стадии синтеза для образцов всех составов проведена аттестация с помощью РФА. В качестве примера в табл. 1 приведены результаты для образца La0.9Bi0.1Mn0.9Fe0.1O3 + δ. При других соотношениях x и y ситуация была полностью аналогичной. Анализ фазового состава показал, что окончательное формирование твердого раствора при выбранных условиях обработки и отжига происходит только при 1200°C. Как видно из табл. 1, уже после первой стадии синтеза образуется искомая фаза на основе манганита лантана с орторомбической структурой (пр. гр. Pnma), которая после термической обработки при 900°C, т.е. незначительно более высокой, чем для незамещенного состава [14], изменяет свою структуру на ромбоэдрическую (пр. гр. R3c). Оксид висмута взаимодействует с оксидом лантана с образованием Bi0.4La0.6O1.5, оксид железа – с оксидом марганца с образованием сложного оксида (Mn0.37Fe0.63)2O3, однако до 900°C исходные оксиды сохраняются. Так как количество введенного висмута или железа на каждой стадии синтеза для образованного твердого раствора не определяли, в табл. 1 указан номинальный состав манганита лантана, соответствующий полученному структурному типу твердого раствора. Синтезированные образцы La1 –xBixMn1 –yFeyO3 + δ (x = 0.1–0.3, y = 0.1–0.3) сохраняют ромбоэдрическую структуру при дальнейшем варьировании температуры. Полученные результаты согласуются с приведенными для La1 –xBixMnO3 + δ [28], LaMn1 –yFeyO3 + δ [21–23] и La1 –xSrxMn1 –yFeyO3 + δ [17, 18, 20]. Дифрактограммы образцов после отжига при 1200°С представлены на рис. 1. Рассчитанные параметры и объемы элементарных ячеек синтезированных порошков приведены в табл. 2.
Таблица 1.
Зависимость фазового состава от температуры при синтезе твердого раствора номинального состава La0.9Bi0.1Mn0.9Fe0.1O3 + δ
| t, °С | Фазовый состав (согласно ICDD PDF2) |
|---|---|
| 600 | Твердый раствор на основе LaMnO3 (пр. гр. Pnma), Bi0.7La0.3O1.5, La2O3, La(OH)3, Bi2O3, Bi2O2CO3, Fe2O3, Mn2O3 |
| 700 | Твердый раствор на основе LaMnO3 (пр. гр. Pnma), Bi0.7La0.3O1.5, La2O3, La(OH)3, Bi2O2CO3, Bi2O3, (Mn0.37Fe0.63)2O3 |
| 800 | Твердый раствор на основе LaMnO3 (пр. гр. Pnma), Bi0.7La0.3O1.5, La2O3, Bi2O2CO3, Bi2O3, (Mn0.37Fe0.63)2O3 |
| 900 | Твердый раствор на основе La0.93MnO3.15 (пр. гр. R3c), Bi0.4La0.6O1.5, (Mn0.37Fe0.63)2O3 |
| 1000 | Твердый раствор на основе La0.93MnO3.15 (пр. гр. R3c), Bi0.4La0.6O1.5, MnO, Fe3O4 |
| 1100 | Твердый раствор на основе La0.93MnO3.15 (пр. гр. R3c), Bi0.4La0.6O1.5 |
| 1200 | Твердый раствор на основе La0.93MnO3.15 (пр. гр. R3c) |
Таблица 2.
Параметры a и c (Å) и объем V (Å3) элементарной ячейки La1 –xBixMn1 –yFeyO3 + δ
| y | x | Параметр | ||
|---|---|---|---|---|
| 0.1 | 0.2 | 0.3 | ||
| 0.1 | 5.524(2) | 5.528(1) | 5.531(2) | a |
| 13.37(6) | 13.40(1) | 13.44(1) | c | |
| 353.6(4) | 354.7(3) | 356.0(1) | V | |
| 0.2 | 5.529(2) | 5.530(0) | 5.532(4) | a |
| 13.38(5) | 13.41(3) | 13.46(2) | c | |
| 354.3(2) | 355.1(2) | 356.7(2) | V | |
| 0.3 | 5.534(3) | 5.536(1) | 5.539(3) | a |
| 13.39(3) | 13.42(4) | 13.47(5) | c | |
| 355.3(1) | 356.2(3) | 357.6(4) | V | |
Для детального изучения микроструктуры образцов выполнено исследование с помощью просвечивающей электронной микроскопии высокого разрешения. Изображения электронной дифракции La0.7Bi0.3Mn0.9Fe0.1O3 + δ представлены на рис. 2. Как и в случае данных рентгеновской дифракции, все полученные дифракционные картины могут быть проиндексированы в R-центрированной тригональной элементарной ячейке с параметрами a = 5.531(5), с = 13.43(7) Å. Зафиксировано наличие двух типов кристаллитов с разными пр. гр. Первый тип может быть проиндексирован в двух возможных пр. гр.: R3c и R3c (hkl: –h + k + l = 3n; h – hl: h + l = 3n, l = 2n; hhl: l = 3n; 00l: l = 6n) (рис. 2а, 2б). Для второго типа кристаллитов в плоскости скольжения с вдоль направления [001] данные условия не выполняются (h – hl: l ≠ 2n и 00l: l = 3n), что отвечает одной из следующих возможных пр. гр.: R3, R3, R32, R3m, R3m (рис. 2в, 2г). Аналогичные результаты были получены для образца La0.8Bi0.2MnO3 + δ [28]. Образование двух типов кристаллитов, вероятно, обусловлено катионным разупорядочением и отклонением октаэдрической цепочки от идеальной кубической модели перовскита при повышении температуры или увеличении содержания допанта в образцах, что приводит к изменению пр. гр. кристалла. Для определения истинной природы сосуществования двух типов кристаллитов необходимы дополнительные нейтронографические и синхротронные исследования.
Рис. 2.
ПЭМ-изображения La0.7Bi0.3Mn0.9Fe0.1O3 + δ, полученные в кристаллографических направлениях: [001] (а), [100] (б), [$\bar {4}$11] (в), [100] (г).

Содержание катионов в La1 –xBixMn1 –yFeyO3 + δ, найденное методами рентгеновского энергодисперсионного анализа (EDX) и химического анализа (ААС и АЭС-ИСП), в целом согласуется между собой и с номинальным составом, заложенным при синтезе. Однако результаты EDX для 15–20 кристаллитов каждого состава выявили незначительные расхождения в катионном распределении в объеме и на поверхности брикетов по сравнению с номинальным значением.
Влияние ионов висмута и железа на устойчивость и термическое поведение образцов было изучено методами высокотемпературной рентгенографии, дилатометрии и термогравиметрического анализа (ТГА). Фазовых переходов в исследованном интервале не обнаружено. На рис. 3 представлена зависимость объема элементарной ячейки от температуры и результаты ТГА для образца La0.9Bi0.1Mn0.8Fe0.2O3 + δ. В обоих случаях при температуре около 650°C наблюдается смена наклона прямолинейных участков кривых. Температурная зависимость линейных размеров образца La0.8Bi0.2Mn0.7Fe0.3O3 + δ показывает аналогичное поведение (рис. 4). Несовпадение кривых нагрева и охлаждения обусловлено дополнительным спеканием образцов при более высокой температуре измерения. В свою очередь, изменение КТР с температурой претерпевает скачок: КТР исследуемых соединений равен 11.6 × 10–6°С–1 в низкотемпературной (25–650°С) и 12.3 × 10–6°С–1 в высокотемпературной (650–1000°С) области. Зафиксированное изменение термических характеристик твердого раствора La1 –xBixMn1 –yFeyO3 + δ при высоких температурах аналогично результатам для La0.8Bi0.2MnO3.15, где изменение значения КТР происходит при 730°С [28]. Авторы [1] показали, что недопированный LaMnO3 также имеет две линейные области на температурной зависимости параметров элементарной ячейки, что может быть объяснено уменьшением избыточной кислородной нестехиометрии вследствие потери кислорода при высоких температурах. Поэтому расширение элементарной ячейки связано не только с термическим расширением, но и со снижением содержания кислорода в элементарной ячейке. Такое явление известно как изотермическое или химическое расширение, происходящее благодаря изменению концентрации дефектов в кристалле. В [29] показано, что причиной химического расширения решетки кислорододефицитного манганита лантана является увеличение среднего радиуса ионов в результате замены меньшего катиона (Mnn+) на больший (Mn+(n– 1)) при снижении содержания кислорода в элементарной ячейке с повышением температуры. Поэтому смена наклона на температурной зависимости параметров элементарной ячейки La1 –xBixMn1 –yFeyO3 + δ определяется, главным образом, химическим расширением образца при высоких температурах (650–1000°С). В подтверждение вышесказанного на кривой ТГА образца La0.9Bi0.1Mn0.7Fe0.3O3 + δ отмечена потеря кислорода при температурах выше 650°С (рис. 3). Кислородная нестехиометрия состава La0.6Bi0.4Mn0.6Fe0.4O3 + δ определена в [8]. Авторы оценили значение δ равным 0.1, что эквивалентно содержанию кислорода в LaBiMn2O6.2 [30]. Наши результаты показали, что δ = 0.15. Эти данные согласуются с ранее полученными значениями [28] и выводами авторов [21] о постоянной степени окисления ионов Fe3+ в этих оксидах.
Рис. 3.
Температурная зависимость объема и термогравиметрическая кривая образца La1 – xBixMn1 – yFeyO3 + δ.
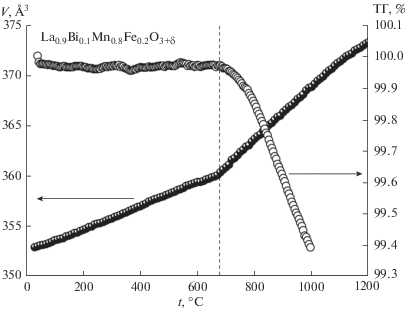
Рис. 4.
Температурные зависимости линейных размеров образца и коэффициента термического расширения La0.7Bi0.3Mn0.8Fe0.2O3 + δ.
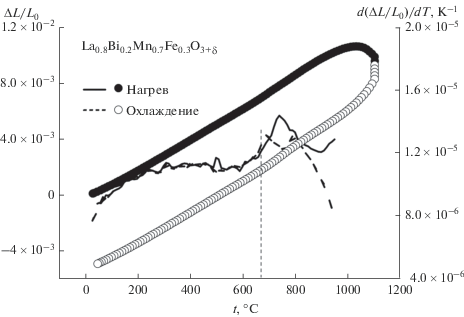
Введение ионов железа в структуру висмутзамещенного манганита лантана приводит к уменьшению значений КТР по сравнению с матричным соединением La0.8Bi0.2MnO3.15 [28] (КТР равен 13 × 10–6°С–1 при 25–730°С и 15 × 10–6°С–1 при 730–1000°С).
С помощью СЭМ (рис. 5) определены размеры частиц синтезированных порошков, значения которых варьируют в диапазоне 1–10 мкм. Дополнительно СЭМ-анализ керамических образцов показал их высокую пористость. Методом гидростатического взвешивания определено, что значение пористости спеченных при 1000°С брикетов составляет 20–26%.
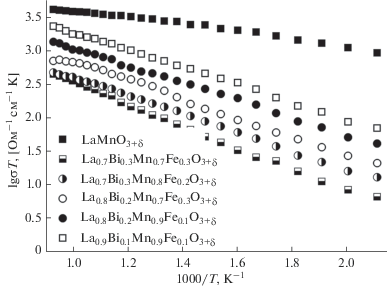
Температурная зависимость электропроводности замещенных манганитов лантана различной степени замещенности, представленная на рис. 6, позволяет оценить влияние вводимых в структуру манганита лантана ионов висмута и железа на общее значение этой величины. Можно заключить, это с увеличением содержания допантов в образцах происходит рост сопротивления образцов, это согласуется с данными низкотемпературных измерений [31]. Такое поведение связано с особой ролью 6s2-неподеленной пары электронов ионов висмута [32–34]. Гибридизация между 6s2 (Bi3+)- и 2p (O2–)-орбиталями может привести к снижению подвижности электронов через связи Mn–O–Mn. Таким образом, значение электропроводности образцов уменьшается. Ионы Fe3+ имеют постоянную степень окисления, поэтому не способствуют увеличению электронной составляющей электропроводности. Однако полученные значения электропроводности La1 –xBixMn1 –yFeyO3 + δ (x = 0.1–0.3, у = 0.1–0.3; Δх, Δу = 0.1) близки к манганиту лантана (рис. 6) и равны 0.25–6 Ом–1 см–1.
ЗАКЛЮЧЕНИЕ
С помощью многостадийного твердофазного синтеза получены твердые растворы La1 –xBixMn1 –yFeyO3 + δ (x = 0.1–0.3, у = 0.1–0.3; Δх, Δу = 0.1), установлена последовательность фазообразования в процессе их синтеза. Все синтезированные образцы имеют ромбоэдрическую структуру (пр. гр. R3c) при комнатной температуре. Подробный анализ структуры методом ПЭМ показал наличие двух типов кристаллитов с различными пр. гр. Исследование твердых растворов с помощью высокотемпературной рентгенографии, термогравиметрии и дилатометрии позволило установить наличие химического расширения образцов при температуре выше 650°С. Индекс кислородной нестехиометрии δ во всех образцах при комнатной температуре равен 0.15 вследствие того, что ионы Bi3+ и Fe3+ имеют постоянную степень окисления в исследуемых соединениях. Замещение марганца железом приводит к уменьшению значений КТР по сравнению с висмутзамещенным манганитом лантана: 11.6 × × 10–6°C–1 (25–650°С) и 12.3 × 10–6°С–1 (650–1000°С) для La0.8Bi0.2Mn0.7Fe0.3O3 + δ; 13 × 10–6°С–1 при 25–730°С и 15 × 10–6°С–1 при 730–1000°С для La0.8Bi0.2MnO3 + δ. Оценочные измерения электропроводности позволили сделать вывод о том, что замещение манганита лантана как ионами висмута, так и ионами железа не приводит к увеличению электронной составляющей проводимости по сравнению с матричным соединением.
Список литературы
Miyoshi S., Kaimai A., Matsumoto H. et al. // Solid State Ionics. 2004. V. 175. P. 383. https://doi.org/10.1016/j.ssi.2004.01.082.
Chen W.-T., Sher F., Mathur N.D. et al. // Chem. Mater. 2012. V. 24. P. 199. doi 10.1021/cm202900v
Porta P., Rossi S., Faticanti M. et al. // J. Solid State Chem. 1999. V. 146. P. 291. https://doi.org/10.1006/ jssc.1999.8326.
Frozandeh-Mehr E., Malekzadeh A., Ghiasi M. et al. // Catal. Commun. 2012. V. 28. P. 32. https://doi.org/ 10.1016/j.catcom.2012.08.009.
Sadykov V., Mezentseva N., Arapova M. et al. // Solid State Ionics. 2013. V. 251. P. 34. https://doi.org/ 10.1016/j.ssi.2013.03.016.
Kundu A.K., Ranjith R., Kundys B. et al. // Appl. Phys. Lett. 2008. V. 93. P. 052906. https://doi.org/10.1063/ 1.2961022.
Kundu A.K., Jha V.K., Seikh Md.M. et al. // J. Phys.: Condens. Matter. 2012. V. 24. P. 255902. https://doi.org/10.1088/0953-8984/24/25/255902.
Kundu A.K., Motin Seikh Md., Srivastava A. et al. // J. Appl. Phys. 2011. V. 110. P. 073904. https://org/doi 10.1063/1.3646458.
Keerthana S.P., Muneeswaran M., Jegatheesan P. et al. // Solid State Physics Symposium 2011 (AIP Conf. Proc.). 2012. V. 1447. P. 1333. https://doi.org/10.1063/ 1.4710506.
Li Y., Zhang H., Liu H. et al. // J. Alloys Compd. 2014. V. 592. P. 19. https://doi.org/10.1016/j.jallcom.2013.12. 244.
Grundy A.N., Chen M., Hallstedt B. et al. // J. Phase Equilibria and Diffusion. 2005. V. 26. № 2. P. 131. doi 10.1361/154777030523021
Van Roosmalen J.A.M., Cordfunke E.H.P., Helmhold R.B. et al. // Solid State Chem. 1994. V. 110. P. 100.
Hervieu M., Mahesh R., Rangavittal N. et al. // Eur. J. Solid State Inorg. Chem. 1995. V. 32. P. 79.
Bogush A.K. Pavlov V.I., Balyko L.V. // Cryst. Res. Technol. 1983. V. 18. № 5. P. 589. doi 10.1002/ crat.2170180504
Izgi T., Kolat V.S., Bayri N. et al. // J. Magn. Magn. Mater. 2014. V. 372. P. 112. https://doi.org/10.1016/j.jmmm.2014.07.037.
Jha V.K., Nautiyal P., Seikh Md.M. et al. // J. Mater. Sci. 2013. V. 48. P. 7629. https://doi.org/10.1007/s10853-013-7580-6.
Petitjean M., Caboche G., Dufour L.C. // Solid State Ionics. 2005. V. 176. P. 9. doi 10.1016/j.ssi.2004.06.007
Caboche G., Dufour L.C., Morin F. // Solid State Ionics. 2001. V. 144. P. 211. https://doi.org/10.1016/S0167-2738(01)00985-7.
Mori M. // Solid State Ionics. 2004. V. 174. P. 1. https://doi.org/10.1016/j.ssi.2004.07.024.
Aksenova T.V., Gavrilova L.Ya., Cherepanov V.A. // Russ. J. Phys. Chem. A. 2012. V. 86. № 12. P. 1862. https://doi.org/10.1134/S0036024412120023 [Аксенова Т.В., Гаврилова Л.Я., Черепанов В.А. // Журн. физ. химии. 2012. Т. 86. № 12. С. 2000.]
Long Zh., Wu X.-Sh. // Chin. Phys, B. 2013. V. 22. P. 107806. https://doi.org/10.1088/1674-1056/22/10/ 107806.
Tong W., Zhang B., Tan Sh. et al. // Phys. Rev. B. 2004. V. 70. P. 014422. https://doi.org/10.1103/PhysRevB.70.014422.
Zhou X.-D., Pederson L.R., Cai Q. et al. // J. Appl. Phys. 2006. V. 99. P. 08M918. https://doi.org/10.1063/ 1.2176389.
Kaymieva O.S., Danilova V.V., Morozova M.V. et al. // Chem. Sustainable Development. 2016. V. 24. № 2. P. 135. [Каймиева О.С., Данилова В.В., Морозова М.В. et al. // Химия в интересах устойчивого развития. 2016. Т. 24. № 2. С. 135. doi 10.15372/ KhUR20160203]
Powder Diffraction File PDF2 ICDD Release 2013.
Laugier J., Bochu B. // LMGP-Suite of Programs for the interpretation of X-ray Experiments. ENSP. Grenoble: Lab. Materiaux genie Phys., 2003.
DiffracPlus: Topas Bruker AXS GmbH, Ostliche. Rheinbruckenstrae 50, D-76187, Karlsruhe, Germany, 2006.
Kaymieva O.S., Morozova M.V., Buyanova E.S. et al. // ECS Transactions. 2015. V. 68. P. 977. doi 10.1149/06801. 0977ecst
Zuev A.Yu., Tsvetkov D.S. // Solid State Ionics. 2010. V. 181. P. 557. doi 10.1016/j.ssi.2010.02.024
Kundu A.K., Pralong V., Caignaert V. et al. // J. Mater. Chem. 2007. V. 17. P. 3347. doi 10.1039/B705027E
Chen W.T., Sher F., Mathur N.D. et al. // Chem. Mater. 2012. V. 24. P. 199. doi 10.1021/cm202900v
Li R., Qu Z., Fang J. // Physica B. 2011. V. 406. P. 1312. https://doi.org/10.1016/j.physb.2011.01.023.
Kim B.H., Kim J.S., Park T.H. // J. Phys.: Condens. Matter. 2007. V. 19. P. 296205. https://doi.org/10.1088/ 0953-8984/19/29/296205.
Garcia-Munoz J.L., Frontera C., Aranda M.A.G. et al. // J. Solid State Chem. 2003. V. 171. P. 84. https://doi.org/10.1016/S0022-4596(02)00192-5.
Дополнительные материалы отсутствуют.
Инструменты
Журнал неорганической химии