Журнал неорганической химии, 2019, T. 64, № 4, стр. 445-450
1,5-бис[2-(диоксифосфорил)-4-этилфенокси]-3-оксапентан и его аналоги. Кислотность и комплексообразование в водных средах с катионом меди(II)
Я. Ф. Аль Ансари 1, *, В. Е. Баулин 2
1 Марийский государственный университет
424000 Йошкар-Ола, пл. Ленина, 1, Россия
2 Институт физиологически активных веществ РАН
142432 Черноголовка, Северный проезд, 1, Россия
* E-mail: yana_ansari@mail.ru
Поступила в редакцию 19.03.2018
После доработки 04.06.2018
Принята к публикации 12.07.2018
Аннотация
Потенциометрическим, спектрофотометрическим и кондуктометрическим методами изучена диссоциация и комплексообразование с катионом Сu(II) фосфорилподандов кислотного типа: четырехосновного − 1,5-бис[2-(диоксифосфорил)-4-этилфенокси]-3-оксапентана (H4LP), двухосновного − 1,5-бис[2-(оксиэтоксифосфорил)-4-этилфенокси]-пентана (H2LP), а также их карбонильного аналога − полиэфирной дикарбоновой кислоты 1,5-бис[2-(оксикарбонилфенокси)]оксапентана (H2LC) в воде в присутствии 5% диметилформамида. Фосфорилподанды обладают хорошими комплексообразующими свойствами и способны к селективному связыванию катионов металлов. В работе определены значения констант диссоциации и получена диаграмма распределения форм ионизации изученных соединений в зависимости от рН среды. Определено, что мольное соотношение металла и поданда во всех комплексах составило 1 : 1. Рассчитаны константы устойчивости комплексов с катионом Cu2+. Наиболее прочные комплексы медь(II) образует с четырехосновным подандом.
ВВЕДЕНИЕ
Водорастворимые координационные соединения меди с органическими лигандами представляют интерес для решения многих медико-биологических задач. В частности, соединения стабильных и радиоактивных изотопов меди с органическими лигандами являются весьма перспективными веществами для поиска новых химиотерапевтических [1] и радиофармацевтических препаратов [2–4]. Супрамолекулярные комплексы меди с органическими лигандами являются катализаторами гидролиза фосфат-эфиров в физиологических средах [5], используются в качестве модельных соединений при изучении строения и свойств центров координации металлов в протеинах [6, 7]. Результаты исследования связывания катионов меди с рядом МРТ-контрастных агентов [8] и люминесцентных маркеров [9] позволяют выявить патологические нарушения гомеостаза, сопутствующие болезням Альцгеймера, Паркинсона и Вильсона. Применение медных комплексов некоторых нестероидных противовоспалительных препаратов позволяет уменьшить их побочные эффекты [10]. Некоторые координационные соединения меди с органическими лигандами проявляют антимикробную активность [11].
Органические кислоты фосфора являются весьма перспективными лигандами для связывания d- и f-элементов и представляют интерес для решения ряда задач, связанных с их селективным выделением [12–16], что до настоящего времени стимулирует синтез и исследование физико-химических свойств как вновь синтезированных, так и известных соединений этого класса [17–24].
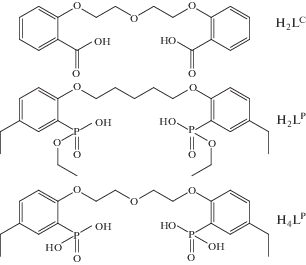
В настоящей работе изучены процессы диссоциации и комплексообразования с катионом Сu(II) ряда фосфорилсодержащих подандов − четырехосновной кислоты − 1,5-бис[2-(диоксифосфорил)-4-этилфенокси]-3-оксапентана (H4LP), двухосновной кислоты − 1,5-бис[2-(оксиэтоксифосфорил)-4-этилфенокси]пентана (H2LP), полиэфирная цепочка которого не содержит координирующего атома кислорода. Для сравнения аналогичные данные получены и для полиэфирной дикарбоновой кислоты (H2LC) (рис. 1).
Соединения H4LP, H2LP являются дифосфоновыми кислотами, а соединение H2LC – дикарбоновой кислотой. Все они относятся к классу синтетически доступных ациклических аналогов краун-эфиров − подандов кислотного типа, полиэфирная цепочка которых содержит два этиленгликолевых звена. Выбор диэтиленгликолевой цепочки в качестве полиэфирного фрагмента обусловлен результатами изучения комплексообразующих свойств в водно-спиртовой среде потенциометрическим методом ряда дифосфоновых кислот – аналогов H4LP − с различным числом полиэфирных звеньев по отношению к двухзарядным катионам металлов с близкими радиусами: Ca(II), Mg(II), Cd(II), Ni(II), Cu(II) и Zn(II). Эти исследования позволили сделать два вывода. Во-первых, комплексы Cu(II) обладают наибольшей устойчивостью по сравнению с комплексами других металлов (разница в значениях констант устойчивости комплексов с Cu(II) составляет 3−4 порядка). Во-вторых, именно два этиленгликолевых звена подандов обеспечивают наибольшую селективность и устойчивость образующихся комплексов Cu(II) [24]. Недавно установлено, что моноалкиловые полуэфиры − диэтиленгликолевые производные H4LP – являются эффективными экстрагентами, количественно извлекающими Th(IV) и U(VI) в присутствии лантанидов из разбавленных растворов азотной кислоты [25–27]. На основе H4LP разработаны экстракционно-хроматографические материалы импрегнированного типа для селективного извлечения промышленно значимых радионуклидов 99Мо [28] и 147Pm из азотнокислых растворов [29]. Фосфорилподанд H4LP перспективен для разработки бинарных экстрагентов для эффективного извлечения Th из азотнокислых растворов [30].
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Синтез H4LP, H2LP и H2LC осуществлен по методике, описанной в [28]. Аналитические данные и спектры ЯМР 1Н, 31Р соответствуют литературным. Спектры ЯМР полученных соединений регистрировали на приборах Bruker-СPX-200 и Bruker-DXР-200 (200 МГц) относительно тетраметилсилана (1Н) или 85%-ной Н3РО4 (31P). Температуру плавления определяли с помощью укороченного термометра Аншутца. Элементный анализ проводили на С, Н, N-анализаторе (Carlo Erba Strumentazione, Italy). В работе использовали 0.01 М растворы фосфорилподандов в диметилформамиде, приготовленные по точной навеске.
Раствор CuSO4 с концентрацей 0.01 моль/л готовили растворением 5-водного сульфата меди(II) марки “ч. д. а.”. Точную концентрацию ионов металла в нем устанавливали комплексонометрическим титрованием при рН 8.0, создаваемом раствором аммиака, с использованием индикатора мурексида. Раствор NaOH с концентрацией 0.1 моль/л готовили из фиксанала. Точную концентрацию NaOH устанавливали титрованием раствором HCl (из фиксанала) с индикаторами фенолфталеином и метилоранжем.
Все исследования проводили в водной среде с 5%-ным (по объему) содержанием диметилформамида при температуре 22 ± 1°С. Потенциометрические измерения осуществляли на иономере марки рН-150МА, откалиброванном по буферным растворам. Постоянство ионной силы (µ = = 0.1) поддерживали раствором KCl.
Спектрофотометрические измерения выполняли на спектрофотометре СФ-46 с использованием кюветы с толщиной поглощающего слоя, равной 1 см.
Электропроводность растворов измеряли на кондуктометре АНИОН 4100.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Константы диссоциации H4LP, H2LP и H2LC и константы устойчивости комплексов с катионом меди определяли методом потенциометрического титрования (ПМТ) растворов подандов раствором NaOH в отсутствие и в присутствии ионов Cu(II) при мольном соотношении металл : лиганд, равном 1 : 1. Результаты потенциометрического титрования лигандов и их комплексов представлены на рис. 2. Каждое титрование проводили по три раза. Константы диссоциации подандов и устойчивости комплексов рассчитывали с использованием метода Шварценбаха [31].
Кривые потенциометрического титрования двухосновных кислот H2LC и H2LP имеют один скачок на 2 экв добавленной щелочи, что соответствует одновременной диссоциации двух протонов. На кривой титрования четырехосновной кислоты H4LP наблюдаются два скачка: первый соответствует одновременному отрыву двух протонов, второй − диссоциации оставшихся двух протонов, что свидетельствует в пользу независимой ионизации концевых фосфоновых и карбоновых фрагментов в исследованных соединениях.
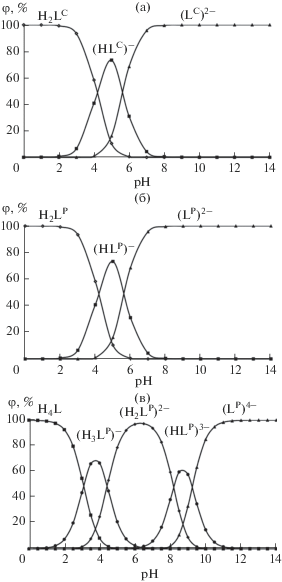
Рассчитанные значения констант диссоциации представлены в табл. 1. Кислотные свойства дикарбоновой кислоты Н2LС ожидаемо несколько ниже, чем дифосфоновой кислоты Н2LР. На основе полученных значений констант диссоциации построены диаграммы распределения форм ионизации H4LP, H2LP и H2LC в зависимости от рН среды (рис. 3), которые представляют несомненный интерес для создания бинарных экстрагентов [32] и медицинских препаратов на основе этих соединений [1–4].
Таблица 1.
Константы ионизации фосфорилподандов (µ = 0.1, KCl)
| Фосфорилподанд | рKа, 1 | рKа, 2 | pKа, 3 | pKа, 4 |
|---|---|---|---|---|
| H2LC | 4.16 ± 0.04 | 5.66 ± 0.02 | – | – |
| H2LP | 2.71 ± 0.05 | 4.16 ± 0.02 | – | – |
| H4LP | 3.09 ± 0.03 | 4.43 ± 0.03 | 8.19 ± 0.02 | 9.24 ± 0.06 |
Расхождение кривых титрования в присутствии и в отсутствие ионов меди(II) служит доказательством протекания процессов комплексообразования во всех трех системах и дает возможность определить значения констант устойчивости (табл. 2). Анализ кривых ПМТ позволяет сделать вывод, что связывание катиона меди всеми исследуемыми соединениями начинается после добавления 2 экв щелочи. Причем комплексообразование с Н2LС начинается при рН около 6, в то время как образование комплексов с катионом Cu2+ с фосфорилсодержащими подандами Н2LP и H4LP − в более кислой области, при рН > 4. При этом в реакцию с Cu2+ вступают преобладающие в данной области рН депротонированные формы исследуемых лигандов (рис. 2).
Таблица 2.
Логарифмы констант устойчивости (µ = 0.1, KCl)
| Лиганд | Комплексная частица | lg β |
|---|---|---|
| H2LC | [CuLC] | 3.91 ± 0.07 |
| H2LP | [CuLP] | 3.16 ± 0.05 |
| H4LP | [CuH2LP] | 3.18 ± 0.08 |
| [CuHLP]– (2 < a < 3) | 6.82 ± 0.02 | |
| [CuHLP]– (3 < a < 4) | 5.02 ± 0.06 | |
| [CuLP]2– | 8.51 ± 0.03 |
Рис. 2.
Кривые ПМТ, µ = 0.1 (KCl), соотношение металл : лиганд = 1 : 1; а – количество эквивалентов NaOH.
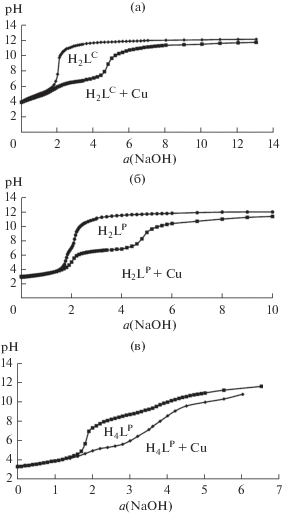
Рис. 3.
Диаграммы распределения форм ионизации подандов H2LC (а), H2LP (б) и H4LP (в) в зависимости от рН.
Анализируя кривые ПМТ, можно сделать вывод, что двухосновные поданды (Н2LС и Н2LP) не насыщают полностью координационную сферу меди(II). Вероятно, в ней имеются еще 2–3 молекулы растворителя – H2O, о чем говорит наличие скачка на кривой при 5 экв NaOH. Этот вывод не противоречит результатам рентгеноструктурного анализа моноядерного комплекса с катионом меди ближайшего аналога H2LР − 1,5-бис[2-(диоксифосфорил)-фенокси]-3-оксапентана меди, согласно которому, катионы меди(II) находятся в искаженном плоскоквадратном окружении двух атомов кислорода молекул воды и двух атомов кислорода хелатного дианиона фосфорилподанда [33]. Близкие значения логарифмов констант устойчивости комплексов [CuLP] (lg β = 3.16) и [CuH2LP] (lg β = 3.18) также подтверждают ранее выявленный факт [33] неучастия центрального атома кислорода полиэфирной цепочки в координации с катионом меди.
Для определения состава комплексов (мольного соотношения металл : лиганд) использовали
спектрофотометрический метод. При смешении растворов подандов и сульфата меди наблюдается
гиперхромный эффект на длинах волн и лиганда (лиганды имеют полосу на 300 нм), и металла
(750 нм). Полоса 300 нм обладает гораздо большим коэффициентом экстинкции, поэтому
измерения проводили на ней. В основе СФ-метрического эксперимента лежала серия насыщения,
представляющая собой серию растворов с одинаковой концентрацией ионов меди(II) и разной
концентрацией поданда. Математическую обработку полученных зависимостей оптической
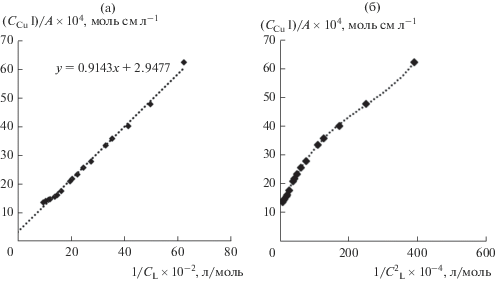
плотности от концентрации лиганда проводили методом Бенеши–Гильдебранда [34], который основан на анализе зависимости СМl/A от 1/$C_{L}^{n},$ которая для искомого n носит прямолинейный характер (СМ и СL – исходные концентрации металла и лиганда, А – оптическая плотность, l – толщина поглощающего слоя, n – количество молекул лиганда в комплексе). Линейная зависимость 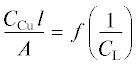 и отсутствие линейной зависимости
и отсутствие линейной зависимости 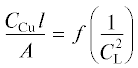 указывают на образование комплексов состава 1 : 1 (метод представлен на рис. 4 на примере системы Cu(II)–Н2LС).
указывают на образование комплексов состава 1 : 1 (метод представлен на рис. 4 на примере системы Cu(II)–Н2LС).
Преобразовав зависимости оптической плотности от концентрации подандов в логарифмические (–lg A = f(–lg CL)), получили прямые с угловым коэффициентом tgα, равным n [35]. Во всех трех системах он оказался равным ~1: 0.8429 (Н2LС), 0.8327 (Н2LР), 0.9173 (Н4LР).
Для комплекса H4LP данный состав подтвержден и методом кондуктометрического титрования раствора меди(II) раствором нейтрализованного поданда (рис. 5). Для нейтрализации использовали раствор NaOH, взятый в мольном соотношении H4LP : NaOH = 1 : 4. Протекающий в растворе процесс можно представить уравнением:
Рис. 5.
Кондуктометрическое титрование раствора меди(II), а – количество добавленных эквивалентов нейтрализованного поданда L4–.
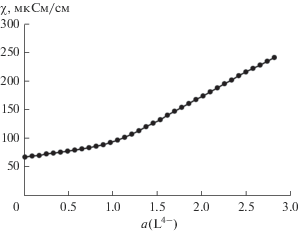
Таким образом, во всех изученных системах зафиксировано образование только моноядерных частиц. Для них найдены интервалы рН комплексообразования. Доказан состав и рассчитаны константы устойчивости комплексных частиц. В случае с подандом H4LP с уменьшением степени протонирования лиганда устойчивость комплексных частиц растет.
Список литературы
Wehbe M., Leung A.W.Y., Abrams M.J. et al. // Dalton Trans. 2017. V. 46 (33). P. 10758. doi 10.1039/ c7dt01955f
Wadas T.J., Wong E.H., Weisman G.R., Anderson C.J. // Chem. Rev. 2010. V. 110. P. 2858. doi 10.1021/ cr900325h
Cutler C.S., Hennkens H.M., Sisay N. et al. // Chem. Rev. 2013. V. 113. P. 858. doi 10.1021/cr3003104
Shuang Liu // Advanced Drug Delivery Rev. 2008. V. 60. P. 1347. doi 10.1016/j.addr.2008.04.006
Mohd Zulkefeli, Asami Suzuki, Motoo Shiro et al. // Inorg. Chem. 2011. V. 50. P. 10113. doi 0.1021/ ic201072q
Kimura E. // Bull. Jpn. Soc. Coord. Chem. 2012. V. 59. P. 26. doi 10.4019/bjscc.59.26
Meierhofer T., Rosnizeck I.C., Graf T. et al. // J. Am. Chem. Soc. 2011. V. 133. P. 2048. doi 10.1021/ ja108779j
Pierre V.C., Harris S.M., Pailloux S.L. // Acc. Chem. Res. 2018. V. 51 (2). P. 342. doi 10.1021/acs.accounts.7b00301
Harris S.M., Srivastava K., League A.B. et al. // Dalton Transactions. 2018. V. 47. P. 2202. doi 10.1039/ C7DT04203E
Puranik R., Bao S., Bonin A.M. et al. // Cell. Biosci. 2016. V. 6. № 1. P. 1. doi 10.1186/s13578-016-0076-8
Hubin T.J., Prince N.-A. Amoyaw, Roewe K.D. et al. // Bioorg. Med. Chem. 2014. V. 22. № 13. P. 3239. doi 10.1016/j.bmc.2014.05.003
Corbridge D.E.C. Phosphorus: Chemistry, Biochemistry and Technology. N.Y.: CRC Press, 2013.
Hill C. // Ion Exchange and Solvent Extraction: A Series of Advances. V. 19 / Ed. Moyer B.A. Boca Raton: CRC Press, 2010. 119 p.
Nash K.L., Barrans R.E., Chiarizia R. et al. // Solv. Extr. Ion Exch. 2000. V. 18. P. 605. https://doi.org/10.1080/07366290008934700.
Otu E.O., Chiarizia R. // Solv. Extr. Ion Exch. 2001. V. 19. P. 885.
Otu E.O., Chiarizia R. // Solv. Extr. Ion Exch. 2001. V. 19. P. 1017.
Nishihama S., Witty R.P., Martin L.R., Nash K.L. // Solv. Extr. Ion Exch. 2013. V. 31. P. 370. https://doi.org/10.1080/07366299.2013.800404.
Zalupski P.R., McAlister D.R., Stepinski D.C., Herlinger A.W. // Solv. Extr. Ion Exch. 2003. V. 21. P. 331.
Ali M.B., Ya A., Ahmed B.H. et al. // Solv. Extr. Ion Exch. 2012. V. 30. P. 469.
Fu Q., Yang L., Wang Q. // Talanta. 2007. V. 72. P. 1248. doi 10.1016/j.talanta.2007.01.015
Lumetta G.J., Sinkov S.I., Krause J.A., Sweet L.E. // Inorg. Chem. 2016. V. 55. № 4. P. 1633. doi 10.1021/acs.inorgchem.5b02524
Batchu N.K., Hoogerstraete T.V., Banerjee D., Binnemans K. // RSC Advances 2017. V. 72. № 7. P. 45351. doi 10.1039/C7RA09144C
Shatrava I.O., Ovchynnikov V.A., Gubina K.E. et al. // Polyhedron. 2018. V. 139. P. 98. doi 10.1016/j.poly.2017.09.038
Игнатьева Т.И., Баулин В.Е., Цветков Е.Н., Раевский О.А. // Журн. общей химии. 1990. Т. 60. Вып. 7. С. 1503.
Сафиулина А.М., Матвеева А.Г., Иванец Д.В. и др. // Изв. АН. Сер. хим. 2015. № 1. С. 161. doi 10.1007/s11172-015-0837-2
Сафиулина А.М., Матвеева А.Г., Иванец Д.В. и др. // Изв. АН. Сер. химическая. 2015. № 1. С. 169. doi 10.1007/s11172-015-0838-1
Туранов А.Н., Карандашев В.К., Баулин В.Е., Цивадзе А.Ю. // Радиохимия. 2014. Т. 56. № 1. С. 21. doi 10.1134/S1066362214010056
Баулин В.Е., Коваленко О.В., Туранов А.Н. и др. // Радиохимия. 2015. V. 56. № 1. С. 53. doi 10.1134/S1066362215010099
Баулин В.Е., Коваленко О.В., Баулин Д.В. и др. // Физикохимия поверхности и защита материалов. 2016. Т. 52. № 6. С. 604. doi 10.1134/ S2070205116060083
Safiullina A.M., Ivanets D.V., Kudryavtsev E.M. et al. // Russ. J. Inorg. Chem. 2018. V. 63. № 12. P. 1679. doi 10.1134/S00360236 [Сафиулина А.М., Иванец Д.В., Кудрявцев Е.М. и др. // Журн. неорган. хим. 2018. № 12. С. 1659. doi 10.1134/S0044457X18120188]
Дятлова Н.М., Темкина В.Я., Колпакова И.Д. Комплексоны. М.: Химия, 1970. 416 с.
Belova V.V., Egorova N.S., Voshkin A.A. et al. // Theoretical Foundations of Chemical Engineering. 2015. V. 49. № 4. P. 545. doi 10.1134/S0040579515040041 [Белова В.В., Егорова Н.С., Вошкин А.А. и др. // Химическая технология. 2014. Т. 15. № 2 С. 106.]
Баулин В.E., Кискин М.А., Иванова И.С. // Russ. J. Inorg. Chem. 2012. Т. 57. № 5. С. 671. doi 10.1134/S0036023612050038
Полле Э.Г. // Успехи химии. 1974. Т. 43. Вып. 8. С. 1337. (Polle E.G. // Russ. Chem. Rev. 1974. V. 43. № 8. P. 1337).
Булатов М.И., Калинкин И.П. Практическое руководство по фотометрическим методам анализа. Л.: Химия, 1986. 432 с.
Дополнительные материалы отсутствуют.
Инструменты
Журнал неорганической химии