Журнал неорганической химии, 2019, T. 64, № 3, стр. 318-322
Фазовые равновесия в системе ZnSO4–H2O при температурах до 444°C и давлениях до 34 МПа
М. А. Урусова 1, В. М. Валяшко 1, *
1 Институт общей и неорганической химии им. Н.С. Курнакова РАН
119991 Москва, Ленинский пр-т, 31, Россия
* E-mail: valyashko@mail.ru
Поступила в редакцию 08.06.2018
После доработки 13.07.2018
Принята к публикации 15.08.2018
Аннотация
Исследованы фазовые равновесия в двойной системе ZnSO4–H2O при температурах 240–450°С и давлениях до 34 МПа различными методами (визуальное наблюдение фазовых превращений в водно-солевых смесях разного состава (30–60 мас. %) в толстостенных кварцевых ампулах (внутренний диаметр 3 мм), отбор проб растворов и их химический анализ, автоклавные измерения P–V–T-параметров при фазовых переходах). Показано, что уменьшение растворимости ZnSO4 с повышением температуры, наблюдаемое до 350–370°С, сменяется ее резким ростом при дальнейшем нагревании, т.е. отрицательный температурный коэффициент растворимости, характерный для систем 2-го типа, сменяется положительным, как в системах 1-го типа. Система ZnSO4–H2O относится к 1-му типу, осложненному расслаиванием насыщенных (и ненасыщенных) растворов, что приводит к резкому увеличению растворимости соли выше 375°С.
ВВЕДЕНИЕ
Как известно, водно-солевые системы и входящие в них соли подразделяются на два типа [1, 2], так же как и другие неорганические и органические бинарные смеси с компонентами разной летучести [3–5]. К 1-му типу относятся системы, в которых растворимость солей увеличивается с ростом температуры вплоть до температуры плавления и критические газово-жидкие явления (г = = ж) существуют только в ненасыщенных растворах. К 2-му типу относятся системы с солями, растворимость которых снижается при приближении к критической температуре воды, что приводит к появлению критической точки p (г = ж–тв). При температурах выше Tp возникает сверхкритическая область, где гомогенный флюид может быть в равновесии только с твердой фазой нелетучего компонента (фл–тв). Эта область заканчивается второй конечной критической точкой Q (г = ж–тв или ж1 = ж2–тв), когда начинается разделение гомогенного флюида на два несмешивающихся раствора. При температурах выше TQ существуют двух- и трехфазные равновесия расслаивания (ж1–ж2) и (ж1–ж2–тв), переходящие постепенно в (г–ж) и (г–ж–тв).
Если обе инвариантные критические точки p и Q соответствуют одинаковому равновесию (г = = ж–тв), то они принадлежат одной моновариантной критической кривой (г = ж), объединяющей критические точки (г = ж) чистых компонентов, что показано в нескольких органических системах [6–8].
Предполагается, что системы 2-го типа, в которых критическая точка Q отвечает равновесию (ж1 = ж2–тв), в большинстве случаев относятся к усложненному типу с метастабильной областью расслаивания (г–ж1–ж2) в пересыщенных растворах при более низких температурах и давлениях, чем в критической точке p, вплоть до параметров метастабильной критической точки (г–ж1 = ж2–тв) [1–3]. Эта область расслаивания может стать стабильной при добавлении третьего компонента, что было установлено в системах SiO2–Na2O–H2O [2, 9] и Li2SO4–KLiSO4–H2O [2, 10].
К такому усложненному 2-му (p–Q) типу относятся водные системы с сульфатами щелочных металлов (Li2SO4, Na2SO4, K2SO4) [1]. Растворимость в воде сульфатов двухвалентных металлов (MgSO4, ZnSO4, CdSO4) до недавнего времени была изучена при температурах до ~250°C [11–14] и было показано, что она снижается при этом до нескольких мас. %. Однако последние исследования растворов некоторых из указанных солей (Li2SO4, MgSO4, ZnSO4, CdSO4) в очень тонких капиллярах (внутренний диаметр 0.05–0.3 мм) [15–18] обнаружили в них трехфазное расслаивание (г–ж1–ж2) при температурах 250–330°С и достаточно высоких концентрациях (до 2–3 m), хотя, согласно более ранним исследованиям, при таких параметрах должно существовать равновесие г–ж–тв.
Цель настоящей работы – установление характера фазовых равновесий в системе ZnSO4–H2O.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
В системе ZnSO4–H2O растворимость соли достаточно высока при невысоких температурах (до 46 мас. % при 63°С), но далее начинает снижаться с ростом температуры (до нескольких мас. % при 250°С [10–14]). В данной работе приведены результаты изучения фазовых равновесий в указанной системе выше 250°С.
Один из методов исследования – наблюдение за изменением фазового состояния в смеси ZnSO4 с водой при изменении температуры в запаянных толстостенных кварцевых ампулах (внутренний диаметр 3 мм) [1, 2, 10]. Таким образом, были получены данные для составов с 30, 40, 50 и 65 мас. % ZnSO4.
При нагревании 30%-ного раствора ZnSO4 в присутствии пара при 200оС было отмечено появление кристаллов, и с ростом температуры их количество увеличивалось. Когда содержание ZnSO4 в смеси ZnSO4 + H2O составляло 40 и 50 мас. %, твердая фаза присутствовала изначально. При 65% вся загрузка представляла собой твердые кристаллогидраты, и в этом случае возникновение раствора было замечено лишь выше 380°С.
Если в ампуле было достаточное количество жидкой фазы (30 и 40 мас. % ZnSO4 в смеси), то при 380°С наблюдались критические явления между раствором и паром в присутствии кристаллов (г = ж–тв), сразу после этого возникало небольшое количество очень концентрированного вязкого раствора. При 30% ZnSO4 твердая фаза сразу вся переходила в раствор, а при 40% она растворялась постепенно с ростом температуры, исчезая лишь к 408°С. При 50 и 60% ZnSO4 критические явления не наблюдались из-за слишком малого количества раствора, но к 380–390°С становилось заметным появление концентрированной жидкой фазы, объем которой увеличивался с возрастанием температуры при одновременном уменьшении количества кристаллов.
В процессе охлаждения вновь становилось больше кристаллов, а при 375°С появлялся еще и разбавленный раствор. Однако при 40% ZnSO4, когда было достигнуто полное растворение соли, происходило переохлаждение возникшего концентрированного раствора и появление при 375°С разбавленного раствора в присутствии второй жидкости без твердой фазы, т.е. возникновение равновесия (г–ж1–ж2). И только при 360°С наблюдали кристаллизацию соли, быстрое уменьшение количества концентрированной жидкости и возвращение к равновесию (г–ж–тв), которое имеет место при этой температуре для составов смеси ZnSO4 + H2O от 30 до 65 мас. % ZnSO4.
На основании проведенных наблюдений можно предположить, что в системе ZnSO4–H2O происходит расслаивание насыщенных растворов и, как результат, резкое увеличение растворимости соли при температуре, близкой к критической температуре воды, т.е. возникает инвариантное равновесие (г–ж1–ж2–тв). Указанное равновесие существует при строго определенной температуре, но переход от равновесия (г–ж–тв) к (г–ж1–ж2–тв) не происходит мгновенно. Небольшое увеличение температуры приводит к тому, что еще до расслаивания жидких фаз разбавленный насыщенный раствор достигает критической точки (г = ж–тв) и только после этого отделяется концентрированная жидкая фаза. При нагревании смеси с 30 и 40 мас. % ZnSO это выглядит как “плавление” твердой фазы сразу после критических явлений в насыщенном растворе (г = ж–тв) и возникновение двух растворов разной концентрации и плотности, которые сохраняются при повышении температуры (двухфазное равновесие (г/ж1–ж2) или (фл–ж)).
Если в процессе нагревания критические явления наблюдаются при 380°С, то в процессе охлаждения при этой температуре такие явления не обнаруживаются, но при 375°С происходит образование капли (или капель) легкой жидкости, количество которой быстро увеличивается, а концентрированный раствор исчезает при понижении температуры.
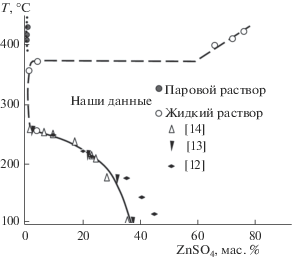
Для определения растворимости ZnSO4 в исследуемой системе проводили анализ проб жидких фаз, отобранных при известной температуре в условиях равновесия с твердой фазой и паром (г–ж–тв), что осуществлялось в специальных “бомбах”-автоклавах [1]. При достижении заданной температуры открывался запорный шток, разделяющий “бомбу” и пробоотборник, и раствор под давлением пара переходил в пробоотборник через фильтр из спрессованной серебряной проволоки, после чего шток закрывался. Состав охлажденных проб устанавливали титрованием Zn2+ раствором трилона Б, результаты приведены в табл. 1 и на рис. 1. Таким образом, определена растворимость ZnSO4 при 250, 310, 355 и 370°С, которая очень мала выше 300°С и слегка возрастает к 370°С.
Таблица 1.
Состав жидких и паровых фаз в системе ZnSO4–H2O
| T, °С | Общее содержание ZnSO4, мас. % | ZnSO4 в жидкой фазе, мас. % | ZnSO4 в паровой фазе, мас. % |
|---|---|---|---|
| 243 | 29.6 | 4.0 | |
| 310 | 30.0 | 1.3 | |
| 355 | 30.0 | 1.6 | |
| 370 | 30.7 | 4.1 | |
| 409 | 30.7 | 0.11 | |
| 415 | 30.7 | 0.12 | |
| 427 | 54.0 | 0.19 |
При более высоких температурах пробы жидких фаз не отбирались в связи с их очень высокой вязкостью и малым количеством, однако были отобраны пробы газовых фаз (при повороте “бомбы” пробоотборником кверху), состав которых также представлен в табл. 1 (0.1–0.2 мас. % при 409–427°С), хотя не установлено, к двух- (г–ж) или трехфазному (г–ж–тв) равновесию они относятся. Тем не менее можно утверждать, что содержание ZnSO4 в газовых фазах, сосуществующих с насыщенными растворами при этих температурах, не превышает найденных значений, так как концентрация газовой фазы в равновесии (г–ж–тв) минимальна при Т = const.
Поскольку исследования, проведенные в кварцевых ампулах и “бомбах”, не позволяют установить состав концентрированных жидких фаз, возникающих после расслаивания растворов (выше 380°С), были поставлены опыты по определению равновесных давлений в системе ZnSO4–H2O при различных температурах и составах. Эту работу осуществляли в автоклаве с ртутным затвором [1], позволяющем изменять объем исследуемой смеси и давление в ней. Давление измеряли образцовым манометром на 60 МПа.
Температуры, при которых проводили работы в автоклаве и “бомбах”, не превышали 444°С, так как было замечено, что воздействие высоких температур приводит к появлению небольшого количества нерастворимого остатка в смесях ZnSO4 + + H2O после опытов. Из литературы известно, что ZnSO4 начинает разлагаться ниже температуры плавления, поэтому расплавы с ним исследованы до 600°С [19]. Возможно, в присутствии воды разложение ZnSO4 усиливается, но не настолько, чтобы существенно изменились фазовые равновесия в системе ZnSO4–H2O. Были поставлены специальные опыты, когда кварцевую пробирку со смесью ZnSO4 + H2O помещали в автоклав и нагревали до 405–408°С при подъеме давления до ~30 МПа. После охлаждения анализ содержимого пробирок показал, что первоначальное количество ZnSO4 практически не менялось, а нерастворимый остаток составлял ~2 мас. % от него и при 31, и при 55 мас. % ZnSO4.
В автоклаве было измерено давление, возникающее в системе ZnSO4–H2O, когда при загрузке оставалось большое паровое пространство (10–11 см3) и при нагревании значительное количество воды переходило в газовую фазу, а жидкий раствор концентрировался. Таким образом, были получены данные по давлению пара для исходных составов 31, 40, 47, 54 и 65 мас. % ZnSO4 в интервале температур 348–444°С при изменении объема пара, что осуществлялось посредством выпуска ртути. При определении давления пара делали поправку на давление воздуха, изначально присутствовавшего в автоклаве, и паров ртути [20]. Давление воздуха было принято равным ~0.2 МПа, так как объем пара существенно не изменялся при нагревании, а возрастание температуры от комнатной до 444°С (от 293 до 717 K) приводило к увеличению давления в ~2 раза.
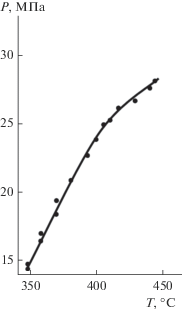
В табл. 2 приведены значения давления пара насыщенных растворов. Эти данные получены, когда давление при Т = const не изменялось при выпуске ртути, т.е. при увеличении количества перешедшей в пар воды сохранялся состав жидкой фазы, что отвечает трехфазному равновесию (г–ж–тв). На рис. 2 показана зависимость этого давления от температуры, представляющая собой непрерывную кривую вплоть до 444°С, что характерно для систем 1-го типа.
Таблица 2.
Давление пара насыщенных растворов в системе ZnSO4–H2O
| T, °С | Общее содержание ZnSO4, мас. % | |||
|---|---|---|---|---|
| 65 | 54 | 39.8 | 30.7 | |
| давление, МПа | ||||
| 348 | 15.7 | 15.0 | ||
| 358 | 16.4 | 16.9 | 16.9 | |
| 370 | 18.3 | 19.3 | 19.3 | 19.3 |
| 381 | 20.8 | |||
| 393 | 22.6 | |||
| 399 | 23.7 | |||
| 405 | 24.8 | |||
| 410 | 25.1 | |||
| 417 | 26.0 | |||
| 429 | 26.5 | |||
| 440 | 27.5 | |||
| 444 | 28.0 | |||
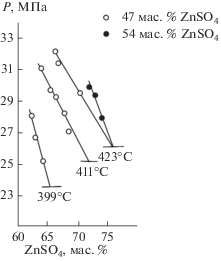
Составы насыщенных растворов при 399, 411 и 423°С оценены приближенно при построении зависимостей давления пара от состава раствора при Т = const. Если раствор ненасыщен, увеличение объема пара, оцениваемого по количеству выпущенной ртути, приводит к снижению давления и увеличению концентрации раствора.
Зная объем пара при известных значениях Т и Р и принимая газовую фазу за чистый водяной пар (ее состав указан в табл. 1), можно определить количество воды, перешедшее в пар [21], и рассчитать концентрацию раствора, если известны состав исходной смеси ZnSO4 + H2O и ее количество. В табл. 3 представлены результаты такого расчета для температур 399, 411 и 423°С при исходных составах 47 и 54 мас. % ZnSO4. На рис. 3 показаны изотермы зависимости давления пара от состава раствора, экстраполированные до давления пара насыщенного раствора. Таким образом, найдены приближенные значения растворимости ZnSO4 при указанных температурах и равновесных давлениях (табл. 3).
Таблица 3.
Расчет состава растворов с учетом перехода воды в пар
| t, °С | Давление, МПа | Объем пара, см3 | H2O в паре, г | ZnSO4 в растворе, мас. % |
|---|---|---|---|---|
| 47.15 мас. % ZnSO4 в 11.45 г смеси ZnSO4 + H2O | ||||
| 399 | 27.9 | 11 | 2.8 | 62.5 |
| 26.6 | 14 | 2.9 | 63 | |
| 25.1 | 17.5 | 3.0 | 64 | |
| 23.5 | 66* | |||
| 47.15 мас. % ZnSO4 в 11.45 г смеси ZnSO4 + H2O | ||||
| 411 | 31.0 | 11 | 3.0 | 64 |
| 29.7 | 14 | 3.2 | 65.5 | |
| 29.2 | 15.4 | 3.4 | 67 | |
| 28.2 | 17.5 | 3.5 | 68 | |
| 27.0 | 20.5 | 3.6 | 68.5 | |
| 25.1 | 72* | |||
| 47.15 мас. % ZnSO4 в 11.45 г смеси ZnSO4 + H2O | ||||
| 423 | 34.6 | 11 | 3.2 | 65.5 |
| 32.1 | 14 | 3.3 | 66.5 | |
| 31.4 | 15.4 | 3.4 | 67 | |
| 29.4 | 20.5 | 3.8 | 70.5 | |
| 26.0 | 75* | |||
| 54 мас. % ZnSO4 в 9.14 г смеси ZnSO4 + H2O | ||||
| 423 | 29.8 | 12 | 2.3 | 72 |
| 29.2 | 13 | 2.4 | 73 | |
| 27.9 | 15 | 2.5 | 74 | |
| 26.0 | 76* | |||
Рис. 3.
Изотермы (399, 411, 423°С) зависимости давления пара растворов ZnSO4 от состава, построенные на основании расчета (табл. 3) для исходных смесей с 47 и 54 мас. % ZnSO4.
На рис. 1 представлена фазовая диаграмма системы ZnSO4–H2O, построенная на основании наших и литературных данных [11–14]. Резкое изменение хода кривой растворимости соли при 250–260°С, вероятно, связано с изменением состава равновесной твердой фазы и переходом кристаллогидрата ZnSO4 · H2O в безводную соль. Согласно данным [14], твердая фаза представляет собой ZnSO4 · H2O при 210оС и ZnSO4 при 244°С, а по данным [13], при 250°С присутствует смесь кристаллов ZnSO4 · H2O и ZnSO4. Около 375°С в рассматриваемой системе имеет место расслаивание насыщенных растворов (возникает инвариантное равновесие г–ж1–ж2–тв), в результате которого растворимость соли резко возрастает и продолжает увеличиваться при дальнейшем повышении температуры. Проследить распространение расслаивания жидкостей в ненасыщенную область не удается, так как обычно применяемый метод получения кривых P–V (зависимость давления от объема при Т = const) [1] не дает четких результатов. Изломы, обнаруживаемые на таких кривых, лишь ориентировочно показывают, что двухфазное равновесие ж1(г)–ж2 существует до достаточно высоких давлений – 80–90 МПа при 380–400°С, что было найдено при использовании манометра на 160 МПа.
ЗАКЛЮЧЕНИЕ
Таким образом, установлено, что система ZnSO4‒H2O относится к 1-му типу водно-солевых систем с инвариантной точкой г–ж1–ж2–тв при температуре, близкой к критической температуре воды, поэтому наблюдаемую критическую точку г = ж–тв следует считать метастабильной.
Высокая растворимость соли и расслаивание растворов в системе ZnSO4–H2O, как и в некоторых других водно-солевых системах, обнаруженные при исследовании в очень тонких капиллярах [15–18], связаны, очевидно, с особенностями межмолекулярных взаимодействий при развитии капиллярных сил, что приводит к существенному изменению набора фазовых равновесий и, возможно, к переходу метастабильных равновесий в стабильные.
Список литературы
Равич М.И. Водно-солевые системы при повышенных температурах и давлениях. М.: Наука, 1974. 151 с.
Валяшко В.М. Фазовые равновесия и свойства гидротермальных систем. М.: Наука, 1990. 270 с.
Buchner E.H. Die heterogenen Gleichgewicte von H.W.B. Roozeboom. Braunschweig, T. 2. H. 2. 226 s.
Ван-дер-Ваальс И.Д., Констамм Ф. Курс термодинамики Ч. 1, 2. М.: ОНТИ, 1963.
Roulinson J.S. Liquids and liquid mixtures. L.: Butterworth, 1969.
Smins A.Z. // Z. Phys. Chem. 1905. V. 51. P. 193.
Pott W., De Loos T.W. // Fluid Phase Equil. 2003. V. 221. P. 165.
Pott W., De Loos T.W. // Ind. Eng., Chem Res. 2008. V. 47. P. 5146.
Валяшко В.М., Кравчук К.Г. // Журн. неорган. химии. 1977. Т. 22. С. 278.
Равич М.И., Валяшко В.М. // Журн. неорган. химии. 1969. Т. 14. С. 1650.
Киргинцев А.Н., Трушникова Л.Н., Лаврентьева В.Г. Растворимость неорганических веществ в воде. Л.: Химия, 1972. 244 с.
Benrath A. // Z. Anorg. Allg. Chem. 1941. B. 247. S. 147.
Jones E.V., Lietzke M.H., Marshall W.L. // J. Am. Chem. Soc. 1957. V. 79. P. 267.
Rundulph W.W., Brooker M.H., Tremaine // J. Solution Chem. 1999. V. 28. P. 621.
Wang X., Chou I.-M., Hu W. et al. // Geochim. Cosmochim. Acta. 2013. V. 103. P. 1.
Wang X., Wang X., Chou I.-M. et al. // Chem. Geology. 2017. V. 451. P. 104.
Wan J., Wang X., Hu W. et al. // Geochim. Cosmochim. Acta. 2017. V. 211. P. 133.
Wang X., Wan Y., Hu W. et al. // Geochim. Cosmochim. Acta. 2016. V. 181. P. 126.
Евсеева Н.М., Бергман А.Г. // Изв. Сектора физ.-хим. анализа ИОНХ РАН. 1959. Т. 21. С. 208.
Бабичев А.П., Бабушкина Н.А., Братковский А.М. и др. Физические величины. Справочник / Под ред. Григорьева И.С., Мейлихова Е.З. М.: Энергоатомиздат, 1991. 1231 с.
Вукалович М.П., Ривкин С.Л., Александров А.А. Таблицы теплофизических свойств воды и водяного пара. М.: Изд-во Стандартов, 1969. 408 с.
Дополнительные материалы отсутствуют.
Инструменты
Журнал неорганической химии