Журнал неорганической химии, 2019, T. 64, № 3, стр. 260-265
Особенности строения мономерных октаэдрических монооксокомплексов d2-рения(V) [ReO(Ln)2(Lмоно)] с атомами кислорода бидентатно-хелатных лигандов О, N (Ln). Часть 1. Комплексы с пятичленными металлоциклами ReNC2O
1 Институт общей и неорганической химии им. Н.С. Курнакова РАН
119991 Москва, Ленинский пр-т, 31, Россия
2 Всероссийский институт научной и технической информации РАН
125190 Москва, ул. Усиевича, 20, Россия
* E-mail: sergienko@igic.ras.ru
Поступила в редакцию 30.11.2017
После доработки 15.08.2018
Принята к публикации 15.07.2018
Аннотация
Рассмотрены особенности строения 14 моноядерных октаэдрических монооксокомплексов d2-Re(V) с однозарядными атомами кислорода бидентатно-хелатных (О, N) лигандов (Ln) – [ReO(Ln)2(Lмоно)] (Lмоно – монодентатный лиганд), содержащих пятичленные металлоциклы ReNC2O. Aтомы O(Ln) находятся в транс-положениях к лигандам О(оксо).
Особенности строения мономерных октаэдрических комплексов (МОК) d 0-, d2-металлов V–VII групп (Nb, V, Mo, W, Re, Tc) с кратносвязанными лигандами О(оксо) подробно изложены в [1–7]. Для d2-Re(V) методом РСА определена кристаллическая структура более пятисот комплексов (см. Кембриджский банк структурных данных (КБСД), вeрсия 5.37, февраль 2017 г. [8]). Большинство из них – МОК ReOоксоО(Lig)транс – с атомами кислорода моно- и полидентатных лигандов в транс-позициях к оксолигандам. Ранее мы опубликовали ряд обзорных статей по МОК d2-Re(V) c атомами галогенидов [9], азота [10], серы и водорода [11], кислорода монодентатных ацидолигандов (гидроксо- [12], алкоксо- (метоксо- [13], этоксо- [14], пропоксо- [15]), ОRn– (n = 1, 2; R = Ph, Cy, C6H4OH, C6H4OMe, P(O)(OMe)2, C(O)(CF3), OCMe(CF3)2, BF3) [16], OERn– (n = 1, 2; Е = Si, B, S; R = Me3, F3, О2CF3) [17]) и бидентатно-хелатных (О, О) [18], (O, S) и (O, C) [19], (О, Р) [20] однозарядных лигандов, а также нейтральных кислородсодержащих лигандов (молекул воды [21], фосфин- и арсиноксидных OER3 (E = P, As; R3 = Ph3, PhEt2) [22], молекул OR' (ДМФ, R"OH (R" = Me, Et, Pr), L (ON4C6 · C6H10, O–(C6H3MeCH2NH+Et2), O–(NH+C5H4)) [23] в транс-позициях к кратносвязанным лигандам О(оксо). Нами опубликованы также обзорные статьи по особенностям строения МОК d 0-Re(VII) [24] и d0-, d2-технеция(V, VII) [25].
Структурное проявление трансвлияния кратносвязанного лиганда O(оксо) – удлинение противолежащей связи Re–Lтранс – определяется параметром ∆ (разность длин одноименных связей (Re–Lтранс) – (Re–Lцис)). Если же в конкретной структуре отсутствуют лиганды одного сорта и в транс-, и в цис-положениях к оксолиганду, мы используем параметр (Re–Lтранс) – (Re–L(СТ), где СТ – среднестатистическое стандартное расстояние Re(V) с атомом лиганда того же сорта, что и Lтранс. В качестве параметра Re–O(СТ) мы приняли (как и в [4]) величину 2.04 Å.
Ранее мы опубликовали две обзорные статьи об особенностях кристаллической структуры [ReO(Ln)(Lмоно)3] (Ln – бидентатно-хелатные кислородсодержащие (О, N), а Lмоно – монодентатные лиганды), содержащей пяти-, шести- и семичленные металлоциклы ReNC2O [26], ReNC3O и ReNC4O [27]. В настоящей статье рассмотрены особенности строения 14 мономерных октаэдрических монооксокомплексов [ReO(Ln)2(Lмоно)], содержащих, за одним исключением, два одинаковых лиганда Ln и один Lмоно. Первые из них в кристаллической структуре комплексов ReO(оксо)3+ по преимуществу выполняют бидентатно-хелатную функцию с ацидоатомом кислорода О(Ln) в транс-позиции к оксолиганду. В трех исключениях – комплексах [ReO(Ln)2(Lмоно)] с пятичленными хелатными циклами ReNC2O – транс-позиции к О(оксо) занимают лиганды Lмоно (Сl–, OMe–). Отметим, что во всем массиве структур с пятичленными хелатными кольцами реализуются два геометрических изомера: одноименные атомы азота и кислорода двух лигандов Ln располагаются либо в транс(N,N), цис(О,О)-, либо в цис(N,N), цис(О,О)-позициях друг к другу (далее транс(N,N)- и цис(N,N)-изомеры, поскольку атомы О(Ln) всегда расположены в цис-положении друг к другу).
Основные длины связей в структурно исследованных 14 комплексах приведены в табл. 1.
Таблица 1.
Основные геометрические параметры (Å) мономерных октаэдрических монооксокомплексов [ReO(Ln)2(Lмоно)] с бидентатно-хелатными (О, N) лигандами (Ln) (n = 1–13), содержащими пятичленные металлоциклы ReNC2O, и с атомами O(Ln) в транс-позициях к О(оксо); Lмоно – монодентатный лиганд
| № соеди-нения | Соединение | Re=O | Re–Lцис | Re–О(Ln)транc | Δ, (∆') | Литература |
|---|---|---|---|---|---|---|
| I | [ReO(L1)2Cl] | 1.693(4) | 1.940(5) O(L1) 2.140(6) ± 0.021 N(L1) 2.396(1) Cl |
1.943(4) | 0.003 | [28] |
| II | [ReO(L2)2(Me)] | 1.662(8) | 2.014(8) O(L2) 2.138(9) ± 0.025 N(L2) 2.11(1)C(Me) |
2.100(7) | 0.086 | [30] |
| III | [ReO(L3) 2Cl] | 1.658(5) | 1.996(5) O(L3)
2.111(6) ± 0.011 N(L3) 2.366(2) Cl |
2.037(6) | 0.041 | [31] |
| IV | [ReO(L4)2Cl] | 1.65(1) | 2.00(1) O(L4)
2.125(2) ± 0.025 N(L4) 2.354(6) Cl |
2.04(1) | 0.04 | [32] |
| V | [ReO(L5)2Cl] · CH2Cl2 | 1.696(3) | 1.933(2) O(L5)
2.136(3) ± 0.026 N(L5) 2.392(1) Cl |
1.966(3) | 0.033 | [33] |
| VI | [ReO(L6)2(Py)]Cl · H2O | 1.675(3) | 1.937(3) O(L6) 2.105(4) ± 0.046 N(L6) 2.153(4) N(Py) | 1.973(3) | 0.034 | [34] |
| VII | [ReO (L7)2Cl] | 1.670 | 2.096 O(L7) 2.108 ± 0.036 N(L7) 2.460 Cl | 2.071 | –0.025 | [35] |
| VIII | [ReO(L8)2(Me)] | 1.677(4) | 1.986(4) O(L8) 2.164(4) ± 0.038 N(L8) 2.111(6) C(Me) | 2.037(4) | 0.051 | [36] |
| VIIIa | [ReO(L8)2(Me)] | 1.658(5) | 2.003(4) O(L8) 2.126(4) ± 0.026 N(L8) 2.128(7) C(Me) | 2.094(4) | 0.091 | [36] |
| IX | [ReO(L9)2Cl] · MeOH | 1.674(3) | 1.974(3) O(L9) 2.117(4) ± 0.009 N(L9) 2.351(1) Cl | 2.039(3) | 0.065 | [37] |
| X | ReO(L9)2(OMe)] | 1.678(3) | 1.988(3) O(L9) 2.130(3) ± 0.007 N(L9) 1.942(3) O(OMe) | 2.065(3) | 0.077 | [37] |
| XI | [ReO(L10)2Br] | 1.660(6) | 1.962(5) O(L10) 2.171(6) ± 0.010 N(L10) 2.4773(10) Br | 2.068(5) | 0.106 | [38] |
| XII | [ReO(L10)2Cl] · MeCN | 1.666(3) | 1.993(2) O(L10) 2.172(3) ± 0.001 N(L10) 2.3345(9) Cl | 2.017(2) | 0.024 | [38] |
| XIII | [ReO(L11)2(PPh3)]Cl | 1.697(4) | 2.043(5) O(L11) 2.063(6) ± 0.048 N(L11) 2.462(2) P | 2.039(6) | –0.004 | [39] |
| XIV | [ReO(L12)(L13)Cl] | 1.69(1) | 1.948(7) O(L12) 2.159(8) ± 0.003 N(L12, L13) 2.360(3) Cl | 2.023(8) O(L13) | 0.075 | [43] |
Условные обозначения лигандов (Ln)– (n = 1–13): L1 = NC5H4CH2O, L2 = NC5H4C(O)O, Ln = NC5H3RC(=O)O (R = H, n = 3, R = OH, n = 4), L5 = NC5H4C(C6H4)2O, L6 = NC6H4N(H)CCH2O, L7 = NC6H4O(H)C(O)C(O), L8 = NC8H6, L9 = = NC9H6C(=O)O, L10 = NC9H4(Me)(COOH)O, L11 = N(H2)CN(CH2)3 COH, L12 = NC5H3(CH2OH)O, L13 = NC9H6O.
Во всех рассмотренных комплексах (как и в содержащих аналогичные пятичленные металлоциклы (МЦ) в соединениях [ReO(Ln)(Lмоно)3] [26, 27]) в однозарядных лигандах (Ln)– пятичленные хелатные кольца Re–N(1)–C(1)–С(2)–O включены по связям N–C (N–C, C–C) в бициклические (трициклические) системы.
I. Комплекс [ReO(L1)2Cl] с бициклами, сочлененными по связям N(1)–C(1)
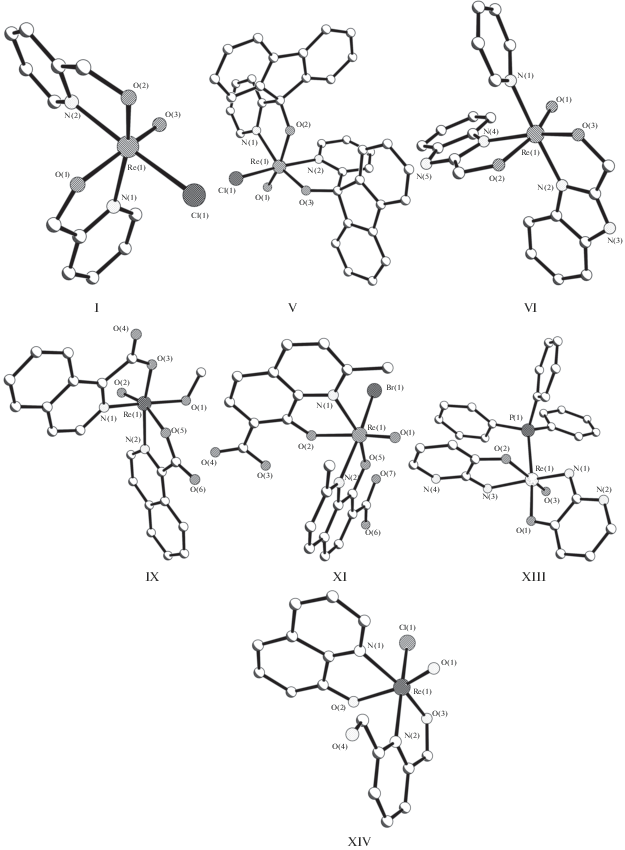
В структуре [ReO(L1)2Cl] (I) [28] (рис. 1) бициклическая система 2-(оксиметил)пиридин С5H4NCH2O (L1) включает пятичленный пиридиновый цикл NC5H4. Атом рения смещен из гофрированной экваториальной плоскости (±0.12 Å) Сl, О, N2 (Пэкв) к оксолиганду (ΔRe = 0.200 Å). Практически плоский (±0.055 Å) металлоцикл МЦ1 почти нормален относительно Пэкв (двугранный угол 3.8°). Второй металлоцикл МЦ2 более гофрирован (±0.144 Å) и составляет с Пэкв двугранный угол 16.2°. Связи Re–N(L1) в структуре I (средн. 2.140 Å) попадают в широкий интервал значений 2.02–2.41 Å (средн. 2.17 Å) для 62 структур (КБСД, 2005 г.) [8]. Связи Re–O(L1) в I (средн. 1.94 Å) сходны с типичными значениями Re–O(фенолят) [29].
II. Комплексы [ReO(Ln)2(Lмоно)] с бициклами, сочлененными по связям N(1)–C(1), и с заместителями при атомах С(2)
Известна кристаллическая структура четырех комплексов указанного в заголовке главы II типа.
Сходное с I строение имеет комплекс [Re(L2)2(Me)] (II) [30]. Лиганд L отличается от L1 наличием заместителя – карбонильного атома кислорода при атоме С(2) (L2 – 2-пиколинат, NС5H4C(O)O). В структуре II следует отметить редкий случай заметного расхождения длины связей Re–N(Ln) c разными транс-партнерами: 2.113(9) и 2.163(9) Å в транс-позициях соответственно к Re–C(Me) и Re–О(L2).
Кристаллы двух комплексов [ReO(Ln)2Cl], содержащих пиколинатный NC5H4C(=O)O (III) [31] (n = 3) и 3-гидроксипиколинатный NC5H3(OH)C(=O)O (IV) [32] (n = 4) лиганды, различаются только наличием во втором из них гидроксизаместителя R в позиции 4 пиридинового цикла. В этих двух соединениях к атомам N(1), С(1) приконденсирован пиридиновый цикл NC5H3R (R = H в III и ОН в IV), к атому С(2) – атом О(карбонил). В комплексах I–IV атомы азота и кислорода двух лигандов Ln располагаются попарно в цис-позициях друг к другу. Такой же геометрический изомер реализуется в комплексной молекуле соединения [ReO(L5)2Cl] · CH2Cl2 (V) [33] (рис. 1 ). Как и в комплексах I–IV, в молекуле V к металлоциклу ReNC2O по связи N(1)–C(1) приконденсирован Ру-цикл. С атомом С(2) пиридилалкоголятного лиганда 9-(2-пиридил)флуорен-9-олато NC5H4C(C6H4)2O связан бициклический заместитель (С6Н4)2. Для комплексной молекулы [ReO(L5)2Cl] cоединения V c типичным расположением атома кислорода одного из лигандов L5 в транс-положении к оксолиганду есть другой геометрический изомер с хлоролигандом в транс-позиции к О(оксо) [32]. В структуре V, как и в II, можно отметить существенную разницу длины связей Re–N(Ln): 2.110(3) и 2.161(3) Å в транс-позициях соответственно к Re–Cl и Re–О(L5).
III. Комплексы [ReO(Ln)2(Lмоно)] с трициклами, сочлененными по связям N(1)–С(1) и С–С
В структурах [ReO(L6)2(Py)]Cl · H2O (VI) (рис. 1 ) [34], [ReO(L7)2Cl] (VII) [35] и [ReO(L8)(Me)] (два независимых исследования: (VIII) [29] и (VIIIa) [36]) в лигандах Ln – моноанионах 1Н-(бензимидазол-2-ил)метанолато) (n = 6) NC6H4N(Н)СCH2О, 1Н-бензимидазол-2-карбоновой кислоты (n = 7) NC6H4O(Н)С(О)СО и 8-гидроксихинолина (n = 8) NC8H6 – металлоциклы ReNC2O сочленены по связям N(1)–С(1), C(1)–C(2) с бензимидазольными бициклами. В структуре VIII, как и в I–IV, реализуется цис(N,N)-, а в VI и VII, наоборот, транс(N,N)-изомер. Структурные единицы кристалла VI – комплексные катионы [ReO(L5)2(Py)]+, анионы хлора и кристаллизационные молекулы воды – объединены разветвленной сеткой водородных связей (ВС) N–H…Cl, N–H…O, O–H…Cl, C–H…O в 2D-слои (H…Cl 2.25 и 2.61, Н…О 2.10–2.58, N…Cl 3.104, N…O 2.911, O…Cl 2.951, C…O 2.885–3.473 Å, углы NHCl 170°, NHO 158°, OHCl 109°, OHO 111°–154°). Отмечается низкая точность рентгеновского эксперимента структуры VII. Координаты атомов структур VII, VIII не включены в КБСД.
IV. Комплексы [ReO(Ln)2(Lмоно)] c трициклами, сочлененными по связям N(1)–С(1), С–С, и с заместителями О(карбонил) при атомах C(2)
В кристаллах [ReO(L9)Cl] · МеОН (IX) [36] (рис. 1 ) и [ReO(L9)(ОМе)] (X) [37] комплексные молекулы различаются только монодентатным лигандом: Cl в IX и ОМе в X. Трициклические системы в изохинолин-2-карбоксилатных лигандах L9 (NC9H6C(=O)O) образованы сочленением пятичленных металлоциклов по связям N(1)–C(1) c бициклами NC9H3. Два изохинолинкарбоксилатных лиганда L9 (NC9H6) cодержат трициклическую систему, в которой металлоцикл ReNC2O cоединен по связи N(1)–C(1) c бициклом NC9H6. В обеих структурах реализуется транс(N,N)-изомер. Авторы [37] отмечают необычность расположения метоксолиганда в структуре X в цис-, а не в транс-позиции (как обычно) к кратносвязанному оксолиганду.
V. Комплексы [ReO(Ln2)(Lмоно)] с трициклическими лигандами Ln; циклы cочленены по связям N(1)–C(1) и С(1)–C(2)
Известна кристаллическая структура двух комплексов [ReO(L10)2(Hal)] [38], где Hal = Br (XI) (рис. 1 ) и Cl (XII, сольват 1 : 1 с MeCN). В трициклическом лиганде L10 – моноанионе 8-гидрокси-2-метилхинолин-7-карбоновой кислоты – хелатный цикл ReNC2O сочленен по связям N(1)–C(1), C(1)–C(2) с бициклическим замещенным 8-гидрокси-2-метилхинолинатным лигандом NC9H4(Ме)(СООН)O. В обеих структурах имеет место цис(N,N)-изомер. В структуре XI, XII параметр ΔRe равен соответственно 0.324, 0.292 Å. Структура обоих комплексов стабилизирована сеткой меж- и внутримолекулярных ВС О–Н…О (в XI O…O 2.569 и 2.629 Å, углы ОНО 143° и 160°; в XII O…O 2.552 и 2.629 Å, углы ОНО 153° и 173°) и С–Н…О (в XI, X C…O 2.729–3.391 Å, углы СНО 100°–171°).
VI. Комплекс [ReO(L11)2(PPh3)]Cl с бициклами, сочлененными по связям C(1)–C(2)
В структуре [Re(L11)(PPh3)]Cl (XIII) [39] (рис. 1 ) (HL11 – 2-амино-3-гидроксипиридин N(H2)CN(CH2)3COH) бицикл, oбразованный металлоциклом ReNC3O по связи С(1)–С(2), включает пиридиновое кольцо. Параметр ΔRe = = 0.252 Å. Одна из неравноценных по длине связей Re–N(L11) в структуре XIII (2.015 и 2.110 Å) выходит за нижнюю границу интервала расстояний Re–N(H2) 2.10–2.22 Å [40, 41 ] . Обе связи Re–O(L11), транс и цис (2.039 и 2.043 Å), типичны для расстояний Re–O(фенолят) 2.015–2.097 Å [42]. В данной структуре реализуется транc(N,N)-изомер. Двугранный угол между плоскостями Ру-циклов равен 88.42°.
VII. Комплекс [Re(L12)(L13)Cl] с двумя бидентатно-хелатными (N, O) лигандами разного состава
В единственном комплексе [Re(L12)(L13)Cl] (XIV) [43] (рис. 1 ) два лиганда, содержащих пятичленные металлоциклы ReNC2O, имеют разный состав. Бициклический лиганд L12 – 2-(оксиметилен-6-гидроксиметил)пиридин NC5H3(CH2OH)О – образован сочленением металлоцикла ReNC2O и оксиметилензамещенного пиридинового кольца по связи N(1)–C(1), трициклический 8-оксихинолиновый лиганд L13 – NC9H6О –формированием связей N(1)–C(1), C(1)–C(2) металлоцикла и бицикла NC9H6. Параметр ΔRe = 0.23 Å. В данной структуре реализуется цис(N, N)-изомер. Транс-позицию к оксолиганду занимает атом О(2) лиганда L13. Двугранный угол между плоскостями квазиортoгональных металлоциклов лигандов L12, L13 составляет 81.0°.
Список литературы
Порай-Кошиц М.А., Гилинская Э.А. Кристаллохимия. М.: ВИНИТИ, Итоги науки и техники. 1966. С. 126.
Порай-Кошиц М.А., Атовмян Л.О. // Коорд. химия. 1975. Т. 1. С. 1271.
Griffith F., Wicing C. // J. Chem. Soc. A. 1968. P. 379.
Порай-Кошиц М.А. // Изв. Югосл. кристаллогр. центра. 1974. Т. 9. С. 19.
Порай-Кошиц М.А., Атовмян Л.О. Кристаллохимия коорд. соед. молибдена. М.: Наука, 1974. 231 с.
Shustorovich E.M., Porai-Koshits M.A., Buslaev Yu.A. // Coord. Chem. Rev. 1975. V. 17. P. 1.
Порай-Кошиц М.А., Сергиенко В.С. // Успехи химии. 1990. Т. 59. С. 86.
Allen F.H. // Acta Crystallogr. 2002. V. 58B. P. 380.
Сергиенко В.С., Чураков А.В. // Кристаллография. 2014. Т. 59. С. 685.
Сергиенко В.С., Чураков А.В. // Кристаллография. 2015. Т. 60. С. 365.
Сергиенко В.С. // Журн. неорган. химии. 2014. Т. 59. № 4. С. 457.
Сергиенко В.С. // Журн. неорган. химии. 2014. Т. 59. № 10. С. 1338.
Sergienko V.S., Churakov A.V. // Russ. J. Inorg. Chem. 2014. V. 59. № 13. P. 1683.
Sergienko V.S., Churakov A.V. // Russ. J. Inorg. Chem. 2014. V. 59. № 14. P. 1715.
Сергиенко В.С. // Журн. неорган. химии. 2015. Т. 60. № 3. С. 333.
Сергиенко В.С. // Журн. неорган. химии. 2015. Т. 60. № 6. С. 758.
Сергиенко В.С. // Журн. неорган. химии. 2016. Т. 61. № 11. С. 1461.
Sergienko V.S., Churakov A.V. // Russ. J. Inorg. Chem. 2016. V. 61. № 14. P. 1708.
Сергиенко В.С. // Журн. неорган. химии. 2017. Т. 62. № 6. С. 766.
Сергиенко В.С., Чураков А.В. // Журн. неорган. химии. 2017. № 10. Т. 62. С. 1043.
Сергиенко В.С. // Журн. неорган. химии. 2014. Т. 59. № 7. С. 957.
Sergienko V.S. // Russ. J. Inorg. Chem. 2015. V. 60. № 14. P. 1723.
Сергиенко В.С., Чураков А.В. // Журн. неорган. химии. 2016. Т. 61. № 7.С. 873.
Сергиенко В.С., Чураков А.В. // Кристаллография. 2014. Т. 59. С. 341.
Сергиенко В.С., Чураков А.В. // Кристаллография. 2013. Т. 58. С. 3.
Сергиенко В.С., Чураков А.В. // Журн. неорган. химии. 2018. Т. 63. № 3. С. 401.
Сергиенко В.С., Чураков А.В. // Журн. неорган. химии. 2018. Т. 63. № 6. С. 718.
Gerber T.I.A., Luzipo G., Mayer P. // J. Chem. Cryst. 2005. V. 35. P. 39.
Gerber T.I.A., Perils J., Bandoli J. et al. // J. Coord. Chem. 1996. V. 39. P. 290.
Shan X., Ellern J. // Inorg. Chem. 2002. V. 41. P. 7136.
Chattopadhyay S., Fanwick P.E., Walton R.A. // Inorg. Chem. Commun. 2003. V. 6. P. 1358.
Gatto S., Gerber I.A., Bandoli G. et al. // Inorg. Chim. Acta. 1998. V. 269. P. 235.
Lobmaier G.M., Frey G.D., Dewhurst R.D. et al. // Organomet. 2007. V. 26. P. 6290.
Machura B., Wolff M., Pencala M. // Polyhedron. 2012. V. 44. P. 156.
Machura B., Kruszzynski R. // Polyhedron. 2007. V. 26. P. 3686.
Delofire A., Halut S., Salles L. et al. // J. Chem. Soc., Dalton Trans. 1999. P. 2897.
Machura B., Wolff M., Benoist E. et al. // Dalton Trans. 2013. V. 42. P. 8827.
Machura B., Kusz J., Tabak D., Kruszynski R. // Polyhedron. 2009. V. 28. P. 493.
Gerber T.I.A., Luzipo D., Mayer P. // J. Coord. Chem. 2004. V. 57. P. 1419.
Bandoli G., Dolmella A., Gerber T.I.A. et al // J. Coord. Chem. 2000. V. 55. P. 823.
Melian C., Dolmella A., Gerber T.I.A. et al. // Inorg. Chim. Acta. 2000. V. 306. P. 70.
Chen X., Femia F.J., Babich J.W., Zubieta J. // Inorg. Chim. Acta. 2000. V. 308. P. 80.
Bandoli G., Gatto S., Gerber T.I.A. et al. // J. Coord. Chem. 1996. V. 39. P. 299.
Дополнительные материалы отсутствуют.
Инструменты
Журнал неорганической химии