Журнал неорганической химии, 2019, T. 64, № 2, стр. 137-145
Золь-гель синтез и формирование структур марганец-цирконий(титан) фосфатов
В. И. Петьков 1, *, Д. А. Лавренов 1, М. В. Суханов 1, А. М. Ковальский 2, Е. Ю. Боровикова 3
1 Национальный исследовательский Нижегородский государственный университет им. Н.И. Лобачевского
603950 Нижний, Новгород, пр-т Гагарина, 23, Россия
2 Национальный исследовательский технологический университет ”МИСиС
119049 Москва, Ленинский пр-т, 4, Россия
3 Московский государственный университет им. М.В. Ломоносова
119991 Москва, Ленинские горы, 1, Россия
* E-mail: petkov@inbox.ru
Поступила в редакцию 20.03.2018
После доработки 06.07.2018
Принята к публикации 23.04.2018
Аннотация
Соединения Mn0.5Ti2(PO4)3 и Mn0.5Zr2(PO4)3 и твердый раствор Mn0.5 + 2хZr2 −x(PO4)3 (0 < х ≤ 0.35) получены двумя вариантами золь-гель метода – с использованием неорганических и органических реагентов – и исследованы с применением рентгенографии и ИК-спектроскопии. Соединение Mn0.5Ti2(PO4)3 со структурой типа NaZr2(PO4)3 (NZP) образуется при 600°С, устойчиво до 950°C. Mn0.5Zr2(PO4)3 обладает диморфизмом: низкотемпературная модификация со структурой Sc2(WO4)3 (SW) получена при 650°С, высокотемпературная NZP-модификация – при 1200°С. Твердый раствор Mn0.5 + 2хZr2 −x(PO4)3 кристаллизуется в структурном типе SW, термически неустойчив при температуре выше 900°С, с ростом x термостойкость образцов уменьшается. Число полос валентных и деформационных колебаний иона ${\text{PO}}_{{\text{4}}}^{{{\text{3}} - }}$ в ИК-спектрах ортофосфатов NZP- и SW-строения находится в согласии с фактор-групповым анализом для пр. гр. R3 и P21/n. Уточнены структуры низкотемпературной модификации Mn0.5Zr2(PO4)3 (пр. гр. P21/n, a = 8.861(3), b = 8.869(2), c = = 12.561(3) Å, β = 89.51(2)°) и твердого раствора. Основой структур являются каркасы из соединяющихся вершинами тетраэдров PO4 и октаэдров ZrO6 или (MnxZr2 −x)O6. В полостях каркасов располагаются катионы Mn2+, имеющие тетраэдрическую кислородную координацию. Сравнительный кристаллохимический анализ морфотропного ряда фосфатов M0.5Zr2(PO4)3 (M – металл в степени окисления +2) позволил выявить взаимосвязь структурных особенностей.
ВВЕДЕНИЕ
Фосфаты формульного состава M0.5E2(PO4)3 (M – металл в степени окисления +2, E = Ti, Zr) принадлежат к структурным типам NaZr2(PO4)3 (NZP, NASICON) и Sc2(WO4)3 (SW) [1, 2]. Основу обеих структур составляет каркас {[E2(PO4)3]p−}3∞, образованный колонками из октаэдро-тетраэдрических фрагментов EO6 и PO4. В обеих структурах в полостях размещаются катионы элементов в степени окисления +2. Широкий изоморфизм катионов в полостях каркасов структурных типов NZP и SW, а также возможности изоморфных замещений в октаэдрах и тетраэдрах, формирующих каркас, определяют обширность поля кристаллизации соединений M0.5E2(PO4)3 и твердых растворов на их основе.
Фосфаты M0.5Ti2(PO4)3 с каркасом, построенным на титане (который характеризуется меньшим размером по сравнению с цирконием), кристаллизуются в структуре NZP (табл. 1). Фосфаты M0.5Zr2(PO4)3 с крупными ионами M2+ (Cd, Pb, Sr, Ba) кристаллизуются в структурном типе NZP, с меньшим размером ионов M2+ − в SW-типе структуры. Mn0.5Zr2(PO4)3 обладает диморфизмом и существует в виде модификаций SW и NZP. Температура перехода от моноклинной к тригональной модификации, по данным разных авторов [16, 29], существенно различается (900−1400°С). Структура низкотемпературной формы Mn0.5Zr2(PO4)3 не расшифрована.
Вещества M0.5E2(PO4)3 обладают высокой химической, термической и радиационной устойчивостью, низким тепловым расширением [4, 15, 26, 30, 31] и могут быть получены методами твердофазной химии, путем осаждения из водных растворов (золь-гель, гидротермальный синтез). Введение 3d-ионов в состав таких фосфатов, в частности Mn, позволило получить перспективные люминофоры, катализаторы дегидрирования и дегидратации спиртов, изомеризации алканов и их селективного окисления [7, 18, 31–35].
Цель настоящей работы – синтез фосфатов Mn0.5 + 2xE2 −x(PO4)3 (E = Ti, Zr), изучение фазообразования, уточнение структуры, выявление полей концентрационно-температурной стабильности твердых растворов.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Образцы Mn0.5 + 2xE2 −x(PO4)3 (E = Ti, Zr) c x = = 0, 0.10, 0.25, 0.35, 0.50, 0.60, 0.75, 1.0 получали золь-гель методом с последующей термообработкой. Исходными реагентами для синтеза служили реактивы квалификации “х. ч.”: Mn(CH3COO)2 · 4H2O, TiOCl2 (получен из TiCl3 путем окисления его на воздухе смесью соляной и азотной кислот), ZrOCl2 · 8H2O и H3PO4. Стехиометрические количества 1 М водных растворов ацетата марганца и оксихлорида титана или циркония сливали при постоянном перемешивании при комнатной температуре. Затем при перемешивании добавляли раствор ортофосфорной кислоты, взятый также в соответствии со стехиометрией. Реакционные смеси высушивали при 90°C и подвергали термообработке на воздухе при 600–1100°C в течение 24 ч на каждой стадии. Поэтапное нагревание чередовали с диспергированием для обеспечения гомогенизации смесей. Также для получения фосфатов использовали другой вариант золь-гель процесса – цитратный метод Печини. В качестве органических реагентов использовали лимонную кислоту (моногидрат, х. ч.) и этиленгликоль (ч. д. а), которые для образования устойчивых хелатных комплексов брали в избытке. К раствору лимонной кислоты добавляли растворы солей марганца и циркония (титана), затем раствор дигидрофосфата аммония и этиленгликоль. Образцы высушивали, диспергировали и подвергали ступенчатому отжигу при температурах 90, 130, 350, 600−950°С. Метод Печини обеспечивал мелкодисперсное однородное распределение ионов в составе полимерного геля и позволял понижать температуру получения однофазных продуктов по сравнению с золь-гель процессом без органических реагентов. Синтезированные образцы представляли собой поликристаллические порошки белого цвета.
Рентгенограммы образцов записывали на дифрактометре Shimadzu XRD-6000 (CuKα-излучение, λ = 1.54178 Å, 2θ = 10°–60°). Рентгенофазовый анализ (РФА) использовали для установления фазового состава образцов в процессе их получения после каждого этапа изотермического обжига и контроля их фазового состава. Индицирование рентгенограмм проводили методом структурной аналогии с использованием кристаллографических данных описанных в литературе соединений. Параметры элементарных ячеек полученных фосфатов уточняли методом наименьших квадратов.
Контроль химического состава и однородности фосфатов проводили на сканирующем электронном микроскопе JEOL JSM-7600F с термополевой электронной пушкой (катод Шоттки). Микроскоп оснащен системой микроанализа – энергодисперсионным спектрометром OXFORD X-Max 80 (Premium) с полупроводниковым кремнийдрейфовым детектором. Погрешность при определении элементного состава образцов составляла не более 2 ат. %.
Рентгенодифракционные спектры Mn0.5 Zr2(PO4)3 (x = 0) и MnZr1.75(PO4)3 (x = 0.25) для структурных исследований записывали в интервале углов 2θ = 10°–110° с шагом сканирования 0.02° и экспозицией в точке 16 с. Обработку рентгенограмм и уточнение структур фосфатов проводили методом Ритвельда [36] с использованием программы RIETAN-97 [37]. Аппроксимирование профилей пиков осуществляли согласно модифицированной функции псевдо-Войта (Mod-TCH pV [38]). В качестве модели для уточнения структуры фосфатов использовали координаты атомов LiZr2(AsO4)3 [39].
Функциональный состав образцов подтверждали ИК-спектроскопическими исследованиями. ИК-спектры поглощения были записаны на ИК-Фурье-спектрометре Shimadzu FTIR-8400S в диапазоне волновых чисел 400–1400 см–1.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
При изучении процессов фазообразования в Mn0.5 + 2хE2 –xP3O12 (E = Ti, Zr) образцы в процессе синтеза подвергали изотермическому обжигу при 600, 700, 800 и 900°C. Время выдержки при каждой температуре составляло 24 ч. В конце каждой стадии обжига часть образцов подвергали быстрой воздушной закалке и анализировали, оставшуюся часть продолжали нагревать.
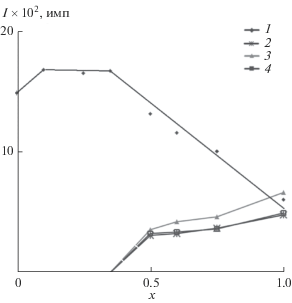
Детальное изучение фазообразования в Mn0.5 + 2хTi2 – xP3O12 показало, что двойной фосфат Mn0.5Ti2(PO4)3 (x = 0), по данным РФА, образуется при 600°С, кристаллизуется в ромбоэдрической системе (пр. гр. R3, a = 8.513(1), c = 21.008(1) Å, V = 1318.5(4) Å3, Z = 6), принадлежит к структурному типу NZP, устойчив до 950°C. Структура Mn0.5Ti2(PO4)3 определена рентгеноструктурным анализом монокристаллов, синтезированных гидротермальным методом [9]. Твердый раствор Mn0.5 + 2хTi2 – x(PO4)3 не образуется из-за значительных различий ионных радиусов Ti4+ (0.61 Å) и Mn2+ (0.83 Å). Результаты РФА синтезированных образцов Mn0.5 + 2хZr2 − xP3O12 свидетельствуют, что их фазовый состав существенно зависит от способа синтеза, термической обработки и содержания марганца в составе фосфата. Цитратный метод Печини позволил понизить температуру получения однофазных продуктов по сравнению с золь-гель процессом без органических реагентов. На рис. 1 в качестве примера представлена зависимость интенсивности максимальных рефлексов отражения фаз для образцов Mn0.5 + 2хZr2 −xP3O12, полученных методом Печини, при температуре 650°C. В области значений x 0−0.35 реализуются условия образования твердого раствора Mn0.5 + 2хZr2 −x(PO4)3 со структурой SW. При значениях 0.5 ≤ х ≤ 1 образцы представляли собой смеси фаз (рис. 1).
Рис. 1.
Зависимость интенсивности максимальных рефлексов отражения фаз в образцах Mn0.5 + 2хZr2 −xP3O12 от x (температура синтеза 650°C). Обозначения фаз: 1 – Mn0.5 + 2xZr2 –x(PO4)3 (0 ≤ x ≤ 0.35, 2θ ≈ 20°), 2 – ZrP2O7 (2θ = 21.5°), 3 – ZrO2 (2θ = 27.5°), 4 – Mn2P2O7 (2θ = 30.2°).
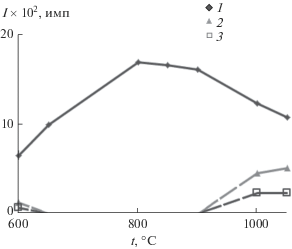
Влияние температуры на формирование ожидаемого твердого раствора на примере фазы состава Mn0.5Zr2P3O12 (x = 0) представлено на рис. 2 (время выдержки при заданных нами температурах составляло 24 ч). При 600°С рентгенофазовым анализом фиксируется смесь фаз: целевого продукта, оксида ZrO2 и пирофосфата Mn2P2O7. Однофазный Mn0.5Zr2(PO4)3 образуется при 650°C. С повышением температуры кристалличность целевой фазы возрастает и при 800−850°С достигает своего максимального значения. Выше 900°C протекает температурно-индуцированный фазовый переход моноклинного фосфата марганца-циркония в ромбоэдрическую модификацию, сопровождаемый частичным разложением целевого продукта. Повышение температуры до 1200°C и длительная термообработка образца при этой температуре позволили получить Mn0.5Zr2(PO4)3 со структурой NZP (пр. гр. R3, a = 8.85(1) Å, c = = 21.80(5) Å, V = 1478(4) Å3, Z = 6). Структура высокотемпературной модификации Mn0.5Zr2(PO4)3 уточнена методом Ритвельда в работе [18].
Рис. 2.
Зависимость интенсивности максимальных рефлексов отражения фаз (1 – Mn0.5 + 2xZr2 –x(PO4)3 (0 ≤ x ≤ 0.35, 2θ ≈ 20°), 2 – ZrO2 (2θ = 27.5°), 3 – Mn2P2O7 (2θ = 30.2°)), образующихся при синтезе фосфата Mn0.5Zr2(PO4)3, от температуры.
По данным электронной микроскопии, образцы полученных индивидуальных фосфатов и твердого раствора гомогенны, химический состав, по данным микрозондового анализа, соответствует теоретическим значениям. На рис. 3 в качестве примера приведена микрофотография фосфата Mn1.0Zr1.75(PO4)3 (Mn0.5 + 2хZr2 − x(PO4)3, x = 0.25). Полученное изображение структуры позволяет сделать вывод, что размеры зерен разные и колеблются от 10 до 100 мкм. Данные микрозондового анализа показали однородность состава зерен, химический состав отвечает формуле Mn1.00(2)Zr1.75(3)P3.0(1)O12.
Рентгенограммы образцов твердого раствора Mn0.5 + 2хZr2 −x(PO4)3 (0 ≤ x ≤ 0.35), кристаллизующегося в структурном типе SW, обнаруживают плавное смещение дифракционных максимумов при постепенном изменении их относительных интенсивностей с ростом х (рис. 4). Зависимости параметров а, b, с, β элементарной ячейки твердого раствора Mn0.5 + 2хZr2 −x(PO4)3 от состава х описываются уравнениями: a = 8.859 – 0.04x (±0.003 Å), b = = 8.959 + 0.0531x (±0.006 Å), c = 12.526 + 0.0366x (±0.005 Å), β = 89.79 – 0.0405x (±0.05°). Кристаллохимическая формула твердого раствора, в которой различные кристаллографические позиции заняты катионами марганца, с большой вероятностью будет следующей: Mn0.5 + x[MnxZr2 − x(PO4)3]3∞, где [MnxZr2 −x(PO4)3]3∞ − каркас структуры, в котором Mn и Zr заселяют позиции с КЧ = 6, а Mn0.5 +x – частично занятые Mn (КЧ = 4) внекаркасные позиции. Твердый раствор термически неустойчив при температуре выше 900°С, с ростом x термостойкость образцов уменьшается.
ИК-спектры индивидуальных фосфатов и твердого раствора имеют вид, типичный для ортофосфатов NZP- и SW-строения с пр. гр. R3 и P21/n соответственно (рис. 5). Из-за различной степени искажения PO4-тетраэдров в структурах таких фосфатов ИК-области колебательных спектров различаются по числу и типу полос в валентной и деформационной областях.
Рис. 5.
ИК-спектры фосфатов, кристаллизующихся в структурном типе NZP: Mn0.5Ti2(PO4)3 (1), Mn0.5Zr2(PO4)3 (2) и SW: Mn0.5 + 2xZr2 –x(PO4)3: x = 0 (3), 0.25 (4).
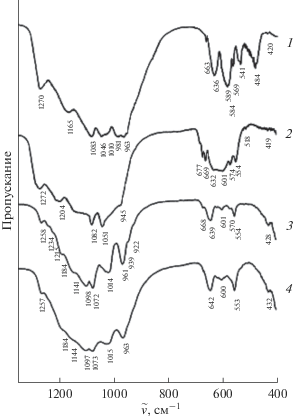
В ИК-спектрах ромбоэдрических фосфатов (пр. гр. R3) правилами отбора разрешено по шесть полос валентных асимметричных ν3 и деформационных асимметричных ν4 колебаний, две полосы валентных симметричных ν1 и четыре полосы деформационных симметричных ν2 колебаний. В ИК-спектрах соединений Mn0.5E2(PO4)3 (E = Ti, Zr) (рис. 5, спектры 1 и 2) в области колебаний ν3 реализуются 4−5 разрешенных правилами отбора полос. Валентные симметричные ν1 колебания представлены двумя полосами в области 990−940 см−1. Из возможных шести полос ν4 в спектрах наблюдаются все 6. Колебания ν2, фиксируемые прибором, представлены двумя полосами.
В ИК-спектрах твердого раствора Mn0.5 + 2хZr2 −x(PO4)3 (рис. 5, спектры 3 и 4) правилами отбора разрешено по 9 полос асимметричных валентных ν3 и асимметричных деформационных ν4 колебаний связи Р−О в анионе ${\text{PO}}_{{\text{4}}}^{{{\text{3}} - }},$ три полосы симметричных валентных ν1 и шесть полос симметричных деформационных ν2 колебаний этого иона. Полосы в области 1260−1010 см–1 отнесены к валентным асимметричным колебаниям ν3 иона PO4. Большие значения волновых чисел 1258−1215 см–1 объясняются тем, что при большом значении угла POE (E = Ti, Zr) в структурах электронная плотность поляризованного иона E4+, имеющего малый размер и большой заряд, частично локализуется на связи P−O, что приводит к более высоким значениям силовых постоянных этой связи. К валентным симметричным ν1 колебаниям отнесены полосы в области 970−920 см–1. Полосы в области 670−550 см–1 соответствуют асимметричным деформационным колебаниям ν4 связи Р−О, а полосы при ~430 см–1 − симметричным деформационным колебаниям ν2 связи Р−О в анионе PO4.
Для подтверждения строения изученных в работе фосфата Mn0.5Zr2(PO4)3 и твердого раствора Mn0.5 +xMnxZr2 − x(PO4)3 с x = 0.25 проведено уточнение их структур при комнатной температуре методом Ритвельда. Условия съемки, параметры ячейки и основные данные по уточнению структуры приведены в табл. 2. На рис. 6 показаны экспериментальная, вычисленная, штрих- и разностная рентгенограммы Mn1.0Zr1.75(PO4)3 (≡Mn0.75Mn0.25Zr1.75(PO4)3). Координаты, параметры атомных смещений и заселенности базисных атомов фосфатов приведены в табл. 3.
Таблица 2.
Условия съемки, параметры ячейки и основные данные по уточнению структуры фосфатов Mn0.5Zr2(PO4)3 и Mn1.0Zr1.75(PO4)3
| Характеристика | Mn0.5Zr2(PO4)3 | Mn1.0.Zr1.75(PO4)3 |
|---|---|---|
| Пр. гр., Z | P21/n, 4 | P21/n, 4 |
| a, Å | 8.861(3) | 8.837(4) |
| b, Å | 8.869(2) | 8.880(2) |
| c, Å | 12.561(3) | 12.595(3) |
| β, град | 89.51(2) | 90.44(3) |
| V, Å3 | 987.1(5) | 988.4(5) |
| ρрентг, г/см3 | 3.330(1) | 3.357(1) |
| Интервал углов 2θ, град | 10.00–110.00 | 10.00–90.00 |
| Шаг сканирования | 0.02 | 0.02 |
| Число рефлексов отражения | 1232 | 803 |
| Число уточняемых параметров: структурные другие |
59 19 |
60 19 |
| Факторы достоверности, %: | ||
| Rwp | 9.14 | 6.66 |
| RP | 6.68 | 4.36 |
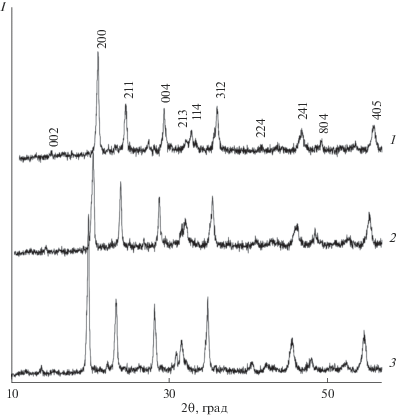
Рис. 6.
Экспериментальная (1), вычисленная (2), разностная (3) и штрих-рентгенограммы (4) фосфата Mn1.0Zr1.75(PO4)3.
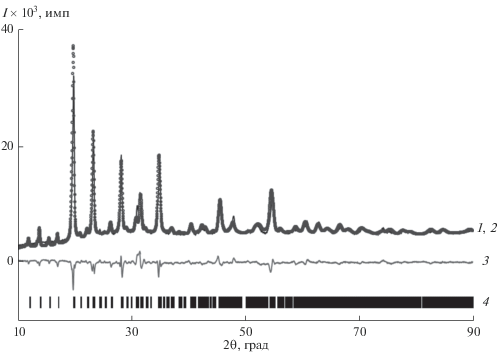
Таблица 3.
Координаты, параметры атомных смещений и заселенности (q) базисных атомов в структуре фосфата Mn0.5Zr2(PO4)3 (I) и Mn1.0Zr1.75(PO4)3 (≡Mn0.75Mn0.25Zr1.75(PO4)3) (II)
| Фосфат | Атом | x | y | z | Bизо | q |
|---|---|---|---|---|---|---|
| I II |
Mn Mn(1) Mn(2) Mn(3) |
0.398(6) 0.364(4) 0.766(2) 0.736(3) |
0.072(5) 0.164(4) 0.487(1) 0.002(2) |
0.335(3) 0.349(3) 0.598(1) 0.385(1) |
0.69(6) | 0.5 0.75 0.125 0.125 |
| I II |
Zr(1) | 0.723(2) 0.766(2) |
0.494(1) 0.487(1) |
0.601(1) 0.598(1) |
0.69(6) | 1.0 0.875 |
| I II |
Zr(2) | 0.760(2) 0.736(3) |
0.006(1) 0.002(2) |
0.387(1) 0.385(1) |
0.69(6) | 1.0 0.875 |
| I II |
P(1) | 0.606(5) 0.608(6) |
0.106(5) 0.106(5) |
0.646(3) 0.645(3) |
0.69(6) | 1.0 |
| I II |
P(2) | 0.629(5) 0.598(5) |
0.382(5) 0.376(5) |
0.360(3) 0.347(4) |
0.69(6) | 1.0 |
| I II |
P(3) | 0.033(5) 0.021(5) |
0.252(6) 0.251(6) |
0.489(4) 0.490(4) |
0.69(6) | 1.0 |
| I II |
O(1) | 0.648(3) 0.645(3) |
0.432(2) 0.432(2) |
0.480(2) 0.479(2) |
0.69(6) | 1.0 |
| I II |
O(2) | 0.683(2) 0.686(2) |
0.251(2) 0.254(2) |
0.681(2) 0.684(2) |
0.69(6) | 1.0 |
| I II |
O(3) | 0.936(2) 0.939(2) |
0.395(2) 0.391(2) |
0.562(1) 0.565(1) |
0.69(6) | 1.0 |
| I II |
O(4) | 0.568(3) 0.569(3) |
0.609(3) 0.612(3) |
0.671(2) 0.675(2) | 0.69(6) | 1.0 |
| I II |
O(5) | 0.831(2) 0.832(2) |
0.479(2) 0.480(2) |
0.777(1) 0.773(1) |
0.69(6) | 1.0 |
| I II |
O(6) | 0.837(3) 0.836(3) |
0.665(2) 0.664(2) |
0.578(2) 0.579(2) |
0.69(6) | 1.0 |
| I II |
O(7) | 0.687(2) 0.688(2) | 0.023(2) 0.025(2) |
0.536(2) 0.532(2) |
0.69(6) | 1.0 |
| I II |
O(8) | 0.660(2) 0.657(2) |
0.202(2) 0.204(2) |
0.317(2) 0.315(2) |
0.69(6) | 1.0 |
| I II |
O(9) | 0.907(3) 0.908(3) |
0.181(2) 0.887(3) |
0.401(2) 0.406(2) |
0.69(6) | 1.0 |
| I II |
O(10) | 0.571(3) 0.574(3) |
0.882(3) 0.887(3) |
0.359(2) 0.356(2) |
0.69(6) | 1.0 |
| I II |
O(11) | 0.790(2) 0.788(2) |
–0.027(2) –0.028(2) |
0.214(2) 0.214(2) |
0.69(6) | 1.0 |
| I II |
O(12) | 0.895(2) 0.895(2) |
0.852(2) 0.851(2) | 0.416(2) 0.416(2) |
0.69(6) | 1.0 |
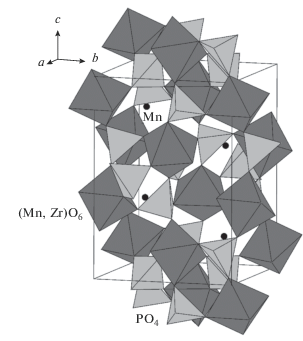
Моноклинные модификации Mn0.5Zr2(PO4)3 и Mn1.0Zr1.75(PO4)3 относятся к структурному типу SW. Фрагмент структуры фосфата Mn0.75Mn0.25Zr1.75(PO4)3 приведен на рис. 7. Основу структур MnZr1.75(PO4)3 и Mn0.5Zr2(PO4)3 формирует трехмерный каркас соответственно {Mn0.25Zr1.75(PO4)3}3∞ или {[Zr2(PO4)3]−}3∞, образованный сочленением изолированных октаэдров (Mn,Zr)O6 или ZrO6 и тетраэдров PO4. Каждый из октаэдров связан вершинами с шестью тетраэдрами PO4, которые, в свою очередь, связаны с четырьмя разными октаэдрами. Два (Mn,Zr)- или Zr-октаэдра и три заселенных атомами фосфора тетраэдра, объединяясь через вершины, образуют характерный фрагмент каркаса – “фонарик”. Эти группировки упакованы в зигзагообразные ленты. В полостях каркаса между ребрами двух октаэдров располагаются катионы Mn2+, имеющие тетраэдрическую кислородную координацию (рис. 7). В фосфате Mn0.5Zr2(PO4)3 атомы циркония расположены в искаженном октаэдрическом кислородном окружении и разупорядочены по двум позициям. Длины связей Zr–O в двух независимых Zr-октаэдрах распределены в интервале 1.75−2.42 и 1.85−2.21 Å, имеют типичные значения для шестикоординированного циркония, средние расстояния Zr−O в координационных полиэдрах составляют 2.04 и 2.08 Å. В MnZr1.75(PO4)3 межатомные расстояния Mn(Zr)−O в октаэдрах смешанного типа (Mn,Zr)O6 характеризуются бóльшим разбросом по сравнению с цирконий-кислородными октаэдрами в Mn0.5Zr2(PO4)3: 1.69−2.43 и 1.81−2.24 Å, средние расстояния Mn(Zr)−O в координационных полиэдрах близки между собой (2.04 и 2.06 Å). Соотношение длин связей и валентных углов в тетраэдрах PO4 обоих фосфатов типично для этого аниона. Тетраэдры деформированы, средние длины связей P−O в полиэдрах PO4 изменяются в пределах 1.60−1.72 Å. Кислородное окружение марганца во внекаркасных позициях может быть описано как четырехкоординированное: расстояния Mn−O по четырем ближайшим атомам O лежат в пределах 1.97−2.85 Å в Mn0.5Zr2(PO4)3 и 1.60−2.52 Å в MnZr1.75(PO4)3.
Синтезированные соединения Mn0.5E2(PO4)3 (E = Ti, Zr) и твердый раствор Mn0.5 +xMnxZr2 −x(PO4)3 (0 ≤ x ≤ 0.35) при общем сходстве строения (сохранении неизменными кристаллоструктурных группировок – фонариков) различаются способом размещения катионов марганца в полостях каркаса: одни принадлежат к пр. гр. P21/n и Mn занимает в структуре тетраэдрические пустоты, другие – к пр. гр. R3 и Mn предпочитает входить в октаэдрическое окружение.
Морфотропное превращение можно проследить в ряду фосфатов формульного состава M0.5Zr2(PO4)3 (M – катион в степени окисления +2): Ni (r = 0.55 Å) → Mg (0.57) → Cu (0.57) → → Co (0.58) → Zn (0.60) → Mn (0.66) ↔ Mn (0.83) → → Cd (0.95) → Ca (1.00) → Sr (1.18) → Pb (1.19) → Ba (r = 1.35 Å). Если первая половина ряда, включая Mn0.5Zr2(PO4)3 (rMn = 0.66 Å), характеризуется координационным числом металла M, равным четырем, то вторая, начиная с Mn0.5Zr2(PO4)3 (rMn = 0.83 Å), – КЧM = 6. Марганец-цирконий фосфат, имеющий две структурные модификации, попадает в этом ряду на границу морфотропного перехода. Полиморфизм Mn0.5Zr2(PO4)3 обусловлен легкой деформируемостью кислородного окружения и нестабильностью координации катиона Mn2+, достаточной гибкостью постройки из координационных полиэдров Zr и P, сочленяющихся по вершинам, и возможностью кристалла распределить напряжения, возникающие при большой амплитуде колебаний атомов, более равномерно между отдельными связями. Фазовый переход сопровождается разворотами тетраэдров PO4 и некоторым изменением формы кислородного окружения атомов Mn при общем сохранении архитектуры постройки. В морфотропном ряду цирконий-фосфатов M0.5Zr2(PO4)3 определяющим структурообразующим фактором в части ряда с мелкими катионами M2+ (по сравнению с ионами Zr4+, участвующими в формировании каркаса {[Zr2(PO4)3]−}3∞) является октаэдро-тетраэдрический каркас, приспосабливающийся к мелкому катиону; в части ряда с крупными катионами (Cd−Ba) определяющим в расположении атомов оказывается геометрический фактор: расположение катионов Zr4+ по сравнению с менее заряженными ионами большего радиуса M2+ приводит к “распирающему” влиянию крупных MO6-октаэдров на геометрию структуры.
ЗАКЛЮЧЕНИЕ
Исследовано фазообразование в системах Mn0.5 + 2xE2 − x(PO4)3 (E = Ti, Zr), синтезированы двойные фосфаты марганца-титана (структурный тип NZP) и марганца-циркония (низкотемпературная SW- и высокотемпературная NZP-модификации), твердый раствор Mn0.5 +x[MnxZr2 −x(PO4)3] (0 ≤ ≤ x ≤ 0.35) со структурой SW. Уточнена структура низкотемпературной модификации Mn0.5Zr2(PO4)3 и твердого раствора, в котором атомы марганца заселяют каркасные (КЧMn = 6) и внекаркасные позиции (КЧMn = 4). Показано, что основой кристаллических структур изученных фосфатов являются трехмерные каркасы из соединяющихся общими вершинами тетраэдров PO4 и октаэдров ZrO6 или (MnxZr2 −x)O6. Обсуждено влияние различных структурообразующих факторов на родственные по общему структурному мотиву, но различные по симметрии соединения M0.5Zr2(PO4)3.
Список литературы
Pet’kov V.I., Orlova A.I., Dorokhova G.I., Fedotova Ya.V. // Crystallogr. Rep. 2000. V. 45. № 1. P. 30. [Петьков В.И., Орлова А.И., Дорохова Г.И., Федотова Я.В. // Кристаллография. 2000. Т. 45. № 1. С. 36.]
Pet’kov V.I., Kurazhkovskaya V.S., Orlova A.I., Spiridonova M.L. // Crystallogr. Rep. 2002. V. 47. № 5. P. 736. [Петьков В.И., Куражковская В.С., Орлова А.И., Спиридонова М.Л. // Кристаллография. 2002. Т. 47. № 5. С. 802.]
Asabina E.A., Glukhova I.O., Pet’kov V.I. et al. // Russ. J. Gen. Chem. 2017. V. 87. № 4. P. 684. doi 10.1134/S1070363217040041 [Асабина Е.А., Глухова И.О., Петьков В.И. и др. // Журн. общей химии. 2017. Т. 87. № 4. С. 550.]
Barth S., Olazcuaga R., Gravereau P. et al. // Mater. Lett. 1993. V. 16. P. 96. https://doi.org/10.1016/0167-577X(93)90031-R.
Olazcuaga R., Le Flem G., Boireau A., Soubeyroux J.L. // Adv. Mater. Res. 1994. V. 1–2. P. 177. https://doi.org/ 10.4028/www.scientific.net/AMR.1-2.177.
Pet’kov V.I., Zhilkin E.V., Asabina E.A., Borovikova E. Yu. // Russ. J. Inorg. Chem. 2014. V. 59. № 10. P. 1087. doi 10.1134/S003602361410012X [Петьков В.И., Жилкин Е.В., Асабина Е.А., Боровикова Е.Ю. // Журн. неорган. химии. 2014. Т. 59. № 10. С. 1322.].
Olazcuaga R., Dance J.M., Le Flem G. et al. // J. Solid State Chem. 1999. V. 143. P. 224. https://doi.org/ 10.1006/jssc.1998.8097.
Derouet J., Beaury L., Porcher P. et al. // J. Solid State Chem. 1999. V. 143. P. 230. https://doi.org/ 10.1006/jssc.1998.8098.
Essehli R., El Bali B., Benmokhtar S. et al. // Mater. Res. Bull. 2009. V. 44. P. 1502. https://doi.org/ 10.1016/j.materresbull.2009.02.013.
Schöneborn M., Glaum R. // Z. Anorg. Allg. Chem. 2008. V. 634. P. 1843. https://doi.org/ 10.1002/zaac.200800186.
Benmokhtar S., El Jazouli A., Aatiq A. et al. // J. Solid State Chem. 2007. V. 180. P. 2004. doi 10.1016/ j.jssc.2007.04.014
Aatiq A., Menetrier M., El Jazouli A., Delmas C. // Solid State Ionics. 2002. V. 150. P. 391. doi 10.1016/S0167-2738(02)00135-2
Senbhagaraman S., Guru Row T.N., Umarji A.M. // J. Mater. Chem. 1993. V. 3. P. 309. doi 10.1039/ JM9930300309
El Bouari A., El Jazouli A. // Phosphorus Res. Bull. 2004. V. 15. P. 136. doi 10.3363/prb1992.15.0_136
Woodcock D.A., Lightfoot P., Smith R.I. // J. Mater. Chem. 1999. V. 9. P. 2631. doi 10.1039/A903489G
El Jazouli A., Soubeyroux J.L., Dance J.M., Le Flem G. // J. Solid State Chem. 1986. V. 65. P. 351. doi 10.1016/0022-4596(86)90107-6
Chaminade J-P., El Bouari A., El Jazouli A. et al. // Acta Crystallogr. 2005. V. 61A. P. C325. doi 10.1107/50108767305086186
Mouline A., Alami M., Brochu R. et al. // Mater. Res. Bull. 2000. V. 35. P. 899. doi 10.1016/S0025-5408(00)00277-4
Brochu R., El-Yacoubi M., Louër M. et al. // Mater. Res. Bull. 1997. V. 32. P. 15. doi 10.1016/S0025-5408(96)00162-6
Alamo J., Rodrigo J.L. // Solid State Ionics. 1993. V. 63–65. P. 678. doi 10.1016/0167-2738(93)90178-6
El Yacoubi A., Mouline A., Alami M. et al. // Phys. Chem. News. 2008. V. 44. P. 76.
Gobechiya E.R., Kabalov Yu.K., Pet’kov V.I., Sukhanov M.V. // Cryst. Rep. 2004. V. 49. № 5. P. 741. [Гобечия Е.Р., Кабалов Ю.К., Петьков В.И., Суханов М.В. // Кристаллография. 2004. Т. 49. № 5. С. 829.]
Pet’kov V.I., Orlova A.I., Kapranov D.A. // Russ. J. Inorg. Chem. 1998. V. 43. № 9. P. 1420. [Петьков В.И., Орлова А.И., Капранов Д.А. // Журн. неорган. химии. 1998. Т. 43. № 9. С. 1534.]
Petkov V.I., Orlova A.I. // J. Therm. Anal. Cal. 1998. V. 54. P. 71. https://doi.org/10.1023/A:1010156616525.
Kinoshita M., Fitch A.N., Piffard Y. et al. // Eur. J. Solid State Inorg. Chem. 1991. V. 28. P. 683.
Gobechiya E.R., Sukhanov M.V., Pet’kov V.I., Kaba-lov Yu.K. // Cryst. Rep. 2008. V. 53. № 1. P. 53. doi 10.1134/S1063774508010069 [Гобечия Е.Р., Суха-нов М.В., Петьков В.И., Кабалов Ю.К. // Кристаллография. 2008. Т. 53. № 1. С. 55.]
El Jazouli A., Alami M., Brochu R. et al. // J. Solid State Chem. 1987. V. 71. P. 444. doi 10.1016/0022-4596(87)90253-2
Nomura K., Ikeda S., Masuda H., Einaga H. // Solid Electrolyte. Chem. Lett. 1993. V. 22. P. 893. doi 10.1246/cl.1993.893
Nomura K., Ikeda S., Ito K., Einaga H. // Bull. Chem. Soc. Jpn. 1992. V. 65. № 12. P. 3221. https://doi.org/10.1246/bcsj.65.3221.
Pet’kov V.I., Orlova A.I., Kazantsev G.N. et al. // J. Therm. Anal. Cal. 2001. V. 66. № 2. P. 623. https://doi.org/10.1023/A:1013145807987.
Pet'kov V., Asabina E., Loshkarev V., Sukhanov M. // J. Nucl. Mater. 2016. V. 471. P. 122. doi 10.1016/j.jnucmat.2016.01.016
Йенеалем С.Н., Гульянова С.Г., Чехлова Т.К. и др. // Журн. физ. химии. 2000. Т. 74. № 12. С. 2273.
Sukhanov M., Pet’kov V., Ermilova M. et al. // Phosphorus Res. Bull. 2005. V. 19. P. 90. https://doi.org/ 10.3363/prb1992.19.0_90.
Shchelokov I., Asabina E., Sukhanov M. et al. // Solid State Sciences. 2008. V. 10. № 4. P. 513. doi 10.1016/ j.solidstatesciences.2007.12.005
Pylinina A.I., Mikhalenko I.I., Ermilova M.M. et al. // Russ. J. Phys. Chem. A. 2010. V. 84. № 3. P. 400. doi 10.1134/S0036024410030106 [Пылинина А.И., Михаленко И.И., Ермилова М.М. и др. // Журн. физ. химии. 2010. Т. 84. № 3. С. 465.]
Rietveld H.M. // Acta Crystallogr. 1967. V. 22. Pt. 1. P. 151.
Kim Y.I., Izumi F. // J. Ceram. Soc. Jpn. 1994. V. 102. P. 401. doi 10.2109/jcersj.102.401
Izumi F. // The Rietveld Method. N.Y.: Oxford Univ. Press, 1993. 298 p.
Pet’kov V.I., Sukhanov M.V., Shipilov A.S. et al. // Inorg. Mater. 2014. V. 50. № 3. P. 263. doi 10.1134/S0020168514030091 [Петьков В.И., Суханов М.В., Шипилов А.С. и др. // Неорган. материалы. 2014. Т. 50 № 3. С. 285.]
Дополнительные материалы отсутствуют.
Инструменты
Журнал неорганической химии