Журнал неорганической химии, 2019, T. 64, № 2, стр. 212-217
Фазовые равновесия в системе KHCO3–K2CO3–H2O при 25°С
С. А. Мазунин 1, *, М. Н. Носков 1, А. В. Елсуков 1
1 Пермский государственный национальный исследовательский университет
614990 Пермь, ул. Букирева, 15, Россия
* E-mail: smazunin@psu.ru
Поступила в редакцию 26.02.2018
После доработки 06.07.2018
Принята к публикации 23.05.2018
Аннотация
Комбинированным методом исследованы фазовые равновесия в тройной водно-солевой системе ${{{\text{K}}}^{ + }}||{\text{CO}}_{{\text{3}}}^{{{\text{2}}-}},$ ${\text{HCO}}_{{\text{3}}}^{-}-{{{\text{H}}}_{{\text{2}}}}{\text{O}}$ при 25°С. Установлено образование ограниченного ряда твердых растворов, выявлены причины разных данных по составу химического соединения. Изучено поведение ограниченного ряда твердых растворов с увеличением содержания карбоната калия в насыщенных растворах.
ВВЕДЕНИЕ
Фазовые равновесия в водно-солевых системах, содержащих гидрокарбонат и карбонат калия, всегда привлекали внимание большого количества исследователей. Серия работ Пермской школы физико-химического анализа посвящена вопросам получения карбоната калия (поташа) и содопоташной смеси по аминной технологии [1–5]. В работах Харьковской школы [6–9] большое внимание уделено вопросу производства поташа на основе данных о фазовых равновесиях в многокомпонентных системах.
В справочной литературе отмечено, что для системы KHCO3–K2CO3–H2O при 25°С характерно образование химического соединения состава 2KHCO3 ⋅ K2CO3 ⋅ 3H2O или 2KHCO3 ⋅ K2CO3 ⋅ ⋅ 1.5H2O и наличие двух нонвариантных точек [10, 11]. Цель данной работы – установление границ фазовых областей и состава равновесных жидких и твердых фаз, обнаружение ограниченного ряда твердых растворов и изучение их поведения комбинированным методом [12–16], объединяющим прогностический [17–19] метод и метод сечений [20–22].
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
В работе использовали гидрокарбонат калия квалификации “ч. д. а.” и “х. ч.”, перекристаллизованный в атмосфере углекислого газа при повышенном давлении, безводный карбонат калия марки “х. ч.” и дистиллированную воду.
Перед выполнением основной части экспериментов необходимо было удостовериться в качестве используемых реактивов. Для этого проводили анализ на содержание карбонат- и гидрокарбонат-ионов в образцах потенциометрическим динамическим титрованием при помощи автотитратора Titrino 878 компании MetrohmAG. Результаты анализов приведены в табл. 1.
Таблица 1.
Данные о составах различных образцов гидрокарбоната калия
| Производитель | Состав, мас. % | ||
|---|---|---|---|
| KHCO3 | K2CO3 | H2O | |
| Реахим | 95.59 | 2.49 | 1.92 |
| Не известен № 1 | 94.39 | 3.15 | 2.46 |
| Не известен № 2 | 94.28 | 3.23 | 2.49 |
| Перекрист. в атм СО2 | 93.84 | 3.38 | 2.78 |
| Биотех | 93.42 | 3.96 | 2.62 |
| Вектон | 92.93 | 4.10 | 2.97 |
При определении содержания ионов ${\text{HCO}}_{{\text{3}}}^{--}$ и ${\text{CO}}_{{\text{3}}}^{{{\text{2}}--}}$ в различных образцах гидрокарбоната калия независимо от их марки, времени производства и фирмы изготовителя было обнаружено небольшое содержание карбоната калия и воды во всех образцах. Фазовые равновесия и растворимость в многокомпонентных водно-солевых системах изучали двумя методами. Равновесие устанавливалось при термостатировании исходных смесей компонентов (ИСК) в герметичных сосудах. Состав равновесных жидких фаз определяли как прямым аналитическим, так и косвенным методом – построением функциональных зависимостей показателя преломления жидких фаз от состава ИСК в сечениях фигур (метод сечений Р.В. Мерцлина). Применение метода сечений возможно только при использовании герметичных сосудов, в них же можно отбирать жидкую фазу и остатки для химического анализа, если это необходимо [4, 17, 18].
Исходные смеси заданного состава готовили взвешиванием на аналитических электронных весах ВСЛ−200/0.1А с точностью ±0.0001 г. Показатель преломления исследуемых растворов измеряли на рефрактометре ИРФ-454 Б2М с погрешностью ±2 × 10−4 единиц и электронном рефрактометре Mettler Toledo RM50 с погрешностью ±1 × 10−5 единиц. Плотность образцов измеряли с помощью денситометра Mettler Toledo DM40 с погрешностью ±1 × 10−4 г/см3. Термостатирование осуществляли при помощи термостата WiseCircu с продольным перемешиванием и погрешностью термостатирования ±0.1°C.
К взвешенным твердым компонентам, помещенным в пластиковые сосуды на 100 мл, добавляли воду или растворы определенного состава, затем сосуды герметично закрывали пластиковыми крышками. Термостатирование осуществляли круглосуточно, измерения и отбор проб проводили после 6–8-часового продольного перемешивания, установление равновесия определяли по постоянству показателя преломления жидкой фазы гетерогенных ИСК.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Данные о фазовых равновесиях и свойствах жидких фаз в тройной системе KHCO3–K2CO3–Н2О при 25°C, полученные при исследовании в закрытом реакторе комбинированным методом, приведены в табл. 2.
Таблица 2.
Данные о свойствах фаз и равновесиях в тройной системе KHCO3–K2CO3–Н2О при 25°C, полученные в закрытом реакторе комбинированным методом
| № п/п |
Жидкая фаза | Состав насыщенного раствора, мас. % | Донная фаза | |||
|---|---|---|---|---|---|---|
| $n_{{\text{D}}}^{{25}}$ | d25, г/см3 | KHCO3 | K2CO3 | H2O | ||
| R4 | 1.3619 | 1.1870 | 26.13 | 1.04 | 72.83 | K(HCO3, CO3, H2O) |
| 1 | 1.3651 | 1.2083 | 22.08 | 5.58 | 72.35 | » |
| 2 | 1.3714 | 1.2426 | 18.47 | 11.40 | 70.12 | » |
| 3 | 1.3775 | 1.2784 | 15.23 | 17.22 | 67.55 | » |
| 4 | 1.3835 | 1.3144 | 12.53 | 22.26 | 65.21 | » |
| 5 | 1.3895 | 1.3517 | 10.33 | 27.44 | 62.23 | » |
| 6 | 1.3948 | 1.3867 | 8.28 | 31.59 | 60.13 | » |
| 7 | 1.3995 | 1.4184 | 6.92 | 35.55 | 57.52 | » |
| 8 | 1.4033 | 1.4465 | 5.78 | 38.54 | 55.68 | » |
| 9 | 1.4077 | 1.4784 | 4.62 | 41.87 | 53.51 | » |
| 10 | 1.4111 | 1.5056 | 4.59 | 44.40 | 51.00 | » |
| P | 1.4178 | 1.5593 | 3.87 | 49.15 | 46.99 | K(HCO3, CO3, H2O) + 2KHCO3 · K2CO3 · 1.5H2O |
| E | 1.4198 | 1.5771 | 2.79 | 51.37 | 45.84 | 2KHCO3 · K2CO3 · 1.5H2O + K2CO3 · 1.5H2O |
| R5 | 1.4195 | 1.5693 | 0.28 | 53.04 | 46.67 | K2CO3 · 1.5H2O |
| Реперные точки | ||||||
| № п/п |
Жидкая фаза | Состав ИСК, мас. % | Фазовое равновесие | |||
| $n_{{\text{D}}}^{{25}}$ | d25, г/мл | KHCO3 | K2CO3 | H2O | ||
| A | 1.4178 | 1.5593 | 11.49 | 45.56 | 42.95 | P + K(HCO3, CO3, H2O) |
| B | 1.4178 | 1.5593 | 9.47 | 46.46 | 44.07 | » |
| C | 1.4178 | 1.5593 | 37.24 | 32.31 | 30.45 | » |
| D | 1.4178 | 1.5593 | 9.56 | 47.78 | 42.66 | P + 2KHCO3 · K2CO3 · 1.5H2O |
| F | 1.4198 | 1.5771 | 7.99 | 49.39 | 42.62 | E + 2KHCO3 · K2CO3 · 1.5H2O |
| G | 1.4198 | 1.5771 | 2.50 | 53.42 | 44.08 | E + K2CO3 · 1.5H2O |
| H | 1.4198 | 1.5771 | 2.68 | 54.57 | 42.75 | » |
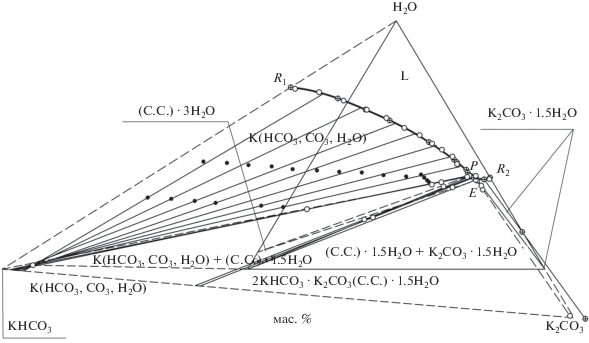
Экспериментальные данные по составу жидких фаз и реперных точек на предельных нодах изображены на рис. 1 светлыми кружками, состав ИСК –черными кружками, а справочные данные [23, т. 1, с. 326, 328] – кружками с крестом. Ранее в литературе отмечалась возможность образования химических соединений 2KHCO3 · K2CO3 · ⋅ 1.5H2O (С.С. · 1.5Н2О) и 2KHCO3 · K2CO3 · 3H2O (С.С. · 3Н2О), оба состава изображены на рис. 1. При этом в литературе отсутствовала информация о том, что трехводный сесквикарбонат калия является метастабильной твердой фазой.
На рис. 1 приведена диаграмма тройной водно-солевой системы KHCO3–K2CO3–H2O при 25°C, где R1 и R2 – растворимость гидрокарбоната и карбоната калия соответственно, P – состав раствора, отвечающего перитоническому равновесию и насыщенного относительно химического соединения 2KHCO3 ⋅ K2CO3 ⋅ 1.5H2O, и предельного твердого раствора K(HCO3, CO3, H2O), E – состав раствора, отвечающего эвтоническому равновесию и насыщенного относительно химических соединений 2KHCO3 ⋅ K2CO3 ⋅ 1.5H2O и K2CO3 ⋅ 1.5H2O.
Координаты всех точек на рис. 1 пересчитаны на содержание полутораводного химического соединения, полутораводного карбоната калия и воду (истинные концентрации). Отрицательные области концентраций диаграммы состава ограничены пунктирными линиями. Пунктирными линиями также соединены метастабильный тригидрат химического соединения с соответствующими ему перитоническим и эвтоническим растворами. Тонкими сплошными линиями показаны ноды и конноды системы, полужирными сплошными линиями – ветви кристаллизации твердого раствора, полутораводного химического соединения и карбоната калия, полужирным пунктиром – границы метастабильных равновесий (рис. 2).
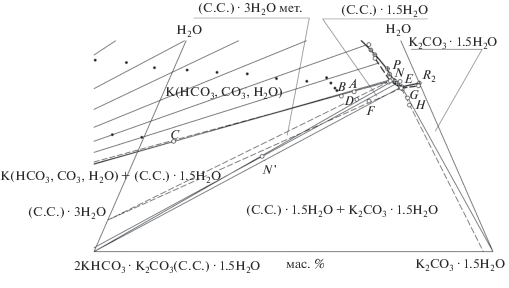
На рис. 2 представлено увеличенное изображение эвтонической и перитонической областей рис. 1 и сохранены все обозначения. Масштаб рис. 2 выбран таким образом, чтобы было видно расположение реперных точек (A, B, C, D, F, G, H, N') около предельных нод. Реперные точки имеют принципиальное значение для вычисления составов равновесных твердых фаз, насыщающих нонвариантные растворы [12–16]. Сопоставив расположение экспериментальных и литературных данных, можно констатировать метастабильный характер растворения тригидрата сесквикарбоната калия и безводного карбоната калия. Из рис. 1 и 2 видно, что в системе происходит кристаллизация ограниченного ряда твердых растворов карбоната калия и воды на основе кристаллов гидрокарбоната калия.
На рис. 3 приведена зависимость содержания карбоната калия в твердой фазе (светлые кружки) от его содержания в маточном растворе. Результаты получены совместной интерполяцией данных метода сечений (показатель преломления и плотность маточного раствора) и химического анализа маточного раствора. На основании данных, полученных интерполяцией составов насыщенных растворов и ИСК, по уравнению прямой вычисляли состав равновесной твердой фазы, пересчитывая его на истинную систему координат. Полученные данные подтвердили переменный характер состава равновесной твердой фазы.
Рис. 3.
Зависимость содержания карбоната калия в солевом составе твердой фазы от его содержания в жидкой фазе в реальном эксперименте и при условии неизменности состава исходного твердого раствора.
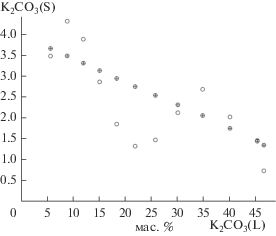
На рис. 3 кружками с крестом изображены вычисленные солевые составы твердой фазы при условии неизменности состава исходного твердого раствора. S-образное расположение светлых кружков (рис. 3) характерно для систем, в которых происходит изменение состава ограниченного ряда твердых растворов. Таким образом, в системе KHCO3–K2CO3–Н2О при 25°C происходит кристаллизация ограниченного ряда твердых растворов карбоната калия и воды на основе кристаллов гидрокарбоната калия.
В табл. 3 приведены составы жидких фаз, участвующих в нонвариантных равновесиях системы KHCO3–K2CO3–Н2О при 25°C, по которым вычислены средние составы этих растворов, представленные в табл. 2. Составы определены при помощи химического анализа.
Таблица 3.
Данные о составах жидких фаз, участвующих в нонвариантных равновесиях системы KHCO3–K2CO3–Н2О при 25°C, полученные в закрытом реакторе комбинированным методом
| Точка | Состав насыщенного раствора, мас. % | Донная фаза | ||
|---|---|---|---|---|
| KHCO3 | K2CO3 | H2O | ||
| P ' | 3.58 | 49.17 | 47.25 | K(HCO3, CO3, H2O) + 2KHCO3 · K2CO3 · 1.5H2O |
| P '' | 4.15 | 49.13 | 46.72 | » |
| Pсредн | 3.87 | 49.15 | 46.99 | » |
| E ' | 2.69 | 51.57 | 45.74 | 2KHCO3 · K2CO3 · 1.5H2O + K2CO3 · 1.5H2O |
| E '' | 2.89 | 51.17 | 45.94 | » |
| Eсредн | 2.79 | 51.37 | 45.84 | » |
В состоянии равновесия составы, отвечающие нонвариантным перитоническому и эвтоническому равновесиям системы, насыщены относительно полутораводного сесквикарбоната калия. Трехводный сесквикарбонат калия соответствует метастабильному равновесию, которое можно зафиксировать при более быстром выполнении эксперимента. Равновесное состояние в системе устанавливалось в течение нескольких дней.
ЗАКЛЮЧЕНИЕ
Изучена водно-солевая система KНСО3–K2СО3–Н2О в закрытом реакторе при атмосферном давлении и температуре 25°C комбинированным методом. Определены границы фазовых областей в данной системе. Установлено, что гидрокарбонат калия в системе образует ограниченный ряд твердых растворов с карбонатом калия и водой. Экспериментально подтверждено, что в системе при указанной температуре кристаллизуются полутораводный сесквикарбонат калия 2KHCO3 · K2CO3 · 1.5H2O и полутораводный карбонат калия. Трехводный сесквикарбонат калия 2KHCO3 · K2CO3 · 3H2O отвечает метастабильным равновесиям системы и кристаллизуется в начальный момент времени. При более длительном установлении равновесия происходит перекристаллизация с выделением полутораводной соли. Данные о фазовых равновесиях в системе могут быть использованы при прогнозировании составов равновесных твердых фаз при исследовании четверной взаимной системы K+, (C2H5)2${\text{NH}}_{{\text{2}}}^{ + }$||${\text{HCO}}_{{\text{3}}}^{--},$ Cl––H2O.
Список литературы
Мазунин С.А., Шульгина Н.П., Зубарев М.П. // Пути решения проблем окружающей среды: сб. науч. тр. Пермь: Изд-во Пермского техн. ун-та, 1993. С. 51–58.
Мазунин С.А., Зубарев М.П., Шульгина Н.П. и др. // Cб. тр. междунар. науч. конф. “Перспективы развития естественных наук на Западном Урале”. Пермь, 1996. Т. 1. 198 с. С. 154–159.
Мазунин С.А., Зубарев М.П., Панасенко В.A. // Журн. неорган. химии. 2001. Т. 46. № 4.
Мазунин С.А. Дис. … д-ра хим. наук. Пермь, 2000.
Зубарев М.П. Дис… канд. хим. наук. Пермь, 2000. 191 с.
Панасенко В.В., Гринь Г.И., Мазунин С.А. и др. // Восточно-Европейский журнал передовых технологий. Харьков. 2011. № 3/6(51). С. 51.
Панасенко В.В., Гринь Г.И., Панасенко В.А. и др. // Вестник НТУ “ХПИ”. Харьков, 2011. № 27. С. 67.
Панасенко В.В., Гринь Г.И., Панасенко В.А. и др. // XVIII Украинская конф. по неорг. химии с участием зарубежных ученых: тез. докл. (27 июня–1 июля 2011 г.). Харьков: ХНУ им. В.Н. Каразина, 2011. С. 278.
Панасенко В.В., Гринь Г.И., Панасенко В.А. и др. // Восточно-Европейский журнал передовых технологий. Харьков. 2011. № 4/6 (52). С. 38.
Солиев Л., Худоербекова З.П., Низомов И.М. // Докл. АН Респ. Таджикистан. 2016. Т. 59. № 5–6. С. 236.
Справочник по растворимости солевых систем. Тройные и многокомпонентные системы, образованные неорганическими веществами / Под ред. Кафарова В.В. и др. Л.: Наука, 1969. Т. 3. кн. 2.
Мазунин С.А., Фролова С.И., Кистанова Н.С. Пат. 2421721 РФ, МПК51 G 01 N 33/18, G 01 N 31/00. Способ определения составов нонвариантных равновесных фаз многокомпонентных водно-солевых систем. № 2010105602/15 // Бюл. изобр. № 17. 9 с.
Мазунин С.А., Фролова С.И., Кистанова Н.С. Пат. 2416790 РФ, МПК51 G 01 N 33/18, G 01 N 31/00. Способ определения составов нонвариантных равновесных фаз многокомпонентных водно-солевых систем № 2010105596/15 // Бюл. изобр. № 11. 10 с.
Мазунин С.А., Фролова С.И., Кистанова Н.С. Пат. 2324933 РФ, МПК51 G 01 N 33/18, G 01 N 31/00. Способ изучения растворимости в многокомпонентных водно-солевых системах; заявитель и патентообладатель ГОУ ВПО Пермск. гос. ун-т. № 2007109333/04; заявл. 15.03.2007; опубл. 20.05.2008 // Бюл. изобр. №14. 10 с.
Мазунин С.А., Фролова С.И., Кистанова Н.С. Пат. 2324932 РФ, МПК51 G 01 N 33/18, G 01 N 31/00. Способ определения составов равновесных твердых фаз в многокомпонентных водно-солевых системах; заявитель и патентообладатель ГОУ ВПО Пермск. гос. ун-т. №2007109332/04; заявл. 15.03.2007; опубл. 20.05.2008 // Бюл. изобр. № 14. 13 с.
Mazunin S.A., Noskov M.N., Elsukov A.V. // Russ. J. Inorg. Chem. 2017. V. 62. № 5. P. 539. [Мазунин С.А., Носков М.Н., Елсуков А.В. // Журн. неорган. химии. 2017. Т. 62. № 5. С. 538. doi 10.7868/S0044457X17050178].
Мазунин С.А., Посягин Г.С. Основы физико-химического анализа: учеб. пособ. по спецкурсу. Перм. ун-т. 2000. Ч. 1, 2. 152 с.
Мазунин С.А. Физико-химический анализ в химии и химической технологии: учеб. пособ. Перм. гос. нац. исслед. ун-т. 2014. 492 с.
Мазунин С.А., Носков М.Н., Елсуков А.В., Кистанова Н.С. // XI Междунар. Курнаковское совещание по физ.-хим. анализу в рамках XX Менделеевского съезда по общей и прикладной химии: тез. конф. Воронеж, 2016. С. 29.
Мерцлин Р.В., Крупаткин И.Л. // Журн. общ. химии. 1940. Т. 10. № 22. С. 1999.
Никурашина Н.И., Мерцлин Р.В. Метод сечений. Приложение его к изучению многофазного состояния многокомпонентных систем. Саратов: Изд-во Сарат. ун-та, 1969. 122 с.
Мерцлин Р.В. // Изв. биолог. н.-и. ин-та при Пермск. гос. ун-те. 1937. Т. 11. Вып. 1–2. С. 11.
Здановский А.Б. и др. Справочник экспериментальных данных по растворимости. Л.: Госхимиздат, 1954.
Дополнительные материалы отсутствуют.
Инструменты
Журнал неорганической химии