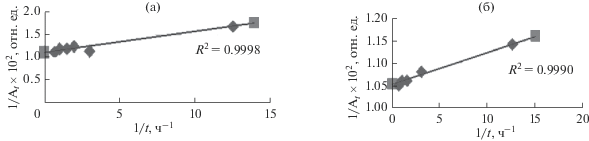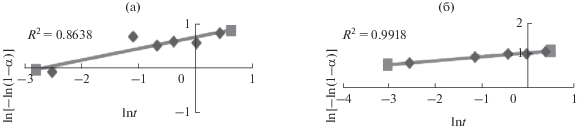Журнал неорганической химии, 2019, T. 64, № 12, стр. 1326-1334
Сорбция ионов стронция силикатами бария из растворов сложного солевого состава
П. С. Гордиенко 1, И. А. Шабалин 1, С. Б. Ярусова 1, 2, *, С. Б. Буланова 1, В. Г. Курявый 1, В. В. Железнов 1, С. Н. Сомова 1, И. Г. Жевтун 1
1 Институт химии ДВО РАН
690022 Владивосток, пр-т 100-летия Владивостока, 159д, Россия
2 ладивостокский государственный университет экономики и сервиса
690014 Владивосток, ул. Гоголя, 41, Россия
* E-mail: yarusova_10@mail.ru
Поступила в редакцию 29.03.2019
После доработки 13.05.2019
Принята к публикации 17.06.2019
Аннотация
С целью расширения ранее полученных научных данных проведен сравнительный анализ сорбционных свойств наноструктурированных силикатов бария, полученных в многокомпонентных системах ВаCl2 · 2H2O–КОН–SiO2–H2O и ВаCl2 · 2H2O–КОН–SiO2–AlCl3–H2O, приведены сведения об их составе и морфологии. Изучены их сорбционные свойства по отношению к ионам Sr2+ из растворов сложного ионного состава. Установлено, что синтетические силикаты и алюмосиликаты бария имеют высокие сорбционные и кинетические характеристики при статических условиях сорбции. Максимальная степень извлечения ионов Sr2+ из сложных по ионному составу растворов (>99%) получена для образца силиката бария ВаSiO3 · 2.3H2O. В пределах погрешности измерений такие же сорбционные характеристики имеют и образцы алюмосиликата бария ВаAl2Si2O8 · 2.6H2O. Показано, что исследуемые сорбенты с учетом их кинетических свойств могут быть рекомендованы для глубокой очистки растворов сложного ионного состава, в том числе морской воды, от ионов стронция в статических условиях.
ВВЕДЕНИЕ
Все радиоактивные изотопы оказывают негативное влияние на биогенные процессы в окружающей среде. К наиболее опасным радиоактивным изотопам в биосфере относятся изотопы таких элементов, как стронций, цезий, кобальт, железо и др., характеризующиеся длительным периодом полураспада. С развитием атомной энергетики и сопутствующих производств, обеспечивающих ее безопасное функционирование и переработку отработанного топлива, параллельно интенсивно ведутся работы, связанные с созданием эффективных методов и материалов, позволяющих извлекать и концентрировать радиоизотопы с последующим их захоронением или использованием в определенных отраслях промышленности, медицине. Извлечение радиоактивных изотопов из объектов окружающей среды, в первую очередь из водных растворов, является актуальной проблемой. Как следует из анализа современных методов очистки объектов окружающей среды от загрязнения радионуклидами, наиболее эффективными являются сорбционные методы. Активно ведутся исследования по созданию новых сорбционных материалов, которые имели бы высокую сорбционную емкость, высокую избирательность извлечения определенного изотопа из сложных по ионному составу растворов и соответствующие кинетические характеристики. Эффективное время сорбции имеет принципиальное значение при использовании сорбентов для дезактивации организма животных и человека.
Для извлечения радионуклидов из водных сред применяется широкий спектр различных материалов: ионообменные смолы, природные и синтетические цеолиты, материалы на основе титаната, ванадата и вольфрама, оксиды марганца, гексацианоферраты, молибдофосфаты аммония, гидроксиапатит и др. [1–8]. Во многих работах особое внимание уделяется использованию силикатов различного состава и структуры и материалов на их основе [9–14].
Авторами [15] дано описание методики получения наноструктурированных алюмосиликатов калия из водных растворов многокомпонентных систем, а в работе [16] представлены экспериментальные данные по сорбционным свойствам полученных наноструктурированных алюмосиликатов типа КxАlхSiуО(2у+ 2х) · nН2О, для которых характерны высокие сорбционные емкости по отношению к ионам Cs+ (до 3.7 ммоль/г), высокие кинетические параметры в статических условиях сорбции (единицы минут выхода на уровень 90–95% от максимальной сорбционной емкости), устойчивость в щелочных средах.
В работах [17, 18] показана эффективность силикатов и алюмосиликатов кальция при извлечении ионов Sr2+ и Cs+. Установлено, что алюмосиликаты кальция, полученные из многокомпонентных систем CaCl2–AlCl3–КОН–SiO2–H2O с соотношением Al : Si = 2 : 2, 2 : 6, 2 : 10, имеют сорбционную емкость по ионам стронция из растворов хлорида стронция без солевого фона до 0.5 ммоль/г, а степень извлечения составляет >90%. Для модифицированных алюмосиликатов кальция (в насыщенном растворе хлорида кальция) степень извлечения ионов Sr2+, определенная с помощью метода радиоактивных индикаторов, из растворов, имитирующих состав пресной воды, используемой в работе [19] (далее ИПВ), составляет 90–90.5%, а Kd = 980, что в два раза выше, чем при извлечении ионов природными алюмосиликатами.
Авторы [20–23] указывают на использование сорбционно-реагентных систем на основе аморфного силиката бария BaSiO3, который образуется в результате золь-гель перехода, индуцированного введением ионов Ba2+ в раствор Na2SiO3.
Представляло интерес провести сравнительный анализ процесса извлечения ионов Sr2+ из растворов сложного солевого состава силикатом и алюмосиликатом бария, полученными из водных растворов.
В настоящей работе приведены данные по составу, морфологии, сорбционным свойствам наноструктурированных силикатов бария, полученных в многокомпонентных системах ВаCl2 · 2H2O–КОН–SiO2–H2O и ВаCl2 · · 2H2O–КОН–SiO2–AlCl3–H2O по методике, описанной в [15], по отношению к ионам Sr2+, присутствующим в водных растворах сложного ионного состава.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Синтез силикатов бария
Для синтеза силиката и алюмосиликата бария использовали следующие реактивы: хлорид алюминия AlCl3 · 6H2O и диоксид кремния SiO2 · nН2О квалификации “ч.”, гидроксид калия КОН квалификации “ч. д. а.” и дигидрат хлорида бария BaCl2 · 2H2O квалификации “х. ч.”.
Компоненты для синтеза силиката и алюмосиликата бария были взяты соответственно в соотношении, отвечающем стехиометрии следующих уравнений:
При синтезе силиката бария гидроксид калия и оксид кремния растворяли в дистиллированной воде при температуре 90–95°С и в полученный раствор силиката калия (SiO2/К2О = 1, С = 0.2 моль/л) вливали приготовленный раствор хлорида бария (С = 0.1428 моль/л). Выпавший осадок отфильтровывали и сушили при температуре 100–105°С. Аналогичным образом синтезировали силикат бария, но с последующей выдержкой при температуре 10°С в течение 7 сут, фильтрацией осадка и промывкой дистиллятом.
По аналогичной методике был получен и алюмосиликат бария. При синтезе алюмосиликата бария к горячему раствору хлорида бария и хлорида алюминия приливали раствор силиката калия. Образовавшийся осадок отфильтровывали и промывали дистиллированной водой до отрицательной реакции на хлорид-ионы в промывных водах.
Опыты по сорбции ионов Sr2+
Опыты по сорбции ионов Sr2+ проводили из водных растворов хлорида стронция (SrCl2 · · 6Н2О) без солевого фона с концентрацией ионов Sr2+ 43.4 мг/л; из растворов ИПВ [19], мг/л: Sr2+ – 10–12, Ca2+ – 100, Mg2+– 75, Na+– 132, K+– 15, Cl– – 82, ${\text{SO}}_{{\text{4}}}^{{{\text{2}}--}}$ – 650 (рН раствора 7.6); из морской воды с элементным составом, мг/л: Al – 0.31, Са – 339.5, Мg > 1000, Fe – 0.07, Ba – 0.02, Cd – 0.04, Co < 0.05, Cr – 0.03, Cu < 0.01, Mn – 0.02, Pb – 0.05, Sr – 6.28, Zn – 0.05.
При приготовлении раствора ИПВ использовали сульфат калия K2SO4 квалификации “ос. ч.”, сульфат натрия Na2SO4 “ос. ч.”, сульфат магния MgSO4 · 7H2O “ч. д. а.”, хлорид кальция СаCl2 “х. ч.”, хлорид стронция SrCl2 · 6H2O квалификации “х. ч.”.
Эксперименты по сорбции проводили в статических условиях при температуре 20°С в течение 3 ч. В серию пробирок помещали навески исследуемых сорбентов, заливали их вышеуказанными растворами, содержащими ионы Sr2+, и перемешивали на магнитной мешалке RT 15 Power (IKA WERKE, ФРГ). Затем растворы отделяли от сорбента фильтрованием (бумажный фильтр “синяя лента”) и определяли в них концентрацию ионов Sr2+, Ca2+, Ва2+.
Методы анализа
Рентгенограммы осадков снимали на автоматическом дифрактометре D8 ADVANCE (Германия) с вращением образца в СuKα-излучении. Рентгенофазовый анализ (РФА) проводили с использованием программы поиска EVA с банком порошковых данных PDF-2.
Наличие кристаллизационной воды в силикатах определяли по разнице в весе образца при нагреве (до постоянного веса) до 110 и 900°С и контролировали по ИК-спектрам в области 3000–4000 см–1.
Удельную поверхность образцов определяли методом низкотемпературной адсорбции азота на приборе Сорбтометр-М (Россия).
ИК-спектры образцов снимали в области 400–4000 см–1 с использованием фурье-спектрометра Shimadzu FTIR Prestige-21 (Япония) при комнатной температуре. Образцы для регистрации растирали в агатовой ступке до мелкодисперсного состояния и в виде суспензии в вазелиновом масле наносили на подложку из стекла KRS-5.
Для определения элементного состава полученных образцов применяли энергодисперсионный рентгенофлуоресцентный метод с использованием спектрометра EDX-800HS фирмы “Shimadzu” (Япония). Анализ проводили без учета легких элементов с использованием программного обеспечения спектрометра.
Изучение морфологии и элементного состава образцов проводили на сканирующем электронном микроскопе высокого разрешения Hitachi S5500 (Япония) с приставкой для энергодисперсионного анализа Thermo Scientific.
Измерение pH раствора проводили на pH-метре/иономере Мультитест ИПЛ-102 со стеклянным электродом ЭСК-10601/7, стандартизированным по буферным растворам.
Определение химических элементов в морской воде было выполнено методом атомно-эмиссионной спектрометрии с индуктивно-связанной плазмой на атомно-эмиссионном спектрометре iCAP 6500 Duo (Thermo Electron Scientific, США). Морскую воду отбирали в Японском море в акватории Амурского залива (Владивосток), предварительно фильтровали через фильтр “белая лента”.
Содержание ионов Sr2+, Ca2+ и Ва2+ в исходных растворах и фильтратах после сорбции определяли методом атомно-абсорбционной спектрометрии на двулучевом спектрометре SOLAAR M6 (Thermo Scientific, США) по аналитическим линиям 460.7, 422.6 и 553.6 нм соответственно. Предел обнаружения ионов стронция в водных растворах составляет 0.002 мкг/мл, кальция – 0.0005 мкг/мл, бария – 0.01 мкг/мл. Погрешность определения стронция в растворах в диапазоне концентраций 0.001–10 мг/л составляет 20%; ионов кальция при концентрации от 0.1 до 50 мг/л – 10%; бария при концентрации 0.01–0.2 мг/л – 30%.
Сорбционную емкость (Ас, ммоль/г) исследуемых образцов рассчитывали по формуле:
где Сисх – исходная концентрация ионов Sr2+ в растворе, ммоль/л; Ср – равновесная концентрация ионов Sr2+ в растворе, ммоль/л; V – объем раствора, л; m – масса сорбента, г.Степень извлечения ионов Sr2+ (α, %) рассчитывали по формуле:
(2)
$\alpha = \frac{{({{C}_{{{\text{исх}}}}} - {{C}_{р}})}}{{{{C}_{{{\text{исх}}}}}}} \times 100\% .$Коэффициент межфазного распределения (Kd, мл/г) определяли следующим образом:
Сорбцию стронция из растворов ИПВ определяли с помощью метода радиоактивных индикаторов. Активность растворов, содержащих 90Sr, составляла 3 × 104 Бк/л. Степень очистки определяли по разности концентраций 90Sr в растворе до и после сорбции. В растворе содержание радионуклидов определяли методом β-спектрометрии c использованием жидкосцинтилляционного спектрометра TRI-CARB модели 2910 TR (Германия). Зная соотношение V/m, на основании распределения радионуклидов между твердой и жидкой фазами рассчитывали коэффициент распределения:
где Аs и Аl – содержание радионуклидов в твердой и жидкой фазах соответственно; V – объем жидкой фазы, мл; m – масса сорбента, г.РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Характеристика силикатов бария
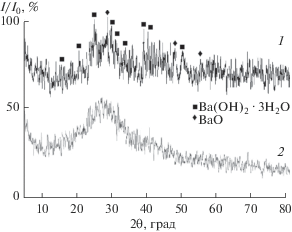
Согласно данным РФА, состав полученных образцов характеризуется наличием рентгеноаморфных фаз (рис. 1), что подтверждается регистрацией гало в диапазоне углов 20°–35°.
На рентгенограмме образца силиката бария на фоне гало проявляются два слабых пика, соответствующих межплоскостным расстояниям d = = 3.62614 и 3.16653 Å, которые, согласно базе данных, могут быть отнесены к гидроксиду бария Ва(ОН)2 ⋅ 3Н2О и к оксиду бария соответственно, но наиболее вероятно присутствие в аморфных образцах силикатов, получаемых из водных систем и карбоната бария, имеющего низкое значение ПР (4 × 10–10).
Содержание кристаллизационной воды в полученных образцах (на моль безводного силиката) составляет ~2.3 моль для ВаSiO3 и 2.6 моль для ВаAl2Si2O8. По данным рентгенофлуоресцентного анализа, содержание указанных соединений в образцах составляет 90–93%. Таким образом, полученные данные свидетельствуют о том, что состав синтезированных образцов соответствует формулам ВаSiO3 · 2.3H2O и ВаAl2Si2O8 · 2.6H2O. Значения удельной поверхности образцов для ВаSiO3 ⋅ 2.3H2O составляют 37.2 м2/г, для ВаAl2Si2O8 · ⋅ 2.6H2O – 125.3 м2/г.
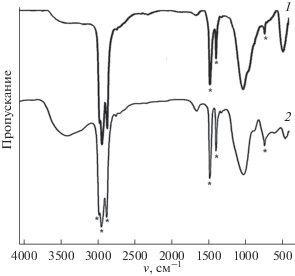
На рис. 2 приведены ИК-спектры образцов силиката и алюмосиликата бария.
Как видно из рисунка, максимумы пиков валентных и деформационных колебаний связей Si–O силиката бария смещены по сравнению с алюмосиликатом бария в сторону более высоких частот (частоты валентных колебаний равны 1014.56 и 1008.77 см–1 для силиката и алюмосиликата бария соответственно). Это является одной из характеристик, подтверждающей повышенную энергию кристаллической решетки силиката бария по сравнению с алюмосиликатом бария. В ИК-спектре алюмосиликата бария максимум частоты валентных колебаний, характерный для кристаллизационной воды (3383.14 см–1), по сравнению с силикатом бария (3118.9 см–1) смещен в сторону высоких частот. Это обусловлено понижением энергии связи молекул воды с кристаллической решеткой алюмосиликата.
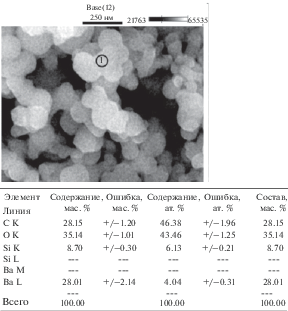
СЭМ-изображение образца ВаSiO3 ⋅ 2.3 H2O и данные по соотношению элементов бария и кремния в локальной точке нанодисперсного силиката бария приведены на рис. 3.
Как видно из представленного рисунка, полученные образцы силиката бария представляют собой порошок, состоящий из нанодисперсных сферообразных частиц практически одного размера (диаметром не более 50 нм). Наночастицы образуют конгломераты, формируя пористую систему (рис. 3).
Рис. 4.
СЭМ-изображения ВаSiO3 после выдержки реакционной смеси при температуре 10°С в течение 7 сут.

На рис. 4 приведены СЭМ-изображения частиц силиката бария после выдержки реакционной смеси при температуре 10°С в течение 7 сут и последующей фильтрации осадка и промывки дистиллятом.
Как видно из рис. 4, для морфологии образца характерно больше сросшихся частиц, а непосредственно на частицах имеются нанопоры (рис. 4) диаметром не более нескольких ангстрем. Наночастицы образца силиката бария, полученного при пониженной температуре (рис. 4), “перфорированы”, что, по-видимому, связано с образованием наноканалов.
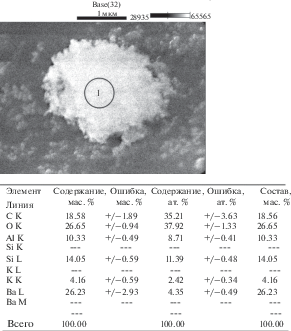
Для алюмосиликата бария (рис. 5) характерен меньший размер наночастиц, не превышающий нескольких нм.
Соотношение элементов бария, алюминия и кремния в выделенной локальной области образца алюмосиликата бария в пределах ошибки измерений соответствует заданному при синтезе составу (рис. 6).
В табл. 1 приведены значения коэффициентов межфазного распределения Kd при сорбции ионов Sr2+ из растворов без солевого фона с концентрацией ионов Sr2+ 43.4 мг/л при различных соотношениях твердой и жидкой фаз (т : ж).
Таблица 1.
Значения коэффициентов межфазного распределения при сорбции ионов Sr2+ из растворов без солевого фона
| Соединение | Соотношение т : ж | Kd, мл/г | Степень извлечения α, % |
|---|---|---|---|
| ВаAl2Si2O8 ‧ 2.6H2O | 1 : 400 | 1.3 × 103 | 76.0 |
| 1 : 1000 | 1.7 × 103 | 64.0 | |
| 1 : 2000 | 1.8 × 103 | 46.0 | |
| ВаSiO3 ‧ 2.3H2O | 1 : 400 | 0.6 × 103 | 61.0 |
| 1 : 1000 | 1.1 × 103 | 55.0 | |
| 1 : 2000 | 0.7 × 103 | 28.0 |
Как видно из табл. 1, наибольшие значения Kd при сорбции ионов Sr2+ из растворов без солевого фона характерны для алюмосиликата бария при всех выбранных соотношениях т : ж.
При исследовании сорбционных свойств образца силиката бария ВаSiO3 ⋅ 2.3H2O по отношению к ионам Sr2+ установлено, что величина степени очистки α раствора ИПВ с начальной концентрацией ионов Sr2+ 12 мг/л при т : ж = 1 : 40, 1 : 400 и 1 : 1000 составляет 96.0, 88.0 и 84.0% соответственно.
При соотношении т : ж = 1 : 40 рассчитана величина коэффициента селективности извлечения ионов стронция по отношению к ионам кальция S = Kds/Kdc, равная 7. При т : ж = 1 : 100 степень извлечения ионов Sr2+ составляет 94.3%, а Кd = = 1640. При т : ж = 1 : 1000 Kd резко увеличивается до 2770, а степень извлечения уменьшается на 20.0% и составляет 73.6%.
При извлечении ионов Sr2+ из морской воды с концентрацией ионов Sr2+ 6.28 мг/л при т : ж = 1 : 40; 1 : 400 и 1 : 1000 (рH растворов 7.6, 8.4 и 8.3 соответственно) степень извлечения ионов Sr2+ находится в диапазоне 88.0–93.0%. С привлечением метода радиоактивных индикаторов и ультрафильтрации получены данные по извлечению ионов Sr2+ силикатом бария из морской воды с концентрацией ионов Sr2+ 6.28 мг/л при т : ж = 1 : 1000 (рH раствора 8.31). Установлено, что степень извлечения силиката бария >99.0%, а коэффициент распределения ионов стронция Kd составляет 0.8 × 105.
Для алюмосиликата бария ВаAl2Si2O8 при соотношении т : ж = 1 : 40, 1 : 400 и 1 : 1000 (рH 8.15, 8.54 и 8.81 соответственно) степень извлечения ионов Sr2+ из раствора ИПВ с исходной концентрацией ионов Sr2+ 12 мг/л составляет 99.0, 98.0 и 87.0%. Коэффициент распределения Kd = 3880, 1593 и 6480 соответственно, что значительно выше, чем для природных силикатных сорбентов, применяемых для очистки подобных растворов [19].
В морской воде с концентрацией ионов Sr2+ 6.28 мг/л при т : ж = 1 : 40; 1 : 400 и 1 : 1000 (рH растворов 7.6, 8.4 и 8.3 соответственно) степень извлечения ионов Sr2+ равна соответственно 97.0, 83.0 и 57.0%.
Ионы Ba2+ после сорбции в исследуемых растворах морской воды методом атомно-абсорбционной спектрометрии не обнаружены. Это объясняется тем, что при катионном обмене ионов Ba2+ на ионы Sr2+ из раствора как образовавшийся силикат стронция, так и получаемый сульфат бария (при наличии в растворе сульфат-ионов) имеет низкие значения произведения растворимости (ПР): 1 × 10–13 для SrSiO3, 1.1 × 10–10 для ВаSО4, 3.98 × 10–11 для ВаSiO3, поэтому эти соединения выпадают в осадок.
Различий в сорбционных параметрах образцов силикатов бария, полученных при смешивании растворов силиката калия и хлорида бария при температурах 100 и 10°С с последующей выдержкой при 10°С в течение 7 сут, не установлено несмотря на замеченные морфологические отличия в нанотекстурировании порошков (рис. 3 и 4).
Данные по кинетике процесса сорбции ионов Sr2+ силикатом бария ВаSiO3 ⋅ 2.3H2O из растворов ИПВ приведены в табл. 2.
Таблица 2.
Данные по кинетике процесса сорбции ионов Sr2+и Ca2+ силикатом бария ВаSiO3 ⋅ 2.3H2O из растворов, имитирующих воды озера-накопителя 11 ПО “Маяк” (соотношение т : ж = 1 : 40 при температуре 20°С) αt, % – экспериментальная и расчетная (в скобках) величина степени извлечения соответствующего иона; Δ, % – относительная разница в значениях αt
| Параметр | t, ч | |||||
|---|---|---|---|---|---|---|
| 0.083 | 0.333 | 0.5 | 0.666 | 1.0 | 1.5 | |
| αt, % (Sr) Δ, % |
87.5 (87.28) 0.24 |
92.2 (92.80) –0.6 |
96.2 (93.46) 1.3 |
94.3 (93.79) –5.0 |
94.3 (94.12) 1.72 |
94.8(94.35) 0.47 |
| αt, % (Ca) Δ, % |
59.7 (59.98) –0.48 |
86.7 (79.36) 8.45 |
81.4 (82.31) –1.1 |
84.0 (83.86) 0.16 |
83.3 (85.48) –2.6 |
88.9 (86.59) 2.59 |
Для обработки данных по кинетике предложено эмпирическое уравнение (I), формально напоминающее уравнение Ленгмюра [24]:
αm – максимальная величина степени извлечения соответствующего иона; t – время сорбции, ч; k – постоянная величина, равная обратной величине времени сорбции, при котором степень извлечения определяемого иона достигает значения 1/2αm, размерность ч–1.Из данных таблицы по величинам αt, αm и t рассчитано значение постоянной k по уравнению:
(6)
$k = {{{{\alpha }_{t}}} \mathord{\left/ {\vphantom {{{{\alpha }_{t}}} {({{\alpha }_{m}} - {{\alpha }_{t}})t}}} \right. \kern-0em} {({{\alpha }_{m}} - {{\alpha }_{t}})t}}.$При сорбции ионов Sr2+ из растворов ИПВ силикатом бария k равно 140 ч–1, а для ионов Ca2+ – 25 ч–1. В табл. 2 в скобках приведены рассчитанные по уравнению (1) величины степени извлечения ионов Sr2+ и Ca2+.
Как видно из данных табл. 2, экспериментальные и расчетные значения α при указанных коэффициентах k, отличаются на величину Δ, %, приведенную в табл. 2. По отношению к экспериментальным данным относительная разница в значениях αt не превышает нескольких процентов, причем отклонение экспериментальных данных от теоретически полученных по уравнению (5) наблюдается как в большую, так и в меньшую сторону. Из расчетных данных следует, что полученный наноструктурированный сорбент достигает значения 0.5 максимальной сорбционной емкости по ионам стронция за время не более 30 с.
Экспериментальные данные по кинетике сорбции ионов обработаны и с использованием уравнения кинетической модели псевдовторого порядка [25]:
где Аt – текущая величина степени извлечения ионов (в отн. ед.); Аe – максимальная величина степени извлечения ионов (в отн. ед.); k2 – константа реакции псевдовторого порядка (ч–1); t – время сорбции (ч).Уравнение (7) приведено к виду:
(8)
${1 \mathord{\left/ {\vphantom {1 {{{A}_{t}}}}} \right. \kern-0em} {{{A}_{t}}}} = {1 \mathord{\left/ {\vphantom {1 {{{A}_{e}}}}} \right. \kern-0em} {{{A}_{e}}}} - {1 \mathord{\left/ {\vphantom {1 {\left( {{{k}_{2}}A_{e}^{2}t} \right)}}} \right. \kern-0em} {\left( {{{k}_{2}}A_{e}^{2}t} \right)}}.$Временные зависимости степени извлечения ионов Ca2+ и Sr2+, согласно уравнению (8), представлены на рис. 7 и описываются уравнениями y = 0.0449x + 1.107 и y = 0.0072x + 1.051 соответственно с коэффициентами корреляции R2, близкими к 1. Параметры Ae = 0.9033 и k2 = 27.3 ч–1 – для ионов Ca2+ и Ae = 0.9513 и k2 = 153.6 ч–1 – для ионов Sr2+.
Данные по кинетике обработаны и с использованием уравнения Колмогорова–Ерофеева, применяемого для анализа топохимических процессов:
где α – степень извлечения ионов; k – параметр процесса сорбции, связанный с константой реакции соотношением k = 1/Кn; t – время (ч); n – порядок реакции.Кинетика топохимических процессов сорбции для ионов Ca2+ и Sr2+, представленная на рис. 8, описывается уравнением (10), полученным после двойного логарифмирования уравнения (9):
Из графических зависимостей (рис. 8) следует, что кинетика этих реакций описывается линейными уравнениями: у = 0.7029 + 0.2587х (с коэффициентом корреляции R2 = 0.8638) и у = 1.0529 + + 0.1173х (с коэффициентом корреляции R2 = = 0.9918) для ионов Ca2+ и Sr2+ соответственно.
Из полученных зависимостей следует, что порядок реакции для процесса сорбции ионов Ca2+ равен 0.2587, а для ионов Sr2+ – 0.1173. Такие величины порядка реакции характерны для процессов, контролируемых диффузией.
ЗАКЛЮЧЕНИЕ
Из полученных экспериментальных данных следует, что синтетические силикаты и алюмосиликаты бария имеют высокие сорбционные и кинетические характеристики при статических условиях сорбции с временем выхода на значения 1/2Am в пределах нескольких десятков секунд.
Максимальная степень извлечения ионов Sr2+ из сложных по ионному составу растворов (>99%) получена для образца силиката бария ВаSiO3 ⋅ ⋅ 2.3H2O. В пределах погрешности измерений такие же сорбционные характеристики имеют и образцы алюмосиликата бария ВаAl2Si2O8. ⋅ 2.6H2O. Но если учитывать мольные доли ионов бария в образцах сорбентов, то эффективность катионного обмена в алюмосиликате бария в разы больше, чем для силиката бария, что, по-видимому, связано как с дисперсностью, так и с морфологией полученных образцов, в связи с чем необходимо провести дополнительные сравнительные исследования этих двух типов сорбентов. Различие в значениях сорбционных параметров барийсодержащих сорбентов необходимо учитывать как при их синтезе, так и при использовании подобных материалов.
Коэффициент распределения ионов стронция при использовании в качестве сорбента синтетического силиката бария составляет 0.8 × 105 (при т : ж = 1 : 1000), т.е. подобные сорбенты с учетом их кинетических свойств могут быть рекомендованы для глубокой очистки растворов сложного ионного состава, в том числе морской воды, от ионов стронция в статических условиях.
Список литературы
Alby D., Charnay C., Heran M. et al. // J. Hazard. Mater. 2018. V. 344. P. 511. https://doi.org/10.1016/j.jhazmat.2017.10.047
Merceille A., Weinzaepfel E., Barré Y. et al. // Sep. Purif. Technol. 2012. V. 96. P. 81. https://doi.org/10.1016/j.seppur.2012.05.018
Ivanets A.I., Prozorovich V.G., Kouznetsova T.F. et al. // Environ. Nanotechnology, Monitoring Management. 2016. V. 6. P. 261. https://doi.org/10.1016/j.enmm.2016.11.004
Ivanets A.I., Katsoshvili L.L., Krivoshapkin P.V. et al. // Radiochem. 2017. V. 59. № 3. P. 264. [Иванец А.И., Кацошвили Л.Л., Кривошапкин П.В. и др. // Радиохимия. 2017. Т. 59. № 3. С. 230.] https://doi.org/10.1134/S1066362217030080
Kitikova N.V., Ivanets A.I., Shashkova I.L. et al. // J. Radioanal. Nucl. Chem. 2017. V. 314. P. 2437. https://doi.org/10.1007/s10967-017-5592-4
Милютин В.В., Некрасова Н.А., Каптаков В.О. // Труды Кольского научного центра РАН. 2018. С. 67.
Egorin A., Sokolnitskaya T., Azarova Yu. et al. // J. Radioanal. Nucl. Chem. 2018. V. 317. P. 243. https://doi.org/10.1007/s10967-018-5905-2
Portnyagin A.S., Egorin A.M., Golikov A.P. et al. // Thermochim. Acta. 2019. V. 675. P. 92. https://doi.org/10.1016/j.tca.2019.03.019
Montoya V., Baeyens B., Glaus M.A. et al. // Geochim. Cosmochim. Acta. 2018. V. 223. P. 1. https://doi.org/10.1016/j.gca.2017.11.027
Kim J., Kwak S.-Y. // Chem. Eng. J. 2017. V. 313. P. 975. https://doi.org/10.1016/j.cej.2016.10.143
Abdel Rahman R.O., Ibrahim H.A., Hanafy M. et al. // Chem. Eng. J. 2010. V. 157. Iss. 1. P. 100. https://doi.org/10.1016/j.cej.2009.10.057
Sepehrian H., Ahmadi S.J., Waqif-Husain S. et al. // J. Hazard. Mater. 2010. V. 176. № 1–3. P. 252. https://doi.org/10.1016/j.jhazmat.2009.11.020
Feng W., Wan Z., Daniels J. et al. // J. Clean. Prod. 2018. V. 202. P. 390. https://doi.org/10.1016/j.jclepro.2018.08.140
QiuY., YuS., Song Y. et al. // J. Mol. Liq. 2013. V. 180. P. 244. https://doi.org/10.1016/j.molliq.2013.02.003
Гордиенко П.С., Шабалин И.А., Ярусова С.Б. Пат. 2516639 РФ 2014.
Gordienko P.S., Yarusova S.B., Shabalin I.A. et al. // Radiochem. 2014. V. 56. № 6. P. 607. [Гордиенко П.С., Ярусова С.Б., Шабалин И.А. и др. // Радиохимия. 2014. Т. 56. № 6. С. 518.] https://doi.org/10.1134/S106636221406005
Gordienko P.S., Shabalin I.A., Suponina A.P. et al. // Russ. J. Inorg. Chem. 2016. V. 61. № 8. P. 946. [Гордиенко П.С., Шабалин И.А., Супонина А.П. и др. // Журн. неорган. химии. 2016. Т. 61. № 8. С. 993.] https://doi.org/10.1134/S003602361608009X
Gordienko P.S., Shabalin I.A., Yarusova S.B. et al. // Russ. J. Phys. Chem. A. 2016. V. 90. № 10. P. 2022. [Гордиенко П.С., Шабалин И.А., Ярусова С.Б. и др. // Журн. физ. химии. 2016. Т. 90. № 10. С. 1534.] https://doi.org/10.1134/S0036024416100125
Баранова О.Ю. Защита водных объектов от техногенных радионуклидов сорбентами на основе опалкристобалитовых пород. Автореф. канд. тех. наук. Екатеринбург, 2006. 19 с.
Сокольницкая Т.А., Авраменко В.А., Бурков И.С. и др. // Журн. физ. химии. 2004. Т. 78. № 3. С. 497.
Авраменко В.А., Бурков И.С., Глущенко В.Ю. и др. // Вестник ДВО РАН. 2002. № 3. С. 7.
Егорин А.М., Сокольницкая Т.А., Тутов М.В. и др. // ДАН. 2015. Т. 460. № 2. С. 177.
Тананаев И.Г., Авраменко В.А. // Журн. Белорус. гос. ун-та. Экология. 2017. № 4. С. 33.
Гордиенко П.С., Шабалин И.А., Ярусова С.Б. и др. // Тез. докл. Всерос. конф. “Химия твердого тела и функциональные материалы” и XII Всерос. симп. “Термодинамика и материаловедение”. СПб, 2018. С. 49.
Ho Y.S., McKay G. // Process Biochem. 1999. V. 34. P. 451.
Дополнительные материалы отсутствуют.
Инструменты
Журнал неорганической химии