Журнал неорганической химии, 2019, T. 64, № 10, стр. 1116-1124
Жидкофазный синтез наночастиц сульфида серебра в пересыщенных водных растворах
1 Институт химии твердого тела УрО РАН
620990 Екатеринбург, ул. Первомайская, 91, Россия
* E-mail: sadovnikov@ihim.uran.ru
Поступила в редакцию 01.03.2019
После доработки 02.04.2019
Принята к публикации 15.04.2019
Аннотация
Порошки и коллоидные растворы сульфида серебра синтезированы химическим осаждением из водных растворов нитрата серебра и сульфида натрия в присутствии цитрата натрия как стабилизатора. Методами рентгеновской дифракции, электронной микроскопии, Брунауэра–Эммета–Теллера и динамического рассеяния света определены размеры наночастиц в осажденных порошках и коллоидных растворах. Изменение концентрации реагентов в реакционных смесях позволило получить нанопорошки со средним размером частиц от ~1000 до ~40–50 нм. Размер наночастиц сульфида серебра в коллоидных растворах составляет 15–20 нм. Установлено качественное соотношение между размером частиц сульфида серебра и пересыщением растворов, использованных для синтеза.
ВВЕДЕНИЕ
Известно, что сульфидные полупроводники при уменьшении размера частиц до нанометрового масштаба изменяют свои физические и химические свойства. Размерный эффект в полупроводниках наиболее явно проявляется на их электронных свойствах, когда размер частиц становится меньше размера экситона [1]. Нанокристаллический сульфид серебра Ag2S [2–5], как и сульфиды ZnS, CdS, PbS, Cu2S, Hg2S [6–10], не только весьма активно изучается, но и уже находит применение. Это связано с возможностью регулирования свойств Ag2S, особенно электронных и оптических, путем изменения размера наночастиц (кристаллитов).
Крупнокристаллический (bulk) сульфид серебра с размером частиц >500 нм является полупроводником с шириной Eg запрещенной зоны ~0.88–0.90 эВ при 300 K [11]. Согласно [12], уменьшение размера частиц сульфида серебра приводит к росту ширины запрещенной зоны, и Eg наночастиц Ag2S размером ~8 нм составляет 2.85 эВ.
Нанокристаллический сульфид серебра получают разными химическими и физическими методами. Согласно [13], для получения наноструктурированных сульфидов серебра наиболее применимы методы синтеза типа “снизу вверх” (bottom-up). Среди них химическое осаждение из водных растворов рассматривается как эффективный способ получения нанокристаллов с контролируемым размером и малой размерной дисперсией [14–16]. Сульфиды Ag2S, CdS, Cu2S, Hg2S, PbS, ZnS почти не растворимы в воде (их произведения растворимости составляют от 10–24 до 10–50), поэтому водные растворы, используемые для осаждения сульфидов, включая Ag2S, являются, как правило, пересыщенными по соответствующему сульфиду. Однако взаимосвязь пересыщения с размером синтезированных наночастиц Ag2S до сих пор никем не обсуждалась.
В настоящей работе обобщены параметры гидрохимического осаждения сульфида серебра в виде нанокристаллических порошков и коллоидных растворов с разным размером наночастиц и впервые сопоставлен размер наночастиц сульфида серебра с пересыщением реакционных смесей, использованных для синтеза.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Порошки и коллоидные растворы сульфида серебра Ag2S синтезировали химическим осаждением из водных растворов нитрата серебра AgNO3, сульфида натрия Na2S и цитрата натрия Na3C6H5O7 (Na3Cit). Синтез проводили при температуре 298 K в темноте. Цитрат натрия не образует комплексов с серебром, но при синтезе играет роль стабилизатора (стабилизирующего агента – stabilizing agent), предотвращающего рост наночастиц. Цитрат натрия является электростатическим стабилизатором. Ион цитрата ${\text{C}}{}_{{\text{6}}}{{{\text{H}}}_{{\text{5}}}}{\text{O}}_{{\text{7}}}^{{{\text{3}} - }}$ имеет три отрицательно заряженных иона кислорода O–. При введении цитрата в водный раствор с частицами сульфида серебра ионы цитрата закрепляются на поверхности частиц одним из ионов O–, тогда как другие два отрицательно заряженных иона направлены в раствор. В результате вокруг каждой частицы сульфида серебра образуется отрицательно заряженный цитратный слой, препятствующий объединению сульфидных частиц и стабилизирующий их размер [17–19].
Поскольку в водных растворах с малым содержанием ионов S2– цитрат натрия может восстанавливать ионы Ag+ с образованием наночастиц металлического серебра, для осаждения сульфида серебра без примеси Ag использовали реакционные смеси с небольшим относительным избытком сульфида натрия Na2S. Осаждение нанокристаллического сульфида серебра происходит в темноте в нейтральной среде при pH ~ 7 по следующей реакционной схеме:
(1)
$\begin{gathered} 2{\text{AgN}}{{{\text{O}}}_{3}} + {\text{N}}{{{\text{a}}}_{2}}{\text{S}}\xrightarrow{{{\text{N}}{{{\text{a}}}_{{\text{3}}}}{{{\text{C}}}_{{\text{6}}}}{{{\text{H}}}_{{\text{5}}}}{{{\text{O}}}_{{\text{7}}}}{\text{ }}}}~ \\ \to {\text{A}}{{{\text{g}}}_{2}}{\text{S}} \downarrow + \,\,2{\text{NaN}}{{{\text{O}}}_{3}}. \\ \end{gathered} $Величину pH растворов контролировали pH-метром Hanna Instruments™ HI73127. Для приготовления исходных растворов и синтеза наночастиц использовали бидистиллированную воду с pH 6.7–6.9. Концентрации реагентов при синтезе коллоидных растворов сульфида серебра настолько малы, что изменение pH водных растворов по сравнению с pH нейтрального растворителя (воды) находится в пределах ошибки измерения pH-метра.
Для синтеза использовали предварительно приготовленные полностью равновесные водные растворы AgNO3, Na2S и Na3Cit. Сначала к 50 мл раствора нитрата серебра приливали 50 мл раствора цитрата натрия (стабилизатора), затем полученный раствор смешивали со 100 мл раствора Na2S. При сливании реагентов реакционная смесь быстро (в течение нескольких секунд) чернеет, указывая на образование раствора, пересыщенного по содержанию сульфида серебра. Затем частицы Ag2S оседают, и раствор в течение 30–60 мин становится прозрачным. Для полноты сульфидизации осадок в течение суток находился в растворе. Осажденный порошок Ag2S не менее 4 раз промывали дистиллированной водой методом декантации, фильтровали и сушили на воздухе при 323 K.
Нанокристаллические порошки Ag2S с размером частиц ≤60 нм осаждали из реакционных смесей с концентрацией AgNO3 и Na2S 50 и 25 ммоль/л соответственно (табл. 1). Концентрация Na3Cit составляла от 5 до 100 ммоль/л. Увеличение концентрации Na3Cit приводит к уменьшению размера частиц Ag2S. Нанопорошок Ag2S с размером частиц <20 нм осадить не удалось, так как наночастицы размером ≤20 нм образуют стабильный коллоидный раствор и не оседают в нем на протяжении нескольких лет. Такие стабильные коллоидные растворы сульфида серебра были получены из реакционных смесей 8–19 с содержанием нитрата серебра ≤2.5 ммоль/л.
Таблица 1.
Состав реакционных смесей, удельная поверхность Ssp порошков, средний размер D частиц сульфида серебра в порошках и коллоидных растворах
| Вид сульфида серебра | № | Концентрация реагентов в реакционной смеси, ммоль /л | Ssp, м2/г | D, нм | |||||
|---|---|---|---|---|---|---|---|---|---|
| в осажденных порошках | в коллоидных растворах |
||||||||
| AgNO3 | Na2S | Na3Cit | БЭТ | рентген | ДРС | ПЭМ | |||
| Крупнокристаллический порошок | 1 | 50 | 200 | 0 | 0.82 ± 0.02 | 1008 | – | – | – |
| 2 | 50 | 500 | 5 | 1.6 ± 0.1 | 515 | – | – | – | |
| 3 | 50 | 100 | 25 | 1.9 ± 0.1 | 430 | – | – | – | |
| 4 | 50 | 50 | 100 | 5.1 ± 0.1 | 163 | 85 ± 7 | – | – | |
| Наночастицы | 5 | 50 | 25.5 | 12.5 | 14.9 ± 0.2 | 56 ± 5 | 46 ± 8 | 55 ± 10 | – |
| 6 | 50 | 25.4 | 25 | 19.0 ± 0.2 | 44 ± 5 | 43 ± 6 | 60 ± 10 | – | |
| 7 | 50 | 25.1 | 100 | 15.6 ± 0.2 | 53 ± 5 | 49 ± 8 | 66 ± 10 | – | |
| Квантовые точки | 8 | 0.3125 | 0.165 | 5 | – | Нет осадка | 2.3 ± 1 | 2–3 | |
| 9 | 0.3125 | 0.168 | 2.5 | – | » | 2.7 ± 1 | 2–3 | ||
| 10 | 0.3125 | 0.170 | 1 | – | » | 3.1 ± 1 | 2–4 | ||
| 11 | 0.625 | 0.313 | 5 | – | » | 4.2 ± 2 | 3–4 | ||
| 12 | 0.625 | 0.325 | 3.75 | – | » | 5.6 ± 2 | 5–6 | ||
| 13 | 2.5 | 1.30 | 1 | – | » | 8.0 ± 2 | 8–10 | ||
| 14 | 1.25 | 0.635 | 1.25 | – | » | 8.2 ± 2 | 8–10 | ||
| 15 | 0.625 | 0.330 | 2.5 | – | » | 9.2 ± 2 | 8–10 | ||
| 16 | 0.625 | 0.335 | 1.25 | – | » | 10.0 ± 2 | 9–11 | ||
| 17 | 2.5 | 1.35 | 2.5 | – | » | 15.0 ± 3 | 11–12 | ||
| 18 | 0.625 | 0.350 | 15 | – | » | 16.0 ± 4 | 10–12 | ||
| 19 | 1.25 | 0.630 | 7.5 | – | » | 17.0 ± 5 | 12–15 | ||
Рентгенодифракционные измерения осажденных порошков проводили в интервале углов 2θ = = 20°–95° с шагом Δ(2θ) = 0.02° на дифрактометре Shimadzu XRD-7000 в CuKα1,2-излучении. Время сканирования в каждой точке составляло 10 с. Структуру синтезированных порошков сульфида серебра уточняли с помощью программного пакета X’Pert HighScore Plus [20]. Средний размер (D) частиц (более точно – средний размер областей когерентного рассеяния) в полученных нанопорошках сульфида серебра находили методом Вильямсона–Холла по уширению дифракционных отражений, используя зависимость приведенного уширения отражений β*(2θ) = [β(2θ)cos θ]/λ от вектора рассеяния s = (2 sin θ)/λ [21, 22]. Для определения уширения β(2θ) экспериментальную ширину на половине высоты FWHMexp каждого дифракционного отражения сравнивали с инструментальной функцией разрешения FWHMR дифрактометра, предварительно измеренной на стандартном образце гексаборида лантана LaB6 (NIST Standart Reference Powder 660a) с периодом решетки a = 0.415692 нм. В хорошо отожженном гомогенном крупнозернистом порошке LaB6 со средним размером частиц 5 мкм отсутствуют причины, вызывающие физическое уширение дифракционных отражений (малый размер частиц, микронапряжения, негомогенность), и наблюдается только инструментальное уширение дифракционных отражений.
Для изучения микроструктуры, размера частиц и элементного химического состава порошков Ag2S использовали сканирующий электронный микроскоп JEOL-JSM LA 6390 с энергодисперсионным рентгеновским анализатором JED 2300 Energy Dispersive X-ray Analyzer и просвечивающий электронный микроскоп JEOL JEM-2010, на котором методом просвечивающей электронной микроскопии (ПЭМ) определяли размер наночастиц сульфида серебра в коллоидных растворах.
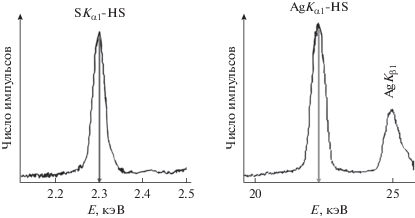
Элементный химический состав синтезированных порошков сульфида серебра определяли также методом рентгеновской флуоресцентной спектроскопии (РФС) на рентгенофлуоресцентном спектрометре S4 EXPLORER (Bruker). Все измерения проводили в вакууме в режиме высокой чувствительности с автоматическим подбором фильтров для возбуждающего излучения. Для измерений использовали таблетки диаметром 18 мм, спрессованные из исследуемого порошка на подложке из амидного воска Licowax C micropowder. Количественное содержание серебра и серы как основных элементов находили по интенсивности линий AgKα1 и SKα1 с энергиями 22.16292 и 2.30784 кэВ, а также линий Kα2 и Kβ1 серебра и серы. Содержание других элементов определяли по интенсивностям линий Kα1, Kα2 и Kβ1 этих элементов.
Средний размер частиц Ag2S оценивали также по величине удельной поверхности синтезированных порошков (Ssp) как D = 6/ρ Ssp (ρ = 7.25 г см–3 – плотность сульфида серебра). Величину удельной поверхности находили экспериментально методом Брунауэра–Эммета–Теллера (БЭТ) на анализаторе удельной поверхности Gemini VII 2390t Surface Area Analyzer.
Размер D наночастиц Ag2S непосредственно в коллоидных растворах определяли методом динамического рассеяния света (ДРС) на приборе Zetasizer Nano ZS (Malvern Instruments Ltd) при температуре 298 K с использованием He-Ne-лазера. Для воспроизводимости результатов размер частиц в каждом растворе измеряли не менее трех раз.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Согласно результатам РФС, содержание серебра и серы в порошках сульфида серебра составляет 79.5 ± 0.5 и 12.0 ± 0.5 мас. % соответственно, что отвечает сульфиду серебра Ag2.00 ± 0.06S1.00 ± 0.03 (рис. 1). Синтезированные порошки содержат также от 0.3 до 0.5 мас. % Na, источником которого является адсорбированный поверхностью порошков цитрат натрия Na3Cit, и ~7.5 мас. % примесного кислорода, также адсорбированного поверхностью сульфидных порошков. Длительный высоковакуумный отжиг порошков уменьшал содержание адсорбированного кислорода до 1.5–2.0 мас. %.
Рис. 1.
Рентгенофлуоресцентный анализ нанопорошка сульфида серебра. Показаны линии SKα1 и AgKα1, зафиксированные при съемке в режиме высокой чувствительности с фильтром CuLiF200. Интенсивности и энергии приведены в логарифмической шкале.
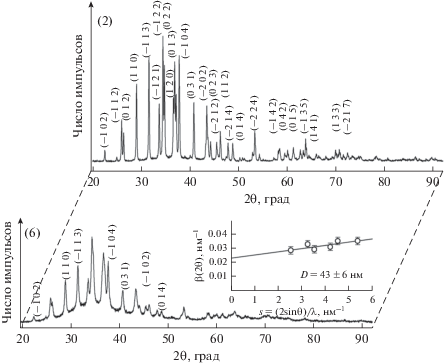
Рентгенограммы порошков сульфида серебра Ag2S, осажденных из реакционных смесей 2 и 6 (табл. 1), показаны на рис. 2 как пример. Pазмер D частиц крупнокристаллических порошков 1–3 находили по величинам измеренных удельных поверхностей Ssp, составивших от ~0.82 до ~1.61 м2/г. Для уточнения кристаллической структуры крупнокристаллического порошка использовали рентгенограмму 2 (рис. 2). Из количественного уточнения рентгенограммы 2 и сравнения с данными [23] следует, что наблюдаемые дифракционные отражения соответствуют однофазному моноклинному (пр. гр. P21/c) стехиометрическому сульфиду серебра со структурой акантита α-Ag2S. Найденные на основе экспериментальных дифракционных данных параметры кристаллической решетки крупнокристаллического моноклинного акантита α-Ag2S равны: a = 0.42264(2), b = 0.69282(3), c = 0.95317(3) нм, β = 125.554(2)○.
Рис. 2.
Рентгенограммы порошков сульфида серебра, осажденных из реакционных смесей 2 и 6 (табл. 1). Крупнокристаллический порошок 2 со средним размером частиц ~500 нм имеет стехиометрический состав Ag2S. Нанопорошок 6 со средним размером частиц ~43 нм является нестехиометрическим и имеет состав ~Ag1.93S. Оба порошка имеют моноклинную (пр. гр. P21/c) структуру типа акантита. Рентгенограммы записаны в излучении CuKα1,2.
По данным энергодисперсионного рентгеновского анализа, содержание Ag и S в просушенном крупнокристаллическом порошке сульфида серебра со средним размером частиц ~500 нм составляет 86.8 ± 0.4 и 12.9 ± 0.1 мас. % соответственно. В пределах ошибки измерений это соответствует стехиометрическому сульфиду Ag2S и согласуется с данными РФС.
Рентгенограммы нанопорошков сульфида серебра со средним размером частиц от ~40 до ~50 нм, осажденных из реакционных смесей 5, 6 и 7, сходны между собой. Как пример на рис. 2 показана рентгенограмма нанопорошка 6. Количественное уточнение рентгенограмм нанопорошков проводили с учетом варьирования заполнения кристаллографических позиций атомами серебра и серы, что позволило заметно повысить сходимость. По результатам ууточнения структуры нанопорошков сульфида серебра и сравнения с данными [24], наблюдаемый набор дифракционных отражений соответствует моноклинному (пр. гр. P21/c) сульфиду серебра, причем координаты атомов Ag и S и параметры элементарной ячейки нанопорошков близки к таковым для крупнокристаллического сульфида Ag2S. Однако степень заполнения кристаллографических позиций 4e атомами серебра Ag(1) и Ag(2) в нанопорошках оказалась несколько <1. В частности, для нанопорошка 6 степень заполнения позиций 4e атомами серебра Ag(1) и Ag(2) равна ~0.97 и ~0.96 соответственно. Это означает, что наночастицы сульфида серебра с размером менее ~50–60 нм содержат вакантные узлы в металлической подрешетке, являются нестехиометрическими и имеют состав ~Ag1.93S. Факторы сходимости Ритвельда составили: RI (RB) = 0.0555, Rp = 0.1165, ωRp = 0.1431. Согласно выполненному расчету, нанокристаллический порошок состава Ag1.93S имеет моноклинную (пр. гр. P21/c) структуру типа акантита со следующими параметрами элементарной ячейки: a = = 0.4234(3), b = 0.6949(3), c = 0.9549(5) нм, β = = 125.43(6)○. Видно, что параметры элементарных ячеек крупнокристаллического и нанокристаллического моноклинных сульфидов серебра немного отличаются.
Выполненное уточнение рентгенограмм показало, что нанопорошки являются нестехиометрическими и имеют состав от Ag1.93S до Ag1.97S. Дифракционные отражения нанопорошков уширены, вследствие чего близко расположенные отражения перекрываются. На вставке к рентгенограмме нанопорошка 6 показана оценка среднего размера D областей когерентного рассеяния по уширению неперекрывающихся дифракционных отражений (–1 0 2), (1 1 0), (−1 1 3), (–1 0 4), (0 3 1) и (0 1 4). Согласно этой оценке, в нанопорошке 6 средний размер D наночастиц равен 43 ± 6 нм. По аналогичным оценкам, в нанопорошках 5 и 7 сульфида серебра средний размер D наночастиц составляет 46 ± 8 и 49 ± 8 нм. Размер наночастиц сульфида серебра, найденный по уширению дифракционных отражений, хорошо согласуется с оценкой размера частиц методом БЭТ (табл. 1).
Средние размеры частиц, найденные методами рентгеновской дифракции и БЭТ, подтверждаются электронно-микроскопическими данными. В качестве примера на рис. 3 приведены изображения крупнокристаллического порошка 2 и нанопорошка 5, полученные с помощью сканирующей (СЭМ) и просвечивающей электронной микроскопии (ПЭМ) соответственно. Размер частиц в крупнокристаллическом порошке 2 составляет 400–500 нм, а в нанопорошке 5 – от 40 до 60 нм.
Рис. 3.
СЭМ-изображение крупнокристаллического порошка 2 (а) и ПЭМ-изображение нанопорошка 5 сульфида серебра (б).

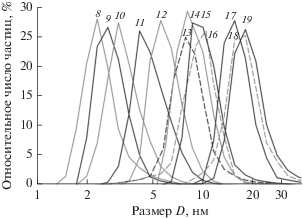
По данным ДРС, размер наночастиц Ag2S в коллоидных растворах 8–19 не превышает 20 нм (рис. 4), и эти наночастицы можно рассматривать как квантовые точки, т.е. частицы, на полупроводниковых свойствах которых могут наблюдаться квантовые размерные эффекты.
Рис. 4.
Размерное распределение частиц сульфида серебра в коллоидных растворах 8–19, измеренное методом ДРС (табл. 1). Размер D представлен в логарифмических координатах.
ПЭМ-изображения коллоидных растворов 13 и 17, показанные как пример на рис. 5, а также приведенные в табл. 1 размеры наночастиц (по данным ПЭМ) подтверждают результаты ДРС-измерений размера наночастиц.
На просвет полученные коллоидные растворы в прямом проходящем свете являются светло-коричневыми и полностью прозрачными, но со стороны выглядят полупрозрачными и голубоватыми, что свидетельствует об их опалесценции. Наблюдаемая опалесценция растворов является следствием флуктуаций плотности, на которых рассеивается свет и которые обусловлены присутствием в растворах малых частиц размером <20 нм.
Стабильность полученных коллоидных растворов можно установить измерениями ζ-потенциала наночастиц в растворе. Признаком электростатической стабильности коллоидных растворов являются абсолютные значения ζ-потенциала, лежащие в пределах от –35 ± 15 до +35 ± 15 мВ. Измерения ζ-потенциала и размера наночастиц методом ДРС показали, что через 3 сут после синтеза растворов 8–19 их ζ-потенциал составлял от –45 до –28 мВ, а размер наночастиц был равен 2–13 нм. Через 100 сут после синтеза ζ-потенциал и размер наночастиц Ag2S почти не изменились. Большая отрицательная величина ζ-потенциала коллоидных растворов 8–19 и ее малое изменение при длительном хранении растворов подтверждают их стабильность.
Сульфид серебра Ag2S имеет одно из наименьших произведений растворимости Ksp, равное 6.3 × × 10–50 при 298 K [25, 26]. Это в ~1023–28 раз меньше, чем произведения растворимости сульфидов кадмия, свинца или цинка, равные 7.9 × 10–27, 2.5 × × 10–27 и 2.5 × 10–22 соответственно [25]. При такой ничтожной растворимости осаждение Ag2S при достаточном содержании Na2S в реакционной смеси происходит очень быстро, за несколько секунд.
Образование сульфида серебра возможно и действительно происходит, если его ионное произведение ${\text{IP}} = a_{{{\text{A}}{{{\text{g}}}^{ + }}}}^{2}{{a}_{{{{{\text{S}}}^{{{\text{2}} - }}}}}} = \gamma _{{{\text{A}}{{{\text{g}}}^{ + }}}}^{2}C_{{{\text{A}}{{{\text{g}}}^{ + }}}}^{2}{{\gamma }_{{{{{\text{S}}}^{{2 - }}}}}}{{C}_{{{{{\text{S}}}^{{2 - }}}}}}$ больше произведения растворимости Ksp. Из-за малой величины произведения растворимости реакционные смеси, использованные для получения порошков и коллоидных растворов с квантовыми точками сульфида серебра, являются пересыщенными по сульфиду серебра. Величину пересыщения Δss, характеризующую превышение ионного произведения соединения над его произведением растворимости, определяют как
(2)
${{\Delta }_{{ss}}} = {{{\text{IP}}} \mathord{\left/ {\vphantom {{{\text{IP}}} {{{K}_{{{\text{sp}}}}}}}} \right. \kern-0em} {{{K}_{{{\text{sp}}}}}}} = \gamma _{{{\text{A}}{{{\text{g}}}^{ + }}}}^{2}C_{{{\text{A}}{{{\text{g}}}^{ + }}}}^{2}{{\gamma }_{{{{{\text{S}}}^{{2 - }}}}}}{{{{C}_{{{{{\text{S}}}^{{2 - }}}}}}} \mathord{\left/ {\vphantom {{{{C}_{{{{{\text{S}}}^{{2 - }}}}}}} {{{K}_{{{\text{sp}}}}}}}} \right. \kern-0em} {{{K}_{{{\text{sp}}}}}}}.$Если ионная сила I раствора больше нуля (I > 0), то при расчете ионного произведения нужно учитывать коэффициенты активности γi соответствующих ионов. Модель учета взаимодействия ионов развита в работе [27]. В ней показано, что коэффициенты γi представляют как
(3)
$\begin{gathered} \ln {{\gamma }_{i}} = \ln \gamma _{i}^{{{\text{DH}}}} + \sum\limits_j {{{\varepsilon }_{{i,j}}}(I){{m}_{j}}} + \\ + \,\,\sum\limits_j {\sum\limits_k {{{c}_{{ijk}}}{{m}_{j}}{{m}_{k}} + ...} } , \\ \end{gathered} $Активность ионов серебра, т.е. долю незакомплексованных ионов серебра, способных вступать в реакцию с ионами серы, можно оценить, используя константы нестойкости разных комплексных форм серебра. В отечественной и зарубежной справочной литературе по аналитической химии нет сведений об образовании комплексов ионов серебра с ионами цитрата. Но в водных растворах серебро образует моно-, ди- и тригидроксокомплексы Ag(OH), ${\text{Ag(OH)}}_{{\text{2}}}^{{{\text{1}} - }}$ и ${\text{Ag(OH)}}_{{\text{3}}}^{{{\text{2}} - }}$ с константами нестойкости K (pK = –lg K): ${{K}_{{11}}} = \frac{{[{\text{Ag(OH)]}}}}{{[{\text{A}}{{{\text{g}}}^{ + }}]{\text{[O}}{{{\text{H}}}^{ - }}]}}$ = 5 × 10–3, ${{K}_{{12}}} = \frac{{\left[ {{\text{Ag(OH)}}_{{\text{2}}}^{{{\text{1}} - }}} \right]}}{{[{\text{A}}{{{\text{g}}}^{ + }}]{{{{\text{[O}}{{{\text{H}}}^{ - }}]}}^{2}}}}$ = 1 × × 10–4 и ${{K}_{{13}}} = \frac{{\left[ {{\text{Ag(OH)}}_{{\text{3}}}^{{{\text{2}} - }}} \right]}}{{[{\text{A}}{{{\text{g}}}^{ + }}]{{{{\text{[O}}{{{\text{H}}}^{ - }}]}}^{3}}}}$ = 6.3 × 10–6 (pK11 = 2.3, pK12 = 4.0, pK13 = 5.2) [25]. Образование гидроксокомплексов снижает количество свободных ионов Ag+ в растворе. Если СAg,Σ = [Ag+] + + [Ag(OH)] + $\left[ {{\text{Ag(OH)}}_{{\text{2}}}^{{{\text{1}} - }}} \right] + \left[ {{\text{Ag(OH)}}_{{\text{3}}}^{{{\text{2}} - }}} \right]$ есть суммарная концентрация всех растворимых форм серебра (свободных ионов серебра и его гидроксокомплексов), то с учетом констант нестойкости после простых преобразований она имеет вид
(4)
$\begin{gathered} {{C}_{{{\text{Ag}},\Sigma }}} = \\ = [{\text{A}}{{{\text{g}}}^{ + }}]\left\{ {1 + {{K}_{{11}}}[{\text{O}}{{{\text{H}}}^{ - }}] + {{K}_{{12}}}{{{[{\text{O}}{{{\text{H}}}^{ - }}]}}^{2}} + {{K}_{{13}}}{{{[{\text{O}}{{{\text{H}}}^{ - }}]}}^{3}}} \right\}. \\ \end{gathered} $В нейтральной среде [OH–] = [H+] = 10–7, поэтому заменяя в (4) концентрации [OH–] на [H+] получим, что в соответствии с (4) концентрация ионов серебра [Ag+], участвующих в образовании Ag2S, равна
(5)
$[{\text{A}}{{{\text{g}}}^{ + }}] = \frac{{{{C}_{{{\text{Ag,}}\Sigma }}}}}{{1 + {{K}_{{11}}}[{{{\text{H}}}^{ + }}] + {{K}_{{12}}}{{{[{{{\text{H}}}^{ + }}]}}^{2}} + {{K}_{{13}}}{{{[{{{\text{H}}}^{ + }}]}}^{3}}}}.$Поскольку осаждение нанокристаллического сульфида серебра происходит в нейтральной среде при pH 7, из (5) получим, что концентрация $[{\text{A}}{{{\text{g}}}^{ + }}] = {{C}_{{{\text{A}}{{{\text{g}}}^{ + }}}}} \approx {{C}_{{{\text{Ag,}}\Sigma }}}.$
В водных растворах ионы серы существуют в форме S2–, HS– и H2S. Согласно диаграмме ионных равновесий в системе S2––H2O, представленной в электронном виде в [28], в области pH 7 долевая концентрация ${{C}_{{{{{\text{S}}}^{{2 - }}}}}}$ ионов S2– составляет ~0.01 от CS,Σ.
Серебро не образует комплексов с цитратом, поэтому в данной работе в уравнении (2) для перехода от концентраций ${{C}_{{{\text{A}}{{{\text{g}}}^{ + }}}}}$ и ${{C}_{{{{{\text{S}}}^{{2 - }}}}}}$ к активностям свободных ионов Ag+ и S2– использовали справочные значения коэффициентов активности.
Ионная сила использованных растворов, оцененная как $I = \frac{1}{2}\sum\nolimits_i {{{C}_{i}}z_{i}^{2}} ,$ где Ci – концентрация соответствующего иона, слабо меняется от 0.03 до 0.12 и в среднем составляет ~0.1. Согласно [25], при такой ионной силе коэффициенты активности равны: ${{\gamma }_{{{\text{A}}{{{\text{g}}}^{ + }}}}}$ = 0.75 и ${{\gamma }_{{{{{\text{S}}}^{{{\text{2}} - }}}}}}$ = 0.38.
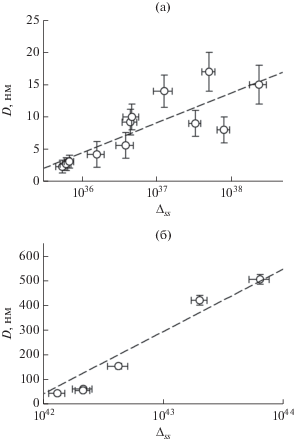
Величины пересыщения Δss, рассчитанные по уравнению (2) с учетом ${{C}_{{{\text{A}}{{{\text{g}}}^{ + }}}}} \approx {{C}_{{{\text{Ag,}}\Sigma }}},$ ${{C}_{{{{{\text{S}}}^{{2 - }}}}}}$ ≈ 0.01CS,Σ, ${{\gamma }_{{{\text{A}}{{{\text{g}}}^{ + }}}}}$ = 0.75 и ${{\gamma }_{{{{{\text{S}}}^{{{\text{2}} - }}}}}}$ = 0.38, являются приближенными, но качественно показывают влияние пересыщения на размер частиц порошков и коллоидных растворов сульфида серебра. Зависимости размера (D) частиц коллоидных растворов и порошков сульфида серебра от пересыщения (Δss) представлены на рис. 6 (пересыщение приведено в логарифмических координатах). Несмотря на большой разброс, видно, что увеличение размера частиц сульфида серебра происходит с ростом пересыщения реакционных смесей.
Рис. 6.
Зависимость размера частиц сульфида серебра в коллоидных растворах (а) и порошках (б) от величины пересыщения Δss исходных реакционных смесей (пересыщение Δss представлено в логарифмических координатах).
Влияние концентрации цитрата натрия как стабилизатора на размер частиц сульфида серебра отчетливо видно на коллоидных растворах с равной концентрацией AgNO3 и меняющейся концентрацией цитрата натрия. Так, в растворах 11, 12, 15 и 16 (табл. 1) снижение концентрации Na3Cit от 5 до 3.75, 2.5 и 1.25 ммоль/л приводит к росту квантовых точек от 4.2 до 5.6, 9.2 и 10.0 нм вследствие уменьшения стабилизирующего эффекта цитрата натрия. То же самое наблюдается на коллоидных растворах 8, 9 и 10. Таким образом, в области концентраций ${{C}_{{{\text{N}}{{{\text{a}}}_{{\text{3}}}}{\text{Cit}}}}}$ ≤ 5 ммоль/л рост концентрации цитрата натрия в реакционной смеси способствует синтезу меньших по размеру частиц сульфида серебра.
ЗАКЛЮЧЕНИЕ
Однофазные порошки сульфида серебра с моноклинной (пр. гр. P21/c) структурой типа акантита α-Ag2S синтезированы методом осаждения из водных растворов нитрата серебра, сульфида натрия и цитрата натрия. Постепенное изменение соотношения между концентрациями реагентов позволяет осаждать частицы Ag2S с заданным средним размером от ~1000 до 40–50 нм. Сульфид серебра с размером частиц >100 нм имеет стехиометрический состав Ag2S, а нанокристаллический сульфид серебра с размером частиц <60 нм содержит структурные вакансии в металлической подрешетке, т.е. является нестехиометрическим и имеет состав Ag1.93–1.97S.
Водные коллоидные растворы квантовых точек сульфида серебра с размером от 2–3 до 15–20 нм сохраняют стабильность более 3 лет.
Размер частиц сульфида серебра в порошках и коллоидных растворах связан с пересыщением исходных реакционных смесей по содержанию ионов серебра и серы. В области малых концентраций рост содержания цитрата натрия в реакционной смеси стабилизирует наночастицы и способствует синтезу меньших по размеру частиц сульфида серебра.
Список литературы
Schaefer H.-E. Nanoscience. The science of the Small in Physics, Engineering, Chemistry, Biology and Medicine. Heidelberg–Dordrecht–N.Y.: Springer, 2010. 772 p. https://doi.org/10.1007/978-3-642-10559-3
Tang A., Wang Yu., Ye H. et al. // Nanotechnology. 2013. V. 24. № 35. P. 355602. https://doi.org/10.1088/0957-4484/24/35/355602
Sadovnikov S.I., Gusev A.I. // J. Mater. Chem. A. 2017. V. 5. № 34. P. 17 676. https://doi.org/10.1039/C7TA04949H
Sadovnikov S.I., Rempel A.A., Gusev A.I. // Russ. Chem. Rev. 2018. V. 87. № 4. P. 303. [Садовников С.И., Ремпель А.А., Гусев А.И. // Успехи химии. 2018. Т. 87. № 4. С. 303. dx.doi.org/https://doi.org/10.1070/RCR4803locatt=label:RUSSIAN]10.1070/RCR4803
Zhang Y., Liu Y., Li C. et al. // J. Phys. Chem. C. 2014. V. 118. № 9. P. 4918. https://doi.org/10.1021/jp501266d
Goel S., Chen F., Cai W. // Small. 2013. V. 10. № 4. P. 631. https://doi.org/10.1002/smll.201301174
Shi X., Zheng S., Gao W. et al. // J. Nanopart. Res. 2014. V. 16. № 12. P. 2741. https://doi.org/10.1007/s11051-014-2741-3
Sadovnikov S.I., Gusev A.I., Rempel A.A. // Russ. Chem. Rev. 2016. V. 85. № 7. P. 731. [Садовников С.И., Гусев А.И., Ремпель А.А. // Успехи химии. 2016. Т. 85. № 7. С. 731. dx.doi.org/https://doi.org/10.1070/RCR4594?locatt=label:RUSSIAN]10.1070/RCR4594
Sadovnikov S.I., Gusev A.I. // J. Alloys Compd. 2014. V. 610. P. 196. http://dx.doi.org/10.1016/j.jallcom.2014.04.220
Hoang H.Y., Akhmadullin R.M., Akhmadullina F.Yu. et al. // Russ. J. Inorg. Chem. 2018. V. 63. № 2. P. 256. [Хоанг Х.И., Ахмадуллин Р.М., Ахмадуллина Ф.Ю. и др. // Журн. неорган. химии. 2018. № 2. С. 245. https://doi.org/10.7868/S0044457X18020174]https://doi.org/10.1134/S0036023618020109
Junod P. // Helv. Phys. Acta. 1959. V. 32. № 6–7. P. 567.
Chen R., Nuhfer N.T., Moussa L. et al. // Nanotechnology. 2008. V. 19. № 45. P. 455 604. https://doi.org/10.1088/0957-4484/19/45/455604
Rempel A.A. // Russ. Chem. Rev. 2007. V. 76. № 5. P. 435. doi.org/ [Ремпель А.А. // Успехи. химии. 2007. Т. 76. № 5. С. 474.]https://doi.org/10.1070/RC2007v076n05ABEH003674
Марков В.Ф., Маскаева Л.Н., Иванов П.Н. Гидрохимическое осаждение пленок сульфидов металлов: моделирование и эксперимент. Екатеринбург: Изд-во УрО РАН, 2006. 217 с. ISBN 5-7691-1766-4
Kwon S.G., Hyeon T. // Accounts Chem. Res. 2008. V. 41. № 12. P. 1696. https://doi.org/10.1021/ar8000537
Panasyuk G.P., Kozerozhets I.V., Semenov E.A. et al. // Russ. J. Inorg. Chem. 2018. V. 63. № 10. P. 1303. [Панасюк Г.П., Козерожец И.В., Семенов Е.А. и др. // Журн. неорган. химии. 2018. № 10. С. 1286.]https://doi.org/10.1134/S0036023618100157
Chen R., Nuhfer N.T., Moussa L. et al. // Nanotechnology. 2008. V. 19. № 45. Paper 455 604. https://doi.org/10.1088/0957-4484/19/45/455604
Xiong S., Xi B., Zhang K. et al. // Sci. Rep. 2013. V. 3. Paper 2177. https://doi.org/10.1038/srep02177
Zhang W., Zhang L., Hui Z. et al. // Solid. State Ionics. 2000. V. 130. № 1–2. P. 111. https://doi.org/10.1016/S0167-2738(00)00497-5
X’Pert HighScore Plus. Version 2.2e (2.2.5). PANalytical B. V. Almedo, the Netherlands.
Williamson G.K., Hall W.H. // Act. Metal. 1953. V. 1. № 1. P. 22.
Гусев А.И. Наноматериалы, наноструктуры, нанотехнологии. М.: Физматлит, 2009. 416 с. ISBN 978-5-9221-0582-8
Sadovnikov S.I., Gusev A.I., Rempel A.A. // Superlatt. Microstr. 2015. V. 83. P. 35.https://doi.org/10.1016/j.spmi.2015.03.024
Sadovnikov S.I., Gusev A.I., Rempel A.A. // Phys. Chem. Chem. Phys. 2015. V. 17. № 19. P. 12 466. https://doi.org/10.1039/C5CP00650C
Лурье Ю.Ю. Справочник по аналитической химии. М.: Химия, 1967. 390 с.
Patnaik P. Dean’s Analytical Chemistry Handbook. N.Y.: McGraw-Hill, 2004. 1280 p. ISBN: 978-0071410601
Activity Coefficients in Electrolyte Solutions / Ed. Pitzer K.S. Boca Raton: CRC Press, 1991. P. 75.
http://www.novedu.ru/calc/fm-s.htm
Дополнительные материалы отсутствуют.
Инструменты
Журнал неорганической химии



