Журнал неорганической химии, 2019, T. 64, № 1, стр. 31-37
Новые перфторкарбоксилатные комплексы Pt(IV): синтез, строение и реакционная способность по отношению к алканам и циклоалканамИ. П. Столяров, Н. В. Черкашина, А. В. Чураков, А. В. Наумкин, А. Б. Корнев, А. В. Черняк, В. М. Мартыненко
И. П. Столяров 1, *, Н. В. Черкашина 1, А. В. Чураков 1, А. В. Наумкин 2, А. Б. Корнев 3, А. В. Черняк 3, В. М. Мартыненко 3
1 Институт общей и неорганической химии им. Н.С. Курнакова РАН
11991 Москва, Ленинский пр-т, 31, Россия
2 Институт элементоорганических соединений им. А.Н. Несмеянова РАН
119334 Москва, ул. Вавилова, 28, Россия
3 Институт проблем химической физики РАН
142432
Московской обл., Черноголовка, пр-т Академика Семенова,1, Россия
* E-mail: stolarov-igic.ras@rambler.ru
Поступила в редакцию 26.12.2017
После доработки 04.07.2018
Принята к публикации 31.12.2017
Аннотация
Синтезированы и исследованы новые перфторкарбоксилатные комплексы Pt(IV) состава [Pt(RFCOO)4]n и M2[Pt(RFCOO)6] (RF = CF3, C2F5; M = Li, Na, K, Rb, Cs, NMe4), которые являются сильными окислителями, способными в мягких условиях окислять алканы в среде трифторуксусной кислоты с образованием сложных эфиров трифторуксусной кислоты и выступать в роли катализаторов окислительного трифторацетоксилирования алканов, циклоалканов и каркасных соединений. Они также могут служить исходными соединениями для синтеза других перфторкарбоксилатных комплексов платины в различных степенях окисления. Строение (NMe4)2[Pt(CF3COO)6] · 6CF3COOH установлено методом РСА.
ВВЕДЕНИЕ
Ранее были подробно изучены ацетатные комплексы Pt(II) и Pt(III) [1–4], однако химия перфторкарбоксилатных комплексов платины до недавнего времени исчерпывалась единственным структурно исследованным соединением – трифторацетатом Pt(II). Структура трифторацетата Pt(II) (Pt4(CF3COO)8) была установлена еще в 1994 г. [5]. Для его получения смесь Na2[Pt(OH)6], трифторуксусной и муравьиной кислот длительно нагревали при 72°С до появления следов металлической платины. По-видимому, сначала в результате кислотно-основной реакции образуется промежуточный продукт – трифторацетатный комплекс Pt(IV), который затем восстанавливается до конечного продукта. Действительно, ранее методом спектроскопии ЯМР 195Pt было установлено, что в растворе гидроксокомплекса Н2[Pt(OH)6] в безводной CF3COOH присутствуют трифторацетат Pt(IV) цис-Pt(CF3COO)4(H2O)2, комплексные ионы [Pt(CF3COO)5(H2O)]– и [Pt(CF3COO)3(H2O)3]+ [6]. Нам удалось выделить индивидуальные перфторкарбоксилатные комплексы Pt(IV) из продуктов реакции гидроксокомплексов Pt(IV) с избытком низших перфторкарбоновых кислот в отсутствие восстановителя в соответствии с уравнениями:
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Гидроксокомплексы K2[Pt(OH)6] и Н2[Pt(OH)6] получали согласно [7] и [8] соответственно. Использовали ледяную уксусную кислоту марки “х. ч.” (Химмед) и перфторкарбоновые кислоты CF3COOH (99%, Alfa Aesar GmbH, Германия) и C2F5COOH (97%, Feinchemikalien und Forschungsbedarf GmbH, Германия). Перфторкарбоксилаты щелочных металлов получали взаимодействием соответствующих карбонатов M2CO3 (х. ч.) с кислотами RFCOOH. Трифторацетат тетраметиламмония получали взаимодействием водного раствора гидроксида тетраметиламмония (РЕАХИМ, СССР) с CF3COOH и осаждали кристаллическую соль ацетоном. Элементный анализ на C, H, N в полученных соединениях проводили на CHN-анализаторе ЕА3000 (Евровектор, ЕС). Содержание платины определяли гравиметрически после восстановления комплексов в растворе водородом. ИК-спектры нарушенного полного внутреннего отражения (НПВО) полученных соединений в области 4000–500 см–1 регистрировали на спектрофотометре фирмы Nikolet (Франция) с приставкой для съемки спектров НПВО. Масс-спектры комплексов в растворах получали методом электроспрея на масс-спектрометре Shimadzu LCMS-2020 (Shimadzu Scientific Instruments, Kyoto, Japan). Образцы растворяли в ацетонитриле, высушенном над молекулярными ситами 4 Å (J.T. Baker, Phillipsburg, USA) непосредственно перед анализом, или в ледяной уксусной кислоте (Sigma-Aldrich, ACS reagent) до достижения концентрации ~0.1 мг/мл. Растворы комплексов с помощью микрошприца вводили непосредственно в масс-спектрометр. Температура испарителя составляла 150°C, соединительной линии – 200°C. Для распыления раствора и осушки использовали азот (1.5 и 10 л/мин соответственно). Напряжение для ионизации – 3.0 кВ для положительных ионов и –3.0 кВ для отрицательных ионов. Диапазон масс-спектров 200–2000 m/z. Для анализа полученных результатов использовали программное обеспечение Shimadzu LabSolutions.
Спектры ЯМР 1H, 13C, 19F и 195Pt регистрировали на спектрометре высокого разрешения AVANCE III 500 MГц фирмы Bruker (Германия) с рабочими частотами 500, 126, 471 и 108 МГц соответственно. Все спектры снимали с растворов в CD3CN при температуре 22 ± 1°С. Калибровку шкалы химических сдвигов для спектров ЯМР 1Н и 13С проводили по сигналам растворителя (δ(CD2HCN) = = 1.94 м. д. для 1Н и δ(CD3CN) = 1.32 м. д. для 13С), для спектров ЯМР 19F – с использованием внутреннего стандарта (δ(C6F6) = –162.2 м. д.).
Рентгеноструктурный анализ выполнен на дифрактометре Bruker SMART APEX II при температуре 173 K c использованием MoKα-излучения (графитовый монохроматор, λ = 0.71073 Å). Учет поглощения проводили на основании измерений интенсивности эквивалентных отражений [9]. Структура расшифрована прямым методом и уточнена анизотропным полноматричным МНК по F 2 для всех неводородных атомов [10]. Все ‒CF3-группы ротационно неупорядочены по трем или четырем положениям. Их уточнение проводили с наложением ограничений на расстояния C–F и F…F. Все атомы водорода были помещены в рассчитанные положения и уточнены с использованием модели “наездника”. Кристаллы C32H30F36N2O24Pt (M = 1705.67) тригональные, a = 15.0054(5), c = 47.414(2) Å, V = 9245.6(6) Å3, пр. гр. R3c, Z = 6, ρc = 1.838 г/см3, F(000) = 4980, μ(MoKα) = 2.457 мм–1. Всего собрано 30187 отражений, из них 2484 независимых, Rint = 0.0283. Окончательные факторы расходимости: R1 = = 0.0440, wR2 = 0.1680 для 1997 отражений с I > > 2σ(I) и 0.0516, 0.1787 по всем данным для 274 параметров.
Кристаллографические данные депонированы в Кэмбриджском банке структурных данных под номером 1029288. РСА проведен в ЦКП ИОНХ РАН.
Идентификацию органических продуктов окисления алканов в реакциях с участием трифторацетатных комплексов Pt(IV) проводили на хроматомасс-спектрометре серии 6890 с масс-селективным детектором 5973 фирмы Agilent (США) без предварительного выделения комплексов из смеси.
СИНТЕЗ ПЕРФТОРКАРБОКСИЛАТНЫХ КОМПЛЕКСОВ Pt(IV)
K2[Pt(CF3COO)6]. Кристаллический гидроксоплатинат калия K2[Pt(OH)6] (0.3753 г, 1 ммоль) нагревали в круглодонной колбе с обратным холодильником с 10 мл трифторуксусной кислоты в течение 15 мин. Осадок гидроксосоединения при кипячении полностью растворялся с образованием желто-оранжевого раствора. Бóльшую часть трифторуксусной кислоты из раствора удаляли в вакууме 30 Торр при 60°С, остатки кислоты удаляли из полученного оранжевого “масла” при высушивании в вакуум-эксикаторе. В вакууме над KOH получено твердое желтое вещество, состав которого отвечает формуле K2[Pt(CF3COO)6]. Выход количественный.
ИК-спектр НПВО приведен в табл. 1, масс-спектр (электрораспыление в MeCN) – в табл. 2. Данные спектроскопии ЯМР:
Таблица 1.
ИК-спектры НПВО комплексов Pt(IV)
| Соединение | νas(СОО–), см–1 | νs(СОО–), см–1 | ν(C–F), см–1 |
|---|---|---|---|
| Li2[Pt(CF3COO)6] | 1679, 1629 | 1405 | 1143 |
| Li2[Pt(C2F5COO)6] | 1683, 1640 | 1390 | 1315, 1213, 1183,1148, 1132 |
| K2[Pt(CF3COO)6] | 1729, 1703 | 1379 | 1130 |
| K2[Pt(C2F5COO)6] | 1732, 1706 | 1370 | 1314, 1214, 1183, 1026 |
| Na2[Pt(CF3COO)6] | 1730, 1648 | 1378 | 1138 |
| Na2[Pt(C2F5COO)6] | 1732, 1660 | 1372 | 1318,1215, 1150, 1130 |
| Rb2[Pt(CF3COO)6] | 1729, 1712 | 1379 | 1127 |
| Rb2[Pt(C2F5COO)6] | 1730, 1718 | 1370 | 1316, 1212, 1148, 1028 |
| Cs2[Pt(CF3COO)6] | 1729, 1676 | 1376 | 1136 |
| Cs2[Pt(C2F5COO)6] | 1732, 1684 | 1371 | 1315, 1214, 1150, 1030 |
| (NMe4)2[Pt(CF3COO)6] | 1722, 1698 | 1390 | 1143 |
| (NMe4)2[Pt(C2F5COO)6] | 1725, 1670 | 1418 | 1314, 1216, 1152, 1026 |
| Pt(CF3COO)4 | 1680 | 1394 | 1140 |
| Pt(C2F5COO)4 | 1706, 1608 | 1370 | 1317, 1213, 1180, 1149, 1029 |
Таблица 2.
Масс-спектры соединений, полученные методом электрораспыления в ацетонитриле
| Соединение | Масса, формула и заряд иона |
|---|---|
| Pt(CF3COO)4 | 664, Pt(CF3COO)4(OH)– 682, Pt(CF3COO)4(H2O)(OH)– 778, Pt(CF3COO)5(H2O)– 1215, Pt2(CF3COO)7$\left( {{\text{OH}}} \right)_{2}^{ - }$ 1365, Pt2(CF3COO)8(H2O)3(OH)– 1592, Pt3(CF3COO)8(H2O)$\left( {{\text{OH}}} \right)_{5}^{ - }$ 1595, Pt3(CF3COO)8(H2O)4$\left( {{\text{OH}}} \right)_{2}^{ - }$ 1689, Pt3(CF3COO)8(H2O)2$\left( {{\text{OH}}} \right)_{3}^{ - }$ |
| Pt(C2F5COO)4 | 882, Pt(C2F5COO)4(OH)(H2O)– 1028, Pt(C2F5COO)5(H2O)– |
| K2Pt(CF3COO)6 | 1931, K3Pt(CF3COO)6(MeCN)+ 912, KPt(CF3COO)6– 1064, K2Pt$\left( {{\text{C}}{{{\text{F}}}_{{\text{3}}}}{\text{COO}}} \right)_{7}^{ - }$ |
| K2Pt(C2F5COO)6 | 556, Pt(OH)$\left( {{{{\text{C}}}_{{\text{2}}}}{{{\text{F}}}_{{\text{5}}}}{\text{COO}}} \right)_{2}^{ + }$ 864, Pt(C2F5COO)4(OH)– 1212, KPt$\left( {{{{\text{C}}}_{{\text{2}}}}{{{\text{F}}}_{{\text{5}}}}{\text{COO}}} \right)_{6}^{ + }$ 1769, KPt2(OH)2(C2F5COO)7(MeCN)– |
| [NMe4]2Pt(CF3COO)6 | 1095, [NMe4]3Pt(CF3COO)6(MeCN)+ 664, Pt(CF3COO)4(OH)– 947, [NMe4]Pt$\left( {{\text{C}}{{{\text{F}}}_{{\text{3}}}}{\text{COO}}} \right)_{6}^{ - }$ |
1H: (500 MГц, CD3CN, 23°C, δ(CD2HCN) = = 1.94): δ 10.72 (CF3COOH).
13C: (126 MГц, CD3CN, 23°C, δ(CD3CN) = = 1.32): 162.8 (m; 2J(13C,19F) = 37.9 Гц, 2J(13C,195Pt) = = 21.1 Гц; COOPt); 159.6 (q; 2J(13C,19F) = 40.2 Гц; COOH); 116.4 (q; 1J(13C,19F) = 286.5 Гц; CF3COOH); 112.9 (m; 1J(13C,19F) = 289.5 Гц, 3J(13C,195Pt) = 68.1 Гц; CF3COOPt).
19F: (471 MГц, CD3CN, 23°C, δ(C6F6) = –162.2): δ –72,05 (m; 4J(19F,195Pt) = 10.6 Гц; CF3COOPt); –74,55 (s; CF3COOH).
195Pt: (108 MГц, CD3CN, 23°C): δ 3780.
[Pt(CF3COO)4]n. Осажденный из водного раствора гидрат диоксида платины PtO2 ⋅ nH2O (H2Pt(OH)6) тщательно промывали метилацетатом или ацетоном и высушивали в вакууме над KOH. Освобожденный от избытка адсорбированной воды гидрат диоксида платины PtO2 ⋅ nH2O (0.280 г, 1 ммоль) нагревали в круглодонной колбе с обратным холодильником с 10 мл трифторуксусной кислоты в течение 15 мин. Осадок гидроксосоединения при кипячении почти полностью растворялся с образованием желто-оранжевого раствора, небольшой осадок удаляли фильтрованием через стеклянный пористый фильтр. Бóльшую часть трифторуксусной кислоты из раствора удаляли в вакууме 30 Торр при 60°С, остатки кислоты из полученного оранжевого “масла” удаляли при выдерживании в вакуум-эксикаторе. В вакууме над KOH получено оранжевое твердое вещество, состав которого отвечает формуле Pt(CF3COO)4. Выход количественный.
ИК-спектр НПВО приведен табл. 1, масс-спектр (электрораспыление в MeCN) – в табл. 2. Масс-спектр, содержащий ионы с двумя и тремя атомами платины, свидетельствует об олигомерном строении соединения [Pt(CF3COO)4]n, n ≥ 3.
По аналогичной методике получали соединение Pt(C2F5COO)4.
(NMe4)2[Pt(CF3COO)6]. Навеску 0.200 г Pt(CF3COO)4 и 0.230 г [NMe4]OCOCF3 растворяли в 5 мл CF3COOH при нагревании с обратным холодильником до ~100°C. Полученный бледно-желтый раствор с небольшой взвесью фильтровали через стеклянный пористый фильтр и удаляли бóльшую часть кислоты в вакууме при 60°С. Остатки кислоты удалялись при хранении полученного вязкого “масла” в вакуум-эксикаторе над KOH. Получено желтое гигроскопичное твердое вещество, состав которого отвечает формуле (NMe4)2[Pt(CF3COO)6]. Выход 95%. Вещество растворимо в метилацетате и нитрометане, нерастворимo в хлороформе. ИК-спектр НПВО приведен в табл. 1, масс-спектр (электрораспыление в MeCN) – в табл. 2. Из раствора в трифторуксусной кислоте в холодильнике получены монокристаллы, пригодные для РСА, который подтвердил ожидаемое строение соединения: молекула состоит из октаэдрического аниона Pt(CF3COO)6 и двух катионов ${\text{NMe}}_{4}^{ + }.$ По аналогичной методике получены и другие комплексы состава M2[Pt(CF3COO)6], где M = K, Na, Li, Rb, Cs.
K2[Pt(C2F5COO)6]. Кристаллический гидроксоплатинат калия K2[Pt(OH)6] (0.1640 г, 0.44 ммоль) нагревали до кипения в круглодонной колбе с обратным холодильником с 10 мл пентафторпропионовой кислоты в течение 30 мин. Осадок гидроксосоединения в ходе реакции полностью растворялся с образованием желто-коричневого раствора. Бóльшую часть пентафторпропионовой кислоты из раствора удаляли в вакууме при 60°С. Полученное “масло” растворяли в 10 мл перфторбензола, растворитель отгоняли в вакууме при 60°С. Остатки кислоты удаляли из полученного твердого продукта при высушивании в вакуум-эксикаторе. В вакууме над KOH получено желто-оранжевое вещество состава K2[Pt(C2F5COO)6]. Выход количественный (0.4100 г). После переосаждения из смеси эфир-пентан (1 : 1) и высушивания в вакууме продукт получен в виде желтого порошка.
ИК-спектр НПВО приведен в табл. 1, масс-спектр (электрораспыление в MeCN) – в табл. 2. При хранении на воздухе продукт, не изменяя своей окраски, постепенно гидролизуется с образованием K2[PtO(C2F5COO)4], который превращается в исходное соединение при растворении в пентафторпропионовой кислоте.
Реакции окисления циклогексана, адамантана и н-алканов под действием трифторацетата Pt(IV) проводили в запаянных стеклянных ампулах, содержащих 20 мг трифторацетата Pt(IV), 0.40 мл CF3COOH и 40–50 мг соответствующих углеводородов, в течение 0.5–2 ч при 100°С. Каталитические реакции окисления углеводородов проводили в запаянных стеклянных ампулах с трифторнадуксусной кислотой, которую получали in situ взаимодействием трифторуксусного ангидрида с 50%-ной Н2О2 при охлаждении. К 0.40 мл смеси трифторнадуксусной и трифторуксусной кислот добавляли 20 мг K2[Pt(CF3COO)6] или [Pt(CF3COO)4]n и 0.050 мл углеводорода, затем ампулу запаивали и оставляли при 20°С на 16–24 ч. При комнатной температуре без перемешивания содержимое ампул постепенно становилось однофазным: слой углеводорода в ампуле уменьшался и полностью исчезал за 17–24 ч в результате окисления алкана с образованием вторичных алкилтрифторацетатов (последние растворялись в трифторуксусной кислоте). При этом каталитически активный комплекс Pt(IV) не разрушался – раствор оставался светло-желтым. В реакционной смеси методом хроматомасс-спектрометрии обнаруживали те же продукты, что и в реакциях стехиометрического окисления алканов под действием соединений Pt(IV), и следы исходных алканов.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Гидроксокомплексы Pt(IV) K2[Pt(OH)6] (I) и H2[Pt(OH)6] (II) (часто обозначаемый как PtO2 · ⋅ 4H2O) легко растворяются в кипящей трифторуксусной кислоте с образованием желто-оранжевых растворов, из которых после удаления кислоты при нагревании в вакууме были получены оранжевые соединения К2[Pt(CF3COO)6] (IIIa) и [Pt(CF3COO)4]n (IVa). Полученные комплексы устойчивы при 20оС, но гигроскопичны. Они растворяются в полярных растворителях (перфторкарбоновые и карбоновые кислоты, ацетонитрил, метилацетат, ацетон), но устойчивы лишь в некоторых их них.
Аналогичные реакции проведены с перфторпропионовой кислотой при температуре 70°С, в результате получены оранжевые комплексы [Pt(C2F5COO)4]n (IVб) и K2[Pt(C2F5COO)6] (IIIб). Последнее соединение оказалось светочувствительным. Перфторбутиратные комплексы Pt(IV) из реакционной смеси после обработки гидроксокомплексов Pt(IV) н-перфтормасляной кислотой выделить в твердом виде не удалось: они легко разлагаются. Под действием метилацетата, спирта или диэтилового эфира все эти соединения восстанавливаются до “платиновых синей” – перфторкарбоксилатных соединений платины в смешанной степени окисления +3.
Все полученные соединения Pt(IV) и продукты их восстановления могут быть использованы для получения других перфторкарбоксилатных комплексов Pt(IV). Взаимодействием IV с трифторацетатами щелочных металлов и тетраметиламмония в среде CF3COOH получены комплексы M2[Pt(CF3COO)6] (IIIв–IIIe, M = Li, Na, Rb, Cs соответственно) и кристаллический комплекс (NMe4)2[Pt(CF3COO)6] · 6CF3COOH (IIIж):
Комплекс K2[Pt(CF3COO)6] · 2CF3COOH был изучен методом спектроскопии ЯМР на ядрах 1H, 13С, 19F, 195Pt. Спектры подтверждают химическое строение и высокую чистоту полученного комплексного соединения.
В спектрах протонного магнитного резонанса присутствует один широкий синглет при 10.72 м. д., принадлежащий кислым протонам остаточной CF3COOH. В спектрах на ядрах 13С и 19F наблюдаются сигналы атомов углерода и фтора, принадлежащих одному типу трифторацетатных групп и участвующих в спин-спиновом взаимодействии с атомами 19F и 195Pt, а также сигналы несвязанной трифторуксусной кислоты. Наличие магнитного взаимодействия 13С–195Pt и 19F–195Pt подтверждает нахождение трифторацетатных групп во внутренней сфере комплексного аниона. Сигнал в спектре ЯМР 195Pt при 3780 м. д. находится в области, характерной для Pt4+, но не для платины в других степенях окисления [11].
Растворы K2[Pt(CF3COO)6] · 2CF3COOH в ацетонитриле-d3 сохраняли стабильность в течение нескольких дней, в то время как растворы (NMe4)2[Pt(CF3COO)6] · 6CF3COOH в том же растворителе быстро разлагались (вероятно, из-за окисления органического катиона), что не позволяло исследовать их методом ЯМР.
Взаимодействием IV с пиридином (L) и о-фенантролином (L2) получены оранжевые комплексы PtL2(CF3COO)4:
Комплекс IIIa реагирует с соляной кислотой с образованием малорастворимого гексахлороплатината калия:
Полученные соединения охарактеризованы данными химического анализа, ИК-спектров НПВО (табл. 1), спектров ЯМР и масс-спектров, полученных методом электроспрея в растворах (табл. 2). Полимерная природа IV подтверждена масс-спектрами в ацетонитриле. Строение IIIв установлено методом РСА (рис. 1).
Рис. 1.
Дианион [Pt(O2CCF3)6 · 6CF3CO2H]2– в структуре III. Представлены только мажорные компоненты неупорядоченности –CF3-групп. Водородные связи показаны пунктиром. Избранные длины связей и углы: Pt(1)–O(1) 1.995(4), O(1)–C(1) 1.291(5), O(2)–C(1) 1.205(5) Å, OPtO 82.4(2)° и 97.6(2)°, C(1)O(1)Pt(1) 122.6(3)°, O(2)…O(4A) 2.689(6) Å.
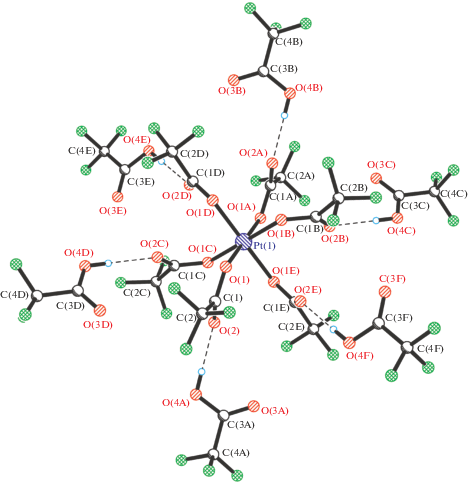
Структура содержит катионы ${\text{NMe}}_{4}^{ + }$, анионы ${\text{Pt}}\left( {{{{\text{O}}}_{{\text{2}}}}{\text{CC}}{{{\text{F}}}_{3}}} \right)_{6}^{{2 - }}$ и сольватные молекулы CF3CO2H. Катион расположен на оси третьего порядка. Атом Pt занимает частное положение 3, таким образом, только один карбоксилатный лиганд является кристаллографически независимым. Атом металла имеет немного искаженную октаэдрическую координацию. Карбоксилатные лиганды монодентатны и образуют почти идеальные углы Pt1O1C1 122.6(3)°. Некоординированные атомы О(2) вовлечены в относительно сильные водородные связи с сольватными молекулами CF3CO2H, образуя супрамолекулярный дианион [Pt(O2CCF3)6 · · 6CF3CO2H]2– (рис. 1). Трифторметильные группы лигандов ротационно неупорядочены по четырем положениям с соотношением заселенностей 0.40/0.37/0.13/0.10. Трифторметильные группы сольватной кислоты также неупорядочены по трем положениям с соотношением заселенностей 0.39/0.34/0.27. Насколько нам известно, соединение III – первый пример гомолептического карбоксилатного комплекса Pt(IV).
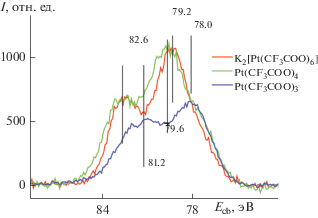
Рентгеноэлектронная спектроскопия (РЭС) была использована нами на начальном этапе работы для определения степени окисления платины в полученных соединениях. По данным РЭС, степень окисления платины в комплексах III и IV равна +4, а в платиновых синях состава Pt(RFCOO)3 близка к +3 (рис. 2).
На рис. 2 представлены фотоэлектронные спектры Pt4f7/2 исследованных образцов, а в табл. 3 – данные по энергиям связи, из которых, согласно [12], следует, что атомы Pt находятся как в состоянии Pt(IV), так и в состоянии Pt(III), что является результатом частичного разложения соединения под действием рентгеновского излучения во время регистрации спектров.
Таблица 3.
Энергии связи в неорганических соединениях платины
| Соединение | Есв(Pt4f7/2), эВ |
|---|---|
| K2PtF6 | 77.8 |
| K2PtCl6 | 75.7 |
| K2Pt(OH)6 | 75.3 |
| K2Pt(CF3COO)6 | 79.2 |
| [Pt(CF3COO)4]n | 79.6 |
| Pt(CF3COO)3 | 78.0 |
| Pt4(CF3COO)8 | 73.9 |
Реакционная способность полученных комплексов Pt(IV) интересовала нас не только в связи с возможностью получения новых перфторкарбоксилатных комплексов платины, но и для использования в реакции окислительной функционализации алканов RH в растворах комплексов Pt(II) и Pt(IV) (реакция Шилова). В водных растворах хлорокомплексов эта реакция приводит к образованию алкилхлоридов RCl и спиртов ROH [13], а в водной CF3COOH – к образованию смеси алкилхлоридов, спиртов и алкилтрифторцетатов ROCOCF3 [14]. В присутствии п‑бензохинона и CuCl2 медленно протекает каталитическая реакция окисления алканов [15]. Замена сравнительно инертных хлорокомплексов платины на лабильные трифторацетатные в этой реакции должна привести к увеличению скорости реакции и к образованию алкилтрифторацетатов в качестве основных продуктов. В отличие от спиртов, последние устойчивы к дальнейшему окислению, группа CF3COO применяется в органической химии для этерификации гидроксильной группы спиртов от окисления [16]. Получение алифатических спиртов путем гидролиза сложных эфиров трифторуксусной кислоты, образующихся при каталитическом окислении алканов, имеет явные преимущества перед гидролизом алкилхлоридов, образующихся при прямом хлорировании алканов или в реакции Шилова с участием хлорокомплексов платины.
Наши опыты показали, что трифторацетатные комплексы Pt(IV) в мягких условиях легко окисляют насыщенные алканы нормального строения, а также циклоалканы и адамантан в среде CF3COOH с образованием соответствующих трифторацетатов. Из углеводородов нормального строения образуется смесь трифторацетатов вторичных спиртов, из циклогексана – циклогексил-трифторацетат, из адамантана – 1-адамантилтрифторацетат. В ходе реакции комплексы Pt(IV) восстанавливаются до комплексов в смешанной степени окисления, предположительно +3, и растворы темнеют.
В присутствии трифторнадуксусной кислоты и K2[Pt(CF3COO)6] или [Pt(CF3COO)4]n реакция окисления циклогексана и н-алканов (н-пентан, н-гексан, н-гептан и др.) с образованием соответствующих трифторацетатов идет каталитически. Примечательно, что, в отличие от оригинальной реакции Шилова, среди продуктов окисления н-алканов отсутствуют трифторацетаты первичных спиртов. Как известно, активация связи С–Н алканов в реакции Шилова происходит при участии хлорокомплексов Pt(II), а комплексы Pt(IV) играют роль окислителя. Очевидно, в наших условиях механизм реакции комплексов с углеводородами отличается от механизма реакции Шилова, так как в реакционной смеси отсутствуют комплексы Pt(II).
ЗАКЛЮЧЕНИЕ
Полученные результаты свидетельствуют о высокой реакционной способности полученных соединений Pt(IV) по отношению даже к таким инертным углеводородам, как алканы, и возможности их применения в органическом синтезе для введения заместителя CF3COO вместо атома водорода у вторичных и третичных атомов углерода алканов, циклоалканов и каркасных соединений типа адамантана.
Список литературы
de C.T. Carrondo M.A.A.F., Skapski A.C. // Acta Crystallogr., Sect. B. 1978. V. 34. № 6. P. 1857.
de C.T. Carrondo M.A.A.F., Skapski A.C. // Acta Crystallogr., Sect. B. 1978. V. 34. № 12. P. 3576.
Рудый Р.И., Черкашина Н.В., Мазо Г.Я. и др. // Изв. АН СССР. Сер. хим. 1980. № 4. С. 754.
Appleton T.G., Byriel K.A., Garrett J.M. et al. // Inorg. Chem. 1995. V. 34. № 22. P. 5646.
Гэрбелэу Н.В., Тимко Г.A., Индричан K.M. и др. // Коорд. химия. 1994. Т. 20. № 11. С. 846.
Bedgood Jr.D.R. // Synthesis, characterization, and mechanistic studies on a group of platinum complexes using 195Pt nuclear magnetic resonance, Thesis of PhD in Chemistry, Montana state University, Bozeman, Montana, 1991.
Синтез комплексных соединений металлов платиновой группы. Справочник / Под ред. Черняева И.И. М.: Наука, 1964. С. 102.
Руководство по неорганическому синтезу / Под ред. Брауэра Г. М.: Мир, 1985. Т. 5. С. 1820.
Sheldric G.M. // SADABS, Program for scaling and correction of area detector data. University of Goettingen. Germany, 1997.
Sheldrick G.M. // Acta Crystallogr., Sect. A. 2008. V. 64. P. 112.
Still B.M., Anil Kumar P.G., Aldrich-Wright J.R. et al. // Chem. Soc. Rev. 2007. V. 36. P. 665.
Нефедов В.И. // Рентгеноэлектронная спектроскопия химических соединений. М.: Химия, 1984.
Гольдшлегер Н.Ф., Еськова В.В., Шилов А.Е. и др. // Журн. физ. химии. 1972. Т. 46. № 5. С. 1353.
Еськова В.В., Шилов А.Е., Штейнман А.А. // Кинетика и катализ. 1972. Т. 13. С. 534.
Гольдшлегер Н.Ф., Лаврушко В.В., Хрущ А.П. // Изв. АН СССР. Сер. хим. 1976. № 10. С. 2174.
Защитные группы в органической химии / Под ред. МакОми Дж. М.: Мир, 1976. С. 113.
Дополнительные материалы отсутствуют.
Инструменты
Журнал неорганической химии