Журнал неорганической химии, 2019, T. 64, № 1, стр. 99-107
Дифференциация многокомпонентной системы Na,К,Sr||Cl,NO3. Фазовая диаграмма и физико-химические свойства солевых композиций системы NaNO3–NaCl–КNO3–Sr(NO3)2А. И. Расулов, П. А. Ахмедова, Б. Ю. Гаматаева, А. М. Гасаналиев, А. К. Мамедова
А. И. Расулов 1, 3, *, П. А. Ахмедова 2, Б. Ю. Гаматаева 1, А. М. Гасаналиев 1, А. К. Мамедова 1
1 Дагестанский государственный педагогический университет
36700 Махачкала, ул. Ярагского, 57, Россия
2 Школа № 667 им. Героя Советского Союза К.Я. Самсонова
11740 Москва, Востряковский пр-д, 13а, Россия
3 Дагестанский институт развития образования
367027 Махачкала, ул. Генерала Магомедтагирова, 159, Россия
* E-mail: abutdin.rasulov@mail.ru
Поступила в редакцию 25.05.2017
После доработки 30.07.2018
Принята к публикации 30.07.2018
Аннотация
На основе теории графов с помощью программного комплекса проведена дифференциация четверной взаимной системы Na,К,Sr||Cl,NO3. С использованием матрицы взаимных пар солей выявлены ее стабильные и метастабильные комплексы. Впервые методами физико-химического анализа (дифференциального термического, визуально-политермического, рентгенофазового с привлечением проекционно-термографического метода) исследована четырехкомпонентная система NaNO3–NaCl–КNO3–Sr(NO3)2, являющаяся стабильным комплексом данной четверной взаимной системы, и найдены координаты нонвариантных точек. Определены плотность и электропроводность, рассчитаны объемные изменения и изучена коррозия стали марки 12Х18Н10Т в солевых композициях эвтектического и перитектического характера плавления.
ВВЕДЕНИЕ
Фазовые равновесия в многокомпонентных солевых системах могут быть использованы для синтеза ряда материалов и совершенствования химико-технологических процессов [1].
Настоящая работа продолжает исследования солевых систем, являющихся стабильными комплексами пятерной взаимной системы Li,K,Na,Sr||Cl,NO3, направленных на выявление теплоаккумулирующих материалов [2–4].
Целью данной работы является исследование четырехкомпонентной взаимной системы Na,К,Sr||Cl,NO3, включающее проведение ее дифференциации с учетом топологических особенностей и с использованием компьютерных технологий, а также изучение четырехкомпонентной системы NaNO3–NaCl–КNO3–Sr(NO3)2. Данная многокомпонентная система изучена нами впервые.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Исследование диаграммы плавкости проводили методами дифференциального термического анализа (ДТА) [3] с помощью приемов проективной геометрии [5] и синхронного термического анализатора модификации STA 409PC [6, 7].
Кривые ДТА записывали на установке, собранной на базе электронного автоматического потенциометра КСП-4 с усилением термо-ЭДС дифференциальной термопары с помощью фотоусилителя Ф-116/1. Образцы помещали в платиновые микротигли емкостью 1 г, измерителем температуры служили Pt–Pt/Rh-термопары, в качестве индифферентного вещества использовали свежепрокаленный оксид алюминия квалификации “ч. д. а”. Масса навесок составляла 0.2 г.
Все исследования проводили в инертной (аргон) атмосфере. Исходными веществами служили соли КNO3, NaNO3, NaCl, Sr(NO3)2 квалификации “х. ч.”, предварительно прокаленные и гомогенизированные в агатовой ступке. Все составы выражены в мол. %, температура – в градусах Цельсия (°С) и Кельвина (K). Плотность расплава измеряли методом гидростатического взвешивания платинового шарика [6, 7].
Зависимость электропроводности расплавленных эвтектических смесей от температуры измеряли при частоте 1 кГц измерителем Е7–8. Температуру расплава измеряли Pt–Pt/Rh (10% родия)-термопарой и поддерживали с точностью ±2°С. Электродами служили платиновые провода диаметром 0.5 мм.
Коррозию изучали гравиметрическим методом, сущность которого заключалась во взвешивании изучаемого образца до и после опыта. Исследуемый образец при соответствующей температуре выдерживали длительное время в расплаве солей. Для создания температурного режима использовали лабораторную мини-электропечь МПЛ-6 с терморегулятором ТП-400. По истечении установленного времени сплав закаливали путем быстрого охлаждения. Закаленные образцы с разными количественными отношениями исходных компонентов подвергали травлению, которое проводили соляной кислотой, для очищения образцов от продуктов коррозии. Солевой плав анализировали химически на содержание основных легирующих компонентов стали.
Скорость коррозии определяли по формуле:
где m – разность массы образцов до и после опыта, г; S – площадь поверхности образцов, см2; τ – время, ч.РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Топологический анализ ограняющих элементов системы Na,К,Sr||Cl,NO3
По диаграмме составов данной системы была составлена матрица смежности ее вершин, которая является главным инструментом при проведении дифференциации (табл. 1). С использованием программного комплекса “Дифференциация многокомпонентных систем на ЭВМ” [8–12] проведено разбиение данной фигуры составов, конечным результатом которого является выведение фазовых единичных блоков: NaNO3–KNO3–NaCl–Sr(NO3)2, K5ClNO3–KCl–NaCl–Sr(NO3)2, KSr2Cl3–SrCl2–NaCl–Sr(NO3)2, K2SrCl4–KCl–NaCl–Sr(NO3)2, K2SrCl4–KSr2Cl3–NaCl–Sr(NO3)2, KNO3–K5ClNO3–NaCl–Sr(NO3)2 и стабильных секущих комплексов данной системы (табл. 2).
Таблица 1.
Матрица смежности четверной взаимной системы Na,К,Sr||Cl,NO3
| Соединение | NaNO3 | KNO3 | K2SrCl4 | KSr2Cl3 | SrCl2 | K5ClNO3 | KCl | NaCl | Sr(NO3)2 |
|---|---|---|---|---|---|---|---|---|---|
| NaNO3 | 1 | 1 | 0 | 0 | 0 | 0 | 0 | 1 | 1 |
| KNO3 | 1 | 0 | 0 | 0 | 1 | 0 | 1 | 1 | |
| K2SrCl4 | 1 | 1 | 0 | 0 | 1 | 1 | 1 | ||
| KSr2Cl3 | 1 | 1 | 0 | 0 | 1 | 1 | |||
| SrCl2 | 1 | 0 | 0 | 1 | 1 | ||||
| K5ClNO3 | 1 | 1 | 1 | 1 | |||||
| KCl | 1 | 1 | 1 | ||||||
| NaCl | 1 | 1 | |||||||
| Sr(NO3)2 | 1 |
Таблица 2.
Комбинированная матрица системы Li,K,Ca,Ba||F,WO4
| Ион | ${\text{NO}}_{3}^{ - }$ | ${\text{Cl}}_{4}^{ - }$ | ${\text{Cl}}_{3}^{ - }$ | ${\text{Cl}}_{2}^{ - }$ | ${\text{ClNO}}_{3}^{{2 - }}$ | Cl– | $\left( {{\text{N}}{{{\text{O}}}_{3}}} \right)_{2}^{ - }$ |
|---|---|---|---|---|---|---|---|
| Na+ | (4) 1, 2, 8, 9 | (9) 1, 2, 3, 4, 5, 6, 7, 8, 9 |
|||||
| K+ | (5) 1, 2, 6, 8, 9 |
(5) 3, 6, 7, 8, 9 |
|||||
| K2Sr3+ | (5) 3, 4, 7, 8, 9 |
||||||
| ${\text{KSr}}_{2}^{{3 + }}$ | (5) 3, 4, 5, 8, 9 |
||||||
| Sr2+ | (4) 4, 5, 8, 9 |
(9) 1, 2, 3, 4, 5, 6, 7, 8, 9 |
|||||
| ${\text{K}}_{5}^{ + }$ | (5) 2, 6, 7, 8, 9 |
||||||
Нами составлена матрица взаимных пар солей для четверной взаимной системы Na,К,Sr||Cl,NO3, с использованием которой выявлены ее стабильные и метастабильные комплексы, схемы левых и правых частей уравнений реакций данной системы, некоторые из них приведены в табл. 3, 4.
Таблица 3.
Матрица взаимных пар солей системы Na,К,Sr||Cl,NO3
| K2SrCl4 | KSr2Cl3 | SrCl2 | KCl | NaCl | |
|---|---|---|---|---|---|
| NaNO3 | 0 | 0 | 0 | 0 | 1 |
| KNO3 | 0 | 0 | 0 | 0 | 1 |
| K5ClNO3 | 0 | 0 | 0 | 1 | 1 |
| Sr(NO3)2 | 1 | 1 | 1 | 1 | 1 |
Таблица 4.
Метастабильные и стабильные комплексы и схемы левых и правых частей уравнений реакций системы Na,К,Sr||Cl,NO3
| Метастабильные комплексы системы Na,К,Sr||Cl,NO3 | Стабильные комплексы системы Na,К,Sr||Cl,NO3 |
|---|---|
| NaNO3 + K2SrCl4 NaNO3 + K2SrCl4 + SrCl2 NaNO3 + K2SrCl4 + KCl NaNO3 + KSr2Cl3 NaNO3 + KSr2Cl3 + SrCl2 и т.д. |
Sr(NO3)2 + KSr2Cl3 + NaCl Sr(NO3)2 + K2SrCl4 + NaCl Sr(NO3)2 + KCl + NaCl и т.д. |
На основании анализа матриц взаимных пар солей возможен рациональный выбор солей для получения системы с заданным направлением реакций обмена.
С использованием приведенной матрицы взаимных пар солей для четверной взаимной системы Na,К,Sr||Cl,NO3 по значениям индексов вершин можно подбирать сочетание наиболее выгодных в прикладном отношении композиций. Индекс вершины в комбинированной матрице отмечен цифрой в скобках и показывает стабильность соли (табл. 2).
Расчет и прогнозирование фазового комплекса
Для прогнозирования нонвариантных точек (НВТ) и построения древа кристаллизации системы NaNO3–NaCl–КNO3–Sr(NO3)2 применили метод априорного прогноза [13].
Обзор и анализ ограняющих элементов исследуемой системы показывает, что физико-химические взаимодействия и диаграммы состояния данной системы характеризуются наличием эвтектических и перитектических фазовых равновесий, обусловленных образованием инконгруэнтно плавящегося бинарного соединения NaCl · · КNO3 (рис. 1).
Рис. 1.
Развертка граневых элементов четырехкомпонентной системы NaNO3–NaCl–КNO3–Sr(NO3)2 и расположение в нем сечения АВС. Обозначения здесь и далее: min – н. р. т. р. – непрерывный ряд твердых растворов с минимумом, Еi – тройные эвтектики, Рi – тройные перитектики.
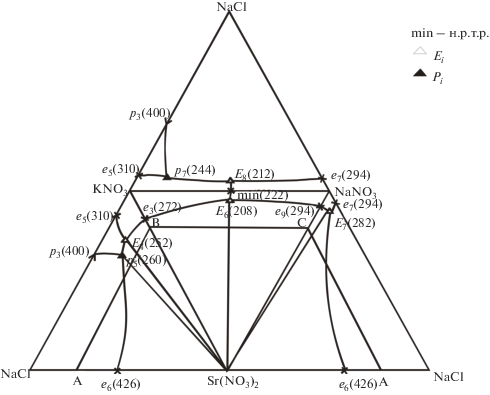
Диаграмма составов четырехкомпонентной системы NaNO3–NaCl–КNO3–Sr(NO3)2 показывает (рис. 1), что ее ликвидус состоит из пяти политермических объемов первичной кристаллизации, из которых четыре принадлежат исходным компонентам: NaNO3 → е7Е8minЕ6е9Е7, NaCl → → е7Е8P7p3P8е6Е7, KNO3 → е5P7Е8minЕ6е3Е4, Sr(NO3)2 → е6Р8Е4е3Е6е9Е7 и одному бинарному соединению NaCl · КNO3→ p3P7е5Е4Р8.
Физико-химические взаимодействия в данной системе привели к образованию следующих поверхностей совместной кристаллизации двух фаз: е9Е7Е6 (NaNO3 + Sr(NO3)2), е3Е6Е4 (КNO3 + + Sr(NO3)2), minЕ8Е6 (КNO3 + NaNO3), е7Е8Е7 (NaCl + NaNO3), е6Р8Е7 (NaCl + Sr(NO3)2), е5Е4Р7 (NaCl ⋅ КNO3 + КNO3). Из полученных результатов следует, что эти объемы должны замыкаться двумя четверными НВТ. На основании вышеизложенного спрогнозирован фазовый состав НВТ и построена схема древа кристаллизации (рис. 2), которая позволяет предположить, что в системе реализуются две НВТ эвтектического и перитектического характера плавления.
Термический анализ системы NaNO3–NaCl–КNO3–Sr(NO3)2
Для подтверждения априорного прогноза и построения топологической модели фазовой диаграммы провели ее термический анализ.
В соответствии с правилами проекционно-термографического метода в тетраэдрической диаграмме (рис. 1, 3), изображающей ее состав, первоначально выбрано двухмерное политермическое сечение АВС, вершинам которого соответствуют составы А – 20% Sr(NO3)2 + 80% NaCl, В –20% Sr(NO3)2 + 80% КNO3, С – 20% Sr(NO3)2 + + 80% NaNO3. Плоскость сечения расположена в гиперобъеме кристаллизации нитрата стронция, занимающего наибольший объем кристаллизации.
Рис. 3.
Диаграмма составов четырехкомпонентной системы NaNO3–NaCl–КNO3–Sr(NO3)2 и расположение в ней политермического сечения АВС, одномерного политермического (GH) и лучевых разрезов. Обозначения: ${{\bar {\bar {\varepsilon }}}^{\square }}$ и ${{\bar {\bar {P}}}^{\square }}$ – вторичные проекции эвтектики и перитектики, ${{\bar {\varepsilon }}^{\square }}$ и ${{\bar {P}}^{\square }}$ – первичные проекции эвтектики и перитектики, 1 – четверная эвтектика, 2 – четверная перитектика.
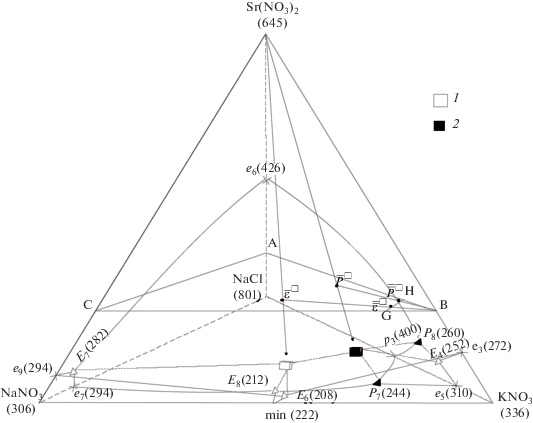
Из вершины, соответствующей нитрату стронция, на стороны сечения АВС нанесены точки Е4, Е6, Е7 и Р8, являющиеся центральными проекциями соответствующих точек тройных эвтектических и перитектических равновесий.
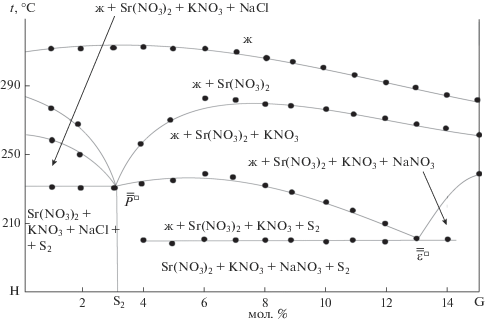
Данное сечение рассматривали как псевдотрехкомпонентную систему, и в ней для экспериментального изучения был выбран одномерный политермический разрез HG (H – 20% Sr(NO3)2 + + 65% KNO3 + 15% NaCl, G – 20% Sr(NO3)2 + 65% KNO3 + 15% NaNO3). Последовательно изучая методом ДТА составы, расположенные на этом разрезе, нашли точки ${{\bar {\bar {\varepsilon }}}^{\square }}$ и ${{\bar {\bar {P}}}^{\square }},$ которые являются вторичными проекциями НВТ системы.
На диаграмме состояния данного разреза (рис. 4) видно, что сначала из жидкой фазы кристаллизуется нитрат стронция, в объеме которого расположено сечение HG, затем нитрат стронция и нитрат калия. Ветви третичной кристаллизации пересекаются в точках ${{\bar {\bar {\varepsilon }}}^{\square }}$ и ${{\bar {\bar {P}}}^{\square }}$ на горизонтальной линии, проходящей при температуре четырехкомпонентных эвтектики и перитектики. При изучении методом ДТА образцов, находящихся на лучевых разрезах В → ${{\bar {\bar {\varepsilon }}}^{\square }}$ → ${{\bar {\varepsilon }}^{\square }},$ выявлена точка ${{\bar {\varepsilon }}^{\square }},$ являющаяся первичной проекцией четверной эвтектики. Для состава ${{\bar {\varepsilon }}^{\square }}$ на диаграмме состояния лучевого разреза В → ${{\bar {\bar {\varepsilon }}}^{\square }}$ → ${{\bar {\varepsilon }}^{\square }}$ вслед за первичной кристаллизацией нитрата стронция наступает нонвариантный процесс, показывающий количественное соотношение фаз NaCl, КNO3 и NaNO3 в эвтектике.
Определение составов четырехкомпонентных эвтектики и перитектики сводилось к постепенному уменьшению концентрации нитрата стронция (без изменения соотношения остальных компонентов) по лучевым разрезам Sr(NO3)2 → ${{\bar {\varepsilon }}^{\square }}$ → → ${{\varepsilon }^{\square }}$ и Sr(NO3)2 → ${{\bar {P}}^{\square }}$ → ${{P}^{\square }}$ (рис. 5), проведенным из вершины Sr(NO3)2 через точки ${{\bar {\varepsilon }}^{\square }}$ и ${{\bar {P}}^{\square }}$ (рис. 6) до наступления нонвариантных процессов (табл. 5).
Рис. 5.
Диаграммы состояния лучевых разрезов Sr(NO3)2 → ${{\bar {\varepsilon }}^{\square }}$ → ${{\varepsilon }^{\square }}$ и Sr(NO3)2 → ${{\bar {P}}^{\square }}$ → ${{P}^{\square }}.$
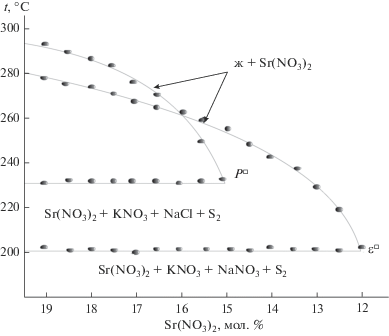
Рис. 6.
Термический анализ эвтектического состава четырехкомпонентной системы, в мол. %: 39NaNO3–4NaCl–45КNO3–12Sr(NO3)2.
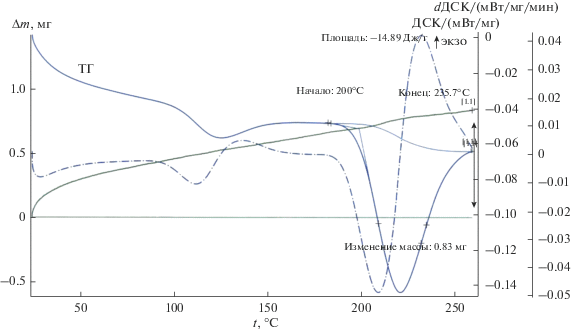
Таблица 5.
Характеристики НВТ системы NaNO3–NaCl–КNO3–Sr(NO3)2
| НВТ | t, °C | Состав, мол. % | |||
|---|---|---|---|---|---|
| NaNO3 | NaCl | КNO3 | Sr(NO3)2 | ||
| ε | 200 | 39 | 4 | 45 | 12 |
| Р | 230 | 3 | 17 | 65 | 15 |
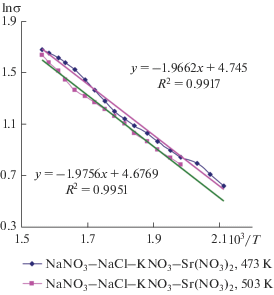
После исследования фазового комплекса системы для оценки возможности использования данных солевых композиций в качестве низкоплавких электролитов нами изучена электропроводность в температурном интервале 483–643 K. Результаты обработаны методом наименьших квадратов, выведены уравнения зависимости и достоверность аппроксимации. Зависимость электропроводности расплава от температуры отображена на рис. 7. Для солевой композиции перитектического характера плавления при повышении температуры от 503 до 643 K проводимость расплавленной смеси возрастает почти в 2.34 раза, а для эвтектической композиции при повышении температуры от 473 до 643 K проводимость расплавленной смеси возрастает в 3 раза. Таким образом, транспортные свойства эвтектической смеси подтверждают перспективность ее использования в качестве низкоплавкого электролита для различных электрохимических процессов.
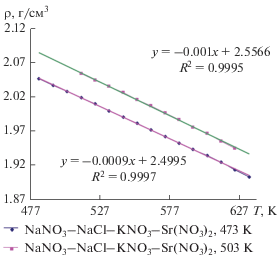
При разработке тепловых аккумуляторов (ТА) помимо заданной температуры плавления (кристаллизации) и высокой удельной энтальпии фазового перехода критерием выбора теплоаккумулирующих материалов (ТАМ) является и плотность. При плавлении объем большинства расплавов увеличивается, поэтому при проектировании ТА фазового перехода в нем предусматривают свободный объем исходя из экспериментальных значений плотности и объемного расширения ТАМ до максимальной рабочей температуры. Чем выше значения плотности и меньше объемные изменения ТАМ, тем более компактным будет тепловой аккумулятор. Методом гидростатического взвешивания платинового шарика нами определены температурные зависимости плотности выявленных солевых композиций. Рассчитаны объемные изменения композиции в рабочем температурном интервале. Измерения плотности начинали при Тпл = 10 K и завершали при температуре 643 K, так как выше этой температуры начинаются процессы разложения нитрата натрия.
Как видно из графика зависимости плотности расплавов от температуры (рис. 8), при повышении температуры от 513 до 623 K плотность расплавленной смеси перитектического характера плавления линейно уменьшается на 5.26%. Объем смеси при этом возрастает на 5.54%. Плотность расплавленной солевой композиции эвтектического характера плавления при повышении температуры от 483 до 633 K уменьшается на 6.94%. Объем смеси возрастает на 7.46%.
Изучение коррозии стали марки 12Х18Н10Т в НВТ
Следующим этапом были коррозионные исследования стали марки 12Х18Н10Т, из которой чаще всего изготавливают контейнеры тепловых аккумуляторов, в зависимости от времени (τ) выдержки в расплаве. Зависимость скорости коррозии от времени выдержки стали указанной марки в эвтектическом и перитектическом расплавах показана соответственно на рис. 9. С увеличением времени выдержки от 0 до 200 ч средняя скорость коррозии линейно возрастает от 0 до 0.0035 (200 ч) г/(см2 ч) для эвтектики и до 0.0039 (200 ч) г/(см2 ч) для перитектики. Это объясняется тем, что процесс коррозии не лимитируется диффузией химических элементов (железа, хрома, никеля, титана) в оксидном слое, т.е. оксидный слой обладает слабыми защитными свойствами. Средняя скорость коррозии при выдержке в течение 400 ч резко убывает, что говорит о сильных защитных свойствах оксидных слоев, образующихся в результате продолжительной выдержки.
Рис. 9.
Зависимость средней скорости коррозии (Кср) стали 12Х18Н10Т от времени (τ) выдержки в эвтектическом (а) и перитектическом (б) расплавах системы NaNO3–NaCl–KNO3–Sr(NO3)2.
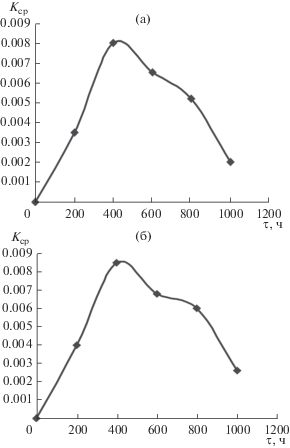
Выше 600°С как для эвтектической, так и для перитектической композиции (более выражено для эвтектики) наблюдается незначительный рост коррозии, это скорее всего объясняется межкристаллитной коррозией, которой аустенитные стали подвержены после длительного нагревания при 450–850°С.
Из полученных данных видно, что скорость коррозии для исследованных материалов уменьшается с продолжительностью опыта и свыше 800 ч становится практически постоянной.
Одной из причин возникновения коррозии стали марки 12Х18Н10Т в расплаве является присутствие окислителей. В роли окислителей могут выступать компоненты атмосферы, катионы примесей, содержащиеся в электролите, а также конструкционные материалы, контактирующие с расплавом. В присутствии кислорода на поверхности хромсодержащих сталей возможно химическое взаимодействие оксида хрома с хлоридом натрия:
Образующиеся хлор и хромат-ионы в дальнейшем сами выступают как окислители, интенсифицируя коррозию стали. Хлор в расплавленных хлоридах щелочных и щелочноземельных металлов также может образовываться по реакции обмена:
Присутствие в расплаве катионов поливалентных металлов, таких как Fe2+, Cr2+ и Ti3+, образующих малорастворимые оксиды, смещает равновесие в сторону образования свободного хлора, который впоследствии может выступать в качестве непосредственного окислителя [14–18].
Важно отметить, что механизм коррозии сталей в расплавах в отсутствие окислителей до настоящего времени не получил объяснения.
По результатам расчета и анализа термодинамических и теплофизических свойств (табл. 6) расплавов нонвариантного равновесия данной системы, наибольшей теплотой фазового перехода обладает солевая композиция перитектического характера плавления [15].
Таблица 6.
Теплоаккумулирующие характеристики и свойства НВТ системы NaNO3–NaCl–КNO3–Sr(NO3)2
| Система | НВТ | Т, K | Ср, кДж/(кг K) | ∆Нпл, кДж/кг | ∆Sпл, кДж/(кгK) | ∆ρ | ∆χ | ∆V |
|---|---|---|---|---|---|---|---|---|
| % | ||||||||
| 39NaNO3–4NaCl–45КNO3–12Sr(NO3)2 | ε | 473 | 0.0996 | 113.28 | 0.239 | 6.94 | 300 | 7.3 |
| 3NaNO3–17NaCl–65КNO3–15Sr(NO3)2 | Р | 503 | 0.0964 | 114.38 | 0.227 | 5.26 | 234 | 5.4 |
С помощью формулы Q = Vρ[Cs(Tf – T2) + ∆Hf + + Cl(Tl – T2)], где Cs и Cl – удельные теплоемкости твердой и жидкой фаз, Tf – температура фазового перехода, вычислено общее количество аккумулируемой энергии без учета жидкой фазы. Тонна выявленных композиций эвтектического и перитектического характера плавления в течение года (из расчета один цикл в день) аккумулирует 48 022 128 и 47 155 440 кДж тепла соответственно, что эквивалентно 1.64 и 1.61 тоннам условного топлива (т.у.т.).
ВЫВОДЫ
1. Проведена дифференциация четверной взаимной системы Na,К,Sr||Cl,NO3, в ходе которой выявлены фазовые единичные блоки, которые могут быть объектом исследования в зависимости от поставленной технологической задачи.
2. Представленные схемы уравнений реакций являются отображением химических процессов, протекающих в данной системе, и могут быть использованы для поиска солевых композиций с регламентируемыми свойствами.
3. Солевые композиции на основе нитратов натрия, калия и хлорида натрия могут быть рекомендованы в качестве материалов для изготовления среднетемпературных аккумуляторов тепла, функционирующих в интервале температур от 473 до 643 K. Эти композиции могут быть приготовлены из доступного и сравнительно недорогого природного сырья (чилийской и калийной селитры, галита).
Список литературы
Курнаков Н.С. Введение в физико-химический анализ. М.–Л.: Изд-во АН СССР, 1940. 564 с.
Гасаналиев А.М. Топология, обмен и комплексообразование в многокомпонентных солевых системах: дис. … д-ра хим. наук. Ташкент, 1990. 477 с.
Гасаналиев А.М., Расулов А.И., Гаматаева Б.Ю., Мамедова А.К. // Журн. физ. химии. 2012. Т. 86. № 2. С. 1.
Гасаналиев А.М., Ахмедова П.А. Дифференциация многокомпонентных систем. Монография. М.: ООО “Е-полиграф”, 2011. 150 с.
Кочкаров Ж.А. Топология многокомпонентных гетерофазных систем из молибдатов, вольфраматов и других солей щелочных металлов: дис. … д-ра хим. наук. Нальчик: КБГУ, 2001. 305 с.
Берг Л.Г. Введение в термографию. М.: Наука, 1969. 276 с.
Уэндланд У. Термические методы анализа / Пер. с англ. под ред. Степанова В.А., Берштейна В.А. М.: Мир, 1978. 526 с.
Гасаналиев А.М., Ахмедова П.А., Гаматаева Б.Ю. Деп. ВИНИТИ от 01.06.2010 г. №328-В2010. Махачкала: ДГПУ, 2010. 20 с.
Гасаналиев А.М., Ахмедова П.А., Гаматаева Б.Ю. Деп. ВИНИТИ от 28.09.2010 г. № 542-В2010. Махачкала: ДГПУ, 2010. 69 с.
Гасаналиев А.М., Ахмедова П.А., Гаматаева Б.Ю. // Жypн. неорган. химии. 2012. Т. 57. № 2. С. 319.
Кочкаров Ж.А. Топология многокомпонентных гетерофазных систем из молибдатов, вольфраматов и других солей щелочных металлов: дис. … д-ра хим. наук. Нальчик: КБГУ, 2001. 305 с.
Чуваков А.В. Комплексная методология формирования древ фаз многокомпонентных солевых систем: автореф. дис. … канд. хим. наук. Самара: СГТУ, 2007. 20 с.
Гаматаева Б.Ю., Расулов А.И., Умарова Ю.А. и др. // Расплавы. 2006. № 6. С. 61.
Гасаналиев А.М., Гаматаева Б.Ю., Расулов А.И. и др. // Журн. неорган. химии. 2009. Т. 54. С. 1565.
Гасаналиев А.М., Гаматаева Б.Ю., Расулов А.И., Мамедова А.К. // Изв. вузов. Химия и хим. технология. 2010. Т. 53. № 9. С. 32.
Антипин Л.Н., Важенин С.Ф. Электрохимия расплавленных солей. М.: Металлургиздат, 1964. 187 с.
Janz G.J. // J. Phys. Chem. Ref. Data. 1988. V. 17. № 2. P. 309.
Абрамов А.В., Половов И.Б., Волкович В.А. и др. // Расплавы. 2011. С. 71.
Дополнительные материалы отсутствуют.
Инструменты
Журнал неорганической химии