Журнал неорганической химии, 2019, T. 64, № 1, стр. 108-114
Взаимодействие трифторацетата кадмия с тиоацетамидом в малополярных органических средахА. А. Исаева, В. П. Смагин, В. А. Зяблицкая
А. А. Исаева 1, В. П. Смагин 1, *, В. А. Зяблицкая 1
1 Алтайский государственный университет
656049 Барнаул, пр-т Ленина, 61, Россия
* E-mail: smaginv@yandex.ru
Поступила в редакцию 01.03.2018
После доработки 04.07.2018
Принята к публикации 09.04.2018
Аннотация
В результате взаимодействия трифторацетата кадмия с H2S, образующимся при гидролизе тиоацетамида, синтезированы наноразмерные частицы (квантовые точки) сульфида кадмия в среде этилацетата и (поли)метилметакрилата. Устойчивость коллоидных растворов обеспечивают тиоацетамидные комплексные соединения на поверхности частиц CdS. Спектрометрическими методами определены соотношения Cd(II):ТАА и константы взаимодействия трифторацетата кадмия с тиоацетамидом в системе (CF3COO)2Cd · nH2O–ТАА–Р, где ТАА – тиоацетамид, Р – этилацетат или (поли)метилметакрилат. Оценена скорость образования и рассчитан размер частиц CdS. Приведены данные о влиянии условий синтеза на спектрально-люминесцентные свойства CdS в матрице (поли)метилметакрилата.
ВВЕДЕНИЕ
Синтез новых материалов является одним из важных направлений развития науки и техники. Широкое применение в оптике, электронике, светотехнике находят композиции, содержащие наноразмерные частицы (квантовые точки (КТ)) металлов и их соединений [1–7]. Они проявляют необычные оптические, электрические, магнитные свойства. Люминесценция КТ связана с квантовыми эффектами, которые возникают из-за малого размера частиц и их дефектности. Рекомбинация зарядов происходит на уровнях структурно-примесных дефектов, которые могут быть целенаправленно сформированы в объеме и на поверхности кристаллов [6, 8, 9]. Стабильные люминесцентные характеристики проявляют полупроводниковые структуры типа “ядро/оболочка” или более сложные композиции. Их получают сочетанием полупроводников [10, 11]. Легирование кристаллов полупроводников ионами металлов положительно отражается на их оптических характеристиках и позволяет получать композиции с прогнозируемыми спектральными свойствами [5, 12–19].
Сочетание уникальных свойств полупроводников и технологичности оптических полимеров привлекает внимание к их композициям [20–24]. Введение КТ в полимеры придает им способность люминесцировать в видимой и ИК-области электромагнитного спектра. В процессе синтеза КТ необходимо решить задачи, связанные с сохранением их устойчивости и воспроизводимости оптических характеристик. Внедрение КТ в полимерные матрицы является одним из решений, позволяющих зафиксировать пространственное положение КТ и сформировать необходимую морфологию композиций [24–26]. Еще одна проблема связана с гетерогенностью композиций. Их оптическая прозрачность также зависит от размера частиц. Одним из способов получения оптически прозрачных композиций является синтез КТ непосредственно в среде мономера и последующее отверждение образующихся коллоидных растворов его полимеризацией до стеклообразного состояния [27, 28]. В качестве источника сульфид-ионов применяются сероводород и сульфид натрия [27, 29], а также органические серосодержащие соединения, в том числе тиоацетамид [28, 30]. Преимущество использования сероводорода заключается в отсутствии побочных продуктов, а также комплексных соединений на поверхности коллоидных частиц и в объеме композиций [27, 29]. Устойчивость коллоидных растворов в этом случае обеспечивается главным образом “зарядовым” фактором. Однако из-за применения токсичного газообразного реагента такой способ синтеза сульфидов металлов является экологически небезопасным. Концентрацию H2S сложно контролировать, а избыток удалять. Более технологичным является применение тиоацетамида (ТАА), что позволяет использовать метод возникающих реагентов и проводить синтез сульфидов металлов в более мягких условиях [28]. Однако при неполном разложении тиоацетамида в композициях присутствуют комплексные соединения, а также побочные продукты, образующиеся при его гидролизе. Они оказывают влияние на спектрально-люминесцентные свойства [12, 18].
В водных растворах взаимодействие ТАА с сульфидобразующими катионами достаточно хорошо изучено [31, 32]. С кислотами ТАА образует соли, с солями металлов – комплексные соединения. Состав комплексных соединений (1 : 1 или 1 : 2) определяется координационными возможностями реагентов и свойствами среды. В водных растворах ТАА медленно гидролизуется. В кислых и щелочных растворах гидролиз усиливается. Он может протекать в две стадии [32]. В результате гидролиза образуются ацетат аммония и сероводород.
В отличие от водных растворов, литературные данные о взаимодействии ТАА с солями металлов в малополярных органических растворителях, в том числе в метилметакрилате (ММА) и близком к нему по полярности, но не полимеризующемся при нагревании этилацетате (ЭА), отсутствуют. Также немногочисленны данные о влиянии условий синтеза на состав композиций и их спектрально-люминесцентные свойства.
Цель настоящей работы – изучение взаимодействия трифторацетата кадмия с тиоацетамидом в этилацетате и метилметакрилате, приводящего к получению оптически прозрачных полиакрилатных композиций состава ПММА/CdS, а также влияния условий синтеза на люминесценцию КТ сульфида кадмия в среде (поли)метилметакрилата (ПММА).
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Трифторацетат кадмия синтезировали взаимодействием оксида кадмия (х. ч.) с трифторуксусной кислотой (х. ч.) в водной среде. В кристаллическом виде соль выделена медленным упариванием подкисленного раствора на водяной бане с последующим высушиванием на воздухе. ТАА перед применением перекристаллизовывали. Вещества идентифицировали методом ИК-спектроскопии.
Наноразмерные частицы (КТ) CdS синтезировали в среде ЭА и ММА взаимодействием трифторацетата кадмия с H2S, который образовывался в растворе при гидролизе ТАА под влиянием молекул кристаллизационной воды. Синтез проводили при температуре 70–90°С в течение 20 мин. На образование КТ указывало появление характерной для CdS желто-зеленой окраски и опалесценция растворов.
Композиции ПММА/CdS в стеклообразном состоянии получены радикальной полимеризацией метилметакрилата в блоке аналогично [28]. Для инициирования полимеризации в коллоидные растворы вводили перекись бензоила в количестве 0.1% от массы ММА. Растворы нагревали при температуре 60–70°С до вязкого состояния. Вязкими растворами заполняли стеклянные кюветы и продолжали нагревание до перехода композиций в стеклообразное состояние. Время полимеризации составляло до 24 ч. Композиции представляют собой желто-зеленые прозрачные “стекла”. Их окраска идентична окраске растворов.
Для исследования взаимодействия в системах (CF3COO)2Cd · nH2O–ТАА–Р, где ТАА – тиоацетамид, Р – этилацетат или (поли)метилметакрилат, были приготовлены растворы трифторацетата кадмия и тиоацетамида с концентрацией веществ, равной 0.0200 и 0.100 моль/л соответственно. Их разведением готовили серии растворов с постоянной концентрацией трифторацетата кадмия 0.00200 моль/л и переменной концентрацией ТАА с мольным соотношением Cd : ТАА от 1 : 0.2 до 1 : 40. Оптическую плотность растворов регистрировали сразу после их приготовления, а также наблюдали за ее изменением в течение времени.
ИК-спектры реагентов регистрировали на спектрометре Infralum FT 801 в диапазоне 4000–500 см–1. Электронные спектры поглощения (ЭСП) растворов записывали на спектрофотометре Specord UV VIS в диапазоне 200–800 нм относительно растворителя. Оптическую плотность измеряли на спектрофотометре СФ-46 относительно растворителя. Калибровка фотометрической шкалы проведена по методике [33]. Электронные фотографии (ПЭМ) получены на просвечивающем электронном микроскопе СМ12 (Philips, Нидерланды). Коллоидные растворы наносили на медные сетки с аморфным углеродным покрытием, высушивали и исследовали с различным увеличением. Спектры возбуждения люминесценции и люминесценции записывали на спектрофлуориметре СМ 2203. В качестве источника излучения использовали ксеноновую дуговую лампу высокого давления ДКсШ 150-1М. Возбуждающий свет лампы падал перпендикулярно поверхности образца. Стационарную люминесценцию регистрировали под углом 45°.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
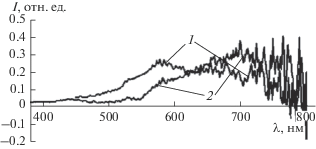
На рис. 1а, 1б приведены электронные фотографии веществ, выделенных из коллоидных растворов до введения инициатора полимеризации, где наблюдаются агрегированные структурные образования сферической формы. Их размер достигает десятков нм. Структуры закрыты слоем реагентов и продуктов реакции. Люминесценция коллоидных растворов практически полностью потушена (рис. 2). Очень низкая интенсивность люминесценции объясняется незавершенностью процесса формирования кристаллов, малой концентрацией CdS после данного этапа синтеза, а также влиянием веществ, находящихся на поверхности частиц.
Рис. 1.
ПЭМ фотографии продуктов, образовавшихся при взаимодействии трифторацетата кадмия с ТАА в ЭА: а, б – фрагменты агрегатов КТ, сформировавшихся с течением времени при различном мольном соотношении Cd : ТАА, покрытые слоем комплексных соединений; в, г – неагрегированные формы продуктов.

Рис. 2.
Спектры люминесценции коллоидного раствора, полученного нагреванием системы (CF3COO)2Cd · nH2O –ТАА–ЭА (1), и выделенных из него продуктов (2).
В УФ-спектрах растворов трифторацетата кадмия наблюдается полоса поглощения с максимумом при 260 нм. Она отнесена к n → σ*-электронному переходу карбонильной группы трифторацетат-ионов. В спектральной области >270 нм растворы трифторацетата кадмия прозрачны. В спектре раствора ТАА фиксируется полоса поглощения с максимумом при 270 нм, связанная с n → σ*-электронным переходом С=S-группы.
В спектрах растворов (CF3COO)2Cd · nH2O–ТАА–ЭА при длинах волн >200 нм присутствует сложная полоса поглощения, состоящая минимум из двух компонент (рис. 3). Коротковолновая компонента с максимумом при 270 нм связана с ТАА, не входящим в состав комплексных соединений. Длинноволновая компонента относится к поглощению комплексных соединений. С увеличением мольного соотношения Cd : ТАА полоса поглощения смещается в область длинных волн (рис. 3, кривые 1–8).
Рис. 3.
Спектры поглощения растворов (CF3COO)2Cd · nH2O–ТАА–ЭА, СCd(II) = 0.00200 моль/л, мольное соотношение Cd(II) : ТАА = 1 : 0.2, 1 : 0.4, 1 : 0.6, 1 : 0.8, 1 : 1.0, 1 : 1.5, 1 : 2, 1 : 3 (1–8 соответственно); 1 : 5 (9), относительно ЭА, l = 1.00 см.
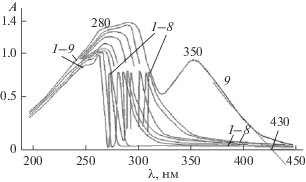
Оптическая плотность в области длинноволнового максимума полосы поглощения (310 нм) по-разному изменяется с течением времени у растворов, содержащих трифторацетат кадмия и тиоацетамид в малых и больших мольных соотношениях (Cd : ТАА): у первых она уменьшается, а у вторых возрастает. Уменьшение оптической плотности можно объяснить разрушением комплексных соединений в результате гидролиза ТАА. Процесс сопровождается образованием H2S. При взаимодействии его с трифторацетатом кадмия начинают формироваться зародыши будущих кристаллов сульфида кадмия. С ростом концентрации ТАА (мольного соотношения Cd : ТАА) в растворе выход сероводорода увеличивается. Повышается концентрация образующегося CdS. Это приводит к увеличению оптической плотности растворов. Постепенно формируются кристаллы CdS. Образование кристаллов подтверждается опалесценцией растворов. Она проявляется с течением времени после приготовления растворов. Например, у раствора с мольным соотношением Cd : ТАА = = 1 : 4 опалесценция наблюдается примерно с 30-й мин. В спектре наблюдается широкая полоса с максимумом при 350 нм (рис. 3, кривая 9), связанная с поглощением кристаллов CdS. Интенсивность этой полосы практически линейно увеличивается с ростом мольного соотношения Cd : ТАА до 1 : 40 (А350 = 0.10 + 0.035N, r = 0.990, где N – мольная доля ТАА при постоянной концентрации трифторацетата кадмия, равной 0.00200 моль/л, r – коэффициент линейности). Широкий интервал линейной зависимости объясняется малой скоростью образования КТ CdS и необходимостью введения большого избытка ТАА для смещения равновесия реакции в сторону образования продуктов.
По положению точки пересечения касательной, проведенной к ниспадающей ветви полосы поглощения с максимумом 350 нм (рис. 3, кривая 9), с абсциссой (430 нм) определена ширина запрещенной зоны частиц CdS и по методике [34] рассчитан их размер:
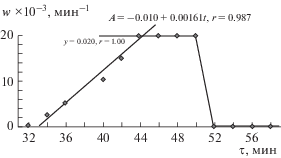
где h – постоянная Планка; ${\mu } = {{\left[ {{{{\left( {m_{e}^{*}} \right)}}^{{ - 1}}} + {{{\left( {m_{h}^{*}} \right)}}^{{ - 1}}}} \right]}^{{ - 1}}},$ $m_{e}^{*} = 0.21{{m}_{e}},$ $m_{h}^{*} = 0.80{{m}_{e}}$ – эффективные массы электронов и дырок в CdS; me – масса покоя электрона; ${\Delta }{{E}_{g}}$ – разность энергий ширины запрещенной зоны (${{E}_{g}}$) наночастицы и массивного кристалла CdS (2.4 эВ). Он равен 2.2 нм. С учетом методических отличий (мольные соотношения веществ, температурный режим синтеза, время синтеза) полученный результат не противоречит данным [12, 18, 35] для коллоидных частиц CdS в ЭА, ММА и ПММА. При нагревании в процессе приготовления коллоидных растворов и далее при нагревании в процессе синтеза полимерных композиций размер частиц CdS увеличивается. Это связано с продолжающимся разрушением комплексов, дальнейшим образованием H2S и ростом кристаллов CdS. Это подтверждается изменениями на электронных фотографиях (рис. 1в, 1г). Размер частиц достигает 5–7 нм. Полученные результаты согласуются с данными [12, 35, 36].Для растворов с различным мольным соотношением Cd : ТАА построены зависимости, характеризующие изменение оптической плотности в области максимума полосы поглощения КТ CdS (350 нм) с течением времени. Пример одной из зависимостей А350= f(τ) приведен на рис. 4. Методом графического дифференцирования [37] на участке зависимости, соответствующем накоплению продуктов с постепенным увеличением скорости реакции (рис. 4, участок 2), оценена скорость образования частиц CdS (w, мин–1). Для этого были проведены касательные и определены тангенсы угла их наклона (рис. 4). Зависимость w = f(τ) приведена на рис. 5. Для растворов, содержащих вещества в мольных соотношениях Cd : ТАА < 1 : 4, время индукционного периода (участок 1) увеличивается. Оно может достигать суток. Для растворов, содержащих вещества в мольных соотношениях Cd : ТАА > 1 : 5, индукционный период исчезает. Скорость реакции увеличивается сразу после приготовления растворов.
Рис. 4.
Зависимость А350= f(τ) для раствора (CF3COO)2Cd · nH2O–ТАА–ЭА, СCd(II) = 0.00200 моль/л, мольное соотношение Cd : ТАА = 1 : 4, относительно ЭА, l = 1.00 см.
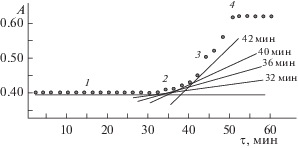
Рис. 5.
Зависимости w = f(τ) для раствора (CF3COO)2Cd · nH2O–ТАА–ЭА, СCd(II) = 0.00200 моль/л, мольное соотношение Cd : ТАА = 1 : 4.
При длине волны в области максимума полосы поглощения комплексных соединений (310 нм) измерена оптическая плотность растворов, содержащих реагенты в соотношениях Cd : ТАА = = 1 : 0.2–1 : 10. Измерения проведены сразу после приготовления растворов. Результаты измерений обработаны спектрофотометрическими методами Асмуса и Бенеши–Гильдебранда [38].
В соответствии с методом Асмуса построены зависимости ${1 \mathord{\left/ {\vphantom {1 {V_{{{\text{Cd}}\left( {{\text{II}}} \right)}}^{n}}}} \right. \kern-0em} {V_{{{\text{Cd}}\left( {{\text{II}}} \right)}}^{n}}}$ = f(1/m), где VCd(II) – объем раствора трифторацетата кадмия, n – целое число, соответствующее мольному соотношению комплексообразователь : лиганд (Cd : ТАА) для зависимости, характеризующейся наибольшим коэффициентом линейности (n = 1, 2, 3, 4); m = = A310/l, где А310 – оптическая плотность при длине волны 310 нм, l – толщина кюветы, см. Уравнения и коэффициенты линейности зависимостей для различных значений n приведены в табл. 1. Результат указывает на образование в растворах комплексных соединений с мольным соотношением Cd : ТАА = 1 : 1.
Таблица 1.
Уравнения и коэффициенты линейности зависимости (${1 \mathord{\left/ {\vphantom {1 {V_{{{\text{Cd}}\left( {{\text{II}}} \right)}}^{n}}}} \right. \kern-0em} {V_{{{\text{Cd}}\left( {{\text{II}}} \right)}}^{n}}}$) = f(1/m) при n = 1, 2, 3, 4 (целое число из уравнения Асмуса)
| n | Уравнение и коэффициент |
|---|---|
| 1 | у = –1.09 + 1.03х, 0.995 |
| 2 | у = –17.9 + 9.52х, 0.934 |
| 3 | у = –185 + 89.7х, 0.882 |
| 4 | у = –1843 + 872х, 0.855 |
В табл. 2 приведены данные для построения зависимостей Бенеши–Гильдебранда $\frac{{{{C}_{{{\text{Cd(II)}}}}}l}}{{{{A}_{{310}}}}}$ = = $f\left( {\frac{1}{{C_{{{\text{Т А А }}}}^{n}}}} \right)$ (СCd(II) – молярная концентрация трифторацетата кадмия; СТАА – молярная концентрация тиоацетамида; n – мольное соотношение Cd : ТАА, n = 1 и 2; А310 – оптическая плотность раствора при λ = 310 нм; l – толщина кюветы, см), а также уравнения зависимостей, коэффициенты линейности и константа взаимодействия трифторацетата кадмия с ТАА, рассчитанная из уравнения, характеризующегося большим коэффициентом линейности. Исходя из линейности зависимостей при n = 1 и нелинейности при n = 2 подтверждено образование комплексных соединений с мольным соотношением Cd : ТАА = 1 : 1. Малая величина константы взаимодействия трифторацетата кадмия с ТАА может указывать как на внешнесферное взаимодействие веществ, так и на сложность процесса, сопровождающегося затратами энергии на вытеснение молекул воды из координационной сферы трифторацетата кадмия при их замещении тиоацетамидом.
Таблица 2.
Данные для построения зависимости $\frac{{{{C}_{{{\text{Cd(II)}}}}}l}}{{{{A}_{{310}}}}} = f\left( {\frac{1}{{C_{{{\text{Т А А }}}}^{n}}}} \right)$ (n = 1 или 2) для системы (CF3COO)2Cd · ⋅ nH2O–ТАА–ЭА, ССd(II) = 2.00 × 10–3 моль/л = const, оптическая плотность измерена относительно ЭА, λ = 310 нм, l = 1.00 см, T = 293 K; Sr = 0.03, Р = 0.95, n = 3
| Мольное соотношение ТАА : Cd(II), ССd(II) = 2.00 × × 10–3 моль/л = = const (ТАА/1) | Концентрация тиоацетамида, СТАА, моль/л | $\frac{1}{{{{C}_{{{\text{Т А А }}}}}}} \times {{10}^{{ - 2}}},$ л/моль | $\frac{1}{{C_{{{\text{Т А А }}}}^{{\text{2}}}}} \times {{10}^{{ - 6}}},$ (л/моль)2 | Оптическая плотность, А310 | $\frac{{{{C}_{{{\text{Cd(II)}}}}}l}}{{{{A}_{{310}}}}} \times {{10}^{4}},$ (моль см)/л |
|---|---|---|---|---|---|
| 0.2 | 4.00 × 10–4 | 25.0 | 6.25 | 0.095 | 210 |
| 0.4 | 8.00 × 10–4 | 12.5 | 1.56 | 0.160 | 125 |
| 0.6 | 12.0 × 10–4 | 8.35 | 0.69 | 0.250 | 80.0 |
| 0.8 | 16.0 × 10–4 | 6.25 | 0.39 | 0.290 | 69.0 |
| 1.0 | 20.0 × 10–4 | 5.00 | 0.25 | 0.30 | 66.7 |
| 1.5 | 30.0 × 10–4 | 3.34 | 0.11 | 0.35 | 57.2 |
| 2 | 40.0 × 10–4 | 2.25 | 0.062 | 0.44 | 45.4 |
| 3 | 60.0 × 10–4 | 1.66 | 0.028 | 0.54 | 37.0 |
| 4 | 80.0 × 10–4 | 1.25 | 0.016 | 0.62 | 32.2 |
| 4.5 | 90.0 × 10–4 | 1.10 | 0.012 | 0.70 | 28.6 |
| 5 | 100 × 10–4 | 1.00 | 0.010 | 0.72 | 27.8 |
| 6 | 120 × 10–4 | 0.84 | 0.0070 | 0.80 | 25.0 |
| 8 | 160 × 10–4 | 0.62 | 0.0040 | 0.95 | 21.0 |
| 10 | 200 × 10–4 | 0.50 | 0.0025 | 1.2 | 16.7 |
| Уравнение зависимости $\frac{{{{C}_{{{\text{Cd(II)}}}}}l}}{{{{A}_{{{\text{310}}}}}}} = f\left( {\frac{1}{{C_{{{\text{Т А А }}}}^{n}}}} \right),$ коэффициент линейности, константа взаимодействия | n = 1 | у = 21.9 + 7.69х, 0.994; К = 2.85 × 102 *у = 28.2 + 7.27х, 0.996; К = 3.88 × 102 |
|||
| n = 2 | у = 40.4 + 29.3х, 0.934 *у = 60.0 + 25.0х, 0.974 |
||||
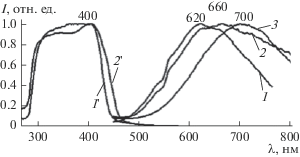
Как показали проведенные исследования, времени, в течение которого коллоидные растворы при мольных соотношениях Cd : ТАА < 1 : 4 сохраняют устойчивость, достаточно для их термического отверждения полимеризацией метилметакрилата в блоке. Для синтеза образцов полимерных композиций выбраны составы с соотношением Cd : ТАА = 1 : 1 и 1 : 2. При нагревании таких растворов при 70–90°С переход в коллоидное состояние происходит в течение 20 мин. Процесс полимеризации композиции объемом до 10 мл до стеклообразного состояния занимает несколько часов. Оптическая прозрачность стеклообразных композиций в области спектра >500 нм достигает 92% (5 мм). Полимерные композиции люминесцируют в видимой и ближней ИК-области спектра (рис. 6, спектры 1–3). Люминесценция композиций связана с дефектностью поверхности кристаллов CdS. На это указывает длинноволновое положение спектральной полосы. Возникновение люминесценции объясняется образованием акцепторных уровней энергии в запрещенной зоне кристаллов CdS. Интенсивность люминесценции полимерных композиций значительно больше интенсивности люминесценции коллоидных растворов. Возбуждение люминесценции происходит излучением ближнего ультрафиолета (рис. 6, спектры 1 ' и 2 '). Значительная ширина полос объясняется неоднородностью центров люминесценции и дисперсностью образующихся частиц. Увеличение количества комплексов на поверхности частиц приводит к батохромному смещению полосы люминесценции. Противоположное смещение полосы наблюдается при увеличении времени полимеризации и “отжига” полимерных образцов. Это связано с разрушением комплексов и продолжающимся образованием CdS в процессе нагревания при полимеризации и “отжиге” полимерных образцов. Рост концентрации ТАА (Cd : ТАА = 1 : 1 и 1 : 2) приводит к повышению интенсивности люминесценции. Это объясняется увеличением выхода H2S и, соответственно, ростом концентрации кристаллов CdS.
ВЫВОДЫ
Получены коллоидные растворы КТ сульфида кадмия в среде этилацетата и (поли)метилметакрилата. Спектрофотометрическими методами определены соотношения Cd : ТАА в комплексных соединениях и константы взаимодействия трифторацетата кадмия с ТАА в растворе. Высказаны предположения о ходе процесса формирования частиц CdS и влиянии на него соотношения реагентов и температуры. Синтезированы композиции ПММА/CdS и исследованы их спектрально-люминесцентные свойства. Показано, что возбуждение люминесценции связано с межзонными переходами электронов в кристаллах CdS, а люминесценция – с дефектами на их поверхности. Положение полосы люминесценции в спектре зависит от комплексообразования на поверхности частиц, времени полимеризации и “отжига” полимерных композиций, а также от концентрации тиоацетамида.
Список литературы
Помогайло А.Д., Розенберг А.С., Уфлянд И.Е. Наночастицы металлов в полимерах. М.: Химия, 2000. 672 с.
Mackenzie J.D. // J. Sol-Gel Sci. Technol. 2003. V. 26. № 1–3. P. 23.
Ремпель А.А. // Успехи химии. 2007. Т. 76. № 5. С. 474 [Rempel A.A. // Russ. Chem. Rev. 2007. V. 76. № 5. P. 435. doi 10.1070/RC2007v076n05ABEH003674].
Zgaren I., Sellami K., Jaziri S. // Sensor Letters. 2009.V. 7. № 5. P. 967. doi 10.1166/sl.2009.1182
Mukherjee P., Shade C.M., Yingling A.M. et al. // J. Phys. Chem. A. 2011. V. 115. № 16. P. 4031. doi 10.1021/jp109786w
Chandra B.P., Chandra V.K., Jha P. // Solid State Phenomena. 2015. V. 222. P. 1. doi 10.4028/www.scientific.net/SSP.222.1
Gong X., Yang Z., Walters G. et al. // Nature Photonics. 2016. V. 10. № 4. P. 253. doi 10.1038/nphoton.2016.11
Lozada-Morales R., Zelaya-Angel O., Torres-Delgado G. // Appl. Surf. Sci. 2001. V. 175–176. P. 562. doi 10.1016/S0169-4332(01)00115-5
Hayne M., Bansal B. // Luminescence. 2012. V. 27. № 3. P. 179. doi 10.1002/bio.2342
Zhao H., Liang H., Vidal F. et al. // J. Phys. Chem. C. 2014. V. 118. № 35. P. 20585. doi 10.1021/jp503617h
Мандал А.Р., Иштеев А.Р., Волчематьев С.А. и др. // Неорган. материалы. 2016. Т. 52. № 3. С. 297. [Mandal A.R., Ishteev A.R., Volchematev S.A. et al. // Inorg. Mater. V. 52. № 3. P. 256. doi 10.1134/S0020168516030109].
Смагин В.П., Давыдов Д.А., Унжакова Н.М., Бирюков А.А. // Журн. неорган. химии. 2015. Т. 60. № 12. С. 1734. [Smagin V.P., Davydov D.A., Unzhakova N.M., Biryukov A.A. // Russ. J. Inorg. Chem. 2016. V. 60. № 12. P. 1588. doi 10.1134/S0036023615120244].
Niu Jing-hua, Hua Rui-nian, Li Wen-lian et al. // J. Phys. D: Appl. Phys. 2006. V. 39. № 11. P. 2357. doi 10.1088/0022-3727/39/11/007
Planelles-Aragó J., Julián-López B., Cordoncillo E. et al. // J. Mater. Chem. 2008. V. 18. № 43. P. 5193. doi 10.1039/b809254k
Буланый М.Ф., Коваленко А.В., Полежаев Б.А., Прокофьев Т.А. // ФТП. 2009. Т. 43. № 6. С. 745 [Bulanuy M.F., Kovalenko A.V., Polezaev B.A., Prokof’Yev T.A. // Semiconductors. 2009. V. 43. № 6. P. 716. doi 10.1134/S1063782609060050].
Огурцов К.А., Бахметьев В.В., Абызов А.М. и др. // Изв. СПбГТИ (ТУ). 2010. № 7. С. 13.
Mukherjee P., Sloan R.F., Shade C.M. et al. // J. Phys. Chem. C. 2013. V. 117. № 27. P. 144514. doi 10.1021/ jp404947x
Смагин В.П., Исаева А.А., Еремина Н.С., Бирюков А.А. // Журн. прикл. химии. 2015. Т. 88. № 6. С. 924 [Smagin V.P., Isaeva A.A., Eremina N.S., Biryukov A.A. // Russ. J. Appl. Chem. 2015. V. 88. № 6. P. 1020. doi 10.1134/S1070427215060208].
Джафаров М.А., Насиров Е.Ф., Джафарли Р.С. // Неорган. материалы. 2017. Т. 53. № 1. С. 15. [Jafarov M.A., Nasirov E.F., Jafarli R.S. // Inorg. Mater. 2017. V. 53. № 1. P. 39. doi 10.1134/S0020168517010058].
Pedone L., Caponetti E., Leone M. et al. // J. Colloid Interface Sci. 2005. V. 284. № 2. P. 495. doi 10.1016/ j.jcis.2004.10.019
Серова В.Н. Оптические и другие материалы на основе прозрачных полимеров. Казань: Изд-во КГТУ, 2010. 540 с.
Sun X., Xie L., Pang F. et al. // Optics Express. 2013. V. 21. № 7. P. 8214. doi 10.1364/OE.21.008214
Смагин В.П. // Обзорный журн. по химии. 2013. Т. 3. № 2. С. 180. [Smagin V.P. // Rev. J. Chem. 2013. V. 3. № 2. Р. 163. doi 10.1134/S2079978013020039].
Звайгзне М.А., Мартынов И.Л., Кривенков В.А. и др. // Оптика и спектроскопия. 2017. Т. 122. № 1. С. 76. [Zvaigzne M.A., Martynov I.L., Krivenkov V.A. et al. // Opt. Spectrosс. 2017. V. 122. № 1. P. 69. doi 10.1134/S0030400X17010313].
Ушаков Н.М., Юрков Г.Ю., Запсис К.В. и др. // Оптика и спектроскопия 2006. Т. 100. № 3. С. 459 [Ushakov N.M., Zapsis K.V., Yurkov G.Yu. et al. // Opt. Spectrosс. 2006. V. 100. № 3. P. 414. doi 10.1134/S0030400X06030180].
Звайгзне М.А., Мартынов И.Л., Самохвалов П.С., Набиев И.Р. // Известия Академии наук. Сер. химическая. 2016. № 11. С. 2568 [Zvaigzne M.A., Martynov I.L., Samokhvalov P.S., Nabiev I.R. // Russ. Chem Bull. 2016. V. 65. № 11. P. 2568. doi 10.1007/s11172-016-1620-8]
Бирюков А.А., Изаак Т.И., Светличный В.А. и др. Патент РФ № 2466094 // Б.И. 2012.
Смагин В.П., Давыдов Д.А., Унжакова Н.М. Патент РФ № 2561287 С1. // Б.И. 2015. № 24.
Бирюков А.А., Изаак Т.И., Светличный В.А., Бабкина О.В. // Изв. вузов. Физика. 2006. Т. 49. № 12. С. 81 [Biryukov A.A., Izaak T.I., Babkina O.V., Svetlichnyi V.A. // Russ. Phys. J. 2006. Т. 49. № 12. P. 1354. doi 10.1007/s11182-006-0265-8].
Пономарева К.Ю., Кособудский И.Д., Третьяченко Е.В., Юрков Г.Ю. // Неорган. материалы. 2007. Т. 43. № 11. С. 1295 [Ponomareva K.Yu., Kosobudsky I.D., Tret’yachenko E.V., Yurkov G.Yu. // Inorg. Mater. 2007. V. 43. № 11. P. 1160. doi 10.1134/S0020168507110027].
Алексеева Л.В. Фотохимическое получение и свойства коллоидов на основе комплексов переходных металлов: автореф. дис. … канд. хим. наук. СПб, 1994. 18 с.
Туленин С.С. Гидрохимическое осаждение пленок In2S3, In2Se3 и халькопиритных структур на их основе: дис. … канд. хим. наук. Екатеринбург, 2015. 197 с.
Гордон А., Форд Р. Спутник химии. М.: Мир, 1976. С. 237.
Пивен Н.Г., Щербак Л.П., Фейчук П.И. и др. // Конденсированные среды и межфазные границы. 2006. Т. 8. № 4. С. 315.
Готовцева Е.Ю., Бирюков А.А., Светличный В.А. // Изв. вузов. Физика. 2013. Т. 56. № 3. С. 32 [Gotovtseva E.Y., Biryukov A.A., Svetlichnyi V.A. // Russ. Phys. J. 2013. Т. 56. № 3. P. 273. doi 10.1007/s11182-013-0027-3].
Смагин В.П., Еремина Н.С., Давыдов Д.А. и др. // Неорган. материалы. 2016. Т. 52. № 6. С. 664. [Smagin V.P., Eremina N.S., Davydov D.A. et al. // Inorg. Mater. 2016. V. 52. № 6. Р. 611. doi 10.1134/S0020168516060157].
Стромберг А.Г. Физическая химия / Под ред. Стромберга А.Г., Семченко Д.П. Изд. 3-е, испр. и дополн. М.: Высш. школа, 1999. С. 284.
Булатов М.И., Калинкин И.П. Практическое руководство по фотоколориметрическим и спектрофотометрическим методам анализа. Л.: Химия, 1976. 376 с.
Дополнительные материалы отсутствуют.
Инструменты
Журнал неорганической химии