Журнал неорганической химии, 2019, T. 64, № 1, стр. 9-14
Кристаллическая структура оксисульфата европия Eu2O2SO4Ю. Г. Денисенко, Н. О. Азарапин, Н. А. Хритохин, О. В. Андреев, С. С. Волкова
Ю. Г. Денисенко 1, 2, *, Н. О. Азарапин 1, Н. А. Хритохин 1, О. В. Андреев 1, С. С. Волкова 1
1 Тюменский государственный университет
625003 Тюмень, ул. Володарского, 6, Россия
2 Тюменский индустриальный университет
625000 Тюмень, ул. Володарского, 38, Россия
* E-mail: yu.g.denisenko@gmail.com
Поступила в редакцию 22.11.2017
После доработки 04.07.2018
Принята к публикации 18.01.2018
Аннотация
По данным порошковой рентгеновской дифракции определена кристаллическая структура оксисульфата европия. Соединение кристаллизуется в моноклинной сингонии. Параметры элементарной ячейки: a = 13.6952(1), b = 4.1929(4), c = 8.1393(2) Å, β = 107.455(4)°, пр. гр. C2/c. Выделены три основных элемента структуры (атомы Eu, тетраэдры SO4, атомы μ-O) и проанализировано их координационное окружение. Представлены оригинальные структурные элементы: неограниченные винтовые цепочки, состоящие из трехшапочных тригональных призм [EuO9]; заключенные в кубы из атомов европия сульфатные тетраэдры [(SO4)Eu8]; неограниченные цепочки, состоящие из тетраэдров [OEu4]. Обосновано расщепление полос поглощения, отвечающих колебаниям сульфатных групп в ИК-спектре.
ВВЕДЕНИЕ
Оксисульфаты редкоземельных элементов (РЗЭ) имеют набор достаточно интересных магнитных свойств. Так, оксисульфид гадолиния Gd2O2SO4 является двумерным гейзенберговским антиферромагнетиком [1, 2].
Легированные оксисульфаты (${\text{L}}{{{\text{n}}}_{{1--x}}}{\text{Ln}}_{x}^{'}$)2O2SO4 перспективны в качестве высокоэффективных люминофоров при возбуждении ультрафиолетовым или рентгеновским излучением. Данные люминофоры обладают как повышенной термической стабильностью, так и эффективными воспроизводимыми характеристиками люминесценции [3–7].
Наличие в оксисульфатах серы как окислительно-восстановительного центра определяет их потенциальное применение в качестве катализаторов процесса конверсии водяного газа [8, 9], твердооксидных топливных элементов и батарей [10, 11], материалов для хранения газообразного кислорода [12–14].
Оксисульфаты образуются при разложении соединений РЗЭ, содержащих в своем составе хотя бы одну сульфатную группу: Ln2(SO4)3 [15–18], Ln2(OH)4SO4 [19, 20], Ln2(OH)2CO3SO4 [21]. Также оксисульфаты можно получить разложением органических сульфонатов различного строения [14]. Прямой метод синтеза заключается в температурной обработке оксидов в атмосфере оксида серы(IV) и кислорода [22].
Оксисульфат европия, по данным [23], кристаллизуется в ромбической сингонии, пр. гр. Pmmm. Однако детальное рассмотрение структуры (индицирование методом Ритвельда) указывает на то, что модель ромбической элементарной ячейки не способна адекватно описать имеющиеся структурные элементы и их реальное расположение.
Цель настоящей работы – уточнение кристаллической структуры оксисульфата европия, анализ координационного окружения всех элементов структуры и их взаимосвязи.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Синтез. Оксисульфат европия Eu2O2SO4 получали разложением сульфата европия(III) Eu2(SO4)3 при 1000°С в атмосфере аргона в течение 25 ч:
Сульфат европия синтезировали из раствора Eu(NO3)3, полученного растворением Eu2O3 (99.995%) в концентрированной азотной кислоте (х. ч.), путем осаждения концентрированной серной кислотой (ос. ч. 15-3).
Рентгеноспектральный анализ (РСпА) проводили на растровом электронном микроскопе JEOL JSM 6510 LV. Точность установления элементного состава ±0.2%.
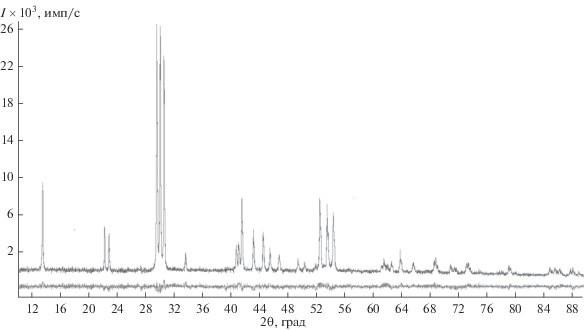
Рентгенофазовый анализ выполняли на дифрактометре Bruker D2 Phaser с линейным детектором Lynxeye (CuKα-излучение, Ni-фильтр). Структура уточнена методом Ритвельда в программе DIFFRAC.TOPAS. В качестве исходной структурной модели использовали данные изоструктурного соединения La2O2SO4. Для визуализации кристаллической структуры и ее основных элементов использовали пакет программ Diamond 3.
Инфракрасную спектроскопию проводили на ИК-Фурье-спектрометре ФСМ 1201. Образец для исследования готовили в виде таблетки с прокаленным бромидом калия.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
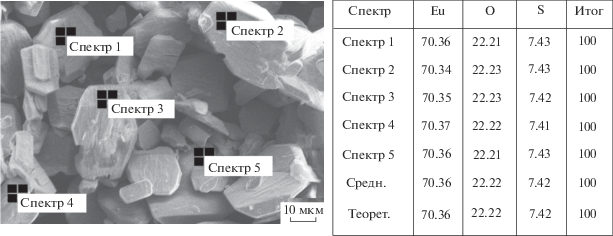
По данным РСпА, распределение элементов в образце, полученном при разложении сульфата европия, соответствует стехиометрической фазе Eu2O2SO4. Данные, полученные в разных точках образца, сопоставимы по значениям (рис. 1).
Рис. 1.
Электронно-микроскопический снимок порошка оксисульфата европия Eu2O2SO4 с указанием точки определения элементного состава, приведенного в таблице справа.
Дифрактограмма оксисульфата европия проиндицирована в моноклинной сингонии (рис. 2). Кристаллографические параметры и основные межатомные расстояния приведены в табл. 1 и 2 соответственно.
Таблица 1.
Кристаллографические параметры оксисульфата европия Eu2O2SO4
| Параметр | Значение |
|---|---|
| М | 431.9894 |
| Сингония | Моноклинная |
| Пр. гр. | С2/с |
| Z | 4 |
| a, Å | 13.6952(1) |
| b, Å | 4.1929(4) |
| c, Å | 8.1393(2) |
| β, град | 107.455(4) |
| V, Å3 | 467.38 |
| ρвыч, г/см3 | 6.46 |
| T, K | 120 |
| R(F), % | 6.16 |
| Rwp, % | 5.91 |
| Rp, % | 4.63 |
Таблица 2.
Межатомные расстояния в структуре Eu2O2SO4
| Связь | d, Å | Преобразование координат атомов O | Связь | d, Å | Связь | d, Å |
|---|---|---|---|---|---|---|
| Eu–O(1) | 2.2960(1) | x, y, z | S–O(2) | 2 × 1.520(1) | O(2)–O(2) | 2.359(2) |
| 2.3059(7) | 0.5 – x, –0.5 + y, 0.5 – z | S–O(3) | 2 × 1.433(2) | O(2)–O(3) | 2.419(3) | |
| 2.3183(3) | 0.5 – x, 1.5 – y, –z | O(2)–O(3) | 2.421(4) | |||
| 2.3454(2) | x, –1 + y, z | |||||
| Eu–O(2) | 2.5622(1) | –1 + x, y, z | ||||
| 2.5651(1) | 1 – x, 1 – y, –z | |||||
| Eu–O(3) | 3.1554(7) | 0.5 – x, –0.5 + y, 0.5 – z | ||||
| 2.7272(6) | x, y, z | |||||
| 2.7055(4) | x, 1 – y, –0.5 + z |
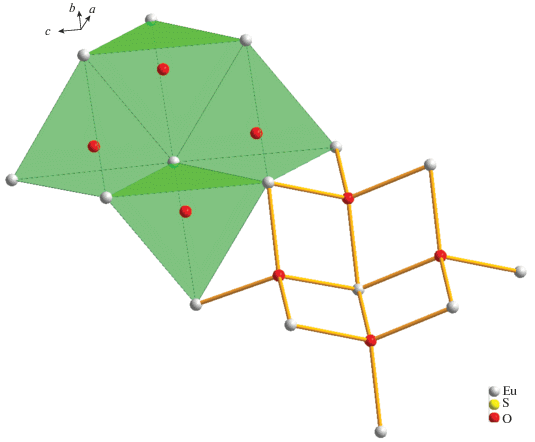
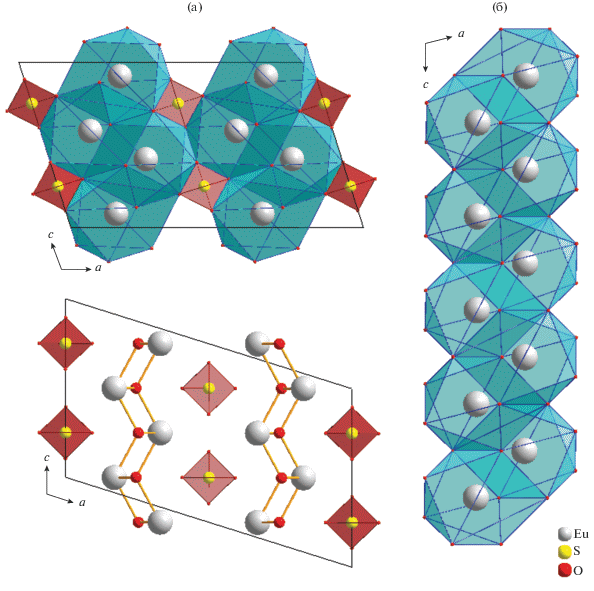
Структура образована чередующимися катионными [${\text{E}}{{{\text{u}}}_{2}}{\text{O}}_{2}^{{2 + }}$]n и анионными слоями, состоящими из изолированных тетраэдров [SO4]2–. Оба слоя параллельны плоскости (100) (рис. 3а). Все атомы европия занимают идентичные кристаллографические позиции и координированы девятью атомами кислорода: пять атомов O принадлежат монодентатно связанным сульфатным группам, остальные атомы O мостиковые. Координированный полиэдр европия – трехшапочная тригональная призма (ТТП). Две шапки, соприкасаясь ребром, формируют плоскость, состоящую из четырех атомов кислорода. ТТП в координационном многограннике деформирована из-за различия в длинах связей Eu–O. Одна из связей Eu–O существенно длиннее других (d(Eu–O(3)) = 3.1554(6) Å), вследствие этого КЧ европия принято как 8 + 1. Соединяясь, координационные многогранники образуют зигзагообразные 1D-цепочки вдоль направления с (рис. 3б).
Рис. 3.
Перспективные проекции структуры соединения Eu2O2SO4 (a) и строение зигзагообразных цепочек [EuO9]n (б).
Каждый мостиковый атом кислорода, находясь в состоянии sp3-гибридизации, связан с четырьмя атомами европия, в результате чего образуются тетраэдры [OEu4]. Данные тетраэдры, последовательно попарно связываясь друг с другом, образуют зигзагообразные 1D-цепочки, которые, соединяясь между собой, образуют 2D-сетки (рис. 4).
Слои [Eu2O2]n и цепочки тетраэдров [OEu4] являются настолько прочными элементами структуры, что сохраняются в процессе восстановления Eu2O2SO4 до Eu2O2S. В структуре Eu2O2S при наложении слоев, состоящих из цепочек тетраэдров [EuO4], происходит образование тетраэдрических пустот [24].
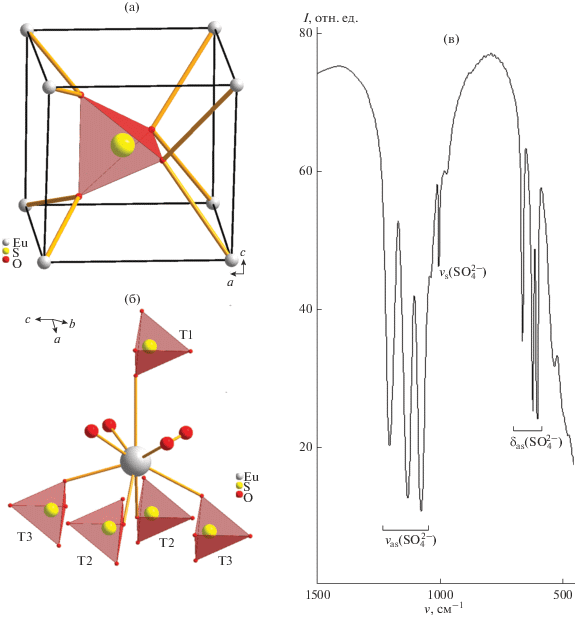
В координации атомов кислорода групп ${\text{SO}}_{4}^{{2 - }}$ участвуют атомы европия. Сульфатный тетраэдр окружен восемью атомами Eu по вершинам почти идеального куба (рис. 5а). На расстоянии 3.115 Å от двух атомов кислорода располагаются дополнительные атомы европия, также участвующие в координации сульфатного тетраэдра, хотя и значительно слабее (“двухшапочный куб”). Таким образом, КЧ сульфатных групп принято как 8 + 2. Все сульфатные тетраэдры в структуре занимают одинаковые кристаллографические позиции. Однако данные ИК-спектроскопии (рис. 5в) указывают на наличие трех сортов групп ${\text{SO}}_{4}^{{2 - }}$ – полосы поглощения, отвечающие валентным и деформационным колебаниям сульфатного тетраэдра, расщеплены на три составляющие. Действительно, детальное рассмотрение координации иона Eu3+ показывает, что сульфатные тетраэдры по-разному обращены к центру координации и образуют наборы сульфатных групп трех сортов (рис. 5б).
Список литературы
Paul W. // J. Magn. Magn. Mater. 1990. V. 87. P. 23.
Lian J., Sun X., Li X. // Mater. Chem. Phys. 2011. V. 125. P. 479. doi 10.1016/j.matchemphys.2010.10.029
Shoji M., Sakurai K. // J. Alloys Compd. 2006. V. 426. № 1. P. 244. doi 10.1016/j.jallcom.2005.12.110
Kijima T., Shinbori T., Sekita M. et al. // J. Luminescence. 2008. V. 128. № 3. P. 311. doi 10.1016/j.jlumin.2007.07.018
Srivastava A.M., Setlur A.A., Comanzo H.A. et al. // Optic. Mater. 2008. V. 30. № 10. P. 1499. doi 10.1016/ j.optmat.2007.09.003
Porcher P., Svoronos D.R., Leskela M. et al. // J. Solid State Chem. 1983. V. 46. № 1. P. 101. doi 10.1016/ 0022-45968390130-5
Lian J., Sun X., Liu Z. et al. // Mater. Res. Bull. 2009. V. 44. № 9. P. 1822. doi 10.1016/j.materresbull.2009.05.021
Valsamakis I., Flytzani-Stephanopoulos M. // Appl. Catal., B. 2011. V. 106. № 1. P. 255. doi 10.1016/j.apcatb.2011.05.037
Tan S., Paglieri S.N., Li D. // Catal. Commun. 2016. V. 73. P. 16. doi 10.1016/j.catcom.2015.10.007
Loureiro F.J.A., Yang T., Stroppa D.G. et al. // J. Mater. Chem. 2015. V. 3. № 24. P. 12636. doi 10.1039/C4TA06640E
Dixini P.V.M., Celante V.G., Lelis M.F.F. et al. // J. Power Sources. 2014. V. 260. P. 163. doi 10.1016/j.jpowsour.2014.03.006
Zhang W., Arends I.W.C.E., Djanashvili K. // J. Chem. Soc., Dalton Trans. 2016. V. 45. № 36. P. 14019. doi 10.1039/C6DT01667G
Osseni S.A., Denisenko Yu.G., Fatombi J.K. et al. // J. Nanostruct. Chem. 2017. V. 7. P. 337. doi 10.1007/ s40097-017-0243-4
Zhang D., Kawada T., Yoshioka F. et al. // ACS Omega. 2016. V. 1. № 5. P. 789. doi 10.1021/acsomega.6b00262
Andreev O.V., Denisenko Yu.G., Sal’nikova E.I. et al. // Russ. J. Inorg. Chem. 2016. V. 61. № 3. P. 296. doi 10.1134/S0036023616030025
Denisenko Yu.G., Khritokhin N.A., Andreev O.V. et al. // J. Solid State Chem. 2017. V. 255. P. 219. doi 10.1016/j.jssc.2017.08.020
Andreev P.O., Sal’nikova E.I., Kislitsyn A.A. // Russ. J. Phys. Chem. A. 2013. V. 87. № 9. P. 1482. doi 10.1134/ S0036024413080050
Sal’nikova E.I., Andreev P.O., Antonov S.M. // Russ. J. Phys. Chem. A. 2013. V. 87. № 8. P. 1280. doi 10.1134/ S0036024413080207
Liang J., Ma R., Geng F. et al. // Chem. Mater. 2010. V. 22. № 21. P. 6001. doi 10.1021/cm102236n
Chen F., Chen G., Liu T. et al. // Scientific reports. 2015. V. 5. P. 17934.
Lian J., Liang P., Wang B. et al. // J. Ceramic Process. Research. 2014. V. 15. № 6. P. 382.
Xing T.H., Song L.X., Xiong J. et al. // Adv. Appl. Ceram. 2013. V. 112. № 8. P. 455. doi 10.1179/ 1743676113Y.0000000112
Berdowski P.A.M., Van Mens R., Blasse G. //J. Lumin. 1985. V. 33. № 2. P. 147. doi 10.1016/0022-23138590013-4
Biondo V., Sarvezuk P.W.C., Ivashita F.F. et al. // Mater. Res. Bull. 2014. V. 54. P. 41. doi 10.1016/j.materresbull.2014.03.008
Дополнительные материалы отсутствуют.
Инструменты
Журнал неорганической химии