Микроэлектроника, 2023, T. 52, № 3, стр. 227-235
Быстрый электрохимический микронасос для портативного модуля доставки лекарств
И. В. Уваров 1, *, П. С. Шлепаков 1, 2, **, А. М. Абрамычев 1, 2, В. Б. Световой 3
1 Ярославский филиал Физико-технологического института имени К.А. Валиева
Российской академии наук
150007 Ярославль, ул. Университетская, 21, Россия
2 Ярославский государственный университет им. П.Г. Демидова
150003 Ярославль,
ул. Советская, 14, Россия
3 Институт физической химии и электрохимии им. А.Н. Фрумкина
Российской академии наук
199071 Москва, Ленинский просп., 31, Россия
* E-mail: i.v.uvarov@bk.ru
** E-mail: p.shlepakov@bk.ru
Поступила в редакцию 20.02.2023
После доработки 01.03.2023
Принята к публикации 02.03.2023
- EDN: UEFVBL
- DOI: 10.31857/S0544126923700345
Аннотация
Микрофлюидные устройства способны осуществлять прецизионную доставку лекарств в организм человека. Для этой цели они должны оснащаться компактным насосом, обеспечивающим высокий расход жидкости и точную дозировку. В настоящей работе представлен микронасос на основе быстрого электрохимического актюатора, отвечающий этим требованиям. Он содержит три актюатора, работающих в перистальтическом режиме. Устройство изготавливается на основе стеклянных и кремниевых пластин с использованием стандартных процессов микротехнологии. Рабочая часть насоса имеет размер около 3 мм3, что на порядок меньше по сравнению с мембранными насосами других типов. Малый размер актюаторов обеспечивает сверхвысокую точность дозировки жидкости, составляющую 0.14 нл. В то же время, высокая частота работы актюаторов позволяет развивать удельную скорость перекачки, сравнимую с насосами других типов.
1. ВВЕДЕНИЕ
Микрофлюидные системы представляют собой чипы с сетью каналов и камер, по которым перемещается жидкость. Благодаря миниатюрным размерам эти устройства открывают новые возможности в исследовании клеток [1, 2], анализе веществ [3, 4], быстрой диагностике заболеваний [5, 6] и прецизионной доставке лекарств к различным органам и тканям человеческого организма [7, 8]. Широкому распространению устройств микрофлюидики препятствует отсутствие компактного и эффективного насоса, перекачивающего рабочую жидкость по каналам. Как правило, насос представляет собой камеру с двумя клапанами, заполненную рабочей жидкостью и закрытой подвижной мембраной [9]. Мембрана совершает возвратно-поступательное движение и прокачивает жидкость через камеру в направлении, задаваемом клапанами. Характеристики насоса определяются актюатором, управляющим движением мембраны. Применяются актюаторы различных типов, но каждый из них имеет недостатки. Электромагнитные устройства обладают высокой скоростью работы, но сложны в изготовлении и не вполне совместимы с микротехнологией [10, 11]. Электростатические актюаторы технологичны, но развивают небольшую силу и требуют подачи высокого напряжения [12, 13]. Термические актюаторы создают значительное давление, но медлительны [14, 15]. Пьезоэлектрические актюаторы способны работать быстро и с большим усилием, однако требуют высокого управляющего напряжения и имеют большой размер [16, 17].
Отдельно стоит отметить актюаторы, использующие электролиз воды в качестве рабочего принципа [18–21]. Электрохимический актюатор представляет собой камеру с электродами, заполненную электролитом и закрытую гибкой мембраной. Подача напряжения на электроды создает пузыри газа, толкающие мембрану вверх. После отключения напряжения газ растворяется, и мембрана возвращается в исходное положение. Эти устройства имеют простую конструкцию, не требуют высокого напряжения, развивают большое усилие и могут быть изготовлены с использованием технологий микроэлектроники. Их недостатком является медленное растворение газа в камере, занимающее несколько минут [20, 21]. В результате электрохимические актюаторы имеют весьма невысокую рабочую частоту порядка 0.01 Гц.
Недавно был представлен электрохимический актюатор нового типа, способный работать на частоте в несколько сотен герц [22]. В отличие от классического устройства, использующего постоянное напряжение или ток, быстрый актюатор управляется серией микросекундных импульсов напряжения переменной полярности. Импульсы создают нанопузырьки водорода и кислорода в камере, толкающие мембрану. После отключения сигнала газ исчезает за миллисекунды в ходе спонтанной реакции горения [23]. Такой актюатор является перспективным для использования в микрофлюидике. Он имеет компактный размер около 0.5 мм и перемещает менее 1 нл жидкости за цикл, что определяет высокую точность дозировки. Благодаря высокой рабочей частоте насос на его основе сможет развивать приемлемую скорость перекачки при относительно небольших габаритах. В настоящей работе представлен перистальтический микронасос на основе быстрого электрохимического актюатора. Детально описан принцип работы, технология изготовления и приведены результаты первых испытаний.
2. ПРИНЦИП РАБОТЫ НАСОСА
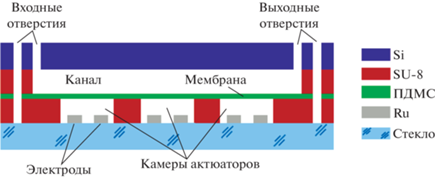
Насос схематично изображен на рис. 1. Он содержит три актюатора, сформированных в слое фоторезиста SU-8 толщиной 16 мкм на стеклянной подложке толщиной 500 мкм. Каждая рабочая камера имеет два электрода. Материалом электродов является проводящий слой алюминия толщиной 500 нм, покрытый рабочим слоем рутения толщиной 150 нм, обладающим высокой стойкостью к износу в электрохимическом процессе переменной полярности [24, 25]. Камеры соединены друг с другом каналом для электролита и закрыты тонкой пленкой полидиметилсилоксана (ПДМС), играющей роль мембраны. Над актюаторами проходит канал для перекачиваемой жидкости, выполненный в слое SU-8 толщиной 10 мкм. Верхней стенкой канала служит кремниевая пластина толщиной 380 мкм с отверстиями для заполнения насоса жидкостью. Каналы для электролита и перекачиваемой жидкости имеют отдельные отверстия и заполняются независимо.
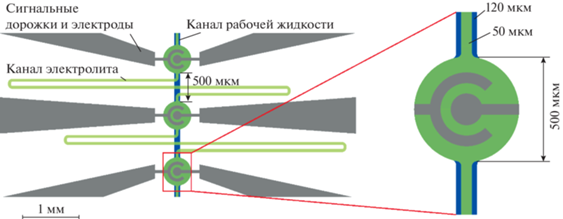
Форма каналов схематично показана на рис. 2. Камеры актюаторов имеют диаметр 500 мкм, что совпадает с размером исходного актюатора, испытанного ранее [22]. Они соединяются друг с другом каналом шириной 50 мкм. Расстояние между камерами составляет 500 мкм. Подача управляющего сигнала на одну пару электродов запускает электролиз в соседних камерах. С целью минимизации этого эффекта длина канала между актюаторами увеличена до 10 мм за счет его зигзагообразной формы. Канал для перекачиваемой жидкости имеет прямую форму и ширину 120 мкм. Он содержит три камеры диаметром 500 мкм, расположенные над актюаторами. Рабочая часть насоса занимает объем около 3 мм3, что на порядок меньше по сравнению с габаритами мембранных насосов, известных на сегодняшний день [18–21, 26]. Электроды имеют концентрическую форму, обеспечивающую наибольшее отклонение мембраны по сравнению с другими конфигурациями [27]. Диаметр внутреннего электрода составляет 150 мкм, внешний электрод имеет форму кольца шириной 50 мкм.
Актюатор работает следующим образом. В камеру закачивается раствор сульфата натрия в дистиллированной воде, играющий роль электролита. На электроды подается серия импульсов напряжения переменной полярности частотой порядка 100 кГц. Над электродами создаются нанопузырьки водорода и кислорода, давление в камере увеличивается, и мембрана движется вверх. Важно отметить, что в электрохимическом процессе переменной полярности формируются лишь нанопузырьки размером 60–80 нм [28]. Главным недостатком электрохимических актюаторов, работающих на постоянном токе, является весьма медленное удаление произведенного газа, занимающее несколько минут и более [29]. Электролиз переменной полярности решает эту проблему. В нанопузырьках, содержащих смесь H2 и O2, реакция горения зажигается спонтанно [30]. Механизм реакции окончательно не ясен, но известно, что важную роль играет большое отношение площади поверхности нанопузырьков к объему [23]. После отключения импульсов давление в камере быстро падает, поскольку встреча двух пузырьков с разными газами приводит к их слиянию вследствие диффузионного газообмена и исчезновению в течение 10 нс в результате реакции горения. Быстрое удаление газа в камере резко сокращает время возвращения мембраны в исходное положение. Таким образом, производство газа в виде нанопузырьков имеет принципиальное значение для ускорения работы актюатора.
Перекачка жидкости осуществляется перистальтическим методом, реализуемым за счет последовательного срабатывания актюаторов. Перистальтика является простым и надежным способом перекачки, который широко применяется в микрофлюидике с использованием актюаторов различных типов [31–34]. Актюаторы срабатывают в последовательности, показанной на рис. 3а, создавая перистальтическую волну и толкая жидкость слева направо. Цикл перекачки состоит из шести фаз. В каждой фазе по меньшей мере одна мембрана находится в поднятом положении, препятствуя обратному течению жидкости. Требуемая последовательность задается управляющими сигналами, показанными на рис. 3б. Серия прямоугольных импульсов напряжения подается на каждый актюатор в течение активного времени ta. Мембрана поднимается и остается в поднятом положении, вытесняя жидкость. В течение пассивного времени tp импульсы выключены, и мембрана возвращается в исходное положение. Сигнал имеет одинаковую форму для всех актюаторов, но для среднего и правого устройств он сдвинут по времени на 2ta/3 и 4ta/3.
Рис. 3.
Принцип работы насоса: (а) последовательность работы актюаторов на одном цикле; (б) осциллограммы управляющего напряжения, подаваемого на актюаторы.
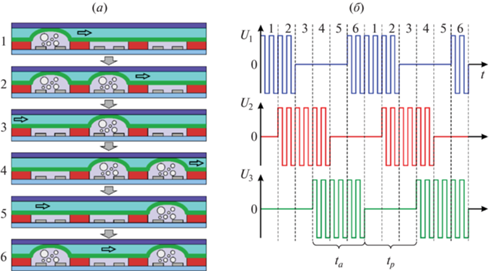
Активное время выбрано равным 20 мс. Работа актюатора в этом режиме широко исследована [24, 27, 35, 36]. Возвращение мембраны в исходное положение занимает 40–60 мс, но в шестифазном цикле ta и tp равны, поэтому на обратное движение отводится лишь 20 мс. В этом случае мембрана не успевает вернуться в исходное состояние и осциллирует в поднятом положении. Испытания актюатора показали, что за активное время ее центр поднимается относительно этого положения на величину d ≈ 5 мкм [24]. Объем жидкости, перекачиваемый за цикл, равен половине объема, вытесняемого мембраной:
где r = 250 мкм – радиус камеры. Согласно выражению (1), насос перекачивает жидкость порциями величиной ΔV = 0.25 нл. Классические микронасосы делают это с шагом в несколько сотен нанолитров [19, 37, 38]. Таким образом, представленное изделие существенно превосходит их по точности дозировки.Цикл работы насоса имеет длительность, равную сумме активного и пассивного времени tc = ta + tp = = 40 мс, а рабочая частота устройства составляет fc = = 1/tc = 25 Гц. Скорость перекачки можно оценить как R = ΔVfc = 0.37 мкл/мин. Это значение невелико по сравнению с расходом жидкости порядка 10 мкл/мин, развиваемым множеством других более крупных насосов [17, 19, 37–39]. Тем не менее, за 1 час работы насос будет перекачивать около 22 мкл жидкости. Этот объем примерно соответствует резервуару размером 5 × 5 × 1 мм, который представляет собой типовую емкость компактной микрофлюидной системы. Кроме того, актюатор способен работать на частотах в 100 Гц и более [35]. В этом случае скорость перекачки будет превышать 1.4 мкл/мин. Таким образом, насос способен обеспечить достойную производительность в сочетании с высокой точностью дозировки, что является весьма привлекательным для систем прецизионной доставки лекарств.
3. ТЕХНОЛОГИЯ ИЗГОТОВЛЕНИЯ
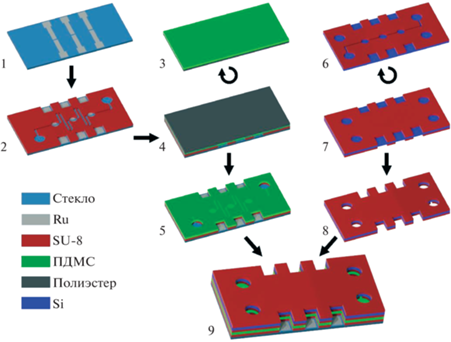
Насос изготавливается на основе стеклянной и кремниевой пластин диаметром 100 мм. Основные технологические этапы представлены на рис. 4. Первым этапом на стеклянной пластине марки Borofloat 33 формируются электроды, сигнальные линии и контактные площадки. Для этого на нее методом магнетронного распыления последовательно наносятся адгезионный слой Ti и проводящий слой Al с толщинами 10 и 500 нм соответственно. Затем методом взрывной фотолитографии формируется маска с рисунком электродов, состоящая из последовательно напыленных слоев Ti и Ru толщиной 10 и 150 нм. Через эту маску выполняется жидкостное травление нижних слоев Al и Ti. Таким образом, электроды представляют собой многослойную структуру Ti/Al/Ti/Ru. Вторым этапом на стеклянную пластину методом центрифугирования наносится слой фоторезиста SU-8 3005 толщиной 16 мкм, в котором формируются камеры актюаторов. Предварительная и финальная сушка фоторезиста проводятся при температуре 95 и 80°С в течение 20 и 10 мин соответственно. Задубливание не выполняется, чтобы исключить окончательное сшивание резиста и сохранить податливость и химический состав поверхности для дальнейшего сращивания.
Третьим этапом формируется мембрана из ПДМС марки Sylgard 184. Базовый компонент и отвердитель смешиваются в соотношении 10 : 1. Полученная смесь обезгаживается и наносится методом центрифугирования на гибкую полиэстеровую пленку при скорости вращения 1000 об./мин. После высыхания при температуре 100°С на пленке формируется слой ПДМС толщиной 60 мкм, который затем сращивается со слоем SU-8 на стеклянной подложке (этап 4). Сращивание выполняется путем обработки ПДМС в азотной плазме в течение 210 с при давлении 0.4 мбар с помощью установки плазменной очистки Diener Atto. Обработанная структура прижимается к слою SU-8, и сборка прогревается в сушильном шкафу в течение 30 мин при температуре 100°C.
Сращивание происходит в результате химической реакции между эпоксидными группами, находящимися на поверхности слоя SU-8, c аминогруппами на поверхности структуры из ПДМС. Достаточное количество эпоксидных групп на поверхности SU-8 обеспечивается естественным образом, если не проводить термических обработок фоторезиста при температуре выше 95°С (именно поэтому задубливание не выполняется). В то же время, аминогруппы на поверхности ПДМС в нормальном состоянии отсутствуют. Они искусственно вносятся путем обработки ПДМС в азотной плазме. Обработанная поверхность ПДМС приводится в контакт с поверхностью SU-8, и выполняется прогрев сборки. Повышенная температура запускает химическую реакцию, в результате которой образуется пептидная (N-C) связь [40]. После сращивания адгезия ПДМС к SU-8 существенно превосходит адгезию ПДМС к пленке, что позволяет удалить пленку вручную. После снятия пленки в слое ПДМС выполняются отверстия для подачи электролита и доступа к контактным площадкам (этап 5).
В предыдущей версии микронасоса использовалась мембрана из нитрида кремния [41]. Процесс сращивания был чувствителен к дефектам и неровностям поверхности пластин и обеспечивал низкий выход годных образцов. ПДМС является гораздо более мягким материалом. Его модуль Юнга составляет 1.3 МПа, в то время как у SiNx эта величина равняется 250 ГПа. Это свойство позволяет огибать детали рельефа и облегчает процесс сращивания. Кроме того, эластичность ПДМС делает мембрану способной выдерживать большое растяжение, имеющее место при взрыве микропузыря в рабочей камере [22].
Следующие этапы выполняются на кремниевой пластине с двусторонней полировкой. На лицевую сторону наносится слой SU-8 толщиной 10 мкм, в котором методом контактной фотолитографии формируются каналы и камеры для рабочей жидкости (этап 6). На тыльную сторону наносится маска из SU-8 (этап 7), через которую выполняется глубокое реактивное ионное травление кремния с использованием плазмы SF6 и CH4F8 [42] (этап 8). В результате травления в пластине формируются отверстия для закачки жидкости и окна для доступа к контактным площадкам. Заключительной операцией является сращивание стеклянной и кремниевой пластин по описанной выше процедуре (этап 9).
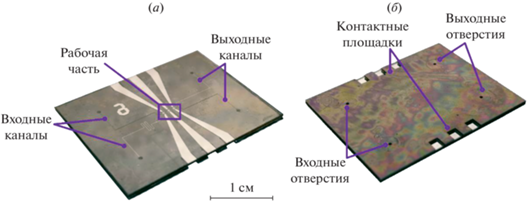
Изготовленный микронасос показан на рис. 5. Он представляет собой чип с латеральным размером 20 × 30 мм и толщиной около 0.9 мм. Со стороны стеклянной подложки видны электроды и каналы с электролитом и перекачиваемой жидкостью. Прозрачность стекла позволяет наблюдать движение мембран и менисков в каналах. Со стороны кремниевой пластины располагаются четыре входных отверстия диаметром 0.5 мм для заполнения каналов жидкостью и окна для доступа к контактным площадкам электродов.
4. ИЗМЕРЕНИЕ РАБОЧИХ ХАРАКТЕРИСТИК
Испытание насоса проводится с помощью держателя, специально изготовленного на 3D-принтере. Фотография держателя представлена на рис. 6. Чип помещается на нижнюю платформу стеклянной стороной вниз и прижимается верхней платформой с использованием винтов. Нижняя платформа содержит шесть вольфрамовых зондов, которые устанавливаются на контактные площадки образца и обеспечивают подачу управляющих сигналов на электроды. Кроме того, в ней предусмотрено окно для наблюдения за движением мембран и жидкости в каналах. Вид образца в смотровое окно показан на рис. 7. Верхняя платформа имеет четыре гнезда для присоединения микрофлюидных трубок внешним диаметром 1.6 мм с помощью специальных уплотнителей. В первую очередь актюаторы заполняются электролитом с помощью шприца. Затем канал для перекачиваемой жидкости заполняется дистиллированной водой. Держатель помещается в оптический микроскоп, оснащенный видеокамерой Moticam 1SP. Образец проверяется на герметичность и подвижность мембран. Для этого в каналах создается избыточное давление за счет сильного нажатия на поршень шприца.
Рис. 6.
Держатель образца: (а) вид со стороны микрофлюидных трубок и зондов; (б) вид со стороны смотрового окна.
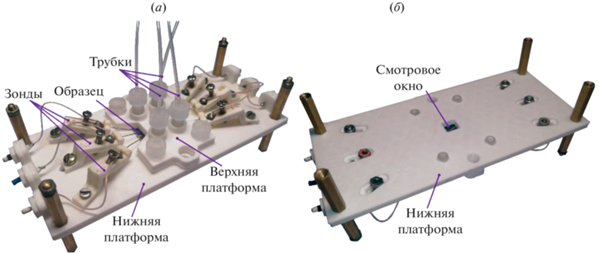
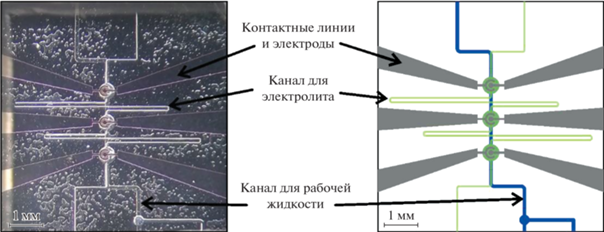
Рис. 7.
Фрагмент образца, наблюдаемый в смотровое окно держателя (слева), и схема этого фрагмента с обозначением структурных элементов (справа).
Управляющее напряжение подается на актюаторы от специально спроектированного и изготовленного трехканального генератора прямоугольных импульсов. Его основой является микроконтроллер STM32G474RBT3, создающий сигнал методом прямого цифрового синтеза, который затем усиливается в 20 раз с помощью встроенного усилителя мощности класса AB. Требуемая форма сигнала задается с помощью специально разработанного программного обеспечения. Для каждого актюатора серия прямоугольных импульсов напряжения подается на рабочий электрод, в то время как противоположный электрод заземлен. Ранее было показано, что увеличение частоты импульсов увеличивает отклонение мембраны и замедляет деградацию электродов [35]. В настоящей работе используется наивысшая частота f = 500 кГц, которую может выдать генератор. Серия содержит N = 104 импульсов и имеет длительность ta = N/f = = 20 мс. Пассивное время также установлено равным 20 мс, поэтому рабочая частота насоса составляет fc = 25 Гц.
Движение мениска перекачиваемой жидкости в канале регистрируется видеокамерой. Видеозапись позволяет измерить расстояние, пройденное мениском, и рассчитать точность дозировки и скорость перекачки. Оценка точности дозировки выполняется путем запуска одиночного цикла работы насоса. Для этого на электроды каждого актюатора подается серия импульсов амплитудой Ua = 5 В. За один цикл работы насос перекачивает объем жидкости ΔV = 0.14 нл, что примерно на 40% меньше расчетного значения. Причиной расхождения является уменьшенный ход мембран актюаторов по сравнению с предполагаемой величиной. Отклонение d ≈ 5 мкм достигается при Ua = 11 В и наличии над мембраной воздуха при атмосферном давлении [24]. В насосе над ней находится перекачиваемая жидкость, которая нагружает мембрану и уменьшает ее ход. Кроме того, испытания проводятся при небольшой амплитуде импульсов, чтобы избежать образования видимых пузырей газа в камерах актюаторов. Прозрачность ПДМС не позволяет измерить отклонение мембраны с помощью интерферометра, как это делалось при исследовании актюатора, покрытого отражающим слоем алюминия [22]. Вытесняемый объем ΔV = = 0.14 нл соответствует ходу мембраны d = 2.9 мкм.
Скорость перекачки измеряется в режиме непрерывной работы насоса. На электроды актюаторов подаются множественные серии импульсов в последовательности, представленной на рис. 3б. Перемещение мениска в канале иллюстрируется видеозаписью, замедленной в 4 раза. На записи видна дискретность перекачки, обусловленная цикличностью работы насоса. За время 1.7 с мениск проходит расстояние 1460 мкм, что соответствует расходу жидкости R = 0.06 мкл/мин. Эта величина примерно в 6 раз меньше расчетного значения. Столь большое расхождение нельзя объяснить снижением хода мембран под нагрузкой. Вероятно, дополнительной причиной является противодавление (backpressure). Выталкивание жидкости в канал нагнетает в нем избыточное давление, которое стремится подать жидкость в обратную сторону. Отклонение мембран недостаточно велико для полного перекрытия канала, поэтому обратный поток не блокируется. Для исключения этого эффекта необходимо привести в соответствие ход мембраны и высоту канала, чтобы обеспечить его перекрытие. Кроме того, следует оснастить насос обратным клапаном, блокирующим обратный поток в случае, когда актюаторы не работают.
Интерес представляет сравнение представленного насоса с известными устройствами. Он имеет существенно меньшие габариты, поэтому сравнение удобно проводить по расходу жидкости, отнесенному к объему рабочей части. Для представленного насоса эта величина составляет 0.02 мкл/(мин мм3). Электрохимические устройства, использующие электролиз постоянного тока, развивают удельную скорость перекачки 0.05 мкл/(мин мм3) [18–21]. Насосы других типов [32, 37–39] способны перекачивать жидкость со скоростью от 1 до 1000 мкл/мин и имеют объем рабочей части свыше 100 мм3. Удельная скорость перекачки данных изделий за редким исключением составляет менее 0.02 мкл/(мин мм3). Таким образом, насос на основе быстрого электрохимического актюатора демонстрирует производительность, сопоставимую с классическими насосами электрохимического типа и изделиями на других рабочих принципах.
ЗАКЛЮЧЕНИЕ
Представлен микронасос на основе быстрого электрохимического актюатора с рутениевыми электродами и ПДМС-мембраной. Чип представляет собой сборку из стеклянной и кремниевой пластин и изготавливается с использованием стандартных техпроцессов микроэлектроники. Технология включает в себя два процесса сращивания ПДМС с SU-8, определяющих герметичность каналов. Устройство содержит три актюатора, работающих по перистальтической схеме. Их малый размер обеспечивает небольшие габариты рабочей части около 3 мм3 и прецизионную дозировку жидкости с точностью 0.14 нл. Частота работы актюаторов составляет 25 Гц и на несколько порядков превышает рабочую частоту классических приводов электрохимического типа. Это позволяет насосу развивать скорость перекачки 0.06 мкл/мин. Насос демонстрирует существенное снижение рабочих характеристик по сравнению с расчетными значениями вследствие уменьшенного хода мембран и наличия противодавления. Тем не менее, по расходу жидкости, отнесенному к размеру рабочей части, насос сопоставим с известными устройствами, а по точности дозировки во много раз превосходит их. В совокупности с малыми габаритами, эти особенности делают его подходящим для использования в микрофлюидных системах, в т.ч. имплантируемых модулях доставки лекарств.
Список литературы
Tang W., Jiang D., Li Z., Zhu L., Shi J., Yang J., Xiang N. Recent advances in microfluidic cell sorting techniques based on both physical and biochemical principles // Electrophoresis. 2019. V. 40. № 6. P. 930–954. https://doi.org/10.1002/elps.201800361
Xu X., Huang X., Sun J., Wang R., Yao J., Han W., Yin M. Recent progress of inertial microfluidic-based cell separation // Analyst. 2021. V. 146. № 23. P. 7070–7086. https://doi.org/10.1039/D1AN01160J
Fujii S.I., Tokuyama T., Abo M., Okubo A. Fluorometric determination of sulfite and nitrite in aqueous samples using a novel detection unit of a microfluidic device // Anal. sci. 2004. V. 20. № 1. P. 209–212. https://doi.org/10.2116/analsci.20.209
Bodor R., Madajová V., Kaniansky D., Masár M., Jöhnck M., Stanislawski B. Isotachophoresis and isotachophoresis—zone electrophoresis separations of inorganic anions present in water samples on a planar chip with column-coupling separation channels and conductivity detection // J. Chromatogr. A. 2001. V. 916. № 1–2. P. 155–165. https://doi.org/10.1016/S0021-9673(00)01080-3
Garcia-Cordero J.L., Maerkl S.J. Microfluidic systems for cancer diagnostics // Current opinion in biotechnol. 2020. V. 65. P. 37–44. https://doi.org/10.1016/j.copbio.2019.11.022
Luan Q., Macaraniag C., Zhou J., Papautsky I. Microfluidic systems for hydrodynamic trapping of cells and clusters // Biomicrofluidics. 2020. V. 14. № 3. P. 031502. https://doi.org/10.1063/5.0002866
Riahi R., Tamayol A., Shaegh S.A.M., Ghaemmaghami A.M., Dokmeci M.R., Khademhosseini A. Microfluidics for advanced drug delivery systems // Curr. Opin. Chem. Eng. 2015. V. 7. P. 101–112. https://doi.org/10.1016/j.coche.2014.12.001
Pons-Faudoa F.P., Ballerini A., Sakamoto J., Grattoni A. Advanced implantable drug delivery technologies: transforming the clinical landscape of therapeutics for chronic diseases //Biomed. microdevices. 2019. V. 21. № 2. P. 1–22. https://doi.org/10.1007/s10544-019-0389-6
Wang Y.N., Fu L.M. Micropumps and biomedical applications–A review // Microelectron. Eng. 2018. V. 195. P. 121–138. https://doi.org/10.1016/j.mee.2018.04.008
Gidde R.R., Pawar P.M., Ronge B.P., Dhamgaye V.P. Design optimization of an electromagnetic actuation based valveless micropump for drug delivery application // Microsyst. Technol. 2019. V. 25. № 2. P. 509–519. https://doi.org/10.1007/s00542-018-3987-y
Pawinanto R.E., Yunas J., Alwani A., Indah N., Alva S. Electromagnetic micro-actuator with silicon membrane for fluids pump in drug delivery system // lab-on a chip.2019. V. 1. № 2. P. 3. https://doi.org/10.18178/ijmerr.8.4.576-579
Conrad H., Schenk H., Kaiser B., Langa S., Gaudet M., Schimmanz K., Lenz M. A small-gap electrostatic micro-actuator for large deflections // Nat. Commun. 2015. V. 6. № 1. P. 1–7. https://doi.org/10.1038/ncomms10078
Lee I., Hong P., Cho C., Lee B., Chun K., Kim B. Four-electrode micropump with peristaltic motion // Sens. Actuator A Phys. 2016. V. 245. P. 19–25. https://doi.org/10.1016/j.sna.2016.04.010
Chia B.T., Liao H.H., Yang Y.J. A novel thermo-pneumatic peristaltic micropump with low temperature elevation on working fluid // Sens. Actuator A Phys. 2011. V. 165. № 1. P. 86–93. https://doi.org/10.1016/j.sna.2010.02.018
Sassa F., Al-Zain Y., Ginoza T., Miyazaki S., Suzuki H. Miniaturized shape memory alloy pumps for stepping microfluidic transport // Sens. Actuators B: Chem. 2012. V. 165. № 1. P. 157–163. https://doi.org/10.1016/j.snb.2011.12.085
Pečar B., Križaj D., Vrtačnik D., Resnik D., Dolžan T., Možek M. Piezoelectric peristaltic micropump with a single actuator // J. Micromech. Microeng. 2014. V. 24. № 10. P. 105010. https://doi.org/10.1088/0960-1317/24/10/105010
Sayar E., Farouk B. Multifield analysis of a piezoelectric valveless micropump: effects of actuation frequency and electric potential // Smart mater. and struct. 2012. V. 21. № 7. P. 075002. https://doi.org/10.1088/0964-1726/21/7/075002
Kim H., Hwang H., Baek S., Kim D. Design, fabrication and performance evaluation of a printed-circuit-board microfluidic electrolytic pump for lab-on-a-chip devices // Sens. Actuator A Phys. 2018. V. 277. P. 73–84. https://doi.org/10.1016/j.sna.2018.04.042
Geipel A., Goldschmidtboeing F., Jantscheff P., Esser N., Massing U., Woias P. Design of an implantable active microport system for patient specific drug release // Biomed. microdevices. 2008. V. 10. P. 469–478. https://doi.org/10.1007/s10544-007-9147-2
Yi Y., Chiao M., Wang B. An electrochemically actuated drug delivery device with in-situ dosage sensing // Smart Mater. and Struct. 2021. V. 30. № 5. P. 055003. https://doi.org/10.1088/1361-665X/abee34
Cobo A., Sheybani R., Tu H., Meng E. A wireless implantable micropump for chronic drug infusion against cancer. Sens. Actuator A Phys. 2016. V. 239. P. 18–25. https://doi.org/10.1016/j.sna.2016.01.001
Uvarov I.V., Lokhanin M.V., Postnikov A.V., Melenev A.E., Svetovoy V.B. Electrochemical membrane microactuator with a millisecond response time // Sens. Actuator B: Chem. 2018. V. 260. P. 12–20. https://doi.org/10.1016/j.snb.2017.12.159
Svetovoy V.B. Spontaneous chemical reactions between hydrogen and oxygen in nanobubbles // Curr. Opin. Colloid Interface Sci. 2021. V. 52. P. 101423. https://doi.org/10.1016/j.cocis.2021.101423
Uvarov I.V., Svetovoy V.B. Nanoreactors in action for a durable microactuator using spontaneous combustion of gases in nanobubbles // Sci. Reports. 2022. V. 12. № 1. P. 20895. https://doi.org/10.1038/s41598-022-25267-2
Shlepakov P.S., Uvarov I.V., Svetovoy V.B. Ruthenium as an electrode material for the fast electrochemical actuator // St. Petersburg State Polytech. Univ. J. Phys. and Math. 2022. V. 15. № 3.2. P. 280–284. https://doi.org/10.18721/JPM.153.351
Zhao B., Cui X., Ren W., Xu F., Liu M., Ye Z. G. A controllable and integrated pump-enabled microfluidic chip and its application in droplets generating // Sci. Reports. 2017. V. 7. № 1. P. 1–8. https://doi.org/10.1038/s41598-017-10785-1
Uvarov I.V., Melenev A.E., Selyukov R.V., Svetovoy V.B. Improving the performance of the fast electrochemical actuator // Sens. Actuator A Phys. 2020. V. 315. P. 112346. https://doi.org/10.1016/j.sna.2020.112346
Postnikov A.V., Uvarov I.V., Penkov N.V., Svetovoy V.B. Collective behavior of bulk nanobubbles produced by alternating polarity electrolysis // Nanoscale. 2018. V. 10. № 1. P. 428–435. https://doi.org/10.1039/C7NR07126D
Yi Y., Buttner U., Carreno A.A., Conchouso D., Foulds I.G. A pulsed mode electrolytic drug delivery device // J. Micromech. Microeng. 2015. V. 25. № 10. P. 105011. https://doi.org/10.1088/0960-1317/25/10/105011
Svetovoy V.B., Sanders R.G., Lammerink T.S., Elwenspoek M.C. Combustion of hydrogen-oxygen mixture in electrochemically generated nanobubbles // Phys. Rev. E. 2011. V. 84. № 3. P. 035302. https://doi.org/10.1103/PhysRevE.84.035302
Stout J.M., Baumgarten T.E., Stagg G.G., Hawkins A.R. Nanofluidic peristaltic pumps made from silica thin films // J. Micromech. Microeng. 2019. V. 30. № 1. P. 015004. https://doi.org/10.1088/1361-6439/ab4cc9
Forouzandeh F., Arevalo A., Alfadhel A., Borkholder D.A. A review of peristaltic micropumps // Sens. Actuator A Phys. 2021.V. 326. P. 112602. https://doi.org/10.1016/j.sna.2021.112602
Tanaka Y. A peristaltic pump integrated on a 100% glass microchip using computer controlled piezoelectric actuators // Micromachines. 2014. V. 5. № 2. P. 289–299. https://doi.org/10.3390/mi5020289
Jeong O.C., Konishi S. Fabrication of a peristaltic micro pump with novel cascaded actuators // J. Micromech. Microeng. 2008. V. 18. № 2. P. 025022. https://doi.org/10.1088/0960-1317/18/2/025022
Uvarov I.V., Melenev A.E., Lokhanin M.V., Naumov V.V., Svetovoy V.B. A fast electrochemical actuator in the non-explosive regime. // J. Micromech. Microeng. 2019. V. 29. № 11. P. 114001. https://doi.org/10.1088/1361-6439/ab3bde
Uvarov I.V., Melenev A.E., Svetovoy V.B. Fast Electrochemical Actuator with Ti Electrodes in the Current Stabilization Regime // Micromachines. 2022. V. 13. № 2. P. 283. https://doi.org/10.3390/mi13020283
Dumont-Fillon D., Tahriou H., Conan C., Chappel E. Insulin micropump with embedded pressure sensors for failure detection and delivery of accurate monitoring // Micromachines. 2014. V. 5. № 4. P. 1161–1172. https://doi.org/10.3390/mi5041161
Spieth S., Schumacher A., Holtzman T., Rich P.D., Theobald D.E., Dalley J.W., Zengerle R. An intra-cerebral drug delivery system for freely moving animals // Biomed. microdevices, 2012. V. 14. № 5. P. 799–809. https://doi.org/10.1007/s10544-012-9659-2
Mousoulis C., Ochoa M., Papageorgiou D., Ziaie B. A skin-contact-actuated micropump for transdermal drug delivery // IEEE. Trans. Biomed. Eng. 2011. V. 58. № 5. P. 1492–1498. https://doi.org/10.1109/TBME.2011.2113347
Zhang Z., Zhao P., Xiao G., Watts B.R., Xu C. Sealing SU-8 microfluidic channels using PDMS // Biomicrofluidics. 2011. V. 5. № 4. P. 046503. https://doi.org/10.1063/1.3659016
Uvarov I.V., Shlepakov P.S., Melenev A.E., Ma K., Svetovoy V.B., Krijnen G.J. A Peristaltic Micropump Based on the Fast Electrochemical Actuator: Design, Fabrication, and Preliminary Testing // Actuators. 2021. V. 10. № 3. P. 62. https://doi.org/10.3390/act10030062
Golishnikov A.A., Kostyukov D.A., Putrya M.G. Research and development of deep anisotropic plasma silicon etching process to form MEMS structures // Russian Microelectronics. 2012. V. 41. № 7. P. 365–369. https://doi.org/10.1134/S1063739712070062
Дополнительные материалы отсутствуют.
Инструменты
Микроэлектроника