Известия РАН. Механика жидкости и газа, 2023, № 2, стр. 9-19
МАТЕМАТИЧЕСКОЕ МОДЕЛИРОВАНИЕ ВЛИЯНИЯ КЛЕТОЧНОЙ ПОДВИЖНОСТИ И МЕЖКЛЕТОЧНЫХ АКТИВНЫХ ВЗАИМОДЕЙСТВИЙ НА СОРТИРОВКУ ДВУХ ТИПОВ КЛЕТОК В КУЛЬТУРАХ БИОЛОГИЧЕСКИХ ТКАНЕЙ
a Национальный исследовательский университет “Высшая школа экономики”
Москва, Россия
b МГУ им. М.В. Ломоносова, Научно-исследовательский институт механики
Москва, Россия
* E-mail: logv@bk.ru
Поступила в редакцию 03.10.2022
После доработки 11.10.2022
Принята к публикации 11.10.2022
- EDN: NTKIEV
- DOI: 10.31857/S0568528122600813
Аннотация
Движение клеток лежит в основе многих биологических явлений. Важную роль в управлении клеточными движениями играют активные напряжения, которые развиваются в биологических тканях в результате механических взаимодействий клеток между собой. Изучение эволюции смесей клеток разных типов, образующих клеточные агрегаты, показало, что активные силовые межклеточные взаимодействия приводят к пространственному разделению клеток разных типов – сортировке клеток. В рамках континуальной модели биологической сплошной среды [24] (клетки разных типов рассматриваются как отдельные фазы), в данной работе проведено исследование влияния параметров, которые характеризуют различные механизмы развития активных межклеточных напряжений, а также адгезию и клеточную подвижность на процесс сортировки двух типов клеток, образующих в начальный момент времени агрегат сферической формы. Показано, что достаточными условиями сортировки клеток разных типов и формирования резкой границы между областями, которые они занимают, является отсутствие стягивающих взаимодействий между клетками разных фаз при условии асимметрии начальных распределений их концентрации или асимметрии параметров, характеризующих развитие активных напряжений в разных фазах. Показано, что клетки той фазы, в которой активные стягивающие межклеточные взаимодействия сильнее (при одинаковых для разных клеточных фаз значениях остальных параметров и одинаковых начальных распределениях концентраций фаз), стремятся занять центральную область сфероида. В то же время клетки другой фазы, между которыми стягивающие взаимодействия слабее, вытесняются на периферию. Увеличение параметра, характеризующего отталкивание клеток, приводит к вытеснению этой клеточной фазы на периферию. Помимо сил активного взаимодействия клеточные движения могут контролироваться как механическими пассивными свойствами среды, так и подвижностью клеток. Асимметрия межфазного распределения этих параметров может приводить к тому, что клетки, обладающие большими стягивающими взаимодействиями, будут вытесняться в периферическую область клеточного сфероида и окружать клетки, между которыми эти взаимодействия слабее.
Миграция клеток как в виде коллективного движения клеточных пластов, в которое оказываются вовлечены большие группы прочно скрепленных между собой клеток, так и миграция клеток, сопровождаемая их движением друг относительно друга, является фундаментальным процессом, который имеет ключевое значение для самых разных биологических явлений, проявляющихся на всех этапах жизни животных и человека. Клеточная миграция необходима как для нормального функционирования многоклеточного организма, так и при развитии заболеваний. Движения эмбриональных клеток лежат в основе формирования структур, которые в процессе развития организма трансформируются в ткани и органы [1–4]. Закрытие раны в слое клеток сопровождается миграцией клеток в зону повреждения под действием сил, создаваемых самими клетками [4–6]. Миграция клеток является также неотъемлемой частью развития и паталогических процессов таких, как рост и метастазирование опухолей [4, 7, 8].
Поля механических напряжений, которые развиваются в тканях в результате активных механических взаимодействий клеток между собой и с внеклеточным матриксом, имеют решающее значение в управлении направленными клеточными движениями, приводящими к формированию различных структур [2, 4, 6–9].
Важной задачей является понимание физических и биологических механизмов на клеточном и тканевом масштабах, управляющих развитием активных напряжений и, тем самым, движением клеток. Регуляция миграции опухолевых клеток представляет несомненную практическую значимость.
Активные взаимодействия между клетками создаются и контролируются механизмами, главным образом связанными с участием межклеточной адгезии (скрепления поверхностей соседних клеток посредством специфических молекул) и сокращением элементов клеточного скелета. Однако проявление этих механизмов может существенно различаться для клеток разных типов и разных тканей.
В одних случаях наблюдается образование различного вида выростов клеточной мембраны (протрузий), способных закрепляться на поверхностях соседних клеток (для эмбриональных клеток) [2, 10–12] или образовывать прочные контакты с внеклеточным матриксом (в частности, для опухолевых клеток) [5, 7]. Развитие сократительных усилий в них приводит к развитию активных напряжений в среде и перемещению клеток.
В других случаях создание активных сил связано с участием натяжения сократительных элементов клеточного скелета в поверхностных областях внутриклеточного пространства (кортикального натяжения) совместно регулируемого с межклеточной адгезией [13–16]. Сила, способствующая сближению клеток, создается натяжением по границе области контакта между клетками, а поверхностные молекулы адгезии обеспечивают прочность механического соединения контактирующих клеток.
В тканях, образованных плотно упакованными клетками, имеющими вид многогранников, механизм межклеточных взаимодействий отличается от двух предыдущих. Сила взаимодействия между клетками этих тканей создается анизотропным сокращением межклеточных границ, в результате чего граница между одной парой клеток исчезает, и появляется новая граница между двумя другими клетками. Анизотропия развития сократительной активности может определяться биологически предпочтительной ориентацией межклеточных границ, на которых образуются сократительные структуры [17, 18], или соседством с клетками другого типа [19–21].
Изучение эволюции простых клеточных систем таких, как пространственные клеточные агрегаты, показало, что активные силовые взаимодействия между клетками приводят к формированию неоднородных клеточных структур [15, 22, 23]. В агрегатах, полученных перемешиванием клеток двух разных типов, происходит их пространственное разделение (сортировка клеток) – формируются структуры, характеризуемые образованием компактной массы клеток одного типа, окруженной клетками другого типа.
Первые результаты решения ставшей в настоящее время классической задачи о сортировке двух разных типов клеток были получены с использованием дискретных “энергетических” моделей, в которых эволюция системы направлена на минимизацию энергии, учитывающей различные механизмы взаимодействия между соседними клетками. Их обзор приведен в [15, 23].
Дискретные модели, использующие принцип минимизации энергии, позволили получить хорошие результаты при описании сортировки клеток, однако, они оставляют без ответа вопрос о том, как механизмы на клеточном уровне связаны с характеристиками среды на тканевом уровне: как развитие активных напряжений и деформационные характеристики клеточной сплошной среды связаны с адгезионными взаимодействиями клеток и напряжениями в клеточном скелете.
Континуальные модели, описывающие поведение биологических сред, образованных активно взаимодействующими клетками, представлены достаточно небольшой группой работ, кратко обсуждаемых в [24]. Разработанная в [24] модель основывается на общих принципах механики многофазных сплошных сред и описывает эволюцию клеточных систем, используя несомненные физические механизмы, которые связаны с активными межклеточными взаимодействиями и подвижностью клеток.
Исследование различных постановок задач (в рамках континуального подхода), в которых учитывается подвижность границ областей, занятых клетками разных типов выполнено в [25, 26]. Исследуемые постановки задач, описывающие перераспределение клеток в плоском слое и сферическом агрегате, различаются граничными условиями. В обеих постановках внешние границы клеточных фаз подвижны, но в одном случае для обеих фаз эти границы совпадают, а в другом перемещаются независимо в соответствии с условиями их нагружения. Таким образом, оказывается возможным описывать образование и перемещение фронтов, разделяющих области с различными объемными концентрациями клеток разных типов. В этих работах выполнено сравнение решений обеих постановок задач с целью выяснения того, какая из них физически более адекватно описывает процесс сортировки клеток.
В данной работе будет проведено исследование степени участия различных физических механизмов управления движением клеток, на процесс сортировки двух типов клеток, образующих в начальный момент времени агрегат сферической формы.
1. ПОСТАНОВКА ЗАДАЧИ И МЕТОД РЕШЕНИЯ
Рассмотрим задачу о перераспределении объемных концентраций двух типов клеток, которые в начальный момент времени равномерно перемешаны и образуют клеточный агрегат сферической формы (рис. 1). Постановка задачи об эволюции клеточной системы в рамках разработанной в [24] континуальной модели биологической сплошной многофазной среды, состоящей из двух активно взаимодействующих клеточных фаз и жидкости, подробно описана [26]. Ниже приведены краткое описание полной системы уравнений и основные предположения, включенные в постановку задачи. Более подробно будут обсуждаться только те уравнения, которые описывают механизмы, исследуемые в следующем разделе.
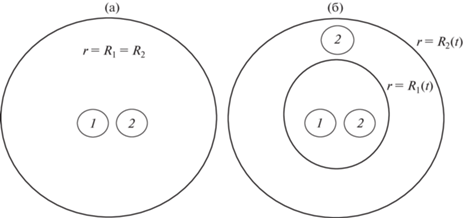
Рис. 1.
Схематическое изображение структуры клеточного сфероида, образованного клетками 1-го и 2-го типов в разные моменты времени. Номера клеточных фаз в разных областях сфероида обведены маленькими кругами. (а) Строение в начальный момент времени. (б) Строение в некоторый момент времени $t$, когда границы клеточных фаз разошлись. Координаты $r = {{R}_{1}}(t)$ и $r = {{R}_{2}}(t)$ являются радиусами сфер, ограничивающих первую и вторую клеточную фазы соответственно.
Клеточная среда рассматривается как многофазный континуум. Она образована двумя клеточными фазами, жидкостью и вспомогательными фазами, о которых будет сказано ниже. Решение задачи выполнено в предположении сферической симметрии, и все уравнения написаны в физическом базисе сферической системы координат с началом в центре сферы. У всех тензоров смешанные компоненты считаются равными нулю. Будем отмечать компоненты тензоров в направлениях $r$, $\varphi $ и $\theta $ соответствующим буквенным индексом, заменяя повторяющийся индекс однократным. У единственной отличной от нуля компоненты векторов скорости в радиальном направлении индекс $r$ опускается, а нижним индексом будем обозначать номер клеточной фазы.
Уравнения неразрывности для клеточных фаз написаны в предположении отсутствия в среде деления и гибели клеток, а также потоков массы между клеточными фазами и жидкостью. Истинные плотности фаз считаются постоянными и равными между собой, поэтому объемные концентрации фаз совпадают с массовыми.
В уравнениях импульсов пренебрегается силой межфазного вязкого трения между клеточными фазами и жидкостью. Это позволяет пренебречь изменением гидростатического давления во внеклеточной жидкости, считая его равным нулю, и решать уравнения для клеточных фаз отдельно от уравнений, описывающих движение жидкости.
Для описания сил активных взаимодействий между клетками в работах [24, 27] было предложено введение вспомогательных фаз, в которых развиваются активные напряжения. Материальными носителями вспомогательных фаз могут быть соответствующие сократительные структуры клеточного скелета, которые обеспечивают передачу усилий между клетками и приводят к их взаимному движению. Активные взаимодействия между клетками описываются посредством введения трех вспомогательных фаз, две из которых обеспечивают активные взаимодействия между клетками, принадлежащими только к первой или только ко второй клеточной фазе, и характеризующимися тензорами напряжений ${{\tau }^{{(1)}}}$ и ${{\tau }^{{(2)}}}$ соответственно. Третья дополнительная фаза с тензором напряжений ${{\tau }^{{(12)}}}$ обеспечивает перекрестные активные взаимодействия между клетками разных фаз. Объемы, занимаемые дополнительными фазами, считаются пренебрежимо малыми в сравнении с объемами основных фаз. Уравнения баланса импульса для клеточных фаз, в пренебрежении инерционными эффектами, учитывают силы их взаимодействия с дополнительными фазами, а также силы межфазного взаимодействия между двумя клеточными фазами.
Выражение для силы взаимодействия между клеточными фазами (пассивного взаимодействия), полученное в [24], учитывает две составляющие, одна из которых связана с действием сил давления в клеточных фазах, вторая – с силой вязкого трения на межфазных поверхностях.
Определяющие соотношения для активных напряжений в дополнительных фазах учитывают как хаотическую активность клеток в создании активных напряжений, которая характеризуется давлениями ${{\Pi }_{1}}$, ${{\Pi }_{2}}$, ${{\Pi }_{{12}}}$ и проявляется в их отталкивании, так и направленные стягивающие усилия, определяемые неоднородными внешними стимулами – соседством с другими клетками. Предполагается, что активные стягивающие взаимодействия развиваются только между клетками внутри фаз, а между клетками разных фаз отсутствуют. Таким образом, в межфазной перекрестной активной силе будем учитывать только расталкивающую компоненту. Определяющие соотношения для активных напряжений в работе [24] приняты в следующем виде:
(1.1)
$\tau _{\alpha }^{{(1)}} = - {{\Pi }_{1}} + {{m}_{1}}\frac{3}{{4\pi R_{s}^{4}}} \cdot {{\phi }_{1}}\int\limits_S {{{\phi }_{1}} \cdot r_{\alpha }^{2}ds} ,\quad \tau _{\alpha }^{{(2)}} = - {{\Pi }_{2}} + {{m}_{2}}\frac{3}{{4\pi R_{s}^{4}}} \cdot {{\phi }_{2}}\int\limits_S {{{\phi }_{2}} \cdot r_{\alpha }^{2}ds} $(1.2)
${{\Pi }_{1}} = {{E}_{1}}\frac{{\phi _{1}^{2}}}{{1 - {{\phi }_{1}} - {{\phi }_{2}}}},\quad {{\Pi }_{2}} = {{E}_{2}}\frac{{\phi _{2}^{2}}}{{1 - {{\phi }_{1}} - {{\phi }_{2}}}},\quad \tau _{\alpha }^{{(12)}} = - {{\Pi }_{{12}}} = - {{E}_{{12}}}\frac{{{{\phi }_{1}}{{\phi }_{2}}}}{{1 - {{\phi }_{1}} - {{\phi }_{2}}}}$Здесь ${{\phi }_{1}}$ и ${{\phi }_{2}}$ – объемные концентрации первой и второй клеточных фаз соответственно. Интегрирование в соотношениях (1.1) выполняется по сферической поверхности $S$ фиксированного для данной среды радиуса ${{R}_{s}}$ (радиуса дальнодействия) с центром в рассматриваемой точке. Для точек, находящихся на расстоянии, меньшем ${{R}_{s}}$ от поверхности клеточного сфероида, интегрирование ведется только по той части поверхности сферы, которая лежит внутри этого объема. Индекс $\alpha $ принимает значения $r$, $\varphi $ и $\theta $, при этом ${{r}_{r}}$, ${{r}_{\varphi }}$ и ${{r}_{\theta }}$ – координаты радиус-вектора точек на поверхности сферы $S$ в локальном физическом базисе сферической системы координат.
В общем случае для многоклеточной биологической среды тензор скоростей деформации клеточных фаз можно представить в виде суммы составляющих, связанных с деформацией самих клеток и с их переупаковкой [28]. В работе [29] принята гипотеза о возможности пренебречь первой составляющей по сравнению со скоростью деформирования, связанного с переупаковками клеток. Будем рассматривать переупаковку клеток как течение, управляемое напряжениями в самих клеточных фазах (${{\sigma }^{{(1)}}}$ и ${{\sigma }^{{(2)}}}$ – тензоры напряжений для первой и второй фазы соответственно) и активными напряжениями. Выражения для компонент тензоров скоростей деформации $e_{\alpha }^{{(1)}}$ и $e_{\alpha }^{{(2)}}$ ($\alpha $ принимает значения $r$, $\varphi $ и $\theta $) первой и второй клеточных фаз соответственно примем в следующем виде:
(1.3)
$e_{\alpha }^{{(1)}} = \frac{1}{{2{{\mu }_{1}}}}(\sigma _{\alpha }^{{(1)}} - {{\phi }_{2}}\sigma _{\alpha }^{{(2)}}) - \frac{1}{{2{{\mu }_{{11}}}}}\tau _{\alpha }^{{(1)}} - \frac{1}{{2{{\mu }_{{12}}}}}\tau _{\alpha }^{{(12)}}$(1.4)
$e_{\alpha }^{{(2)}} = \frac{1}{{2{{\mu }_{2}}}}(\sigma _{\alpha }^{{(2)}} - {{\phi }_{1}}\sigma _{\alpha }^{{(1)}}) - \frac{1}{{2{{\mu }_{{22}}}}}\tau _{\alpha }^{{(2)}} - \frac{1}{{2{{\mu }_{{21}}}}}\tau _{\alpha }^{{(12)}}$Выбор знаков учитывает, что растягивающие напряжения во вспомогательных фазах стимулируют сближение клеток (уплотнение клеточной фазы), а растягивающие клеточные напряжения в рассматриваемой фазе и сжимающие клеточные напряжения в соседней фазе этому уплотнению препятствуют. Полная система уравнений дополняется кинематическими соотношениями для компонент тензоров скоростей деформации клеточных фаз.
Граничные условия учитывают возможность независимого перемещения поверхностей, ограничивающих клеточные фазы. Координаты $r = {{R}_{1}}(t)$ и $r = {{R}_{2}}(t)$ являются радиусами сфер, которые ограничивают области, занятые первой и второй клеточной фазой соответственно (рис. 1б).
В начальный момент времени клетки обеих фаз заполняют весь объем сферы, и в качестве начальных условий при t = 0 будем задавать положение границ клеточных фаз ${{R}_{1}}(0) = {{R}_{2}}(0) = {{R}_{0}}$ и начальные распределения концентраций фаз ${{\phi }_{1}}(0,\;x) = {{\phi }_{{10}}}(x)$, ${{\phi }_{2}}(0,\;x) = {{\phi }_{{20}}}(x)$. В дальнейшем при решении задачи будет происходить разделение границ областей, занятых клетками разных типов.
Сила, действующая на внешней границе со стороны окружающей среды, сводится к давлению жидкости и равна нулю. Будем предполагать, что в начальный момент времени (и пока ${{R}_{1}}(t) = {{R}_{2}}(t)$) на внешней границе нагрузка распределена равномерно между фазами пропорционально их концентрациям.
После разделения границ условие отсутствия нагрузки на внешней поверхности сферы справедливо только для клеточной фазы, граница которой является границей сферы (“внешняя” фаза). На границе (внутренняя граница) клеточной фазы, переместившейся вглубь сферы (“внутренняя” фаза), должны быть сформулированы условия, учитывающие перераспределение нагрузки между фазами (условия на разрыве были получены в [25]) и условие непрерывности потока массы внешней фазы.
Перемещение границ $r = {{R}_{1}}(t)$ и $r = {{R}_{2}}(t)$ определяется движением клеток соответствующих фаз, поэтому считаются выполненными условия ${{\dot {R}}_{1}}(t) = {{{v}}_{1}}$ при $r = {{R}_{1}}(t)$ и ${{\dot {R}}_{2}}(t) = {{{v}}_{2}}$ при $r = {{R}_{2}}(t)$, где ${{{v}}_{1}}$ и ${{{v}}_{2}}$ – радиальные компоненты векторов скорости клеточных фаз. Из уравнений неразрывности и условия ограниченности скоростей фаз в центре сферы следует, что при r = 0: ${{{v}}_{1}} = {{{v}}_{2}} = 0$.
Граничные условия для ${{\phi }_{1}}$ при r = 0 и $r = {{R}_{1}}(t)$, а также ${{\phi }_{2}}$ при r = 0 и $r = {{R}_{2}}(t)$ не ставятся, так как границы фаз перемещаются со скоростями, равными скоростям частиц соответствующих фаз на этих границах. То есть границы r = 0 и $r = {{R}_{1}}(t)$ являются характеристиками уравнений соответствующих уравнений неразрывности.
Преобразование и схема численного решения полной системы уравнений с описанными граничными условиями приведены в [26].
2. РЕЗУЛЬТАТЫ РАСЧЕТОВ И ОБСУЖДЕНИЕ
Присутствие двух слагаемых в определяющих соотношениях для активных напряжений (1.1) учитывает действие различных механизмов в создании силы взаимодействия между клетками. Вклад различных механизмов в результирующее активное напряжение определяется выбором соответствующих коэффициентов. Первое слагаемое в (1.1), описывающее отталкивание клеток (активное давление), может обеспечиваться не только хаотической активностью клеток, но также и биологическими механизмами, связанными с реакцией клеток на свое окружение. В ряде тканей этот процесс может запускается специфическими поверхностными молекулами при участии внутриклеточных регуляторов активности клеточного скелета [30, 31]. На клеточном уровне эти реакции характеризуются локальным увеличением сократимости кортикальных элементов клеточного скелета, приводящим к дестабилизации клеточной адгезии, подавлению протрузий в месте контакта, и изменению направления движения клеток. Флуктуации поверхностей клеток [32] и силы электростатического взаимодействия между контактирующими участками мембран соседних клеток также могут принимать участие в отталкивании клеток [33].
Интегральные слагаемые в (1.1) описывают направленные активные стягивающие взаимодействия между клетками. Развитие стягивающих взаимодействий может обеспечиваться как активными сокращениями в протрузиях, так и кортикальным натяжением в клетках. В обоих случаях величина сократительного усилия контролируется клеточной адгезией [34, 35].
Формулировка законов, определяющих скорость деформации клеточных фаз (1.3) и (1.4), предполагает, что процесс взаимного перемещения клеток друг относительно друга может управляться физически различными механизмами. Первые два слагаемых описывают поведение клеточных фаз как вязкое течение, сопровождаемое разрывом одних и образованием других клеточных контактов. Этот процесс контролируется прочностью межклеточных контактов. Физически коэффициенты μ1 и μ2 можно рассматривать как коэффициент вязкости среды.
Последние два слагаемых в (1.3) и (1.4) отвечает за перемещения клеток вследствие их механической активности, управляемой активными напряжениями. Этот механизм перемещения у ряда типов клеток проявляется в их способности распластываться и перемещаться на плоском субстрате в результате развития активных напряжений. В ткани эти клетки могут осуществлять перемещения и менять соседей в результате активных взаимодействий с поверхностями соседних клеток, используя их в качестве субстрата. Этот процесс можно рассматривать как проявление клеточной подвижности, а коэффициенты $1{\text{/}}{{\mu }_{{k\,n}}}$ ($k = 1,\;2$; $n = 1,\;2$) в дальнейшем будут называться коэффициентами клеточной подвижности.
Гипотезы, привлекаемые для объяснения явления сортировки двух типов клеток, и экспериментальные данные, связанные с сортировкой, свидетельствуют в конечном итоге о решающей роли параметров, которые характеризуют различные механизмы развития активных напряжений, а также межклеточную адгезию и клеточную подвижность. Последующее исследование эволюции плотностей клеток в сфероиде будет выполнено в зависимости от значений соответствующих безразмерных параметров.
Введем безразмерные величины:
Здесь E и $\mu $ – некоторые характерные значения соответствующих групп коэффициентов, k12 – коэффициент вязкого трения между клеточными фазами. В дальнейшем звездочку при безразмерных параметрах будем опускать.
В последующих расчетах, если не сказано иначе, в качестве стандартного набора безразмерных параметров приняты значения такие же, как в [25, 26]:
Использование данного набора значений параметров предполагает, что активные стягивающие взаимодействия внутри клеточных фаз доминируют над активными стягивающими взаимодействиями между клетками, принадлежащим разным фазам. При этом стягивающие взаимодействия внутри первой клеточной фазы незначительно превышают таковые внутри второй клеточной фазы. Можно сказать, что параметры $m_{1}^{{}}$ и $m_{2}^{{}}$ характеризуют так называемое в биологии сродство клеток – стремление взаимодействовать и устанавливать контакты между клетками одного типа. Параметры $E_{1}^{{}}$ и $E_{2}^{{}}$, характеризующие активные давления, предполагаются равными. Параметры, характеризующие вязкие свойства фаз и подвижность клеток разных фаз также предполагаются одинаковыми.
А) Рассмотрим влияние параметров, характеризующих сродство клеток, на их сортировку. Будет исследована эволюция пространственно-однородных начальных распределений концентраций клеток ${{\phi }_{1}}(0,\;x) = {{\phi }_{{10}}}$, ${{\phi }_{2}}(0,\;x) = {{\phi }_{{20}}}$. На рис. 2а представлены распределения концентраций клеточных фаз ${{\phi }_{1}}$ и ${{\phi }_{2}}$ в разные моменты времени и эволюция границ клеточных фаз (рис. 2б) при значениях параметров из стандартного набора (${{m}_{1}} = 7$ и ${{m}_{2}} = 6$) и при ${{m}_{1}} = 12$, ${{m}_{2}} = 11$.
Рис. 2.
Решения задачи о сортировке клеток при совпадающих пространственно-однородных начальных условиях ${{\phi }_{1}}(0,\;x) = {{\phi }_{{10}}}$, ${{\phi }_{2}}(0,\;x) = {{\phi }_{{20}}}$ и стандартных значениях параметров. (а) Распределения концентраций клеток (1 и 2 для ${{\phi }_{1}}$ и ${{\phi }_{2}}$ соответственно) в разные моменты времени. Штриховые линии – распределения концентраций при $t = 0.1$, сплошные линии – при t = 10. (б) Эволюция границ клеточных фаз (1 и 2 для ${{R}_{1}}{\text{/}}{{R}_{0}}$ и ${{R}_{2}}{\text{/}}{{R}_{0}}$ соответственно). Сплошные кривые соответствуют ${{m}_{1}} = 7$ и ${{m}_{2}} = 6$, штриховые – ${{m}_{1}} = 12$ и ${{m}_{2}} = 11$.
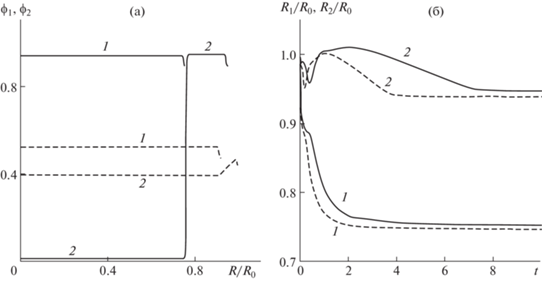
Распределения концентраций клеток при стандартных значениях параметров (рис. 2а), демонстрируют пространственное разделение двух типов клеток, которые первоначально равномерно заполняли сферический клеточный агрегат. Полученные результаты показывают, что клетки первой фазы, в которой активные стягивающие межклеточные взаимодействия сильнее (при одинаковых для разных клеточных фаз значениях остальных параметров), стремятся занять центральную область сфероида. В то же время клетки второй фазы, обладающие более слабыми стягивающими взаимодействиями, вытесняются на периферию. Обрыв линий 1 соответствует границе области, занятой клетками первой фазы. Эта граница делит клеточный сфероид на две части, первая из которых занята клетками первой и второй фазы. При этом концентрация клеток второй фазы в этой области приближается к нулю, и они имеют тенденцию сосредоточиться во внешней области. Обрыв линий 2 соответствует внешней границе сфероида. Вид графиков на рис. 2а свидетельствует о формировании четкой границы, разделяющей клеточный сфероид на две области, каждая из которых занята клетками только одного типа.
Численное исследование показало, что распределения, представленные на рис. 2а сплошными линиями (при $t = 10$), остаются практически неизменными в последующие моменты времени. Предельные распределения концентрации клеток (при увеличении времени), полученные при ${{m}_{1}} = 12$ и ${{m}_{2}} = 11$, почти полностью совпадают со сплошными линиями на рис. 2а (плато расположены на $ \sim {\kern 1pt} 2.5\% $ выше).
Эволюция границ клеточных фаз, представленная на рис. 2б, сопровождается их стремлением к некоторым стационарным значениям. При этом стационарные значения радиусов границ клеточных фаз очень слабо зависят от значений коэффициентов, характеризующих развитие активных стягивающих взаимодействий между клетками внутри фаз – увеличение ${{m}_{1}}$ и ${{m}_{2}}$ почти в два раза фактически не меняет предельные значения ${{R}_{1}}$ и ${{R}_{2}}$. Однако величины ${{m}_{1}}$ и ${{m}_{2}}$ оказывают влияние на скорость сортировки – штриховые линии на рис. 2б быстрее приближаются к своим стационарным значениям.
В работах [30, 31] утверждается, что для формирования и поддержания резкой границы между клетками разных типов достаточны два условия – это отсутствие стягивающих взаимодействий и развитие отталкивающих взаимодействий между клетками разных типов вдоль границы по разные ее стороны даже при идентичности параметров, характеризующих активные межклеточные взаимодействия (таких как адгезия и кортикальное натяжение).
Очевидно, что отсутствие различий между параметрами, характеризующими развитие активных напряжений в разных клеточных фазах, не может привести к сортировке клеток за счет межфазного активного давления, характеризуемого коэффициентом ${{E}_{{12}}}$, при условии полной идентичности всех остальных определяющих параметров и начальных распределений концентраций фаз. Однако расчеты показали, что если различие между ${{m}_{1}}$ и ${{m}_{2}}$ имело место только на некотором начальном интервале времени (${{m}_{1}} = 7$ и ${{m}_{2}} = 6$ при $t < 0.1$), а далее их значения совпадают (${{m}_{1}} = {{m}_{2}} = 6$), то в этом случае сформировавшаяся на начальном этапе асимметрия распределения концентраций фаз (штриховая линия на рис. 2а) в дальнейшем развивается почти также, как и при стандартных параметрах (рис. 2). В отличие от работ [30, 31], формирование четкой границы не требует увеличения значения коэффициента $E_{{12}}^{{}}$, характеризующего расталкивание клеток разных типов. Достаточными условиями сортировки клеток разных типов и формирования резкой границы между областями, которые они занимают, является отсутствие стягивающих взаимодействий между клетками разных фаз при условии асимметрии начальных распределений их концентрации или асимметрии параметров, характеризующих развитие активных напряжений в разных фазах. В рассматриваемой постановке задачи изменение $E_{{12}}^{{}}$ оказывает влияние на эволюцию сортировки, однако, предельные распределения и положения границ клеточных фаз остаются практически без изменения.
Б) Рассмотрим влияние составляющей активных напряжений, которая описывает нелинейное активное сопротивление клеток избыточному сближению, обусловленное их отталкиванием. Эти слагаемые описываются активными давлениями (1.2).
Эволюция границ клеточных фаз при различных значениях параметра ${{E}_{1}}$ (при этом для всех остальных параметров будут использованы стандартные значения) представлена на рис. 3. Видно, что увеличение параметра ${{E}_{1}}$, характеризующего активное отталкивание между клетками 1-й фазы, приводит к замедлению развития сортировки клеток на начальном этапе (штриховые линии на рис. 3) при условии, что ${{E}_{1}}$ не превышает некоторое критическое значение $E{\kern 1pt} *$. Замедление сортировки является временным, и графики зависимостей координат границ фаз от времени асимптотически приближаются к зависимостям, полученным при стандартных значениях параметров (пунктирные линии на рис. 3). В результате происходит формирование клеточной структуры, в которой клетки 1-й фазы, характеризуемые большим значением коэффициента ${{m}_{1}}$, по-прежнему занимают центральную область и оказываются окруженными клетками 2-й фазы.
Рис. 3.
Эволюция границ клеточных фаз (1 и 2 для ${{R}_{1}}{\text{/}}{{R}_{0}}$ и ${{R}_{2}}{\text{/}}{{R}_{0}}$ соответственно) при различных значениях параметра ${{E}_{1}}$. Пунктирные линии получены при стандартных значениях параметров (${{E}_{1}} = 0.333$), штриховые линии – при ${{E}_{1}} = 0.483$, сплошные линии – при ${{E}_{1}} = 0.633$.
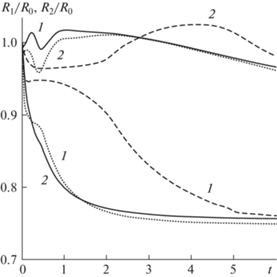
Дальнейшее увеличение значения параметра ${{E}_{1}}$ приводит к существенному изменению эволюции границ клеток. Превышение параметром ${{E}_{1}}$ критического значения $E{\kern 1pt} *$ приводит к “инверсии” сортировки. В этом случае клетки 1-й фазы, характеризуемые значением ${{m}_{1}}$, большим ${{m}_{2}}$, занимают периферическую область сфероида, и окружают клетки 2-й фазы, которые занимают центральную область (координаты границ фаз изображены сплошными линиями на рис. 3). Эволюция пространственно-однородных начальных распределений концентраций клеток происходит качественно сходно кривым на рис. 2а, но с одним важным отличием: номера 1-й и 2-й клеточных фаз следует поменять местами. Таким образом, несмотря на то что активные стягивающие взаимодействия между клетками второй фазы слабее, чем в первой, именно они стремятся занять центральную область слоя. Результаты работы [32] также свидетельствуют о важной роли активного отталкивания клеток при их сортировке. Флуктуации клеточной поверхности, приводящие к активному отталкиванию клеток, являются одним из ключевых факторов, управляющих их пространственным позиционированием.
В) Помимо сил активного взаимодействия клеточные движения могут контролироваться как механическими пассивными свойствами среды, характеризуемыми коэффициентами ${{\mu }_{1}}$ и ${{\mu }_{2}}$, так и подвижностью клеток, характеризуемой коэффициентами ${{\mu }_{{k\,n}}}$ ($k = 1,\;2$ и $n = 1,\;2$) в уравнениях (1.3), (1.4).
В работе [15] описаны эксперименты, связанные с изучением сортировки клеток нормального эпителия молочной железы и нескольких типов опухолевых клеток. По данным экспериментов нельзя непосредственно оценить значения коэффициентов $m_{1}^{{}}$ и $m_{2}^{{}}$, характеризующих развитие активных стягивающих напряжений в разных клеточных средах. Однако косвенные данные позволяют предположить, что коэффициент, характеризующий развитие активных стягивающих напряжений в опухолевых клетках определенного типа, меньше аналогичной величины для эпителия. Результаты сортировки клеток показали, что для этой пары типов клеток происходило нарушение ожидаемого сценария: опухолевые клетки, у которых активные стягивающие взаимодействия слабее, чем у эпителиальных клеток, тем не менее занимали центральную область агрегата.
Одним из возможных объяснений наблюдаемой сортировки может являться различие подвижностей рассматриваемых типов клеток, а также различие реологических свойств рассматриваемых клеточных сред – многие ткани демонстрируют переход от жидкого состояния к твердому и наоборот [15].
В.1) Движения клеток друг относительно друга в рамках используемой модели рассматриваются как течение. Исследуем влияние коэффициентов ${{\mu }_{1}}$ и ${{\mu }_{2}}$, характеризующих вязкости клеточных фаз, на сортировку клеток.
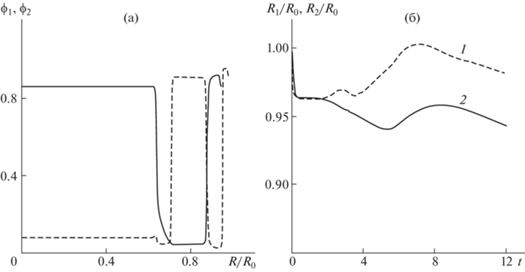
Распределения концентрации клеток, полученные в момент времени $t = 12$ (рис. 4а) при значениях параметров ${{\mu }_{1}} = 1$ и ${{\mu }_{2}} = 10$ (значения остальных параметров взяты стандартными), показывают инверсию сортировки – клетки 2-й фазы, характеризуемой значением ${{m}_{2}}$, меньшим ${{m}_{1}}$ и обладающие значительно большей вязкостью, стремятся занять центральную область, в которой концентрация клеток 1-й фазы приближается к нулю. Однако пространственное разделение клеток разных фаз, происходящее при данном наборе параметров, нельзя назвать типичной сортировкой (по крайней мере автору не известно описание формирования клеточных структур такого типа). Несмотря на пространственное разделение клеток в центральной области клеточного агрегата, клетки разных фаз остаются “перемешанными” – чередуются слоями – в его периферической области. При этом границы областей, занятых клетками разных фаз, расходятся очень незначительно (рис. 4б). Возможной причиной такой эволюции клеточной системы является неустойчивость границы $r = {{R}_{2}}(t)$ клеток 2-й фазы и при данном наборе параметров, и сферически симметричная постановка задачи является некорректной. Этот вопрос требует дополнительного исследования и в данной работе не рассматривается.
Рис. 4.
Решения задачи о сортировке клеток при совпадающих пространственно-однородных начальных условиях ${{\phi }_{1}}(0,\;x) = {{\phi }_{{10}}}$, ${{\phi }_{2}}(0,\;x) = {{\phi }_{{20}}}$, ${{\mu }_{1}} = 1$ и ${{\mu }_{2}} = 10$. (а) Распределения концентраций клеток (1 и 2 для ${{\phi }_{1}}$ и ${{\phi }_{2}}$ соответственно) при t = 12. (б) Эволюция границ клеточных фаз (1 и 2 для ${{R}_{1}}{\text{/}}{{R}_{0}}$ и ${{R}_{2}}{\text{/}}{{R}_{0}}$ соответственно).
При значениях параметров ${{\mu }_{1}} = 10$ и ${{\mu }_{2}} = 1$ проходит стандартная сортировка клеток. Распределения концентраций клеточных фаз и эволюция их границ с увеличением времени приближаются к линиям на рис. 2.
В.2) Различие параметров, характеризующих подвижности клеток разных фаз, также может приводить к нарушению типичного сценария сортировки, когда клетки, обладающие более сильными активными стягивающими взаимодействиями, занимают центральную область и окружены клетками, у которых активные стягивающие взаимодействия слабее.
Вычисления, выполненные при значениях параметров ${{\mu }_{{11}}} = 1.5$, ${{\mu }_{{22}}} = 0.5$, (клетки 1-й фазы являются менее подвижными, чем клетки 2-й фазы), показали, что эволюция начальных пространственно-однородных распределений клеток приводит к формированию клеточной структуры, в которой клетки 1-й фазы занимают периферическую область и окружают клетки 2-й фазы, занимающие центральную область, несмотря на то, что ${{m}_{1}} > {{m}_{2}}$. Предельные (при больших $t$) распределения концентраций клеточных фаз и эволюция их границ качественно соответствуют рис. 2, с условием того, что номера 1-й и 2-й клеточных фаз следует поменять местами.
ЗАКЛЮЧЕНИЕ
Движение клеток друг относительно друга является фундаментальным процессом, который лежит в основе самых разных биологических явлений. Физические и биологические механизмы на клеточном и тканевом масштабах, управляющие движением клеток, до сих пор являются предметом обсуждений.
Изучение эволюции простых клеточных систем таких, как смеси клеток разных типов [15, 22, 23], показало, что активные силовые межклеточные взаимодействия приводят к пространственному разделению клеток разных типов. Экспериментальные данные свидетельствуют о решающей роли параметров, которые характеризуют различные механизмы развития активных напряжений, а также межклеточную адгезию и клеточную подвижность.
В данной работе исследовано влияния различных параметров, характеризующих развитие активных напряжений и деформацию среды, на процесс сортировки двух типов клеток, образующих в начальный момент времени агрегат сферической формы. Решение задачи позволяет оценить роль различных физических механизмов, несомненно вовлеченных в процесс эволюции клеточных систем.
В результате получено, что клетки той фазы, в которой активные стягивающие межклеточные взаимодействия сильнее (при одинаковых для разных клеточных фаз значениях остальных параметров и одинаковых начальных однородных распределениях концентрации фаз), стремятся занять центральную область сфероида. В то же время клетки другой фазы, между которыми стягивающие взаимодействия более слабые, вытесняются на периферию. При этом формируется резкая граница, отделяющая одну фазу от другой.
Показано, что хаотическая активность клеток, проявляющаяся в их активном отталкивании, является одним из важных механизмов, оказывающих влияние на процесс сортировки. Так, увеличение хаотической активности клеток может привести к инверсии сортировки, когда клеточная фаза, обладающая большими активными стягивающим взаимодействиями, будет занимать периферическую область клеточного сфероида и окружать компактную массу клеток, у которых стягивающие взаимодействия слабее.
Помимо характеристик клеточной среды, имеющих отношение к развитию активных напряжений, сортировка клеток контролируется и другими не менее важными параметрами. Подвижность клеток разных фаз и реологические свойства клеточных фаз являются ключевыми факторами, которые оказывают влияние на эволюцию клеточной системы и могут приводить к нарушению стандартного сценария сортировки, приводя к ее инверсии.
Работа поддержана РФФИ (проект № 20-01-00329) и Госпрограммой АААА-А19-119012990119-3.
Список литературы
Davidson L.A., Joshi S.D., Kim H.Y., Dassow M., Zhang L., Zhou J. Emergent morphogenesis: elastic mechanics of a self-deforming tissue // J. Biomech. 2010. V. 43. № 1. P. 63–70.
Keller R., Davidson L., Edlund A., Elul T., Ezin M., Shook D., Skoglund P. Mechanisms of convergence and extension by cell intercalation // Philos. Trans. R. Soc. Lond. B Biol. Sci. 2000. V. 355 (1399). P. 897–922.
Keller R., Davidson L.A., Shook D.R. How we are shaped: The biomechanics of gastrulation // Differentiation. 2003. V. 71. P. 171–205.
Fried P., Gilmour D. Collective cell migration in morphogenesis, regeneration and cancer // Nat. Rev. Mol. Cell Biol. 2009. V. 10. P. 445–457.
Farooqui R., Fenteany G. Multiple rows of cells behind an epithelial wound edge extend cryptic lamellipodia to collectively drive cell-sheet movement // J. Cell. Sci. 2005. V. 118. P. 51–63.
Serra-Picamal X., Conte V., Vincent R., Anon E., Tambe D.T., Bazellieres E., Butler J.P., Fredberg J.J., Trepat X. Mechanical waves during tissue expansion // Nature Physic. 2012. V. 8. P. 628–634.
Tracqui P. Biophysical models of tumour growth // Rep. Progr. Phys. 2009. V. 72. № 5. P. 056701.
Franssen L.C., Lorenzi T., Burgess A.E.F., Chaplian M. A. J. A mathematical framework for modelling the metastatic spread of cancer // Bull. Math. Biol. 2019. V. 81. P. 1965–2010.
Mammoto T., Ingber D.E. Mechanical control of tissue and organ development // Development. 2010. V. 137. № 9. P. 1407–1420.
Reig G., Pulgar E., Concha M.L. Cell migration: from tissue culture to embryos // Development. 2014. V. 141. № 10. P. 1999–2013.
Gerhart J.C. Mechanisms regulating pattern formation in the amphibian egg and early embryo. In: “Biological Regulation and Development, Goldberger R. (ed), New York: Plenum Press, 1980. V. 2. P. 133–316.
Beloussov L.V., Louchinskaia N.N., Stein A.A. Tension-dependent collective movements in the early gastrula ectoderm of Xenopus laevis embryos // Dev. Gen. Evol. 2000. V. 210. P. 92–104.
Maitre J.L., Berthoumieux H., Krens S.F., Salbreux G., Julicher F., Paluch E., Heisenberg C.P. Adhesion functions in cell sorting by mechanically coupling the cortices of adhering cells // Science. 2012. V. 338(6104). P. 253–256.
Theveneau E., Mayor R. Cadherins in collective cell migration of mesenchymal cells // Curr. Opin. Cell Biol. 2012. V. 24. P. 677–684.
Pawlizak S., Fritsch A.W., Grosser S., Ahrens D., Thalheim T., Riedel S., Kiebling T.R., Oswald L., Zink M., Manning M.E., Kas J. A. Testing the differential adhesion hypothesis across the epithelial-mesenchymal transition // New Journal of Physics. 2015. V. 17. № 8. 083049.
Vasioukhin V., Fuchs E. Actin dynamics and cell-cell adhesion in epithelia // Curr. Opin. Cell Biol. 2001. V. 13. № 1. P. 76–84.
Bertet C., Sulak L., Lecuit T. Myosin-dependent junction remodelling controls planar cell intercalation and axis elongation // Nature. 2004. V. 429. P. 667–671.
Lecuit T., Lenne P.F., Munro E. Force generation, transmission, and integration during cell and tissue morphogenesis // Annu. Rev. Cell Dev. Biol. 2011. V. 27. P. 157–184.
Harris A.K. Is cell sorting caused by differences in the work of intercellular adhesion? A critique of the steinberg hypothesis // J. Theor. Biol. 1976. V. 61. P. 267–285.
Brodland G.W. The Differential Interfacial Tension Hypothesis (DITH): a comprehensive theory for the self-rearrangement of embryonic cells and tissues // J. Biomech. Eng. 2002. V. 124. P. 188–197.
Krieg M., Arboleda-Estudillo Y., Puech P.H., Kafer J., Graner F., Muller D.J., Ytisenberg C.-P. Tensile forces govern germ-layer organization in zebrafish // Nat. Cell Biol. 2008. V. 10. P. 429–436.
Steinberg M.S., Wiseman L.L. Do morphogenetic tissue rearrangements require active cell movements? // J. Cell Biol. 1972. V. 55. P. 606–615.
Mehes E., Viscek T. Segregation mechanisms of tissue cells: from experimental data to models // Complex Adapt. Syst. Model. 2013. V. 1. P. 4.
Логвенков С.А., Штейн А.А. Континуальное моделирование биологической среды, составленной активно взаимодействующими клетками двух разных типов // Изв. РАН. МЖГ. 2020. № 6. С. 3–16.
Логвенков С.А., Штейн А.А. Континуальное моделирование сортировки клеток в плоском слое с учетом возможного расхождения границ областей, занятых клетками двух разных типов // Изв. РАН. МЖГ. 2022. № 3. С. 1–16.
Логвенков С.А. Моделирование сортировки двух типов клеток в клеточном сфероиде с учетом подвижности границ областей, занятых клетками разных типов // Изв. РАН. МЖГ. 2022. № 6. С. 101–115.
Stein A.A., Logvenkov S.A., Volodyaev I.V. Continuum modeling of mechano-dependent reactions in tissues composed of mechanically active cells // BioSystems. 2018. V. 173. P. 225–234.
Белоусов Л.В., Логвенков С.А., Штейн А.А. Математическая модель активной биологической сплошной среды с учетом деформаций и переупаковки клеток // Известия РАН. МЖГ. 2015. № 1. С. 3–14.
Логвенков С.А., Штейн А.А. Математическая модель пространственной самоорганизации в механически активной клеточной среде // Биофизика. 2017. Т. 62. № 6. С. 1123–1133.
Taylor H.B., Khuong A., Wu Z., Xu Q., Morley R., Gregory L., Poliakov A., Taylor W.R., Wilkinson D.G. Cell segregation and border sharpening by Eph receptor-ephrin-mediated heterotypic repulsion // J. R. Soc. Interface. 2017. V. 14. № 132. P. 20170338.
Canty L., Zarour E., Kashkooli L., François P., Fagotto F. Sorting at embryonic boundaries requires high heterotypic interfacial tension // Nat. Commun. 2017. V. 8. P. 157.
Yanagida A., Corujo-Simon E., Revell C.K., Sahu P., Stirparo G.G., Aspalter I.M., Winkel A.K., Peters R., De Belly H., Cassani D.A.D., Achouri S., Blumenfeld R., Franze K., Hannezo E., Paluch E.K., Nichols J., Chalut K.J. Cell surface fluctuations regulate early embryonic lineage sorting // Cell. 2022. V. 185. № 5. P. 777–793.
Mehes E., Viscek T. Collective motion of cells: from experiments to models // Integr. Biol. 2014. V. 6. № 9. P. 831–854.
Halbleib J.M., Nelson W.J. Cadherins in development: cell adhesion, sorting, and tissue morphogenesis // Genes Dev. 2006. V. 20. P. 3199–214.
Niessen C.M., Leckband D., Yap A.S. Tissue organization by cadherin adhesion molecules: dynamic molecular and cellular mechanisms of morphogenetic regulation // Physiol. Rev. 2011. V. 91. P. 691–731.
Дополнительные материалы отсутствуют.
Инструменты
Известия РАН. Механика жидкости и газа


