Известия РАН. Механика жидкости и газа, 2022, № 3, стр. 17-29
ГАЗОДИНАМИЧЕСКИЕ И ТЕПЛОВЫЕ ЭФФЕКТЫ СИНТЕЗА МИКРОННЫХ ЧАСТИЦ МЕТОДОМ ГОРЕНИЯ УГЛЕРОДА В ПРЯМОТОЧНОМ И ТРЕХЗОННОМ РЕАКТОРЕ
a Институт проблем механики им. А.Ю. Ишлинского РАН
Москва, Россия
* E-mail: markov.ipm@yandex.ru
Поступила в редакцию 01.10.2021
После доработки 20.10.2021
Принята к публикации 20.11.2021
- EDN: CFMNTG
- DOI: 10.31857/S0568528122030136
Аннотация
Развивается двухтемпературная осесимметричная модель для анализа синтеза сложных оксидов методом горения углерода. Определяющая система уравнений включает сохранения вещества, импульса и энергии для газовой и твердой фаз в прямоточном и трехзонном реакторе. Излагаются результаты исследования резкого роста температуры – “неправильного поведения” реактора в процессе синтеза микронных порошков титаната бария с рассмотрением тепловой и массовой дисперсии. Определяющие уравнения с параметрами подобия в безразмерной форме применены к численному моделированию воздействия как газодинамического и межфазного сопротивления, так и осевой и поперечной дисперсии при синтезе микронных частиц титаната бария в прямоточном и трехзонном реакторе. Делается вывод о преимуществах трехзонного реактора в моделировании синтеза микронных частиц в режимах “неправильного поведения” прямоточного реактора. Сопоставлены результаты расчетов прямоточного и трехзонного реакторов при одинаковых величинах дисперсии, коэффициента извилистости пор, диаметра частиц, локальных величин чисел Пекле.
Одной из наиболее удивительных динамических характеристик реактора с уплотненным слоем является его неправильное поведение [1–16], при котором переходное повышение температуры вызывается быстрым снижением температуры подаваемых реагентов в нижней части вертикально расположенного реактора. Впервые возникновение такого явления в реакторе с уплотненным слоем было предсказано в работах [4, 5]. Неправильное поведение наблюдалось в эксперименте [6] в реакторе с уплотненным слоем, в котором протекала гомогенная жидкофазная реакция. Температурное возмущение переходного режима может перевести реактор в нежелательное состояние или привести к выходу из строя. Неправильное поведение вызвано разницей в скорости распространения концентрационных и температурных возмущений в реакторе. Внезапное охлаждение сырья в нижней части снижает конверсию в верхней части реактора. Повышенная концентрация реагентов вызывает кратковременное повышение температуры в нижней части реактора [3], где использовалась одномерная псевдогомогенная модель для получения простых критериев, предсказывающих условия, при которых возникает неправильное поведение. Эта модель игнорировала осевое рассеивание тепла в реакторе, а также транспортные сопротивления между катализатором и жидкостью. Получено резкое возрастание температурного фронта с нереально высокой пиковой температурой. Оказалось, что модель не может предсказать воспламенение реактора из низкотемпературного установившегося состояния в высокотемпературное установившееся состояние, когда существует множество стационарных состояний, которые экспериментально наблюдались в [2]. Влияние межфазового тепло- и массопереноса на неправильное поведение реактора рассмотрено в [7]. Повышение температуры в процессе регенерации дизельного сажевого фильтра при внезапном понижении температуры на входе в фильтр изучено в [9–11]. Переходный режим в реакторах изучался в [12–17].
Исследование межфазного тепло- и массообмена, дисперсии тепла и вещества проводилось в ряде работ [18–23], где приведены дополнительные ссылки. Были предложены модели усреднения на основе взаимно-проникающих континуумов. При таком подходе утраченная детальная информация о микромасштабах (напр., конфигурация межфазных границ) присутствует в виде коэффициентов тепло- и массопереноса. Отмечалось, что в усредненных уравнениях наряду с молекулярной диффузией тепла и вещества важную роль играет дисперсионный механизм тепло- и массопереноса и пористость реагентов и продуктов синтеза в реакторе. Причиной концентрационной и тепловой дисперсии являются флуктуации массового и теплового потока, тогда как диффузия массы и тепла вызвана случайным молекулярным движением. Различные модели тепловой дисперсии представлены в [21, 22]. Наряду с упомянутыми моделями усреднения развивается также прямое моделирование течения в пористой структуре – см., например, [23]. В [1–10] показано, что осевая дисперсия тепла уменьшает величину температурного отклонения, продлевает переход к новому устойчивому состоянию и может привести к некоторым особенностям: например, дисперсия может создавать волну температуры, которая первоначально движется в восходящем направлении. Дисперсия также может воспламенить реактор из низкотемпературного состояния, что приведет к катастрофическим последствиям [1, 2]. Исследовалось воздействие межфазных транспортных сопротивлений при массовой и тепловой дисперсии возмущения, вызывающие неправильное поведение реактора. Показано, что эти возмущения могут распространяться только в нижнем направлении вертикально расположенного реактора с подачей реагентов сверху, в отличие от диффузионного механизма, при котором возмущения могут распространяться как в восходящем, так и в нижнем направлениях [7].
Следует заметить, что потоки тепла, вещества реагентов и продуктов через пористую среду существенно зависят от структуры пористой среды и особенностей межфазного взаимодействия. Размеры пор, как правило, неравномерно распределены в реакторе синтеза и меняются во времени. Это обстоятельство обусловливает важность моделирования изменения пористости смеси реагентов и продуктов в процессе синтеза мелкодисперсных порошков методом горения. Математические модели синтеза и спекания порошковых смесей основаны на совместном описании тепловых и химических процессов объемных изменений в условиях неоднородного нагрева [24–29]. Химические превращения происходят с изменением объема и сопровождаются появлением механических напряжений и деформаций дополнительно к напряжениям и деформациям вследствие высоких градиентов температуры. В работах [26, 27, 29] проведены теоретические и экспериментальные исследования формирования структуры и физико-механических свойств материала при спекании с целью получения минимальной пористости. Изучение кинетики синтеза титаната бария рассмотрено в [30–33]. В связи с требованиями промышленного производства керамики на основе возникает необходимость сбалансировать потребление энергии, время синтеза и качество конечного продукта, такого как форма и распределение частиц.
Цель данной работы – оценить влияние межфазного, теплового и массового сопротивления в каждой фазе на неправильное поведение при синтезе сложных оксидов в прямоточном реакторе методом горения углерода (CCSO) [30]. На основе осесимметричных моделей [31] анализируется влияние межфазного, теплового и массового сопротивления в газовой и твердой фазах на неправильное поведение проточного реактора синтеза микронных частиц титаната бария при осевой и поперечной дисперсии тепла и вещества в проточном и трехзонном реакторе. Проводится расчет переходных режимов Результаты позволяют сделать вывод о преимуществах трехзонного реактора, в сравнении с моделью проточного реактора в режиме “неправильного поведения”. Прекурсором синтеза ${\text{BaTi}}{{{\text{O}}}_{{\text{3}}}}$ служит ${\text{BaC}}{{{\text{O}}}_{{\text{3}}}}$ [33]. Формулируются осредненные потоки массы компонент: C, ${\text{BaC}}{{{\text{O}}}_{{\text{3}}}}$, BaO, ${\text{Ti}}{{{\text{O}}}_{{\text{2}}}}$, ${\text{BaTi}}{{{\text{O}}}_{{\text{3}}}}{\text{,}}\,{\text{B}}{{{\text{a}}}_{{\text{2}}}}{\text{Ti}}{{{\text{O}}}_{{\text{4}}}}$, зависящие от температуры газовой и твердой фазы при заданном межфазовом теплообмене, переменном коэффициенте пористости. Результаты моделирования титаната бария в прямоточном и трехзонном реакторе получены на основе макроуравнений сохранения при тепловой и массовой дисперсии, записанных в безразмерных переменных. Проведено моделирование синтеза титаната бария методом CCSO в осесимметричном проточном и трехзонном реакторе при размерах частиц реагентов и продуктов, превышающих микрон. Отметим, что при микронных размерах синтезируемых частиц характерные величины чисел Кнудсена малы и эффекты скольжения и скачков температуры газа на границе пор пренебрежимо малы. Однако для субмикронных размеров частиц и пор становится существенным влияние слоев Кнудсена в газе около поверхности пор и необходим учет эффектов скольжения [34].
1. ОПИСАНИЕ МОДЕЛИ
Кинетическая схема синтеза титаната бария. Рассмотрим схему синтеза ${\text{BaTi}}{{{\text{O}}}_{{\text{3}}}}$ с прекурсором ${\text{BaC}}{{{\text{O}}}_{{\text{3}}}}$ [30–33]
(1.1)
$\begin{gathered} {{{\text{O}}}_{{\text{2}}}} + {\text{C}}\xrightarrow[{{{Q}_{1}}}]{{{{k}_{1}}}}{\text{C}}{{{\text{O}}}_{{\text{2}}}},\quad {\text{BaC}}{{{\text{O}}}_{{\text{3}}}}\xrightarrow[{{{Q}_{2}}}]{{{{k}_{2}}}}{\text{C}}{{{\text{O}}}_{{\text{2}}}} + {\text{BaO,}}\quad {\text{Ti}}{{{\text{O}}}_{{\text{2}}}} + {\text{BaO}}\xrightarrow[{{{Q}_{2}}}]{{{{k}_{2}}}}{\text{BaTi}}{{{\text{O}}}_{{\text{3}}}} \\ {\text{BaO}} + {\text{BaTi}}{{{\text{O}}}_{{\text{3}}}}\xrightarrow[{{{Q}_{3}}}]{{{{k}_{3}}}}{\text{B}}{{{\text{a}}}_{{\text{2}}}}{\text{Ti}}{{{\text{O}}}_{{\text{4}}}},\quad {\text{Ti}}{{{\text{O}}}_{{\text{2}}}} + {\text{B}}{{{\text{a}}}_{{\text{2}}}}{\text{Ti}}{{{\text{O}}}_{{\text{4}}}}\xrightarrow[{{{Q}_{3}}}]{{{{k}_{3}}}}{\text{2BaTi}}{{{\text{O}}}_{{\text{3}}}} \\ \end{gathered} $Компонентами газа и твердой фазы являются ${{{\text{O}}}_{{\text{2}}}}$, ${\text{C}}{{{\text{O}}}_{{\text{2}}}}$ и C, BaO, ${\text{BaC}}{{{\text{O}}}_{{\text{3}}}}$, ${\text{Ti}}{{{\text{O}}}_{{\text{2}}}}$, ${\text{BaTi}}{{{\text{O}}}_{{\text{3}}}}$, ${\text{B}}{{{\text{a}}}_{{\text{2}}}}{\text{Ti}}{{{\text{O}}}_{{\text{4}}}}$ соответственно. В реакции ${\text{Ti}}{{{\text{O}}}_{{\text{2}}}} + {\text{BaO}}$ синтез продукта ${\text{BaTi}}{{{\text{O}}}_{{\text{3}}}}$ контролируется диффузией ионов бария через слой титаната бария [33]. В реакциях (1.1) для компонент твердой фазы реагенты не смешиваются на молекулярном уровне, диффундируют и движутся в пределах твердой фазы, ${{Q}_{{\text{1}}}}$ – тепловой эффект горения углерода. Реакции с тепловым эффектом ${{Q}_{2}}$, ${{Q}_{3}}$ предполагаются эндотермическими.
Уравнения в безразмерных переменных. Далее переходим к безразмерным переменным, отмеченным тильдой; характерные величины имеют индекс ноль [25, 31]
(1.2)
$\tilde {Q} = \frac{{Q{{t}_{0}}k}}{{{{\rho }_{0}}{{C}_{{pg}}}{{T}_{0}}}},\quad {{p}_{0}} = \frac{{R{{\rho }_{0}}{{T}_{0}}}}{{{{M}_{0}}}}\quad \tilde {K} = K{\text{/}}{{\mu }_{{S0}}},\quad {{\tilde {\mu }}_{{solid}}} = {{\mu }_{{solid}}}{\text{/}}{{\mu }_{{S0}}},\quad {{\tilde {\mu }}_{{sj}}} = {{\mu }_{{sj}}}{\text{/}}{{p}_{0}},\quad j = 1,\;2$Здесь [25] ${{l}_{0}} = 0.007$ м, ${{t}_{0}} = 2.215$ с, ${{u}_{0}} = 7 \times {{10}^{{ - 4}}}$ мс–1, $A = 0.015$ м2 – характерная площадь реактора, $V = 1.1 \times {{0}^{{ - 4}}}$ м3 – характерный объем реактора, ${{\rho }_{0}} = {{\rho }_{{air}}} = 0.4$ кг м–3, ${{\lambda }_{0}} = {{\lambda }_{{air}}} = 0.06$ Вт ⋅ м–1 ⋅ K–1, ${{D}_{0}} = 2 \times {{10}^{{ - 5}}}$ м2 ⋅ с–1, ${{\nu }_{{air}}} = 9.7 \times {{10}^{{ - 5}}}$ м2 ⋅ с–1, ${{d}_{p}} = 3 \times {{10}^{{ - 6}}}$ м – характерный диаметр частицы, ${{\mu }_{{S0}}} = 2 \times {{10}^{9}}$ Па, ${{\rho }_{{0C}}} = 2267$ кг м–3, ${{\rho }_{{1S}}} = {{\rho }_{C}}$, $p = {{\rho }_{g}}(1 + \beta {{\tilde {T}}_{g}})$ – давление газа, ${{\rho }_{{1g}}}$, ${{\rho }_{{2g}}}$, ${{\rho }_{{3g}}}$ – плотности компонент O2, N2, ${\text{C}}{{{\text{O}}}_{{\text{2}}}}$ газовой фазы, ${{\rho }_{g}} = {{\rho }_{{1g}}} + {{\rho }_{{2g}}} + {{\rho }_{{2g}}}$, ${{\rho }_{{1S}}}$, ${{\rho }_{{2S}}}$, ${{\rho }_{{3S}}}$, ${{\rho }_{{4S}}}$, ${{\rho }_{{5S}}}$, ${{\rho }_{{6S}}}$ – плотности компонент C, ${\text{BaC}}{{{\text{O}}}_{{\text{3}}}}$, BaO, ${\text{Ti}}{{{\text{O}}}_{{\text{2}}}}$, ${\text{BaTi}}{{{\text{O}}}_{{\text{3}}}}$, ${\text{B}}{{{\text{a}}}_{{\text{2}}}}{\text{Ti}}{{{\text{O}}}_{{\text{4}}}}$ твердой фазы, ${{\rho }_{S}} = {{\rho }_{{1S}}} + {{\rho }_{{2S}}}$ + ... + ρ6S, ${{T}_{g}}$, ${{T}_{S}}$ – температура газа и твердого углерода. Температура газа и твердой фазы находится по формулам: ${{T}_{g}} = {{T}_{0}}(1 + \beta {{\tilde {T}}_{g}})$, ${{T}_{S}} = {{T}_{0}}(1 + \beta {{\tilde {T}}_{S}})$ соответственно; $\beta = {{R{{T}_{0}}} \mathord{\left/ {\vphantom {{R{{T}_{0}}} E}} \right. \kern-0em} E}$ – безразмерный параметр, характеризующий энергию активации; $R$, $E$, $Q$ – газовая постоянная, энергия активации, тепловой эффект горения, ${{\tilde {\kappa }}_{0}}$ – коэффициент теплообмена, ${{\tilde {c}}_{S}}$, ${{\tilde {c}}_{{pg}}}$ – теплоемкости, ${{\tilde {\lambda }}_{S}}$, ${{\tilde {\lambda }}_{g}}$ – коэффициенты теплопроводности, $\tilde {D}$ – коэффициент диффузии, Ma, Re – числа Маха и Рейнольдса, ${\text{P}}{{{\text{e}}}_{{\text{T}}}}$, ${\text{P}}{{{\text{e}}}_{{\text{1}}}}$ – тепловое и диффузионное число Пекле, индекс air относится к параметрам для воздуха при нормальных условиях, $\tilde {p} = {p \mathord{\left/ {\vphantom {p {{{p}_{0}}}}} \right. \kern-0em} {{{p}_{0}}}}$ – давление, ${{\tilde {x}}_{i}} = {{{{x}_{i}}} \mathord{\left/ {\vphantom {{{{x}_{i}}} {{{l}_{0}}}}} \right. \kern-0em} {{{l}_{0}}}}$, $\tilde {t} = {t \mathord{\left/ {\vphantom {t {{{t}_{0}}}}} \right. \kern-0em} {{{t}_{0}}}}$ координаты и время, $\operatorname{R} _{S}^{{}}$ – аналог числа Рейнольдса для твердой фазы. Система уравнений приводится ниже в безразмерных переменных (1.2), символ тильда опускается.
Базовые уравнения. Ниже приведены основные уравнения осесимметричной модели [25].
Уравнения сохранения суммарной массы газовой и твердой фаз
Уравнения сохранения массы компонент O2, ${\text{C}}{{{\text{O}}}_{{\text{2}}}}$, N2
(1.3)
$\frac{{\partial \chi {{\rho }_{g}}{{C}_{3}}}}{{\partial t}} + \nabla \cdot \left( {\chi {{\rho }_{g}}{{C}_{3}}{\mathbf{u}}} \right) = \nabla \cdot \left( {\frac{\chi }{{{\text{P}}{{{\text{e}}}_{1}}}}{{\rho }_{g}}{{D}_{{mg}}}\nabla {{C}_{3}}} \right),\quad {{C}_{2}} = 1 - {{C}_{1}} - {{C}_{3}}$Компоненты тензора массовой дисперсии имеют вид
Здесь ${{b}_{0}}$, ${{b}_{1}}$ – постоянные, $\xi $ – коэффициент извилистости пор.
Уравнения сохранения массы компонент твердой фазы, включая диффузию оксида бария ${\text{BaO}}$, зависящую от концентрации титаната бария ${\text{BaTi}}{{{\text{O}}}_{{\text{3}}}}$ согласно кинетике синтеза (1.1)
(1.4)
$\frac{{\partial {{\rho }_{{4S}}}}}{{\partial t}} = - J_{{3S}}^{{}} - J_{{5S}}^{{}},\quad \frac{{\partial {{\rho }_{{5S}}}}}{{\partial t}} = \frac{{{{M}_{{5S}}}}}{{{{M}_{{4S}}}}}(J_{{3S}}^{{}} - J_{{4S}}^{{}} + 2J_{{5S}}^{{}}),\quad \frac{{\partial {{\rho }_{{6S}}}}}{{\partial t}} = \frac{{{{M}_{{5S}}}}}{{{{M}_{{4S}}}}}(J_{{4S}}^{{}} - J_{{5S}}^{{}})$Здесь $D{{s}_{0}}$ – коэффициент диффузии мигрирующей компоненты BaO, ${{\beta }_{D}}$ – параметр, характеризующий зависимость диффузии от плотности титаната бария. Массовые потоки для компонент твердой фазы C, BaO, ${\text{BaC}}{{{\text{O}}}_{{\text{3}}}}$, ${\text{Ti}}{{{\text{O}}}_{{\text{2}}}}$, ${\text{BaTi}}{{{\text{O}}}_{{\text{3}}}}$, ${\text{B}}{{{\text{a}}}_{{\text{2}}}}{\text{Ti}}{{{\text{O}}}_{{\text{4}}}}$ (1.3, 1.4) приводятся в [25].
Уравнение движения газа в порах [25, 31]
(1.5)
$\begin{gathered} \frac{{\partial \chi {{\rho }_{g}}{\mathbf{u}}}}{{\partial t}} + \nabla \cdot \left( {\chi {{\rho }_{g}}{\mathbf{uu}}} \right) + {\text{M}}{{{\text{a}}}^{{ - 2}}}\nabla p = {{\operatorname{Re} }^{{ - 1}}}\nabla \cdot {\mathbf{\tau }} + {{S}_{V}}, \\ {\mathbf{\tau }} = \mu \left[ {\nabla {\mathbf{u}} + {{{\left( {\nabla {\mathbf{u}}} \right)}}^{T}} - \frac{2}{3}\left( {\nabla \cdot {\mathbf{u}}} \right){\mathbf{I}}} \right] \\ \end{gathered} $Уравнение баланса тепла в газовой фазе, включающее дисперсию [24],
В правую часть уравнения (1.6) включен тепловой поток $Q_{r}^{{}}$ химического превращения. Тензор тепловой дисперсии [25] учитывает продольную и поперечную дисперсию – ${{D}_{{Tg}}} = \left( {\begin{array}{*{20}{c}} {{{\lambda }_{{1g}}}}&0 \\ 0&{{{\lambda }_{{2g}}}} \end{array}} \right)$, где ${{\lambda }_{{1g}}} = {{\lambda }_{g}}\left( {\xi + {{\varphi }_{1}}\left( {{\text{P}}{{{\text{e}}}_{{1t}}}} \right)} \right)$, ${{\lambda }_{{2g}}} = {{\lambda }_{g}}\left( {\xi + {{\varphi }_{2}}\left( {{\text{P}}{{{\text{e}}}_{{2t}}}} \right)} \right)$.
Уравнение баланса тепла в твердой фазе
(1.7)
$\begin{gathered} {{\rho }_{S}}{{c}_{S}}\left( {1 - \chi } \right)\left( {\frac{{\partial {{T}_{S}}}}{{\partial t}} + {{{\text{V}}}_{{solid}}} \cdot \nabla {{T}_{S}}} \right) - {{c}_{S}}{{T}_{S}}\left( {1 - \chi } \right)J_{{S \to g}}^{{}} = \\ = \;\nabla \times \left( {\left( {1 - \chi } \right)\frac{{{{\lambda }_{S}}}}{{P{{e}_{{Ts}}}}}\nabla {{T}_{S}}} \right) + \kappa \chi \left( {1 - \chi } \right)\left( {{{T}_{g}} - {{T}_{S}}} \right) + \left( {1 - \chi } \right)Q_{r}^{{}} \\ \end{gathered} $Коэффициент теплообмена между газовой и твердой фазами в (1.6), (1.7) описывается с помощью формулы Левека [31, 35] в виде $\kappa = {{\kappa }_{0}}(1 + {\text{Re}}_{{loc}}^{{0.3}}{\text{Pe}}_{{Tloc}}^{{0.3}})$. Здесь ${\text{R}}{{{\text{e}}}_{{loc}}} = \operatorname{Re} \left| {\mathbf{u}} \right|\rho _{g}^{{}}$, ${\text{P}}{{{\text{e}}}_{{Tloc}}} = {\text{P}}{{{\text{e}}}_{{Tg}}}\left| {\mathbf{u}} \right|\rho _{g}^{{}}$, ${\text{P}}{{{\text{e}}}_{{Tloc}}} = {\text{P}}{{{\text{e}}}_{T}}\left| {\mathbf{u}} \right|\rho _{g}^{{}}$ – локальные числа Рейнольдса и Пекле [31]. Справедливость модели распределенного сопротивления пористости в уравнении движения (1.5) подтверждена согласием результатов с экспериментом [25, 30, 31, 34].
Граничные условия в проточном реакторе. Приведенный на рис. 1 реактор состоит из внешней зоны 1 ($0 < x < L$, $1 - d < r < 1$), в которую поступает поток смеси кислорода и азота, и пористой зоны 2 ($0 < x < L$, $0 < r < 1 - d$), которая является двухфазной средой реагентов, продуктов газа и мелкодисперсных частиц реагентов, а также продуктов синтеза.
Рис. 1.
(а) Схема проточного реактора и (б) осесимметричные области моделирования синтеза в трехзонном реакторе: зона 1 – канал подачи смеси ${{{\text{O}}}_{{\text{2}}}}$ и ${{{\text{N}}}_{{\text{2}}}}$; зона 2 – область смеси частиц реагентов и продуктов синтеза титаната бария и компонент газовой смеси; 2а – нагретая область, содержащая продукт синтеза и продукт горения; 2b – холодная область, содержащая реагенты синтеза и горения; 2с – фронт горения углерода; зона 3 – канал отвода смеси ${{{\text{N}}}_{{\text{2}}}}$ и ${\text{C}}{{{\text{O}}}_{{\text{2}}}}$. Фронт горения движется слева направо, кислород поступает слева.
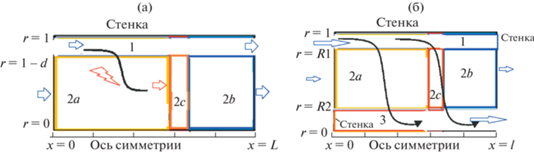
Граничные условия на входе x = 0 в зоны реактора
Граничные условия на выходе $x = L$ из зон реактора
Граничные условия на наружной стенке реактора $r = 1$
Граничные условия на оси симметрии реактора
Граничное условие на внутренней границе $r = 1 - d$
Начальные условия для каждой из трех зон
Граничные и начальные условия для трехзонного реактора. Граничные условия на входе в зоны
Граничные условия на выходе из зон
Граничное условие на наружной стенке
Граничные условия на оси симметрии реактора
Условия на внутренней границе первой зоны ${{G}_{1}} = \left\{ {0 < x < L;\;{{R}_{1}} < r < 1} \right\}$
$t > 0;\quad 0 < x < L;\quad r = {{R}_{1}}{\text{:}}\,\,{{T}_{S}} = {{T}_{g}}$ либо условие охлаждения ${{T}_{S}} = {{T}_{g}} = {{T}_{{W,1}}}$
Условия на внутренней границе второй зоны ${{G}_{2}} = \left\{ {0 < x < L;\;{{R}_{2}} < r < {{R}_{1}}} \right\}$ те же, что и выше
$t > 0;\quad 0 < x < L;\quad r = {{R}_{1}}{\text{:}}\,\,{{T}_{S}} = {{T}_{g}}$, либо условие охлаждения ${{T}_{S}} = {{T}_{g}} = {{T}_{{W,1}}}$
$t > 0;\quad 0 < x < L;\quad r = {{R}_{2}}{\text{:}}\,\,{{T}_{S}} = {{T}_{g}}$, либо условие охлаждения ${{T}_{S}} = {{T}_{g}} = {{T}_{{W,1}}}$
Условия на внутренней границе третьей зоны ${{G}_{3}} = \left\{ {0 < x < L;\;0 < r < {{R}_{3}}} \right\}$ те же, что и выше $t > 0$; $0 < x < L$, $r = {{R}_{2}}$: ${{T}_{S}} = {{T}_{g}}$, либо условие охлаждения ${{T}_{S}} = {{T}_{g}} = {{T}_{{W,1}}}$
Начальные условия для каждой из трех зон
Предполагается свободный теплообмен на границе r = 1 и выходе из реактора $x = L$ при коэффициенте теплообмена ${{\alpha }_{{ex}}} = {{10}^{3}}$.
2. РЕЗУЛЬТАТЫ МОДЕЛИРОВАНИЯ
Моделирование синтеза в проточном и трехзонном реакторе на основе (1.1)–(1.7) 1юпроведено методом конечных элементов с адаптацией в зонах больших градиентов, ранее успешно примененного в моделировании процессов горения в химических реакторах синтеза микронных порошков [25, 31, 34] и позволяющего выявить сложные структуры нестационарного горения [36]. Верификации кодов служит решение данным методом задач синтеза ферритов с применением горения углерода [25, 30, 31], где получено удовлетворительное согласие с экспериментами по температуре фронта горения. В данной работе анализировалось влияние числа расчетных ячеек на точность моделирования. Представленные данные расчетов достаточно слабо зависят от размеров ячеек. Использовались сетки, ${{N}_{{cel}}} = 13{\kern 1pt} {\kern 1pt} 233$ и ${{N}_{{cel}}} = 52{\kern 1pt} {\kern 1pt} 927$ расчетных ячеек, получены близкая скорость движения фронта горения и устойчивый выход на стационарный режим как для прямоточного, так и для трехзонного реактора при различных сетках.
Анализировалось влияние числа расчетных ячеек на точность моделирования. Представленные данные расчетов достаточно слабо зависят от размеров ячеек. Приводятся результаты для: проточных реакторов P1, P2, P3 и трехзонных реакторов T1, T2, имеющих следующие геометрические параметры
Р1: $L = 2$, $R = 0.8$, $d = 0.2$; Р2: $L = 2$, $R = 0.8$, $d = 0.2$;
Р3: $L = 6$, $R = 0.8$, $d = 0.2$
Т1: $L = 6$, ${{R}_{1}} = 0.8$, ${{R}_{2}} = 0.2$; Т2: $L = 2$, ${{R}_{1}} = 0.9$, ${{R}_{2}} = 0.1$
Рассматривалась холодная начальная смесь ${{T}^{0}} = - 5$, реактор Р1 и горячая начальная смесь ${{T}^{0}}$ = 0, реакторы Р2, Р3, Т1, Т2. Расчет проводился при неизменной пористости $\chi = 0.6$. Варьировался поток кислорода ${{{\text{O}}}_{{2f}}} = 20$ на входе в реактор Р1, Р2, Т2 и ${{{\text{O}}}_{{2\,f}}} = 10$ ра входе в реактор Р3, Т1. Инициация горения в реакторе Р1 проводилась тепловым потоком на ходе ${{q}_{f}} = 100$. В реакторах Р2, Р3, Т1, Т2 ${{q}_{f}} = 0$. Все параметры трехзонного реактора T2 совпадают с соответствующими параметрами проточного реактора Р2. Все параметры трехзонного реактора Т1 совпадают с соответствующими параметрами проточного реактора Р3.
Представленные результаты моделирования синтеза титаната бария на основе уравнений (1.2)–(1.7) в реакторе с порами микронного размера проведены при следующих безразмерных параметрах (ср. [25]): ${{t}_{{init}}} = {{t}_{1}} = 0.025$, $\beta = 0.1$, $\gamma = 0.288$, $K = 56.4$, $\operatorname{R} _{{Solid}}^{{}} = 0.0316$, Ma = 0.2, ${{Q}_{f}} = {\text{10}}{\kern 1pt} - {\kern 1pt} {\text{500}}$, Q = 60. Инициация горения производится тепловым потоком ${{q}_{f}}(t)$, ${{q}_{f}}(t) = {{Q}_{f}}$, $0 \leqslant t \leqslant {{t}_{1}}$; ${{q}_{f}}(t) = 0$, $t > {{t}_{1}}$. Задавался поток кислорода ${{O}_{{2\,f}}}(t) = 10,\;20$ на интервале времени$\,0 < t < {{t}_{2}}$ поступающий с сечения $x = 0$, ${{R}_{2}} < r < 1$ – см. рис. 1б. В начальный момент времени задавались плотности компонент твердой и газовой фазы. Скорость газа равна нулю в начальный момент времени и на внешней границе $0 \leqslant x \leqslant L$, $r = 1$.
Рассмотрены холодная начальная смесь ${{T}^{0}} = - 5$ и горячая начальная смесь ${{T}^{0}} = 0$. Варьировался поток кислорода ${{O}_{{2f}}}(t) = 10\;{\text{B}}\;20$, $0 < t < {{t}_{2}}$, ${{O}_{{2f}}}(t) = 0$, $t > {{t}_{2}}$ на входе в реактор. При избытке кислорода углерод успевает полностью прореагировать. Расчеты массовой и тепловой дисперсии проведены для начальной пористости ${{\chi }_{0}} = 0.6$. Горение холодной начальной смеси инициировалось потоком тепла на входе в реактор ${{Q}_{f}} = 500$, ${{t}_{1}} = 0.025$.
На рис. 2–6 представлены результаты расчетов с массовой и тепловой дисперсией ${{D}_{{1m}}} = {{D}_{m}}\left( {\xi + {{\varphi }_{1}}\left( {{\text{P}}{{{\text{e}}}_{{1m}}}} \right)} \right)$, ${{D}_{{2m}}} = {{D}_{m}}\left( {\xi + {{\varphi }_{2}}\left( {{\text{P}}{{{\text{e}}}_{{2m}}}} \right)} \right)$, ${{\lambda }_{{1g}}} = {{\lambda }_{g}}\left( {\xi + {{\varphi }_{1}}\left( {{\text{P}}{{{\text{e}}}_{{1t}}}} \right)} \right)$, ${{\lambda }_{{2g}}} = {{\lambda }_{g}}\left( {\xi + {{\varphi }_{2}}\left( {{\text{P}}{{{\text{e}}}_{{2t}}}} \right)} \right)$, Pe1m = $\frac{{\left| u \right| \cdot {{d}_{p}}}}{{{{D}_{m}}}}$, ${\text{P}}{{{\text{e}}}_{{2m}}} = \frac{{\left| {v} \right| \cdot {{d}_{p}}}}{{{{D}_{m}}}}$, ${\text{P}}{{{\text{e}}}_{{1t}}} = \frac{{\left| u \right| \cdot {{d}_{p}}{{\rho }_{g}}{{c}_{g}}}}{{{{\lambda }_{g}}}}$, ${\text{P}}{{{\text{e}}}_{{2t}}} = \frac{{\left| {v} \right| \cdot {{d}_{p}}{{\rho }_{g}}{{c}_{g}}}}{{{{\lambda }_{g}}}}$ (см. (1.5), (1.8)) для одинаковых параметров размеров частиц.
Рис. 2.
(а) Неправильное поведение прямоточного реактора Р1, ${{T}^{0}} = - 5$ (холодная начальная смесь). ${{t}_{1}} = 0.025$, ${{t}_{2}} = 0.5$, ${{{\text{O}}}_{{2f}}} = 20$, $0 < t \leqslant {{t}_{2}}$, ${{{\text{O}}}_{{2f}}} = 0$, $t > {{t}_{2}}$. Температура в реакторе в момент времени $t = 2$. Палитра справа – температура газа. (б) Динамика температуры газа в контрольных точках с координатами $(0,\;0.5)$, $(0.1,\;0.5)$, $(j \cdot 0.25,\;0.5)$, $j = 1, \ldots ,7$ – кривые 1–9.
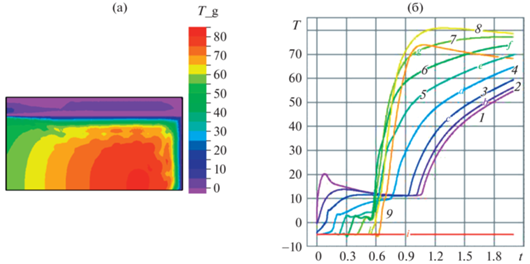
Рис. 3.
(а) Неправильное поведение прямоточного реактора Р2 (горячая начальная смесь), ${{T}^{0}} = 0$. Динамика температуры газа (кривые 1–9) в контрольных точках с координатами (0, 0.5), $(0.1,\;0.5)$, $(j \cdot 0.25,\;0.5)$, $j = 1,\; \ldots ,\;7$; (б) Динамика температуры газа в точках с координатами (0, 0.5), $(0.1,\;0.5)$, $(j \cdot 0.25,\;0.5)$, $j = 1,\; \ldots ,\;7$в трехзонном реакторе Т2 на интервале времени 0 < t < 5.
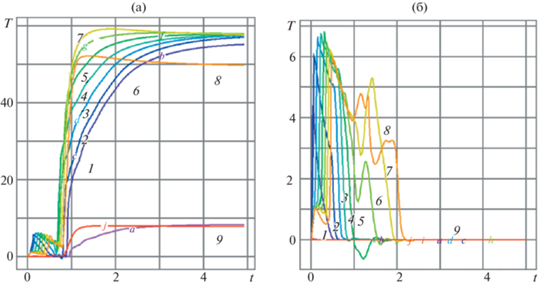
Рис. 4.
(а) Расчет для проточного реактора Р3 и трехзонного реактора Т1. (б) Температура в трехзонном реакторе Т1. Температура в точках с координатами (0, 0.5), $(0.1,\;0.5)$, $(j \cdot 0.25,\;0.5)$, $j = 1,\; \ldots ,\;7$.

Рис. 5.
Сравнение реагента синтеза BaO в момент времени $t = 0.9$ в (а) проточном Р2 и (б) трехзонном Т2 реакторе. (а1, б1) – палитра распределений плотности BaO.
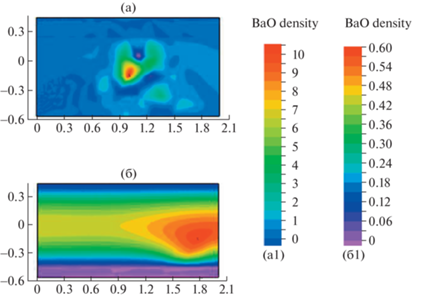
Рис. 6.
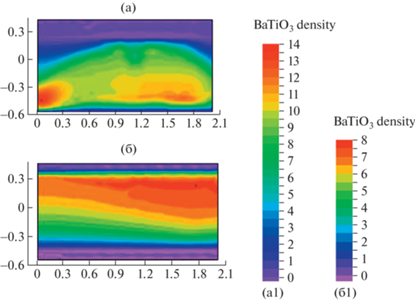
Сравнение продукта синтеза ${\text{BaTi}}{{{\text{O}}}_{{\text{3}}}}$ в момент времени $t = 0.9$ в проточном Р2 (а) и трехзонном Т2 (б) реакторе. (а1, б1) – палитра распределений плотности ${\text{BaTi}}{{{\text{O}}}_{{\text{3}}}}$.
Данные расчетов проточного реактора при интенсивном потоке кислорода на входе $\,{{O}_{{2f}}} = 20$, $0 < t \leqslant {{t}_{2}}$ в переходном температурном режиме неправильного поведения представлены на рис. 2 и 3 полем температуры в момент времени t = 2 (рис. 2а и б) и динамикой температуры газа в контрольных точках реактора с координатами: (0, 0.5), (0.1, 0.5), ($j \times 0.25,0.5$), $j = 2,\; \ldots ,\;10$ (кривые 1–9), $0 < t \leqslant 5$. На рис. 2 иллюстрируется переходный режим для холодной начальной смеси ${{T}^{0}} = - 5$. В момент времени $t = {{t}_{2}} = 0.5$ прекращается пополнение окислителя на входе ${{{\text{O}}}_{{2f}}} = 20$, $0 < t \leqslant {{t}_{2}}$, ${{{\text{O}}}_{{2f}}} = 20$, $0 < t \leqslant {{t}_{2}}$, и горение поддерживается накопившимся ранее кислородом. В момент $t = 0.6$ в средней части реактора начинается переходный режим значительного разогрева (рис. 2, кривые 6–8), вызванное этим понижением концентрации реагента температурное возмущение передается в направлении входа в реактор x = 0, $0 < r < 1$ (рис. 2, линии ${{{\text{O}}}_{{2f}}} = 0$, $t > {{t}_{2}}$, и-5). Аналогичный переходный режим иллюстрируется на рис. 3, где представлены результаты расчета для Р2 (горячая начальная смесь) ${{T}^{0}} = 0$. Отметим появление вторичного воспламенения. На интервале времени 0 < t < 0.6 температура успевает понизиться почти до величины, заданной в начальный момент времени, и при $t \geqslant 0.7$ развивается значительный перегрев, при котором тепловое возмущение, как и ранее, распространяется в направлении входа в реактор $x = 0$, $0 < r < 1$ (рис. 3, кривые 1–5). Переходные процессы на рис. 2, 3 получены как для свободного теплообмена с внешней средой $\frac{{\partial {{T}_{g}}}}{{\partial n}} = {{\alpha }_{{ex}}}\left( {{{T}_{{ex}}} - {{T}_{g}}} \right)$, $\frac{{\partial {{T}_{S}}}}{{\partial n}} = {{\alpha }_{{ex}}}\left( {{{T}_{{ex}}} - {{T}_{S}}} \right)$ с коэффициентом теплообмена ${{\alpha }_{{ex}}} = 1000$, так и при задании температуры на выходе, равной температуре внешней среды. Результаты качественно совпадают.
Рисунки 2, 3 иллюстрируют развитие перегрева в проточном реакторе при интенсивном притоке окислителя ${{{\text{O}}}_{{2f}}} = 20$, $0 < t \leqslant {{t}_{2}}$, при холодной (рис. 2) и горячей (рис. 3) смеси реагентов в начальный момент времени. Для холодной смеси ${{T}^{0}} = - 5$, рис. 2, горение инициировалось тепловым потоком ${{Q}_{f}} = 100$, ${{t}_{1}} = 0.025$, который разогревал область синтеза около входа в реактор до безразмерной температуры ${{\tilde {T}}_{g}} = $ 10–20 (кривые 1–3). К моменту ${{t}_{2}} = 0.5$ (рис. 2) реактор успел прогреться, и прекращение притока кислорода ${{{\text{O}}}_{{2f}}} = 0$, $t > {{t}_{2}}$ приводит к понижению концентрации окислителя, замедлению горения и, как следствие, к неправильному поведению – появлению перегрева [1–11], который отчетливо виден на кривых 4–9. Повторный разогрев смеси реагентов и продуктов синтеза во входной области реактора иллюстрируется линиями 1–3 для интервала времени t > 0.9. Переходный режим неправильного поведения проточного реактора при горячей начальной смеси реагентов ${{T}^{0}} = 0$ показан на рис. 3а. Разогрев до ${{\tilde {T}}_{g}} = 0.6$ (линия 1) и распространение волны горения (линии 2–9) на интервале времени 0 < t < 0.8 сменяются повторным воспламенением 4 и движением теплового фронта с резким разогревом в направлении к выходу из реактора 5–8. Температурное возмущение распространяется также в направлении ко входу в реактор 1, 2 на интервале t > 0.8. Рисунок 3б иллюстрирует стабильный режим трехзонного реактора Т2 при тех же параметрах. Отметим отсутствие перегрева и выход на начальную температуру. Устойчивый выход температурного фронта на стационарный режим, показанный на рис. 3 для интервала $0 < t \leqslant 5$, указывает на отсутствие накопления погрешности с ростом времени расчета.
Сопоставление расчетов на рис. 3, 4 проводится при одинаковых величинах физико-химических параметров и начальных данных для проточного и трехзонного реактора.
В случае горячей начальной смеси инициация горения производится достаточно интенсивным потоком кислорода ${{{\text{O}}}_{{2f}}} = 20$, $0 < t \leqslant {{t}_{2}}$ на входе в реактор. Интересно отметить, что в проточном реакторе Р1 (рис. 2) и Р2 (рис. 3) перегрев при холодной начальной смеси происходит сильнее, чем при горячей начальной смеси.
На рис. 4 представлен расчет для проточного реактора Р3 (а) и трехзонного реактора Т1 (б). Приводится температура ${{\tilde {T}}_{g}}$ в точках с координатами (0, 0.5), (0.1, 0.5), ($j \times 0.25,\;0.5$), $j = 2,\; \ldots ,\;10$. Отметим стабильный режим работы трехзонного реактора Т1. Расчеты на больших отрезках времени рис. 4б не показали повторного возрастания температуры как в проточном реакторе, рис. 4а.
Сравнение переходного режима в проточных реакторах (рис. 3 и 4) с динамикой температуры в трехзонных реакторах при одинаковых параметрах на входе, на стенке, в начальный момент времени и свободном теплообмене с внешней средой и одинаковой тепловой и массовой дисперсии показывает устойчивый режим синтеза в трехзонных реакторах, в то время как в проточных реакторах при уменьшении подачи окислителя происходит развитие перегрева.
Данные на рис. 5 иллюстрируют особенности синтеза титаната бария в проточном реакторе Р2 в режиме перегрева. Для сравнения приводятся результаты расчета устойчивого синтеза в трехзонном реакторе Т2. Показана динамика изменения плотности реагентов твердой фазы и продукта синтеза. Отметим неустойчивый характер синтеза в проточном реакторе, появление локальных неоднородностей на рис. 5а и б. На больших интервалах времени $t > 1$ расчет синтеза в прямоточном реакторе приводит к нереалистичным величинам плотности реагентов и продукта синтеза титаната бария.
Сравнение продукта синтеза ${\text{BaTi}}{{{\text{O}}}_{{\text{3}}}}$ в момент времени $t = 0.9$ в проточном Р2 и трехзонном Т2 реакторе представлено распределениями ${\text{BaTi}}{{{\text{O}}}_{{\text{3}}}}$ в реакторах Р2 и Т2 на рис. 6а и б соответственно. Палитра распределений плотностей позволяет видеть степень неоднородности синтезируемого продукта.
Проведен сравнительный анализ работы проточного и трехзонного реактора при синтезе микронных частиц титаната бария методом горения углерода для горячей смеси реагентов. Рассмотрены осесимметричные проточные реакторы P1, P2, P3 длинной L=2, с радиусом рабочей части $R = 0.8$, протоком $d = 0.2$ и трехзонный реактор T1 с размерами L = 2, ${{R}_{1}} = 0.8$, ${{R}_{2}} = 0.2$ и T2 с размерами L = 6, ${{R}_{1}} = 0.9$, ${{R}_{2}} = 0.1$. Инициация горения углерода производилась тепловым потоком ${{q}_{f}}(t) = {{Q}_{f}}$, $0 \leqslant t \leqslant {{t}_{1}}$; ${{q}_{f}}(t) = 0$; $t > {{t}_{1}}$ на небольшом интервале времени и потоком кислорода ${{{\text{O}}}_{{2f}}}$, $0 < t \leqslant {{t}_{2}}$, ${{{\text{O}}}_{{2f}}} = 0$, $t > {{t}_{2}}$ различной интенсивности, заданными на входе в реактор. Анализируются процессы синтеза титаната бария при холодной и горячей начальной смеси реагентов. Первоначальный нагрев смеси реагентов ускоряет процесс синтеза, но как показали наши исследования, приводит к появлению вторичной моды работы проточного реактора со значительным разогревом и влияет на стабильность работы проточного реактора. В случае горячей начальной смеси реагентов при дефиците кислорода в проточном реакторе P2 и P3 углерод успевает прореагировать только на участке 0 < x < L/3. Получены два фронта горения с максимальной температурой ${{T}_{{{\text{max}}}}} = 600$ K и ${{T}_{{{\text{max}}}}} = 900$ K в реакторе Р3 и ${{T}_{{{\text{max}}}}} = 600$ K и ${{T}_{{{\text{max}}}}} = 2200$ K в реакторе Р2, рис. 3 и 5. Показано, что дисперсия может создавать температурное возмущение, воспламеняющее реактор из низкотемпературного состояния, что приведет к катастрофическим последствиям. Сопротивление тепломассопереносу между газовой и твердой фазой приводит к установившейся множественности мод в проточном реакторе, аналогичной для реактора с уплотненным слоем [3, 7]. Появление второй моды обусловлено понижением концентрации окислителя вследствие прекращения притока кислорода ${{{\text{O}}}_{{2f}}} = 0$, $t > {{t}_{2}}$ и замедления горения. В расчетах при дефиците кислорода в момент времени $0.7 < t < 0.9$ происходит резкое понижение температуры, это увеличивает концентрацию O2 вверх по потоку, что, по-видимому, приводит к резкому возрастанию температуры в момент времени $0.9 < t \leqslant 1.1$ и к переходу реактора на новый устойчивый высокотемпературный режим работы [1, 2]. Отмеченный неустойчивый режим не проявляется в работе трехзонного реактора при тех же первоначальных параметрах (рис. 4 и 5). Синтез титаната бария проходит устойчиво и значительно эффективнее, чем в прямоточном и в трехзонном реакторе с холодной начальной смесью реагентов. Отсутствие перегрева в работе трехзонного реактора связано с теплоотводом через канал $0 < x < L$, $0 < r < {{R}_{2}}$.
ЗАКЛЮЧЕНИЕ
Развита двухтемпературная модель проточного и трехзонного реактора при осевой и поперечной дисперсии в режимах нестабильной работы проточного реактора. Концентрационное и температурное возмущение приводит проточный реактор в нежелательное состояние или к разгону, неправильное поведение вызвано разницей в скорости распространения концентрации и температурных возмущений в реакторе. Подтвержден вывод о реакторе с уплотненным слоем о том, что внезапное охлаждение сырья снижает конверсию в верхней секции реактора. Повышенная концентрация реагента вызывает переходное повышение температуры в нижней части реактора. Заметим, что в реакторе без протока расчеты не показали перегрева, указывающего на неправильное поведение.
Результаты подтверждают прогнозы, что внезапное снижение температуры подачи в реакторе приводит к незначительному отклонению температуры, когда конверсия в реакторе очень низкая или очень высокая, но может привести к заметному отклонению температуры для реактора с промежуточным уровнем конверсии.
Результаты позволяют сделать вывод, какой тип модели следует использовать для эффективного прогнозирования неправильного поведения.
Работа выполнена по теме государственного задания № госрегистрации АААА-А20-120011690135-5.
Список литературы
Sharma C.S., Hughes R. The Behavior of an Adiabatic Fixed Bed Reactor for the Oxidation of Carbon Monoxide: I. General Parametric Studies // Chem. Eng. Sci. 1979. V. 34. P. 613.
Sharma C.S., Hughes R. The Behavior of an Adiabotic FixedBed Reactor for the Oxidation of Carbon Monoxide: II. Effect of Perturbations // Chem. Eng. Sci. 1979. V. 34. P. 625.
Mehta P.S., Sams W.N., Luss D. Wrong-way behavior of packed-bed reactors: 1. The pseudo-homogeneous model // AIChE J. 1981. V. 27. P. 234–246. https://doi.org/10.1002/aic.690270210
Boreskov G.K., Slinko M.G. Modelling of Chemical Reactors // Pure Appl. Chem. 1965. V. 10. P. 611.
Crider J.E., Foss A.S. Computational Studies of Transients in Packed Tubular Chemical Reactors // AIChE J. 1966. V. 12. P. 514.
Hoiberg J.A., Lyche B.C., Foss A.S. Experimental Evaluation of Dynamic Models for a Fixed-Bed Catalytic Reactor // AIChE J. 1971. V. 17. P. 1434.
Chen Y.C., Luss D. Wrong-Way Behavior of Packed-Bed Reactors: Influence of lnterphase Transport // AIChE Journal July 1989. V. 35 (7). P. 1148–1156.
Gallant T. Experimental diesel particulate filter capabilities at PNNL // Proceedings of the DEER Conference, 2006. 20–24 Aug. Chicago.
Chen K., Martirosyan K.S., Luss D. Wrong-Way Behavior of Soot Combustion in a Planar Diesel Particulate Filter // Ind. Eng. Chem. Res. 2009. V. 48. P. 8451–8456.
Chen K., Martirosyan K.S., Luss D. Hot Zones Formation During Regeneration of Diesel Particulate Filters // AIChE J. 2011. V. 57 (2). P. 497–506.
Chen K., Martirosyan K.S., Luss D. Temperature gradients within a soot layer during DPF regeneration // Chem. Eng. Sci. 2011. V. 66. P. 2968–2973.
Haralampous O.A., Koltsakis G.C. Intra-layer temperature gradients during regeneration of diesel particulate filters // Chem. Eng. Sci. 2002.V. 57. (13). P. 2345–2355.
Haralampous O.A., Koltsakis G.C. Oxygen diffusion modeling in diesel particulate filter regeneration // AICHE J. 2004. V. 50 (9). P. 2008–2019.
Bissett E.J. Mathematical model of the thermal regeneration of a wall-flow monolith diesel particulate filter. Chemical Engineering Science // 1984. V. 8 (39). P. 1233–1244.
Pinjala V., Chen Y.C., Luss D. Wrong-way behavior of packed-bed reactors. II. Impact of thermal dispersion // AICHE J. 1988. V. 34. P. 1663–1672.
Guo Z., Zhang Z. Hybrid modeling and simulation of multidimensional processes for diesel particulate filter during loading and regeneration // Numerical Heat Transfer. Part A: Applications. 2007. V. 51 (6) P. 519–539.
Fatehi M., Kaviany M. Role of gas - phase reaction and gas - solid thermal nonequilibrium in reverse combustion // Int. J. Heat Mass Transfer. 1997. V. 11. P. 2607.
Oliveira A.A.M., Kaviany M. Nonequilibrium in the transport of heat and reactants in combustion in porous media // PECS . 2001. V. 27. P. 523.
Pereira F.M., Oliveira A.A.M., Fachini F.F. Theoretical analysis of ultra - lean premixed flames in porous inert media // J. Fluid Mech. 2010. V. 657. P. 285.
Fatehi M., Kaviany M. Role of gas - phase reaction and gas - solid thermal nonequilibrium in reverse combustion // Int. J. Heat Mass Transfer. 1997. V. 11. P. 2607.
Delgado J.M.P.Q. Longitudinal and transverse dispersion in porous media // Chem. Eng. Res. Des. 2007. V. 85. P. 1245.
Quintard M., Whitaker S. Theoretical Analysis of Transport in Porous Media. Eds. N.Y.: Marcel Dekker, 2000. 788 p.
Betelin V.B., Galkin V.A., Shpilman A.V., Smirnov N.N. Digital core simulator – a promising method for developming hard-to-recover oil reserves technology // Materials Physics and Mechanics, Санкт-Петербург: Изд-во ФГБУ ИПМаш. РАН, 2020. V. 44. P. 186–209.
Markov A.A. On Thermal and Mass Dispersion Effect on Barium Titanate Synthesis via CCSO // Физ.-хим. кинет. газов. дин. 2010. Т. 20 (4) С. 1. http://chemphys.edu.ru/issues/2019-20-4/articles/870/, http://www.chemphys.edu.ru.
Марков А.А. Моделирование синтеза микронных частиц титаната бария в осесимметричном прямоточном и трехзонном реакторе // Инженерно-физический журнал. 2021. Т. 94 (5). С. 1343–1357.
Сорокова С.Н., Князева А.Г. Связанная модель спекания порошков системы Ti–TiAI3 // Изв. ТПУ. 2009. Т. 314 (2). С. 96.
Князева А.Г. Введение в термодинамику необратимых процессов. Томск: Изд-вo Иван Федоров, 2014. 170 с.
Trevino C., Leo De, Dannangoda G.C., Hobosyan M.A., Held J.T. Safi Samghabadi F., Khodadadi M., Litvinov D., Mkhoyan K.A., Martirosyan K.S. Carbon combustion synthesis of Janus-like particles of magnetoelectric cobalt ferrite and barium titanate // Ceramics Int. 2021. V. 47 (4). P. 5415–5422. https://doi.org/10.1016/j.ceramint.2020.10.123
Марков А.А. Эффект теплового и концентрационного расширения при синтезе титаната бария в прямоточном реакторе // ТОХТ. 2021. Т. 55 (5). С. 618–631.
Martirosyan K.S., Luss D. Carbon Combustion Synthesis of Oxides Process Demonstration and Features // AIChE 2005. V. 51 (10). P. 2801.
Марков А.А., Филимонов И.А., Мартиросян К.С. Моделирование синтеза сложных оксидов субмикронной дисперсности // ТОХТ. 2017. V. 51 (1). С. 31.
Brzozowski E., Sanchez J., Castro 1. M.S. BaCO3–TiO2 Solid State Reaction: A Kinetic Study // J. Materials Synthesis and Processing. 2002. V. 10 (1). P. 1064.
Beauger A., Mutin J.C., Niepce J.C. Synthesis reaction of metatitanate BaTiO3. Part 1 Effect of the gaseous atmosphere upon the thermal evolution of the system BaCO3–TiO2 // J. Materials Science. 1983. V. 18. P. 3041.
Марков А.А., Обосян М.А., Мартиросян К.С. Исследование синтеза ферритов за волной горения с применением моделей скольжения и скачков температуры и концентраций компонент газовой фазы на поверхности пор твердой фазы // Физ.-хим. кинет. газов. дин. 2015. V. 16 (1). http://chemphys.edu.ru/issues/2015-16-1/articles/506/
Франк-Каменецкий Д.А. Диффузия и теплопередача в химической кинетике. 3-e, испр и доп. M.: Наука, 1987. 491 с.
Марков А.А., Филимонов И.А. Нестационарные структуры спирального горения на поверхности // Физ.-хим. кинет. газов. дин. 2021. Т. 22 (3). http://chemphys.edu.ru/issues/2021-22-3/articles/938/.
Дополнительные материалы отсутствуют.
Инструменты
Известия РАН. Механика жидкости и газа


