Литология и полезные ископаемые, 2020, № 1, стр. 65-74
Адсорбция катионов тяжелых металлов полиметаллическими сульфидами гидротермальных полей Брокен Спур и ТАГ Атлантического океана
Г. В. Новиков a, *, Н. А. Шульга a, Н. В. Лобус a, О. Ю. Богданова a
a Институт океанологии им. П.П. Ширшова РАН
117997 Москва,
Нахимовский проспект, 36, Россия
* E-mail: gvnovikov@yandex.ru
Поступила в редакцию 12.03.2018
После доработки 06.08.2018
Принята к публикации 22.07.2019
Аннотация
В статье приведены результаты изучения минерального и химического состава образцов сульфидных отложений из гидротермальных полей Брокен Спур и ТАГ Срединно-Атлантического Хребта. Основные минералы в образце поля Брокен Спур – марказит, пирротин, пирит, халькопирит и сфалерит; в образце из ТАГ – халькопирит, пирит и марказит. Установлено, что эти сульфидные минералы железа, меди и цинка являются природными ионообменниками и относятся к классу адсорбентов. Обменная емкость сульфидных минералов по катионам тяжелых металлов – Ni2+, Co2+, Cd2+ и Pb2+ находится в диапазоне 0.022–0.32 мг-экв/г. В продуктах обменных реакций минеральный состав сульфидных отложений сохраняется, и новые фазы не появляются. Высказано предположение, что адсорбированные катионы тяжелых металлов заселяют либо вакантные катионные, либо межузловые дефектные позиции в структурах сульфидных минералов. Прочность связи адсорбированных катионов тяжелых металлов с основными структурными элементами минералов низкая, что подтверждается высоким их извлечением в кислой среде. Результаты экспериментов по адсорбции-десорбции указывают на две формы нахождения катионов тяжелых металлов в сульфидных минералах – сорбированную (основную) и химически связанную.
Гидротермальные системы приурочены к вулканически активным структурам океанского дна, прежде всего к рифтовым зонам срединно-океанических хребтов, и являются источником вещества для формирования залежей массивных полиметаллических сульфидных руд [Богданов, Сагалевич, 2002]. Высокотемпературный гидротермальный раствор достигает поверхности дна, и в результате его смешивания с холодными придонными океанскими водами часть химических элементов осаждается, главным образом, в виде сульфидных фаз. Эти фазы формируют трубу вокруг гидротермальных источников, а их ассоциации, слагающие реликтовые и действующие трубы, образуют сульфидную гидротермальную постройку (“холм”). При этом на ранних стадиях ее формирования накапливаются относительно более высокотемпературные разновидности отложений медной и медно-цинковой специализации [Лисицын и др., 1990; Бортников и др., 2004; Бортников, Викентьев, 2005]. Современные “черные курильщики” являются уникальной природной лабораторией, на примере которой возможно исследование различных аспектов функционирования гидротермальных систем [Богданов и др., 2006; Hannington et al., 2011]. Это связано, в первую очередь, с перспективами освоения океанских рудных месторождений и их высокой экономической ценностью, которая определяется присутствием в них значительного количества металлов. Для гидротермальных сульфидов это, прежде всего, медь и цинк, железо. Кроме них в сульфидных минералах присутствуют, хотя и в значительно меньших количествах, золото, свинец, серебро, кобальт, никель, кадмий, барий, селен, индий и другие элементы, которые могут быть попутно извлечены при переработке сульфидных руд.
Однако, с научной точки зрения, интересны и другие аспекты, в частности, выяснение механизмов концентрирования катионов тяжелых металлов в сульфидных минералах. Понятно, что в качестве основного способа накопления этих металлов следует рассматривать их соосаждение из гидротермального раствора вместе с главными элементами сульфидных минералов при его смешении с океанской водой. Данный механизм может быть реализован только при условии постоянного присутствия катионов тяжелых металлов в гидротермальном растворе или в океанской воде, с которой он смешивается, в момент осаждения сульфидных минералов. Однако возможен и другой механизм – сорбционный, который не связан непосредственно с осаждением сульфидов и может действовать в течение всего времени формирования сульфидных залежей.
В 1960–1970 гг. прошлого века было проведено несколько экспериментов по сорбции катионов тяжелых металлов (Cd2+, Fe2+, Zn2+) на природных сульфидах из месторождений на континентах: сфалерите (ZnS) и миллерите (NiS), при комнатной температуре и атмосферном давлении [Вольхин, Львович, 1968а, б; Львович, Вольхин, 1968, 1970; Рябчиков и др., 1962], а также при повышенных параметрах – температуре 550°С и давлении 1000 кг/см2 [Челищев, 1973]. В результате этих исследований было установлено частичное изоморфное замещение катионов Zn2+ – катионами Cd2+, Fe2+ и Cu2+ и катионов Ni2+ – катионами Cd2+, Pb2+ и Cu2+, в соответствующих сульфидных минералах. Кроме того, при обмене катионов Zn2+ на катионы Cd2+ наблюдалось образование холиита (CdS), а при замещении цинка катионами Fe2+ происходило также образование пирротина. H.O. Phillips и K.A. Kraus [1963], изучая адсорбционные свойства холиита, пришли к выводу, что его можно использовать для извлечения из растворов Cu2+, Hg2+ и Ag+. В те годы глубоководные полиметаллические сульфидные отложения еще не были открыты, а, следовательно, не были изучены их ионообменные свойства. Однако вплоть до настоящего времени эти аспекты остаются слабо освещенными, а проблема в целом – актуальной. Целью данной работы являлось изучение обменных реакций между катионами тяжелых металлов и глубоководными полиметаллическими сульфидными отложениями различного минерального состава.
МАТЕРИАЛЫ И МЕТОДЫ ИССЛЕДОВАНИЯ
Исследовались два образца гидротермальных сульфидных отложений, отобранных в 47-м рейсе НИС “Академик Мстислав Келдыш” (2002 г.) при помощи глубоководных обитаемых аппаратов “Мир-1” и “Мир-2” на гидротермальных полях Брокен Спур и ТАГ Срединно-Атлантического хребта (САХ).
Гидротермальное поле Брокен Спур, площадью 6000 м2, расположено в пределах одного из сегментов рифта САХ длиной 61 км, в 100 км к югу от трансформного разлома Атлантис. Рифтовая долина шириной около 5 км (на широте гидротермального поля) и глубиной до 3200–3300 м ограничена тектоническими уступами. Поверхность рифтовой долины сложена базальтами и практически лишена покрова рыхлых осадков. Гидротермальный раствор достигает температуры 364°С при pH флюида 3.9 [Mitchell et al., 1998; Богданов и др., 2008; Леин, Иванов, 2009]. В отличие от поля ТАГ, в пределах этого поля индивидуальные постройки разделены участками дна, в которых обнажаются вулканиты фундамента [Богданов, Сагалевич, 2002]. Из исследованных гидротермальных полей, связанных с базальтовым вулканизмом, гидротермальное поле Брокен Спур является самым молодым, его гидротермальная активность началась не более 1000 лет назад [Mitchell et al., 1998; Богданов и др., 2006].
Образец 4354-5 отобран на поле Брокен Спур, с цоколя у подножья активной постройки Вайт Машрум, с глубины 3047 м. Образец представляет собой вершину гидротермального холма, который образовался в зоне разгрузки рудоносного гидротермального раствора, поднимающегося к поверхности дна по многочисленным мелким подводящим каналам. Поверхность образца покрыта тонкой пленкой гидроксидов железа, что свидетельствует о завершении восстановительных и проявлении окислительных процессов. Основными минеральными фазами рудных отложений являются сульфиды железа и цинка, с небольшой примесью сульфидов меди. Под поверхностной гидроксидной пленкой, в верхней части массивных отложений по трещинам развивается ангидрит.
Гидротермальное поле ТАГ расположено в пределах сегмента низкоспредингового Срединно-Атлантического хребта длиной около 40 км, ограниченного с севера и юга нетрансформными смещениями. Поле находится примерно в центре сегмента, на вершине вулканического свода рифтовой долины, возвышающегося более чем на 500 м относительно расположенных к северу и югу участков внутреннего рифта [Богданов и др., 2008]. Осевая рифтовая долина характеризуется расчлененным рельефом, обусловленным не только вулканическими и тектоническими процессами, но также развитием процессов выравнивания [Rona et al., 1985; Лисицын и др., 1990]. Эти процессы связаны с интенсивным переотложением осадочного материала с краевых тектонических уступов в рифтовую долину. Особенностью рифтовой долины в районе поля ТАГ является присутствие приподнятого участка восточнее оси спрединга, который прилегает к восточному краевому тектоническому уступу. В пределах этого участка находится активное высокотемпературное гидротермальное поле [Thompson et al., 1985]. Продолжительность гидротермального сульфидного рудоотложения составляет около 100 000 лет [James et al., 1995; Богданов и др., 2006]. Активная высокотемпературная постройка обнаружена у подножья небольшого (диаметром 500 м и высотой 35 м) молодого вулканического купола, расположенного в 2.4 км к востоку от оси спрединга и на расстоянии примерно в 1 км от краевого уступа рифтовой долины. Зафиксированная температура гидротермального флюида составляет 290–320°С при pH флюида 3.1 [Леин, Иванов, 2009]. Цоколь практически полностью сложен крупными сульфидными обломками, поверхность которых со всех сторон покрыта бурой пленкой оксидных минералов железа.
Образец 4342-4 отобран в зоне “черных курильщиков” поля ТАГ с глубины 3618 м. Образец представляет собой активную гидротермальную трубу высотой 27 см и диаметром 18 см. Минеральный состав гидротермального образования преимущественно пирит-халькопиритовый. Центральный полый подводящий канал инкрустирован крупными кристаллами халькопирита.
Для проведения экспериментов по сорбции катионов тяжелых металлов на сульфидных минералах использовались 0.5 М растворы их солей – NiCl2. 6Н2О; CoCl2. 7H2O, CdCl2. 8Н2О и Pb(NO3)2. С целью уменьшения влияния компонентов, содержащихся в полиминеральной матрице сульфидов, на процесс сорбции катионов тяжелых металлов, предварительно были выделены липиды и удалена кристаллическая сера экстракцией хлористым метиленом по методике, описанной в работе [Шульга и др., 2010]. Оба образца растирались в агатовой ступке до однородной тонкодисперсной массы. Эксперименты по сорбции проводились в статическом режиме при следующих условиях: Т = 22 ± 2°С, соотношении жидкой и твердой фаз Ж : Т = 100, интенсивном перемешивании; длительность эксперимента составила 10 суток. Десорбция катионов металлов из соответствующих катионных форм сульфидных минералов проводилась 1 M раствором HCl при Ж : Т =100 в течение 4 часов.
Определение содержаний катионов металлов в образцах до и после сорбции выполнялось методами ИСП-МС и ИСП-АЭС [Карандашев и др., 2007] с использованием спектрометров iCAP-6500 и Х-7, соответственно (ThermoScientific, USA) в Аналитическом сертифицированном испытательном центре Института проблем технологии микроэлектроники и особочистых материалов РАН.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Минеральный состав сульфидных отложений
Исследования минерального состава образцов сульфидных отложений из полей Брокен Спур (обр. 4354-5) и ТАГ (обр. 4324-4) позволили установить в них идентичный набор основных рудных минералов – пирит, марказит, халькопирит, но разные соотношения между ними (табл. 1). Кроме того, в образце 4354-5 поля Брокен Спур к основным минералам относится также пирротин (18%), присутствующий в двух модификациях – моноклинный и гексагональный, и сфалерит (10%). В виде примеси присутствуют вюртцит (5%), сера (3%) и гетит (6%), обнаруженный на внешней поверхности образца. В образце 4324-4 поля ТАГ среди основных минералов резко преобладает халькопирит (53%), содержание пирита и марказита соответственно 23 и 16%, в качестве примесей присутствуют ковеллин (2%) и сфалерит (2.5%).
Таблица 1.
Минеральный состав полиметаллических сульфидных руд гидротермальных полей Брокен Спур и ТАГ в исходных образцах и после сорбции катионов металлов
| Название минерала | Формула | Содержание минералов в исходном образце и его катионных формах, % |
||||
|---|---|---|---|---|---|---|
| исходный образец |
Ni | Co | Cd | Pb | ||
| Поле Брокен Спур (обр. 4354-5) | ||||||
| Марказит | FeS2 | 23 | 30.5 | 26 | 31 | 24 |
| Пирротин (моноклинный + гексагональный) | Fe1 – xS | 18 | 17 | 15 | 18 | 7 |
| Пирит | FeS2 | 16 | 20.5 | 18 | 15 | 15 |
| Сфалерит | ZnS | 10 | 12 | 9 | 12.5 | 11 |
| Халькопирит | CuFeS2 | 9 | 6 | 5 | 5 | 7 |
| Гетит | FeOOH | 6 | 2.5 | 4 | 4 | 3 |
| Вюрцит | ZnS | 5 | 4 | 3 | 2 | 4 |
| Сера | S | 3 | 2.5 | 3 | 1 | 4 |
| Англезит | PbSO4 | − | − | − | – | 12 |
| ∑ | 90 | 95 | 83 | 94.5 | 87 | |
| Поле ТАГ (обр. 4342-4) | ||||||
| Халькопирит | CuFeS2 | 53 | 47 | 47 | 33 | 47 |
| Пирит | FeS2 | 23 | 31 | 31 | 36 | 30.5 |
| Марказит | FeS2 | 16 | 16 | 16 | 25 | 15 |
| Ковеллин | CuS | 2 | 0.5 | 0.5 | – | − |
| Сфалерит | ZnS | 2.5 | 2.5 | 2.5 | 4.5 | 2.5 |
| Англезит | PbSO4 | − | − | − | – | 2.5 |
| ∑ | 96.5 | 97 | 97 | 98.5 | 97.5 | |
Химический состав сульфидных отложений
Несмотря на сходный минеральный состав сульфидных отложений и близкое содержание Fe в образцах 4354-5 поля Брокен Спур и 4324-4 и поля ТАГ– 42.63 и 40.38 мас. % (табл. 2), в них установлены различия в содержании других основных элементов – Cu и Zn. Так, образец поля Брокен Спур обогащен Zn – 9.95 и обеднен Cu – 1.51 мас. %, а в образце поля ТАГ наблюдается противоположная картина – содержания Zn и Cu составляют соответственно 1.90 и 11.81 мас. %. Содержание тяжелых (Ni, Co, Cd, Pb) металлов в этих же образцах существенно различается (см. табл. 2). Образец 4354-5 поля Брокен Спур характеризуется низким содержанием Ni и Со – 2.0 и 1.4 г/т соответственно, и высоким содержанием Cd и Pb – 255 и 420 г/т. В образце 4324-4 поля ТАГ содержание Ni остается таким же низким – 2.2 г/т, тогда как содержание Со возрастает до 108 г/т. По сравнению с образцом поля Брокен Спур, содержание Cd и Pb в образце поля ТАГ значительно ниже, концентрации этих элементов составляют 52.4 и 121 г/т соответственно.
Таблица 2.
Содержание элементов в полиметаллических сульфидах гидротермальных полей Брокен Спур и ТАГ в исходном состоянии, после сорбции и десорбции катионов металлов
| Состояние образца | Fe | Cu1 | Zn2 | S3 | Ni | Co | Cd | Pb | Ca | Mg | Na | K |
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| мас. % | г/т | |||||||||||
| Поле Брокен Спур (обр. 4354-5) | ||||||||||||
| Исходный | 42.63 | 1.51 | 9.95 | 23.80 | 2.0 | 1.4 | 255 | 420 | 80.5 | 129 | 975 | 88.4 |
| После сорбции | 42.6 | 1.50 | $\frac{{8.81}}{{0.63}}$ | 23.80 | 1103 | 655 | 17 930 | 29 878 | 34.1 | <5.0 | 144 | 68.6 |
| После десорбции | 42.6 | 1.50 | 23.80 | 185 | 177 | 9768 | 1797 | <24.0 | <5.0 | 93.7 | 48.6 | |
| Поле ТАГ (обр. 4324-4) | ||||||||||||
| Исходный | 40.38 | 11.80 | 1.90 | 31.74 | 2.2 | 108 | 52.4 | 121 | 220 | 205 | 2413 | 196 |
| После сорбции | 40.15 | $\frac{{11.26}}{{1.37}}$ | $\frac{{0.61}}{{1.90}}$ | 20.55 | 1256 | 658 | 593 | 15 355 | 29.1 | <5.0 | 127 | 63.4 |
| После десорбции | 40.08 | 14.7 | 79.1 | 29.0 | 10 696 | 27.0 | <5.0 | 90.6 | 47.1 | |||
Примечаниe. Содержания элементов Ca, Mg, Na, K после сорбции и десорбции представлены средними значениями. Содержание Ca < 24.0 и Mg < 5.0 – меньше предела обнаружения. Для образца из поля ТАГ: 1 – в числителе среднее содержание катионов Cu2+ после сорбции Co2+, Ni2+, Cd2+, в знаменателе – после сорбции Pb2+; 2 – в числителе среднее содержание Zn2+ после сорбции катионов Co2+, Ni2+, Cd2+, в знаменателе – после сорбции Pb2+; 3 – в числителе среднее содержание S2– после сорбции катионов Pb2+. Для образца из поля Брокен Спур: 2 – в числителе среднее содержание Zn2+ после сорбции катионов Co2+, Ni2+, в знаменателе – после сорбции катионов Pb2+.
Обменные реакции катионов тяжелых металлов
Поведение образцов сульфидных отложений, различающихся по минеральному и химическому составу, было изучено в растворах солей никеля, кобальта, кадмия и свинца. Взаимодействие твердых и жидких фаз приводит к обменным реакциям между катионами сульфидных минералов и катионами тяжелых металлов, содержащихся в растворах, в результате чего существенно увеличивается содержание тяжелых металлов в обоих типах сульфидных отложений. При этом наблюдается дифференцированное поглощение катионов тяжелых металлов, которое зависит от минерального состава отложений. После эксперимента содержание (г/т) катионов тяжелых металлов в образцах 4354-5 поля Брокен Спур и 4324-4 поля ТАГ было следующим: Ni – 1103 и 1256: Со – 655 и 658; Сd – 17930 и 593; Pb – 29878 и 15355 соответственно (см. табл. 2). Таким образом, катионы Ni2+ практически одинаково, а Со2+ – совершенно одинаково поглощаются обоими образцами, тогда как катионы Cd2+ и Pb2+ – более заметно концентрируются в образце 4354-5, по сравнению с образцом 4324-4.
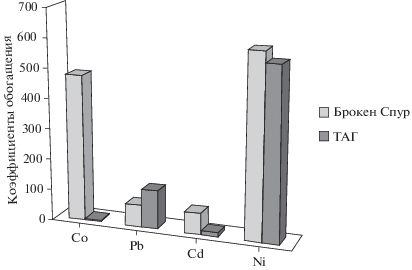
В то же время максимальные коэффициенты обогащения по катионам Ni2+ наблюдаются в обоих образцах (604 и 568), а по катионам Со2+ – в образце 4354-5 (483); минимальный коэффициент обогащения среди всех катионов тяжелых металлов также относится к катионам Со2+ – 6 (рис. 1). Катионы Cd2+ и Pb2+ по значениям коэффициента обогащения занимают промежуточное положение между катионами Ni2+ и Со2+, коэффициенты обогащения по которым одинаковы в сульфидных рудах образца 4354-5 поля Брокен Спур – 70 и 71, а в образце 4324-4 поля ТАГ – различаются на порядок: Cd2+ – 11, Pb – 127 (см. рис. 1). Однако рассчитанные коэффициенты обогащения катионов тяжелых металлов являются относительными величинами, зависящими от содержания каждого из них в исходном образце.
Рис. 1.
Коэффициенты обогащения полиметаллических сульфидных отложений гидротермальных полей Брокен Спур и ТАГ после сорбции катионов тяжелых металлов.
Обменные реакции с участием катионов тяжелых металлов в обоих образцах сопровождается дифференцированным извлечением катионов щелочных и щелочно-земельных металлов из сульфидных минералов. Катионы Mg2+ извлекаются из них практически полностью, значительное извлечение характерно и для катионов Na+ – 85.0–94.7%. Извлечение катионов Са2+ и К+ из образца 4324-4 поля ТАГ происходит более интенсивно, по сравнению с извлечением этих же катионов из сульфидов образца 4354-5 поля Брокен Спур – 86.7 и 57.6% и 67.7 и 22.6% соответственно (см. табл. 2). Следовательно, катионы щелочных и щелочно-земельных металлов составляют обменный комплекс сульфидных минералов.
Несмотря на заметное относительное увеличение содержания каждого катиона тяжелых металлов, обменная емкость сульфидных минералов является низкой (табл. 3). Значения емкости (мг-экв/г) образцов из полей Брокен Спур и ТАГ по катионам Ni2+ близкие – 0.037 и 0.043, по Со2+ одинаковые – 0.022; значения обменной емкости по катионам Cd2+ и Pb2+ в образце из поля Брокен Спур – соответственно 0.32 и 0.29, тогда как в образце из поля ТАГ – 0.011 и 0.15. Полученные данные свидетельствуют о том, что поглощение катионов Со2+ и Ni2+, скорее всего, не зависит от минерального состава сульфидных залежей, тогда как катионы Cd2+ и Pb2+ интенсивнее адсорбируются на образце поля Брокен Спур, в котором преобладают сульфиды железа (марказит, пирротин и пирит), по сравнению с образцом поля ТАГ, где основным минералом является халькопирит (см. табл. 1). Обменную емкость сульфидных отложений с разным минеральным составом в отношении катионов тяжелых металлов можно представить в виде следующих рядов:
Таблица 3.
Обменная емкость (мг-экв/г) сульфидных отложений гидротермальных полей Брокен Спур и ТАГ
| Поле, № образца | Основные минералы | Ni | Co | Cd | Pb |
|---|---|---|---|---|---|
| Брокен Спур, обр. 4354-5 | Марказит, пирротин, пирит, сфалерит | 0.037 | 0.022 | 0.32 | 0.29 |
| ТАГ, обр. 4324-4 | Халькопирит, пирит, марказит | 0.043 | 0.022 | 0.011 | 0.15 |
1) для марказита, пирротина, пирита (поле Брокен Спур): Co < Ni < Pb < Cd;
2) для халькопирита, пирита, марказита (поле ТАГ): Сd < Co < Ni < Pb.
Таким образом, установленные, хотя и довольно низкие, значения обменной емкости глубоководных сульфидных отложений позволяют отнести их к природным адсорбентам. Сравнение сульфидных минералов с другими природными минералами-сорбентами показывает, что по значениям обменной емкости они близки гематиту, Fe2O3, – одному из основных минералов океанских низкотемпературных гидротермальных железистых отложений, а также слоистым алюмосиликатным минералам – флогопиту, каолиниту и хлориту (табл. 4), на поверхности которых происходит поглощение катионов металлов.
Таблица 4.
Обменная емкость (мг-экв/г) известных минеральных ионообменников
| Минеральные ионообменники |
Преобладающие минералы |
Емкость по катионам | Источники данных | |
|---|---|---|---|---|
| щелочных металлов |
тяжелых металлов |
|||
| Глины | Флогопит каолинит хлорит гидрослюда галлуазит монтмориллонит нонотронит вермикулит |
0.01–0.16 0.03–0.15 0.10–0.40 0.10–0.40 0.40–0.50 0.80–1.50 0.55–1.20 1.00–1.50 |
[Гримм, 1967; Кокотов, 1980] |
|
| Океанские
пелагические осадки: типы ГР, РГ, МПГ тип ЭГЦ |
Полевые шпаты, кварц; смектит, гидрослюда, хлорит; смектит, смешанослойный иллит-смектит, филлипсит |
0.24–0.27 0.10–0.37 0.45–0.65 |
0.01–0.03 0.20–1.60 0.30–1.40 |
[Новиков, Мурдмаа, 2007] |
| Цеолиты | Морденит, эрионит; клиноптилолит; филлипсит |
1.05–1.35 1.10–1.45 1.50–2.13 |
1.50–1.80 1.70–1.95 – |
[Челищев и др., 1984, 1987, 1988] |
| Океанские железомарганцевые образования |
Бузерит-I, асболан-бузерит; |
0.85–1.20 | 1.50–2.55 |
[Новиков, 2011, 2018; Новиков и др., 2006] |
| бузерит-I, бернессит; | 0.95–1.10 | 1.80–3.35 | ||
| бернессит; | 1.05–1.25 | 1.85–3.00 | ||
| Fe-вернадит, Mn-фероксигит |
0.70–1.10 | 1.30–2.85 | ||
| гетит; | – | 0.50–1.00 | ||
| ферригидрит; | 0.35–0.45 | 0.10–0.75 | ||
| гематит | 0.10–0.15 | 0.020–0.30 | ||
| Глубоководные полиметаллические сульфиды | Марказит, пирротин, пирит, сфалерит; | – |
0.022–0.32 |
Настоящая статья |
| халькопирит, пирит, марказит |
– | 0.022–0.15 | ||
Несмотря на то, что обменные реакции с катионами тяжелых металлов протекают на поверхности сульфидных минералов, представляло интерес проанализировать состав сульфидных отложений после процесса адсорбции. Результаты исследований показали, что минеральный состав сульфидных отложений в образцах обоих гидротермальных полей Срединно-Атлантического хребта в целом сохраняется при некоторых изменениях содержания отдельных минералов (см. табл. 1). Однозначно ответить на вопрос, каким минералом поглощаются катионы тяжелых металлов, не представляется возможным, поскольку мы имеем дело не с отдельными сульфидными минералами, а с их ассоциацией. Наибольшие изменения в образце 4354-5 поля Брокен Спур наблюдаются после адсорбции катионов Ni2+ – возрастают содержания марказита и пирита, и Pb2+ – более чем в два раза уменьшается содержание пирротина. В образце 4324-4 поля ТАГ, после адсорбции катионов Ni2+, Со2+ и Pb2+ наблюдается одинаковый эффект: содержание халькопирита уменьшается, а содержание пирита возрастает.
Среди катионных форм обоих образцов особенно выделяются их Pb-формы, в которых помимо основных сульфидных минералов была идентифицирована новая фаза – англезит PbSO4 с содержанием 12 и 2.5% (см. табл. 1). Образование этой фазы представляется, скорее всего, следующим. Взаимодействие 0.5 М раствора Pb(NO3)2 с пирротином (обр. 4354-5) приводит к его частичному (более 50%) растворению, а взаимодействие с ковеллином (обр. 4324-4) – к полному растворению этой фазы. Сульфид-ионы S2–, перешедшие в раствор, окисляются ионами О2–, источником которых являются молекулы воды, с образованием сульфат-иона – ${\text{SO}}_{4}^{{2 - }},$ то есть протекает окислительно-восстановительная реакция. Следовательно, процесс взаимодействия сульфидов железа и меди с азотнокислым раствором состоит из реакции ионного обмена (рассмотренной выше) и реакции окисления-восстановления.
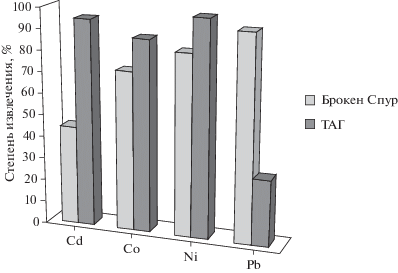
Важным этапом настоящей работы было изучение прочности связи адсорбированных катионов тяжелых металлов с основными элементами кристаллохимической структуры сульфидных минералов, что позволяет, в свою очередь, оценить формы нахождения в них тяжелых металлов. Десорбция поглощенных катионов тяжелых металлов, проводившаяся 1М раствором HCl, сопровождается дифференцированным их извлечением из сульфидных минералов (рис. 2). Извлечение катионов тяжелых металлов из образца 4354-5 поля Брокен Спур возрастает в следующей последовательности: Сd (45.5%) < Co (73.0%) < < Ni (88.2%) < Pb (94.0%), в то время как для образца 4324-4 поля ТАГ эта последовательность имеет другой вид: Pb (30.3%) < Co (88.0%) < < Сd (95.1%) < Ni (98.8%). Как при адсорбции катионов Ni2+ и Со2+ ассоциациями марказита, пирротина, пирита (обр. 4354-5) и халькопирита, пирит, марказита (обр. 4324-4), так и при десорбции, извлечение этих металлов мало зависит от минерального состава сульфидных отложений, тогда как для адсорбированных катионов Сd2+ и Pb2+ такая зависимость прослеживается.
Рис. 2.
Степень извлечения адсорбированных катионов тяжелых металлов из полиметаллических сульфидных отложений гидротермальных полей Брокен Спур и ТАГ.
Результаты сорбции‒десорбции катионов Ni2+, Со2+, Cd2+ и Pb2+ сульфидными минералами ставят вопрос об особенностях вхождения этих катионов в кристаллические структуры сульфидов. Несмотря на структурные различия сульфидов железа, меди и цинка, общим свойством этих минералов является плотная упаковка атомов и, следовательно, ограниченное количество позиций, которые могут быть заселены катионами тяжелых металлов. По мнению В. Онуфриенок [2013а‒г]. В структурах пирита, пирротина и халькопирита для них предполагается существование трех позиций: частичное изоморфное замещение адсорбированными катионами основных катионов (Fe, Cu, Zn), вакантные катионные и межузловые дефектные позиции. Близкие способы вхождения элементов-примесей в сульфиды были рассмотрены на примере пирита в работе [Викентьев, 2015].
Сохранение сульфидных минералов в обоих образцах после обменных реакций с участием катионов Ni2+, Со2+, Cd2+ и Pb2+ свидетельствует, скорее всего, об отсутствии изоморфного замещения структурных катионов Fe2+ и Cu2+ в кристаллической решетке минералов, несмотря на достаточно высокие содержания адсорбированных катионов: Сd2+ – 1.79 и Pb2+ – 2.79 и 1.54 мас. % в соответствующих катионных формах образцов (см. табл. 2). Высокое извлечение адсорбированных катионов Ni2+, Со2+ и Pb2+ (73–94% от общего количества) из образца 4354-5 поля Брокен Спур и катионов Со2+, Cd2+ и Ni2+ (88.0–98.8%) из образца 4324-4 поля ТАГ свидетельствует, по-видимому, о равноценности двух других позиций – вакантных катионных и межузловых дефектных, в которых наблюдается слабая связь адсорбированных катионов с основными элементами структуры минералов – Fe2+ и Cu2+. Следовательно, можно предположить, что основной формой нахождения катионов тяжелых металлов в сульфидных минералах является сорбированная, а другой их формой – химически связанная, но в значительно меньшем количестве.
ЗАКЛЮЧЕНИЕ
Исследования глубоководных полиметаллических сульфидных залежей гидротермальных полей Срединно-Атлантического Хребта для изучения ионообменных свойств сульфидных отложений различного минерального состава проведены впервые. Выяснено, что сульфидные минералы железа, меди, цинка, в соответствии со значениями установленной для них обменной емкости по катионам Ni2+, Co2+, Cd2+, Pb2+ – 0.02–0.32 мг-экв/г, относятся к классу адсорбентов. Сорбция и десорбция катионов Ni2+ и Co2+ не зависит от минерального состава сульфидных отложений, тогда как для катионов Cd2+ и Pb2+ наблюдается отчетливая зависимость: в присутствии халькопирита обменная емкость по Cd2+ уменьшается более чем на порядок величины, а по Pb2+ – в два раза. Результаты экспериментов по адсорбции-десорбции позволяют предполагать, что для катионов тяжелых металлов характерны две формы нахождения в сульфидных минералах – адсорбированная (более 70% от общего количества катионов) и химически связанная. Участие катионов тяжелых металлов в обменных реакциях с различными сульфидными минералами играет важную роль при формировании химического состава глубоководных полиметаллических сульфидных руд.
Список литературы
Богданов Ю.А., Сагалевич А.М. Геологические исследования с глубоководных обитаемых аппаратов “Мир”. М.: Научный мир, 2002. 304 с.
Богданов Ю.А., Лисицын А.П., Сагалевич А.М., Гурвич Е.Г. Гидротермальный рудогенез океанского дна. М.: Наука, 2006. 527 с.
Богданов Ю.А., Леин А.Ю., Масленников В.В. и др. Минералого-геохимические особенности сульфидных руд гидротермального поля Брокен Спур // Океанология. 2008. Т. 48. № 5. С. 734–756.
Бортников Н.С., Симонов В.А., Богданов Ю.А. Флюидные включения в минералах из современных рифтовых сульфидных построек: физико-химические условия минералообразования и эволюция флюида // Геология рудных месторождений. 2004. Т. 46. № 1. С. 74–87.
Бортников Н.С., Викентьев И.В. Современное сульфидное полиметаллическое минералообразование в Мировом Океане // Геология рудных месторождений. 2005. № 1. С. 16–50.
Викентьев И.В. Невидимое и микроскопическое золото в пирите: методы исследования и новые данные для колчеданных руд Урала // Геология рудных месторождений. 2015. Т. 57. № 4. С. 267–298.
Вольхин В.В., Львович Б.И. Приготовление труднорастворимых гидратированных сульфидов в гранулированной форме и их сорбционные свойства // Синтез и свойства ионообменных материалов. М.: Наука, 1968а. С. 73–77.
Вольхин В.В., Львович Б.И. Взаимодействие в системах NiS–CdSO4–H2O и NiS–CdSO4–H2SO4–H2O // Журнал неорганической химии. 1968б. Т. 13. Вып. 7. С. 1992–1997.
Гримм Р. Минералогия и практическое использование глин. М.: Иностранная Литература, 1967. 510 с.
Карандашев В.К., Туранов А.Н., Орлова Т.А. и др. Использование метода масс-спектрометрии c индуктивно связанной плазмой в элементном анализе объектов окружающей среды // Заводская лаборатория. Диагнос-тика материалов. 2007. Т. 73. № 1. С. 12‒22.
Кокотов Ю.А. Иониты и ионный обмен. Л.: Химия, 1980. 132 с.
Леин А.Ю., Иванов М.В. Биогеохимический цикл метана в океане. М.: Наука, 2009. 576 с.
Лисицын А.П., Богданов Ю.А., Гурвич Е.Г. Гидротермальные образования рифтовых зон океана. М.: Наука, 1990. 256 с.
Львович Б.И., Вольхин В.В. Системы NiS–CuSO4–H2O, NiS–H2SO4–H2O, NiS–CuSO4, H2SO4–H2O // Журнал неорганической химии. 1968. Т. 13. Вып. 2. С. 570-575.
Львович Б.И., Вольхин В.В. Гетерогенные ионообменные реакции в системах ZnS–CuSO4–H2O, ZnS–CuSO4–H2SO4–H2O, Zn(OH)2–CuSO4–H2O // Журнал неорганической химии. 1970. Т. 15. Вып. 2. С. 520–524.
Новиков Г.В. Сорбционные типы железомарганцевых образований Мирового океана // Минералого-технологическая оценка месторождений полезных ископаемых и проблемы раскрытия минералов / Под ред. В.В. Щипцова. Петрозаводск: Карельский научный центр РАН, 2011. С. 68–82.
Новиков Г.В. Ионообменные свойства рудных минералов океанских железомарганцевых образований // Мировой океан. Т. III. Твердые полезные ископаемые и газовые гидраты в океане. М.: Научный мир, 2018. С. 355–498.
Новиков Г.В., Мурдмаа И.О. Ионообменные свойства океанских железомарганцевых конкреций и вмещающих пелагических осадков // Литология и полез. ископаемые. 2007. № 2. С. 153–186.
Новиков Г.В., Викентьев И.В., Богданова О.Ю. Сорбция катионов тяжелых металлов низкотемпературными отложениями гидротермальных полей Тихого океана // Геология рудных месторождений. 2006. Т. 48. № 4. С. 351–374.
Онуфриенок В.В. Сравнительный анализ распределения примесных атомов в структуре пирротина золотосодержащих руд // Современные наукоемкие технологии. 2013а. № 3. С. 51–57.
Онуфриенок В.В. Пирит месторождения “Панимба”: состав, примесные атомы, распределение золота // Современные наукоемкие технологии. 2013б. № 4. С. 78–84.
Онуфриенок В.В. Анализ позиций примесных атомов в структуре пирита // Современные наукоемкие технологии. 2013в. № 6. С. 186–193.
Онуфриенок В.В. Сравнительный анализ плотности точечных дефектов в структуре халькопирита и содержание золота в породе // Современные наукоемкие технологии. 2013г. № 9. С. 120–127.
Рябчиков Д.И., Цитович И.К., Попурдженян М.К. О сравнительной сорбируемости переходных элементов четвертого периода минеральными ионитами // Докл. АН СССР. 1962. Т. 145. № 4. С. 825–828.
Челищев Н.Ф. Ионообменные свойства минералов. М.: Наука, 1973. 203 с.
Челищев Н.Ф., Беренштейн Б.Г., Новиков Г.В. Равновесия ионного обмена щелочных металлов на природном филлипсите // Докл. АН СССР. 1984. Т. 274. № 1. С. 138–141.
Челищев Н.Ф., Б.Г. Беренштейн Б.Г., Володин В.Ф. Цеолиты – новый тип минерального сырья. М.: Недра, 1987. 176 с.
Челищев Н.Ф., Володин В.Ф., Крюков В.Л. Ионообменные свойства природных высококремнистых цеолитов. М.: Наука, 1988. 128 с.
Шульга Н.А., Пересыпкин В.И., Ревельский И.А. Изучение состава н-алканов в образцах гидротермальных отложений Срединно-Атлантического хребта с помощью метода газовой хроматографии/масс-спектрометрии // Океанология. 2010. Т. 50. № 4. С. 515–523.
Hannington M., Jamieson J., Monecke T. et al. The abundance of seafloor massive sulfide deposits // Geology. 2011. V. 39(12). P. 1155–1158.
James R.H., Elderfield H., Palmer M.R. The chemistry of hydrothermal fluids from the Broken Spur site, 29° N Mid-Atlantic ridge // Geochim. Cosmochim. Acta. 1995. V. 59(4). P. 651–659.
Mitchell N.C., Allerton S., Escartin J. Sedimentation of young ocean floor at the Mid-Atlantic Ridge, 29° N // Mar. Geol. 1998. V. 148. P. 1–8.
Phillips H.O., Kraus K.A. Adsorption on inorganic materials. V. Reactions of cadmium sulfidie with copper(II), mercury(II) and silver(I) / Communications to the editor. 1963. V. 85. 487 p.
Rona P.A., Von Damm K., Edmond J.M. Hydrothermal activity at the Trans-Atlantic Geotraverse hydrothermal field, Mid-Atlantic Ridge Crest at 26° N // J. Geophys. Res. 1985. V. 89. P. 365–377.
Thompson G., Mottl M.A., Rona P.A. Morphology, mineralogy and chemistry of hydrothermal deposits from the TAG-area, 26° N Mid-Atlantic Ridge // Chem. Geol. 1985. V. 49. P. 243–257.
Дополнительные материалы отсутствуют.
Инструменты
Литология и полезные ископаемые


