Химическая физика, 2022, T. 41, № 9, стр. 3-10
Термическое разложение 1-[2,2-бис(метокси-NNO-азокси)этил]-3-нитропиразола
В. В. Захаров 1, *, Б. Л. Корсунский 1, 2, Т. С. Ларикова 1, И. Н. Зюзин 1, Н. В. Чуканов 1, **
1 Институт проблем химической физики Российской академии наук
Черноголовка, Россия
2 Федеральный исследовательский центр химической физики им. Н.Н. Семёнова Российской академии наук
Москва, Россия
* E-mail: vzakh@icp.ac.ru
** E-mail: chukanov@icp.ac.ru
Поступила в редакцию 17.07.2021
После доработки 10.08.2021
Принята к публикации 20.08.2021
- EDN: YSBEAB
- DOI: 10.31857/S0207401X22090126
Аннотация
С использованием методов термического анализа, манометрии, ИК-спектроскопии, масс-спектрометрии и ЯМР изучено термическое разложение 1-[2,2-бис(метокси-NNO-азокси)этил]-3-нитропиразола (I) в изотермических и неизотермических условиях. Теплота полиморфного перехода α → β, теплота плавления β-I и теплота термического разложения I равны соответственно 0.4, 6.2 и 79.2 ккал/моль (274 кал/г). Проанализирован состав продуктов реакции. Среди продуктов найдены N2O, H2O, NO2, NO, N2, СН3ОН и 3-нитропиразол. Кинетика термического разложения соединения I имеет сложный характер и не описывается простыми уравнениями. Определены эффективные энергии активации реакции, значения которых близки к 34–35 ккал/моль и слегка возрастают по мере протекания разложения. Сделан вывод, что первая стадия реакции включает в себя отщепление метоксидиазеноксидной группы через пятичленное циклическое переходное состояние. Число нитрогрупп, связанных с пиразольным циклом, не влияет на кинетику термического разложения.
ВВЕДЕНИЕ
Алкокси-NNO-азоксисоединения (N-алкил-N'-алкоксидиазен-N-оксиды) представляют значительный интерес как эффективные энергоемкие соединения [1–3]. Обладая бóльшим запасом энергии, чем родственные им N-нитросоединения, они в то же время превосходят их по величине энтальпии образования [4], а также по термической [5] и химической стабильности [6–8].
В последние годы синтезирован ряд веществ, молекулы которых, наряду с метоксидиазеноксидными, содержат другие энергоемкие группы [9–13], в том числе нитропиразольные [9–14]. Ряд производных нитропиразолов предложен в качестве компонентов твердых ракетных топлив [15–18]. Симбиоз нитропиразолов с метоксидиазеноксидными группами позволяет получать материалы с высоким содержанием водорода при сохранении положительной энтальпии образования, что важно для использования их в качестве компонентов порохов и твердых ракетных топлив.
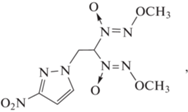
В настоящей работе изучены термические превращения одного из представителей этого класса веществ – 1-[2,2-бис(метокси-NNO-азокси)этил]-3-нитропиразола (I)
который может существовать в виде двух полиморфных модификаций – α и β [13].
Сведения о термическом разложении алкокси-NNO-азоксисоединений весьма скудны. В работе [5] изучено разложение ряда алкокси-NNO-азоксисоединений в газовой фазе. Кинетика реакции описывается уравнением первого порядка. При этом оказалось, что структура молекул реагирующих веществ заметно влияет на кинетику и механизм процесса. При N-алкильном заместителе CH3 и (CH3)3CCH2 энергии активации реакции равны 48.8–49.2 ккал/моль, предэкспоненциальные факторы – 1014.5–1014.6 с–1, а ее лимитирующей стадией является гомолитический разрыв связи N–O. Однако при N-алкильном заместителе (CH3)3C наличие в молекуле атомов водорода в β-положении позволяет реакции протекать по энергетически более выгодному каналу – через пятичленное циклическое переходное состояние. В этом случае энергия активации равна 35.4 ккал/моль, а предэкспоненциальный множитель равен 1013.3 с–1. Сходные результаты были получены при исследовании разложения алкокси-NNO-азоксисоединений в жидкой фазе [19]. При этом радикальный распад протекает с энергиями активации 43.5–44.5 ккал/моль и предэкспоненциальными множителями 1014.6–1015.5 с–1, а распад через циклическое переходное состояние – с энергиями активации 31.9–38.8 ккал/моль и предэкспоненциальными множителями 1011.9–1014.0 с–1.
Термическое разложение нитропиразолов изучено более подробно [20–34]. Было показано [27, 29], что увеличение числа нитрогрупп, связанных с пиразольным циклом в молекуле пиразола, сопровождается ускорением разложения, хотя в работе [15] сделано прямо противоположное заключение. В ряде работ исследованы кинетические закономерности разложения. При этом наблюдались два типа кинетических законов: уравнение реакции первого порядка [29, 31] и уравнение автокатализа [28, 29, 33]. Как отмечено в работе [29], при увеличении числа нитрогрупп, связанных с пиразольным циклом, наблюдается постепенное изменение кинетических зависимостей – переход от реакции первого порядка к кинетике, описываемой законом автокатализа первого порядка.
Несмотря на обилие работ по термическому разложению нитропиразолов, до сих пор нет единого мнения о природе даже первой стадии распада. Предлагались различные варианты: гомолитический разрыв связей C–NO2 [22, 23, 31], N–N [23] и C–N [23], переход нитрогруппы в ациформу [29, 21, 22, 31], нитро-нитритная перегруппировка [20], 1,5-перенос водорода [24, 33], окисление нитрогруппой соседнего атома углерода [29].
Поскольку исследованное в настоящей работе вещество содержит 3-нитропиразольную группу, остановимся на данных по распаду 3-нитропиразола несколько подробнее. Судя по виду кинетических кривых, приведенных в работе [29], это вещество распадается, возможно, со слабым самоускорением. Тем не менее кинетические данные вполне могут быть удовлетворительно описаны уравнением первого порядка с энергией активации 34.0 ккал/моль и предэкспоненциальным множителем 108.50 с–1. Первой стадией реакции, по мнению авторов, является окисление нитрогруппой соседнего атома углерода. В работе [24] термическое разложение 3-нитропиразола изучено в неизотермичесих условиях методами термогравиметрии (ТГ) и дифференциального термического анализа (ДТА), а кинетический анализ выполнен изоконверсионным методом. Энергии активации, вычисленные методами Фридмана и Флинна–Уолла–Озавы, найдены равными соответственно 31.6 и 27.5 ккал/моль. В обоих случаях выяснилось, что рассчитанные значения эффективных энергий активации сильно зависят от степени превращения. В той же работе приведено несколько возможных схем распада 3-нитропиразола, однако лишь для механизма, начинающегося с 1,5-переноса водорода, рассмотрена возможная цепочка дальнейших превращений. В работе [26] термическое разложение ряда нитропиразолов (в том числе 3-нитропиразола) изучено методом импульсной фотоакустической спектроскопии. Авторами сделан вывод, что реакция протекает многостадийно и может включать таутомеризацию исходного вещеста. Среди газообразных продуктов разложения обнаружены H2O, CO, CO2, NO2, NO, N2, N2O, HCN, H2.
В работах [35, 36] изучено термическое разложение веществ, молекулы которых содержат как алкокси-NNO-азоксидные, так и нитропиразольные группы. В работе [35] методами ДСК, термогравиметрии и ИК-спектроскопии изучено термическое разложение N-[2,2-бис(метокси-NNO-азокси)этил]-4-нитропиразола в неизотермическом режиме и определен состав образующихся продуктов. Методом Киссинджера рассчитаны энергия активации и предэкспоненциальный множитель, значения которых найденны равными соответственно 40.7 ккал/моль и 1013.4 с–1. В работах [35, 36] исследовано термическое разложение 1-[2,2-бис(метокси-NNO-азокси)этил]-3,4-динитро-1H-пиразола как в изотермическом, так и в неизотермическом режимах. Жидкофазное разложение этого вещества протекает со слабовыраженным самоускорением. В отличие от индивидуальных алкокси-NNO-азоксисоединений и нитропиразолов, кинетику разложения вещества, в котором одновременно присутствуют обе эти функциональные группы, не удалось описать ни уравнением первого порядка, ни уравнением автокатализа. Поэтому для количественного описания процесса был использован изоконверсионный метод. Оцененные таким способом значения эффективных энергий активации изменяются в зависимости от степени превращения, но в целом близки к 30 ккал/моль. Полученные в работах [35, 36] результаты позволили заключить, что в лимитирующей стадии реакции участвует алкокси-NNO-азокси-группа.
Исследованный в настоящей работе 1-[2,2-бис(метокси-NNO-азокси)этил]-3-нитропиразол по структуре очень близок к веществам, изученным в работах [35, 36]; различие состоит лишь в числе и расположении нитрогрупп в пиразольном цикле. Поэтому данное исследование представляется полезным в плане установления роли нитропиразольной группы в кинетике термического разложения.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Как отмечено выше, соединение I может находиться в двух кристаллических модификациях – α и β. Полиморф α-I синтезирован по известной методике [13]. Температура плавления (123.8–124.2 °С), ИК-спектр и спектры 1Н- и 13С-ЯМР соответствовали литературным данным [13]. Перед началом работ вещество перекристаллизовывали из этанола. Чистота подтверждена данными элементного анализа. Найдено, %: C – 29.11, H – 3.87, N – 34.10; C7H11N7O6. Вычислено, %: C – 29.07, H – 3.83, N – 33.90. Полиморф β-I получен перекристаллизацией α-полиморфа из толуола. Температура плавления (148.4–148.7 °С), ИК-спектр и спектры 1H- и 13C-ЯМР также соответствовали литературным данным [13]. Найдено, %: C – 29.20, H – 3.95, N – 34.06; C7H11N7O6. Вычислено, %: C – 29.07, H – 3.83, N – 33.90.
Термическое разложение I в неизотермическом режиме изучали методами дифференциальной сканирующей калориметрии и ТГ с использованием синхронного термического анализатора STA 449F5 производства компании Netzsch (Germany), сопряженного с квадрупольным масс-спектрометром QMS 403C Aeolos, в диапазоне температур 30–350 °С при продувке аргоном со скоростью 40 мл/мин, скорости нагрева 5 °С/мин и массе навески 1.3 мг. Масс-спектрометрический анализ газообразных продуктов термического разложения I проводился при энергии ионизирующих электронов 70 эВ.
В изотермических условиях кинетика разложения изучалась двумя способами. Опыты по потере массы проводили в открытой системе с использованием автоматических термовесов АТВ-14М [37], а манометрические измерения газовыделения – в замкнутой системе с использованием стеклянных мембранных манометров Бурдона. При проведении термовесовых опытов образец массой ~8 мг помещали в кварцевый стаканчик и вводили в термостатированную часть установки (печь с электроподогревом). В ходе термогравиметрических экспериментов наблюдалось осаждение белого вещества на холодных частях установки. Как будет показано ниже, оно образуется в результате возгонки одного из продуктов термического разложения соединения I.
Рабочая часть манометра Бурдона, использовавшегося при манометрических измерениях, имела объем 3.5–4 мл, а навеска исследуемого вещества составляла 3.5–4 мг. Перед началом опыта реакционный сосуд откачивали до остаточного давления ~0.1 Торр.
ИК-спектры исходного вещества и конденсированных продуктов его разложения получены с помощью ИК-фурье-спектрометра ALPHA II производства компании Bruker Optics (Germany) в диапазоне 360–3800 см–1 при разрешающей способности 4 см–1 и количестве сканирований, равном 16. Образцы для съемки ИК-спектров готовили в виде таблеток с KBr. В каждом случае из общего спектра вычитался спектр аналогичной таблетки, приготовленной из чистого KBr.
Спектр 1H-ЯМР возгонов продуктов разложения регистрировали в 5%-ном растворе CD3CN на спектрометре Avance III 500 МГц компании Bruker (500.2 МГц); внутренний стандарт – тетраметилсилан.
ЭКСПЕРИМЕНТАЛЬНЫЕ РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
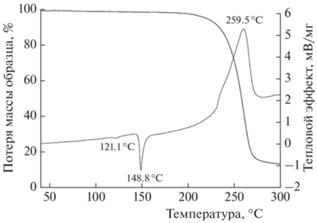
На рис. 1 представлены данные, полученные при нагревании исследуемого вещества со скоростью 5 °С/мин. Кривые ДСК содержат два эндотермических пика с минимумами при температурах 121 и 148 °С. Первый из них соответствует полиморфному переходу α → β (наблюдения в капилляре показали, что этот переход осуществляется через плавление α-I), а второй – плавлению β-I. Теплоты указанных превращений найдены равными соответственно 0.4 и 6.2 ккал/моль. Экзотермический пик на кривой ДСК и соответствующая потеря массы отвечают процессу термического разложения. При нагревании до 300 °С потеря массы составила ~90%, а соответствующий тепловой эффект найден равным 79.2 ккал/моль (274 кал/г). При проведении термического анализа оказалось, что процессы термического разложения α- и β-полиморфов соединения I протекают совершенно идентично. Поэтому все последующие измерения проводили с α-полиморфом этого соединения.
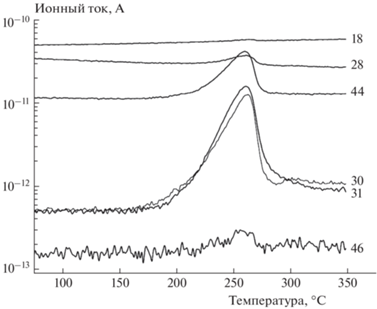
На рис. 2 приведены результаты масс-спектрометрических измерений, проводившихся синхронно с опытами ТГ и ДСК. В результате установлено, что в качестве газообразных продуктов реакции образуются N2O, H2O, NO2, NO, N2 и СН3ОН.
Рис. 2.
Масс-спектрометрические кривые термического разложения соединения I при скорости нагрева 5 °C/мин; числа у кривых – значения m/z.
В ИК-спектре исходного соединения I (кривая 1 на рис. 3) присутствуют полосы валентных колебаний связей C–H триазольного цикла (при 3126 и 3143 см–1), а также метильных и метиленовых групп (в интервале 2835–3050 см–1). Полоса при 1543 см–1 относится к двойной связи C=N, а интенсивная полоса при 1054 см–1 – к фрагменту N–O–C. Остальные полосы относятся к смешанным модам, в том числе с участием антисимметричных валентных (в диапазоне волновых чисел 1450–1520 см–1), антисимметричных валентных (1240–1370 см–1) и деформационных (750–830 см–1) колебаний нитрогрупп вследствие резонанса этих колебаний с колебаниями триазольного кольца и N-оксидных групп.
Рис. 3.
ИК-спектры исходного соединения I α-модификации (1), твердого остатка в стаканчике после разложения I при температуре 173 °С (2), возгона продуктов разложения на холодной стенке над стаканчиком (3) и эталонного образца 3-нитропиразола (4).
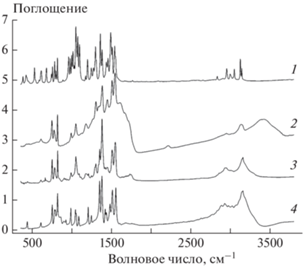
ИК-спектр твердого остатка в стаканчике после разложения соединения I (кривая 2 на рис. 3) представляет собой суперпозицию спектров кристаллического (узкие полосы) и аморфного (широкие полосы) веществ, причем широкие полосы в диапазоне волновых чисел 1100–1700 см–1 относятся к полисопряженной системе связей, образуемых атомами углерода и азота, а большинство узких полос совпадают с полосами возгона на холодной стенке над стаканчиком (кривая 3 на рис. 3). Кроме того, в спектре твердого остатка присутствуют полосы молекул воды (при 1615 и 3421 см–1), адсорбированной вследствие контакта продукта с атмосферой. Полоса при 3158 см–1 в спектре возгона и полоса при 3134 см–1 в спектре твердого остатка не могут быть отнесены к колебаниям связей C–H, так как их большие ширины свидетельствуют об образовании водородных связей различной силы. В то же время положения и ширины этих полос исключают их принадлежность к связям O–H. Следовательно, полосы в диапазоне волновых чисел 3130–3160 см–1 ИК-спектров возгона и твердого остатка относятся к колебаниям с участием группы N–H, образующей водородную связь.
В свою очередь, наиболее интенсивные полосы в ИК-спектре возгона практически совпадают с сильными полосами 3-нитропиразола (кривая 4 на рис. 3). Дополнительные пики (относительно слабые и узкие) на спектрограмме возгона, скорее всего, относятся к небольшой примеси кристаллов летучего побочного продукта реакции. Дополнительные пики (также относительно слабые и узкие) на спектрограмме 3-нитропиразола, использованного в качестве образца сравнения, могут относиться к примесям, в частности к молекулам кристаллогидратной воды (полоса при 1683 см–1 и повышенное поглощение в области 3100–3300 см–1). По-видимому, использованный образец 3-нитропиразола полностью или частично является кристаллогидратом. В таком случае дополнительные полосы при 443 и 614 см–1 в его спектре могут относиться к либрационным колебаниям молекул воды.
Интересно отметить, что ни одна полоса пиразольного цикла в ИК-спектре 3-нитропиразола не совпадает с какой-либо полосой в спектре соединения I. Этот факт может быть объяснен резонансными взаимодействиями колебаний различных групп в соединении I и образованием водородной связи между группой N–H и атомом азота в пиразольном цикле 3-нитропиразола, что могло привести к перераспределению электронной плотности в сопряженной системе.
Таким образом, на основании данных ИК-спектроскопии можно заключить, что основными конденсированными продуктами термического разложения соединения I являются 3-нитропиразол и аморфный полимер, содержащий полисопряженную систему связей, образуемых атомами углерода и азота. Заметим, что образование подобных полимеров вообще характерно для термического разложения многих энергоемких соединений [35, 38, 39].
По данным 1H-ЯМР возгон представляет собой сложную смесь, основной компонент которой – 3-нитропиразол, идентифицированный по всем трем протонам (δ, м.д.: 6.92, дублет, 1H, 3J = = 2.5 Гц, H-4; 7.71, дублет, 1H, 3J = 2.5 Гц, H-5; 11.8, 1H, уширенный синглет, NH). В спектре 1H-ЯМР есть также несколько веществ, содержащих группу CH3ON=N(O), идентифицировать которые не удалось (δ, м.д.: 4.07, синглет, 3H, CH3O). В возгоне присутствует исходное соединение I в следовом количестве (менее 0.4 мольн.% по отношению к 3-нитропиразолу), идентифицированное по характерному триплету (δ, м.д.: 6.49, триплет, 1H, 3J = 6.8 Гц, CH2CH).
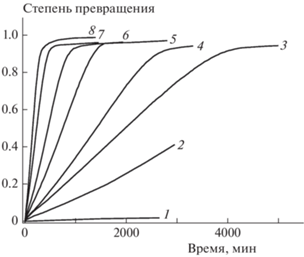
На рис. 4 представлены результаты кинетических измерений термического разложения соединения I в изотермическом режиме, полученные термогравиметрическим методом. Как видно, реакция протекает со слабовыраженным самоускорением при относительно низких температурах, однако по мере повышения температуры опыта оно постепенно скрадывается.
Рис. 4.
Кинетические кривые термического разложения соединения I при различных температурах, °С: 1 – 140, 2 – 160, 3 – 167, 4 – 173, 5 – 180, 6 – 187, 7 – 194, 8 – 200.
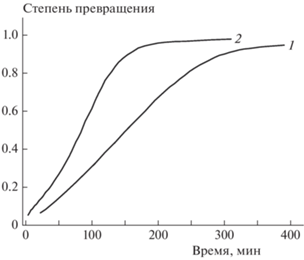
Изотермические измерения проведены также в замкнутой системе с использованием манометрического метода. В целом результаты термогравиметрических и манометрических измерений хорошо совпадают между собой, хотя и имеются некоторые различия. На рис. 5 сопоставлены экспериментальные результаты, полученные при 200 °С (аналогичная картина наблюдалась и при других температурах). Из этого рисунка видно, что в замкнутой системе реакция протекает несколько быстрее, а самоускорение выражено в большей степени.
Рис. 5.
Кинетические кривые термического разложения соединения I при 200 °С: 1 – открытая систем, 2 – замкнутая система.
Попытка количественного описания приведенных выше кинетических зависимостей успехом не увенчалась: эти зависимости не удалось описать уравнениями, обычно используемыми для анализа термического разложения энергоемких веществ – уравнением первого порядка или уравнением автокатализа. Поэтому для определения эффективных энергий активации был использован изоконверсионный метод [40]. Энергии активации оценивали двумя методами – по температурной зависимости времен заданного процента превращения и по температурной зависимости скоростей разложения при заданной степени превращения. Полученные результаты приведены в табл. 1. Из нее видно, что оба использованных способа расчета приводят к практически идентичным результатам, причем по мере возрастания степени превращения эффективная энергия активации несколько увеличивается, а ее среднее значение близко к 34–35 ккал/моль.
Таблица 1.
Эффективные энергии активации термического разложения соединения I
| Степень превращения, % | Энергия активации, ккал/моль | |
|---|---|---|
| по времени | по скорости | |
| 20 | 32.1 ± 1.1 | 32.4 ± 1.0 |
| 30 | 31.9 ± 0.8 | 32.5 ± 1.0 |
| 40 | 32.5 ± 1.1 | 32.2 ± 1.1 |
| 50 | 34.3 ± 0.9 | 33.5 ± 0.7 |
| 60 | 34.3 ± 0.9 | 36.1 ± 1.1 |
| 70 | 34.2 ± 0.7 | 32.9 ± 1.6 |
| 80 | 35.4 ± 0.7 | 37.0 ± 2.5 |
Из сказанного следует, что изученная реакция протекает по сложному многостадийному механизму и зависит от самых различных факторов. Например, из того факта, что в замкнутой системе (манометрические измерения) реакция осуществляется несколько быстрее, чем в открытой (в термогравиметрических опытах), можно заключить, что на нее оказывают влияние газообразные продукты разложения. Состав этих продуктов приведен выше. Поскольку среди них наибольшей активностью обладает диоксид азота, естественно предположить, что одной из стадий исследованного процесса является окисление исходного вещества или продуктов его превращений диоксидом азота. Это окисление, равно как и влияние газообразных продуктов на термическое разложение, весьма характерно для энергоемких веществ [41].
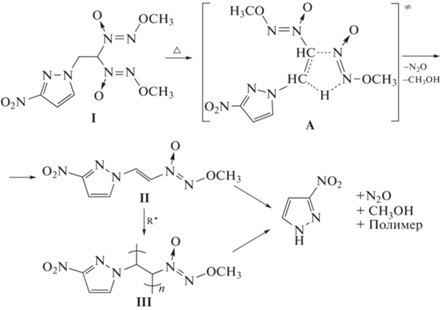
Исследуемое соединение I содержит два типа реакционноспособных функциональных групп – 3-нитропиразольную и две геминальные метоксидиазеноксидные группы. Поэтому при анализе механизма его разложения следует прежде всего, рассмотреть возможность того, что реакция начинается с распада одной из этих групп. Выше говорилось о термическом разложении нитропиразолов. 3-Нитропиразол распадается с энергией активации, равной 34.0 ккал/моль [29], и эта величина прекрасно согласуется со значениями, полученными в настоящей работе. Однако для распада 3-нитропиразола характерно очень низкое значение предэкспоненциального фактора: 108.5 с–1, и для того чтобы он реагировал со скоростями, сопоставимыми со скоростью разложения соединения I, потребовалось бы повысить температуру на ~100 °С. Что же касается метоксидиазеноксидной группы, то в случае, если она распадается через циклическое переходное состояние (а возможность для этого есть, поскольку молекула соединения I содержит два атома водорода в β‑положении), то значение энергии активации, как отмечено выше, должно находиться в диапазоне 32–39 ккал/моль, и это вполне согласуется с данными, приведенными в табл. 1. Более того, во Введении отмечалось, что предэкспоненциальные множители для реакции распада диазеноксидов по вышеуказанному механизму на несколько порядков выше, чем для 3-нитропиразола. Поэтому вполне логичной представляется возможность протекания разложения соединения I по механизму, характерному для алкоксидиазеноксидов с атомами водорода в β-положении, в соответствии со следующей схемой:
Эта схема предполагает, что термическое разложение соединения I протекает последовательно и включает в себя образование промежуточного продукта II и его полимеризацию с последующим разложением полимера III с образованием 3-нитропиразола. Подобные процессы и эффекты наблюдались ранее при синтезе метокси-NNO-азоксиэтена методом препаративного пиролиза 1,1-бис(метокси-NNO-азокси)этана [42, 43]. Поскольку по ходу разложения эффективная энергия активации несколько возрастает, вторая стадия реакции, возможно, протекает медленнее первой.
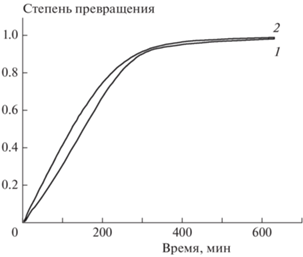
На рис. 6 сопоставлены кинетические кривые термического разложения двух близких аналогов – 1-[2,2-бис(метокси-NNO-азокси)этил]-3-нитропиразола и 1-[2,2-бис(метокси-NNO-азокси)этил]-3,4-динитропиразола (данные для второго вещества заимствованы из работы [36]). Видно, что они практически совпадают. Таким образом, нитропиразольная группа как заместитель не оказывает влияния на лимитирующую стадию реакции. Это, в свою очередь, означает, что увеличение числа нитрогрупп в пиразольном заместителе (что приводит к повышению кислородного баланса и, соответственно, энергоемкости) не снижает термической стабильности веществ исследованного класса.
Рис. 6.
Кинетические кривые термического разложения при 200 °С соединения I (1) и 1-[2,2-бис(метокси-NNO-азокси)этил]-3,4-динитропиразола (2).
Работа выполнена по теме госзадания ИПХФ РАН (регистрационный номер AAAA-A19-119101690058-9) и по теме госзадания ФИЦ химической физики им. Н.Н. Семёнова (регистрационный номер АААА-А17-117040610346-5).
Список литературы
Зюзин И.Н., Лемперт Д.Б. // Изв. АН СССР. Сер. хим. 1985. № 4. С. 831.
Зюзин И.Н., Нечипоренко Г.Н., Головина Н.И., Трофимова Р.Ф., Логинова М.В. // Изв. АН. Сер. хим. 1997. № 8. С. 1486.
Зюзин И.Н., Головина Н.И., Лемперт Д.Б., Нечипоренко Г.Н., Шилов Г.В. // Изв. АН. Сер. хим. 2008. № 3. С. 619.
Кирпичев Е.П., Зюзин И.Н., Авдонин В.В., Рубцов Ю.И., Лемперт Д.Б. // ЖФХ. 2006. Т. 80. № 9. С. 1543.
Зюзин И.Н., Лемперт Д.Б., Нечипоренко Г.Н. // Изв. АН СССР. Сер. хим. 1988. № 7. С. 1506.
Зюзин И.Н., Лемперт Д.Б. // ЖОХ. 2010. Т. 80. № 9. С. 1473.
Зюзин И.Н., Лемперт Д.Б. // Кинетика и катализ. 2011. Т. 52. № 1. С. 19.
Зюзин И.Н., Лемперт Д.Б. // ЖОХ. 2012. Т. 82. № 6. С. 947.
Зюзин И.Н., Головина Н.И., Федоров Б.С., Шилов Г.В., Нечипоренко Г.Н. // Изв. АН. Сер. хим. 2003. № 3. С. 726.
Зюзин И.Н., Лемперт Д.Б. // Изв. АН. Сер. хим. 2009. № 10. С. 2108.
Zyuzin I.N., Suponitsky K.Yu., Sheremetev A.B. // J. Heterocyclic Chem. 2012. T. 49. № 3. C. 561; https://doi.org/10.1002/jhet.811
Зюзин И.Н. // ЖОрХ. 2015. Т. 49. № 4. С. 536.
Зюзин И.Н., Супоницкий К.Ю., Далингер И.Л. // Химия гетероцикл. соединений. 2017. Т. 53. № 6/7. С. 702.
Зюзин И.Н. // // Изв. АН. Сер. хим. 2020. № 10. С. 1949.
Зюзин И.Н., Казаков А.И., Лемперт Д.Б. и др. // Физика горения и взрыва. 2019. Т. 55. № 3. С. 92; https://doi.org/10.15372/FGV20190310
Зюзин И.Н., Лемперт Д.Б., Набатова А.В., Казаков А.И. // Физика горения и взрыва. 2020. Т. 56. № 4. С. 104; https://doi.org/10.15372/FGV20200410
Гудкова И.Ю., Зюзин И.Н., Лемперт Д.Б. // Хим. физика. 2020. Т. 39. № 3. С. 53; https://doi.org/10.31857/S0207401X20030061
Зюзин И.Н., Гудкова И.Ю., Лемперт Д.Б. // Хим. физика. 2020. Т. 39. № 9. С. 52; https://doi.org/10.31857/S0207401X20090149
Zyuzin I., Lempert D., Prokudin V., Kirpichev E., Manelis G. // Energetic Materials. Performance and Safety. 36th Intern. Annu. Conf. Karlsruhe: ICT, 2005. P. 162.
Dalinger I., Shevelev S., Korolev V. et al. // J. Therm. Anal. Calorim. 2011. V. 105. P. 509.
Gryzlova O., Pivkina A., Dalinger I. et al. // Proc. 15th Sem. “New Trends in Research of EnergeticMaterials”. Pardubice, Czech Republic, 2012. Pt. I. P. 173.
Dalinger I., Pivkina A., Gryzlova O. et al. // Proc. 38th Intern. Pyrotechnics Sem. Denver, Colorado, USA, 2012. P. 479.
Ravi P., Goreb G.M., Sikder A.K., Tewari S.P. // Thermochim. Acta. 2012. V. 528. P. 53.
Ravi P., Vargeese A.A., Tewari S.P. // Ibid. V. 550. P. 83.
Wang Y.L., Zhao F.Q., Ji Y.P. et al. // J. Anal. Appl. Pyrol. 2012. V. 98. P. 231.
Yehya F., Chaudhary A.K. // Appl. Phys. B. 2013. V. 110. № 1. P. 15.
Bragin A., Pivkina A., Muravyev N. et al. // Phys. Procedea. 2015. V. 72. P. 358.
Дубихин В.В., Назин Г.М., Прокудин В.Г. и др. // Изв. РАН. Сер. хим. 2015. № 1. С. 126.
Дубихин В.В., Назин Г.М., Прокудин В.Г., Далингер И.Л., Шевелев С.А. // Хим. физика. 2015. Т. 34. № 3. С. 28.
Muravyev N.V., Bragin A.A., Monogarov K.A. et al. // Propel. Expl. Pyrotech. 2016. V. 41. № 6. P. 999.
Sinditskii V.P., Smirnov S.P., Egorshev V.Yu. et al. // Thermochim. Acta. 2017. V. 651. P. 83.
Sinditskii V.P., Hoang T.H., Smirnova A.D. et al. // Ibid. 2018. V. 667. P. 1.
Gorn M.V., Monogarov K.A., Dalinger I.L. et al. // Ibid. 2020. V. 690. P. 178697.
Sinditskii V.P., Smirnova A.D., Serushkin V.V. et al. // Ibid. 2021. V. 698. P. 178876.
Захаров В.В., Чуканов Н.В., Зюзин И.Н., Неделько В.В., Корсунский Б.Л. // Хим. физика. 2019. Т. 38. № 2. С. 3;https://doi.org/10.1134/S0207401X19020146
Корсунский Б.Л., Захаров В.В., Ларикова Т.С. и др. // Хим. физика. 2022. Т. 41. № 7. С. 32;https://doi.org/10.31857/S0207401X22070081
Гальперин Л.Н., Колесов Ю.Р., Зеленов Н.А. // Измер. техника. 1981. № 4. С. 23.
Неделько В.В., Корсунский Б.Л., Ларикова Т.С. и др. // Хим. физика. 2011. Т. 38. № 2. С. 3.
Неделько В.В., Чуканов Н.В., Корсунский Б.Л. и др. // Хим. физика. 2018. Т. 37. № 11. С. 36;https://doi.org/10.1134/S0207401X18110092
Vyazovkin S. Isoconversional Kinetics of Thermally Stimulated Processes. Heidelberg: Springer, 2015.
Манелис Г.Б., Назин Г.М., Рубцов Ю.И., Струнин В.А. Термическое разложение и горение взрывчатых веществ и порохов. М.: Наука, 1996.
Зюзин И.Н. // ЖПХ. 2009. Т. 82. С. 1677.
Грачев В.П., Зюзин И.Н., Курмаз С.В. и др. // Изв. РАН. Сер. хим. 2020. № 12. С. 2312.
Дополнительные материалы отсутствуют.
Инструменты
Химическая физика