Химическая физика, 2022, T. 41, № 3, стр. 29-40
Конверсия низкокалорийных топлив в синтез-газ в режиме фильтрационного горения в подвижном слое гранулированного теплоносителя
С. О. Дорофеенко 1, *, Е. В. Полианчик 1
1 Институт проблем химической физики Российской академии наук
Черноголовка, Россия
* E-mail: dorofeenko@icp.ac.ru
Поступила в редакцию 25.05.2021
После доработки 27.09.2021
Принята к публикации 20.10.2021
- EDN: FBSTKE
- DOI: 10.31857/S0207401X22030049
Аннотация
Теоретически исследована возможность конверсии низкокалорийных горючих в синтез-газ посредством их парциального окисления в подвижном пористом слое гранулированного теплоносителя. Рассматривается процесс в новой версии реактора с противотоком твердого гранулированного теплоносителя и реагирующих газов. Особенностью реактора является наличие дополнительного теплообменника, где производится предварительный нагрев газа-окислителя за счет остаточного тепла твердого теплоносителя, выгруженного из реактора. Теоретически, в приближении отсутствия теплопотерь и установившегося термодинамического равновесия в продуктах, рассмотрены макрокинетические режимы процесса в зависимости от основных управляющих параметров: расхода газа-окислителя, расхода пара, расхода твердого теплоносителя, состава топлива. Проведен количественный расчет температуры и состава продуктов в различных режимах горения при воздушно-паровой конверсии изопропанола и воздушной конверсии низкокалорийного пиролизного газа. Показано, что рассматриваемая схема позволяет проводить конверсию низкокалорийного газа при температуре выше 1500 К с химическим КПД газификации выше 90%.
ВВЕДЕНИЕ
Конверсия различных углеводородных топлив в синтез-газ – смесь водорода и оксида углерода – составляет основу работы ряда крупнотоннажных химических производств, включая получение синтетического жидкого топлива по реакции Фишера–Тропша, синтеза метанола, многоатомных спиртов, диметилового эфира и др. Получение синтез-газа является важной стадией при производстве аммиака, а также наиболее широко используемой сегодня технологией производства водорода методом парового риформинга. Основными сырьевыми источниками, используемыми для получения синтез-газа, служат уголь, который газифицируют, а также углеводородные газы, прежде всего, природный газ. Наряду с производством синтез-газа для целей химического синтеза не менее актуальной задачей является превращение в синтез-газ разного рода низкокалорийных газов, в том числе пиролизных газов, что существенно расширяет возможности их использования как для химических синтезов [1] (в том числе биохимических [2]), так и в качестве моторных топлив [3, 4].
Важным направлением процесса конверсии углеводородов в синтез-газ является окислительная конверсия при парциальном окислении [5–7]. Конверсия различных низкокалорийных пиролизных и генераторных газов, содержащих пиролизные смолы, в синтез-газ посредством парциального окисления исследовалась экспериментально и рассматривалась теоретически в работах [8–11]. Проведенное в работах [10, 11] рассмотрение показывает, что парциальное окисление низкокалорийных газов сопряжено с высокими теплопотерями в виде уноса тепла с горячими продуктами. Ранее нами было показано, что конверсия в синтез-газ углеводородных газов и легкокипящих жидкостей может быть успешно реализована при их парциальном окислении в режиме фильтрационного горения в реакторе с обращаемым потоком либо в подвижном слое пористого инертного материала [12, 13]. Осуществление процесса в слое пористого твердого теплоносителя позволяет в значительной мере обеспечить рекуперацию тепла газообразных продуктов. В настоящей работе мы развиваем предложенный ранее [12, 13] подход к получению синтез-газа.
Базовая идея, лежащая в основе развиваемого в работах [12, 13] подхода, – использование твердого химически инертного пористого материала в качестве теплоносителя, который отбирает физическое тепло у продуктов химической реакции (синтез-газа) и позволяет использовать его для подогрева исходных реагентов до того, как они вступят в реакцию. Такой подход обеспечивает возможность проведения парциального окисления при малом относительном потреблении кислорода (а значит, при малом тепловом брутто-эффекте процесса), при том что в ходе процесса обеспечивается достижение высокой температуры (что позволяет достичь высокой скорости химического превращения и требуемого состава конечных продуктов – синтез-газа с преобладанием в составе оксида углерода и водорода). Другая важная особенность используемого подхода – проведение процесса с заранее неперемешанными реагентами, что позволяет провести его с предварительным подогревом реагентов до того, как они вступят в реакцию. Это позволяет достичь более высокой температуры, чем температура реакции, которую “выбирает” смесь заранее перемешанных реагентов [14].
Проведенное в работах [12, 13] рассмотрение показывает, что использование противотока твердого теплоносителя позволяет осуществить предварительный подогрев воздуха за счет теплообмена с твердым теплоносителем и таким образом существенно повысить энергетический КПД процесса по сравнению с парциальным окислением без рекуперации тепла. Вместе с тем для конверсии низкокалорийных топлив общая энергетическая эффективность процесса, согласно [12, 13], оказывается недостаточной. Даже в оптимальном режиме конверсии брутто-тепловыделение в процессе должно обеспечить нагрев топлива до температуры горения (при том что топливо низкокалорийное, т.е. несет большую балластную массу на каждый кДж теплоты сгорания).
В работе [15] было предложено техническое решение, позволяющее повысить эффективность рекуперации тепла при конверсии низкокалорийных топлив, основанное на общем подходе [12, 13] и дополняющее его. В настоящей работе мы рассматриваем вычислительную модель, позволяющую проводить оптимизацию режимов конверсии низкокалорийных топлив по схеме, предложенной в работе [15], и оценить пределы достижимой энергетической эффективности. В работе [16] рассмотрены зависимости характеристик этого процесса при конверсии метана и биогаза от управляющих параметров.
ОПИСАНИЕ ПРОЦЕССА И МОДЕЛИ
Основной задачей нашей работы является исследование конверсии в синтез-газ низкокалорийных топлив, в том числе газов и жидкостей. Химическая схема конверсии топлива в синтез-газ, содержащий оксид углерода, водород и, возможно, другие продукты, при его парциальном окислении, возможно, в присутствии водяного пара и диоксида углерода описывается реакцией
(1)
$\begin{gathered} (f{\text{C}}{{{\text{H}}}_{y}}{{{\text{O}}}_{z}} + {{w}_{f}}{{{\text{H}}}_{{\text{2}}}}{\text{O}} + {{n}_{f}}{{{\text{N}}}_{2}}) + \\ + \,\,(x{{{\text{O}}}_{2}} + {{w}_{x}}{{{\text{H}}}_{{\text{2}}}}{\text{O}} + {{n}_{x}}{{{\text{N}}}_{2}}) \to \\ \to m{\text{CO}} + h{{{\text{H}}}_{2}} + d{\text{C}}{{{\text{O}}}_{2}} + w{{{\text{H}}}_{{\text{2}}}}{\text{O}} + n{{{\text{N}}}_{2}} + ..., \\ \end{gathered} $При конверсии, как правило, требуется максимальный выход водорода и монооксида углерода. Очевидно, что чем ниже расход окислителя (кислорода, воздуха) в процессе, тем выше его тепловая эффективность и выход целевых продуктов. Также очевидно, что чем выше температура, достигаемая в ходе процесса, тем более полным будет превращение горючего в целевые продукты.
Напомним суть предложенного в работе [15] метода на примере воздушно-паровой конверсии в синтез-газ жидкого топлива (изопропанола). Процесс конверсии изопропанола в реакторе с подогревом воздушно-паровой смеси в противотоке твердого теплоносителя ранее рассматривался в работе [13]. Сравнение результатов, полученных в [13] и в настоящей работе позволяет оценить выигрыш от предварительного нагрева обоих реагентов, реализуемого в схеме процесса, описанного в работе [15].
Окислительно-паровую конверсию в сверхадиабатическом режиме фильтрационного горения газов реализуют в непрерывном процессе, используя реактор с подвижным слоем твердого теплоносителя, схематически представленный на рис. 1. Реактор снабжен затворными шлюзами в его верхней и нижней частях, поток пористой среды (сыпучего гранулированного твердого теплоносителя) может подаваться с заданным постоянным расходом. Топливо, газообразное или легкокипящая жидкость, подается в нижнюю часть реактора, где жидкость испаряется, и ее пары фильтруются противотоком сквозь засыпку гранулированного теплоносителя. Пары жидкости (горючий газ) при теплообмене с твердым теплоносителем нагреваются, а теплоноситель, соответственно, остывает [13]. Усовершенствование, предложенное в [15], реализует предварительный подогрев газа-окислителя благодаря тому, что твердый теплоноситель из реактора выгружается в дополнительный теплообменник, в который также противотоком к теплоносителю подается газ-окислитель. Таким образом, газ-окислитель нагревается за счет остаточного тепла твердого теплоносителя.
Рис. 1.
Реактор с раздельным вводом и предварительным подогревом обоих реагентов (адаптированный вариант схемы из [15]).
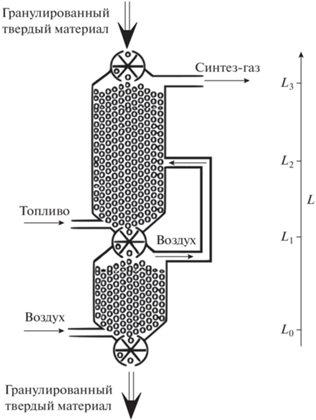
Подогретый газ-окислитель из теплообменника поступает в среднюю часть реактора. Здесь топливо, также нагретое за счет теплообмена с гранулированным материалом, смешивается с газообразным окислителем, и горит при высокой температуре. Полагаем, что длина зоны смешения реагентов и реакции достаточно мала в осевом направлении реактора по сравнению с высотой пористого слоя (этого всегда возможно достичь, увеличив общую высоту реактора). Полагаем, что поданное топливо и газ-окислитель равномерно распределены по поперечному сечению на длине реакционной зоны. Это может быть достигнуто за счет подачи газа в среднюю часть реактора через множество фурм. Наша задача – найти условия протекания высокотемпературного процесса конверсии: при высокой температуре внутри зоны горения можно ожидать быстрого протекания химических реакций, которые достигают химического равновесия. При этом рассматриваем стационарный установившийся режим при постоянном заданном расходе и составе реагентов.
Топливо подается в нижнюю часть реактора с мольным расходом f при начальной температуре Tf. Помимо горючих составляющих топливо может содержать водяной пар и азот с мольными расходами wf и nf соответственно. Жидкое топливо испаряется, и пары фильтруются сквозь пористую матрицу – слой твердого теплоносителя, который ранее был нагрет в зоне горения до высокой температуры Tc. Благодаря межфазному теплообмену твердый теплоноситель в нижней части реактора остывает, а газ (пары топлива) нагревается. Предварительно нагретое топливо достигает центра реактора, куда подается в недостатке по отношению к топливу предварительно нагретый до температуры T1 воздух. Здесь, в реакционной зоне, кислород реагирует с топливом и образуются продукты (синтез-газ).
Как сказано выше, мы полагаем зону реакции достаточно короткой по сравнению с общей длиной реактора. Продукты реакции – водород, моно- и диоксид углерода, воду, азот и, возможно (но нежелательно), некоторые второстепенные продукты выходят из реакционной зоны и далее фильтруются в верхней части реактора сквозь слой гранулированного теплоносителя, отдавая ему физическое тепло и обеспечивая его нагрев. Из реактора синтез-газ выходит при относительно низкой температуре, в основном отдав свое физическое тепло твердому теплоносителю.
Предположим далее, что реактор достаточно теплоизолирован, чтобы пренебречь потерями тепла через его стенки. Наконец, поскольку мы ищем условия реакции при высоких температурах, подобно рассмотрению, представленному в работе [17], полагаем, что в протяженной горячей зоне, через которую протекает синтез-газ в верхней части реактора, происходит установление термодинамически равновесного состава продуктов. Вышеприведенные допущения дают основу для описания зависимости характеристик процесса от параметров управления.
Рассмотрим, каким образом можно оптимизировать режим конверсии топлива в реакторе, представленном на рис. 1. Целью является нахождение такого соотношения управляющих параметров, а именно расходов топлива, газа-окислителя, пара и твердого теплоносителя, при котором достигаются наибольший выход целевых продуктов, наименьшие энергозатраты и максимальная удельная производительность реактора.
Предположим, что в равновесии синтез-газ не содержит других компонентов, кроме водорода, воды, моно- и диоксида углерода, а также азота. Обоснованность этого предположения для синтез-газа, находящегося при высокой температуре, подтверждается термодинамическими расчетами, проведенными ранее в работах [12, 17].
В левой части уравнения (1) стехиометрические коэффициенты являются задаваемыми параметрами управления, а в правой – не являются заранее известными, поскольку они должны быть самосогласованы с установившейся температурой горения Tc, которая также является искомой величиной. Поэтому наша задача – определить при сделанных выше предположениях зависимости Tc и состава синтез-газа (т.е. стехиометрические коэффициенты m, d, h, w, n) от состава и расхода реагентов, подаваемых в реактор (f, y, z, wf, nf и x, wx, nx). Отметим, что стехиометрические коэффициенты в реакции (1) пропорциональны мольным расходам соответствующих реагентов и продуктов на входе в реактор и выходе из него.
В зоне горения соблюдаются следующие условия сохранения соответственно для углерода, водорода, кислорода и азота:
Система уравнений (2)–(5) дополняется условием термодинамического равновесия в продуктах реакции при температуре Tc:
где k(T) – константа равновесия, которая является известной функцией температуры и может быть выражена через константы диссоциации (Ki) соответствующих газов [12] как(7)
$k\left( T \right) = {{{{K}_{m}}\left( T \right){{K}_{w}}\left( T \right)} \mathord{\left/ {\vphantom {{{{K}_{m}}\left( T \right){{K}_{w}}\left( T \right)} {{{K}_{d}}\left( T \right){{K}_{h}}\left( T \right)}}} \right. \kern-0em} {{{K}_{d}}\left( T \right){{K}_{h}}\left( T \right)}}.$Система уравнений (2)–(6) однородна по стехиометрическим коэффициентам. Поскольку мы полагаем, что в высокотемпературной зоне устанавливается термодинамическое равновесие, важны не абсолютные значения расхода реагентов, а их отношения. Поэтому, не ограничивая общности, можем полагать f = 1 и рассматривать все расходы реагентов и продуктов относительно мольного расхода топливного углерода. Это естественный выбор, поскольку мы рассматриваем именно конверсию топлива.
Еще одно уравнение, замыкающее систему уравнений (2)–(6) с шестью неизвестными: Tc, m, d, h, w, n, следует из сохранения энергии. Это условие принимает вид равенства суммы энтальпий реагентов (в том числе твердого теплоносителя), поступающих в зону горения, и полной энтальпии покидающих эту зону продуктов (синтез-газа и теплоносителя). Как показано в работе [13], уравнение принимает различный вид в зависимости от соотношения теплоемкости потока газа, поступающего из нижней части реактора (в случае, рассмотренном в [13], – газа-окислителя, в рассматриваемом нами процессе – топливного газа), и расхода гранулированного твердого теплоносителя, p.
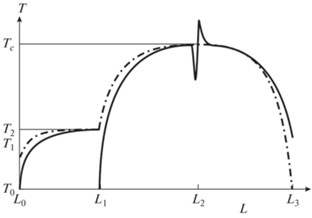
Режим A (режим холодного теплоносителя). Режим A устанавливается, когда в нижней части реактора теплоемкость потока гранулированного твердого теплоносителя ниже, чем теплоемкость потока топлива (газового потока и паров). При этом топливо, поступающее в зону горения, полностью отнимает физическое тепло, запасенное в инертном материале, и последний выгружается из реактора холодным (при начальной температуре газа). Зона межфазного теплообмена (нагревания топлива и охлаждения теплоносителя) примыкает к зоне реакции. Качественная картина распределения температуры по высоте теплообменника и реактора представлена на рис. 2.
Рис. 2.
Качественная картина распределения в режиме A температуры газа (сплошная линия) и твердого теплоносителя (штрих-пунктирная) вдоль оси теплообменника (L0–L1) и реактора (L1–L3).
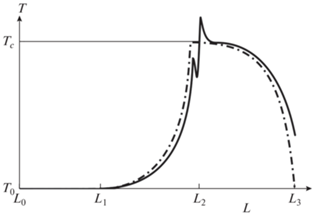
Поскольку теплоемкость потока топлива выше чем теплоемкость потока твердого теплоносителя, все физическое тепло, выносимое теплоносителем из зоны горения, в нижней части реактора передается потоку топлива. Топливо нагревается при теплообмене с твердым теплоносителем в зоне, непосредственно примыкающей к зоне горения. В теплообменнике теплоноситель уже не может передать тепло окислителю, поэтому последний поступает в зону горения при начальной температуре, как и в случае отсутствия теплообменника [13]. В центре реактора (точка L2) газ несколько охлаждается за счет смешения с холодным газом-окислителем, а затем смесь воспламеняется и топливо реагирует с кислородом с выделением тепла. Поток газообразных продуктов пребывает в протяженной высокотемпературной зоне (L2–L3), где есть условия для установления термодинамического равновесия (высокая температура и длительное время пребывания). В верхней части реактора (точка L3), куда загружается холодный теплоноситель, который нагревается до установившейся температуры горения при теплообмене с потоком синтез-газа, имеющим бóльшую теплоемкость, чем теплоемкость потока теплоносителя. Далее для простоты полагаем, что топливо, газ-окислитель и твердый теплоноситель поступают в реактор при одной и той же температуре T0.
Уравнение сохранения энергии в режиме A принимает вид
(8)
$\begin{gathered} ({{w}_{x}} + {{w}_{f}})[{{H}_{w}}({{T}_{с}}) - {{H}_{w}}({{T}_{0}})) + \\ + \,\,x({{H}_{x}}({{T}_{с}}) - {{H}_{x}}({{T}_{0}})] + ({{n}_{x}} + {{n}_{f}})[{{H}_{n}}({{T}_{с}}) - \\ - \,\,{{H}_{n}}({{T}_{0}})] + [{{H}_{f}}({{T}_{с}}) - {{H}_{f}}({{T}_{0}})] - \\ - \,\,p[{{H}_{p}}({{T}_{с}}) - {{H}_{p}}({{T}_{0}})] = \\ = ({{w}_{x}} + {{w}_{f}} - w){{H}_{w}}({{T}_{с}}) + {{H}_{f}}({{T}_{с}}) + \\ + \,\,x{{H}_{x}}({{T}_{с}}) - [h{{H}_{h}}({{T}_{с}}) + m{{H}_{m}}({{T}_{с}}) + d{{H}_{d}}({{T}_{с}})]. \\ \end{gathered} $Полное изменение энтальпии в реакции (1) при температуре Tс (правая часть (8)) равно количеству тепла, необходимому для того, чтобы нагреть все реагенты от их начальной температуры до температуры горения Tс за вычетом физического тепла, переданного реагентам при охлаждении твердого теплоносителя от Tс до T0.
Уже упоминалось, что расход гранулированного твердого теплоносителя, р, является независимо изменяемым параметром регулирования. В режиме А увеличение расхода гранулированного твердого теплоносителя приводит к лучшей рекуперации тепла и, следовательно, к более высокой температуре горения (см. уравнение (8)). Однако эта лучшая рекуперация тепла происходит только до тех пор, пока выполнено условие, что теплоемкость потока топлива выше, чем у потока твердого теплоносителя:
(9)
$\begin{gathered} \text{[}{{H}_{f}}({{T}_{c}}) - {{H}_{f}}({{T}_{0}})] + {{w}_{f}}[{{H}_{w}}({{T}_{c}}) - {{H}_{w}}({{T}_{0}})] + \\ + \,\,{{n}_{f}}[{{H}_{n}}({{T}_{c}}) - {{H}_{n}}({{T}_{0}})] \geqslant p[{{H}_{p}}({{T}_{c}}) - {{H}_{p}}({{T}_{0}})]. \\ \end{gathered} $При увеличении p неравенство (9) нарушается, распределение температуры в реакторе качественно перестраивается и реализуется режим B.
Режим B (промежуточный). Режим B устанавливается при расходе твердого теплоносителя, когда его теплоемкость превышает теплоемкость потока топлива, но остается меньше теплоемкости синтез-газа. Последняя всегда выше, поскольку в состав синтез-газа входит не только топливо, но также и газ-окислитель (в химически преобразованном состоянии). Реализуется режим, где теплоемкость потока топливного газа ниже, но теплоемкость потока синтез-газа превышает теплоемкость потока гранулированного твердого теплоносителя. В этом промежуточном режиме реакционная зона находится между двумя зонами теплообмена. При этом поток теплоносителя выходит из зоны горения, сохраняя температуру горения. Качественная картина распределения температуры для режима B представлена на рис. 3. Зона теплообмена, в которой нагревается топливо, смещается на дно реактора, и, поскольку теплоемкость топлива ниже, при нагреве топлива до температуры горения все физическое тепло горячего теплоносителя не поглощается, и последний выгружается из реактора в теплообменник “теплым” при температуре T2 > T0:
(10)
$\begin{gathered} \text{[}{{H}_{f}}({{T}_{c}}) - {{H}_{f}}({{T}_{0}})] + {{w}_{f}}[{{H}_{w}}({{T}_{c}}) - {{H}_{w}}({{T}_{0}})] + \\ + \,\,{{n}_{f}}[{{H}_{n}}({{T}_{c}}) - {{H}_{n}}({{T}_{0}})] = p[{{H}_{p}}({{T}_{c}}) - {{H}_{p}}({{T}_{2}})]. \\ \end{gathered} $Газ-окислитель подается в теплообменник (L0–L1), где благодаря теплообмену с твердым теплоносителем, поток которого имеет теплоемкость выше, чем поток газа-окислителя, нагревается до температуры T1 = T2 и при этой температуре поступает в среднюю часть реактора (L2), где реагирует с топливом. Так же как и в режиме A, синтез-газ длительно пребывает в высокотемпературной зоне (L2–L3) и охлаждается в верхней части реактора при теплообмене со свежезагруженным холодным теплоносителем.
В режиме B уравнение сохранения энергии принимает вид
(11)
$\begin{gathered} x[{{H}_{x}}({{T}_{с}}) - {{H}_{x}}({{T}_{1}})] + {{w}_{x}}[{{H}_{w}}({{T}_{с}}) - \\ - \,\,{{H}_{w}}({{T}_{1}})] + {{n}_{x}}[{{H}_{n}}({{T}_{с}}) - {{H}_{n}}({{T}_{1}})] = \\ = ({{w}_{x}} + {{w}_{f}} - w){{H}_{w}}({{T}_{с}}) + {{H}_{f}}({{T}_{с}}) + \\ + \,\,x{{H}_{x}}({{T}_{с}}) - h{{H}_{h}}({{T}_{с}}) - m{{H}_{m}}({{T}_{с}}) - d{{H}_{d}}({{T}_{с}}), \\ \end{gathered} $т.е. тепловой эффект реакции при температуре Tс равен количеству тепла, необходимого для нагревания окислителя от температуры T1 до Tс. Параметрическая область промежуточного режима B – расход гранулированного твердого теплоносителя в диапазоне между средней в интервале T1–Tс теплоемкостью горючего и теплоемкостью синтез-газа:
(12)
$\begin{gathered} \text{[}{{H}_{f}}({{T}_{c}}) - {{H}_{f}}({{T}_{0}})] + {{w}_{f}}[{{H}_{w}}({{T}_{c}}) - {{H}_{w}}({{T}_{0}})] + \\ + \,\,{{n}_{f}}[{{H}_{n}}({{T}_{c}}) - {{H}_{n}}({{T}_{0}})] \leqslant p[{{H}_{p}}({{T}_{c}}) - {{H}_{p}}({{T}_{0}})] \leqslant \\ \leqslant w[{{H}_{w}}({{T}_{c}}) - {{H}_{w}}({{T}_{0}})] + m[{{H}_{m}}({{T}_{c}}) - {{H}_{m}}({{T}_{0}})] + \\ + \,\,d[{{H}_{d}}({{T}_{c}}) - {{H}_{d}}({{T}_{0}})] + h[{{H}_{h}}({{T}_{c}}) - {{H}_{h}}({{T}_{0}})] + \\ + \,\,n[{{H}_{n}}({{T}_{c}}) - {{H}_{n}}({{T}_{0}})]. \\ \end{gathered} $Расход азота в топливном газе выпадает из управляющих уравнений, но он присутствует в описании режима B, поскольку входит в соотношения (12), устанавливающие для него пределы. Как и в [13], в режиме В расход твердого теплоносителя не входит явно в уравнение (11), однако, в отличие от рассматриваемого случая, зависимость от расхода теплоносителя есть, поскольку от него зависит температура T1 = T2 (см. уравнение (10)). При увеличении расхода теплоносителя выше верхнего предела, определяемого условием (12), теплоемкость потока теплоносителя превышает теплоемкость синтез-газа и реализуется режим C [13].
Режим С (режим холодного синтез-газа). Этот режим характеризуется тем, что теплоемкость потока твердого теплоносителя выше теплоемкости синтез-газа, а следовательно, еще сильнее превышает теплоемкость топлива. Последнее нагревается до температуры горения от горячего теплоносителя, который поступает из зоны горения. Синтез-газ, вытекающий из зоны горения, отдает все свое физическое тепло твердому теплоносителю.
В режиме С температура горения уменьшается с увеличением расхода твердого теплоносителя. Кроме того, предположение о равновесном составе синтез-газа, самосогласованном с температурой горения, не может быть полностью оправдано, поскольку, в отличие от режимов А и В, где синтез-газ длительное время пребывает в протяженной зоне над горячим твердым материалом, в режиме С к реакционной зоне примыкает зона охлаждения газа, где состав газа “замораживается”. Мы не рассматриваем режим С подробно. Он не выглядит практичным для конверсии топлива в синтез-газ, поскольку не имеет смысла обеспечивать чрезмерный расход твердого теплоносителя, чтобы получить режим с более низкой эффективностью. Поэтому мы учитываем наличие режима C лишь для определения параметрической границы режима B.
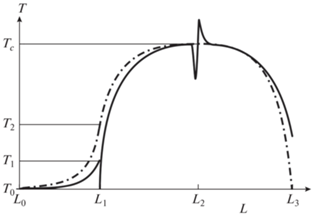
Режим A1 (режим холодного теплоносителя). Рассматривая выше режим B, мы неявно сделали допущение, которое не всегда справедливо, а именно, что если теплоемкость потока твердого теплоносителя больше теплоемкости потока топлива, то она превышает и теплоемкость газа-окислителя. Однако возможен режим, в котором это условие не соблюдено – когда теплоемкость потока газа-окислителя выше теплоемкости топливного газа, но при этом теплоемкость потока твердого теплоносителя имеет промежуточное значение между ними. В этом случае реализуется режим, схематически представленный на рис. 4.
Распределение температур в реакторе подобно режиму B – топливо нагревается в зоне теплообмена в нижней части реактора (L1) до температуры Tc, а твердый теплоноситель остывает до температуры T2, определяемой уравнением (11). Так же как и в режиме B, в верхней части реактора (L2–L3) реализуется высокотемпературная зона, где устанавливается равновесие состава продуктов при высокой температуре. Однако в теплообменнике (L0–L1), где теплоемкость потока газа-окислителя выше теплоемкости потока твердого теплоносителя, последний остывает до температуры T0, передавая все свое физическое тепло газу-окислителю, который, в свою очередь, нагревается до температуры T1 < T2:
(13)
$\begin{gathered} x[{{H}_{x}}({{T}_{1}}) - {{H}_{x}}({{T}_{0}})] + {{w}_{x}}[{{H}_{w}}({{T}_{1}}) - {{H}_{w}}({{T}_{0}})] + \\ + \,\,{{n}_{x}}[{{H}_{n}}({{T}_{1}}) - {{H}_{n}}({{T}_{0}})] = p[{{H}_{p}}({{T}_{2}}) - {{H}_{p}}({{T}_{0}})]. \\ \end{gathered} $Подставляя в уравнение (11) соотношения (10) и (13), получим уже знакомое уравнение (8), т.е. в режиме A1 зависимость режима горения от расхода реагентов имеет тот же вид, что и в режиме A.
Решение задачи определения параметрических границ области, перспективной для конверсии топлива в синтез-газ, ищем, решая обратную задачу, т.е. строя изотермы в пространстве управляющих параметров [13]. Задаем искомое значение температуры в диапазоне 1100 < Tc < 2100 К. Верхний предел определяется ограничением рабочей температуры конструкции реактора и термостойкостью твердого теплоносителя, а нижний предел – минимальной температурой, при которой еще можно ожидать установления в реакторе термодинамически равновесного состава за практически реализуемое время пребывания газа в реакторе.
Для режимов A и A1 при заданной температуре Tc система уравнений (2)–(6) и (8) является конечным соотношением, которое может быть разрешено в виде p = p(x, wx, nx, Tc), если известны входящие в эти уравнения энтальпии соответствующих компонентов как функции температуры и константа равновесия (7). Получаемое решение необходимо проверять на самосогласованность, а именно, во-первых, на то, что полученное для конкретного набора значений (x, wx, nx, Tc) значение расхода твердого теплоносителя p неотрицательно и для режима A удовлетворяет условию (9); во-вторых, что полученные при решении значения d, w, n, h удовлетворяют условию отсутствия сажи (твердой фазы углерода) в равновесии при Tc. Последнее условие имеет вид [11]
(14)
$\begin{gathered} {{K}_{c}}({{T}_{c}}) > [{\text{C}}] = \\ = {{P\left[ {{{K_{m}^{2}({{T}_{c}})} \mathord{\left/ {\vphantom {{K_{m}^{2}({{T}_{c}})} {{{K}_{d}}({{T}_{c}})}}} \right. \kern-0em} {{{K}_{d}}({{T}_{c}})}}} \right]{{m}^{2}}} \mathord{\left/ {\vphantom {{P\left[ {{{K_{m}^{2}({{T}_{c}})} \mathord{\left/ {\vphantom {{K_{m}^{2}({{T}_{c}})} {{{K}_{d}}({{T}_{c}})}}} \right. \kern-0em} {{{K}_{d}}({{T}_{c}})}}} \right]{{m}^{2}}} {[d(h + d + m + w + n)]}}} \right. \kern-0em} {[d(h + d + m + w + n)]}}, \\ \end{gathered} $Аналогично для режима B, задавая значение температуры Tc и подставляя его в систему уравнений (2)–(6) и (10), (11) с T1 = T2 и известными значениями энтальпии соответствующих компонентов как функции температуры и константой равновесия (7), разрешаем это соотношение в виде p = p(x, wx, nx, Tc). Как и в режиме A, получаемое решение необходимо проверять на самосогласованность. Проверяется выражение (14), определяющее условие отсутствия сажи. Также проверяется, что значение p не попадает в режим A1, т.е. выполнено условие T1 = T2. Процедура вычисления и отбора решений детально описана в работе [16].
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
В качестве примера будем рассматривать паровоздушную конверсию 2-пропанола (y = 8/3, z = = 1/3), которую в работе [13] рассматривали для реактора без теплообменника. Результаты расчетов, приводимые ниже, показывают, какой выигрыш в эффективности предоставляет использование схемы процесса, предложенной в [15] (рис. 1), по сравнению с реактором без теплообменника, рассмотренным в [13].
Мольные энтальпии и константы диссоциации для m, d, h, w, входящие в расчетные формулы – известные табулированные функции. В расчетах нами использовались значения, приведенные в справочнике [18]; значения Kc(T) и энтальпии оксида алюминия, которое принималось для твердого теплоносителя, брались из базы данных GRI-Mech [19]. Расчет проводился для атмосферного давления (P = 0.1 МПа).
Кроме перечисленных величин в расчетные формулы входит энтальпия изопропанола (на один атом углерода). При начальной температуре T0 = 298.15 К использовали значение Hf(T0) = $ = \left( {1{\text{/}}3} \right)\Delta H_{{liquid}}^{^\circ }$ = –106.1 кДж/моль [20]. Значение энтальпии изопропанола при температуре горения нам неизвестно1)1). Можем приблизительно оценить это значение как
(15)
$\begin{gathered} {{H}_{f}}(T) = {{H}_{f}}({{T}_{0}}) + {{H}_{d}}(T) - {{H}_{d}}({{T}_{0}}) + \\ + \,\,({4 \mathord{\left/ {\vphantom {4 3}} \right. \kern-0em} 3})[{{H}_{w}}(T) - {{H}_{w}}({{T}_{0}})] - \left( {{3 \mathord{\left/ {\vphantom {3 2}} \right. \kern-0em} 2}} \right)[{{H}_{x}}(T) - {{H}_{x}}({{T}_{0}})], \\ \end{gathered} $Результаты расчета для двух фиксированных значений расхода пара при воздушной и паровоздушной конверсии изопропанола представлены на рис. 5 и 6. На рис. 5 представлены изотермы в плоскости x–p в двух сечениях wx = const пространства основных управляющих параметров (p, x, wx). Процедура вычисления изотерм p = p(x, wx, nx, Tc) подразумевает и вычисление в каждой точке стехиометрических коэффициентов m, d, h, w, и, таким образом, мы получаем поле значений этих коэффициентов. На рис. 5 также представлены изолинии постоянного отношения концентрации водорода к концентрации оксида углерода (важная характеристика синтез-газа) и изолинии химического КПД конверсии, вычисленного как отношение низшей теплоты сгорания синтез-газа к низшей теплоте сгорания изопропанола. Для удобства ось x дополнена шкалой стехиометрического отношения по кислороду, а ось p (моль Al2O3 на моль углерода) – шкалой “г теплоносителя/г изопропанола”.
Рис. 5.
Расчетные изотермы воздушно-паровой конверсии изопропанола в плоскости x–p; nx = (79/21)x; wx = 0 (a) и 1.5 (б). Сплошные линии – изотермы, штриховые – изолинии химического КПД, штрих-пунктирные – изолинии отношения h/m в синтез-газе. Темными звездочками на изотермах помечены точки перехода из режима A в режим A1, светлыми – точки перехода из режима A1 в режим B; штриховая линия, ограничивающая диаграмму сверху – переход из режима B в режим C. Точечная линия на рис. 5а ограничивает область равновесного сажеобразования.
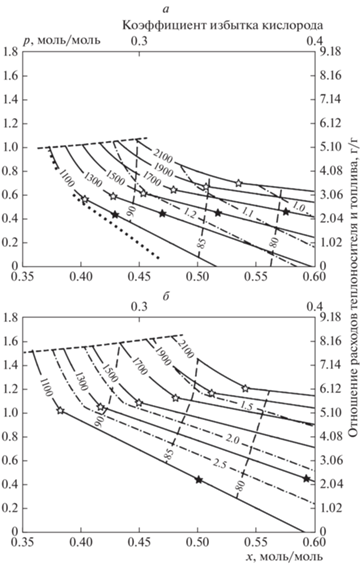
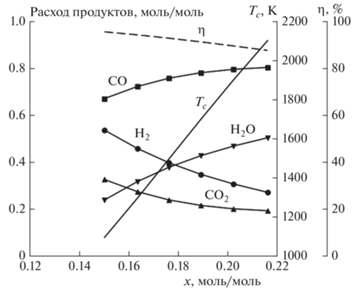
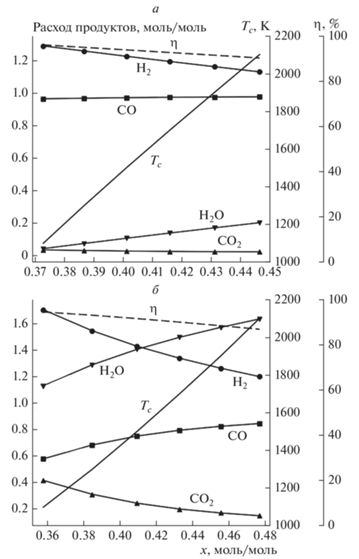
Рис. 6.
Расчетные зависимости выхода продуктов h, m, d, w, температуры горения Tc и химического КПД η от расхода кислорода x вдоль линии перехода из режима B в режим C при воздушно-паровой конверсии изопропанола; nx = = 79/21x; wx = 0 (a), 1.5 (б).
Как показывают приведенные результаты расчетов, в благоприятной для конверсии изопропанола параметрической области теплоемкость изопропанола меньше, чем теплоемкость воздуха, и тем более паровоздушной смеси. Как следствие, при малом расходе инертного теплоносителя реализуется режим A. По мере роста p при фиксированном расходе кислорода растет температура горения. Температура горения при фиксированном расходе теплоносителя закономерно растет с увеличением расхода воздуха относительно расхода изопропанола. При повышении расхода теплоносителя вдоль изотермы (при одновременном снижении x) режим A сменяется режимом A1, затем режим A1 сменяется режимом B, пока, наконец, теплоемкость потока теплоносителя не сравняется с теплоемкостью потока синтез-газа, что говорит о переходе в нежелательный режим C. При этом в режиме B вдоль изотермы с ростом расхода теплоносителя уменьшается относительный расход воздуха, что означает уменьшение теплового брутто-эффекта (т.е. теплозатрат на конверсию) благодаря большей рекуперации тепла синтез-газа на твердом теплоносителе, в отличие от схемы, рассматриваемой в [13], где для режима B отсутствует зависимость от расхода твердого теплоносителя. Наибольший КПД конверсии достигается при расходе теплоносителя, близком к значению, соответствующему переходу в режим C.
На рис. 6 представлены расчетные зависимости выхода продуктов h, m, d, w, температуры горения Tc и химического КПД η от расхода кислорода x вдоль линии перехода из режима B в режим C для двух значений wx, представленных соответственно на рис. 5а и б. Сравнение диаграмм при различных расходах пара в составе газа-окислителя (паровоздушной смеси) показывает, что увеличение расхода пара очень мало меняет положение изотерм относительно расхода воздуха, если расход теплоносителя увеличивается так, чтобы скомпенсировать теплоемкость пара. С ростом расхода пара увеличивается параметрический диапазон для режима A1, а переход в режим C смещается к бóльшим расходам теплоносителя. Вместе с тем увеличение расхода пара позволяет заметно изменить соотношение водород/оксид углерода в синтез-газе, что немаловажно, если получаемый синтез-газ предназначен для химического синтеза.
Далее рассмотрим паровоздушную конверсию генераторного газа следующего состава (по сухому газу): 17.5% CO2, 17.5% CO, 3.1% H2, 61.9% N2, дополнительно содержащего 210 г/м3 водяного пара и 500 г/м3 пиролизных смол брутто-состава CH1.48O0.58. Указанный газ получается при воздушной газификации древесины в противоточном (updraft) реакторе [10]. Основная часть топливной составляющей генераторного газа представлена в форме пиролизных смол – широкого набора углеводородов, фенолов и органических кислот, которые, как правило, могут использоваться только при прямом сжигании в котле, поэтому окислительная конверсия в синтез-газ позволит существенно расширить область применения такого газа, например, в качестве топлива для газопоршневого мотора или топливного элемента. Расчеты конверсии пиролизного газа в реакторе парциального окисления без рекуперации тепла выполнены в работе [11]. Приведенный выше состав генераторного газа в обозначениях настоящей работы отвечает брутто-формуле y = 0.90, z = = 0.96, nf = 0.74, wf = 0.31.
Так же как и для рассмотренного выше случая конверсии изопропанола, мы вынуждены использовать при расчете приблизительную оценку энтальпии топливного газа при температуре горения. В соответствии с составом газа полагаем, что
(16)
$\begin{gathered} {{H}_{f}}(T) = 0.58{{H}_{r}}(T) + 0.21{{H}_{d}}(T) + \\ + \,\,0.21{{H}_{m}}(T) + 0.04{{H}_{h}}(T), \\ \end{gathered} $При этом, поскольку сам состав пиролизных смол остается охарактеризованным весьма приблизительно, необходимо воспользоваться приблизительной оценкой значения энтальпии их образования. Аналогично (15) оценим последнюю как
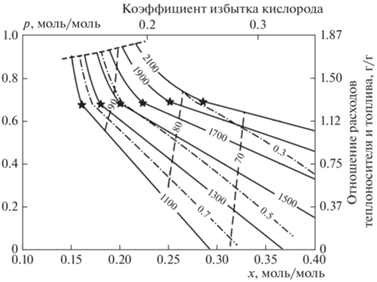
где Q – удельная (на моль углерода) низшая теплота окисления пиролизной смолы. Эту теплоту окисления, в свою очередь, оценим с использованием интерполяционной формулы Д. Менделеева [21], в форме [22] где q – низшая теплота сгорания в МДж/кг; C, H, O – массовые доли соответствующих элементов в топливе. Для пиролизных смол состава CH1.48O0.58 (C – 52.72%, H – 6.50%, O – 40.77%) q = 20.14 МДж/кг и, соответственно, Q = 458.3 кДж/моль.Приведенные на рис. 7 и 8 результаты расчета показывают, что конверсия генераторного газа может быть проведена с высокой энергетической эффективностью. По существу, при этом происходит конверсия пиролизных смол, и для достижения высокого КПД высокое содержание в генераторном газе балластных компонентов (прежде всего азота) должно быть скомпенсировано повышенным расходом твердого теплоносителя. Высокая степень рекуперации тепла синтез-газа на твердом теплоносителе позволяет провести высокотемпературную конверсию при x < 0.2 (полному окислению генераторного газа соответствует x = 0.783). Вследствие забалластированности генераторного газа его теплоемкость в параметрической области конверсии выше, чем у подаваемого воздуха, поэтому при повышении расхода твердого теплоносителя процесс из режима A непосредственно переходит в режим B. Высокое содержание в генераторном газе эндотермических окислителей (водяного пара и диоксида углерода) делает излишней подачу пара с воздухом. Равновесное сажеобразование не происходит во всей параметрической области с температурой горения выше 1100 К.
Рис. 7.
Расчетные изотермы воздушной конверсии генераторного газа в плоскости x–p; wx = 0, nx = 79/21x. Сплошные линии – изотермы, штриховые – изолинии химического КПД, штрих-пунктирные – изолинии отношения h/m в синтез-газе; темными звездочками на изотермах помечены точки перехода из режима A в режим B; штриховая линия, ограничивающая диаграмму сверху, – переход из режима B в режим C.
ЗАКЛЮЧЕНИЕ
Как показывает проведенное на ограниченном примере изопропанола и генераторного газа исследование, предложенный подход позволяет конвертировать в синтез-газ самое разнообразное углеводородное сырье. Предложенный подход к окислительной конверсии углеводородов благодаря эффективной рекуперации тепла на твердом теплоносителе обеспечивает высокую энергетическую эффективность конверсии, в том числе при использовании в качестве окислителя воздуха и при конверсии забалластированных газов. Возможность варьировать в широких пределах подачу пара, компенсируя его теплоемкость увеличением расхода твердого теплоносителя, позволяет управлять составом синтез-газа. Описанная выше процедура позволяет для заданного состава топлива предварительно рассчитать параметрическую область, в которой следует проводить оптимизацию условий конверсии, в том числе находить компромисс между уменьшением расхода воздуха (т.е. ростом КПД конверсии) и увеличением температуры горения (т.е. увеличением полноты конверсии и удельной производительности процесса).
Наивысшая энергетическая эффективность конверсии достигается в режиме B при теплоемкости потока твердого теплоносителя, близкой к теплоемкости потока синтез-газа. При этом полученный синтез-газ выводится из реактора при низкой температуре, что облегчает его технологическое использование.
Улучшения процесса, предложенные в работе [15], позволяют, помимо высокой энергетической эффективности, обеспечить переработку топлив, которые при пиролизе образуют небольшие коксовые отложения на поверхности твердого теплоносителя: в режиме B теплоноситель, имеющий высокую температуру, попадает в теплообменнике в поток нагретого газа-окислителя, что позволяет окислить коксовые отложения на поверхности. (В случае, когда коксовые отложения составляют существенную часть подаваемого топлива, их окисление в верхней части теплообменника необходимо учитывать в материальном и энергетическом балансе процесса, что выходит за рамки настоящей работы.)
Приведенные термодинамические оценки показывают высокую эффективность рассматриваемого процесса. Для его практической реализации, безусловно, потребуются дополнительные исследования для уточнения пределов применимости модели, нахождения временных параметров переходных режимов, кинетических ограничений, связанных с конечными скоростями реакций и конечной скоростью тепло- и массообмена. Потребуется и серьезная работа по аппаратному оформлению описанного выше процесса.
Исследование выполнено при частичной финансовой поддержке Российским фондом фундаментальных исследований совместно с агенством ТУБИТАК в рамках научного проекта № 21-51-46007. Работа выполнена по теме госзадания (регистрационный номер АААА-А19-119022690098-3, тема 0089-2019-0018).
Список литературы
Арутюнов В.С., Стрекова Л.Н., Савченко В.И. и др. // Нефтехимия. 2019. Т. 59. № 3. С. 246; https://doi.org/10.1134/S002824211903002X
Abubackar H.N., Veiga M.C., Kennes C. // Sustainable Resource Recovery and Zero Waste Approaches / Eds. Taherzadeh M.J., Bolton K., Wong J., Pandey A. UK: Elsevier, 2019. P. 207; https://doi.org/10.1016/B978-0-444-64200-4.00015-3
Huang J., Schmidt K.G., Bian Z. // Energies. 2011. V. 4. № 8. P. 1163; https://doi.org/10.3390/en4081163
Zhang W., Liu H., Ul Hai I., Neubauer Y., Schröder P., Oldenburg H., Seilkopf A., Kölling A. // Intern. J. Low-Carbon Technol. 2012. V. 7. № 2. P. 69; https://doi.org/10.1093/ijlct/ctr046
Систер В.Г., Борисов А.А., Трошин К.Я. и др. // Хим. физика. Т. 25. № 1. 2006. С. 61.
Арутюнов В.С., Стрекова Л.Н. // Хим. физика. Т. 31. № 8. 2012. С. 18.
Алдошин С.М., Арутюнов В.С., Савченко В.И. и др. // Хим. физика. Т. 40. № 5. 2021. С. 46.
Тереза А.М., Агафонов Г.Л., Андержанов Э.К., Медведев С.П. // Хим. физика. Т. 40. № 8. 2021. С. 56.
Тереза А.М., Агафонов Г.Л., Андержанов Э.К. и др. // Хим. физика. Т. 39. № 8. 2020. С. 58.
Глазов С.В., Кислов В.М., Размыслов А.В., Салганская М.В. // ЖПХ. 2019. Т. 92. № 7. С. 1020; https://doi.org/10.1134/S0044461819070156
Глазов С.В. // Теорет. основы хим. технологии. 2019. Т. 53. № 1. С. 54; https://doi.org/10.1134/S0040357119010032
Dorofeenko S., Polianczyk E. // Chem. Eng. J. 2016. V. 292. P. 183; https://doi.org/10.1016/j.cej.2016.02.013
Polianczyk E., Dorofeenko S. // Intern. J. Hydrogen Energy. 2019. V. 44. № 8. P. 4079; https://doi.org/10.1016/j.ijhydene.2018.12.117
Костенко С.С., Полианчик Е.В., Карнаух А.А., Иванова А.Н., Манелис Г.Б. // Хим. физика. Т. 25. № 5. 2006. С. 43.
Зюбин Л.В., Баканов К.Д. Способ получения свободного от пиролизных смол горючего газа при газификации конденсированного топлива и устройство для его осуществления. Патент РФ № 2733777 // Роспатент № 28. 2020.
Dorofeenko S., Polianczyk E. // Intern. J. Hydrogen Energy. 2019. V. 44. № 57. P. 30039; https://doi.org/10.1016/j.ijhydene.2019.09.208
Арутюнов В.С. // Хим. физика. Т. 24. № 9. 2005. С. 76.
Термодинамические свойства индивидуальных веществ. Справочное издание в четырех томах / Под ред. Глушко В.П., Гурвич Л.В., Бергман Г.А. и др. М.: Наука, 1978. (Т. I, II), 1981 (Т. III).
Smith G.P., Golden D.M., Frenklach M. et al. GRI-Mech 3.0. 2018; http://combustion.berkeley.edu/gri-mech/version30/text30.html
Chao J., Rossini F.D. // J. Chem. Eng. Data. 1965. V. 10. № 4. P. 374; https://doi.org/10.1021/je60027a022
Менделеев Д.И. Основы фабрично-заводской промышленности. Вып. 1. СПб.: Тип. В. Демакова, 1897. С. 90.
Равич М.Б. Эффективность использования топлива. М.: Изд-во Наука, 1977. С. 36.
Дополнительные материалы отсутствуют.
Инструменты
Химическая физика