Химическая физика, 2022, T. 41, № 11, стр. 63-72
Влияние нейтральных добавок к окислителю, заполняющему канал, на самовоспламенение водорода
А. Е. Смыгалина 1, *, А. Д. Киверин 1
1 Объединенный институт высоких температур Российской академии наук
Москва, Россия
* E-mail: smygalina-anna@yandex.ru
Поступила в редакцию 02.03.2022
После доработки 18.03.2022
Принята к публикации 21.03.2022
- EDN: TLNPCA
- DOI: 10.31857/S0207401X22110127
Аннотация
Настоящая работа посвящена исследованию самовоспламенения водорода, истекающего под давлением в канал, заполненный окислительной средой с добавлением нейтральных компонент: водяного пара, гелия, углекислого газа, азота, аргона. Работа выполнена методами численного моделирования процесса с учетом конечного времени раскрытия диафрагмы, разделяющей камеру высокого давления и канал. Проведенные расчеты показали, что с ростом содержания H2O, He, CO2 или N2 в кислороде время задержки воспламенения водорода увеличивается и по достижении предельной степени разбавления его самовоспламенение не происходит. При этом продемонстрировано, что самовоспламенение может развиваться в форме очагов двух типов – охватывающих все сечение канала либо локализованных у его стенки. При этом в ряде случаев очаг у стенки оказывается неустойчивым и затухает до выхода струи водорода из канала. При разбавлении окислителя аргоном наблюдается качественно другой сценарий развития процесса, и с ростом содержания аргона в окислительной среде время самовоспламенения уменьшается. Причем очаговое воспламенение имеет место даже при очень высоком содержании аргона в кислороде – до 99.5%. Этот эффект связан со значительно меньшей теплоемкостью аргона в сравнении с другими нейтральными добавками и, следовательно, с более интенсивным нагревом окислительной среды при струйном истечении водорода в канал.
ВВЕДЕНИЕ
В настоящее время большое внимание уделяется исследованиям в области водородной энергетики. Водород является перспективным топливом [1], в том числе по причине отсутствия в продуктах горения водорода оксидов углерода и сажи, что выгодно отличает процесс сжигания водорода от использования широко распространенных углеводородных топлив. При этом водород обладает высокой удельной теплотой сгорания. Однако как само использование водорода, так и его хранение сопряжено с высокой опасностью. Так, например, при хранении водорода в баллонах под высоким давлением возможно развитие нештатных аварийных сценариев, связанных с самовоспламенением водорода при его истечении из разгерметизированного баллона. Помимо практически важной задачи обеспечения безопасного хранения и транспортировки водорода, сам процесс развития горения при истечении водорода под высоким давлением в канал представляет интерес для решения фундаментальной задачи определения особенностей горения водорода, предварительно не перемешанного с окислителем. Здесь важным является понимание того, как возникает и развивается горение. В отличие от предварительно неперемешанных смесей, для ингибирования горения водородовоздушных перемешанных смесей в литературе представлены такие способы, как использование дополнительных присадок к смесям, активных или химически нейтральных [2].
Процесс самовоспламенения водорода при его истечении под высоким давлением в атмосферу достаточно подробно исследован. При этом в опубликованных работах рассматривались особенности влияния различных параметров на процесс самовоспламенения: давления водорода, времени раскрытия диафрагмы, параметров геометрической области, куда истекает водород, а также добавок некоторых веществ к водороду либо в атмосферу окислителя. В пионерской работе [3] введено понятие “диффузионного воспламенения”, которое состоит в том, что при истечении горючего газа под высоким давлением в среду с окислителем происходит диффузионное перемешивание окислителя с горючим и быстрое воспламенение полученной смеси за счет теплового потока от окислителя, нагретого ударной волной. При этом в качестве горючего использовался водород и синтез-газ, а в качестве окислителя – кислород и воздух.
В последующих работах, как экспериментальных [4–9], так и численных [10–14], было исследовано самовоспламенение водорода при варьировании таких параметров, как давление, время раскрытия диафрагмы, длина, радиус и форма сечения трубы, в которую истекал водород. В работах [5, 6, 12–14] рассматривался процесс истечения водорода в трубу, в то время как в работах [7–11] исследовалась эволюция процесса при истечении водорода в открытое пространство, в том числе из трубы. В работе [5] обнаружено, что самовоспламенение в каналах прямоугольного сечения наблюдается при более низких давлениях водорода, чем в случае истечения в канал круглого сечения, при одинаковой площади сечения. Истечение в загроможденное пространство исследовано в работе [9]; при этом сделан вывод о фокусировке возмущений потока за счет загромождений, что приводит к самовоспламенению, и предложены методы для предотвращения таких процессов на практике. В работе [10] показано, что горение струи газа после выхода из канала вероятнее всего вызвано возникновением пристеночных очагов в трубе. Авторы работы [11] показали, что существует критический радиус отверстия, через которое истекает водород, при этом при меньшем радиусе отверстия самовоспламенение отсутствует. Результаты работ [4, 10, 12] указывают на то, что большую роль в наличии или отсутствии самовоспламенения играют давление водорода и время раскрытия диафрагмы. В частности, получено, что чем ниже давление, больше время раскрытия или меньше длина трубы, тем вероятность самовоспламенения ниже. В работе [8] показано, что при уменьшении радиуса трубы происходит увеличение критического давления, необходимого для самовоспламенения, а зависимость критического давления от длины трубы является немонотонной: при длинах от 0.3 до 1.45 м критическое давление уменьшается, а при длинах от 1.45 до 3 м оно увеличивается. В работах [6, 12] установлоено, что механизм самовоспламенения в трубах связан с возникновением очага в пристеночном слое. Далее же, при достаточно большой длине трубы, этот очаг самовоспламенения распространяется к центру струи.
В недавних работах было проведено также исследование с использованием варьирования формы канала, в который истекает водород. Так, в работе [15] рассматривались истечение и самовоспламенение водорода в канале формы L, а в работе [16] – формы T. Отдельно процесс рассматривался в канале с переменным сечением [17]. Показано, что при использовании труб L-формы или трубы с локальным расширением вероятность самовоспламенения повышается. При использовании труб Т-формы малой длины самовоспламенение наблюдается при более низком давлении водорода, чем в случае использования прямых труб. При увеличении длины трубы зависимость от формы трубы становится обратной.
Одним из направлений работы по исследованию самовоспламенения водорода является варьирование состава горючего в камере высокого давления и окислителя в камере низкого давления. Так, в работах [18, 19] показано, что при добавлении к водороду до 2.5 об.% метана вероятность самовоспламенения водорода существенно снижалась. Схожий эффект наблюдался в работах [20–22]. Добавление азота к водороду в камере высокого давления приводит к тому, что необходимое для самовоспламенения давление повышается с увеличением содержания азота [22, 23]. В работе [22] показано, что добавление N2, CO, CH4 к водороду снижает вероятность самовоспламенения, причем этот эффект объясняется уменьшением интенсивности ударной волны и связан с молекулярным весом добавок. Для N2 и CO этот эффект примерно одинаков и интенсивнее, чем для CH4. Эффект разбавления окислителя при струйном истечении водорода исследован в работах [24, 25]. Так, в эксперименте из работы [24] к воздуху добавляли водород и было получено, что минимальное давление для самовоспламенения водорода существенно снижается с увеличением добавки водорода к воздуху. В работе [25] наблюдали обратный эффект: минимальное давление для самовоспламенения росло с увеличением содержания CO2 в воздухе.
Настоящая работа является продолжением цикла работ авторов [12, 26], выполненных методами математического моделирования. В работе [12] на основе постановки задачи и результатов экспериментального исследования [4] определен механизм самовоспламенения при истечении водорода под давлением в канал, заполненный воздухом. Исследовано влияние скорости раскрытия диафрагмы и начального давления водорода на его самовоспламенение. В работе [26] было проанализировано также влияние состава среды, заполняющей канал (камеру низкого давления). Для этого канал заполнялся кислородом с добавками водяного пара, гелия, углекислого газа, азота. Было продемонстрировано, что разбавление кислорода такими компонентами способствует задержке самовоспламенения и его “вырождению” при достижении определенного содержания добавки.
Настоящая работа продолжает исследование, начатое в работе [26]. Рассмотрено влияние указанных выше добавок на воспламенение водорода при истечении в кислород, а также исследовано влияние добавки аргона в окислитель. В последнем случае наблюдается обратный эффект, и разбавление аргоном способствует интенсификации процесса самовоспламенения. Отметим, что выбор аргона в качестве добавки актуален в силу существующей тенденции использовать аргон вместо азота в воздухе в двигателях внутреннего сгорания [27–30]. В работе [30] отмечены преимущества сжигания водорода в атмосфере Ar–O2 в сравнении с его сжиганием в атмосфере N2–O2 (воздуха) в условиях, имитирующих процесс в двигателе внутреннего сгорания. Среди таких преимуществ отмечено, что использование Ar приводит к повышению КПД двигателя и расширению пределов использования бедных смесей. Помимо этого, очевидным преимуществом при замещении азота аргоном является отсутствие выбросов оксидов азота NOx.
ПОСТАНОВКА ЗАДАЧИ ЧИСЛЕННОГО МОДЕЛИРОВАНИЯ
Как было отмечено во Введении, настоящая работа является прямым продолжением работ авторов [12, 26], а также экспериментальной работы [4]. Как и в экспериментах, проведенных в [4], здесь процесс рассматривается внутри цилиндрического канала, схематично изображенного на рис. 1. При этом, как и в [4], камеры высокого и низкого давления имеют одинаковый радиус, равный 9 мм, и длину 8 см. Длина камеры высокого давления оказывается достаточной для того, чтобы волна разрежения, отразившаяся от закрытой стенки 1, не оказывала влияния на течение в камере низкого давления до выхода струи водорода из нее через открытый конец 3 (рис. 1).
Рис. 1.
Расчетная область: 1 – закрытая стенка, 2 – боковая стенка канала, 3 – открытая граница, 4 – ось симметрии, 5 – диафрагма, 6 – область с грубой сеткой. Размеры области указаны в метрах.
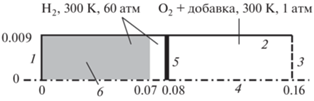
В начальный момент времени камера высокого давления заполнена водородом при температуре 300 К и давлении 60 атм, а камера низкого давления – смесью кислорода с добавками H2O, He, CO2, N2 и Ar при температуре 300 К и давлении 1 атм. Камера высокого давления отделена от камеры низкого давления плоской диафрагмой толщиной 0.2 мм, раскрывающейся в течение 30 мкс, что соответствует данным экспериментов из работы [4], определяя характерное время раскрытия диафрагмы при начальном давлении водорода 60 атм. При этом скорость раскрытия диафрагмы предполагается постоянной: радиус раскрывающейся области растет линейно во времени от начала раскрытия. На боковой стенке канала (2 на рис. 1) задается условие прилипания.
Моделирование проводится в двумерной области в цилиндрических координатах с учетом аксиальной симметрии. Математическая модель представляет собой систему уравнений газодинамики с учетом явлений переноса: вязкости, теплопроводности, диффузии, а также с учетом химического превращения. Численное решение уравнений газодинамики проводится лагранжево-эйлеровым методом, известным как метод “крупных частиц” [31]. Выбранный численный метод имеет второй порядок точности по пространству и первый порядок точности по времени и показывает надежность использования для широкого класса задач в области физики горения и взрыва, выраженную в получении удовлетворительного согласия с экспериментами по переходу горения в детонацию [32, 33], стуку в двигателях [34] и, собственно, самовоспламенению водорода при его истечении в канал [12].
Моделирование химического превращения проводится с использованием детального механизма химической кинетики [35], состоящего из 21 реакции между восемью компонентами. Добавки He, CO2, N2, Ar не участвуют в реакциях; их концентрации учитываются лишь для расчета трехчастичных взаимодействий. Численное решение уравнений химической кинетики проводится методом Гира [36]. Коэффициенты процессов переноса рассчитываются по формулам, приведенным в работе [37].
Для расчета термодинамических параметров и коэффициентов переноса использовались данные для каждого компонента реагирующей смеси (H2, O2, H2O, H, O, OH, HO2, H2O2, N2, Ar), взятые из таблиц данных, прилагаемых к механизму из работы [35]; для CO2 – из таблиц данных механизма GRI-Mech 3.0 [38]; для He – из таблиц данных механизма AramcoMech 3.0 [39]. Для Kr термодинамические данные были взяты из базы данных [40], а транспортные – из статьи [41].
Расчетная область разделена на две части: с грубой сеткой (область 6 на рис. 1) и мелкой сеткой (оставшаяся область). Такое разделение дает экономию по времени проведения отдельного расчета и при этом позволяет менее детально описывать динамику процесса в области 6, не представляющую интерес для самовоспламенения водорода, которое имеет место в камере низкого давления. В Приложении представлены результаты теста на сходимость, на основе которого была выбрана однородная сетка с шагом 200 мкм в области 6 и сетка с шагом 50 мкм в оставшейся области. Сокращение времени расчета при использовании локального огрубления расчетной сетки составило 30%.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Задержка самовоспламенения при истечении водорода в кислород с добавками H2O, He, CO2, N2 и Ar
На рис. 2 представлены зависимости максимальной температуры в камере низкого давления (канале) от времени. Рисунок 2a показывает, что при добавлении CO2 к кислороду происходит замедление самовоспламенения водорода и при содержании СО2 55% (и выше) оно отсутствует (здесь и всюду ниже имеется в виду процентное содержание по объему). Аналогичная картина наблюдается при разбавлении парами воды, гелием или азотом, что обсуждалось ранее в работе [26]. При добавлении к кислороду аргона наблюдается качественно иная зависимость: с увеличением содержания аргона в смеси с кислородом наблюдается ускорение роста температуры, что отражено на рис. 2б. В качестве контрольного варианта на обоих рисунках приведен результат для случая истечения водорода в чистый кислород.
Рис. 2.
Максимальная температура в канале в зависимости от времени для случаев добавления CO2 (а) и Ar (б) к O2 в канале. Линии 1 – истечение в чистом O2. Линии 2–6 на рисунке а – O2 с добавлением соответственно 20, 30, 40, 50, 55% СО2. Линии 2–5 на рисунке б – O2 с добавлением соответственно 30, 70, 90, 99.5% Ar.
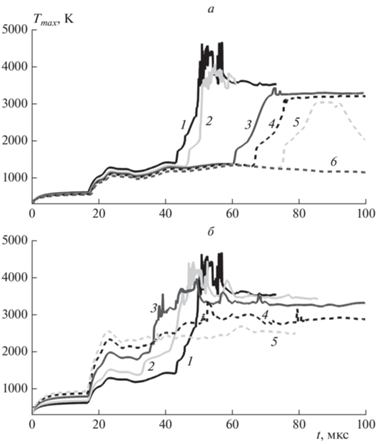
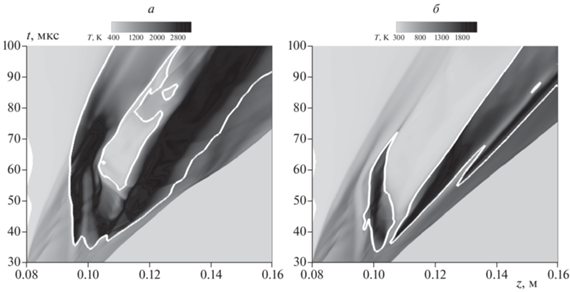
Анализ проведенных расчетов показывает, что для всех рассматриваемых здесь добавок к кислороду самовоспламенение впервые возникает вблизи стенки канала. Для иллюстрации процесса самовоспламенения на рис. 3 представлены x–t-диаграммы для слоя расчетной области непосредственно у самой стенки канала для случая истечения водорода в чистый кислород (а) и в смесь 99.5% Ar/O2 (б). При этом в последнем случае, несмотря на значительное содержание аргона (99.5%) в окислительной среде, самовоспламенение имеет место.
Рис. 3.
x–t-Диаграммы эволюции температуры в пристеночном слое в случае истечения водорода в чистый O2 (a) и смесь Ar 99.5% Ar/O2 (б). Изолинии 1 и 2 соответствуют 30%- и 5%-ному содержанию H2O в смеси без учета инертного разбавителя. Звездочки соответствуют началу самовоспламенения согласно выбранному критерию.
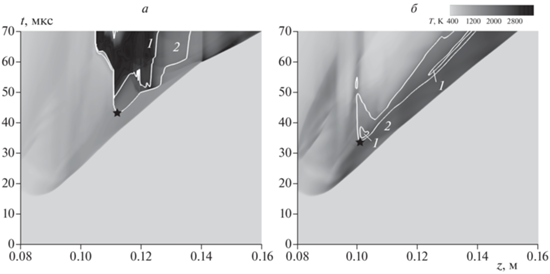
Для описания процесса самовоспламенения во всех рассмотренных случаях удобно использовать время задержки самовоспламенения. При этом в случае разбавления окислителя CO2, H2O, He или N2 это время задержки можно определить из хронограмм максимальной температуры (рис. 2а), поскольку на них отчетливо заметен резкий рост температуры, соответствующий началу протекания экзотермической реакции горения водорода. При разбавлении кислорода аргоном определение времени задержки самовоспламенения по рис. 2б затруднено, так как рост температуры при больших степенях разбавления может соответствовать исключительно нагреву смеси без протекания химического превращения. Тем не менее анализ расчетов показывает, что очаг в таких случаях также возникает и локализуется вблизи стенки канала. В таком случае для определения задержки самовоспламенения представляется целесообразным использование x–t-диаграммы и следующего критерия. Будем считать, что самовоспламенение имеет место, когда продукты горения (H2O) составляют 5% от всего объема газовой смеси без учета разбавителя. На рис. 3 изолинии соответствуют 5%- и 30%-ному содержанию H2O в смеси без учета инертного разбавителя. Из сравнения данных, представленных на рис. 2 и 3, видно, что в случае истечения водорода в чистый кислород выбранный критерий совпадает с описанным выше критерием по определению времени задержки по резкому росту температуры. В случае смеси с большим содержанием (99.5%) аргона этот критерий позволяет сделать заключение о времени задержки, равном 33.9 мкс, что меньше времени задержки в случае истечения в чистый кислород составляющем 43.0 мкс.
На рис. 4 приведены результаты расчетов по времени задержки самовоспламенения при истечении водорода в кислород с использованием различных добавок в зависимости от степени разбавления. Возникновение самовоспламенения во всех рассмотренных случаях, за исключением вариантов расчета с большим содержанием аргона, происходит у боковой стенки канала преимущественно за счет дополнительного разогрева в области пограничного слоя [12]. Как показано на рис. 4, имеют место три типа очагов: очаг, развивающийся по всей контактной поверхности водорода с окислителем (крупные символы); очаг, локализованный у боковой стенки канала и не охватывающий все сечение канала (мелкие символы); а также очаг, возникающий у боковой стенки и затухающий до выхода струи водорода из канала (незакрашенные символы). Отметим также наличие в некоторых случаях нескольких очагов. Так, при содержании N2 79–85%, как показывает рис. 4, имеет место ранний, затухающий, и поздний, устойчивый, очаги. Наличие таких очагов имеет место и для некоторых других составов (например, при содержании N2 70%), при этом ранний очаг не всегда затухает до появления позднего.
Рис. 4.
Время задержки самовоспламенения для разных вариантов добавок к кислороду. Крупные символы означают, что очаг развивается в объеме канала, мелкие – что очаг существует только у стенки, незакрашенные – что очаг затухает, не достигнув открытого конца канала. Штриховая линия соответствует времени самовоспламенения при истечении водорода в чистый кислород.
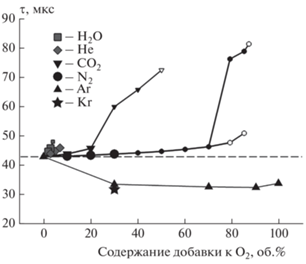
Отметим, исходя из данных, представленных на рис. 4, что в случае добавления аргона к кислороду время задержки самовоспламенения сокращается, причем во всех рассмотренных случаях наблюдаются очаги, развивающиеся по всей контактной границе водорода с кислородом. Анализ физико-химических свойств рассматриваемых смесей показал, что такое качественное различие зависимостей задержек самовоспламенения от содержания используемых добавок к окислителю связано с термодинамическими свойствами получаемой смеси окислителя с разбавителем. Так, на рис. 5 приведены зависимости удельной теплоемкости рассматриваемых смесей при 300 К и 1 атм от доли добавки. Видно, что в случае разбавления кислорода аргоном теплоемкость значительно уменьшается при увеличении доли аргона в смеси. Для случаев использования в качестве разбавителей H2O, He, N2 наблюдается обратная тенденция, а при использовании CO2 теплоемкость смеси почти неизменна во всем рассмотренном диапазоне концентраций.
Рис. 5.
Удельная теплоемкость при постоянном объеме для смесей кислорода с H2O, He, CO2, N2, Ar и Kr при 300 К и 1 атм.

Теплоемкость определяет, какое количество теплоты Q необходимо подвести для изменения температуры на ΔT: Q = CудmΔT. Соответственно, чтобы увеличить температуру на одну и ту же величину, смесям с меньшей теплоемкостью требуется меньшее количество теплоты, чем смесям с большей теплоемкостью. В рассматриваемой задаче теплота передается смеси окислителя с добавками в результате ударного сжатия под давлением струи водорода с учетом действия вязких напряжений. Отметим, что в численном решении расчет внутренней энергии осуществляется с учетом реального значения теплоемкости, что непосредственно влияет на реализацию условий для воспламенения.
Для проверки того факта, что эффект самовоспламенения связан с теплоемкостью смеси, в которую истекает водород, и уменьшение времени задержки самовоспламенения происходит не только для смесей с аргоном, выберем еще одно вещество, подобным образом способствующее уменьшению теплоемкости смеси с кислородом по мере его добавления в смесь. В качестве такого вещества возьмем криптон и рассмотрим процесс истечения водорода в среду 30% Kr/O2. Удельная теплоемкость Cv, уд для такой смеси составляет 388 Дж/К · кг (рис. 5). Анализ результатов расчета показал, что время задержки самовоспламенения является примерно таким же, как и для смеси 30% Ar/O2 (рис. 4), что дополнительно подтверждает связь эффекта сокращения задержки самовоспламенения с теплоемкостью окислительной среды.
Истечение водорода в канал, заполненный O2 либо воздухом, с добавками Ar
В настоящем разделе рассмотрим, возникает ли описанный эффект более быстрого возникновения самовоспламенения при добавлении аргона не к кислороду, а к воздуху. На рис. 6а представлены временны́е зависимости максимальной температуры в канале при добавлении 30, 70 и 90% Ar к воздуху, а также результат для истечения водорода в чистый воздух. Видно, что как и в случае разбавления аргоном кислорода, так и в рассматриваемом здесь случае разбавления аргоном воздуха подъем температуры происходит в присутствии аргона быстрее и времена задержки самовоспламенения сокращаются с увеличением содержания аргона.
Рис. 6.
Максимальная температура в канале в зависимости от времени для вариантов добавления Ar к воздуху (a) и Ar к O2 либо воздуху (б) в канале. Линии 1–4 на рисунке а соответствуют истечению водорода в чистый воздух и при добавлении 30, 70, 90% Ar к воздуху. Линии 1–3 на рисунке б соответствуют истечению водорода при добавлении 30, 70 и 90% Ar к воздуху, а 4–6 – к кислороду.
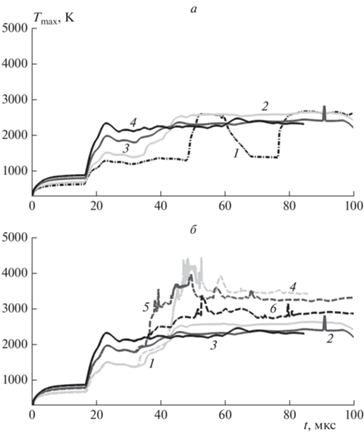
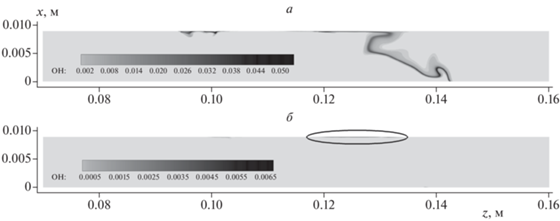
На рис. 6б для сопоставления влияния конкретного значения добавки приведены результаты при добавлении 30, 70 и 90% Ar к кислороду или воздуху. В рассмотренных случаях при истечении водорода в кислород наблюдается больший рост температуры, чем в случае истечения в воздух. При этом на ранних стадиях, когда формируются струя водорода и ударная волна и когда они взаимодействуют с боковой стенкой канала, результаты в кислороде и воздухе оказываются довольно близкими. На стадии же воспламенения горение водорода в кислороде дает больший тепловой эффект. При этом, как показывают x–t-диаграммы, представленные на рис. 7 для вариантов 70%-ного разбавления аргоном, развитие очага в непосредственной близости к боковой стенке канала начинается с ~35 мкс. Анализ полей температуры в рассмотренных случаях показывает, что при воспламенении водорода в воздухе с добавлением 70% аргона возникает только очаг у стенки (рис. 8б), тогда как горение во всем сечении канала не развивается. В случае же воспламенения водорода в кислороде с добавлением 70% аргона сначала возникает очаг у стенки и затем, при ~50 мкс этот очаг распространяется по сечению канала – по контактной поверхности водорода с кислородом (рис. 8а). Распространение горения вдоль контактной поверхности происходит в основном путем передачи тепла из области первичного очага в соседние слои. В случае использования воздуха в качестве окислителя тепловой эффект реакции относительно невысок, и выделившегося в первичном очаге тепла оказывается недостаточно для инициирования горения в соседних слоях движущейся смеси. В случае же использования кислорода тепловой эффект реакции значительно выше (рис. 6б), что и позволяет очагу охватить все сечение канала. При существенном разбавлении кислорода инертными компонентами, однако, очаг горения также локализуется вблизи боковой стенки (рис. 4).
Приложение
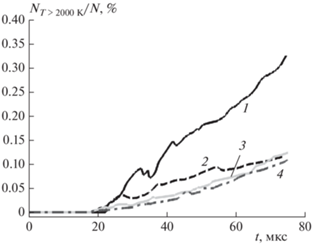
Представим здесь результаты теста на сходимость решения по размеру расчетной ячейки. В качестве методики проведения теста выберем ту, что использована в работах [12, 13]: сравним зависимости величины NT > 2000 K/N от времени для разных сеток, где NT > 2000 K – число ячеек вычислительной сетки, в которых температура поднялась выше 2000 K, N – общее число ячеек сетки. Долю ячеек NT > 2000 K от общего числа N представим в процентах.
В качестве условий проведения вычислений выберем параметры геометрической области, как для основных расчетов, а в качестве состава в камере низкого давления – 99.5% Ar/O2, поскольку для данного состава самовоспламенение водорода зависит как от граничного условия – условия прилипания, так и от газодинамических процессов в ядре потока. Кроме того, данный состав неоднократно рассматривается в статье и представляет особый интерес. В области с грубой сеткой (см. рис. 1) зададим размер ячейки 200 мкм.
На рис. 9 представлены результаты теста с постепенным ростом величины NT > 2000 K/N, связанным только с горением. Видно, что сетка с размером расчетной ячейки 50 мкм дает результат, близкий к результатам, получаемым на сетках с размерами ячейки 25 и 12.5 мкм. Результат же для сетки с размером ячейки 100 мкм заметно отличен от результата, полученного на сетке с размером ячейки 50 мкм. Таким образом, для всех расчетов в данной статье была выбрана сетка с шагом 50 мкм.
ВЫВОДЫ
В качестве основных выводов настоящей работы отметим следующие:
1. При истечении водорода в канал разбавление кислорода с использованием добавок H2O, He, CO2 и N2 способствует увеличению времени задержки самовоспламенения, и при достижении определенных критических значений содержаний добавок самовоспламенение не возникает. В случае использования указанных добавок очаг самовоспламенения возникает у стенки канала и при малых степенях разбавления развивается по контактной поверхности водорода в объеме канала.
2. Разбавление кислорода или воздуха аргоном приводит к ускорению процесса самовоспламенения водорода при его истечении в канал. При этом с ростом степени разбавления окислителя аргоном время задержки самовоспламенения сокращается. При содержании Ar 70% и менее в кислороде очаг возникает у стенки и далее развивается по контактной поверхности водород/окислитель. При таких же добавках Ar к воздуху очаг возникает и развивается только у стенки.
3. Интенсификация процесса самовоспламенения при разбавлении окислителя аргоном связана с относительно низким значением теплоемкости последнего.
4. Охват горением всего сечения канала при истечении водорода в кислород связан с большим тепловым эффектом при горении водорода в кислороде по сравнению со случаем горения водорода в воздухе.
Все полученные результаты могут быть использованы при решении задач обеспечения водородной взрывобезопасности, в том числе для разработки систем подавления взрыва с использованием инертных или ингибирующих соединений. Помимо этого, полученные результаты могут использоваться для разработки систем сжигания водорода в циклах водородной энергетики, в частности систем управления процессами воспламенения и горения водорода путем варьирования состава среды окислителя.
Список литературы
Фролов С.М., Иванов В.С. // Хим. физика. 2021. Т. 40. № 4. С. 68.
Азатян В.В., Прокопенко В.М., Чапышева Н.В., Абрамов С.К. // Хим. физика. 2018. Т. 37. № 1. С. 71.
Wolanski P., Wojcicki S. // Proc. 14th Sympos. (Intern.) on Combust. Pittsburgh: The Combust. Inst., 1973. P. 1217.
Golovastov S., Bocharnikov V. // Intern. J. Hydrogen Energy. 2012. V. 37. P. 10956.
Головастов С.В., Бакланов Д.И., Володин В.В. и др. // Хим. физика. 2009. Т. 28. № 5. С. 19.
Kim Y.R., Lee H.J., Kim S., Jeung I.S. // Proc. Combust. Inst. 2013. V. 34. P. 2057.
Duan Q.L., Xiao H.H., Gao W. et al. // Intern. J. Hydrogen Energy. 2015. V. 40. P. 8281.
Wang Z., Pan X., Jiang Y. et al. // Intern. J. Hydrogen Energy. 2020. V. 45. P. 18 042.
Mironov V.N., Penyazkov O.G., Ignatenko D.G. // Intern. J. Hydrogen Energy. 2015. V. 40. P. 5749.
Wen J.X., Xu B.P., Tam V.H.Y. // Combust. and Flame. 2009. V. 156. P. 2173.
Golub V.V., Baklanov D.I., Bazhenova T.V. et al. // J. Loss Prev. Process Ind. 2007. V. 20. P. 439.
Ivanov M.F., Kiverin A.D., Smygalina A.E. et al. // Intern. J. Hydrogen Energy. 2017. V. 42. P. 11902.
Lee H.J., Park J.H., Kim S.D. et al. // Proc. Combust. Inst. 2015. V. 35. P. 2173.
Баженова Т.В., Головастов С.В., Голуб В.В. и др. // Хим. физика. 2009. Т. 28. № 11. С. 38.
Pan X., Wang Q., Yan W. et al. // Intern. J. Hydrogen Energy. 2020. V. 45. P. 5028.
Wang Z., Pan X., Jiang Y. et al. // Saf. Sci. 2020. V. 127. 104694.
Duan Q., Zhang F., Xiong T. et al. // J. Loss Prev. Process Ind. 2017. V. 49. P. 184.
Zeng Q., Duan Q., Li P. et al. // Intern. J. Hydrogen Energy. 2020. V. 45. P. 3381.
Zeng Q., Duan Q., Sun D. et al. // Fuel. 2020. V. 277. P. 118 217.
Golovastov S.V., Bocharnikov V.M., Samoilova A.A. // Intern. J. Hydrogen Energy. 2016. V. 41. P. 13 322.
Rudy W., Dabkowski A., Teodorczyk A. // Intern. J. Hydrogen Energy. 2014. V. 39. P. 20 388.
Zeng Q., Duan Q., Jin K. et al. // Fuel. 2022. V. 308. 122 016.
Rudy W., Teodorczyk A., Wen J. // Intern. J. Hydrogen Energy. 2017. V. 42. P. 7340.
Gong L., Duan Q., Liu J. et al. // Intern. J. Hydrogen Energy. 2018. V. 43. P. 23 558.
Gong L., Duan Q., Liu J. et al. // Intern. J. Hydrogen Energy. 2019. V. 44. P. 7041.
Смыгалина А.Е., Киверин А.Д. // Хим. физика. 2021. Т. 40. № 8. С. 49.
Mansor M.R.A., Shioji M. // Combust. and Flame. 2016. V. 173. P. 245.
Hafiz N.M., Mansor M.R.A., Mahmood W.M.F.W. // Intern. J. Hydrogen Energy. 2018. V. 43. P. 11286.
Nasruldin M.A.A., Mansor M.R.A. // IOP Conf. Ser.: Earth Environ. Sci. 2019. V. 354. 012056.
Shi S., Tomomatsu Y., Chaturvedi B. et al. // Appl. Energy. 2021. V. 281. 116109.
Белоцерковский О.М., Давыдов Ю.М. Метод крупных частиц в газовой динамике. М.: Наука, 1982.
Ivanov M.F., Kiverin A.D., Yakovenko I.S., Liberman M.A. // Intern. J. Hydrogen Energy. 2013. V. 38. P. 16427.
Киверин А.Д., Смыгалина А.Е., Яковенко И.С. // Хим. физика. 2020. Т. 39. № 8. С. 9.
Liberman M.A., Ivanov M.F., Valiev D.M., Eriksson L.E. // Combust. Sci. Technol. 2006. V. 178. P. 1613.
O Conaire M., Curran H.J., Simmie J.M. et al. // Intern. J. Chem. Kinet. 2004. V. 36. P. 603.
Hairer E., Wanner G. Solving ordinary differential equations II. Stiff and differential-algebraic problems. N.Y.: Springer, 1996.
Варнатц Ю., Маас У., Диббл Р. Горение. М.: Физматлит, 2006.
Smith G.P., Golden D.M., Frenklach M. et al. GRI-Mech 3.0; http://combustion.berkeley.edu/gri-mech/ version30/text30.html.
Zhou C.-W., Li Y., Burke U. et al. // Combust. and Flame. 2018. V. 197. P. 423.
Burcat A. Thermodynamic Data at the Web Site of the Laboratory for Chemical Kinetics. Ideal Gas Thermodynamic Data in Polynomial Form for Combustion and Air Pollution Use; http://garfield.chem.elte.hu/ Burcat/BURCAT.THR.
Kim S.U., Monroe C.W. // J. Comput. Phys. 2014. V. 273. P. 358.
Дополнительные материалы отсутствуют.
Инструменты
Химическая физика