Химическая физика, 2022, T. 41, № 11, стр. 3-14
Кинетическое моделирование окисления пропана при температурах 700–1100 К
С. Д. Арсентьев 1, Л. А. Тавадян 1, М. Г. Брюков 2, А. С. Паланкоева 2, *, А. А. Беляев 2, В. С. Арутюнов 2, 3
1 Институт химической физики им. А.Б. Налбандяна Национальной академии наук Республики Армения
Ереван, Армения
2 Федеральный исследовательский центр химической физики им. Н.Н. Семенова Российской академии наук
Москва, Россия
3 Институт проблем химической физики Российской академии наук
Черноголовка, Россия
* E-mail: anitadmitruk@gmail.com
Поступила в редакцию 20.03.2022
После доработки 15.04.2022
Принята к публикации 20.04.2022
- EDN: WWKDIC
- DOI: 10.31857/S0207401X22110024
Аннотация
В работе приведены экспериментальные данные по окислению пропана и пропилена в лабораторных реакторах и результаты их кинетического моделирования на основе представленных в литературе механизмов. Показана возможность количественного согласования расчетных и экспериментальных данных с учетом ряда процессов, протекающих на поверхности реактора. Установлено, что при окислении и пиролизе пропана необходимо также учитывать реакции продолжения цепей с участием алкилпероксильных радикалов. Результаты моделирования демонстрируют возможность количественного согласования расчетов с экспериментальными результатами, получаемыми в реакторах лабораторного масштаба, при учете ряда процессов с участием активных промежуточных компонентов, протекающих на поверхности реактора. Необходим также учет ряда реакций продолжения цепей с участием алкилпероксильных радикалов. Вопреки ожиданиям, при совместном (сопряженном) окислении пропана и пропилена в указанных выше условиях эти углеводороды практически не оказывают взаимного влияния на конверсию друг друга.
ВВЕДЕНИЕ
Обильные ресурсы и невысокая стоимость делают углеводородные газы привлекательным сырьем для нефтехимии. В работах [1–3] показана возможность производства различных химических продуктов в некаталитических процессах непосредственно из легких газообразных углеводородов. Обсуждаются преимущества и возможность практической реализации таких технологий. Существующие газохимические процессы имеют высокую энерго- и капиталоемкость и позволяют получать широкий, но ограниченный ассортимент базовых продуктов. Перед газохимией стоит важная и сложная задача создания новых, более эффективных технологий.
Газообразные углеводороды также находят широкое применение в качестве топлива как для стационарных энергоустановок, так и на транспорте. Их использование в энергетике и перспективы развития газохимии объясняют постоянный интерес к исследованию процессов их горения и окислительной конверсии, в том числе в базовые нефте- и газохимические продукты. Для повышения эффективности применения углеводородных газов в качестве топлива необходимо увеличивать полноту их сгорания, снижать объем экологически вредных выбросов, расширять пределы стабильного горения. Это, как и повышение эффективности использования углеводородных газов в качестве химического сырья, требует более глубокого исследования кинетики цепных процессов их окисления и конверсии в химические продукты. Экспериментальные исследования процессов окисления углеводородных газов проводят на различных экспериментальных установках, таких как проточные реакторы, ударные трубы, машины быстрого сжатия и другие. Интерпретация результатов, получаемых с использованием различного оборудования, требует адекватных кинетических моделей, учитывающих особенности используемой экспериментальной техники.
Пропан в ряду предельных углеводородов занимает особое место. С одной стороны, он является простейшим среди углеводородов, которые начинают проявлять общие черты с более тяжелыми алканами при химической конверсии как в низкотемпературном, так и в высокотемпературном диапазонах. С другой стороны, он является промежуточным звеном между легкими (CH4 и C2H6) и тяжелыми (C4H10, C5H12 и др.) алканами. Пропан и пропилен – базовые компоненты сжиженного нефтяного газа (СНГ) и нефтезаводских газов (НЗГ), определяющие их поведение в окислительных процессах и моторные свойства [4–7]. Изучение процессов их окисления и окисления содержащих их смесей позволит оптимизировать промышленные процессы, связанные с их получением и использованием, получить информацию о поведении в окислительных процессах других предельных и непредельных углеводородов и способствовать созданию надежных кинетических механизмов для анализа процессов конверсии СНГ и НЗГ.
Однако окислительная конверсия пропана в промышленных условиях может существенно отличаться от аналогичных процессов в небольших лабораторных реакторах, используемых для их изучения. Причина – в возможности значительного вклада гетерогенных процессов на поверхности лабораторных реакторов с высоким отношением площади поверхности реактора S к его объему V (S/V). Задача настоящей работы – анализ возможности адекватного кинетического описания процессов окисления пропана и содержащих его смесей в статических и проточных реакторах лабораторного масштаба в диапазоне температур 600–1100 К, наиболее интересном для создания новых газохимических технологий и анализа процессов воспламенения газомоторного топлива в двигателях внутреннего сгорания (ДВС) с тем, чтобы эти результаты могли быть использованы и для анализа практически важных крупномасштабных процессов.
МОДЕЛИРОВАНИЕ ПРОЦЕССОВ ОКИСЛЕНИЯ ЛЕГКИХ УГЛЕВОДОРОДОВ
Основу кинетических механизмов окисления всех углеводородов составляет механизм окисления простейшего их них – метана. Исторически сложилось так, что первоначально основной целью разработки механизмов окисления метана было описание процессов его горения и высокотемпературной конверсии. Количество публикаций по этому вопросу очень велико. Укажем лишь один из последних обзоров [8], посвященный выбору кинетического механизма для получения максимально точных результатов при разумных вычислительных затратах. Было показано, что результаты моделирования пламени метана по сокращенному механизму с 42 необратимыми реакциями хорошо согласуются с экспериментальными данными при использовании только 5% вычислительного времени, необходимого при работе с известным механизмом моделирования GRI-Mech 3.0 [9]. Однако такие редуцированные механизмы, хорошо характеризуя установившееся высокотемпературное пламя метана, значительно хуже описывают переходные процессы, такие как воспламенение, развитие которых происходит при более низких температурах.
В обзоре [10] обсуждаются аспекты численного моделирования химических процессов с акцентом на кинетические механизмы, описывающие окисление углеводородов. Рассматриваются детальные и редуцированные механизмы ряда процессов, которые позволяют достаточно точно описывать эксперименты как по воспламенению, так и по пиролизу различных углеводородов в высокотемпературном диапазоне (T > 1100 K). В то же время кинетика окисления углеводородов в низкотемпературном диапазоне (T < 1100 K) остается еще недостаточно хорошо исследованной.
Детальный кинетический механизм окисления различных углеводородов С1–С2 – метана, этана, этилена, ацетилена, а также их кислородсодержащих производных: формальдегида, метанола, ацетальдегида и этанола, был предложен в работе [11]. Механизм был проверен для широкого диапазона начальных условий на таких разных расчетных моделях, как проточный реактор, ударная труба и реактор с полным перемешиванием. Моделирование проводили на базе программного пакета Chemkin Pro [12].
Что касается механизма окисления и горения собственно пропана, то в свое время было предложено большое число механизмов, описывающих этот процесс [13–19]. Однако, несмотря на большой интерес к процессам крекинга и окислительных превращений пропана, некоторые связанные с этими процессами вопросы до сих пор недостаточно исследованы. Одна из причин состоит в том, что многие кинетические механизмы окисления пропана, разработанные для процессов его горения в области высоких температур [15–19] не включают реакций, играющих важную роль в низкотемпературном диапазоне. Поэтому они в принципе непригодны для описания экспериментов в области Т < 1100 К и процессов воспламенения. В настоящее время большинство работ по моделированию окисления легких углеводородов различных классов в области умеренных температур Т < 1100 K выполняется с использованием коммерческой версии механизма AramcoMech, содержащей 124 химических компонента и 766 реакций [20], который можно рассматривать как наиболее надежную основу для моделирования подобных процессов [21, 22].
Среди работ по низкотемпературному (500–1000 К) воспламенению пропан-воздушных и этан-воздушных смесей можно отметить работу [23]. Известный детальный механизм San Diego из 235 элементарных реакций между 40 химическими компонентами [24], который моделирует время воспламенения этих смесей в широком диапазоне условий для начальных температур выше примерно 1000 К, был пересмотрен и дополнен для описания двухстадийного воспламенения и явления отрицательного температурного коэффициента скорости реакции (ОТК), наблюдаемого при температуре ниже 1000 К. Это исследование показало, что механизм San Diego, модифицированный добавлением небольшого количества соответствующих элементарных актов, позволяет описать низкотемпературное воспламенение сложных углеводородных систем, а также их поведение в области ОТК.
В работах [25–31] эксперименты по самовоспламенению воздушных смесей пропана, этана и их смесей с метаном в статическом реакторе были описаны с помощью механизма NUIGMech 1.1 [32]. В работе [33] предложен кинетический механизм воспламенения и горения смеси пропана с воздухом, включающий 599 реакций с участием 92 химических компонентов. Механизм был протестирован на экспериментальных данных (T0 = = 680–1900 K, P0 = 0.17–30 атм) по времени задержки воспламенения, а также конверсии пропана и изменению концентрации компонентов при пиролизе пропана. Полученные результаты сопоставлялись с расчетами по другим кинетическим механизмам [9] и [17]. Расчет ламинарной скорости пламени для всех кинетических механизмов проводили с использованием пакета программ CHEMKIN 4.0 [12].
Данные по наиболее важным элементарным стадиям процессов низкотемпературного горения и самовоспламенения углеводородов проанализированы в обзоре [34], в котором особый акцент был сделан на роли реакций алкилпероксильных и гидропероксильного радикалов. Разработка механизма, описывающего самовоспламенение пропана, пропилена и их смесей в широком диапазоне температур, давлений и составов смеси была проведена в работе [35]. Механизм был разработан на основе ряда известных в литературе кинетических механизмов, а также сравнения с экспериментальными данными по временам задержки воспламенения пропана из работы [36].
При моделировании времени задержки самовоспламенения с использованием механизмов AramcoMech 3.0 [20] и NUIGMech 1.1 [32] в работе [37] анализ скорости процесса показал, что основной расход пропилена связан с его реакцией с гидроксильным радикалом, приводящей к образованию резонансно стабилизированного аллильного радикала C3H5. Константы скорости отрыва H-атома от пропилена радикалом OH приведены в экспериментальной работе [38].
Работа [36] показала, что механизм AramcoMech 3.0 отражает тенденции реакционной способности и образования продуктов качественно лучше, чем другие механизмы, представленные в доступной литературе. Однако он переоценивает реакционную способность системы в области ОТК. В этой же работе анализируется механизм окисления пропилена, предложенных в работах Burke и соавт. [39, 40]. Был сделан вывод, что этот механизм не позволяет корректно предсказать реакционную способность пропана. Более удовлетворительные результаты при моделировании режима ОТК были получены при использовании механизма NUIGMech 1.1 [32].
Таким образом, хотя в настоящее время существует ряд детальных кинетических механизмов с высокими прогностическими возможностями для моделирования окисления метана при температурах ниже 1000 К [41], его смесей с углеводородами C1–C5 [30], а также этана [42], надежные и валидированные кинетические механизмы окисления более тяжелых алканов в этом диапазоне температур для описания процессов в проточных реакторах лабораторного масштаба практически отсутствуют. Большинство предложенных механизмов при T0 < 1100 K не дает даже качественного согласия с экспериментальными результатами.
ЭКСПЕРИМЕНТАЛЬНЫЕ ДАННЫЕ ПО ОКИСЛЕНИЮ ПРОПАНА
Процессы окисления и крекинга пропана имеют большое значение для разработки новых технологий получения олефинов, являющихся сырьем крупнотоннажных химических производств. В настоящее время крекинг углеводородов – основной способ получения олефинов. Процесс проводят как в газовой фазе, так и в присутствии катализаторов. Использование катализаторов существенно увеличивает выход олефинов и снижает образование побочных продуктов. Однако каталитическое дегидрирование имеет ряд недостатков. Поскольку реакция обратима, выход продуктов дегидрирования ограничен термодинамическим равновесием, и для получения высокого выхода пропилена необходимы высокие температуры. При этом происходит интенсивное коксообразование на поверхности катализатора, что приводит к постепенному падению его активности. Газофазные некаталитические процессы крекинга углеводородов лишены этих недостатков, поэтому возможность их разработки привлекает внимание исследователей.
Для валидации разрабатываемых кинетических механизмов окислительной конверсии пропана могут быть использованы экспериментальные результаты по газофазной окислительной конверсии легких алканов C2–C5 в среде азота, гелия или метана при атмосферном давлении и температурах 500–750 °C, представленные в работе [43]. Имеется большой массив экспериментальных данных по образованию продуктов окисления и пиролиза алканов в ударных трубах и проточных реакторах [44–46], которые также можно использовать для валидации разрабатываемых механизмов.
Интересный материал для анализа процессов сопряженного окисления пропана и других углеводородов дают эксперименты по некаталитической конверсии пропана в проточных двухсекционных реакторах [47–51]. В работах [47, 48] окисление пропана исследовали в широком диапазоне экспериментальных условий с использованием различных реакторов и разработали механизм, который адекватно описывает полученные экспериментальные результаты.
В работе [52] исследовали низкотемпературное окисление пропана в реакторе со струйным перемешиванием при атмосферном давлении. Методом CBS-QB3, реализованном в программном пакете Gaussian 09, были проведены расчеты термохимических данных для молекул, радикалов и переходных состояний, рассчитаны кинетические параметры для реакций изомеризации алкоксильных радикалов.
МОДЕЛИРОВАНИЕ ОКИСЛЕНИЯ ПРОПАНА В СТАТИЧЕСКОМ РЕАКТОРЕ
В работе проведено моделирование экспериментальных данных по газофазному окислению пропана в статическом реакторе при постоянном объеме (P = 250 Торр, T = 623 K) и соотношении реагентов C3H8 : O2 = 1 : 1, взятых из работы [53]. Расчеты проводили с использованием программы Chemkin 19.2, входящей в состав программного пакета ANSYS 19.2 [54]. Сначала рассматривали группу наиболее популярных современных механизмов окислительного превращения углеводородов: GRI-Mech 3.0 [9], San Diego [24], AramcoMech 3.0 [20] и близкий к нему механизм NUIGMech 1.1 [32].
Механизм San Diego [24], который включает 270 реакций с участием 58 химических компонентов, был ранее использован авторами работы [55], предложившими скелетный механизм окисления пропана, описывающий низкотемпературное горение и предсказывающий образование основных углеводородных продуктов в пламени с раздельной подачей реагентов. Первоначальный механизм [24] был уточнен и минимизирован до скелетного механизма из 122 реакций с участием 33 химических компонентов. Однако с точки зрения возможности описания низкотемпературных процессов окисления углеводородов критически важным недостатком механизма San Diego является отсутствие в нем реакций алкилпероксильных радикалов RO2, хотя их важная роль при окислении углеводородов хорошо известна [56–58].
Давно известный механизм GRI-Mech 3.0 [9], включающий 325 реакций с участием 53 химических компонентов, так же как и механизм San Diego, не учитывает образования алкилпероксильных радикалов. Кроме того, в нем отсутствуют реакции образования таких практически важных продуктов, как оксиды этилена и пропилена.
Более приемлемыми для моделирования процессов окисления углеводородов при средних и низких температурах представляются родственные механизмы AramcoMech 3.0 [20], первоначальный вариант которого включает 3037 реакций с участием 581 компонента и NUIGMech 1.1 [32], исходный вариант которого включает 11279 реакций с участием 2746 компонентов. Именно эти механизмы были использованы при последующем моделировании.
В результате предварительного моделирования установлено значительное расхождение экспериментального значения времени протекания процесса и расчетной величины. В частности, согласно механизму AramcoMech 3.0 период индукции процесса окисления составляет 4 с при общей продолжительности менее 40 с, а механизм NUIGMech 1.1 предсказывает 5 и 70 с соответственно. В то же время экспериментальный период индукции составляет 20 с при общей продолжительности процесса 200 с. При этом наблюдаются и заметные расхождения концентраций продуктов реакции с расчетными значениями. Сравнение экспериментальных данных с рассчитанными по механизмам AramcoMech 3.0 и NUIGMech 1.1 результатами приведено в табл. 1. Как видно из табл. 1, расчет по механизму NUIGMech 1.1 дает значения максимальных концентраций более близких к экспериментальным данным по сравнению с AramcoMech 3.0.
Таблица 1.
Сравнение максимальной концентрации продуктов реакции окисления пропана, полученных экспериментально в статическом реакторе при T = 623 K, P = 250 Торр и C3H8 : O2 = 1 : 1 с расчетными значениями
| Продукт реакции | Максимальные концентрации · 107, моль/см3 | |||
|---|---|---|---|---|
| эксперимент | механизм расчета | |||
| AramcoMech 3.0 | NUIGMech 1.1 | модифицированный NUIGMech 1.1 | ||
| CH2O | 2.43 | 3.30 | 2.30 | 2.27 |
| CH3CHO | 1.64 | 1.64 | 1.24 | 0.91 |
| CH3OH | 3.21 | 7.01 | 3.80 | 2.93 |
| C3H6 | 4.17 | 3.01 | 4.10 | 4.10 |
| CO | 17.1 | 14.7 | 16.0 | 18.0 |
| CO2 | 1.52 | 2.21 | 1.45 | 1.58 |
| H2O2 | 1.35 | 3.60 | 6.60 | 1.30 |
| C2H6 | 0.12 | 0.03 | 0.08 | 0.17 |
| C2H4 | 1.28 | 0.67 | 1.04 | 1.18 |
| CH4 | 1.1 | 0.90 | 0.98 | 1.04 |
| H2 | 0.38 | 0.60 | 0.46 | 0.45 |
Для того чтобы получить хорошее согласие экспериментальных данных и расчетных величин времени протекания процесса и максимальной концентрации продуктов окисления пропана механизм NUIGMech 1.1 был модифицирован. Из него были исключены реакции частиц, содержащих четыре и более атомов углерода, и добавлены реакции продолжения цепей с участием алкилпероксильных радикалов:
(1)
${\text{C}}{{{\text{H}}}_{{\text{3}}}}{{{\text{O}}}_{2}} + {{{\text{C}}}_{{\text{2}}}}{{{\text{H}}}_{{\text{5}}}}{{{\text{O}}}_{{\text{2}}}} \leftrightarrow {{{\text{O}}}_{2}} + {\text{C}}{{{\text{H}}}_{{\text{3}}}}{\text{O}} + {{{\text{C}}}_{{\text{2}}}}{{{\text{H}}}_{{\text{5}}}}{\text{O}},$(2)
${{{\text{C}}}_{{\text{2}}}}{{{\text{H}}}_{{\text{5}}}}{{{\text{O}}}_{{\text{2}}}} + {{{\text{C}}}_{{\text{2}}}}{{{\text{H}}}_{{\text{5}}}}{{{\text{O}}}_{2}} \leftrightarrow {{{\text{O}}}_{2}} + {{{\text{C}}}_{{\text{2}}}}{{{\text{H}}}_{{\text{5}}}}{\text{O}} + {{{\text{C}}}_{{\text{2}}}}{{{\text{H}}}_{{\text{5}}}}{\text{O}},$(3)
${\text{C}}{{{\text{H}}}_{{\text{3}}}}{{{\text{O}}}_{{\text{2}}}} + {\text{C}}{{{\text{H}}}_{{\text{3}}}}{\text{C}}{{{\text{O}}}_{{\text{3}}}} \leftrightarrow {\text{C}}{{{\text{H}}}_{{\text{3}}}}{\text{O}} + {\text{C}}{{{\text{H}}}_{{\text{3}}}}{\text{C}}{{{\text{O}}}_{2}} + {{{\text{O}}}_{2}},$(4)
${{{\text{C}}}_{{\text{2}}}}{{{\text{H}}}_{{\text{4}}}} + {\text{C}}{{{\text{H}}}_{{\text{3}}}}{{{\text{O}}}_{2}} \to {{{\text{C}}}_{{\text{2}}}}{{{\text{H}}}_{{\text{4}}}}{\text{O}} + {\text{C}}{{{\text{H}}}_{{\text{3}}}}{\text{O}},$(5)
${{{\text{C}}}_{{\text{2}}}}{{{\text{H}}}_{{\text{4}}}} + {{{\text{C}}}_{{\text{2}}}}{{{\text{H}}}_{{\text{5}}}}{{{\text{O}}}_{{\text{2}}}} \to {{{\text{C}}}_{{\text{2}}}}{{{\text{H}}}_{{\text{4}}}}{\text{O}} + {{{\text{C}}}_{{\text{2}}}}{{{\text{H}}}_{{\text{5}}}}{\text{O}},$(6)
${{{\text{C}}}_{{\text{2}}}}{{{\text{H}}}_{{\text{4}}}} + n{\text{ - }}{{{\text{C}}}_{{\text{3}}}}{{{\text{H}}}_{{\text{7}}}}{{{\text{O}}}_{2}} \to {{{\text{C}}}_{{\text{2}}}}{{{\text{H}}}_{{\text{4}}}}{\text{O}} + n{\text{ - }}{{{\text{C}}}_{{\text{3}}}}{{{\text{H}}}_{{\text{7}}}}{\text{O}},$(7)
${{{\text{C}}}_{{\text{2}}}}{{{\text{H}}}_{{\text{4}}}} + i{\text{ - }}{{{\text{C}}}_{{\text{3}}}}{{{\text{H}}}_{{\text{7}}}}{{{\text{O}}}_{2}} \to {{{\text{C}}}_{{\text{2}}}}{{{\text{H}}}_{{\text{4}}}}{\text{O}} + i{\text{ - }}{{{\text{C}}}_{{\text{3}}}}{{{\text{H}}}_{{\text{7}}}}{\text{O}},$(8)
${{{\text{C}}}_{{\text{3}}}}{{{\text{H}}}_{{\text{6}}}} + {\text{C}}{{{\text{H}}}_{{\text{3}}}}{{{\text{O}}}_{{\text{2}}}} \to {{{\text{C}}}_{{\text{3}}}}{{{\text{H}}}_{{\text{6}}}}{\text{O}} + {\text{C}}{{{\text{H}}}_{{\text{3}}}}{\text{O}},$(9)
${{{\text{C}}}_{{\text{3}}}}{{{\text{H}}}_{6}} + {{{\text{C}}}_{{\text{2}}}}{{{\text{H}}}_{{\text{5}}}}{{{\text{O}}}_{{\text{2}}}} \to {{{\text{C}}}_{{\text{3}}}}{{{\text{H}}}_{{\text{6}}}}{\text{O}} + {{{\text{C}}}_{{\text{2}}}}{{{\text{H}}}_{{\text{5}}}}{\text{O}},$(10)
${{{\text{C}}}_{{\text{3}}}}{{{\text{H}}}_{{\text{6}}}} + n{\text{ - }}{{{\text{C}}}_{{\text{3}}}}{{{\text{H}}}_{{\text{7}}}}{{{\text{O}}}_{2}} \to {{{\text{C}}}_{{\text{3}}}}{{{\text{H}}}_{{\text{6}}}}{\text{O}} + n{\text{ - }}{{{\text{C}}}_{{\text{3}}}}{{{\text{H}}}_{{\text{7}}}}{\text{O}},$(11)
${{{\text{C}}}_{{\text{3}}}}{{{\text{H}}}_{6}} + i{\text{ - }}{{{\text{C}}}_{{\text{3}}}}{{{\text{H}}}_{{\text{7}}}}{{{\text{O}}}_{2}} \to {{{\text{C}}}_{{\text{3}}}}{{{\text{H}}}_{{\text{6}}}}{\text{O}} + i{\text{ - }}{{{\text{C}}}_{{\text{3}}}}{{{\text{H}}}_{{\text{7}}}}{\text{O}},$(12)
${{{\text{C}}}_{{\text{3}}}}{{{\text{H}}}_{{\text{6}}}} + {\text{C}}{{{\text{H}}}_{{\text{3}}}}{\text{CO}} \to {{{\text{C}}}_{{\text{3}}}}{{{\text{H}}}_{{\text{6}}}}{\text{O}} + {\text{C}}{{{\text{H}}}_{{\text{3}}}}{\text{C}}{{{\text{O}}}_{{\text{2}}}}.$Экспериментально измеренные константы скорости эпоксидирования этилена и пропилена алкилпероксильными радикалами взяты из работы [59].
Важную роль в процессах окисления углеводородов играют реакции разветвления, поэтому в механизм NUIGMech 1.1 была добавлена реакция мономолекулярного распада метилгидропероксида:
(13)
${\text{C}}{{{\text{H}}}_{{\text{3}}}}{{{\text{O}}}_{{\text{2}}}}{\text{H}} \to {\text{C}}{{{\text{H}}}_{{\text{3}}}}{\text{O}} + {\text{OH}},$Поскольку при низких давлениях заметную роль играют реакции, протекающие на стенках реактора, механизм был дополнен рядом гетерогенных реакций, в частности, реакциями гетерогенного нерадикального распада гидропероксидов:
(14)
${\text{C}}{{{\text{H}}}_{{\text{3}}}}{{{\text{O}}}_{{\text{2}}}}{\text{H}} \to {\text{C}}{{{\text{H}}}_{{\text{4}}}} + {{{\text{O}}}_{2}},$(15)
${{{\text{C}}}_{{\text{2}}}}{{{\text{H}}}_{{\text{5}}}}{{{\text{O}}}_{{\text{2}}}}{\text{H}} \to {{{\text{C}}}_{{\text{2}}}}{{{\text{H}}}_{{\text{6}}}} + {{{\text{O}}}_{2}},$(16)
$i{\text{ - }}{{{\text{C}}}_{{\text{3}}}}{{{\text{H}}}_{{\text{7}}}}{{{\text{O}}}_{{\text{2}}}}{\text{H}} \to {{{\text{C}}}_{{\text{3}}}}{{{\text{H}}}_{{\text{8}}}} + {{{\text{O}}}_{2}},$(17)
$n{\text{ - }}{{{\text{C}}}_{{\text{3}}}}{{{\text{H}}}_{{\text{7}}}}{{{\text{O}}}_{{\text{2}}}}{\text{H}} \to {{{\text{C}}}_{{\text{3}}}}{{{\text{H}}}_{{\text{8}}}} + {{{\text{O}}}_{2}},$(18)
${\text{H}}{{{\text{O}}}_{{\text{2}}}} \to {{{\text{O}}}_{{\text{2}}}}{\text{H}}\left( {{\text{NRP}}} \right),$(19)
${{{\text{H}}}_{{\text{2}}}}{{{\text{O}}}_{{\text{2}}}} \to 0.5{{{\text{O}}}_{2}} + {{{\text{H}}}_{2}},$В связи с тем, что кинетические данные по указанным гетерогенным реакциям отсутствуют, константы их скорости khet рассчитывали по формуле
где $v = ({{8{{k}_{B}}T} \mathord{\left/ {\vphantom {{8{{k}_{B}}T} {\pi {{M}_{m}}}}} \right. \kern-0em} {\pi {{M}_{m}}}})$ – средняя скорость теплового движения частиц, Mm – молярная масса, kB – константа Больцмана, γ – вероятность захвата частицы поверхностью реактора, S и V – внутренняя поверхность и объем реактора соответственно.Коэффициент аккомодации γ при соударении активных частиц с поверхностью молибденового и кварцевого стекла обычно меняется в пределах γ ≈ 10–5–10–2 [60]. Значения γ из отмеченного интервала подбирали для получения удовлетворительного согласия с экспериментальными данными и с учетом существенного различия значений для радикальных и молекулярных реакционных интермедиатов.
Дополненные стадии продолжения цепи в реакциях пероксильных радикалов между собой и в реакциях эпоксидирования с их участием, в результате которых пероксильные радикалы, являющие источниками гидропероксидов, трансформируются в алкоксильные, а также реакции гетерогенной дезактивации гидропероксидов, пероксида водорода и гидропероксильного радикала сдерживают образование пероксильных радикалов и пероксидных соединений. В результате этого регулируется скорость автоинициирования – вырожденного разветвления цепей и скорость реакции в целом.
Применение модифицированного нами механизма NUIGMech 1.1 позволило достаточно точно описать кинетику расходования исходных реагентов – пропана и кислорода (рис. 1). Максимальные концентрации продуктов, полученные на основе модифицированного механизма NUIGMech 1.1, приведены в табл. 1.
Рис. 1.
Расчет кинетики расхода пропана и кислорода в статическом реакторе с использованием модифицированного механизма NUIGMech 1.1: – результаты моделирования, сплошные линии, точки – экспериментальные данные. P = 250 Торр, T = 623 K, соотношение реагентов – C3H8 : O2 = 1 : 1.
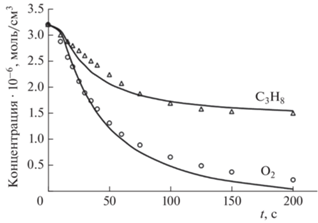
Как видно из данных, приведенных на рис. 1 и в табл. 1, модифицированный механизм NUIGMech 1.1 демонстрирует хорошее соответствие расчетных максимальных значений концентрации продуктов окисления пропана и экспериментальных результатов. Единственным продуктом, для которого не удалось получить хорошего соответствия с экспериментом, является ацетальдегид. Одной из возможных причин этого может быть неучтенная в модифицированном механизме возможность гетерогенных процессов его образования и расхода в реальном реакторе. Рассчитанная суммарная концентрация алкилпероксильных радикалов составляет 2.12 · 10–10 моль/см3. Экспериментально измеренная концентрация алкилпероксильных радикалов при окислении пропана составляет (0.5÷2.9) · 10–10 моль/см3 [57, 61–63].
МОДЕЛИРОВАНИЕ ОКИСЛЕНИЯ ПРОПАНА В ПРОТОЧНОМ РЕАКТОРЕ
Также была проанализирована возможность адекватного описания окислительного крекинга пропана в проточном лабораторном реакторе в диапазонах температур 773–1023 K и давлений 1–2 атм. Начальное соотношение пропан/кислород лежало в диапазоне ~1–3. Длина реактора составляла 350 мм, внутренний диаметр – 14 мм. Отношение площади внутренней поверхности реактора к его объему (S/V) в рабочей части с учетом поверхности “карманов” для термопар составляло 5.4 см–1. Реактор нагревался тремя независимыми электронагревателями, что позволяло поддерживать постоянный температурный профиль по длине высокотемпературной зоны реактора, которая составляла 200 мм. Более подробное описание лабораторной установки приведено в работах [43, 64].
Полученные экспериментальные температурные зависимости изменения концентрации реагентов и основных продуктов оксикрекинга пропана на выходе из реактора показаны на рис. 2 символами. Там же приведены результаты моделирования на основании специально отобранных, наиболее адекватных из опубликованных в литературе механизмов San Diego [24] и UBC [65], которые точнее других отражали полученную температурную зависимость.
Рис. 2.
Температурная зависимость конверсии пропана (а) и кислорода (б): экспериментальные данные (◼), результаты моделирования по механизмам San Diego (⚪) и UBC (▽); Р = 1 атм. [C3H8]0 = 5.6%, [O2]0 = 1.9%, газ-разбавитель – азот, время пребывания газовой смеси в реакторе τ = 2.02 ± 0.05 с.
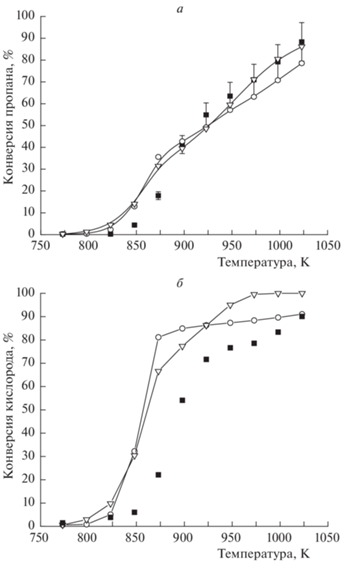
Одним из наиболее важных параметров оксикрекинга пропана является максимально достигаемая концентрация пропилена. Практически все модели показывают достижение максимума концентрации пропилена в области температур 825–850 K. Для кинетической модели San Diego и ряда других температура, при которой наблюдается концентрационный максимум, соответствует ~873 К, что ниже экспериментальной на ~50 К (рис. 3). Поскольку все традиционные газофазные модели дают более низкую температуру начала реакции по сравнению с экспериментальными значениями, что наблюдалось и в работе [66], было сделано предположение о необходимости учета процессов на поверхности лабораторного реактора.
Рис. 3.
Температурная зависимость концентрации пропилена при окислительном крекинге пропана: экспериментальные данные (◼), результаты моделирования по механизму San Diego (⚪); Р = 1 атм, [C3H8]0 = 5.6%, [O2]0 = 1.9%, газ-разбавитель – азот, время пребывания газовой смеси в реакторе τ = 2.02 ± ± 0.05 с.
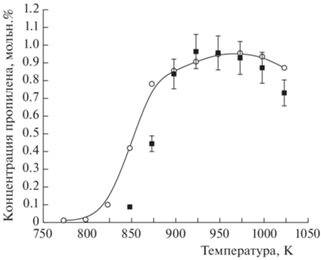
Согласно данным работы [66], оксикрекинг легких алканов протекает по цепному механизму с вырожденным разветвлением цепей в результате образования и распада пероксида водорода Н2О2, образующегося в результате взаимодействия гидропероксильного радикала ${\text{НО}}_{2}^{ \bullet }$ с алканом, с последующим разложением пероксида водорода на гидроксильные радикалы ОН•. Необходимость учета гетерогенных процессов при оксикрекинге этана, а следовательно и других легких алканов, обоснована в работе [67]. Там же была предложена методика такого учета, в том числе расчета коэффициентов аккомодации γi для взаимодействия соответствующих молекул с кварцевой поверхностью реактора. Поэтому показавший при предварительном анализе наилучшую описательную способность газофазный механизм NUIGMech 1.1 [32] был дополнен тремя гетерогенными реакциями с участием радикалов ${\text{НО}}_{2}^{ \bullet }$ и молекул H2O2, CO, которые обеспечивают превращение на поверхности реактора пероксидных радикалов и пероксида водорода в молекулы воды и кислорода, а монооксида углерода – в диоксид углерода:
(22)
${{{\text{H}}}_{{\text{2}}}}{{{\text{O}}}_{2}} \to {{{\text{H}}}_{{\text{2}}}}{{{\text{O}}}_{{2s}}},$Расчет соответствующих констант скорости и коэффициентов аккомодации частиц на поверхности для описания экспериментальных результатов по оксикрекингу пропана в кварцевом реакторе проводили по методике, описанной в работах [67–69]. Моделирование проводили в программной среде российского программного комплекса CWB 4.3 [70] на модели изотермического реактора идеального вытеснения (Plug-flow reactor).
Значения коэффициентов аккомодации частиц на поверхности реактора γi для трех гетерогенных реакций (21)–(23) подобраны согласно методике, описанной в работе [67], приведены ниже:
γ(HO2) = 2 · 10–3,
γ(H2O2) = 1.1 · 10–4,
γ(СО) = 6.7 · 10–8.
Результаты моделирования по механизму NUIGMech 1.1, дополненному гетерогенными стадиями, хорошо описывают экспериментальные результаты, что наглядно демонстрирует рис. 4 из работы [69]. Этот факт является весомым аргументом в пользу необходимости учета гетерогенных реакций в реакторах лабораторного масштаба.
Рис. 4.
Температурная зависимость концентрации пропана (а) и пропилена (б) при окислении смеси [C3H8]0 + [C3H6]0 = 4.59%, [O2]0 = 2.49%: линии – результаты моделирования с использованием модифицированного механизма NUIGMech 1.1 (см. табл. 2) при ${{\alpha }_{{{{{\text{C}}}_{{\text{3}}}}{{{\text{H}}}_{{\text{6}}}}}}}$ (%): 0 (1), 10 (2), 30 (3), 50 (4); символы – экспериментальные данные при ${{\alpha }_{{{{{\text{C}}}_{{\text{3}}}}{{{\text{H}}}_{{\text{6}}}}}}}$ = 0. Р = 1 атм, газ-разбавитель – азот.
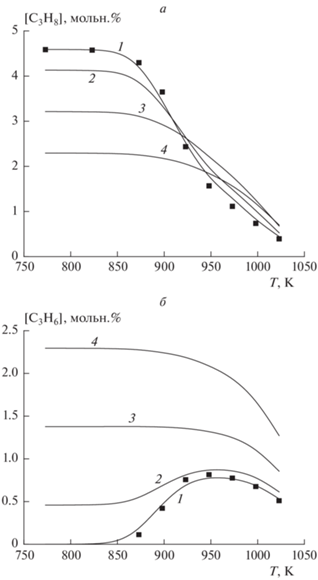
Таким образом, дополнение газофазного механизма NUIGMech 1.1 реакциями, описывающими наиболее важные гетерогенные процессы на поверхности реактора, на ~50 К повышает расчетную температуру начала быстрого роста конверсии реагентов по сравнению с традиционным газофазным механизмом, что позволяет количественно согласовать результаты расчетов с экспериментальными данными. Учет гетерогенных процессов с участием других радикалов (Н●, ОН● и др.), играющих важную роль в газофазном механизме оксикрекинга, также как и при оксикрегинге этана [67], не оказывал заметного влияния на результаты, видимо, из-за значительно более высокой скорости газофазных процессов с их участием.
МОДИФИЦИРОВАННЫЙ МЕХАНИЗМ ОКИСЛЕНИЯ ПРОПАНА ПРИ УМЕРЕННЫХ ТЕМПЕРАТУРАХ
Моделирование экспериментов в статическом и в проточном лабораторных реакторах показало, что модифицированный кинетический механизм NUIGMech 1.1 может служить основой для прогнозирования процессов окисления пропана в лабораторных реакторах при сравнительно низких температурах, а также управления этими процессами. Но с учетом всех сделанных выводов оригинальный газофазный механизм NUIGMech 1.1 [32] необходимо дополнить гетерогенными стадиями, а также реакциями с участием алкилпероксильных радикалов, реакциями эпоксидирования этилена и пропилена и реакцией мономолекулярного распада метилгидропероксида. Добавленные в механизм реакции с соответствующими константами скорости для трехпараметрической формы уравнения Аррениуса вида
представлены в табл. 2.Таблица 2.
Гомогенные и гетерогенные реакции, добавленные в механизм NUIGMech 1.1 для моделирования процесса окисления пропана
| Реакция | А | В | Е |
|---|---|---|---|
| CH3O2 + C2H5O2 ↔ O2 + CH3O + C2H5O | 1.40E+016 | –1.61E+000 | 1.86 |
| C2H5O2 + C2H5O2 ↔ O2 + C2H5O + C2H5O | 1.40E+016 | –1.61E+000 | 1.86 |
| CH3O2 + CH3CO3 ↔ CH3O + CH3CO2 + O2 | 1.40E+016 | –1.61E+000 | 1.86 |
| C2H4 + RO2 → C2H4O + RO | 0.97E+011 | 0.00 | 13.76 |
| C3H6 + RO2 → C3H6O + RO | 1.86E+011 | 0.00 | 11.75 |
| CH3O2H → CH3O + OH | 6.31E+014 | 0.00 | 42.3 |
| CH3CO2 + CH3CHO ↔ CH3CO + CH3CO2H | 3.01E+012 | 0.00 | 11.92 |
| CH3CO2 + CH2O ↔ HCO + CH3CO2H | 3.01E+012 | 0.00 | 11.92 |
| CH3CO2 + H2O2 ↔ HO2 + CH3CO2H | 3.01E+012 | 0.00 | 11.92 |
| i-C3H7O2 → O2C3H7 | 0.70E+001 | 0.00 | 0.00 |
| CH3O2H → CH4 + O2 | 0.12E+000 | 0.00 | 0.00 |
| C2H5O2H → C2H6 + O2 | 0.12E+000 | 0.00 | 0.00 |
| i-C3H7O2H → C3H8 + O2 | 0.50E+000 | 0.00 | 0.00 |
| n-C3H7O2H → C3H8 + O2 | 0.50E+000 | 0.00 | 0.00 |
| HO2 → O2H (NRP) | 2.00E+000 | 0.00 | 0.00 |
| H2O2 → O2 + H2 | 0.10E+000 | 0.00 | 0.00 |
| HO2 → HO2s | 2.97E–2 | 1.13 | 509.0 |
| H2O2 → H2O2s | 3.76E–1 | 0.50 | 320.0 |
| СО → СОs | 2.49E–4 | 0.50 | 0.0 |
С использованием полученного модифицированного механизма было проведено моделирование процесса окисления пропан-пропиленовой смеси при разной доле пропилена ${{\alpha }_{{{{{\text{C}}}_{{\text{3}}}}{{{\text{H}}}_{{\text{6}}}}}}}$ = = [C3H6]0/([C3H8]0 + [C3H6]0) (рис. 4). Приведенные на рис. 4 результаты показывают, что, вопреки ожиданиям, при совместном (сопряженном) окислении пропана и пропилена в указанных выше условиях эти углеводороды практически не оказывают влияния на конверсию друг друга, которая протекает для обоих компонентов достаточно независимо. Видимо, подобного поведения следует ожидать при окислении в подобных условиях и этан-этиленовых смесей, что подтверждается экспериментами по окислительному крекингу этан-этиленовых смесей при давлениях 1–3 атм [71, 72].
ЗАКЛЮЧЕНИЕ
Проведенные исследования показали, что представленные на сегодня в литературе механизмы окисления легких алканов NUIGMech 1.1 и AramcoMech 3.0 являются хорошей базой для описания газофазных процессов окисления и пиролиза пропана при умеренных (< 1100 K) температурах, хотя продолжается уточнение кинетических параметров отдельных реакций [72]. Однако для количественного согласования расчетных и экспериментальных данных, получаемых в реакторах лабораторного масштаба, необходимо учитывать ряд процессов, протекающих с участием активных промежуточных компонентов на поверхности реактора. Кроме того, при окислении и пиролизе пропана заметную роль играют реакции продолжения цепей с участием алкилпероксильных радикалов, в то время как реакции образования тяжелых углеводородных молекул и их дальнейшие превращения слабо влияют на конверсию пропана, поэтому их можно исключить из рассмотрения.
Результаты моделирования с использованием модифицированного указанным образом механизма NUIGMech 1.1 для работы с лабораторными реакторами показывают, что, вопреки экспериментальным наблюдениям при использовании двухсекционных реакторов [48–51], при совместном (сопряженном) окислении пропана и пропилена в условиях данной работы эти углеводороды практически не оказывают взаимного влияния на конверсию друг друга.
Исследование выполнено при финансовой поддержке Российским фондом фундаментальных исследований в рамках совместного научного проекта № 20-53-05001 и Комитета по науке Республики Армения по проекту 20RF-002.
Список литературы
Arutyunov V.S. // Rev. Chem. Eng. 2019. V. 37. P. 99; https://doi.org/10.1515/revce-2018-0057
Арутюнов В.С., Савченко В.И., Седов И.В., Никитин А.В. // Катализ в пром-сти. 2021. Т. 21. № 4. С. 227; https://doi.org/10.18412/1816-0387-2021-4-227-237
Savchenko V.I., Nikitin A.V., Zimin Y.S. et al. // Chem. Eng. Res. Des. 2021. V. 175. P. 250; https://doi.org/10.1016/j.cherd.2021.09.009
Krieck M., Günther M., Pischinger S., Kramer U., Thewes M. // SAE Intern. J. Engines. 2016. V. 9. № 1. P. 237; https://doi.org/10.4271/2015-01-1947
Morganti K.J., Brear M.J., da Silva G., Yang Y., Dryer F.L. // Proc. Combust. Inst. 2015. V. 35. P. 2933; https://doi.org/10.1016/j.proci.2014.06.070
Morganti K.J., Foong T.M., Brear M.J. et al. // Fuel. 2013. V. 108. P. 797; https://doi.org/10.1016/j.fuel.2013.01.072
Ramalingam A.K., Krieck M., Pischinger S., Heufer K.A. // Energy Fuels. 2020. V. 34. P. 2323; https://doi.org/10.1021/acs.energyfuels.9b03695
Zettervall N., Fureby C., Nilsson E.J.K. // Fuels. 2021. V. 2. P. 210; https://doi.org/10.3390/fuels2020013
GRI-Mech 3.0 // http://combustion.berkeley.edu/ gri_mech/releases.html
Curran H.J. // Proc. Combust. Inst. 2019. V. 37. № 1. P. 57; https://doi.org/10.1016/j.proci.2018.06.054
Metcalfe W.K., Burke S.M., Ahmed S.S., Curran H.J. // Intern. J. Chem. Kinet. 2013. V. 45. P. 638; https://doi.org/10.1002/kin.20802
Kee R.J., Rupley F.M., Miller J.A. et al. “CHEMKIN Release 4.0”. San Diego, CA, USA: Reaction Design, Inc., 2004.
Leungand K.M., Lindstedt R.P. // Combust. and Flame. 1995. V. 102. № 1. P. 129; https://doi.org/10.1016/0010-2180(94)00254-P
Refael S., Sher E. // Ibid. 1989. V. 78. № 3. P. 326; https://doi.org/10.1016/0010-2180(89)90021-7
Starik A.M., Titova N.S., Yanovskii L.S. // Kinet. Catal. 1999. V. 40. № 1. P. 7.
Petrova M.V., Williams F.A. // Combust. and Flame. 2006. V. 144. № 3. P. 526; https://doi.org/10.1016/j.combustflame.2005.07.016
Konnov A.A. // Proc. Combust. Inst. 2000. V. 28. Pap. 317.
Koert D.N., Pitz W.J., Bozzelli J.W., Cernansky N.P. // Proc. 26th Sympos. (Intern.) on Combust. Pittsburgh: The Combust. Inst., 1996. P. 633; https://doi.org/10.1016/S0082-0784(96)80270-0
Dagaut P., Cathonnet M., Boettner J.-C. // Intern. J. Chem. Kinet. 1992. V. 24. № 9. P. 813; https://doi.org/10.1002/kin.550240906
AramcoMech version 3.0, 2018; http://c3.nuigalway.ie/combustionchemistrycentre/mechanismdownloads/
Savchenko V.I., Zimin Ya.S., Nikitin A.V., Sedov I.V., Arutyunov V.S. // J. CO2 Util. 2021. V. 47. P. 101490; https://doi.org/10.1016/j.jcou.2021.101490
Савченко В.И., Зимин Я.С., Никитин А.В., Седов И.В., Арутюнов В.С. // Нефтехимия. 2021. Т. 61. № 4. С. 520; https://doi.org/10.31857/S0028242121040079
Prince J.C., Williams F.A. // Combust. Flame. 2012. V. 159. № 7. P. 2336; https://doi.org/10.1016/j.combustflame.2012.02.012
The San Diego Mechanism; https://web.eng.ucsd.edu/ mae/groups/combustion/mechanism.html
Трошин К.Я., Никитин А.В., Борисов А.А., Арутюнов В.С. // Горение и взрыв. 2015. Т. 8. № 1. С. 42.
Трошин К.Я., Никитин А.В., Борисов А.А., Арутюнов В.С. // Горение и взрыв. 2016. Т. 9. № 2. С. 23.
Трошин К.Я., Никитин А.В., Борисов А.А., Арутюнов В.С. // Физика горения и взрыва. 2016. Т. 52. № 4. С. 15; https://doi.org/10.15372/FGV20160402
Трошин К.Я., Никитин А.В., Беляев А.А. и др. // Физика горения и взрыва. 2019. Т. 55. № 5. С. 17; https://doi.org/10.15372/FGV20190502
Арутюнов А.В., Беляев А.А., Никитин А.В., Трошин К.Я., Арутюнов В.С. // Горение и взрыв. 2019. Т. 12. № 3. С. 14; https://doi.org/10.30826/CE19120302
Arutyunov A.V., Troshin K.Ya., Nikitin A.V., Belyaev A.A., Arutyunov V.S. // J. Phys. Conf. Ser. 2018. P. 012 153; https://doi.org/10.1088/1742-6596/1141/1/012153
Arutyunov V., Troshin K., Nikitin A. et al. // Chem. Eng. J. 2020. V. 381. P. 122706; https://doi.org/10.1016/j.cej.2019.122706
NUIGMech 1.1; http://c3.nuigalway.ie/combustionchemistrycentre/mechanismdownloads/
Titova N.S., Kuleshov P.S., Starik A.M. // Combust. Explos. Shock Waves (Novosibirsk). 2011. V. 47. № 3. P. 249; https://doi.org/10.1134/S0010508211030014
Zádor J., Taatjes C.A., Fernandes R.X. // Prog. Energy. Combust. Sci. 2011. V. 37. P. 371; https://doi.org/10.1021/acs.energyfuels.6b01071
Ramalingam A., Panigrahy S., Fenard Y., Curran H., Heufer R.A. // Combust. and Flame. 2021. V. 223. P. 361; https://doi.org/10.1016/j.combustflame.2019.10.015
Ramalingam A., Fenard Y., Heufer A. // Ibid. 2020. V. 211. P. 392; https://doi.org/10.1016/j.combustflame.2019.10.015
Zhou C.-W., Li Y., Burke U. et al. // Ibid. 2018. V. 197. P. 423; https://doi.org/10.1016/j.combustflame.2018.08.006
Badra J., Khaled F., Giri B.R. // Phys. Chem. Chem. Phys. 2015. V. 17. P. 24477; https://doi.org/10.1039/C4CP04322G
Burke S.M., Metcalfe W., Herbinet O. et al. // Combust. and Flame. 2014. V. 161. P. 2765; https://doi.org/10.1016/j.combustflame.2014.05.010
Burke S.M., Burke U., McDonagh R. et al. // Ibid. 2015. V. 162. P. 296; https://doi.org/10.1016/j.combustflame.2014.07.032
Беляев А.А., Никитин А.В., Токталиев П.Д. и др. // Горение и взрыв. 2018. Т. 11. № 1. С. 19; https://doi.org/10.30826/ce18110102
Naik C.V., Dean A.M. // Combust. and Flame. 2006. V. 145. P. 16; https://doi.org/10.1016/j.combustflame.2005.12.006
Arutyunov V.S., Magomedov R.N., Proshina A.Yu., Strekova L.N. // Chem. Eng. J. 2014. V. 238. P. 9; http:// dx.doi.org/https://doi.org/10.1016/j.cej.2013.10.009
Davidson D.F., Herbon J.T., Horning D.C., Hanson R.K. // Intern. J. Chem. Kinet. 2001. V. 33. № 12. P. 775; https://doi.org/10.1002/kin.10000
Lifshitz A., Frenklach M. // J. Phys. Chem. 1975. V. 79. № 7. P. 686; https://doi.org/10.1021/j100574a004
Кталхерман М.Г., Намятов И.Г., Емелькин В.А., Поздняков Б.А. // Теплофизика высоких температур. 2009. Т. 47. № 5. С. 741; https://doi.org/10.1134/S0018151X09050137
Погосян Н.М., Погосян М.Д., Арсентьев С.Д. и др. // Хим. физика. 2015. Т. 34. № 4. С. 29;
Погосян Н.М., Погосян М.Д., Арсентьев С.Д. и др. // Нефтехимия. 2016. Т. 56. № 6. С. 612; https://doi.org/10.7868/S0028242116060174
Погосян Н.М., Погосян М.Д., Шаповалова О.В., Никитин А.В., Арутюнов В.С. // Хим. физика. 2016. Т. 35. № 12. С. 30; https://doi.org/10.7868/S0207401X16110078
Arutyunov V., Pogosyan N., Pogosyan M. Et al. // Chem. Eng. J. 2017. V. 329. P. 231; https://doi.org/10.1016/j.cej.2017.05.109
Погосян Н.М., Погосян М.Дж., Шаповалова О.В. и др. Коллективная монография. Технологическое горение / Под. ред. Алдошина С.М. М.: Изд-во РАН, 2018. С. 114; https://doi.org/10.31857/S9785907036383000005
Cord M., Husson B., Huerta J.C.H. et al. // J. Phys. Chem. A. 2012. V. 116. P. 12214; https://doi.org/10.1021/jp309821z
Поладян Е.А. Дис. … канд. хим. наук. Механизм окисления пропана в области отрицательного температурного коэффициента максимальной скорости реакции. Ереван: Ереванский ун-т, 1976.
Программный продукт ANSYS Academic Research CFD. Лицензия ФИЦ ХФ РАН идентифицируется по Customer ID:1080307.
Kuang C.L., Chuang-Te C. // Fuel. 2017. V. 203. P. 102; https://doi.org/10.1016/j.fuel.2017.04.064
Mantashyan A.A., Khachatryan L.A., Niazyan O.M., Arsentyev S.D. // Combust. and Flame. 1981. V. 43. P. 221; https://doi.org/10.1016/0010-2180(81)90022-5
Поладян Е.А., Григорян Г.Л., Хачатрян Л.А., Манташян А.А. // Кинетика и катализ. 1976. Т. 17. № 2. С. 304.
Григорян Р.Р., Арсентьев С.Д. // Нефтехимия. 2020. Т. 60. № 2. С. 206; https://doi.org/10.31857/S0028242120020057
Григорян Р.Р., Арсентьев С.Д., Манташан А.А. // Нефтехимия. 2011. Т. 51. № 6. С. 456.
Семенов Н.Н. О некоторых проблемах химической кинетики и реакционной способности. Т. 1. М.: Изд-во АН СССР, 1958.
Mantashyan A.A., Gookasyan P.S., Sayadyan R.H. // React. Kinet. Catal. Lett. 1979. V. 11. № 3. P. 225; https://doi.org/10.1007/BF02067830
Григорян Р.Р., Арсентьев С.Д., Манташян А.А. Сб. “Химия и хим. технология”. Ереван: Изд-во Ереванского ун-та, 1983. Выпуск 2. С. 15.
Манташян А.А. // Хим. физика. 1996. Т. 15. № 4. С. 75.
Дмитрук А.С., Никитин А.В., Стрекова Л.Н., Арутюнов В.С. // Горение и взрыв. 2016. Т. 9. № 3. С. 21.
Huang J., Bushe W.K. // Combust. and Flame. 2006. V. 144. P. 74; https://doi.org/10.1016/j.combustflame.2005.06.013
Miller J.A., Klippenstein S.J. // Intern. J. Chem. Kinet. 2001. V. 33. P. 654; https://doi.org/10.1002/kin.1063
Брюков М.Г., Паланкоева А.С., Беляев А.А., Арутюнов В.С. // Кинетика и катализ. 2021. Т. 62. № 6. С. 666; https://doi.org/10.31857/S0453881121060022
Паланкоева А.С., Зимин Я.С., Брюков М.Г., Беляев А.А., Арутюнов В.С. // Горение и взрыв. 2021. Т. 14. № 4. С. 42; https://doi.org/10.30826/CE21140405
Паланкоева А.С., Беляев А.А., Арутюнов В.С. // Хим. физика. 2022. Т. 41. № 6. С. 7; https://doi.org/10.31857/s0207401x22060097
Chemical Workbench 4.3; http://www.kintechlab. com/products/chemical-workbench/
Озерский А.В., Старостин А.Д., Никитин А.В., Арутюнов В.С. // Горение и взрыв. 2022. Т. 15. № 1. С. 30; https://doi.org/10.30826/ce22150104
Давтян А.Г., Манукян З.О., Арсентьев С.Д. и др. // Хим. физика. 2023. Т. 42. № 4. (в печати).
Дополнительные материалы отсутствуют.
Инструменты
Химическая физика


