Химическая физика, 2021, T. 40, № 9, стр. 3-7
Электрическое стимулирование каталитической активности палладиевых наноразмерных покрытий при окислении СО
М. В. Гришин 1, А. К. Гатин 1, В. Г. Слуцкий 1, *, А. С. Федотов 2, В. А. Харитонов 1, Б. Р. Шуб 1
1 Федеральный исследовательский центр химической физики им. Н.Н. Семёнова
Российской академии наук
Москва, Россия
2 Институт нефтехимического синтеза им. А.В. Топчиева Российской академии наук
Москва, Россия
* E-mail: slutsky@chph.ras.ru
Поступила в редакцию 11.03.2020
После доработки 10.12.2020
Принята к публикации 22.02.2021
Аннотация
Измерено увеличение скорости каталитического окисления СО на палладиевых наноразмерных покрытиях при подаче на покрытия электрического напряжения различной полярности и величины от внешнего источника. В условиях эксперимента при 330 °С, атмосферном давлении и начальном составе смеси 1.8% СО + 10.2% О2 + Ar подача на покрытие положительного напряжения +10 или +30 В приводит к увеличению скорости окисления СО на 14% или 42% соответственно. Подача отрицательного напряжения –10 или –30 В приводит к меньшему ускорению окисления – на 4% или 12%. Показано, что эффект от подачи напряжения не зависит от размера частиц в покрытии и линейно растет с ростом напряжения. Выполнены квантовохимические расчеты теплот ассоциации СО и О2 с простейшим нейтральным или электрически заряженным кластерами палладия Pd2. Установлено, что создание на Pd2 положительного заряда приводит к уменьшению разницы между теплотами ассоциации СО и О2 на 16.7 ккал/моль, в то время как создание на Pd2 отрицательного заряда приводит к меньшему эффекту – уменьшению указанной разницы на 10.6 ккал/моль. По результатам расчетов предложено объяснение увеличения скорости каталитического окисления СО на палладии, электрически заряженном с помощью внешнего источника напряжения.
ВВЕДЕНИЕ
Наноразмерные покрытия из палладия или платины используются в качестве катализаторов окисления СО в автомобильных конверторах, предназначенных для повышения экологической чистоты отработанных газов двигателей внутреннего сгорания [1–4]. Увеличение активности указанных покрытий способно повысить эффективность конверторов, сократить количество требуемых для конверсии дорогостоящих палладия или платины, что позволит удешевить конверторы и расширить область их применения.
В настоящее время основным приемом, позволяющим влиять на активность каталитических наноразмерных покрытий, является варьирование материала подложки, на которую наносится покрытие (см. обзоры [5, 6]). В общем случае подложка может оказывать следующее воздействие на состояние нанесенных на нее наночастиц: предотвращать их слипание либо способствовать противоположному процессу, изменять форму, состав и заряд наночастиц, стабилизировать промежуточные продукты реакции. В результате описанных выше эффектов взаимодействия в системе наночастица–подложка химические свойства первых могут изменяться в широких пределах. Взаимосвязь каталитических свойств и структуры, электронных свойств, природы подложки и других параметров структурированных на наноуровне покрытий рассмотрена в ряде работ, например [7–13].
Возможность увеличения активности платиновых наноразмерных покрытий методом подачи на них электрического напряжения от внешнего источника установлена нами впервые на примерах каталитического разложения аммиака [14], гидрирования этилена [15] и окисления СО [16, 17] на указанных покрытиях. Обнаружено, что подача на покрытия умеренного положительного напряжения (до +30 В) способна увеличить скорости гидрирования C2H4, разложения NH3 и окисления СО на 40–70%. В то же время эффект от подачи на покрытия аналогичного отрицательного напряжения был существенно ниже. Предложено объяснение полученных результатов, связывающее увеличение каталитической активности платиновых покрытий с электрическим зарядом, возникающим на платине при подаче на нее напряжения.
Возможность увеличения каталитической активности палладиевых наноразмерных покрытий при окислении СО разрабатываемым методом подачи напряжения на них впервые продемонстрирована в наших опытах, представленных в работе [18]. В условиях эксперимента [18] подача на платиновое покрытие напряжения +10 В приводила к увеличению скорости окисления СО на 14%.
Данная работа продолжает экспериментальные исследования [18], расширяя как диапазон, так и полярность подаваемого на палладиевые наноразмерные покрытия электрического напряжения. Кроме того, выполнены квантовохимические расчеты теплот ассоциации СО и О2 с простейшим нейтральным или электрически заряженным кластерами палладия Pd2, поясняющие влияние подаваемого на палладий напряжения на его каталитическую активность при окислении СО.
ЭКСПЕРИМЕНТАЛЬНЫЕ УСЛОВИЯ
Эксперименты по окислению СО в смеси с начальным составом 1.8% СО + 10.2% О2 + Ar проводили при температуре 330 °С и атмосферном давлении в прогреваемой статической установке. Реактор установки состоял из стеклянной трубки длиной 250 мм с внутренним диаметром 5 мм, снабженной вентилями входа, выхода и отбора проб продуктов реакции. Внутри реактора размещалась алюминиевая пластина размером 100 × 3 мм с нанесенным на нее с двух сторон палладиевым наноразмерным покрытием. Пластину подсоединяли к незаземленной клемме источника напряжения, а заземленную клемму соединяли с металлической фольгой, охватывающей стеклянную трубку реактора. Подробное описание установки приведено в работе [18].
Нанесение покрытия осуществляли следующим образом. Вначале на каждую из сторон пластины наносили и высушивали на воздухе 150 мкл водного раствора нитрата палладия Pd(NO3)2 с содержанием металла 0.3 ⋅ 10–2 мг/мл. Затем пластину размещали в реакторе, где в потоке водорода с расходом 30 мл/мин прогревали до 480 °С в течение 4 ч. При этом происходило разложение Pd(NO3)2 и образование палладиевого наноразмерного покрытия. По данным сканирующей туннельной микроскопии созданное таким способом покрытие состояло из наночастиц палладия с характерным размером в 0.5–5 нм [18].
Эксперименты по окислению СО начинали с прогрева реактора до 330 °С в потоке исходной смеси с расходом 30 мл/мин. После этого проводили несколько серий экспериментов. В первой серии электрическое напряжение U на образец с палладиевым покрытием не подавали, U = 0. Первый опыт этой серии начинали сразу по достижении реактором температуры в 330 °С. После этого реактор дополнительно продували исходной смесью с указанным расходом в течение 5 мин. Затем вентили входа и выхода из реактора закрывали, заполнившую реактор смесь выдерживали в нем в течение 10 мин, после чего с помощью подсоединенного к реактору шприца проводили отбор пробы из реактора для хроматографического анализа состава продуктов реакции. Затем реактор снова продували исходной смесью (время продувки – 5 мин, расход смеси – 30 мл/мин) и аналогично проводили второй опыт с целью подтверждения полученного в первом опыте результата.
После завершения первой серии на образец подавали положительное напряжение U = +10 В и начинали вторую серию экспериментов. Реактор снова продували исходной смесью в течение 5 мин с расходом смеси 30 мл/мин, закрывали вентили и выдерживали смесь в течение 10 мин; осуществляли отбор пробы из реактора и хроматографическим анализом определяли содержание СО и СО2 в отобранной пробе. Подобная процедура проводилась дважды. Затем напряжение отключали, U = 0, и по той же методике, что и в экспериментах с подачей напряжения на образец, определяли состав продуктов реакции при отсутствии напряжения на палладиевом покрытии. Повторное проведение экспериментов при U = 0 связано с тем, что подача на образец напряжения приводит к частичному уносу с образца заряженных палладиевых наночастиц под действием электрического поля и последующему уносу этих частиц из реактора во время его продувки свежей смесью [18]. Вследствие этого для корректного определения влияния напряжения на конверсию СО в СО2 данные по конверсии с подачей напряжения должны сравниваться с данными по конверсии при U = 0, полученными после подачи напряжения.
Затем аналогичным образом проводились еще три серии экспериментов с U = –10 В и U = 0, U = = +30 В и U = 0, U = –30 В и U = 0.
Для оценки влияния материала подложки на окисление СО проводили контрольные опыты, в которых использовали алюминиевую пластину без покрытия. Опыты проводили по той же методике, что и с палладиевым покрытием.
ЭКСПЕРИМЕНТАЛЬНЫЕ РЕЗУЛЬТАТЫ
На рис. 1 приведены экспериментальные данные по степени превращения (конверсии) СО в СО2:
(1)
${{\left[ {{\text{C}}{{{\text{O}}}_{{\text{2}}}}} \right]} \mathord{\left/ {\vphantom {{\left[ {{\text{C}}{{{\text{O}}}_{{\text{2}}}}} \right]} {{{{\left[ {{\text{CO}}} \right]}}_{0}}}}} \right. \kern-0em} {{{{\left[ {{\text{CO}}} \right]}}_{0}}}} = {{\left[ {{\text{C}}{{{\text{O}}}_{{\text{2}}}}} \right]} \mathord{\left/ {\vphantom {{\left[ {{\text{C}}{{{\text{O}}}_{{\text{2}}}}} \right]} {\left( {\left[ {{\text{CO}}} \right] + \left[ {{\text{C}}{{{\text{O}}}_{{\text{2}}}}} \right]} \right)}}} \right. \kern-0em} {\left( {\left[ {{\text{CO}}} \right] + \left[ {{\text{C}}{{{\text{O}}}_{{\text{2}}}}} \right]} \right)}}$Рис. 1.
Конверсия СО на палладиевом наноразмерном покрытии при различных напряжениях, подаваемых на покрытие: черные метки – конверсия при последовательной подаче положительных и отрицательных напряжений; светлые метки – конверсия при U = 0 как до подачи напряжения, так и после подачи напряжений, указанных на оси абсцисс.
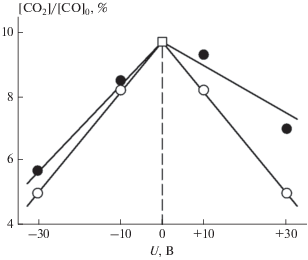
при последовательной подаче на образец как положительного, так и отрицательного напряжения (черные метки). Там же приведены данные по конверсии при U = 0 как до подачи напряжения на образец, так и после каждой подачи напряжения (светлые метки). Как следует из рисунка, при U = 0 конверсия уменьшается после подачи на образец как положительного, так и отрицательного напряжения. Так, после подачи на образец +10 или –10 В конверсия СО в последующих опытах с U = 0 падает на 15% по сравнению с конверсией при U = 0 до подачи напряжения, а после подачи на образец +30 или –30 В конверсия падает на 48% по сравнению конверсией СО в начальных опытах до подачи напряжения. Это означает, что при подаче напряжения на образец и возникновении заряда на палладиевых наночастицах часть из них уносится с поверхности образца под действием электрического поля с последующим уносом из реактора во время его продувки. В результате количество наночастиц на поверхности образца уменьшается, что и объясняет падение каталитической активности образца после подачи на него напряжения.
Отметим, что при последовательном увеличении подаваемого на образец напряжения с его поверхности также последовательно уносятся вначале мелкие, а затем более крупные заряженные палладиевые частицы благодаря лучшему сцеплению крупных частиц с разномасштабными неоднородностями на поверхности подложки. При этом предложенная методика проведения опытов позволяет определять влияние (или отсутствие влияния) размера частиц палладия на эффект увеличения их каталитической активности при подаче на них напряжения.
Установленный эффект уноса означает, что для корректного определения влияния напряжения на каталитическую активность образца с палладиевым нанопокрытием необходимо сравнивать конверсию СО при подаче напряжения с конверсией СО при U = 0 после подачи напряжения. Такое сравнение приведено на рис. 2.
Рис. 2.
Увеличение конверсии СО на палладиевом покрытии при подачи на него электрического напряжения.
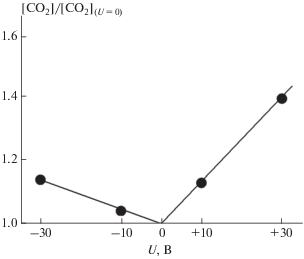
Из рис. 2 следует, что эффект увеличения конверсии при подаче на покрытие положительного напряжения составляет 14% или 42% для U = +10 или +30 В соответственно. В то же время эффект от подачи отрицательного напряжения существенно ниже, составляя 4% или 12% для U = –10 В или U = = –30 В соответственно.
Из рисунка следует также, что в опытах с положительным напряжением увеличение конверсии растет пропорционально подаваемому напряжению с коэффициентом роста 1.4%/В. Этот коэффициент одинаков как для относительно малых частиц в опытах с U = +10 В, так и для более крупных частиц в опытах с U = +30 В. Это означает, что эффект от подачи положительного напряжения не зависит от размера частиц палладия в покрытии и линейно растет с ростом подаваемого напряжения. Аналогичный эффект имеет место и в опытах с отрицательным напряжением, однако в этом случае коэффициент роста конверсии существенно ниже, составляя 0.4%/В. Отметим, что в контрольных опытах с образцом без палладиевого покрытия конверсия CO не наблюдалась как при U = 0, так и при подаче на образец напряжения.
КВАНТОВОХИМИЧЕСКИЕ РАСЧЕТЫ
Известно, что теплота адсорбции (ассоциации) СО на палладии существенно превышает теплоту адсорбции О2 на палладии – по разным данным на 7–12 ккал/моль [19–21]. Вследствие этого при температуре T ∼ 800 °С, характерной для отработанных газов автомобильных двигателей, концентрация O2 на поверхности палладия в десятки раз меньше концентрации СО и именно концентрация О2 определяет скорость каталитического окисления СО на палладии.
Для объяснения обнаруженного в наших экспериментах влияния напряжения на каталитическую активность наноразмерного палладия при окислении СO мы провели квантовохимические расчеты теплот ассоциации СО и О2 с простейшим электрически нейтральным или заряженным кластерами палладия – димером Pd2 (заряд возникает на палладии при подаче на него положительного или отрицательного напряжения). Расчеты проводились в рамках теории функционала плотности с использованием программного пакета OpenMX-3.7 [22, 23]. Результаты расчетов приведены в табл. 1. Там же приведены полученные по результатам расчетов разницы теплот ассоциации СО и О2. Рассчитанные структуры ассоциатов приведены на рис. 3.
Таблица 1.
Значения теплоты ассоциации СО и О2 с электрически нейтральным или электрически заряженным кластерами Pd2
| Заряд Pd2 | QCO, ккал/моль | ${{Q}_{{{{{\text{O}}}_{{\text{2}}}}}}},$ ккал/моль | QCO – ${{Q}_{{{{{\text{O}}}_{{\text{2}}}}}}},$ ккал/моль |
|---|---|---|---|
| 0 | 92.7 | 49.4 | 43.3 |
| –1 | 83.3 | 50.6 | 32.7 |
| +1 | 60.7 | 34.1 | 26.6 |
Рис. 3.
Структуры электрически нейтральных, а также отрицательно и положительно заряженных ассоциатов Pd2CO и Pd2O2: серые метки – Pd, черные – C, белые – O; числа у связей – расстояния в Å.
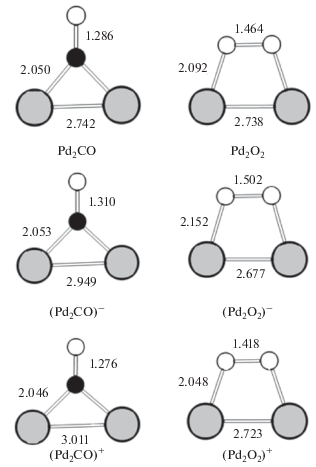
Как следует из данных таблицы, появление на частицах палладия заряда уменьшает разницу между значениями теплот ассоциации СО и О2 с частицами, причем этот эффект сильнее проявляется для положительно заряженных частиц, чем для отрицательно заряженных. Подобные закономерности, полученные на примере простейших частиц палладия Pd2, должны быть справедливы и для более крупных частиц в силу общей природы взаимодействия палладия с СО и О2.
Приведенные расчеты позволили предложить следующее объяснение влияния заряда палладия на его каталитическую активность при окислении СО. Уменьшение разницы теплот ассоциации (адсорбции) СО и О2 на заряженном палладии приводит к увеличению концентрации О2 на поверхности палладия. Как следствие, скорость окисления СО на заряженном палладии возрастает, что согласуется с представленными выше результатами наших экспериментов. А поскольку для положительно заряженного палладия уменьшение теплот адсорбции более существенно, чем для отрицательно заряженного, то и эффект увеличения скорости окисления СО на палладии при подаче на него положительного напряжения должен превышать эффект от подачи отрицательного напряжения, что также согласуется с экспериментом.
ЗАКЛЮЧЕНИЕ
Экспериментально определено, что подача на палладиевое наноразмерное покрытие положительного напряжения +10 или +30 В приводит к увеличению скорости каталитического окисления СО на 14% или 42% при 330 °С, атмосферном давлении и начальном составе смеси 1.8% СО + + 10.2% О2 + Ar. При подаче отрицательного напряжения –10 или –30 В увеличение скорости существенно ниже. Показано, что эффект от подачи напряжения линейно растет с ростом напряжения и не зависит от размера частиц в покрытии.
Квантовохимическими расчетами установлено, что создание на простейшем кластере палладия Pd2 как положительного, так и отрицательного заряда уменьшает разницу между теплотами ассоциации СО и О2 с кластером, однако указанный эффект более существенен для положительно заряженного кластера. По результатам расчетов предложен механизм, объясняющий увеличение каталитической активности палладия при подаче на него электрического напряжения. По аналогии с Pd2, возникновение заряда на палладии при подаче напряжения уменьшает разницу между теплотами ассоциации (адсорбции) СО и О2 с палладием, что приводит к увеличению концентрации О2 на поверхности заряженного палладия. Как следствие, скорость окисления СО на заряженном палладии возрастает, поскольку концентрация О2 на палладии существенно ниже концентрации СО и именно концентрация О2 определяет скорость окисления СО. А поскольку для положительно заряженного палладия уменьшение разницы теплот ассоциации (адсорбции) более существенно, чем для отрицательно заряженного, то и эффект увеличения скорости окисления СО на палладии при подаче на него положительного напряжения превышает эффект от подачи отрицательного напряжения.
Квантовохимические расчеты проведены с использованием суперкомпьютерных ресурсов МСЦ РАН.
Работа выполнена в рамках государственного задания ИХФ РАН (тема 45.9, 0082-2014-0011, регистрационный номер АААА-А20-120013190076-0) и при финансовой поддержке Российским фондом фундаментальных исследований (грант № 20-03-00419).
Список литературы
Csere C. // Car and Driver. 1988. V. 33. № 7. P. 63.
Kaspar J., Fornasiero P., Graziani M. // Catal. Today. 1999. V. 50. № 2. P. 285.
Brandt E., Wang Y., Grizzle J. // IEEE Trans. Control Syst. Technol. 2000. V. 8. № 5. P. 767.
Алексахин А.В., Кириченко А.С. // Экономика в промышленности. 2013. № 4. С. 3.
Бухтияров В.И., Слинько М.Г. // Успехи химии. 2001. Т. 70. № 2. С. 167.
Roldan Cuenya B. // Thin Solid Films. 2010. V. 518. P. 3127.
Grishin M.V., Gatin A.K., Dokhlikova N.V., Kirsankin A.A., Kulak A.I., Nikolaev S.A., Shub B.R. // Kinet. Catal. 2015. V. 56. № 4. P. 532.
Эллерт О.Г., Цодиков М.В., Николаев С.А., Новоторцев В.М. // Успехи химии. 2014. Т. 83. № 8. С. 718.
Николаев С.А., Смирнов В.В., Васильков А.Ю., Подшибихин В.Л. // Кинетика и катализ. 2010. Т. 51. № 3. С. 396.
Simakova I.L., Solkina Yu.S., Moroz B.L., Simakova O.A., Reshetnikov S.I. et al. // Appl. Catal., A. 2010. V. 385. № 1–2. P. 136.
Roldan Cuenya B., Behafarid F. // Surf. Sci. Rep. 2015. V. 70. P. 135.
Ланин С.Н., Пичугина Д.А., Шестаков А.Ф., Смирнов В.В., Николаев С.А. и др. // Журн. физ. химии. 2010. Т. 84. № 12. С. 2330.
Гришин М.В., Гатин А.К., Слуцкий В.Г., Харитонов В.А., Шуб Б.Р. // Хим. физика. 2015. Т. 34. № 7. С. 3.
Гришин М.В., Гатин А.К., Слуцкий В.Г., Харитонов В.А., Цыганов С.А., Шуб Б.Р. // Хим. физика. 2016. Т. 35. № 10. С. 16.
Корчак В.Н., Гришин М.В., Быховский М.Я., Гатин А.К., Слуцкий В.Г., Харитонов В.А., Цыганов С.А., Шуб Б.Р. // Хим. физика. 2017. Т. 36. № 11. С. 29.
Гришин М.В., Гатин А.К., Слуцкий В.Г., Федотов А.С., Харитонов В.А., Шуб Б.Р. // Хим. физика. 2020. Т. 39. № 3. С. 29.
Гришин М.В., Гатин А.К., Слуцкий В.Г., Федотов А.С., Харитонов В.А., Шуб Б.Р. // Хим. физика. 2020. Т. 39. № 5. С. 84.
Гришин М.В., Гатин А.К., Слуцкий В.Г., Федотов А.С., Харитонов В.А., Шуб Б.Р. // Хим. физика. 2021. Т. 40. № 6. С. 10.
Yudanov I.V., Sahnoun R., Neyman K.M., Rosch N., Hoffmann J. et al. // J. Phys. Chem. B. 2003. V. 107. P. 255.
Hooshmand Z., Le D., Rahman T.S. // Surf. Sci. 2017. V. 655. P. 7.
Oguz I., Mineva T., Guesmi H. // J. Chem. Phys. 2018. V. 148. P. 024701.
Ozaki T. // Phys. Rev. B. 2003. V. 67. P. 155108.
Ozaki T., Kino H. // Ibid. 2004. V. 69. P. 195113.
Дополнительные материалы отсутствуют.
Инструменты
Химическая физика


