Химическая физика, 2021, T. 40, № 2, стр. 66-73
Индуцированные гипохлоритом нарушения вторичной структуры коагуляционного фактора XIII
А. Н. Щеголихин 1, *, А. Д. Васильева 1, **, Л. В. Юрина 1, М. А. Розенфельд 1
1 Институт биохимической физики им. Н.М. Эмануэля Российской академии наук
Москва, Россия
* E-mail: shchegol@deom.chph.ras.ru
** E-mail: ms.kadaver@mail.ru
Поступила в редакцию 02.07.2020
После доработки 02.07.2020
Принята к публикации 21.09.2020
Аннотация
Коагуляционный фактор XIII (FXIII), превращающийся в активную форму FXIIIа при совместном действии тромбина и ионов кальция, играет важную роль в процессах коагуляции и фибринолиза. Было показано, что FXIII, обработанный 150 мкМ гипохлорита, практически полностью сохранял свою трансглутаминазную активность, тогда как в случае FXIIIa, обработанного 50 мкМ гипохлорита, последняя резко снижалась. Согласно данным ИК-спектроскопии действие 150 мкМ гипохлорита на FXIII, на FXIII, частично активированный Ca2+, и на FXIIIa приводило к слабовыраженным нарушениям вторичной структуры белка, которые сопровождались некоторым снижением содержания α-спиралей при увеличении содержания β-структур. Наиболее заметное снижение содержания α-спиралей было обнаружено при окислении FXIIIa. С учетом особенностей строения каталитической, FXIII-А, и регуляторной, FXIII-В, субъединиц кажется разумным предположить, что снижение количества α-спиралей под действием окислителя должно быть обусловлено структурными перестройками в домене каталитического ядра. Результаты исследования свидетельствуют, что структура FXIII является высокорезистентной к атаке окислителя.
ВВЕДЕНИЕ
Инфракрасная спектроскопия (ИК) широко используется для изучения биологических объектов, особенно для конформационного анализа белков [1, 2]. Важным достоинством ИК-спектроскопии при анализе структурных характеристик белков является независимость этого метода от размера молекулы белка или физического состояния образца, т.е. его универсальная применимость для анализа как гидратированных пленок, так и лиофилизированных образцов [3].
В настоящее время общепризнанно, что различные комбинации валентных, деформационных и смешанных мод колебаний так называемой пептидной группировки белка (–CO–NH–) могут проявляться в среднем ИК-диапазоне в виде девяти характерных полос поглощения: ~3300 см–1 – амид A, ~3100 см–1 – амид B, ~1650 см–1 – амид I, ~1550 см–1 – амид II, ~1300 см–1 – амид III, ~735 см–1 – амид IV, ~635 см–1 – амид V, ~600 см–1 – амид VI и ~200 см–1 – амид VII [4, 5]. Таким образом огибающая ИК-спектра содержит важную информацию о вторичной структуре белка, поскольку известные элементы последней находят свое отражение в конкретном наборе специфических полос поглощения, принадлежащих различным колебаниям известных фрагментов пептидной связи. С привлечением других методов анализа, таких как рентгеновская дифракция монокристаллов пептидов и спектроскопия кругового дихроизма, за последние годы установлено множество надежных корреляций между ИК-спектрами и специфическими белковыми структурами [6, 7].
Полоса поглощения амида I (1600–1700 см–1), обусловленная валентными колебаниями группировок C=O (70–85%) и C–N (10–20%), является наиболее информативной частью ИК-спектров белков при исследовании их вторичной структуры [8]. Частота колебаний С=О в этой полосе поглощения зависит от системы водородных связей, выстраиваемых вдоль цепи протеина в процессе формирования вторичной структуры. Более подробная информация о вторичной структуре протеина может быть получена посредством разложения композитной полосы амида I на ее составляющие с помощью соответствующих процедур [9].
По их расположению в ИК-спектре эти элементы вторичной структуры обычно классифицируют следующим образом: неупорядоченные структуры, 1642–1657 см–1; α-спираль, 1648–1657 см–1; 310-спираль, 1660–1666 см–1; β-поворот, 1662–1686 см–1; параллельный β-лист, 1615–1640 см–1; и антипараллельный β-лист, 1674–1698 см–1 [10–13]. Интересно, что для всех исследованных белков лиофилизация приводит к увеличению процентного содержания β-листов с одновременным снижением процентного содержания α-спиралей и неупорядоченных структур [3]. Однако следует заметить, что при сравнительном анализе образцов нативного и модифицированного белка подобные изменения в надмолекулярной структуре не имеют принципиального значения для идентификации или локализации отдельных “химически поврежденных” сайтов или участков структуры белковой молекулы. Таким образом, ИК-спектроскопия является полезным инструментом для определения вторичной структуры белка, а полоса амида I широко используется для количественного определения вторичной структуры и конформационных изменений белков и полипептидов [14].
Будучи высокочувствительными мишенями для активных форм кислорода (АФК), окисленные белки претерпевают существенные нарушения, касающиеся как их структуры, так и механизма функционирования. Коагуляционный фактор XIII играет ключевую роль в поддержании коагуляции и фибринолиза благодаря ковалентному сшиванию предварительно сформированных полимеров фибрина, делая их устойчивыми к лизису плазмином и сшивая фибрин с белками фибринолитической системы. Он представляет собой гетеротетрамерный профермент FXIII-A2B2, который состоит из двух одноцепочечных каталитических субъединиц A (FXIII-A2), каждая из которых имеет молекулярную массу ~83 кДа, и двух идентичных одноцепочечных регуляторных субъединиц B (FXIII-В2) с молекулярной массой ~80 кДа каждая. Субъединицы скреплены нековалентными связями [15].
Превращение FXIII-A2B2 в активную форму фермента (номер классификации – EC 2.3.2.13) – многостадийный процесс, который физиологически индуцируется в конечной фазе каскада свертывания путем совместного действия тромбина и Ca2+. Первая стадия – катализируемое тромбином протеолитическое расщепление связи Arg37–Gly38 на NH2-концевом участке субъединицы FXIII-A, приводящее к высвобождению активационного пептида. Это расщепление приводит к превращению гетеротетрамера FXIII-A2B2 в гетеротетрамер FXIII-${\text{A}}_{{\text{2}}}^{'}{{{\text{B}}}_{{\text{2}}}},$ который также не обладает ферментативной активностью. Вторая стадия активации сопровождается связыванием ионов кальция с FXIII-A', что приводит к конформационным изменениям, запускающим диссоциацию гетеротетрамера FXIII-${\text{A}}_{{\text{2}}}^{'}{{{\text{B}}}_{{\text{2}}}}$ в димерные субъединицы FXIII-${\text{A}}_{{\text{2}}}^{'}$ и FXIII-B2. На последнем этапе в присутствии ионов кальция FXIII-${\text{A}}_{{\text{2}}}^{'}$ претерпевает также крупномасштабные конформационные перестройки, вследствие которых FXIII-${\text{A}}_{{\text{2}}}^{'}$ превращается в активную форму фермента FXIII-${\text{A}}_{{\text{2}}}^{*},$ тем самым облегчая доступ субстрата к каталитическому сайту [15].
Совсем недавно были получены новые результаты, доказывающие, что димерная молекула FXIII-${\text{A}}_{{\text{2}}}^{*}$ имеет тенденцию к диссоциации на два мономера FXIII-A*, каждый из которых сохраняет трансглутаминазную активность [16, 17]. Как показано в работе [18], стадия перехода гетеротетрамера FXIII-A2B2 в мономеры FXIII-A* включает в себя образование промежуточного гетеродимера FXIII-AB, в котором субъединицы FXIII-A не полностью насыщены кальцием и все еще слабо связаны с одним из регуляторных мономеров FXIII-B.
В процессе циркуляции в кровотоке FXIII, как и другие белки плазмы, может постоянно подвергаться воздействию различных АФК. В настоящее время исследования по окислительному повреждению FXIII крайне немногочисленны [19–21]. Ранее было показано, что вызванное озоном окисление FXIII влияет на трансглутаминазную активность FXIIIa, которая в значительной степени зависит от стадии превращения FXIII в FXIIIa, на которой проводилось окисление белка [19, 22].
С помощью масс-спектрометрии высокого разрешения было показано, что набор многочисленных сайтов окисления на каталитической субъединице, обнаруженный при окислении озоном исходного FXIII, а также FXIII, активированного только Ca2+, и полностью активированного FXIII путем добавления тромбина и Ca2+, значительно различался [20, 21]. В отличие от озона, гипохлорит, который был выбран для настоящего исследования, является физиологическим окислителем. Образованный in vivo в результате реакции перекиси водорода и Cl– с помощью фермента миелопероксидазы, высвобождаемой из нейтрофилов при их активации, гипохлорит рассматривается как важный патофизиологический фактор при окислительном стрессе [23].
Впервые с помощью метода ИК-спектроскопии было изучено влияние гипохлорита (HOCl/–OCI) на вторичную структуру FXIII на различных стадиях его активации.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Выделение человеческого FXIII и фибриногена
Коагуляционный фактор XIII выделяли из пула плазмы крови человека методом фракционного осаждения с сульфатом аммония и последующей ионообменной хроматографией с использованием сорбента DEAE-ToyoPearl M650 [24]. Фибриноген был очищен из плазмы путем осаждения глицином [25]. Концентрацию белка измеряли по Брэдфорду с использованием концентрата реагента для анализа белка производства компании Bio-Rad (USA). Гомогенность FXIII и фибриногена, выделенных из плазмы, оценивали методом электрофореза в 12%-ном полиакриламидном геле в присутствии додецилсульфата натрия [26].
Приготовление образцов FXIII
Превращение FXIII в FXIIIа в присутствии ионов кальция и тромбина было выполнено, как описано ранее [19]. Чтобы инактивировать ферментативную активность тромбина, гирудин добавляли к активированному тромбином FXIII перед инкубацией с окислителем или к контрольному образцу [27]. Полная инактивация тромбина была протестирована с помощью хромогенного субстрата S-2238 [28]. Тромбин, ранее инактивированный гирудином, добавляли к образцам окисленного и исходного профермента и FXIII, обработанного 5 мМ Са2+.
Определение трансглутаминазной активности FXIIIа
Для определения удельной трансглутаминазной активности активированного FXIII, выделенного из плазмы крови человека, был использован колориметрический метод (коммерческий набор производства компании BioVision, Milpitas, CA, USA). Активированный FXIII имел удельную активность 1836 ± 79 ед. Loewy/мг (для всех образцов FXIIIa измерения трансглутаминазной активности проводили с тремя биологическими повторностями): 1 ед. Loewy/мл представляет собой самое высокое разведение фермента, способного образовывать нерастворимый сгусток в условиях, описанных Loewy et al. [29].
Экспозиция FXIII к гипохлориту на различных стадиях его активации
Коагуляционный фактор XIII (1 мг/мл) был окислен гипохлоритом в условиях, аналогичных таковым для индуцированного гипохлоритом окисления фибриногена [30]. Каждую серию образцов FXIII разделяли на три части, которые независимо окисляли с 50 или 150 мкМ HOCl/–OCI в течение 1 ч при 37 °C. Реакцию окисления останавливали 10-молярным избытком L-метионина к окислителю. Концентрации HOCl/–OCI были стандартизированы при pH 11 и 292 нм с использованием коэффициента экстинкции, равного 350 М–1 ⋅ см–1 [31].
В контрольные образцы добавляли предварительно обработанный избытком метионина HOCl/–OCI. Удаление метионина из растворов и замену буфера на 150 мМ NaCl осуществляли центрифугированием на фильтрах Amicon Ultra с размером пор 10 кДа (Merck, Millipore, Germany).
ИК-измерения образцов FXIII
ИК-спектры образцов исходного и окисленного FXIII регистрировали на ИК-фурье-спектрометре “Spectrum Two” (Perkin-Elmer, США), усредняя их по 16–25 аккумулированным сканам с оптическим разрешением 4 см–1 (цифровое разрешение – 1 см–1) с использованием ПО “Spectrum v.10.3” [20]. Образцы для измерений готовили, нанося 5–10 мкл водного раствора образца в 150 мМ NaCl на поверхность пластин ZnSe диаметром 12.7 мм и толщиной 2 мм. После высушивания при комнатной температуре до постоянного веса получали в центральной части поверхности ZnSe-диска пятно сухого материала пробы диаметром 4–6 мм и толщиной в несколько микрон. Для записи ИК-спектров в режиме “на пропускание” использовали двухлинзовую (MgF2) фокусирующую приставку “Microfocus” (Perkin-Elmer, Англия), установленную в стандартном слайдовом держателе образцов в измерительном отсеке прибора. Диск ZnSe с нанесенной на него пробой помещали вертикально в специальный пост приставки “Microfocus” между двумя MgF2-линзами на пути горизонтального зондирующего ИК-луча спектрометра. Фоновый спектр прибора обновляли в тех же условиях непосредственно перед записью спектра пробы, используя для этого идентичную чистую пластину ZnSe. Обработку полученных ИК-спектров (коррекция базовых линий, вычитание спектров и т.п.) осуществляли в рамках специализированного пакета ПО OPUS v.6.5 (Bruker GmbH, ФРГ) [32], а для более углубленной обработки данных (деконволюции сложных пиков на составляющие с описанием формы сигналов стандартными функциями) использовали программу “PeakFit v.4.11” (Systat, США). В частности, для разделения полос амида I FXIII на составляющие, отвечающие различным компонентам вторичной структуры FXIII, использовали комплексную спектральную стандартную функцию “гауссиан + лоренциан”, описываемую формулой
где a0 – амплитуда сигнала, а1 – пиковая частота полосы, а2 – ширина полосы, а3 – фактор формы полосы. На стадии предварительной деконволюции огибающей полосы амида I использовали вторую производную сигнала, которая указывала на наличие 13 индивидуальных компонент. Затем итерационный процесс описания исходной огибающей набором стандартных полос продолжали до достижения критерия среднеквадратичных отклонений R2 ~ 0.99.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
Анализ вторичной структуры FXIII и его гомологов методом ИК-спектроскопии
Авторы данной работы впервые изучили вызванную гипохлоритом трансформацию молекулярной структуры профермента FXIII, его частично активированной формы, а также полностью активированного FXIIIa методом ИК-спектроскопии. Соответственно, ряд колебательных спектров (рис. 1) был записан для серии образцов FXIII как до, так и после их окисления гипохлоритом. Сосредоточившись на анализе полосы амида I, мы стремились выявить изменения во вторичной структуре окисленного FXIII на разных этапах его активации. Несмотря на усредненные инфракрасные спектры белков, которые имеют несколько амидных полос, полоса амида I при 1700–1600 см–1, как упоминалось ранее, в основном используется для извлечения информации о вторичной структуре. Поскольку каждый из различных элементов вторичной структуры вносит свой вклад в форму полосы амида I в ИК-спектре, наблюдаемые различия заключаются в наличии нескольких перекрывающихся полос компонентов, представляющих структуры α-спирали, β-листа, β-поворота и неструктурированных участков.
Рис. 1.
Обзорные ИК-спектры различных образцов FXIII: 1 – FXIII, 2 – FXIII + Са2+, 3 – FXIII + Ca2+/Тромбин; а – до окисления (тонкая линия); b – после окисления (жирная линия). Все кривые смещены по ординате для наглядности.
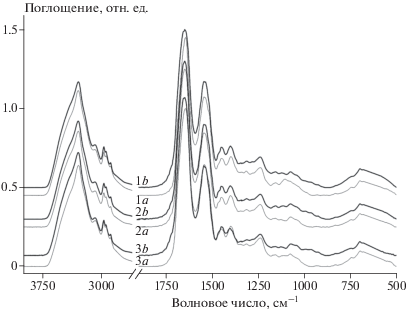
Наблюдаемое в эксперименте множество индивидуальных полос с пиками при разных частотах можно выделять с помощью процедуры деконволюции (разложения) огибающей кривой на составляющие (рис. 2, 3). Значение интегральной площади каждой выделенной полосы поглощения является мерой обилия соответствующего вторичного элемента структуры. Эти значения вместе с позициями и структурными соотношениями полос приведены в табл. 1–3. Анализ состава вторичной структуры показывает, что различные образцы FXIII представлены в основном как материал β-листа (табл. 1–3). Примечательно, что содержание структур β-листа в образцах растет в результате окисления и происходит главным образом за счет уменьшения количества α‑спиралей.
Рис. 2.
ИК-спектр неокисленного FXIII + Ca2+/Тромбин: а – огибающая полосы амида I и ее составляющие, выделенные методом деконволюции с использованием 2-й производной; б – соответствующая вторая производная полосы амида I.
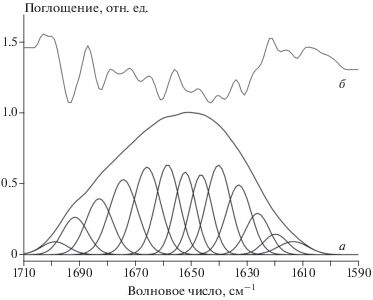
Рис. 3.
ИК-спектр FXIII + Ca2+/Тромбин, обработаного 150 мкМ гипохлорита: а – огибающая полосы амида I и ее составляющие, выделенные методом деконволюции с использованием 2-й производной; б – соответствующая вторая производная полосы амида I.
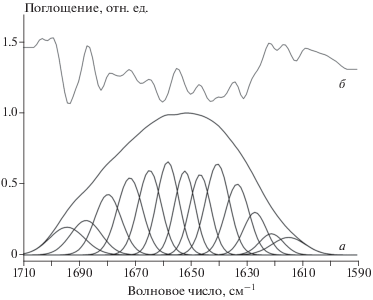
Таблица 1.
Состав компонентов полосы амида I для FXIII до и после обработки гипохлоритом (150 мкМ)
| Нативный FXIII | Окисленный FXIII | Структурные компоненты | ||
|---|---|---|---|---|
| пик, см–1 | площадь, % | пик, см–1 | площадь, % | |
| 1613.5 | 2.74 | 1615.7 | 4.60 | параллельные β-листы (1615 ± 2.0 см–1) |
| 1620.1 | 2.92 | 1622.8 | 4.14 | параллельные β-листы (1624 ± 2.0 см–1) |
| 1625.7 | 4.64 | параллельные β-листы (1627 ± 2.0 см–1) | ||
| 1632.0 | 7.85 | 1629.5 | 7.94 | параллельные β-листы (1633 ± 2.0 см–1) |
| 1638.8 | 11.79 | 1636.6 | 10.00 | параллельные β-листы (1638 ± 2.0 см–1) |
| 1645.2 | 10.56 | 1643.6 | 10.42 | неупорядоченные структуры (1642–1657 см–1) |
| 1650.9 | 9.03 | 1650.5 | 10.88 | α-спирали (1648 ± 2.0 см–1, 1648–1657 см–1) |
| 1656.9 | 10.89 | 1657.6 | 10.78 | α-спирали (1656 ± 2.0 см–1) |
| 1663.9 | 11.65 | 1664.3 | 9.63 | 310-спирали (1663 ± 3.0 см–1) |
| 1671.9 | 10.75 | 1671.3 | 10.26 | β-поворот (1667 ± 1.0 см–1, 1662–1686 см–1) |
| 1680.8 | 9.21 | 1680.2 | 12.07 | β-поворот (1680 ± 2.0 см–1) |
| 1690.5 | 6.45 | 1691.4 | 8.19 | антипараллельные β-листы (1691 ± 2.0 см–1) |
| 1698.8 | 1.52 | антипараллельные β-листы (1674–1699 см–1) | ||
Таблица 2.
Состав компонентов полосы амида I для FXIII + Са2+ до и после обработки гипохлоритом (150 мкМ)
| Нативный FXIII + Ca2+ | Окисленный FXIII + Са2+ | Структурные компоненты | ||
|---|---|---|---|---|
| пик, см–1 | площадь, % | пик, см–1 | площадь, % | |
| 1613.5 | 2.09 | 1614.9 | 3.08 | параллельные β-листы (1615 ± 2.0 см–1) |
| 1619.8 | 2.69 | 1621.0 | 2.69 | параллельные β-листы (1624 ± 2.0 см–1) |
| 1626.3 | 5.32 | 1626.9 | 5.17 | параллельные β-листы (1627 ± 2.0 см–1) |
| 1633.0 | 9.36 | 1633.3 | 8.94 | параллельные β-листы (1633 ± 2.0 см–1) |
| 1640.2 | 11.72 | 1640.3 | 11.41 | параллельные β-листы (1638 ± 2.0 см–1) |
| 1646.5 | 9.28 | 1646.5 | 8.98 | неупорядоченные структуры (1642–1657 см–1) |
| 1652.2 | 9.40 | 1652.0 | 9.07 | α-спирали (1648 ± 2.0 см–1, 1648–1657 см–1) |
| 1658.5 | 11.42 | 1658.1 | 10.78 | α-спирали (1656 ± 2.0 см–1) |
| 1665.8 | 12.55 | 1664.6 | 10.41 | 310-спирали (1663 ± 3.0 см–1) |
| β-поворот (1667 ± 1.0 см–1, 1662–1686 см–1) | ||||
| 1674.3 | 11.31 | 1671.7 | 10.27 | β-поворот (1680 ± 2.0 см–1) |
| 1683.0 | 7.96 | 1679.5 | 8.51 | антипараллельные β-листы (1691 ± 2.0 см–1) |
| 1691.6 | 5.09 | 1687.3 | 5.59 | антипараллельные β-листы (1674–1699 см–1) |
Таблица 3.
Состав компонентов полосы амида I для FXIII + Ca2+/Тромбин до и после обработки гипохлоритом (150 мкМ)
| Нативный FXIII + Ca2+/Тромбин | Окисленный FXIII + Ca2+/Тромбин | Структурные компоненты | ||
|---|---|---|---|---|
| пик, см–1 | площадь, % | пик, см–1 | площадь, % | |
| 1614.8 | 3.68 | 1616.0 | 3.73 | параллельные β-листы (1615 ± 2.0 см–1) |
| 1620.9 | 3.34 | 1621.9 | 2.72 | параллельные β-листы (1624 ± 2.0 см–1) |
| 1627.0 | 5.23 | 1627.8 | 5.60 | параллельные β-листы (1627 ± 2.0 см–1) |
| 1633.2 | 8.90 | 1634.1 | 9.76 | параллельные β-листы (1633 ± 2.0 см–1) |
| 1640.2 | 11.74 | 1641.4 | 11.92 | параллельные β-листы (1638 ± 2.0 см–1) |
| 1646.6 | 9.66 | 1648.0 | 9.74 | неупорядоченные структуры (1642–1657 см–1) |
| 1652.3 | 9.07 | 1653.4 | 8.07 | α-спирали (1648 ± 2.0 см–1, 1648–1657 см–1) |
| 1658.3 | 10.18 | 1659.0 | 10.18 | α-спирали (1656 ± 2.0 см–1) |
| 1664.8 | 10.05 | 1665.7 | 11.49 | 310-спирали (1663 ± 3.0 см–1) |
| 1672.0 | 9.60 | 1673.6 | 10.88 | β-поворот (1667 ± 1.0 см–1, 1662–1686 см–1) |
| 1679.7 | 8.10 | 1682.1 | 8.69 | β-поворот (1680 ± 2.0 см–1) |
| 1687.4 | 5.92 | 1691.5 | 5.87 | антипараллельные β-листы (1691 ± 2.0 см–1) |
| 1694.9 | 4.53 | 1700.1 | 1.36 | антипараллельные β-листы (1674–1699 см–1) |
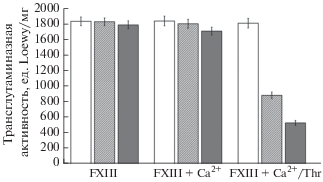
Влияние окисления на ферментативную активность FXIII
При обработке FXIII 50 и 150 мкМ гипохлорита значения трансглутаминазной активности FXIIIа практически не изменились по отношению к неокисленному FXIII и составили 1830 ± ± 49, 1790 ± 51 и 1836 ± 55 ед/мг соответственно (рис. 4). Результаты показали, что значение трансглутаминазной активности FXIIIа в образце FXIII + Са2+ составляло 1841 ± 62 ед/мг, а затем снижалось до 1804 ± 57 и 1710 ± 41 ед/мг при инкубации образца с 50 или 150 мкМ гипохлорита соответственно. При окислении полностью активированного FXIIIа белок сильно страдал как при умеренном, так и при сильном окислении. В результате значения трансглутаминазной активности снизились с 886 ± 43 до 532 ± 31 ед/мг, тогда как для контрольного образца оно было равно 1812 ± 61 ед/мг. Таким образом, можно сделать вывод, что каталитические XIII-субъединицы A* в полностью активированном FXIII являются наиболее уязвимой мишенью для окислителя.
Рис. 4.
Значения трансглутаминазной активности (ед. Loewy/мг) для различных образцов FXIII, подвергнутых воздействию 50 мкМ (заштрихованные колонки), 150 мкМ (серые колонки) гипохлорита, и для неокисленного FXIII (белые колонки). Активность трансглутаминазы выражена как среднее значение ± ± стандартное отклонение.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Активированные нейтрофилы могут генерировать около 10 мМ HOCl/–OCl in vitro, в то время как локализованная концентрация гипохлорита вблизи активированных нейтрофилов in vivo может быть намного выше [33, 34]. Таким образом, сильное окисление циркулирующих в плазме крови белков высокими концентрациями гипохлорита может потенциально способствовать нарушению их структуры и функции. Как было показано в ряде работ, индуцированное гипохлоритом окисление in vitro повреждает ряд белков плазмы, таких как ингибитор альфа-1-протеазы [35], α1-антитрипсин [36], ингибитор протеиназы плазминогена [37] человека альфа-2-макроглобулин [38], человеческий сывороточный альбумин и церулоплазмин [39], фибриноген [40] и др.
В настоящей работе впервые исследовано обусловленное действием гипохлорита повреждение в структуре неактивированного FXIII, а также в структурах FXIII, активированного Ca2+, и полностью активированного FXIII, обработанного тромбином и Ca2+. Согласно данным инфракрасной спектроскопии окисление FXIII привело к некоторому снижению содержания α-спиралей наряду с увеличением вклада от структур β-листа (табл. 1–3).
Известно, что гидрофобные аминокислотные остатки белка в его нативной конформации находятся в ядре, а не на поверхности. Окисление ароматических и серосодержащих остатков, по-видимому, нарушает эту пространственную структуру из-за введения дополнительных функциональных групп в окисленные белки. Следовательно, увеличение количества гидрофобных аминокислот, доступных водному окружению, происходит во время разворачивания структуры молекулы, поскольку гидрофобные аминокислоты, которые обычно находятся внутри всех растворимых белков, подвергаются воздействию водной среды [41, 42]. Кроме того, окисление боковых цепей аминокислот в белках и конформационные перестройки во вторичной или третичной структурах влияют на стабильность и активность белка [43].
Нами было показано, что окисленный максимально выбранным количеством гипохлорита профермент FXIII при его последующей активации не терял своей трансглутаминазной активности, в то время как она существенно уменьшалась для FXIIIа, обработанного минимальным количеством окислителя (рис. 4). Бóльшая уязвимость активной формы FXIII выявлена также и методом ИК-спектроскопии (рис. 2, 3, табл. 3.). В этой связи интересным представляется понимание того, какая область белка может быть наиболее ответственной за этот эффект.
Полипептидная цепь каталитической субъединицы FXIII-A свернута в пять различных структурных доменов: N-концевую область, β‑сэндвич, каталитический домен, β-баррель 1 и β-баррель 2 [15]. Домены β-сэндвич, β-баррель 1 и β-баррель 2 почти исключительно состоят из β-листов, тогда как домен каталитического ядра содержит как β-листы, так и α-спирали [15]. Регуляторные субъединицы FXIII-В составлены только из суши-доменов, которые практически полностью состоят из неупорядоченных структур и β-нитей [44 ] . Следовательно, с высокой долей вероятности можно сделать вывод, что наблюдаемое умеренное снижение содержания α-спирали обусловлено структурным повреждением домена каталитического ядра под действием окислителя. Этот вывод согласуется с данными масс-спектрометрии, свидетельствующими о значительном окислительном повреждении первичной структуры каталитического ядра FXIIIа при его окислении гипохлоритом [20].
ВЫВОДЫ
1. Фактор XIII, обработанный 150 мкМ гипохлорита, практически полностью сохранял свою трансглутаминазную активность, свойственную немодифицированному белку.
2. Трансглутаминазная активность FXIIIa, обработанного 50 мкМ гипохлорита, резко снижалась.
3. Действие 150 мкМ гипохлорита на FXIII, на FXIII, частично активированный Ca2+, и на FXIIIa вызывало слабовыраженные нарушения вторичной структуры белка, сопровождаемые некоторым снижением содержания α-спиралей наряду с увеличением β-структур.
4. Наиболее заметное снижение содержания α-спиралей было обнаружено при окислении FXIIIa.
5. Результаты исследования свидетельствуют, что структура FXIII является высокорезистентной к атаке окислителя.
Список литературы
Tatulian S. // Methods Mol. Biol. 2019. V. 203. P. 281.
Baronio C., Baldassarre M., Barth A. // Phys. Chem. Chem. Phys. 2019. V. 21. P. 8587.
Griebenow K., Klibanov A. // Proc. Natl. Acad. Sci. USA. 1995. V. 921. P. 10969.
Krimm S., Bandekar J. // Adv. Protein Chem. 1986. V. 38. P. 181.
Bandekar J. // Biochim. Biophys. Acta. 1992. V. 1120. P. 123.
Byler D., Susi H. // Biopolymers. 1986. V. 25. P. 469.
Sarver R.W., Krueger W.C. // Anal. Biochem. 1991. V. 194. P. 89.
Susi H., Byler M. // Biochem. Biophys. Res. Commun. 1988. V. 115. P. 391.
Kong J., Yu S. // Acta Biochim. Biophys. Sin. 2007. V. 39. P. 549.
Yang H., Yang S., Kong J. et al. // Nature Protocols. 2015. V. 10. P. 382.
Dong A., Huang P., Caughey W.S. // Biochemistry. 1990. V. 29. P. 3303.
Kalnin N.N., Baikalov I.A., Venyaminov S. // Biopolymers. 1990. V. 30. P. 1273.
Venyaminov S., Kalnin N.N. // Biopolymers. 1990. V. 30. P. 1259.
Jiang Y.J., Li C., Nguyen X. et al. // J. Pharm. Sci. 2011. V. 100. P. 4631.
Muszbek L., Bereczky Z., Bagoly Z. et al. // Physiol. Rev. 2011. V. 91. P. 931.
Anokhin B.A., Stribinskis V., Dean W.L. et al. // FEBS J. 2017. V. 284. P. 3849.
Protopopova A.D., Ramirez A., Klinov D.V. et al. // J. Thromb. Haemost. 2019. V. 17. P. 737.
Singh S., Nazabal A., Kaniyappan S. et al. // Biomolecules. 2019. V. 9. P. 765.
Rosenfeld M.A., Bychkova A.V., Shchegolikhin A.N. et al. // Biochim. Biophys. Acta. 2013. V. 1834. P. 2470.
Васильева А.Д., Юрина Л.В., Леонова В.Б. и др. // Хим. физика. 2020. Т. 39. № 6. С. 24.
Vasilyeva A., Yurina L., Indeykina M. et al. // Biochim. Biophys. Acta. 2018. V. 1866. P. 875.
Розенфельд М.А., Бычкова А.В., Щеголихин А.Н. и др. // Хим. физика. 2014. Т. 33. № 1. С. 47.
Loria V., Dato I., Graziani F. et al. // Mediat. Inflamm. 2008. V. 2008. P. 135625.
Lorand L., Credo R.B., Janus T.J. // Methods Enzymol. 1981. V. 80. P. 333.
Blombäck B.B., Blombäck M. // Arkiv. Kemi. 1956. V. 10. P. 415.
Laemmli U.K. // Nature. 1970. V. 227. P. 680.
Rosenfeld M.A., Vasileva M.V. // Biomed. Sci. 1997. V. 2. P. 155.
Svendsen L., Blombäck B., Blombäck M. et al. // Thrombosis Res. 1972. V. 1. P. 267.
Loewy A.G., Dunathan K., Kriel R. et al. // J. Biol. Chem. 1961. V. 236 P. 2625.
Colombo G., Cleric M., Giustariniet D. et al. // Biochim. Biophys. Acta. 2015. V. 1850. P. 1.
Morris J.C. // J. Phys. Chem. 1966. V. 70. P. 3198.
Литвин Я.А., Щеголихин А. Н., Скоблин А.А. и др. // Хим. физика. 2016. Т. 35. № 9. С. 3.
Klebanoff S.J., Leukoc J. // J. Biol. 2005. V. 77. P. 598.
Stief T.W., Kurz J., Doss M.O. et al. // Thromb. Res. 2000. V. 97. P. 473.
Clark R.A., Stone P.J., EI Hag A. et al. // J. Biol. Chem. 1981. V. 256. P. 3348.
Summers F.A., Morgan P.E., Davies M.J. et al. // Chem. Res. Toxicol. 2008. V. 21. P. 1832.
Gugliucci A. // Clin. Chem. Lab. Med. 2008. V. 46. P. 1403.
Siddiqui T., Zia M.K., Ali S. et al. // Intern. J. Biol. Macromol. 2018. V. 117. P. 401.
Власова И.И., Соколов А.В., Костевич В.А. и др. // Биохимия. 2019. Т. 84. С. 652.
Weigandt K.M., White N., Chung D. et al. // Biophys. J. 2012. V. 103. P. 2399.
Davies K.J., Delsignore M.E. // J. Biol. Chem. 1987. V. 262. P. 9908.
Schmid F.X. // Prot. Struc.: A Pract. App. 1997. V. 28. P. 291.
Hawkins C.L., Davies M.J. // Chem. Res. Toxicol. 2005. V. 18. C. 1600.
Singh S., Akhter M.S., Dodt J. et al. // Intern. J. Mol. Sci. 2019. V. 20. P. 1956.
Дополнительные материалы отсутствуют.
Инструменты
Химическая физика


