Химическая физика, 2020, T. 39, № 6, стр. 7-12
Совместная хемилюминесценция лофина и люминола в присутствии пероксида водорода и гемина
Ю. Б. Цаплев 1, *, Р. Ф. Васильев 1, В. Д. Кънчева 2, А. В. Трофимов 1, 3
1 Институт биохимической физики им. Н.М. Эмануэля Российской академии наук
Москва, Россия
2 Институт органической химии с центром фитохимии Болгарской академии наук
София, Болгария
3 Московский физико-технический институт
Долгопрудный, Россия
* E-mail: tsap_04@mail.ru
Поступила в редакцию 23.10.2019
После доработки 23.10.2019
Принята к публикации 20.11.2019
Аннотация
Посредством спектрально-кинетической регистрации исследована совместная хемилюминесценция люминола и лофина, инициируемая активными частицами, которые генерируются при разложении пероксида водорода гемином.
ВВЕДЕНИЕ
Одним из направлений использования хемилюминесценции и хемилюминофоров, ставшим к настоящему времени классическим, является определение антиоксидантной способности различных веществ [1–14]. Для этого конструируется химическая модельная система, в которой генерируются химически активные частицы и происходит окисление хемилюминофора. Реакции интермедиатов или продуктов окисления приводят к возникновению хемилюминесценции (при необходимости усиления свечения вводят соответствующие люминофоры [13, 14]). Введение в систему веществ, которые конкурируют с хемилюминофором за химически активные частицы, сопровождается тушением хемилюминесценции с последующим ее разгоранием по мере расходования конкурента. При работе с антиоксидантами в слабополярных средах хорошо зарекомендовала себя химическая система, в которой радикалы генерируются при термолизе азо(бис)изобутиронитрила и исследуется влияние испытуемых соединений на оксихемилюминесценцию углеводорода (например, этилбензола) в растворе хлорбензола [2–9, 11–13]. Для работы в водных средах неоднократно предлагалась модельная окисляющая система на основе пероксида и гемина [15], пероксидазы [16, 17] или цитохрома c [18] с люминолом в качестве индикаторного хемилюминофора. Как это ни странно, первая из этих систем (т.е. гемин–H2O2) является значительно более сложной, чем другие. Это связано с многообразием форм гемина в растворе, нестабильностью растворов, изменением активности (в частности, пероксидазно-окислительной активности) под влиянием аксиальных лигандов, зависимостью активности от формы гемина в растворе [19–23].
Важно отметить, что в ряде случаев после введения испытуемого соединения наблюдается не полное тушение хемилюминесценции, а лишь тушение до определенного уровня. Это, возможно, указывает на возникновение дополнительных эмиттеров хемилюминесценции. В данной работе моделируется такая двухэмиттерная ситуация в окисляющей системе на основе гемина и H2O2. В качестве инструмента исследования была использована спектрально-кинетическая регистрация хемилюминесценции.
Спектрально-кинетическая регистрация была ранее предложена для получения спектральной и кинетической информации при исследовании хемилюминесцентных реакций с двумя эмиттерами. Она основана на регистрации хемилюминесценции по двум спектральным каналам посредством двухканального хемилюминометра, в каналах которого установлены полосовые оптические фильтры с различной полосой пропускания [24–27]. Например, в одном канале расположен полосовой оптический фильтр, пропускающий свет в синей области спектра, а в другом – в зеленой. Отношение интенсивностей хемилюминесценции, регистрируемых по синему (B) и зеленому (G) каналам, определяет величину спектрального отношения δ = B/G. В присутствии только одного хемилюминофора величина δ имеет вполне определенное, характерное для него значение. В данной работе в качестве хемилюминофоров были взяты люминол (L1) – 5-амино-2,3-дигидро-1,4-фталазиндион и производное лофина (L2) – 2-(п-диметиламинофенил)-4,5-дифенилимидазол (рис. 1). Известно, что световые пути превращений и L1, и L2 в сильнощелочной среде схожи между собой [28–31]. Максимум испускания L1 расположен в синей области спектра, а L2 – в сине-зеленой; квантовый выход хемилюминесценции у L2 значительно меньше, чем у L1 [32]. В ходе предварительных опытов было установлено, что хемилюминесценция в результате окисления активными частицами, образующимися при разложении пероксида водорода гемином в щелочной среде, имеется не только у L1, но и у L2.
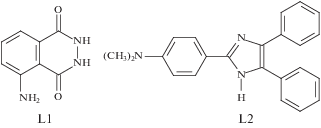
Рис. 1.
Химические структуры хемилюминофоров: люминола (L1) – 5-амино-2,3-дигидро-1,4-фталазиндиона и производного лофина (L2) – 2-(п-диметиламинофенил)-4,5-дифенилимидазола.
В работе показано, что при одновременном присутствии L1 и L2 в реакционной смеси между ними возникает конкуренция за активные частицы, генерируемые гемином и пероксидом водорода. Результатом конкуренции является изменение спектрального отношения δ во времени. Анализ этого изменения позволил установить, что скорость окисления L2 в модельной системе во много раз больше скорости окисления L1. В итоге была получена хемилюминесцентная система, содержащая “пробный” хемилюминофор L2 и “индикаторный” хемилюминофор L1, разгорание хемилюминесценции которого возможно лишь после окончания окисления L2, т.е. L2 выступает в качестве антиокислителя в процессе хемилюминесценции L1.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Реактивы. В работе использовали следующие реактивы: гемин (98%, “Serva”), гемин свиной (98%, “AppliChem”), диметилсульфоксид (для спектроскопии, “AppliChem”), NaOH (х. ч), люминол (95%, “AppliChem”), 2-(п-диметиламинофенил)-4,5-дифенилимидазол (ч, ИРЕА).
Оборудование. Кинетику хемилюминесценции исследовали на двухканальном хемилюминометре, собранном на основе двух фотоприемных модулей: H7360-1 и H7360-2 (“Hamamatsu”, Япония), счетчика CNT-202 (Спецприбор, Беларусь) и компьютера. Люминометрическая система регистрировала хемилюминесценцию в двух спектральных каналах. В синем и зеленом каналах были установлены полосовые оптические фильтры, пропускающие свет в областях 430–490 и 480–560 нм соответственно. Пропускание света блокируется вне указанных областей. Средние коэффициенты пропускания фильтров – 0.80 и 0.88. Схема хемилюминометра описана в работах [26, 27].
Приготовление образцов. Реакторами служили полипропиленовые микропробирки объемом 2 мл, в которых смешивали растворы реагентов. Обычно к 75 мкл раствора NaOH с концентрацией 0.07 М, содержащего смесь гемина (15 мкМ) и L1 (1.1 мкМ) посредством светоизолированного инжектора добавляли 25 мкл диметилсульфоксида, содержащего смесь L2 и пероксида водорода (100 мкМ). Концентрации L2 и других реагентов далее указаны как их начальные концентрации в реакционной смеси.
Двухканальная регистрация хемилюминесценции. Известно, что между интенсивностью хемилюминесценции (i), измеряемой в квант/с, и начальной концентрацией хемилюминофора (С0) при условии его полного расходования к концу реакции существует равенство:
где Φ – квантовый выход хемилюминесценции, v – объем реактора. Поскольку концентрация интермедиатов, которые образуются из хемилюминофора, много меньше концентрации последнего, равенство (1) можно переписать в виде
где t – время после начала реакции, а C(t) – концентрация хемилюминофора в момент времени t. Дифференцируя (2), получим
Это соотношение часто используется для перевода интенсивности хемилюминесценции в скорость расходования хемилюминофора – w [33, 34].
Следует отметить, что интенсивность хемилюминесценции, регистрируемая фотоприемником, I(t) = i(t)α, где посредством коэффициента α учитывается спектральная чувствительность фотоприемника к измеряемому сигналу, геометрические особенности установки и рефракция растворителя. Имеет смысл представить коэффициент α в виде произведения спектрального коэффициента αS и коэффициента αА, в котором учитываются прочие факторы. Спектральный коэффициент αS равен
где S(λ) – спектр хемилюминесценции, P(λ) – спектральная чувствительность фотоприемника, F(λ) – спектр пропускания светофильтра, если он установлен в канале регистрации. Таким образом,
В двухканальном люминометре при наличии одного эмиттера сигналы, регистрируемые в “синем” и “зеленом” спектральных каналах, и спектральное отношение соответственно равны
Из выражения для δ видим, что спектральная чувствительность фотоприемников и спектры пропускания фильтров выполняют роль весовых функций, поэтому двухканальную регистрацию можно сравнить со спектральным взвешиванием.
При наличии двух хемилюминофоров и, соответственно, двух эмиттеров имеем
(5)
$\begin{gathered} B{\text{(}}t{\text{)}} = {{B}_{{\text{1}}}}(t) + {{B}_{2}}(t),\,\,\,\,G{\text{(}}t{\text{)}} = {{G}_{{\text{1}}}}(t) + {{G}_{2}}(t), \\ {{B}_{{\text{1}}}}(t) = {{\Phi }_{1}}{v}{{w}_{1}}{{\alpha }_{A}}{{\alpha }_{{SB{\text{1}}}}},\,\,\,\,{{B}_{{\text{2}}}}(t) = {{\Phi }_{2}}{v}{{w}_{2}}{{\alpha }_{A}}{{\alpha }_{{SB{\text{2}}}}}, \\ {{G}_{{\text{1}}}}(t) = {{\Phi }_{1}}{v}{{w}_{1}}{{\alpha }_{A}}{{\alpha }_{{SG{\text{1}}}}},\,\,\,\,{{G}_{{\text{2}}}}(t) = {{\Phi }_{2}}{v}{{w}_{2}}{{\alpha }_{A}}{{\alpha }_{{SG{\text{2}}}}}, \\ {{{{B}_{{\text{1}}}}} \mathord{\left/ {\vphantom {{{{B}_{{\text{1}}}}} {{{G}_{{\text{1}}}}}}} \right. \kern-0em} {{{G}_{{\text{1}}}}}} = {{{{\alpha }_{{SB1}}}} \mathord{\left/ {\vphantom {{{{\alpha }_{{SB1}}}} {{{\alpha }_{{SG{\text{1}}}}}}}} \right. \kern-0em} {{{\alpha }_{{SG{\text{1}}}}}}} = {{\delta }_{1}}, \\ {{{{B}_{{\text{2}}}}} \mathord{\left/ {\vphantom {{{{B}_{{\text{2}}}}} {{{G}_{{\text{2}}}}}}} \right. \kern-0em} {{{G}_{{\text{2}}}}}} = {{{{\alpha }_{{SB{\text{2}}}}}} \mathord{\left/ {\vphantom {{{{\alpha }_{{SB{\text{2}}}}}} {{{\alpha }_{{S{{G}_{{\text{2}}}}}}}}}} \right. \kern-0em} {{{\alpha }_{{S{{G}_{{\text{2}}}}}}}}} = {{\delta }_{2}},\,\,\,\,{{B{\text{(}}t{\text{)}}} \mathord{\left/ {\vphantom {{B{\text{(}}t{\text{)}}} {G{\text{(}}t{\text{)}}}}} \right. \kern-0em} {G{\text{(}}t{\text{)}}}} = \delta (t). \\ \end{gathered} $Из (5), зная значения δ1, δ2, B(t), G(t), можно определить величины интенсивностей Bi(t), Gi(t), т.е. найти спектрально-кинетические зависимости для каждого люминофора (такая возможность продемонстрирована в работе [26]):
Кроме того, из (5) можно найти и отношение w2/w1:
(6)
$\frac{{{{w}_{2}}(t)}}{{{{w}_{1}}(t)}} = \frac{{{{\Phi }_{1}}}}{{{{\Phi }_{2}}}}\frac{{{{\alpha }_{{SG1}}}}}{{{{\alpha }_{{SG2}}}}}\frac{{{{\delta }_{1}} - \delta (t)}}{{\delta (t) - {{\delta }_{2}}}},$откуда видно, что регистрация стремления δ(t) к δ1 указывает на то, что w2 → 0, а стремление δ(t) к δ2 указывает на стремление w1 к нулю.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Спектральные отношения, характеризующие L1 и L2, равны 1.9 ± 0.2 и 0.10 ± 0.01 соответственно. Они получены в присутствии лишь одного из хемилюминофоров.
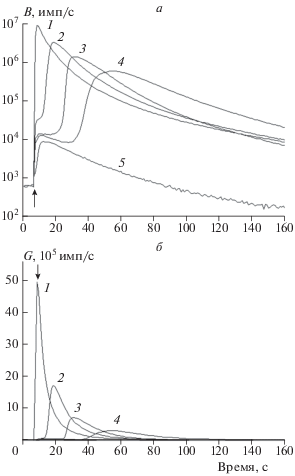
На рис. 2 линии 1–5 – кинетические кривые хемилюминесценции, регистрируемой в синем и зеленом каналах, при варьировании начальной концентрации L2 и постоянной начальной концентрации L1. Масштаб по оси ординат в одном случае логарифмический, а в другом – линейный. Видим, что в присутствии L2 наблюдается уменьшение максимальной интенсивности хемилюминесценции, и появляется задержка между моментом смешивания реагентов и подъемом интенсивности к максимуму.
Рис. 2.
Кинетические кривые совместной хемилюминесценции, регистрируемой в синем (B) и зеленом каналах (G), в присутствии L2 в концентрации 0 (1), 3.8 (2), 7.3 (3), 10.8 (4) и 37.8 мкМ (5) и L1 в концентрации 0.8 мкМ. Момент смешивания реагентов указан стрелкой.
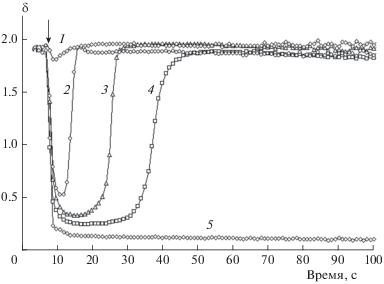
На рис. 3 представлены кинетические кривые изменения спектрального отношения δ в ходе реакции. Уменьшение спектрального отношения в начале реакции свидетельствует о том, что на этом интервале времени происходят преимущественно окисление и хемилюминесценция L2. Увеличение δ до значений, характерных для L1, служит индикатором окончания окисления L2. При отношении начальных концентраций L2/L1 ≈50 (кривые 5 на рис. 2 и 3) наблюдается исключительно хемилюминесценция L2 при полном тушении хемилюминесценции L1.
Рис. 3.
Кинетические кривые изменения спектрального отношения δ для данных, представленных на рис. 2.
Таким образом, хемилюминофор L2 для L1 в системе гемин – H2O2 выступает в роли типичного антиокислителя-антиоксиданта, но не обычного, а такого, о расходовании которого можно судить по изменению хемилюминесценции. И это очень удобно как для настройки параметров модельной окисляющей системы на основе пероксида водорода и гемина с люминолом в качестве индикаторного хемилюминофора, так и для использования L2 в качестве референтного соединения.
Отметим, что величина спектрального отношения чувствительна не только к изменению спектрального состава испускаемого света, но и к изменению оптической плотности среды в полосе испускания хемилюминесценции в ходе реакции. Это означает, что необходим контроль за оптической плотностью реакционной среды посредством спектрофотометрических измерений.
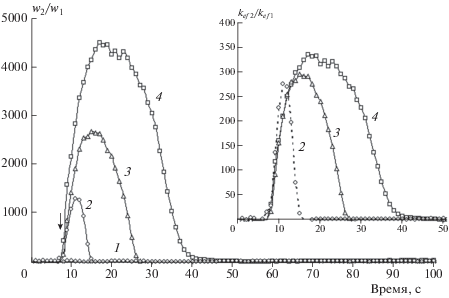
С помощью формулы (6) графики зависимости δ(t) преобразуются в графики зависимости отношения скоростей расходования w2/w1 от времени. Для этого преобразования необходимо знать отношения Φ1/Φ2 и αSG1/αSG2. В условиях опытов отношение Φ1/Φ2 ≈ 1600. Отношение αSG1/αSG2 найденное численным интегрированием на основе известных спектров хемилюминесценции L1 и L2, равно 0.26. Произведение первых двух сомножителей, таким образом, дает величину, приблизительно равную 400. Результат преобразования графиков δ(t) в графики w2(t)/w1(t) при (Φ1/Φ2)(αSG1/αSG2) = 400 представлен на рис. 4. Видим, что скорость расходования L2 превышает скорость расходования L1 в несколько тысяч раз. Предполагая, что скорости расходования определяются произведением концентрации на эффективную константу скорости, и умножив w2(t)/w1(t) на L10/L20, получим графики, представленные на вставке к рис. 4. Откуда видно, что эффективные константы скоростей L2 и L1 различаются приблизительно в 300 раз.
Рис. 4.
Кинетические кривые изменения отношения w2/w1 для данных, представленных на рис. 2. На вставке – кривые зависимости отношения эффективных констант скоростей расходования L2 и L1 от времени.
ЗАКЛЮЧЕНИЕ
Спектрально-кинетическая регистрация хемилюминесценции является компромиссным вариантом между спектральной регистрацией с накоплением сигнала при больших концентрациях хемилюминофора на длительных интервалах времени и, как следствие, с потерей кинетической информации и кинетической регистрацией, при которой спектральная информация оказывается недоступной. Спектрально-кинетическая регистрация полезна для установления факта неизменности эмиттера или факта появления нового дополнительного эмиттера в ходе хемилюминесцентной реакции.
В совместной хемилюминесценции, которая инициируется активными частицами, генерируемыми при разложении пероксида водорода гемином, лофин выступает в роли антиокислителя-антиоксиданта для люминола. Совместная хемилюминесценция люминола и лофина удобна для настройки параметров модельной окисляющей системы на основе пероксида и гемина с люминолом в качестве индикаторного хемилюминофора.
Работа выполнена при финансовой поддержке Российским фондом фундаментальных исследований (грант № 19-53-18019 Болг_а) и Национальным научным фондом Болгарии (грант № КП-06-Русия-28).
Список литературы
Denisov E.T., Afanas’ev I.B. Oxidation and Antioxidants in Organic Chemistry and Biology. Boca Raton: CRC Press, Taylor & Francis Group, 2005.
Шляпинтох В.Я., Карпухин О.Н., Постников Л.М. и др. Хемилюминесцентные методы исследования медленных химических процессов. М.: Наука, 1966.
Fedorova G.F., Menshov, A.V., Trofimov A.V. et al. // Analyst. 2009. V. 134. № 10. P. 2128.
Русина И.Ф., Карпухин О.Н., Касаикина О.Т. // Хим. физика. 2013. Т. 32. № 8. С. 49.
Жигачева И.В., Русина И.Ф., Генерозова и др. // Хим. физика. 2018. Т. 37. № 11. С. 68.
Васильев Р.Ф., Вепринцев Т.Л., Долматова Л.С. и др. // Кинетика и катализ. 2014. Т. 55. № 2. С. 157.
Slavova-Kazakova A.K., Angelova S.E., Denev P. et al. // Beilstein J. Org. Chem. 2015. V. 11. P. 1398.
Fedorova G.F., Menshov V.A., Trofimov A.V. et al. // Photochem. Photobiol. 2017. V. 93. № 2. C. 579
Fedorova G.F., Menshov V.A., Naumov V.V. et al. // Photochem. Photobiol. 2019. V. 95. № 3. P. 780.
Handbook of Chemiluminescent Methods in Oxidative Stress Assessment / Eds. Popov I., Lewin G. Kerala: Transworld Research Network, 2008.
Эмануэль Н.М., Гал Д. Окисление этилбензола (модельная реакция). М.: Наука, 1984.
Беляков В.А., Васильев Р.Ф., Федорова Г.Ф. // Кинетика и катализ. 2004. Т. 45. № 3. С. 355.
Fedorova G.F., Trofimov A.V., Vasil’ev R.F. et al. // ARKIVOC. 2007. № 8. P. 163.
Беляков В.А., Васильев Р.Ф., Трофимов А.В. // Хим. физика. 1994. Т. 13. № 11. С. 8.
Bastos E.L., Romoff P., Eckert C.R. et al. // J. Agr. Food Chem. 2003. V. 51. № 25. P. 7481.
Whitehead T.P., Thorpe G.H.G., Maxwell S.R.J. // Anal. Chim. Acta. 1992. V. 266. № 2. P. 265.
Thorpe G.H.G., Whitehead T.P. US Patent № 5395755. 1995.
Ashida S., Okazaki S., Tsuzuki W. et al. // Anal. Sci. 1991. V. 7. № 1. P. 93.
Maehly A.C., Akeson A. // Acta Chem. Scand. 1958. V. 12. № 6. P. 1259.
Kremer M.L. // Biochim. Biophys. Acta. 1973. V. 297 № 2. P. 268.
de Villiers K.A., Kaschula C.H., Egan T.J. et al. // J. Biol. Inorg. Chem. 2007. V. 12. № 1. P. 101.
Brown S.B., Dean T.C., Jones P. // Biochem. J. 1970. V. 117. № 4. P. 741.
Jones P., Mantle D., Wilson I. // J. Chem. Soc. Dalton Trans. 1983. № 1. P. 161.
Suzuki K., Saito H., Jinno N. et al. // Chem. Lett. 2008. V. 37. № 10. P. 1090.
Harada Y., Suzuki K., Hashimoto M. et al. // Talanta. 2009. V. 77. № 3. P. 1223.
Цаплев Ю.Б. // ЖФХ. 2011. Т. 85. № 7. С. 1371.
Tsaplev Yu., Vasil’ev R., Trofimov A. // Luminescence. 2014. V. 29. № S1. P. 49.
Merenyi G., Lind J., Eriksen T.E. // J. Biolum. Chemilum. 1990. V. 5. № 1. P. 53.
Baj S., Krawczyk T. // J. Photochem. Photobiol., A. 2006. V. 183. № 1–2. P. 111.
Boyatzis S., Nikokavouras J. // Ibid. 1993. V. 74. № 1. P. 65.
Lu G., Wada J., Kimoto T. et al. // Eur. J. Org. Chem. 2014. № 6. P. 1212.
White E.H., Harding M.J.C. // Photochem. and Photobiol. 1965. V. 4. № 6. P. 1129.
Olsson T., Ewetz L., Thore A. // Ibid. 1983. V. 38. № 2. P. 223.
Jones P., Scowen N.R. // Ibid. 1987. V. 45. № 2. P. 283.
Дополнительные материалы отсутствуют.
Инструменты
Химическая физика


