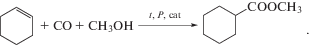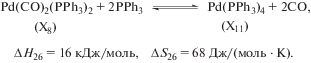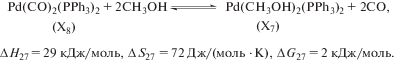Химическая физика, 2019, T. 38, № 4, стр. 3-11
Гидрокарбометоксилирование циклогексена, катализируемое системой Pd(OAc)2–PPh3–n-толуолсульфокислота. Некоторые аспекты кинетики реакции и термодинамики лигандного обмена между палладиевыми комплексами
Н. Т. Севостьянова 1, *, С. А. Баташев 1, А. С. Родионова 1
1 Тульский государственный педагогический университет им. Л.Н. Толстого
Тула, Россия
* E-mail: piligrim.tula.ru@gmail.com
Поступила в редакцию 13.07.2018
После доработки 13.07.2018
Принята к публикации 20.09.2018
Аннотация
В диапазоне температур 368–383 К установлены количественные закономерности влияния концентрации промотирующей добавки PPh3 на скорость гидрокарбометоксилирования циклогексена при катализе системой Pd(OAc)2–PPh3–n-толуолсульфокислота. Показано, что в исследуемом температурном диапазоне зависимости скорости реакции от концентрации PPh3 проходят через максимумы. Полученные результаты интерпретированы в рамках предложенного ранее гидридного механизма гидрокарбометоксилирования. Оценены значения некоторых эффективных констант кинетического уравнения реакции. С использованием температурной зависимости одной из эффективных констант скорости оценена эффективная энергия активации и на ее основе – изменения энтальпии, энтропии и свободной энергии Гиббса в реакции лигандного обмена между комплексами Pd(PPh3)4 и Pd(CO)2(PPh3)2. Установлено, что при 373 К эта реакция близка к состоянию равновесия. С использованием полученных ранее данных при температурах 363, 368, 373, 378 и 383 К разработаны кинетические модели гидрокарбометоксилирования циклогексена, отражающие совокупное влияние различных участников реакции на ее скорость и работающие на всем протяжении реакции.
ВВЕДЕНИЕ
Гидрокарбалкоксилирование ненасыщенных соединений спиртами и СО открывает возможности одностадийного синтеза разнообразных сложных эфиров. Интерес к этим реакциям не утихает. В последние годы в качестве субстратов гидрокарбалкоксилирования использовались: гексен-1 [1, 2], циклогексен [3], октен-1 [1], терминальные алкены С8–С14 разной структурной сложности (линейные незамещенные, циклогексил- и арилзамещенные, содержащие кето- и сложноэфирную группы) [4], метиловый эфир 10-ундеценовой кислоты [5], стирол, фенилацетилен и их производные [3, 6, 7], аллены и 1,2-бутадиен [8]. Во всех перечисленных случаях применялись гомогенные каталитические системы на основе соединений палладия, позволяющие осуществлять синтезы в мягких условиях с высокими выходами целевых продуктов.
Наиболее эффективными промоторами гомогенных палладиевых катализаторов гидрокарбалкоксилирования являются свободные органофосфины. Однако влияние концентрации органофосфинов на скорость гидрокарбалкоксилирования неоднозначно. В средах, проявляющих восстановительные свойства, добавки органофосфинов способствуют поддержанию нульвалентных комплексов палладия в растворенном состоянии [9]. Как правило, с увеличением концентрации этих промоторов до определенного верхнего предела скорость реакции возрастает, после чего наблюдается перелом и при дальнейшем увеличении концентрации фосфинов скорость реакции снижается [10–15]. Объяснение такому снижению скорости было дано в рамках представлений об образовании стабильных и каталитически малоактивных комплексов палладия, в которых моно- или бидентатные фосфины занимают три или четыре координационных места [3, 11, 14–17]. Таким образом, процессы, протекающие в системах гидрокарбалкоксилирования алкенов, чрезвычайно сложны и включают множество реакций лигандного обмена, имеющих обратимый характер и приводящих к образованию “балластных” комплексов. Интерес, по нашему мнению, представляет вопрос об относительной стабильности этих комплексов в условиях реакции гидрокарбалкоксилирования и влиянии на нее спиртов как сольватирующих компонентов среды. Другим актуальным направлением является разработка кинетических моделей процессов гидрокарбалкоксилирования как основы для проектирования реакторов синтеза сложных эфиров.
Удобным модельным алкеном для исследования закономерностей гидрокарбалкоксилирования является циклогексен, реакция с которым не осложняется образованием побочных продуктов [3, 10–12, 16, 18]. В данной работе нами в качестве объекта исследования была выбрана реакция гидрокарбометоксилирования циклогексена:
Ранее нами было изучено влияние концентрации метанола и давления СО на скорость этой реакции при катализе системой Pd(OAc)2 – PPh3 – n-толуолсульфокислота (TsOH) в широком температурном диапазоне [16, 18], а также влияние концентрации циклогексена, Pd(OAc)2, PPh3 и TsOH при 378 К [11, 19]. Были оценены значения эффективных констант кинетического уравнения реакции, некоторые эффективные энергии активации и на их основе – изменения энтальпии, энтропии и свободной энергии Гиббса в реакции лигандного обмена между “балластными”, каталитически неактивными комплексами Pd(CH3OH)2(PPh3)2 и Pd(CO)2(PPh3)2. Было установлено, что при 373 К реакция лигандного обмена между указанными комплексами близка к состоянию равновесия [16]. В продолжение перечисленных выше работ в данной статье нами было выполнено исследование влияния концентрации промотирующей добавки трифенилфосфина и температуры на скорость гидрокарбометоксилирования циклогексена, катализируемого системой Pd(OAc)2 – PPh3 – TsOH, и разработаны кинетические модели этой реакции в температурном диапазоне 363–383 К.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Методика экспериментов
Каждый эксперимент проводили в условиях постоянства температуры и давления СО в среде толуола. Пробы реакционной массы анализировали методом газожидкостной хроматографии. Содержание компонентов определяли методом внутреннего стандарта, используя в качестве последнего о-ксилол в концентрации 5.0 · 10–2 моль/л. Описание методики кинетических экспериментов и анализа реакционной массы изложено в работе [15].
Результаты экспериментов
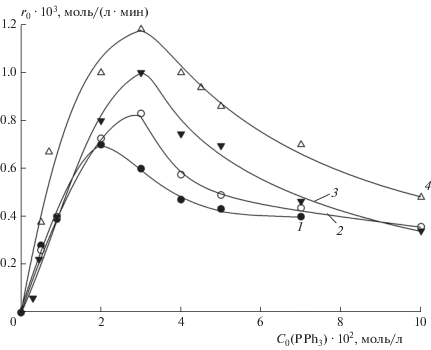
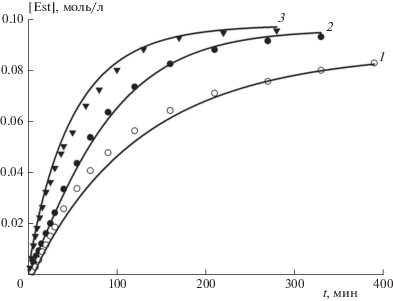
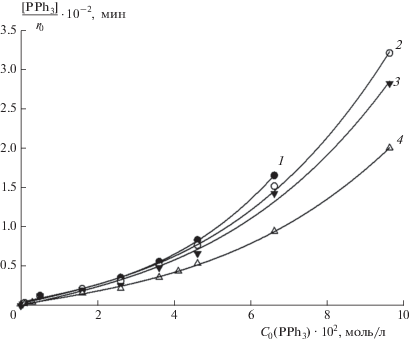
С целью исследования влияния концентрации промотирующей добавки трифенилфосфина и температуры на скорость гидрокарбометоксилирования циклогексена были проведены три серии экспериментов при температуре 368, 373 и 383 К с варьированием концентрации PPh3 при постоянстве давления СО и концентраций остальных участников реакции. На рис. 1 представлены типичные кинетические кривые накопления продукта реакции – сложного эфира метилциклогексанкарбоксилата (Est). Начальные скорости реакции определялись дифференцированием начальных участков кинетических кривых, следующих после автокаталитических участков (в случае их наличия), или начиная с нулевого момента времени. Полученные зависимости начальной скорости реакции r0 от концентрации трифенилфосфина в температурном диапазоне 368–383 К, дополненные кривой, полученной ранее в работе [11] при 378 К, представлены на рис. 2. Все зависимости имеют экстремальный характер с максимумами при концентрации PPh3 (2.0÷3.0) · 10–2 моль/л.
Рис. 1.
Кинетические кривые накопления метилциклогексанкарбоксилата (Est). Точки – экспериментальные данные, линии – расчетные данные, полученные с использованием моделей (32) и (34). РСО = 2.1 · 106 Па; концентрации, моль/л: C0(C6H10) = 0.10, C0(CH3OH) = 0.45, C0(Pd(OAc)2) = 2.0 ∙ 10–3, C0(TsOH·H2O) = 2.4 ∙ 10–2; 1 – Т = 373 К, C0(PPh3) = 0.10 моль/л; 2 – Т = 373 К, C0(PPh3) = 3.0 ∙ 10–2 моль/л; 3 – Т = 383 К, C0(PPh3) = 4.0 ⋅ 10–2 моль/л.
Обсуждение результатов
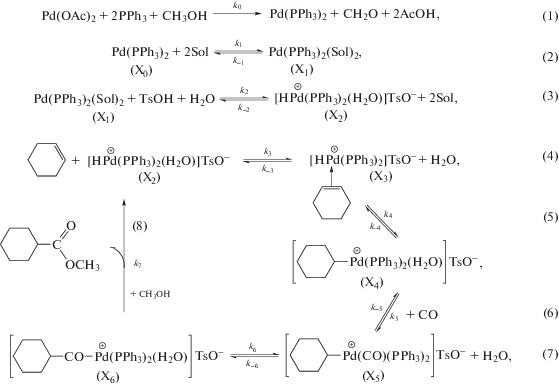
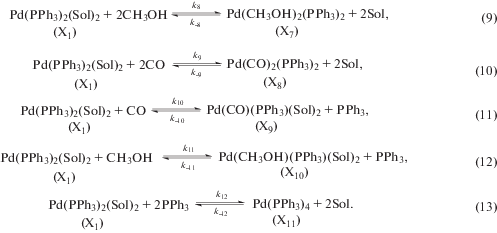
Объяснение полученным результатам может быть дано в рамках гидридного механизма [11, 16, 18] (см. ниже Схему, дополненную реакциями лигандного обмена (9)–(13), где Sol – молекулы растворителя).
Схема
Как указывалось в работе [11], экстремальный характер зависимостей скорости реакции от концентрации трифенилфосфина можно объяснить действием двух факторов. С увеличением концентрации трифенилфосфина до (2.0÷3.0) · 10–2 моль/л прогрессируют обратимые реакции образования активного комплекса Х1 с участием одной молекулы PPh3 (реакции (11) и (12)), что вызывает рост скорости гидрокарбометоксилирования. Дальнейшее повышение концентрации PPh3 ведет к существенному увеличению концентрации комплекса Х1 и, как следствие, к смещению равновесия реакции (13) в сторону образования “балластной” формы Х11. Это, по-видимому, приводит к перелому в ходе зависимости скорости гидрокарбометоксилирования от концентрации PPh3 и дальнейшему снижению скорости реакции.
Ранее нами было получено кинетическое уравнение гидрокарбометоксилирования циклогексена [11]:
(14)
${{r}_{0}} = \frac{{k{{C}_{{{\text{Pd}}}}}[{\text{CO}}]{{C}_{{\text{0}}}}{\text{(}}{{{\text{C}}}_{{\text{6}}}}{{{\text{H}}}_{{{\text{10}}}}})C_{0}^{2}{\text{(TsOH}}){{C}_{0}}({\text{C}}{{{\text{H}}}_{{\text{3}}}}{\text{OH)}}}}{{1 + aC_{0}^{2}({\text{C}}{{{\text{H}}}_{{\text{3}}}}{\text{OH)}} + b{{{[{\text{CO}}]}}^{2}} + c\frac{{[{\text{CO}}]}}{{{\text{[PP}}{{{\text{h}}}_{{\text{3}}}}{\text{]}}}} + d\frac{{{{C}_{0}}({\text{C}}{{{\text{H}}}_{{\text{3}}}}{\text{OH)}}}}{{{\text{[PP}}{{{\text{h}}}_{{\text{3}}}}{\text{]}}}} + e{{{\left[ {{\text{PP}}{{{\text{h}}}_{{\text{3}}}}} \right]}}^{2}}}},$Как было показано в работе [11], в условиях однофакторного эксперимента по влиянию концентрации PPh3уравнение (14) приводится к виду:
(15)
$\frac{{[{\text{PP}}{{{\text{h}}}_{{\text{3}}}}]}}{{{{r}_{0}}}} = \frac{A}{{{{k}_{{ef1}}}}}[{\text{PP}}{{{\text{h}}}_{{\text{3}}}}] + \frac{{d{\text{*}}}}{{{{k}_{{ef1}}}}} + \frac{e}{{{{k}_{{ef1}}}}}{{\left[ {{\text{PP}}{{{\text{h}}}_{{\text{3}}}}} \right]}^{3}},$где
Обработка полученных данных в координатах уравнения (15) позволила оценить его параметры. Значения этих параметров при температурах 368, 373 и 383 К, дополненные полученными ранее значениями при 378 К [11], приведены в табл. 1. Статистически незначимым оказался параметр d*/kef1 при 378 К. Соответствующие уравнению (15) зависимости [PPh3]/r0 от [PPh3] при температурах 368, 373 и 383 К, а также полученная ранее при 378 К зависимость, описываемая функцией [11]
(16)
$\frac{{[{\text{PP}}{{{\text{h}}}_{{\text{3}}}}]}}{{{{r}_{0}}}} = \frac{A}{{{{k}_{{ef1}}}}}[{\text{PP}}{{{\text{h}}}_{{\text{3}}}}] + \frac{{\bar {e}}}{{{{k}_{{ef1}}}}}{{\left[ {{\text{PP}}{{{\text{h}}}_{{\text{3}}}}} \right]}^{3}},$Таблица 1.
Значения эффективных констант ${A \mathord{\left/ {\vphantom {A {{{k}_{{ef1}}}}}} \right. \kern-0em} {{{k}_{{ef1}}}}},$ ${{d*} \mathord{\left/ {\vphantom {{d*} {{{k}_{{ef1}}}}}} \right. \kern-0em} {{{k}_{{ef1}}}}},$ ${e \mathord{\left/ {\vphantom {e {{{k}_{{ef1}}}}}} \right. \kern-0em} {{{k}_{{ef1}}}}}$ и ${{e'} \mathord{\left/ {\vphantom {{e'} {k{{'}_{{ef1}}}}}} \right. \kern-0em} {k{{'}_{{ef1}}}}}$
| Т, К | $\frac{A}{{{{k}_{{ef1}}}}} \cdot {{10}^{{ - 3}}},\;\,\frac{{{\text{л }} \cdot {\text{м и н }}}}{{{\text{м о л ь }}}}$ | $\frac{{d{\text{*}}}}{{{{k}_{{ef1}}}}},\;\,{\text{м и н }}$ | $\frac{e}{{{{k}_{{ef1}}}}} \cdot {{10}^{{ - 5}}},\,\;\frac{{{{{\text{л }}}^{{\text{3}}}} \cdot {\text{м и н }}}}{{{\text{м о л }}{{{\text{ь }}}^{{\text{3}}}}}}$ | $\frac{{e{\text{'}}}}{{k{{{\text{'}}}_{{ef1}}}}} \cdot {{10}^{{ - 12}}},\,\,\frac{{{\text{м о л }}{{{\text{ь }}}^{{\text{2}}}} \cdot {\text{П a}} \cdot {\text{c}}}}{{{{{\text{м }}}^{{\text{6}}}}}}$ |
|---|---|---|---|---|
| 368 | 0.99 ± 0.08 | 4.6 ± 1.6 | 3.31 ± 0.18 | 2.16 ± 0.12 |
| 373 | 1.12 ± 0.11 | 2.8 ± 2.4 | 2.39 ± 0.10 | 1.56 ± 0.07 |
| 378 | 1.1 ± 0.2 | – | 2.0 ± 0.2 | 1.32 ± 0.12 |
| 383 | 0.80 ± 0.03 | 1.6 ± 0.9 | 1.38 ± 0.03 | 0.90 ± 0.02 |
представлены на рис. 3 и демонстрируют хорошее соответствие экспериментальных и расчетных данных.
Рис. 3.
К определению соответствия экспериментальных данных по влиянию концентрации PPh3 на скорость гидрокарбометоксилирования циклогексена уравнениям (15) и (16). Обозначения те же, что и для рис. 2.
Выражения для эффективных констант A/kef1 и d*/kef1 содержат сумму нескольких слагаемых:
(17)
$\frac{A}{{{{k}_{{ef1}}}}} = \frac{{1 + {{K}_{1}} + {{K}_{1}}{{K}_{8}}C_{{\text{0}}}^{{\text{2}}}{\text{(C}}{{{\text{H}}}_{{\text{3}}}}{\text{OH)}} + {{K}_{1}}{{K}_{9}}{{{[{\text{CO}}]}}^{2}}}}{{{{K}_{1}}{{K}_{2}}{{K}_{3}}{{K}_{4}}{{K}_{5}}{{K}_{6}}{{k}_{7}}{{C}_{{{\text{Pd}}}}}{\text{[CO]}}{{C}_{{\text{0}}}}{\text{(}}{{{\text{C}}}_{{\text{6}}}}{{{\text{H}}}_{{{\text{10}}}}}{\text{)}}C_{{\text{0}}}^{{\text{2}}}{\text{(TsOH)}}{{C}_{{\text{0}}}}{\text{(C}}{{{\text{H}}}_{{\text{3}}}}{\text{OH)}}}},$(18)
$\frac{{d{\text{*}}}}{{{{k}_{{ef1}}}}} = \frac{{{{K}_{{10}}}[{\text{CO}}] + {{K}_{{11}}}{{C}_{{\text{0}}}}{\text{(C}}{{{\text{H}}}_{{\text{3}}}}{\text{OH)}}}}{{{{K}_{2}}{{K}_{3}}{{K}_{4}}{{K}_{5}}{{K}_{6}}{{k}_{7}}{{C}_{{{\text{Pd}}}}}{\text{[CO]}}{{C}_{{\text{0}}}}{\text{(}}{{{\text{C}}}_{{\text{6}}}}{{{\text{H}}}_{{{\text{10}}}}}{\text{)}}C_{{\text{0}}}^{{\text{2}}}{\text{(TsOH}}){{C}_{{\text{0}}}}{\text{(C}}{{{\text{H}}}_{{\text{3}}}}{\text{OH)}}}}.$Значения константы A/kef1 не подчиняются уравнению Аррениуса (см. табл. 1), в то время как значения d*/kef1 удовлетворительно описываются уравнением
(19)
$\frac{{d{\text{*}}}}{{{{k}_{{ef1}}}}} = {{10}^{{ - 8.990}}}\exp \left( {\frac{{80 \pm 3}}{{RT}}} \right),\;{\text{c}}{\text{.}}$В то же время эффективная константа e/kef1 представляет собой комбинацию ряда констант и концентраций участников реакции:
(20)
$\begin{gathered} \frac{e}{{{{k}_{{ef1}}}}} = \frac{{{{K}_{{12}}}}}{{{{K}_{2}}{{K}_{3}}{{K}_{4}}{{K}_{5}}{{K}_{6}}{{k}_{7}}{{C}_{{{\text{Pd}}}}}{\text{[CO]}}{{C}_{{\text{0}}}}{\text{(}}{{{\text{C}}}_{{\text{6}}}}{{{\text{H}}}_{{{\text{10}}}}}{\text{)}}C_{{\text{0}}}^{{\text{2}}}{\text{(TsOH}}){{C}_{0}}{\text{(C}}{{{\text{H}}}_{{\text{3}}}}{\text{OH)}}}} = \\ = \frac{{{{K}_{{12}}}{{H}_{{{\text{CO}}}}}}}{{{{K}_{2}}{{K}_{3}}{{K}_{4}}{{K}_{5}}{{K}_{6}}{{k}_{7}}{{C}_{{{\text{Pd}}}}}{{P}_{{{\text{CO}}}}}{{C}_{{\text{0}}}}{\text{(}}{{{\text{C}}}_{{\text{6}}}}{{{\text{H}}}_{{{\text{10}}}}}{\text{)}}C_{{\text{0}}}^{{\text{2}}}{\text{(TsOH}}){{C}_{0}}{\text{(C}}{{{\text{H}}}_{{\text{3}}}}{\text{OH)}}}}, \\ \end{gathered} $Введем новый параметр:
Тогда
(21)
$\frac{{e{\text{'}}}}{{k_{{ef1}}^{'}}} = \frac{{{{K}_{{12}}}{{H}_{{{\text{CO}}}}}}}{{{{K}_{2}}{{K}_{3}}{{K}_{4}}{{K}_{5}}{{K}_{6}}{{k}_{7}}}}.$Величины давления СО и концентраций различных участников реакции указаны в подписи к рис. 2. С использованием этих величин были рассчитаны значения ${{e{\text{'}}} \mathord{\left/ {\vphantom {{e{\text{'}}} {k_{{ef1}}^{'}}}} \right. \kern-0em} {k_{{ef1}}^{'}}}$ (см. табл. 1), которые подчиняются уравнению Аррениуса
(22)
$\frac{{e{\text{'}}}}{{k_{{ef1}}^{'}}} = {{10}^{{3.048}}}\exp \left( {\frac{{65 \pm 2}}{{RT}}} \right),\,\;\frac{{{\text{м о л }}{{{\text{ь }}}^{{\text{2}}}} \cdot {\text{П а }} \cdot {\text{c}}}}{{{{{\text{м }}}^{{\text{6}}}}}}.$Ранее для реакции гидрокарбометоксилирования циклогексена при катализе системой Pd(OAc)2 – PPh3 – TsOH в среде толуола нами были оценены значения эффективной константы ${{b'} \mathord{\left/ {\vphantom {{b'} {k_{{ef\,2}}^{'}}}} \right. \kern-0em} {k_{{ef\,2}}^{'}}}$, представляющей собой следующую комбинацию констант различных стадий процесса [16]:
(23)
$\frac{{b{\text{'}}}}{{k{{{_{{ef2}}^{'}}}_{{}}}}} = \frac{{{{K}_{9}}}}{{{{K}_{2}}{{K}_{3}}{{K}_{4}}{{K}_{5}}{{K}_{6}}{{k}_{7}}{{H}_{{{\text{CO}}}}}}},$и уравнение Аррениуса [16]
Из выражений (21) и (23) следует
(24)
$\begin{gathered} \ln \frac{{e{\text{'}}}}{{k_{{ef1}}^{'}}} - \ln \frac{{b{\text{'}}}}{{k_{{ef2}}^{'}}} = \frac{{\Delta {{S}_{{12}}} - \Delta {{S}_{9}}}}{R} - \\ - \,\,\frac{{\Delta {{H}_{{12}}} - \Delta {{H}_{9}}}}{{RT}} + 2\ln {{H}_{{{\text{CO}}}}}. \\ \end{gathered} $Следовательно, разность значений двух эффективных энергий активации будет равна
Воспользовавшись значением теплоты $\Delta {{H}_{{\text{H}}}} = - 6\;\,{{{\text{к Д ж }}} \mathord{\left/ {\vphantom {{{\text{к Д ж }}} {{\text{м о л ь }}}}} \right. \kern-0em} {{\text{м о л ь }}}}$ из данных работы [20], получим
(25)
$\begin{gathered} \Delta {{H}_{{12}}} - \Delta {{H}_{9}} = - 65 - ( - 69) - \\ - \,\,2( - 6) = 16\;\,{{{\text{к Д ж }}} \mathord{\left/ {\vphantom {{{\text{к Д ж }}} {{\text{м о л ь }}}}} \right. \kern-0em} {{\text{м о л ь }}}}{\text{.}} \\ \end{gathered} $Подставив в уравнение (24) значения разности изменения энтальпий из уравнения (25), значения эффективных констант ${{e{\text{'}}} \mathord{\left/ {\vphantom {{e{\text{'}}} {k_{{ef1}}^{'}}}} \right. \kern-0em} {k_{{ef1}}^{'}}}$ (табл. 1), ${{b'} \mathord{\left/ {\vphantom {{b'} {k_{{ef\,2}}^{'}}}} \right. \kern-0em} {k_{{ef\,2}}^{'}}}$ [16] при 373 К и значение ${{H}_{{{\text{CO}}}}} = 8.77 \cdot {{10}^{3}}\;{{{\text{П а }} \cdot {{{\text{м }}}^{{\text{3}}}}} \mathord{\left/ {\vphantom {{{\text{П а }} \cdot {{{\text{м }}}^{{\text{3}}}}} {{\text{м о л ь }}}}} \right. \kern-0em} {{\text{м о л ь }}}}$ [20], получим
Значения разностей $\Delta {{H}_{{12}}} - \Delta {{H}_{9}}$ и $\Delta {{S}_{{12}}} - \Delta {{S}_{9}}$ отражают изменение энтальпии и энтропии в реакции лигандного обмена между комплексами:
Изменение свободной энергии Гиббса в этой реакции при 373 К есть
Как показывает найденное значение $\Delta {{H}_{{26}}},$ реакция (26) слабоэндотермична. Энергия связывания молекулы СО с атомом палладия в комплексе Х8 на 8 кДж/моль превышает энергию связывания молекулы PPh3 в комплексе Х11. Это позволяет сделать вывод о том, что в условиях реакции комплекс Х8 несколько стабильнее комплекса Х11. Увеличение энтропии в реакции (26) соответствует общим закономерностям изменения энтропии при переходе от молекулы с меньшим числом атомов (комплекс Х8) к молекуле с большим числом атомов (комплекс Х11) и газообразному продукту (СО). Полученное значение $\Delta G$ позволяет заключить, что в условиях гидрокарбометоксилирования циклогексена реакция (26) близка к состоянию равновесия.
Ранее путем аналогичных расчетов нами были оценены изменения энтальпии, энтропии и энергии Гиббса в реакции (27) [16].
На основании полученных термодинамических параметров реакций (26) и (27) можно составить ряд относительной стабильности “балластных” палладиевых комплексов –
(28)
$\begin{gathered} {\text{Pd(CO}}{{{\text{)}}}_{{\text{2}}}}{{{\text{(PP}}{{{\text{h}}}_{{\text{3}}}}{\text{)}}}_{{\text{2}}}} > {\text{Pd(PP}}{{{\text{h}}}_{{\text{3}}}}{{{\text{)}}}_{{\text{4}}}} > \\ > \,\,{\text{Pd(C}}{{{\text{H}}}_{{\text{3}}}}{\text{OH}}{{{\text{)}}}_{{\text{2}}}}{{{\text{(PP}}{{{\text{h}}}_{{\text{3}}}}{\text{)}}}_{{\text{2}}}}, \\ \end{gathered} $и ряд увеличения энтропии образования этих комплексов в условиях гидрокарбометоксилирования циклогексена –
(29)
$\begin{gathered} {\text{Pd(CO}}{{{\text{)}}}_{{\text{2}}}}{{{\text{(PP}}{{{\text{h}}}_{{\text{3}}}}{\text{)}}}_{{\text{2}}}} < {\text{Pd(PP}}{{{\text{h}}}_{{\text{3}}}}{{{\text{)}}}_{{\text{4}}}} \leqslant \\ \leqslant \,\,{\text{Pd(C}}{{{\text{H}}}_{{\text{3}}}}{\text{OH}}{{{\text{)}}}_{{\text{2}}}}{{{\text{(PP}}{{{\text{h}}}_{{\text{3}}}}{\text{)}}}_{{\text{2}}}}. \\ \end{gathered} $Сопоставляя ряд (28) с рядом увеличения координирующей способности лигандов CH3OH < $ < {\text{CO}} < {\text{PP}}{{{\text{h}}}_{{\text{3}}}},$ следует отметить, что более высокая стабильность комплекса Х8 по сравнению с комплексом Х11, по-видимому, обусловлена более высокой степенью сольватации комплекса Х8, содержащего полярные молекулы СО, молекулами метанола как компонента среды по сравнению с сольватацией стерически более объемного комплекса Х11 с малополярными лигандами PPh3. В то же время увеличение энтропии образования комплексов в ряду (29) обусловлено не только усложнением молекул (в этом случае комплекс Х11 должен иметь самую высокую энтропию образования в указанном ряду), но и эффектом сольватации комплекса Pd(CН3OН)2(PPh3)2 молекулами метанола как компонента среды.
Представленные в этой работе и полученные ранее [11, 16, 18] экспериментальные данные по влиянию различных участников реакции на ее скорость позволили получить кинетические модели гидрокарбометоксилирования циклогексена. Наиболее полный массив данных был получен при 378 К [11]. При 363 К было изучено влияние давления СО [18] и концентрации метанола [16], при 368 К – концентрации PPh3 и метанола [16], а при 373 и 383 К – влияние давления СО [18] и концентрации PPh3 на скорость реакции. С целью оценки эффективных констант при указанных температурах на основании массивов данных уравнение (14) было приведено к линейной форме по отношению к эффективным константам. Оценка констант в программе MS Excel 2010 на основании массивов данных выявила статистическую незначимость некоторых констант. В результате были получены следующие кинетические модели:
(30)
${{r}_{{{\text{363}}\,\,{\text{K}}}}} = \frac{{{{C}_{{{\text{Pd}}}}}{{P}_{{{\text{CO}}}}}\left[ {{{{\text{C}}}_{{\text{6}}}}{{{\text{H}}}_{{{\text{10}}}}}} \right]\left[ {{\text{C}}{{{\text{H}}}_{{\text{3}}}}{\text{OH}}} \right]C_{0}^{2}({\text{TsOH}})}}{{\left[ {{\text{(3}}{\text{.6}} \pm 1.{\text{1)}} \cdot {\text{1}}{{{\text{0}}}^{{\text{2}}}}{{{\left[ {{\text{C}}{{{\text{H}}}_{{\text{3}}}}{\text{OH}}} \right]}}^{{\text{2}}}} + {\text{(6}}{\text{.0}} \pm {\text{3}}{\text{.8)}} \cdot {\text{1}}{{{\text{0}}}^{{ - {\text{12}}}}}P_{{{\text{CO}}}}^{{\text{2}}}} \right]}}\,\,\left[ {\frac{{{\text{м о л ь }}}}{{{\text{л }} \cdot {\text{м и н }}}}} \right],$(31)
${{r}_{{{\text{368}}\,{\text{K}}}}} = \frac{{{{C}_{{{\text{Pd}}}}}{{P}_{{{\text{CO}}}}}\left[ {{{{\text{C}}}_{{\text{6}}}}{{{\text{H}}}_{{{\text{10}}}}}} \right]\left[ {{\text{C}}{{{\text{H}}}_{{\text{3}}}}{\text{OH}}} \right]C_{0}^{2}({\text{TsOH}})\left[ {{\text{PP}}{{{\text{h}}}_{{\text{3}}}}} \right]}}{{\left[ {{\text{(7}}{\text{.7}} \pm {\text{0}}{\text{.8)}} \cdot {\text{1}}{{{\text{0}}}^{{\text{2}}}}{{{\left[ {{\text{C}}{{{\text{H}}}_{{\text{3}}}}{\text{OH}}} \right]}}^{{\text{2}}}}\left[ {{\text{PP}}{{{\text{h}}}_{{\text{3}}}}} \right] + {\text{(7}}{\text{.0}} \pm {\text{2}}{\text{.0)}} \cdot {\text{1}}{{{\text{0}}}^{{ - {\text{8}}}}}{{P}_{{{\text{CO}}}}} + {\text{(1}}{\text{.6}} \pm {\text{1}}{\text{.3)}} \cdot {\text{1}}{{{\text{0}}}^{{\text{4}}}}{{{\left[ {{\text{PP}}{{{\text{h}}}_{{\text{3}}}}} \right]}}^{3}}} \right]}}\,\,\left[ {\frac{{{\text{м о л ь }}}}{{{\text{л }} \cdot {\text{м и н }}}}} \right],$(32)
${{r}_{{{\text{373}}\,\,{\text{K}}}}} = \frac{{{{C}_{{{\text{Pd}}}}}{{P}_{{{\text{CO}}}}}\left[ {{{{\text{C}}}_{{\text{6}}}}{{{\text{H}}}_{{{\text{10}}}}}} \right]\left[ {{\text{C}}{{{\text{H}}}_{{\text{3}}}}{\text{OH}}} \right]C_{0}^{2}({\text{TsOH}})[{\text{PP}}{{{\text{h}}}_{3}}]}}{{\left[ {{\text{(1}}{\text{.9}} \pm {\text{0}}{\text{.5)}} \cdot {\text{1}}{{{\text{0}}}^{{ - {\text{11}}}}}P_{{{\text{CO}}}}^{{\text{2}}}[{\text{PP}}{{{\text{h}}}_{3}}] + {\text{(1}}{\text{.8}} \pm 0.{\text{4)}} \cdot {\text{1}}{{{\text{0}}}^{{ - {\text{7}}}}}{{P}_{{{\text{CO}}}}} + {\text{(3}}{\text{.1}} \pm 0.{\text{7)}} \cdot {\text{1}}{{{\text{0}}}^{{\text{4}}}}{{{\left[ {{\text{PP}}{{{\text{h}}}_{3}}} \right]}}^{{\text{3}}}}} \right]}}\,\,\left[ {\frac{{{\text{м о л ь }}}}{{{\text{л }} \cdot {\text{м и н }}}}} \right],$(33)
${{r}_{{{\text{378}}\,\,{\text{K}}}}} = \frac{{{{C}_{{{\text{Pd}}}}}{{P}_{{{\text{CO}}}}}\left[ {{{{\text{C}}}_{{\text{6}}}}{{{\text{H}}}_{{{\text{10}}}}}} \right]\left[ {{\text{C}}{{{\text{H}}}_{{\text{3}}}}{\text{OH}}} \right]C_{0}^{2}({\text{TsOH}})\left[ {{\text{PP}}{{{\text{h}}}_{{\text{3}}}}} \right]}}{{\left[ {{\text{(4}}{\text{.6}} \pm {\text{0}}{\text{.5)}} \cdot {\text{1}}{{{\text{0}}}^{{\text{2}}}}{{{\left[ {{\text{C}}{{{\text{H}}}_{{\text{3}}}}{\text{OH}}} \right]}}^{{\text{2}}}}\left[ {{\text{PP}}{{{\text{h}}}_{{\text{3}}}}} \right] + {\text{(2}}{\text{.0}} \pm {\text{1}}{\text{.6)}} \cdot {\text{1}}{{{\text{0}}}^{{ - {\text{12}}}}}P_{{{\text{CO}}}}^{{\text{2}}}\left[ {{\text{PP}}{{{\text{h}}}_{{\text{3}}}}} \right] + {\text{(6}}{\text{.0}} \pm {\text{1}}{\text{.3)}} \cdot {\text{1}}{{{\text{0}}}^{{ - {\text{8}}}}}{{P}_{{{\text{CO}}}}}} \right]}}\,\,\left[ {\frac{{{\text{м о л ь }}}}{{{\text{л }} \cdot {\text{м и н }}}}} \right],$(34)
${{r}_{{{\text{383}}\,\,{\text{K}}}}} = \frac{{{{C}_{{{\text{Pd}}}}}{{P}_{{{\text{CO}}}}}\left[ {{{{\text{C}}}_{{\text{6}}}}{{{\text{H}}}_{{{\text{10}}}}}} \right]\left[ {{\text{C}}{{{\text{H}}}_{{\text{3}}}}{\text{OH}}} \right]C_{0}^{2}({\text{TsOH}})[{\text{PP}}{{{\text{h}}}_{3}}]}}{{\left[ {{\text{(1}}{\text{.3}} \pm {\text{0}}{\text{.5)}} \cdot {\text{1}}{{{\text{0}}}^{{ - {\text{11}}}}}P_{{{\text{CO}}}}^{{\text{2}}}[{\text{PP}}{{{\text{h}}}_{3}}] + {\text{(1}}{\text{.3}} \pm 0.{\text{3)}} \cdot {\text{1}}{{{\text{0}}}^{{ - {\text{7}}}}}{{P}_{{{\text{CO}}}}} + {\text{(2}}{\text{.0}} \pm 0.{\text{6)}} \cdot {\text{1}}{{{\text{0}}}^{{\text{4}}}}{{{\left[ {{\text{PP}}{{{\text{h}}}_{3}}} \right]}}^{{\text{3}}}}} \right]}}\,\,\left[ {\frac{{{\text{м о л ь }}}}{{{\text{л }} \cdot {\text{м и н }}}}} \right].$Модель (30) получена в условиях: Т = 363 К, РСО = (0.35–4.1) · 106 Па, концентрации (моль/л): С0(C6H10) = 0.10, С0(CH3ОН) = 0.05–1.0, СPd = 2.0 · · 10–3, [PPh3] = 8.0 · 10–3, C0(TsOH) = 2.4 · 10–2. Модель (31) получена при 368 К, [PPh3] = (0.1–6.6) · · 10–2 моль/л, РСО = 2.0 ⋅ 106 Па, концентрации циклогексена, метанола, Pd(OAc)2 и TsOH использовались те же, что и в случае модели (30). Модели (32) и (34) были получены при 373 и 383 К соответственно, С0(CH3ОН) = 0.45 моль/л, [PPh3] = (0.1–9.6) · 10–2 моль/л, диапазон давлений СО, концентрации циклогексена, Pd(OAc)2 и TsOH были те же, что и в случае модели (30). Модель (33) получена при 378 К в диапазонах давлений РСО = (0.6–6.1) · 106 Па и концентраций (моль/л): С0(C6H10) = 0.02–0.11, СPd = (1.0–6.0) · · 10–3, [PPh3] = (0.05–9.6) · 10–2, C0(TsOH) = (0.5–6.5) · 10–2, концентрация CH3ОН варьировалась в том же диапазоне, что и в случае модели (30).
С использованием интегральной формы уравнений (30)–(34) были получены кинетические кривые накопления эфира, которые продемонстрировали удовлетворительное совпадение экспериментальных и расчетных данных. Некоторые из этих кривых представлены на рис. 1. Таким образом, разработанные кинетические модели работают не только в области начальных скоростей, но и на всем протяжении реакции.
ЗАКЛЮЧЕНИЕ
В диапазоне температур 368–383 К установлены количественные закономерности влияния концентрации трифенилфосфина на скорость гидрокарбометоксилирования циклогексена. Показано, что в исследуемом температурном диапазоне зависимости скорости реакции от концентрации PPh3 проходят через максимумы. Полученные результаты интерпретированы в рамках гидридного механизма гидрокарбалкоксилирования, дополненного реакциями лигандного обмена, обусловливающими вывод части катализатора из активной формы. В исследуемом температурном диапазоне проведена оценка значений некоторых эффективных констант полученного ранее кинетического уравнения реакции. С использованием теории активированного комплекса на основании новых данных по влиянию концентрации трифенилфосфина и полученных ранее в диапазоне 363–383 К данных по влиянию давления СО на скорость гидрокарбометоксилирования циклогексена оценены эффективные энергии активации, изменение энтальпии, энтропии и свободной энергии Гиббса в реакции лигандного обмена между комплексами Pd(PPh3)4 и Pd(CO)2(PPh3)2. Установлено, что при 373 К эта реакция близка к состоянию равновесия. Получены ряды изменения относительной стабильности и энтропии образования “балластных” палладиевых комплексов в условиях гидрокарбометоксилирования в среде толуол–метанол. При температурах 363, 368, 373, 378 и 383 К получены кинетические модели гидрокарбометоксилирования циклогексена, отражающие совокупное влияние различных участников реакции на ее скорость и работающие на всем протяжении реакции.
Список литературы
Суербаев Х.А., Кудайбергенов Н.Ж., Вавасори А. // ЖОХ. 2017. Т. 87. № 4. С. 574.
Суербаев Х.А., Кудайбергенов Н.Ж., Курманситова А.К. // Ibid. 2016. Т. 86. № 9. С. 1562.
Rosales M., Pacheco I., Medira J., Fernandez J., Gonzalez A. et al. // Catal. Lett. 2014. V. 144. P. 1717; doi: https://doi.org/10.1007/s10562-014-1335-0
Amézquita-Valencia M., Achonduh G., Alper H. // J. Org. Chem. 2015. V. 80. № 12. P. 6419; doi: https://doi.org/10.1021/acs.joc.5b00851
Lemberg M., Sadowski G. // J. Chem. and Eng. Data. 2016. V. 61. № 9. P. 3317; doi: https://doi.org/10.1021/acs.jced.6b00360
Pongrácz P., Abu Seni A., Mika L.T., Kollár L. // Mol. Catal. 2017. V. 438. P. 15; doi: https://doi.org/10.1016/j.mcat.2017.05.010
Queirolo M., Vezzani A., Mancuso R., Gabriele B., Costa M., Ca’ N.D. // J. Mol. Catal. A: Chem. 2015. V. 398. P. 115; doi: https://doi.org/10.1016/j.molcata.2014.11.028
Liu J., Liu Q., Franke R., Jackstell R., Beller M. // J. American Chem. Soc. 2015. V. 137. № 26. P. 8556; doi: https://doi.org/10.1021/jacs.5b04052
Kiss G. // Chemical Reviews. 2001. V. 101. № 11. P. 3435; doi: https://doi.org/10.1021/cr010328q
Vavasori A., Toniolo L., Cavinato G. // J. Mol. Catal. A: Chem. 2003. V. 191. P. 9; doi: https://doi.org/10.1016/S1381-1169(02)00358-8
Аверьянов В.А., Севостьянова Н.Т., Баташев С.А., Воробьев А.А., Родионова А.С. // Хим. физика. 2014. Т. 33. № 3. С. 19; doi:
Nifant’ev I.E., Sevostyanova N.T., Averyanov V.A. et al. // Appl. Catal., A: General. 2012. V. 449. P. 145; doi: https://doi.org/10.1016/j.apcata.2012.09.020
Vavasori A., Cavinato G., Toniolo L. // J. Mol. Catal. A: Chem. 2001. V. 176. P. 11; doi: https://doi.org/10.1016/S1381-1169(01)00235-7
Nifant’ev I., Sevostyanova N., Batashev S., Vorobiev A., Tavtorkin A. // React. Kinet. Mech. Catal. 2015. V. 116. P. 63; doi: https://doi.org/10.1007/s11144-015-0888-2
Nifant’ev I.E., Batashev S.A., Toloraya S.A. et al. // J. Mol. Catal. A: Chem. 2011. V. 350. P. 64; doi: https://doi.org/10.1016/j.molcata.2011.09.005
Севостьянова Н.Т., Баташев С.А., Родионова А.С. // Хим. физика. 2016. Т. 35. № 3. С. 49; doi:
Seayad A., Jayasree S., Damodaran K., Toniolo L., Chaudhari R.V. // J. Organomet. Chem. 2000. V. 601. P. 100; doi: https://doi.org/10.1016/S0022-328X(00)00041-3
Севостьянова Н.Т., Аверьянов В.А., Баташев С.А., Родионова А.С., Воробьев А.А. // Известия АН. Сер. хим. 2014. № 4. С. 837.
Аверьянов В.А., Севостьянова Н.Т., Баташев С.А. // Изв. вузов. Химия и хим. технология. 2012. Т. 55. Вып. 4. С. 111.
Yoshida H., Sugita N., Kudo K., Takezaki Y. // Bull. Chem. Soc. Jpn. 1976. V. 49. № 8. P. 2245; doi: https://doi.org/10.1246/bcsj.49.2245
Дополнительные материалы отсутствуют.
Инструменты
Химическая физика