Журнал высшей нервной деятельности им. И.П. Павлова, 2023, T. 73, № 3, стр. 398-410
Фоновая ЭЭГ-активность опосредует ассоциации между BDNF-VAL66MET-полиморфизмом и памятью при старении
Н. В. Вольф 1, 2, *, Е. Ю. Приводнова 1, 2
1 Научно-исследовательский институт нейронаук и медицины,
Новосибирск, Россия
2 Новосибирский государственный университет
Новосибирск, Россия
* E-mail: volfnv@neuronm.ru
Поступила в редакцию 08.11.2022
После доработки 24.12.2022
Принята к публикации 27.02.2023
- EDN: TTRRJK
- DOI: 10.31857/S0044467723030139
Аннотация
Значительная гетерогенность когнитивного старения объясняется влиянием как генетических, так и средовых факторов. BDNF (brain-derived neurotrophic factor) – нейротропный фактор, вовлеченный в процессы пластичности зрелого мозга. Val66Met-полиморфизм является функциональным полиморфизмом гена BDNF, что обусловливает его ассоциации с архитектоникой и функциями мозга и эффективностью когнитивных функций. Задачей настоящего исследования было выявить связанные со старением особенности взаимосвязей между Val66Met-полиморфизмом и эффективностью процессов вербальной памяти, определяемой в дихотическом тесте, а также с фоновой осцилляторной активностью мозга, регистрируемой при закрытых глазах в 52 ЭЭГ-отведениях. В исследовании участвовали 235 праворуких европеоидов молодого (МВ, средний возраст 21.65 лет, SD = 3.18) и 141 старшего возраста (СВ, средний возраст 64.37 лет, SD = 6.04). Ассоциированные с BDNF-Val66Met-полиморфизмом различия в показателях памяти и паттернах ЭЭГ-активности выявлены только у лиц СВ. При дихотическом тестировании испытуемые СВ с генотипом Val/Val воспроизводили меньше слов с правого уха по сравнению с носителями Met-аллеля. При анализе ЭЭГ различия между генотипами обнаружены в фокальных показателях асимметрии мощности дельта-, тета-, бета1- и бета2-ритмов и были обусловлены большей мощностью ритмов в центрально-темпоральных отделах правого по сравнению с левым полушарием у Val/Val при обратном соотношении у носителей Met-аллеля. Для бета2-ритма аналогичные различия в асимметрии были характерны также для париетально-окципитальных областей полушарий. Обнаружено, что показатели центрально-темпоральной асимметрии являются медиаторами в ассоциации между полиморфизмом гена BDNF и эффективностью памяти. Полученные данные впервые показывают возрастные различия в эффектах Val66Met-полиморфизма BDNF в отношении эффективности вербальной памяти и мощности ЭЭГ и указывают на возможные взаимосвязи между этими ассоциированными с генотипом параметрами.
При прогрессивном увеличении продолжительности жизни и сроков трудовой деятельности сохранение интеллектуальных способностей в пожилом возрасте является фактором, влияющим на благополучие общества. Анализ когнитивного старения показывает значительную гетерогенность этого процесса (Nyberg et al., 2020), что объясняется влиянием как генетических, так и средовых факторов (Li et al., 2020).
BDNF (brain-derived neurotrophic factor) является нейротропным фактором, вовлеченным в процессы пластичности мозга. Наряду с ролью в процессах развития нервной системы, BDNF также регулирует выживание нейронов, плотность нейронных шипиков, структуру и функции синапсов и нейронных сетей во взрослой жизни, таким образом, сильно влияя на когнитивные процессы (Kowiaoski et al., 2018). Наиболее широко изученным полиморфизмом в гене BDNF является однонуклеотидный (SNP) G196A-полиморфизм (rs6265). Полиморфизм G196A обусловлен заменой аминокислоты валин на метионин в положении кодона 66 (Val66Met). При этом происходит снижение зависимой от активности секреции BDNF (Colucci-D’Amato et al., 2020).
Показано, что когнитивное старение сопровождается уменьшением объема гиппокампа и ухудшением памяти (Mercado et al., 2017). Выявление высокой экспрессии BDNF в гиппокампе, коре, базальных отделах переднего мозга и его роли в регуляции связанных с памятью процессов долговременной потенциации в гиппокампе (De Vincenti et al., 2019) привело к исследованию ассоциаций между BDNF-Val66Met-полиморфизмом и изменениями памяти при старении. Тем не менее нейронные механизмы, опосредующие взаимосвязь этих факторов, остаются неизвестными.
Показано, что генетические особенности находят отражение в характеристиках мозговых функций, определяемых на основе показателей фоновой ЭЭГ. Характеристики ЭЭГ являются высоко наследуемыми (Smit et al., 2005) и стабильными во времени. Также установлено, что изменения электрофизиологических показателей работы мозга являются более чувствительным маркером нейродегенеративных процессов, чем психометрические тесты, фиксирующие поведенческую эффективность (Rochart et al., 2020). Соответственно, эффекты Val66Met-полиморфизма BDNF на возрастные изменения осцилляторной активности, определяемые по характеристикам фоновой ЭЭГ, также могут быть более выраженными, чем в отношении поведенческих функций. Исследование этих эффектов приближает к пониманию нейрофизиологических механизмов ассоциации полиморфизма BDNF с показателями ментального здоровья, в частности памяти, в пожилом возрасте.
Задачей настоящего исследования было выявление ассоциаций между генотипами полиморфизма BDNF и эффективностью вербальной памяти, а также характеристиками электрической активности мозга и определение того, опосредуют ли выявленные особенности мозговой активности ассоциированные с генотипом возрастные изменения памяти. Основываясь на результатах наших предыдущих исследований, показавших, что генетические различия в паттернах мозговой активности и поведенческих фенотипах в наибольшей степени проявляются на фоне обусловленного старением снижения когнитивных резервов (Volf et al., 2016; Belou-sova et al., 2018; Вольф и др., 2019; Вольф, Приводнова, 2022), мы предполагали более вероятное выявление связанных с генотипом Val66Met-полиморфизма BDNF различий в группе пожилых испытуемых.
МЕТОДИКА
Иcпытуемые. В исследовании приняли участие 235 испытуемых-правшей, европеоидов молодого (МВ, 18–35 лет, средний возраст 21.65, SD = 3.1; 95 мужчин) и 141 – старшего возраста (СВ, 51–80 лет, средней возраст 64.37, SD = 6.04; 70 мужчин). Выборку составили студенты, аспиранты, технический, административный и научный персонал Новосибирского государственного университета и научно-исследовательских институтов Сибирского отделения Российской академии наук. Все испытуемые на момент исследования учились или работали полный рабочий день. Критериями исключения были психические, неврологические и серьезные соматические заболевания (рак, болезни сердца и диабет), черепно-мозговая травма в анамнезе, злоупотребление алкоголем или наркотиками, текущее лечение психотропными препаратами. Исследование было одобрено Этическим комитетом Научно-исследовательского института нейронаук и медицины и соответствовало принципам Хельсинкской декларации.
Исследование кратковременной памяти в процедуре дихотического тестирования. В процессе исследования с помощью компьютеризированного дихотического теста через головные телефоны испытуемым были предъявлены 7 списков, состоящих из 10 пар синхронно предъявляемых конкретных односложных или двусложных существительных. Существительные в парах были подобраны по частотному словарю, чтобы избежать предъявления в одной паре слов, различающихся по встречаемости в языке. Интервалы между парами слов в списке составляли 1 с, а между списками – 1 мин. Каждому списку предшествовала бинауральная команда “внимание”. После предъявления списка следовала команда “пишите”, после которой испытуемые письменно воспроизводили в произвольном порядке все запомненные слова. Воспроизведение заканчивалось по команде “конец воспроизведения”, предшествующей команде “внимание” перед предъявлением следующего списка. Испытуемые получали инструкцию не прислушиваться только к одному уху, а попытаться запомнить как можно больше слов с обоих ушей. Более подробно детали методики и результаты ее использования приведены ранее (Вольф, 2000). Для анализа использовали показатели количества воспроизведенных слов с правого и левого уха отдельно.
Регистрация и обработка ЭЭГ. Во время регистрации ЭЭГ испытуемые сидели в звукоизолированной комнате. Их просили свести к минимуму движения и моргание. Анализировали ЭЭГ, зарегистрированную в покое в течение 3 мин при закрытых глазах. Регистрацию ЭЭГ в 52 отведениях согласно модифицированной системе 10–20 (American Electroencephalographic Society, 1991) выполняли с помощью комплекса “Neuroscan 4.4” с коэффициентом усиления 250, полосой пропускания 0–70 Гц и частотой дискретизации 1000 Гц. Фронто-центральный электрод использовался в качестве заземления, а объединенный ушной электрод в качестве референтного. Сопротивление электродов было ниже 5 кОм. Одновременно регистрировали горизонтальную и вертикальную электроокулограмму, запись которой использовали при удалении глазодвигательных артефактов. Оставшиеся артефакты удаляли с помощью метода независимых компонент в пакете EEGLAB (http://www.sccn.ucsd.edu/eeglab/).
Учитывая связанное со старением смещение альфа-активности в область низких частот, границы частотных диапазонов были определены на основе индивидуальной частоты пика альфа-ритма (ИЧПА): (дельта: от 1 до ИЧПА-6); (тета: от ИЧПА-6 до ИЧПА-4); (альфа1: от ИЧПА-4 до ИЧПА-2); (альфа2: от ИЧПА-2 до ИЧПА); (альфа3: от ИЧПА до ИЧПА + 2); (бета1: от ИЧПА + 2 до 20 Гц); (бета2: от 20 до 30 Гц) и (гамма: от 30 до 45 Гц).
Для определения спектральной плотности ЭЭГ использовали быстрое преобразование Фурье. Данные отдельных электродов были сгруппированы в соответствии с их анатомическим расположением в 8 областях: фронтальная левая (Fp1, AF3, F7, F5, F3, F1), фронтальная правая (Fp2, AF4, F8, F6, F4, F2), центральная левая (FC3, FC1, C3, C1, CP3, CP1), центральная правая (FC4, FC2, C4, C2, CP4, CP2), центрально-темпоральная левая (FT7, FC5, T7, C5, TP7, CP5), центрально-темпоральная правая (FT8, FC6, T8, C6, TP8, CP6), теменно-затылочная левая (P7, P5, P3, P1, PO7, PO5, PO3, O1) и теменно-затылочная правая (P8, P6, P4, Р2, РО8, РО6, РО4, О2). Для каждой из этих областей были рассчитаны средние значения спектральной плотности мощности. Переменные ЭЭГ были логарифмически преобразованы, чтобы нормализовать распределение данных (Gasser et al., 1982; Knott et al., 2001; Yuvaraj et al., 2014).
Генотипирование. Геномную ДНК экстрагировали из клеток буккального эпителия. Генотипирование аллелельных вариантов полиморфизма BDNF Val66Met проводили с помощью полимеразной цепной реакции (ПЦР) по методике Sheikh и соавт. (Sheikh et al., 2010). В работе использовали четыре праймера для амплификации локуса BDNF, содержащего полиморфизм rs6265 (номер в базе Genebank: AB038670). Первый набор праймеров (P1 и P2) амплифицирует область 401 п.н., содержащую интересующий SNP, тогда как второй набор (P3 и P4) праймеров является аллель-специфичным и учитывает замену G → A (табл. 1). ПЦР-амплификацию проводили при начальной температуре денатурации 94°С в течение 5 мин, затем следовали 30 циклов 94°С в течение 45 с, 62.5°С в течение 60 с и 72°С в течение 60 с. На последней стадии проводилась заключительная элонгация при 72°C в течение 5 мин. Продукты ПЦР, включающие два аллель-специфичных ампликона (253 и 201 п.н.) и всю область (401 п.н.) в качестве внутреннего контроля, разделяли на 3%-м агарозном геле.
Таблица 1.
Праймеры для определения аллельных вариантов BDNF-Val66Met (rs6265) полиморфизма Table 1. Tetra PCR primers used in the BDNF Val66Met (rs6265) polymorphism assay
| Праймеры | Последовательность | Tпл, °C |
|---|---|---|
| P1 (прямой) | 5'-cctacagttccaccaggtgagaagagtg-3' | 68 |
| P2 (обратный) | 5'-tcatggacatgtttgcagcatctaggta-3' | 68 |
| P3 (G аллель-специфичный) | 5'-ctggtcctcatccaacagctcttctataac-3' | 67 |
| P4 (A аллель-специфичный) | 5'-atcattggctgacactttcgaaccca-3' | 70 |
Статистический анализ. Обработку экспериментальных данных производили с использованием дисперсионного анализа (ANOVA) на базе STATISTICA 8. При анализе поведенческих данных внутригрупповым фактором была ЛАТЕРАЛЬНОСТЬ (воспроизведение слов, адресованных соответственно правому или левому полушарию), межгрупповыми – ГЕНОТИП (Val/Val и Met-носители), ПОЛ (мужчины, женщины) и ВОЗРАСТ (МВ, СВ).
ANOVA ЭЭГ проводился для каждого частотного диапазона. Внутригрупповыми факторами были ОБЛАСТЬ (фронтальная, центральная, центрально-темпоральная, теменно-затылочная) и ЛАТЕРАЛЬНОСТЬ (левое и правое полушария). Межгрупповые факторы включали ГЕНОТИП, ПОЛ и ВОЗРАСТ. Последующий анализ значимых взаимодействий проводили с помощью плановых сравнений и критерия Фишера. Тест хи-квадрат использовали для определения соответствия распределения генотипов соотношению Харди–Вайнберга.
Исследование опосредования связей между генотипом и поведенческими индикаторами через работу мозга проведено с использованием медиационного анализа, который все чаще применяется в психобиологии для определения содержательных механизмов ассоциаций (например, Gatt et al., 2009). Чтобы избежать ограничений традиционного подхода к оценке медиации (подробный анализ ограничений изложен, например, в Hayes, 2009), мы применили статистический подход непосредственного тестирования эффекта медиации (Hayes, 2018) с помощью программного приложения PROCESS 3.5, базирующегося на синтаксисе SPSS. С помощью уравнений регрессии оценивается сила связей между предшествующей переменной и медиатором (коэффициент a) и сила связей между медиатором и результирующей переменной (коэффициент b) при статистическом контроле предшествующей переменной. Их произведение (ab) обозначает непрямой эффект предшествующей переменной на зависимую переменную через медиатор. Статистический вывод относительно непрямого эффекта (ab) рассчитывается с помощью доверительного интервала, полученного с использованием процесса бутстрапирования (использовано 10 000 рандомизаций). Если доверительный интервал не включает в себя ноль, то непрямой эффект считается значимым. Для контроля множественных сравнений при тестировании ряда моделей медиации применяли алгоритм FDR (False discovery rate) коррекции доверительных интервалов (Benjamini, Hochberg, 1995).
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЙ
Распределение Val/Val-, Val/Met-, Met/Met-генотипов не отличалось от соотношения Харди–Вайнберга, как для всех испытуемых (N = 376, χ2 = 1.34, p = 0. 84), так и в МВ- (N = 235, χ2 = 0.39, p = 0.83) и СВ-группах (N = 141, χ2 = 1.17, p = 0. 84). Демографические характеристики испытуемых представлены в табл. 2. Представители различных групп не отличались по возрасту и уровню образования. Учитывая редкую встречаемость генотипа Met/Met (N = 4; 1.7% в группе МВ и N = 3; 2.1% в СВ), он был объединен в одну группу с гетерозиготами Val/Met (N = 67; 28.5% в группе МВ и N = 42; 29.8% в СВ), которая была названа “Met-носители”.
Таблица 2.
Демографические характеристики в группах с разными генотипами BDNF Table 2. Demographic data in groups with different genotypes of the BDNF gene
| Показатели | Val/Val-гомозиготы | Met-носители | ||
|---|---|---|---|---|
| молодые (м/ж) 66/97 |
пожилые (м/ж) 48/49 |
молодые (м/ж) 29/43 |
пожилые (м/ж) 22/22 |
|
| M (SD) | M (SD) | M (SD) | M (SD) | |
| Возраст, годы | 21.63 (2.92) | 64.69 (6.16) | 21.69 (3.71) | 63.70 (6.00) |
| Годы обучения | 14.14 (0.71) | 13.62 (2.04) | 14.01 (0.89) | 14.22 (1.52) |
Данные дихотического тестирования. Поскольку задачей данного исследования было выявление эффектов, связанных с полиморфизмом Val66Met в гене BDNF, здесь и далее мы рассматриваем только эффекты, связанные с генотипом или его взаимодействиями с другими факторами.
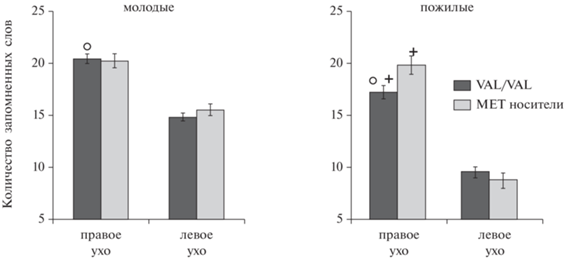
Для фактора ГЕНОТИП обнаружено только одно значимое взаимодействие ЛАТЕРАЛЬНОСТЬ × ВОЗРАСТ × ГЕНОТИП (F (1, 336) = 4.531, p = 0.034). Дальнейший анализ выявленного взаимодействия методом плановых сравнений показал, что оно обусловлено отсутствием ассоциированных с Val66Met-полиморфизмом различий в группе МВ, в отличие от СВ, в которой испытуемые с генотипом Val/Val воспроизводили меньше слов, чем носители Met-аллеля (F (1, 336) = = 5.470, p = 0.020). Также воспроизведение с правого уха отличалось у МВ и СВ с Val/Val-генотипом (F (1, 336) = 13.007, p = 0.0003, рис. 1).
Рис. 1.
Различия в запоминании дихотически предъявленных в правое ухо слов между Val/Val- и Met-носителями в группе испытуемых старшего возраста. Fig. 1. Differences in the e memorization of dichotically presented to the right ear words between Val/Val and Met carriers in the group of older adults.
ЭЭГ-данные. ANOVA мощности биопотенциалов дельта-частотного диапазона выявил взаимодействие факторов ОБЛАСТЬ × × ЛАТЕРАЛЬНОСТЬ × ГЕНОТИП (F (3, 1104) = 3.333, p = 0.019), а также ОБЛАСТЬ × × ЛАТЕРАЛЬНОСТЬ × ВОЗРАСТ × ГЕНОТИП (F (3, 1104) = 5.951, p = 0.0005). Поскольку факторы, включенные в первое взаимодействие, входили во взаимодействие более высокого порядка, мы проводили анализ только второго взаимодействия. Выявлено, что эффект BDNF-Val66Met-полиморфизма присутствует только у испытуемых СВ за счет противоположных значений межполушарной асимметрии мощности ритма (мощность в левом полушарии - мощность в правом) в центрально-темпоральных отделах: мощность в правом полушарии больше, чем в левом, у Val/Val, и наоборот – у носителей Met-аллеля (F (1, 368) = 7.648, p = 0.006, рис. 2).
Рис. 2.
Различия в асимметрии (мощность левого – мощность правого полушария) мощности дельта-, тета- и бета-ритмов в центрально-темпоральных областях полушарий между Val/Val и носителями Met-аллеля в группе пожилых испытуемых при отсутствии генетических различий у молодых. Fig. 2. Difference in the power asymmetry of delta, theta and beta rhythms in the central-temporal regions of the hemispheres between Val/Val and carriers of the Met allele in the group of elderly subjects in the absence of genetic differences in young people.
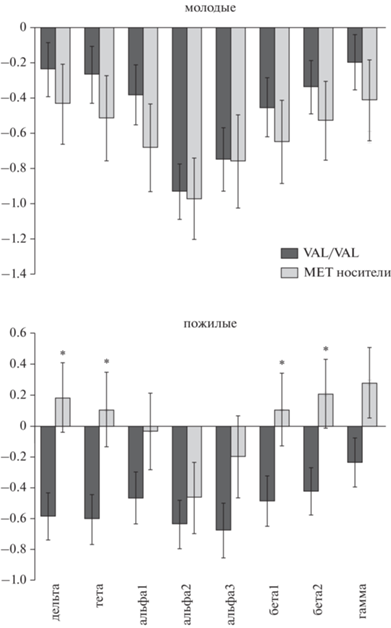
Для тета-частотного диапазона значимыми были взаимодействия ОБЛАСТЬ × ВОЗРАСТ × ГЕНОТИП (F (3, 1104) = 2.875, p = = 0.035), ЛАТЕРАЛЬНОСТЬ × ВОЗРАСТ × × ГЕНОТИП (F (1, 368) = 4.698, p = 0.031), которые входили во взаимодействие ОБЛАСТЬ × ЛАТЕРАЛЬНОСТЬ × ВОЗРАСТ × × ГЕНОТИП (F (3, 1104) = 3.724, p = 0.011). При анализе последнего взаимодействия различия между генотипами обнаружены только в группе СВ. Как и для дельта-ритма, они были обусловлены правосторонней асимметрией ритма у Val/Val и левосторонней – у носителей Met-аллеля в центрально-темпоральных областях полушарий (F (1, 368) = 5.855, p = 0.016).
При анализе мощности альфа1-ритма выявлено значимое взаимодействие ОБЛАСТЬ × ЛАТЕРАЛЬНОСТЬ × ВОЗРАСТ × ГЕНОТИП (F (3, 1104) = 3.118, p = 0.025). Однако различий между носителями разных генотипов не обнаружено ни в СВ-, ни в МВ-группах. Различия выявлены между СВ- и МВ-носителями Met-аллеля для показателя латеральной асимметрии в центрально-темпоральных областях (p < 0.05): правосторонняя асимметрия была выражена у МВ и отсутствовала у СВ.
Для ритмов альфа2- и альфа3-диапазонов не выявлено эффектов, связанных с генотипом или его взаимодействиями с другими факторами.
Для бета1-ритма обнаружено значимое взаимодействие ОБЛАСТЬ × ВОЗРАСТ × × ГЕНОТИП (F (3, 1104) = 2.875, p = 0.035), которое входило в следующее достоверное взаимодействие ОБЛАСТЬ × ЛАТЕРАЛЬНОСТЬ × ВОЗРАСТ × ГЕНОТИП (F (3, 1104) = 3.614, p = 0.0129). Его анализ показал, что в только в группе СВ асимметрия ритма в центрально-темпоральных областях полушарий у Val/Val была правосторонней, а у носителей Met-аллеля – левосторонней. Достоверность латеральных различий (F (1, 368) = = 4.579, p = 0.033).
Для бета2-диапазона выявлены следующие эффекты: ПОЛ × ГЕНОТИП (F (1, 368) = = 4.024, p = 0.046), ЛАТЕРАЛЬНОСТЬ × × ВОЗРАСТ × ГЕНОТИП (F (1, 368) = 5.337, p = 0.021), ОБЛАСТЬ × ЛАТЕРАЛЬНОСТЬ × × ВОЗРАСТ × ГЕНОТИП (F (3, 1104) = 4.518, p = 0.004). Взаимодействие, включающее ПОЛ, обусловлено тем, что у мужчин мощность ритма у носителей генотипа Val/Val меньше, чем у носителей Met-аллеля, при обратном соотношении у женщин. Анализ взаимодействия ОБЛАСТЬ × ЛАТЕРАЛЬНОСТЬ × ВОЗРАСТ × ГЕНОТИП показал, что связанные с BDNF-Val66Met-полиморфизмом различия у испытуемых СВ обусловлены различиями асимметрии ритма в центрально-темпоральных (F (1, 368) = 5.367, p = = 0.021) и париетально-окципитальных (F (1, 368) = 3.918, p = 0.049) областях полушарий мозга.
Для гамма-ритма не обнаружено эффектов, связанных с генотипом или его взаимодействиями с другими факторами.
Корреляции между характеристиками ЭЭГ и памяти. Поскольку только у пожилых испытуемых СВ обнаружены ассоциированные с генотипом различия, как в показателях воспроизведения слов с правого уха, так и в центрально-темпоральной асимметрии мощности ритмов, мы рассмотрели корреляции между этими показателями в группе СВ. Для всех выделенных ритмов обнаружены достоверные положительные корреляции между показателями асимметрии (мощность в левом полушарии – мощность в правом) и количеством слов, запомненных с правого уха (дельта: r = 0.20, p = 0.035, тета: r = 0.21, p = = 0.025, бета1: r = 0.25, p = 0.006, бета2: r = = 0.30, p = 0.001).
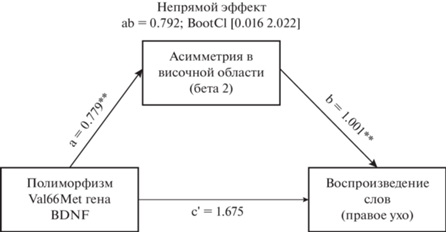
Медиационный анализ. Для исследования, опосредуют ли показатели фоновой мощности ЭЭГ ассоциации между генотипом BDNF и количеством непосредственно воспроизведенных слов с правого уха в старшей возрастной группе, был проведен медиационный анализ. Поскольку ассоциированные с полиморфизмом Val66Met различия были выявлены для показателей межполушарной асимметрии в височной области в дельта-, тета-, бета1- и бета2-ритмах, эти ЭЭГ-маркеры были использованы в качестве медиаторов; пол был учтен в модели в качестве ковариаты. Во всех построенных моделях были значимы эффекты, опосредованные медиаторами (непрямые эффекты, табл. 3), однако прямые эффекты генотипа на воспроизведение были статистически не значимы, что говорит об опосредовании эффекта генотипа на воспроизведение показателями асимметрии в электрической активности мозга. Значимость непрямых эффектов в протестированных моделях медиации сохранилась при FDR-коррекции доверительных интервалов для контроля множественных сравнений. Из четырех аналогичных моделей медиации мы визуализировали одну, для бета2-ритма (рис. 3).
Таблица 3.
Непрямой эффект Val66Met-полиморфизма гена BDNF на запоминание слов Table 3. Indirect effect of Val66Met BDNF gene polymorphism on words recall
| Ритм ЭЭГ (медиатор) |
Непрямой эффект | Доверительный интервал | ||
|---|---|---|---|---|
| ab | SE | нижняя граница | верхняя граница | |
| Дельта | 0.624 | 0.353 | 0.071 | 1.417 |
| Тета | 0.614 | 0.388 | 0.014 | 1.594 |
| Бета1 | 0.729 | 0.391 | 0.038 | 1.792 |
| Бета2 | 0.792 | 0.391 | 0.016 | 2.022 |
Примечание: ab – величина непрямого эффекта, рассчитанного на основе нестандартизированных регрессионных коэффициентов. Статистический вывод о значимости непрямых эффектов сделан на основе бутстраповского доверительного интервала, скорректированного по алгоритму FDR-коррекции. Значимые эффекты выделены жирным шрифтом. Note: ab – size of indirect effect based on unstandardized regression coefficients. Statistical inference on the significance of indirect effects is made based on bootstrap confidence interval adjusted by FDR correction algorithm. Significant effects are in bold.
Рис. 3.
Непрямой эффект полиморфизма Val66Met гена BDNF на количество воспроизведенных с правого уха слов через показатель асимметрии мощности бета2-ритма в центрально-темпоральной области у лиц старшего возраста. Примечание: Полиморфизм BDNF – бинарная переменная (Val/Val = 0, Met-носители = 1). c' и ab – нестандартизированные коэффициенты прямого и непрямого эффектов. BootCI – скорректированный по алгоритму FDR-коррекции бутстраповский доверительный интервал (98.75%). ** – p < 0.01. Fig. 3. Indirect effect of the Val66Met polymorphism of the BDNF gene on the number of words reproduced from the right ear through the beta2 rhythm power asymmetry in the central-temporal region among older adults. Note: BDNF polymorphism is a binary variable (Val/Val = 0, Met-carriers = 1). c' and ab are non-standardized coefficients of direct and indirect effects. BootCI – adjusted by FDR correction algorithm bootstrap confidence interval (98.75%). ** – p < 0.01.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Нами обнаружено, что старение является фактором, модулирующим ассоциации между полиморфизмом Val66Met гена BDNF и эффективностью вербальной памяти. Обусловленные полиморфизмом различия наблюдались только в группе СВ: испытуемые с генотипом Val/Val воспроизводили меньше слов с правого уха, чем носители Met-аллеля.
Отмеченное нами отсутствие влияния генотипа на показатели вербальной памяти у молодых испытуемых согласуется с данными ряда исследований (Houlihan et al., 2009; Cathomas et al., 2010; Karnik et al., 2010). В то же время в некоторых работах отмечены лучшие показатели в группе Val/Val по сравнению с Met-носителями (Ho et al., 2006; Egan et al., 2003). Неоднородность полученных результатов может быть обусловлена этническими особенностями выборки в работе (Ho et al., 2006). Что касается данных, полученных (Egan et al., 2003), то в этом исследовании Met-гомозиготы выделены в отдельную группу, отличающуюся от других генотипов, при отсутствии различий в эффективности памяти у носителей Val/Val и Val/Met. В этой связи мы должны отметить очень малое количество гомозигот Met/Met в группе Met-носителей в нашей выборке, что позволяет предположить, что Met-носители демонстрируют эффекты, свойственные преимущественно Val/Met-генотипу и согласующиеся с данными (Egan et al., 2003).
В литературе можно найти лишь единичные исследования влияния BDNF на вербальную память у здоровых пожилых испытуемых. Исследования с использованием для оценки памяти процедуры дихотического тестирования, позволяющего рассматривать эффекты, обусловленные функциональной специализацией полушарий, вообще отсутствуют. Обнаруженное нами лучшее воспроизведение слов с правого уха пожилыми носителями Met-аллеля согласуется с данными ряда других исследований. В задачах, характеризующих эффективность при основанном на памяти переключении заданий, у пожилых испытуемых аллель Met был связан с более низким уровнем ошибок, но не тогда, когда переключение управлялось внешними сигналами (Gajewski et al., 2011). С этими данными согласуются результаты, согласно которым у пожилых носителей Met в задании с аналогичным переключением эффективность не изменилась через 10 лет после первого тестирования, тогда как гомозиготы по Val продемонстрировали значительное снижение продуктивности (Erickson et al., 2008). В то же время у пожилых испытуемых в тесте на воспроизведение списков из 10 слов обнаружено отсутствие ассоциированных с полиморфизмом Val66Met различий при немедленном воспроизведении и лучшее воспроизведение у носителей Val/Val при отсроченном (Miyajima et al., 2008). Аналогичные данные по влиянию полиморфизма Val66Met гена BDNF получены при анализе немедленного и отсроченного воспроизведения рассказов у испытуемых СВ (Azeredo et al., 2017).
Приведенные данные позволяют заключить, что различия в выполняемых заданиях могут лежать в основе неоднозначности полученных результатов у пожилых испытуемых. Высказывается предположение, что простые тесты памяти не ассоциированы с полиморфизмом гена BDNF, но различия между генотипами будут проявляться при увеличении нагрузки на память. Это может иметь место как в сложных задачах с переключениями, управляемыми оперативной памятью, так и в дихотическом тесте, где предъявление списков слов осуществляется в условиях интерференции информации, синхронно поступающей в разные уши. Также возможно влияние отличий в социоэкономическом статусе, физической активности (Brown et al., 2019) и когнитивном резерве, зависящем, в частности, от интеллектуальной насыщенности внешней среды, в которой находятся пожилые испытуемые (Ward et al., 2017). В этой связи следует отметить, что, в отличие от большинства исследований с участием пожилых людей, наши испытуемые СВ представляют высокофункциональную группу, продолжавшую профессиональную деятельность на момент исследования.
Проведенное нами исследование ассоциаций между полиморфизмом Val66Met гена BDNF и характеристиками спектральной мощности ЭЭГ выявило различия в показателях осцилляторной активности между Val/Val- и Met-носителями также только у испытуемых СВ. Эти различия были обусловлены противоположными значениями межполушарной асимметрии мощности ритма в центрально-темпоральных отделах: мощность в правом полушарии больше, чем в левом, у Val/Val, и наоборот – у носителей Met-аллеля. Различия были достоверными для ритмов дельта, тета, и бета частотных диапазонов. Показано, что структуры темпоральной области, такие как гиппокамп, амигдала, медиальная темпоральная и ангулярная извилины, тесно связаны с вербальной памятью (Moradi et al., 2016). При этом запоминание вербальной информации сопровождается возрастанием активности височных структур преимущественно левого полушария (Kim, 2011). Можно предположить, что превалирование фоновой активности в центрально-темпоральной области левого полушария у пожилых носителей Met-аллеля может способствовать выявленному у них лучшему воспроизведению адресованных речевому левому полушарию слов с правого уха. Такое предположение подтверждается обнаруженными в настоящем исследовании положительными корреляциями между выраженностью левосторонней асимметрии мощности ЭЭГ-ритмов и эффективностью воспроизведения слов, адресованных левому полушарию, в группе СВ. Более обоснованное подтверждение дает исследование медиации, которое выявило непрямой эффект Val66Met-полиморфизма BDNF на эффективность непосредственного воспроизведения с правого уха через показатели асимметрии ритмов ЭЭГ в центрально-темпоральной области в группе старшего возраста.
Полученные результаты в общем согласуются с многочисленными данными, показывающими, что характеристики фоновой осцилляторной активности мозга влияют на последующую эффективность памяти. Конкретно, наши данные, основанные на анализе пространственно-частотных характеристик ЭЭГ в группе СВ, согласуются с результатами ранее проведенных исследований, обнаруживших, что увеличение предшествующей деятельности тета-активности в темпоральных отделах мозга ассоциировано с последующим успешным воспроизведением информации (Guderian et al., 2009; Lega et al., 2012; Gruber et al., 2013; Merkow et al., 2014; Scholz et al., 2017). Полученные в нашем исследовании данные об ассоциациях повышенной фоновой бета-активности в темпоральных областях с эффективностью памяти также находят подтверждение в ряде исследований (Noh, 2014; Salari, Rose, 2016; Schneider, Rose, 2016). Что касается мощности дельта-ритма, то ее величина в центрально-темпоральных отделах полушарий коррелирует с успешностью исполнительных функций, обеспечивающих переключение и селекцию информации (Vlahou et al., 2014), процессов, имеющих важное значение для контроля интерференции поступающей с разных ушей информации в процедуре дихотического тестирования.
В отличие от пожилых носителей Met-аллеля носители Val/Val-генотипа и молодые носители Met-аллеля характеризовались правосторонней асимметрией рассматриваемых ЭЭГ-ритмов. Ранее нами было показано, что запоминание конкретных существительных, предъявляемых в процедуре дихотического тестирования, возможно с применением разных стратегий. Наиболее распространенными являются прослушивание с последующим воспроизведением “всплывающих” слов и стратегия смыслового кодирования (“meaning strategy”), основанная на объединении слов в предложения или связанных с конкретными существительными образов в картины с последующим их словесным описанием (Вольф, 2000). Обнаружено, что самопроизвольный выбор эффективного семантического кодирования при запоминании вербальной информации ассоциирован с Val/Val-генотипом. Люди со сниженной экспрессией BDNF склонны использовать менее эффективные стратегии кодирования (Kennedy et al., 2015). Можно предположить, что молодые испытуемые, обладающие высоким когнитивным резервом, вне зависимости от генотипа могут сознательно использовать эффективную стратегию семантического кодирования, что согласуется с высокими показателями воспроизведения и их независимостью от полиморфизма Val66Met. В свою очередь генетическая предрасположенность к использованию стратегий семантического кодирования при возрастном снижении его эффективности может быть причиной наиболее низких показателей памяти у пожилых Val/Val-гомозигот. Таким образом, нельзя исключить, что различия в стратегиях запоминания наряду с генотипом могут модулировать ассоциации между фоновыми характеристиками ЭЭГ, Val66Met-полиморфизмом и эффективностью памяти. Физиологическая интерпретация обнаруженных эффектов требует дальнейшего изучения.
Ограничением нашего исследования является тот факт, что при применении ANOVA показатели достоверности различий приведены без коррекции на множественные сравнения, что приводит к повышению вероятности выявления случайных ассоциаций. Однако полученные результаты, во-первых, согласуются с выдвинутой во введении гипотезой о более вероятном выявлении ассоциаций BDNF Val66Met с исследуемыми в работе показателями ЭЭГ и памяти в группе испытуемых СВ. Кроме этого, выявление различий между Val/Val и носителями Met-аллеля в запоминании вербальной информации согласуется с многочисленными данными литературы, свидетельствующими об ассоциациях Val66Met-полиморфизма с эффективностью различных видов памяти. В пользу достоверности полученных результатов свидетельствуют также обнаруженные для данных группы СВ корреляции между ассоциированными с рассматриваемым полиморфизмом поведенческими и ЭЭГ-показателями и, наконец, факт наличия достоверных моделей медиации, согласно которым ассоциированные с BDNF-Val66Met-полиморфизмом ЭЭГ-характеристики опосредуют эффект полиморфизма в отношении вербальной памяти. При этом проверка достоверности моделей медиации проведена с коррекцией на множественные сравнения. Статистическую силу исследованию также добавляет факт использования довольно большой по меркам аналогичных исследований выборки.
ЗАКЛЮЧЕНИЕ
В настоящем исследовании мы впервые показали, что, при отсутствии генетических различий у молодых испытуемых, Val66Met-полиморфизм гена BDNF ассоциирован с эффективностью запоминания латерализованно предъявленной речевой информации и с паттернами асимметрии мощности дельта-, тета- и бета-ритмов в центрально-темпоральных областях полушарий у испытуемых пожилого возраста. Среди испытуемых старшего возраста Met-носители воспроизводили больше слов с правого уха и по сравнению с носителями Val/Val-генотипа. Обнаружено, что показатели центрально-темпоральной асимметрии являются медиаторами в ассоциации между полиморфизмом гена BDNF и эффективностью памяти.
Список литературы
Вольф Н.В. Половые различия функциональной организации процессов полушарной обработки речевой информации. Издательство ЦББР. Ростов-на-Дону. 2000. С. 239.
Вольф Н.В., Приводнова Е.Ю. Ассоциации между полиморфизмом STin2VNTR гена транспортера серотонина и характеристиками внимания при старении зависят от интеллектуальной среды профессиональной деятельности. Журн. высш. нервн. деят. им. И.П. Павлова. 2022. 72 (1): 77–86.
Вольф Н.В., Приводнова Е.Ю., Базовкина Д.В. Полиморфизм STin2VNTR гена транспортера серотонина: ассоциации с эффективностью кратковременной памяти у молодых и пожилых испытуемых. Журн. высш. нервн. деят. им. И.П. Павлова. 2019. 69 (5): 570–576.
Azeredo L.A., De Nardi T., Levandowski M.L., Tractenberg S.G., Kommers-Molina J., Wieck A., Irigaray T.Q., da Silva Filho I.G., Grassi-Oliveira R. The brain-derived neurotrophic factor (BDNF) gene Val66Met polymorphism affects memory performance in older adults. Braz. J. Psychiatry. 2017. 39 (2): 90–94.
Belousova L.V., Volf N.V., Bazovkina D.V. Dependence of aging-related changes in background brain activityon serotonin transporter gene 5-HTTLPR polymorphism in men. Human Physiology. 2018. 44 (5): 574–580.
Benjamini Y., Hochberg Y. Controlling the False Discovery Rate: A Practical and Powerful Approach to Multiple Testing. Journal of the Royal Statistical Society: Series B (Methodological). 1995. 57: 289–300.
Brown B.M., Castalanelli N., Rainey-Smith S.R., Doecke J., Weinborn M., Sohrabi H.R., Laws S.M., Martins R.N., Peiffer J.J. Influence of BDNF Val66Met on the relationship between cardiorespiratory fitness and memory in cognitively normal older adults. Behav. Brain. Res. 2019. 362: 103–108.
Cathomas F., Vogler C., Euler-Sigmund J.C., de Quervain D.J., Papassotiropoulos A. Fine-mapping of the brain-derived neurotrophic factor (BDNF) gene supports an association of the Val66Met polymorphism with episodic memory. Int. J. Neuropsychopharmacol. 2010. 13 (8): 975–980.
Colucci-D’Amato L, Speranza L, Volpicelli F. Neurotrophic factor BDNF, physiological functions and therapeutic potential in depression, neurodegeneration and brain cancer. Int. J. Mol. Sci. 2020. 21 (20): 7777.
De Vincenti A.P., Ríos A.S., Paratcha G., Ledda F. Mechanisms That Modulate and Diversify BDNF Functions: Implications for Hippocampal Synaptic Plasticity. Front. Cell Neurosci. 2019. 13: 135.
Egan M.F., Kojima M., Callicott J.H., Goldberg T.E., Kolachana B.S., Bertolino A., Zaitsev E., Gold B., Goldman D., Dean M., Lu B., Weinberger D.R. The BDNF val66met polymorphism affects activity-dependent secretion of BDNF and human memory and hippocampal function. Cell. 2003. 112: 257–269.
Erickson K.I., Kim J.S., Suever B.L., Voss M.W., Francis B.M., Kramer A.F. Genetic contributions to age-related decline in executive function: a 10-year longitudinal study of COMT and BDNF polymorphisms. Front. Hum. Neurosci. 2008. 2: 11.
Gajewski P.D., Hengstler J.G., Golka K., Falkenstein M., Beste C. The Met-allele of the BDNF Val66Met polymorphism enhances task switching in elderly. Neurobiol. Aging. 2011. 32 (12): 2327.e7–19
Gasser T., Bacher P., Mocks J. Transformations towards the normal distribution of broad spectral parameters of the EEG. Electroencephalogr Clin Neurophysiol. 1982. 53: 119–124.
Gatt J.M., Kuan S.A., Dobson-Stone C., Paul R.H., Joffe R.T., Kemp A.H., Gordon E., Schofield P.R., Williams L.M. Association between BDNF Val66Met polymorphism and trait depression is mediated via resting EEG alpha band activity. Biol. Psychol. 2008. 79 (2): 275–284.
Gruber M.J., Watrous A.J., Ekstrom A.D., Ranganath C., Otten L.J. Expected reward modulates encoding-related theta activity before an event. NeuroImage. 2013. 64: 68–74.
Guderian S., Schott B.H., Richardson-Klavehn A., Düzel E. Medial temporal theta state before an event predicts episodic encoding success in humans. PNAS. 2009. 106 (13): 5365–5370.
Hayes A.F. Beyond Baron and Kenny: Statistical mediation analysis in the new millennium. Communication Monographs. 2009. 76 (4): 408–420.
Hayes A.F. Introduction to Mediation, Moderation, and Conditional Process Analysis: A Regression-Based Approach (2nd Ed). New York: The Guilford Press. 2018.
Ho B.C., Milev P., O’Leary D.S., Librant A., Andreasen N.C., Wassink T.H. Cognitive and magnetic resonance imaging brain morphometric correlates of brain-derived neurotrophic factor Val66Met gene polymorphism in patients with schizophrenia and healthy volunteers. Arch Gen Psychiatry. 2006. 63: 731–740.
Houlihan L.M., Harris S.E., Luciano M., Gow A.J., Starr J.M., Visscher P.M., Deary I.J. Replication study of candidate genes for cognitive abilities: the Lothian Birth Cohort 1936. Genes Brain Behav. 2009. 8: 238–247.
Kennedy K.M., Reese E.D., Horn M.M., Sizemore A.N., Unni A.K., Meerbrey M.E., Kalich A.G., Rodrigue K.M. BDNF Val66Met polymorphism affects aging of multiple types of memory. Brain Res. 2015. 1612: 104–117.
Karnik M.S., Wang L., Barch D.M., Morris J.C., Csemansky J.G. BDNF polymorphism rs6265 and hippocampal structure and memory performance in healthy control subjects. Psychiatry Res. 2010. 178: 425–429.
Kim H. Neural activity that predicts subsequent memory and forgetting: A meta-analysis of 74 fMRI studies. Neuroimage. 2011. 54: 2446–2461.
Knott V., Mahoney C., Kennedy S., Evans K. EEG power, frequency, asymmetry, and coherence in male depression. Psychiatry Res. 2001. 106: 123–140.
Kowiański P., Lietzau G., Czuba E., Waśkow M., Steliga A., Moryś J. BDNF: A key factor with multipotent impact on brain signaling and synaptic plasticity. Cell Mol. Neurobiol. 2018. 38 (3): 579–593.
Lega B.C., Jacobs J., Kahana M. Human hippocampal theta oscillations and the formation of episodic memories. Hippocampus. 2012. 22 (4): 748–761.
Li S., Nguyen T.L., Wong E.M., Dugu P.A., Dit G.S., Armstrong N.J., Crai J.M., Mathe K.A., Sachde P.S., Saffer R., Sun J., Tan Q., Thalamuthu A., Miln R.L., Giles G.G., Southey M.C., Hoppe J.L. Genetic and environmental causes of variation in epigenetic aging across the lifespan. Clin Epigenetics. 2020. 12 (1): 158.
Mercado N.M., Collier T.J., Sortwell C.E., Steece-Collier K. BDNF in the aged brain: Translational implications for Parkinson’s disease. Austin Neurol. Neurosci. 2017. 2 (2): 1021.
Merkow M.B., Burke J.F., Stein J.M., Kahana M.J. Prestimulus theta in the human hippocampus predicts subsequent recognition but not recall. Hippocampus. 2014. 24 (12): 1562–1569.
Miyajima F., Ollier W., Mayes A. et al. Brain-derived neurotrophic factor polymorphism Val66Met influences cognitive abilities in the elderly. Genes Brain Behav. 2008. 7 (4): 411–417.
Moradi E., Hallikainen I., Hänninen T., Tohka J. Alzheimer’s disease neuroimaging initiative. Rey’s auditory verbal learning test scores can be predicted from whole brain MRI in Alzheimer’s disease. Neuroimage Clin. 2016. 13: 415–427.
Noh E., Herzmann G., Curran T., de Sa V.R. Using single-trial EEG to predict and analyze subsequent memory. NeuroImage. 2014. 84: 712–723.
Nyberg L., Boraxbek C.J., Sörman D.E., Hansson P., Herlit A., Kauppi K., Ljungberg J.K., Lövheim H., Lundquist A., Adolfsson A.N., Oudin A., Pudas S., Rönnlund M., Stiernstedt M., Sundström A., Adolfsso R. Biological and environmental predictors of heterogeneity in neurocognitive ageing: Evidence from Betula and other longitudinal studies. Ageing Res. Rev. 2020. 64: 101184.
Rochart R., Liu Q., Fonteh A.N., Harrington M.G., Arakaki X. Compromised behavior and gamma power during working memory in cognitively healthy individuals with abnormal CSF amyloid/tau. Front. Aging Neurosci. 2020. 12: 574214.
Salari N., Rose M. Dissociation of the functional relevance of different pre-stimulus oscillatory activity for memory formation. NeuroImage. 2016. 125: 1013–1021.
Schneider S.L., Rose M. Intention to encode boosts memory-related pre-stimulus EEG beta power. NeuroImage. 2016. 125: 978–987.
Schol S., Schneider S.L., Rose M. Differential effects of ongoing EEG beta and theta power on memory formation. PLoS One. 2017. 12 (2): e0171913.
Stacey J.E., Crook-Rumsey M., Sumich A., Howard C.J., Crawford T., Livn K., Lenzon S., Badham S. Age differences in resting state EEG and their relation to eye movements and cognitive performance. Neuropsychologia. 2021. 157: 107887
Smit D.J.A., Posthuma D., Boomsma D.I., Geus E.J.C. Heritability of background EEG across the power spectrum. Psychophysiology. 2005. 42: 691–697.
Sheikh H.I., Hayden E.P., Kryski K.R., Smith H.J., Singh S.M. Genotyping the BDNF rs6265 (val66met) polymorphism by one-step amplified refractory mutation system PCR. Psychiatr. Genet. 2010. 20 (3): 109–112.
Volf N.V., Belousova L.V., Knyazev G.G., Kulikov A.V. Interactive effect of 5-HTTLPR genotype and age on sources of cortical rhythms in healthy women. Int. J. Psychophysiol. 2016. 109: 107–115.
Ward D.D., Ande R., Saunders N.L., Thow M.E., Klekociuk S.Z., Bindoff A.D., Vickers J. The BDNF Val66Met polymorphism moderates the effect of cognitive reserve on 36-month cognitive change in healthy older adults. Alzheimers Dement. (N Y). 2017. 3 (3): 323–331.
Yuvara R., Murugappa M., Mohamed Ibrahim N., Iqbal M., Sundaraj K., Mohamad K., Palaniappan R., Mesquita E., Satiyan M. On the analysis of EEG power, frequency and asymmetry in Parkinson’s disease during emotion processing. Behav. Brain Funct. 2014. 10: 12.
Дополнительные материалы отсутствуют.
Инструменты
Журнал высшей нервной деятельности им. И.П. Павлова


