Журнал высшей нервной деятельности им. И.П. Павлова, 2023, T. 73, № 3, стр. 334-347
Влияние зрительного предъявления движений пальцев руки на моторный ответ, вызванный транскраниальной магнитной стимуляцией. Эффект, связанный с возможной реакцией системы зеркальных нейронов
К. Ньето-Доваль 1, А. А. Рагимова 1, М. Феурра 1, *
1 Центр нейроэкономики и когнитивных исследований Института когнитивных нейронаук,
Национальный исследовательский университет “Высшая школа экономики”
Москва, Россия
* E-mail: mfeurra@hse.ru
Поступила в редакцию 15.03.2022
После доработки 07.12.2022
Принята к публикации 27.02.2023
- EDN: TTOQDZ
- DOI: 10.31857/S0044467723030115
Аннотация
Исследования зеркальных нейронов прошли долгий путь с момента их открытия у приматов до современных экспериментов на людях. Однако остается много методологических вопросов о способе и времени предъявления стимулов в таких исследованиях. Каков оптимальный способ предъявления моторных стимулов? Можно ли оценить временную динамику эффекта зеркальных нейронов с помощью транскраниальной магнитной стимуляции в определенные отрезки времени? В текущем исследовании мы рассматривали различные типы предъявления стимулов (фото и видео движения руки), используя одноимпульсную транскраниальную магнитную стимуляцию (ТМС) первичной моторной коры (М1) доминантного полушария в разных временных окнах (0, 320, 640 мс). Были зарегистрированы моторные вызванные потенциалы (МВП) от первой тыльной межкостной мышцы (FDI, мышца указательного пальца) и от мышцы, отводящей мизинец (ADM, мышца мизинца) с помощью клейких электродов, размещенных на мышцах рук, у 11 здоровых испытуемых в состоянии покоя с ортогональным положением рук при наблюдении за зрительными стимулами в трех различных условиях предъявления. Результаты исследования показали, что видеостимулы вызывают самый сильный зеркальный эффект при подаче ТМС-стимула через 320 мс с момента предъявления движения. Этот эффект специфичен для определенных мышц. Полученные данные помогут сформировать оптимальный протокол для исследования системы зеркальных нейронов у человека и будут способствовать дальнейшему применению его в клинике при исследованиях на пациентах и при реабилитации.
ВВЕДЕНИЕ
С момента открытия зеркальных нейронов проведено много исследований, направленных на изучение их происхождения и функционирования. Зеркальные нейроны – это группа нейронов, которые активизируются как при выполнении действия самим индивидом, так и при наблюдении за действием, которое выполняет другой индивид (Rizzolatti, Craighero, 2004; Di Pellegrino, 1992). Было показано, что у животных зеркальные нейроны пассивно связаны с пониманием действий, а у человека также активно участвуют в процессе обучения при имитации действий других людей (Rizzolatti, Craighero, 2004). Таким образом, зеркальные нейроны выполняют функцию преобразования информации о наблюдаемых действиях в наш собственный двигательный паттерн, учитывая индивидуальную способность сопоставлять восприятие действия с его выполнением (Oztop et al., 2006; Umilta et al., 2001).
Данные нейровизуализационных исследований с применением функциональной магнитно-резонансной томографии (фМРТ) и регистрации нейронов на обезьянах показали локальную активацию зеркальной системы при наблюдении за выполняемым действием (Fogassi et al., 1992; Di Pellegrino et al., 1992; Rizzolatti, Craighero, 2004).
Зеркальные нейроны были впервые обнаружены в области вентральной премоторной коры (PMv, область F5), а затем в нижней теменной доле (IPL) обезьяны. При детальном исследовании к системе зеркальных нейронов у обезьян стали относить и каудальную часть нижней лобной извилины (IFG) (Fogassi et al., 2005; Rizzolatti et al., 1996; Rizzolatti, Craighero, 2004; Rizzolatti et al., 2006).
Методы неинвазивной стимуляции мозга, такие как транскраниальная магнитная стимуляция (ТМС), широко используются для исследования зеркальных нейронов у человека11.
Несмотря на большое количество исследований, посвященных изучению зеркальных нейронов, несколько важных вопросов остаются без ответа: какой тип представления движения в рамках эксперимента является оптимальным и вызывает самый сильный ответ системы зеркальных нейронов? Какая продолжительность ТМС-стимуляции на моторную кору является оптимальной в рамках изучения зеркальных нейронов? Основная цель данной работы состояла в том, чтобы понять, можно ли модулировать и максимизировать наблюдаемые эффекты системы зеркальных нейронов во время визуализации движения, используя различные виды предъявления стимулов и время ТМС.
В исследованиях зеркальных нейронов на человеке используют различные способы зрительного предъявления стимулов. Однако, несмотря на то, что все они демонстрируют эффекты работы зеркальных нейронов, некоторые способы визуализации двигательных стимулов более надежны, чем другие, в отношении воспроизводимости между предъявлениями стимулов и индивидуальными особенностями испытуемых в зависимости от времени начала ТМС.
К наименее надежным методам можно отнести исследования, основанные на воображении движения (Bianco et al., 2012; Rossini et al., 1999), где результаты зависели от способностей испытуемых к воображению.
Исследования с демонстрацией реальных движений, выполняемых ассистентом во время эксперимента, показывают более высокую воспроизводимость (Bianco et al., 2012; Feurra et al., 2019). Основными недостатками подобных исследований являются невозможность синхронного предъявления движения и ТМС-стимуляции и невозможность идеально воспроизвести движение каждый раз с точно такими же пространственными и временными характеристиками.
На данный момент наиболее надежным методом зрительного предъявления стимулов для изучения зеркальных нейронов является предъявление образов движения в фото- или видеоформате, которые считаются более надежными из-за точного повторения движений и возможности стимуляции с помощью ТМС в определенное и заранее установленное время с высокой точностью во время наблюдения за стимулом, одинаково для всех испытуемых, с использованием программного и аппаратного обеспечения. Способ предъявления стимулов, использованных в данном исследовании, указан в разделе “Методы”. На данный момент в доступной литературе по этой теме используются два разных метода презентации: изображения/фотографии движения руки, обычно в конечной позиции (Catmur et al., 2007, 2011; Taschereau-Dumouchel et al., 2016; Ubaldi et al., 2015), или видео полного движения руки (Barchiesi, Cattaneo, 2013; Errante, Fogassi, 2020; Press et al., 2012). Однако ни в одном из исследований не объясняется причина предпочтения одного из этих видов стимулов, и ни в одном из исследований не было попытки сравнить два типа презентации.
Что касается времени ТМС-стимуляции, мы использовали наиболее часто встречавшиеся в предыдущих исследованиях и показавшие свою эффективность параметры (0, 320, 640 мс) (Catmur et al., 2007). Существует небольшое количество исследований, сравнивающих разное время ТМС-стимуляции, однако полученные результаты требуют уточнения (Barchiesi, Cattaneo, 2013).
В исследованиях зеркальных нейронов, когда зрительный стимул (например, движение пальца) предъявляется в течение определенного периода времени, исследователи обычно применяют ТМС в разные периоды времени от начала предъявления стимула (начальной точки движения) (Barchiesi, Cattaneo, 2013; Catmur et al., 2007, 2011; Errante, Fogassi, 2020; Press et al., 2012; Taschereau-Dumouchel et al., 2016; Ubaldi et al., 2015). Однако систематического исследования по этому вопросу до сих пор не проводилось.
Данная работа – первое исследование, в котором изучается временная динамика двигательной реакции на наблюдение за действием от начала демонстрируемого движения до его прекращения, а также после прекращения действия стимула.
Целью данного исследования было определить оптимальное сочетание вида зрительного предъявления стимула и времени начала применения ТМС для создания наилучшего протокола стимуляции. Мы исследовали различия между двумя наиболее распространенными видами предъявления стимулов (фото и видео) и наиболее часто используемыми вариантами времени начала применения ТМС от начала (для стимулов “фото” и “видео”) либо окончания (для условий “пост-видео”) демонстрируемых движений (0, 320, 640 мс).
Мы предположили, что сочетание стимулов “видео” с началом ТМС-стимуляции через 320 или 640 мс от начала предъявления стимула будет более эффективно, чем “фото”-презентация.
МЕТОДИКА
Участники
В эксперименте приняли участие 11 человек, все были праворукими, 6 испытуемых были женщины, и 5 – мужчины (возрастной диапазон: 20–35 лет). Участники не имели личной или семейной истории неврологических и психических расстройств и отрицали употребление алкоголя и психоактивных веществ за несколько дней до эксперимента. Все участники дали информированное письменное согласие на участие в исследовании и получили финансовое вознаграждение после эксперимента. Исследование соответствовало этическим принципам Хельсинкской декларации, и эксперимент был одобрен Этическим комитетом НИУ ВШЭ, Москва. Во время эксперимента участники сидели в комфортном кресле, держа правую руку расслабленной и в ортогональном положении по отношению к экрану презентации, и получали инструкцию не двигать руками во время экспериментальной сессии.
Настройки ТМС
При помощи нейронавигационной ТМС осуществлялась стимуляция левого полушария, моторной коры (M1) с помощью стимулятора MagPro X100 (MagVenture, Дания), оснащенного индукционной катушкой в форме восьмерки C-B60 (внешний диаметр крыла 75 мм) для получения двухфазных импульсов ТМС. Катушка удерживалась по касательной линии к коже головы, ручка была направлена назад и в сторону под углом 45° к средней сагиттальной оси головы участника. Нейронавигационная система (Localite TMS Navigator, Localite GmbH, Германия) использовалась для навигации на основе МРТ-снимков T1, позволяющих локализовать оптимальную точку стимуляции и стабилизировать положение катушки во время поиска точки на моторной коре головного мозга, соответствующей оптимальному мышечному сокращению в ответ на стимуляцию.
Во время процедуры ТМС испытуемые сидели в комфортном кресле с регулируемой позицией. Для измерения моторного порога покоя (rMT) и сбора данных во время эксперимента катушка ТМС была заменена на индукционную катушку типа “восьмерка” C-B85 (радиус наружного диаметра крыла 75 мм), прикрепленную к системе Axilum TMS Cobot System (Brainbox Ltd). Использовали ту же систему нейронавигации и ранее выбранную “горячую точку”. ‘Горячая точка” M1 определялась как точка на голове, соответствующая оптимальному положению катушки, позволяющему получить стабильный мышечный ответ от мышц первой дорсальной межкостной мышцы (FDI) и отводящей малой мышцы мизинца (ADM) правой руки на основе регистрации сигнала электромиографии (ЭМГ) в режиме реального времени. Как только “горячая точка’ была обнаружена, rMT измеряли с помощью ступенчатой процедуры до тех пор, пока не была найдена минимальная интенсивность стимуляции, способная вызвать 50 мкВ размаха амплитуды вызванных мышечных потенциалов (ВМП) в 50% случаев (5 из 10 ВМП) (Rossini et al., 1994).
Интенсивность ТМС, используемая во время экспериментальных задач, была затем зафиксирована на уровне 110% от левого (доминирующего) rMT. Поверхностная ЭМГ-активность регистрировалась для правых мышц FDI и ADM с использованием одноразовых клейких поверхностных электродов (EB Neuro SpA), помещенных в абдоминально-сухожильный монтаж с усилителем постоянного тока BrainAmp (Brain Products GmbH) (частота дискретизации: 5 кГц).
Протокол презентации и стимуляции
После определения “горячей точки” и интенсивности стимуляции перед испытуемыми помещали презентационный экран. Основной стандартный протокол для всех условий состоял из двух этапов: исходный уровень (состояние покоя) и презентация. Исходный уровень измеряли перед основной задачей. Черный экран с белым фиксационным крестом предъявлялся при сборе 27 МВП для исходного уровня.
Основная задача состояла из трех основных условий демонстрации зрительных стимулов, таких как условие “фото’, условие “видео” и условие “пост-видео”. Условия различались по способу предъявления стимулов и/или времени стимуляции.
Условия
Условия различались по типу презентации. Каждый участник получал стимуляцию во всех трех условиях в случайном порядке и с интервалом не менее четырех дней, чтобы избежать возможных влияний предыдущих сеансов стимуляции. Так как это была пассивная задача, включавшая только наблюдение за презентацией зрительных стимулов, между сессиями не ожидалось эффекта обучения. Условия различались по способу предъявления стимулов и/или времени стимуляции:
Для условия “фото”:
а) белый фиксационный крест на черном экране предъявлялся в течение 1500 мс;
б) затем предъявлялась статическая рука в нейтральном положении перед стимулом движения на рандомизированное время 800, 1600 или 2400 мс, чтобы избежать эффекта предсказуемости;
в) во время демонстрации начала движения одно из трех различных движений предъявлялось в течение 1000 мс при каждой демонстрации (движение указательного пальца, движение мизинца или статичная рука (без движения)), всего 54 раза каждое в рандомизированном порядке и как статичное изображение готового движения;
г) импульсы ТМС применялись через 0, 320 или 640 мс от начала зрительной демонстрации начала движения, по одному на одно фото, всего 54 попытки в каждой, и в рандомизированном порядке;
д) стимуляция оканчивалась демонстрацией черного экрана 1500 мс (рис. 1 (а)).
Рис. 1.
(а) Пример презентации с применением фотоизображения. (б) Пример презентации с применением видео движения руки и стимуляцией во время демонстрации видео. (в) Пример презентации с применением видео движения руки и стимуляцией после демонстрации видео. Fig. 1. (a) An example of a presentation using a photographic image. (б) An example of a presentation using video of hand movement and stimulation during video demonstration. (в) Presentation example using video of hand movement and post-video stimulation.
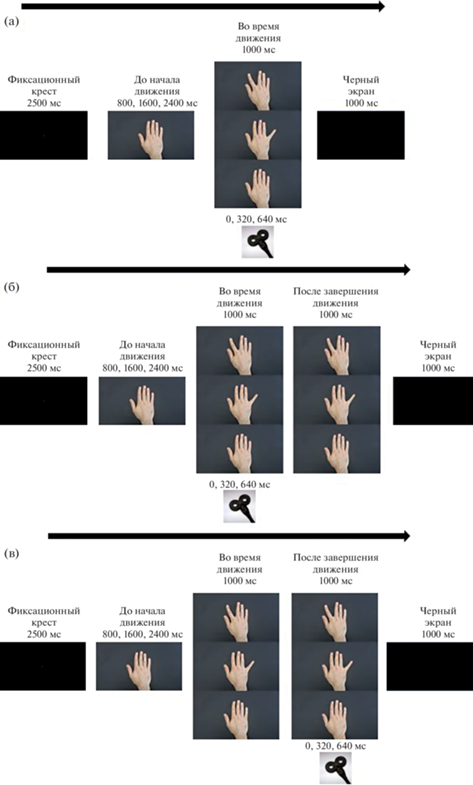
Для условия “видео”:
а) белый фиксационный крест на черном экране предъявлялся в течение 1500 мс;
б) затем предъявлялась статическая рука в нейтральном положении перед стимулом движения на рандомизированное время 800, 1600 или 2400 мс, чтобы избежать предсказуемости поступающего стимула;
в) в начале демонстрации движения одно из трех различных движений предъявлялось в течение 1000 мс в каждой демонстрации (движение указательного пальца, движение мизинца или неподвижная рука (без движения)), всего 54 раза каждое в случайном порядке и в виде видео, длительность движения от начала до конца полных 1000 мс;
г) импульсы ТМС применялись через 0, 320 или 640 мс от начала визуализации или начала движения, по одному на попытку, всего 54 попытки каждый, и в рандомизированном порядке;
д) для фазы постдвижения позиция законченного движения оставалась в течение 1000 мс в виде статического изображения;
е) стимуляция оканчивалась демонстрацией черного экрана 1500 мс (рис. 1 (б)).
Для условия “пост-видео”:
а) белый фиксационный крест на черном экране предъявлялся в течение 1500 мс;
б) затем предъявлялась статическая рука в нейтральном положении перед стимулом движения на рандомизированное время 800, 1600 или 2400 мс, чтобы избежать предсказуемости поступающего стимула;
в) в начале демонстрации движения одно из трех различных движений предъявлялось в течение 1000 мс в каждой демонстрации (движение указательного пальца, движение мизинца или статичная рука (без движения)), всего 54 раза каждое в рандомизированном порядке и как видео, длительность движения от начала до конца полных 1000 мс;
г) для фазы постдвижения позиция законченного движения оставалась в течение 1000 мс в виде статического изображения;
д) импульсы ТМС применялись через 0, 320 или 640 мс после окончания постдвигательной фазы после визуальной демонстрации, по одному на демонстрируемый фрагмент видео, всего 54 демонстрации фрагментов видео, в рандомизированном порядке;
е) стимуляция оканчивалась демонстрацией черного экрана 1500 мс (рис. 1 (в)).
Все стимулы (например, фиксационный крест и движения рук) демонстрировались с использованием программного обеспечения E-Prime 3.0 (Psychology Software Tools, Pittsburgh, PA). Всего во время предъявления демонстировалось 162 стимула, по 54 на каждое движение руки. Импульсы ТМС применялись в случайное время для каждого стимула, доставляемого с помощью Trigger Station (BrainTrends, Rome, Italy) в качестве соединителя между презентационным компьютером с программным обеспечением E-Prime 3.0 и стимулятором MagPro X100.
В общей сложности 189 импульсов были поданы во время экспериментального протокола между презентацией и базовыми уровнями, и соответствующие МВП были зарегистрированы как для FDI, так и для ADM.
Условия различались только по типу презентации, представляемой испытуемым. Каждый испытуемый выполнял каждое из трех условий визуализации в случайном порядке и с интервалом не менее четырех дней, чтобы избежать возможных помех от предыдущих сеансов стимуляции. Так как это была пассивная задача, между сессиями не ожидалось эффекта обучения.
Обработка данных
Все МВП с высокой предстимульной активностью (то есть с амплитудой более 50 мкВ в диапазоне до 300 мс до подачи ТМС-импульса) исключались из дальнейшего анализа, так же как и пробы с задержкой появления МВП более 2 мс, так как такая задержка свидетельствует о наличии подпороговой мышечной активности, которая может влиять на амплитуду МВП. Необработанные данные амплитуды от МВП мышц FDI и ADM затем усреднялись для каждого состояния в соответствии с типом стимула и временем стимуляции, а затем нормализовались на основе исходного уровня. Из-за вариабельности необработанных МВП между испытуемыми результаты во время предъявления стимулов были нормализованы. Влияние на размер МВП, зарегистрированных во время экспериментальной части (презентация движений рук), анализировалось в процентах пик-пик-амплитуды МВП исходного уровня (100%) как для FDI-, так и для ADM-мышц (Feurra et al., 2019; Rossini et al., 1999).
Статистический анализ
Мы провели три отдельных трехфакторных дисперсионных анализа с повторными измерениями для независимых факторов: движение (указательный палец, мизинец и нейтральное), мышцы (FDI, ADM) и время ТМС-стимуляции от начала движения (0, 320, 640 мс). По одному на каждое условие (“фото”, “видео”, “пост-видео”).
При нарушении допущения о сферичности данных применялась поправка Хюнха-Фельдта. При наличии значительных взаимодействий скорректированные парные сравнения были выполнены с использованием LSD-теста Фишера, чтобы ограничить экспериментальную частоту ошибок до α и максимизировать мощность теста для обнаружения парных различий. Уровень значимости был установлен на уровне р = 0.05.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЙ
Стимуляция во время фотопрезентации: для сравнения нормализованных данных стимуляции в условиях фотопрезентации (N = 11) для мышц FDI и ADM был применен трехфакторный дисперсионный анализ с повторными измерениями. Результаты показали отсутствие значимого влияния каких-либо факторов или их взаимодействий. Для взаимодействия Движение × Мышца мы видим тенденцию к более высокой активации мышцы FDI при предъявлении движения указательного пальца и мышцы ADM – при предъявлении движения мизинца, в то время как для нейтрального она остается такой же. Та же самая тенденция наблюдается для взаимодействия Движение × Время с тенденцией к более высокому отклику на стимуляции в момент времени 320 мс от начала предъявления движений указательного пальца и мизинца, в то время как для нейтрального положения (при предъявлении руки без движения) он остается одинаковым. Но, как указывалось ранее, эти результаты не являются значимыми.
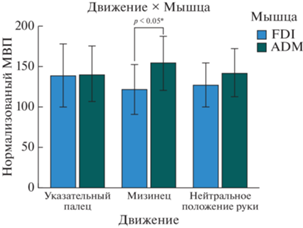
Стимуляция во время видеопрезентации: для сравнения нормализованных данных стимуляции в условиях видеопрезентации (N = 11) для мышц FDI и ADM был применен трехфакторный дисперсионный анализ с повторными измерениями. Результаты показали значимый эффект взаимодействия факторов демонстрации движения пальцев [F (2, 9) = = 5.836, p = 0.024, ηp2 = 0.565]. Апостериорные сравнения выявили значимую разницу между мышцами FDI и ADM во время демонстрации движения мизинца [F (1, 10) = 8.106, p = 0.017, ηp2 = 0.448] (см. рис. 2).
Рис. 2.
Движение × Взаимодействие мышц для условия “Видео”: разница между активностью мышц во время наблюдения за движением мизинца для взаимодействия “Движение–Мышца” для условия “Видео”. Звездочки обозначают значимые различия (* – p < 0.05). Fig. 2. Movement × Muscle Interaction for Video Condition: Difference between muscle activity while observing the movement of the little finger for the Movement–Muscle interaction for Video condition. Asterisks denote significant differences (* – p < 0.05).
Значимый эффект был также обнаружен для двустороннего взаимодействия факторов “движение” и “время” [F (4, 40) = 3.113, p = = 0.025, ηp2 = 0.237].
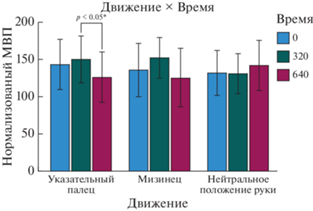
В ретроспективном сравнении была обнаружена значимая разница между временем ТМС-стимуляции 320 и 640 мс для предъявления движения указательного пальца, с более высоким средним значением при времени ТМС-стимуляции 320 мс [F (2, 9) = 13.294, p = 0.002, ηp2 = 0.747] (см. рис. 3).
Рис. 3.
Взаимодействие “Движение × Время” для условия “Видео”: значительные различия в случае начала стимуляции через 320 и 640 мс после начала предъявления движения указательного пальца для взаимодействия “Время–Движения” для условия “Видео”. Звездочки обозначают значимые различия (* – p < 0.05). Fig. 3. Movement × Time interaction for the Video condition: significant differences in the case of stimulation at 320 and 640 ms after the start of the index finger movement for the Time–Movement interaction for the Video condition. Asterisks denote significant differences (* – p < 0.05).
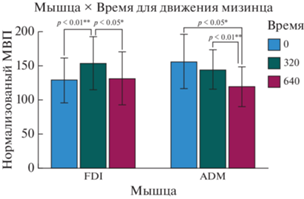
Последний значимый эффект наблюдался при рассмотрении трехфакторного взаимодействии факторов “движение”, “мышцы” и “время” [F (4, 40) = 2.755, p = 0.041, ηp2 = = 0.216]. При post hoc сравнении были выявлены существенные различия для FDI при ТМС-стимуляции на 320 мс при сравнении ответа на предъявление движения указательного пальца и статичной руки со средним значением для предъявления движения указательного пальца [F (2, 9) = 2.2915, p = 0.029, ηp2 = 0.393] (см. рис. 4 (а)).
Рис. 4.
(а) Трехстороннее взаимодействие. Сравнение ответа мышцы FDI на предъявление указательного пальца и статичной руки, условие “видео”: значимое различие между ответом на предъявление движения указательного пальца и статичной руки в условиях начала стимуляции через 320 мс после начала предъявления зрительного стимула. Звездочки обозначают значимые различия (* – p < 0.05). (б) Трехстороннее взаимодействие. Сравнение ответа мышцы ADM на предъявление указательного пальца и статичной руки, условие “Видео”: значимое различие между ответами на движения указательного пальца и предъявление статичной руки в условиях начала стимуляции через 640 мс после начала предъявления зрительного стимула. Звездочки обозначают значимые различия (* – p < 0.05). Fig. 4. (a) Three-way interaction. Comparison of the response of the FDI muscle to the presentation of the index finger and the static hand in “video” condition: significant difference between the response to the presentation of the index finger movement and the static hand with stimulation at 320 ms after the start of the presentation of the visual stimulus. Asterisks denote significant differences (* – p < 0.05). (б) Three-way interaction. Comparison of the response of the ADM muscle to the presentation of the index finger and the static hand in “Video” condition: significant difference between the responses to the presentation of index finger movement and the static hand with stimulation at 640 ms after the start of the presentation of the visual stimulus. Asterisks denote significant differences (* – p < 0.05).
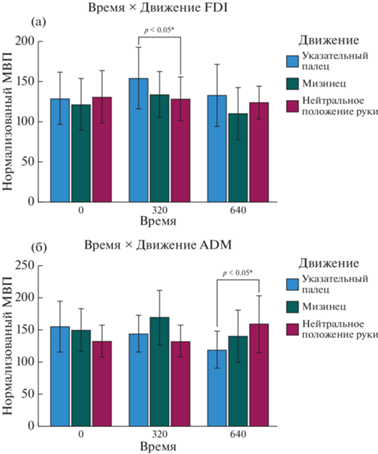
Было выявлено различие при сравнении ADM при ТМС-стимуляции на 640 мс и ответов на движение указательного пальца и предъявление статичной руки [F (2, 9) = = 3.892, p = 0.015, ηp2 = 0.464] (см. рис. 4 (б)).
При сравнении амплитуд мышц FDI и ADM во время предъявления движения мизинца и с началом стимуляции через 640 мс после начала предъявлении стимула мы обнаружили, что ответы у ADM значительно больше [F (1, 10) = 10.264, p = 0.009, ηp2 = = 0.507] (см. рис. 5).
Рис. 5.
Трехстороннее взаимодействие. Сравнение ответа на предъявление движения мизинца мышц FDI и ADM, условие “видео”: значимые различия ответов мышц FDI и ADM в условиях начала стимуляции через 640 мс после начала предъявления зрительного стимула. Звездочки обозначают значимые различия (** – p < 0.01). Fig. 5. Three-way interaction. Comparison of the response to the presentation of the little finger movement on FDI and ADM muscles for “video” condition: significant differences in the responses of the FDI and ADM muscles during stimulation at 640 ms after the start of presentation of the visual stimulus. Asterisks denote significant differences (** – p < 0.01).
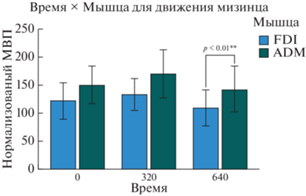
Во время ответа на движения указательного пальца активность FDI была выше при стимуляции через 320 мс после начала предъявления стимула, чем при 0 мс [F (2, 9) = = 9.073, p = 0.007, ηp2 = 0.668] и 640 мс [F (2, 9) = = 9.073, p = 0.028, ηp2 = 0.668].
При ответе на движение указательного пальца амплитуда ADM была меньше в случае начала стимуляции через 640 мс после начала предъявления стимула по сравнению с 0 мс [F (2, 9) = 7.132, p = 0.011, ηp2 = 0.613] и 320 мс [F( 2, 9) = 7.132, p = 0.003, ηp2 = 0.613] (см. рис. 6).
Рис. 6.
Взаимодействие Мышца × Время в ответ на предъявление движения указательного пальца, условие “Видео”: Значимые различия в различных временных окнах начала стимуляции для ответов мышц FDI и ADM при предъявлении движения указательного пальца. Звездочки обозначают значимые различия (* – p < 0.05, ** – p < 0.01). Fig. 6. Interaction Muscle × Time during the presentation of index finger movement for “Video” condition: Significant differences in the different time windows of stimulation for the responses of the FDI and ADM muscles to the presentation of the movement of the index finger. Asterisks denote significant differences (* – p < 0.05, ** – p < 0.01).
Все отдельные факторы и другие двусторонние взаимодействия не показали значимых результатов: Движение [F (2, 9) = 0.219, p = 0.807, ηp2 = 0.046], Мышцы [F (1, 10) = = 2.083, p = 0.180 , ηp2 = 0.172], Время [F (2, 9) = = 0.750, p = 0.500, ηp2 = 0.143] и Мышцы × × Время [F (2, 9) = 0.311, p = 0.740, ηp2 = = 0.065].
Все результаты на графиках представлены в виде нормализованных значений (ось Y), полученных после процесса нормализации, подробно описанного ранее в разделе “Метод”.
“Постстимуляция” после видеопрезентации (“пост-видео”): Для нормализованных данных ответов мышц FDI и ADM в группе “пост-видео”-стимуляции (N = 11) трехфакторный дисперсионный анализ с повторными измерениями не показал значительного влияния каких-либо факторов или их взаимодействий. Для этого условия мы можем наблюдать ситуацию, аналогичную описанной ранее для “фото”-условия: для взаимодействия Движение × Мышца мы можем видеть тенденцию к более высокой активации мышцы FDI во время наблюдения за движением указательного пальца и мышцы ADM во время движения мизинца, в то время как в случае предъявления статичной руки она остается прежней. В то время как для взаимодействия Движение × Время мы обнаружили более сильную реакцию на движение указательного пальца и мизинца по сравнению со статичным изображением, с большими нормализованными МВП для ответов на движения мизинца и их увеличением с течением времени. Но эти результаты не являются статистически значимыми.
Отсутствие эффектов, наблюдаемых при визуальной демонстрации стимулов для условий “фото” и “пост-видео”, а также при некоторых сравнениях в условии “видео”, может быть связано с несколькими причинами: общим повышением активности МВП для обеих мышц (FDI, ADM) при всех вариантах начала времени стимуляции (0, 320, 640 мс) из-за демонстрации изображения руки и эффекта ожидания движений, что затрудняет получение статистически значимых различий, несмотря на явные тенденции. Возможно также, что выборка оказалась недостаточно большой, чтобы продемонстрировать статистическую значимость полученных в эксперименте результатов.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
В этом исследовании мы стремились определить наилучшую методологию зрительного предъявления стимулов в виде движений и подобрать время начала стимуляции, вызывающее максимальный мышечный ответ, в качестве ключевых характеристик для разработки оптимального протокола презентации зрительных стимулов и параметров ТМС для изучения “зеркальных нейронов”.
Наша гипотеза состояла в том, что “видео”-условие, будучи наиболее экологичной методикой демонстрации, будет вызывать больший эффект работы системы зеркальных нейронов в случае начала стимуляции через средний или максимальный в данном эксперименте интервал (320 или 640 мс).
В предыдущих исследованиях зеркальных нейронов в качестве зрительных стимулов использовали и фотографии (Catmur et al., 2007, 2011; Taschereau-Dumouchel et al., 2016; Ubaldi et al., 2015), и видео (Barchiesi, Cattaneo, 2013; Errante, Fogassi, 2020; Press et al., 2012), чтобы предъявить движения рук. ТМС применяли обычно позже, чем через 250 мс после начала зрительной стимуляции (Barchiesi, Cattaneo, 2013; Catmur et al., 2007).
Однако не существует исследования, в котором вышеописанные методологические моменты были бы систематизированы. Мы впервые исследовали не только различные варианты зрительного предъявления стимулов, но и различные варианты времени начала стимуляции как во время, так и после окончания предъявления движений.
В данном исследовании мы использовали ТМС-области коры M1 для оценки уровня кортикоспинальной возбудимости путем измерения амплитуд МВП двух мышц кисти (FDI, ADM) во время наблюдения трех различных состояний (движение указательным пальцем, движение мизинцем, нейтральное) и при стимуляции в три разных момента времени от начала предъявления зрительного стимула (0, 320, 640 мс) для каждого из трех условий или типов презентации (“фото”, “видео”, “пост-видео”). Мы обнаружили, что из трех изученных условий после нормализации данных только условие “видео” показало некоторые значимые результаты в сравнении с двумя другими методами презентации.
Разница между амплитудой ответа ADM и FDI на предъявление движения мизинца оказалась больше в сравнении с другими стимулами, с более сильным эффектом для ADM (см. рис. 2), которая является мышцей, связанной с представленным стимулом. С одной стороны, это может быть результатом активации ADM вследствие зеркального эффекта, создаваемого наблюдением за движением с участием этой мышцы, и, с другой стороны, из-за тормозящего эффекта, который представленное движение оказывает на противоположную мышцу (FDI). Этот эффект может быть обусловлен более сильной активацией ADM во время предъявления соответствующего зрительного стимула из-за более высокого моторного набора, обусловленного меньшей кортикальной репрезентацией ADM по сравнению с FDI (Dechent, Frahm, 2003), то есть с мышцей, связанной с указательным пальцем, которая чаще используется в повседневной жизни.
При рассмотрении корреляции между стимулом и временем начала стимуляции мы можем наблюдать меньшую амплитуду ответа МВП, зарегистрированную при стимуляции через 640 мс после начала предъявления стимула – движения указательного пальца, по сравнению с 320 мс (см. рис. 3). Эти различия могут отражать влияние предъявления определенного стимула и временных параметров стимуляции как для мышцы FDI, так и для мышцы ADM. Также полученные результаты позволяют предполагать, что различия в величине мышечного ответа при начале стимуляции через 320 и через 640 мс, вероятно, обусловлены большими МВП для мышцы FDI при параметрах стимуляции в момент времени 320 мс после начала предъявления зрительного стимула по сравнению с 0 и 640 мс, а также из-за тормозящего эффекта, который оказывает движение указательного пальца на мизинец, увеличивающегося с течением времени. Результаты показывают значительно большую амплитуду ответа FDI при наблюдении за движением указательного пальца по сравнению с расслабленной (статичной) кистью руки при стимуляции через 320 мс после начала предъявления стимула и меньшую амплитуду ответа ADM при наблюдении за движением указательного пальца по сравнению с расслабленной кистью при стимуляции через 640 мс после начала предъявления стимула. Мы также наблюдали аналогичный тормозящий эффект для нормализованной амплитуды МВП при анализе ответов ADM во время стимульного предъявления движения мизинца, и снова – при стимуляции через 640 мс после начала предъявления стимула.
Эффекты проявляются также, когда мы анализируем мышечную активность при трехстороннем взаимодействии. Активация FDI выше во время наблюдения за движением указательного пальца при стимуляции через 320 мс после начала предъявления стимула по сравнению с 0 и 640 мс. Что касается тормозящего эффекта, то, когда мы измеряем амплитуду ответа ADM, она значительно меньше при стимуляции через 640 мс после начала предъявления стимула во время наблюдения за движением указательного пальца, по сравнению с 0 и 320 мс. Описанные выше результаты являются доказательством зеркального эффекта, наблюдаемого в состоянии “видео”, характеризующегося двойной диссоциацией с сильнейшим возбуждающим эффектом для мышцы, связанной со стимульным движением, при стимуляции через 320 мс после начала предъявления стимула, и тормозящим эффектом для мышцы, противоположной стимульному движению, при стимуляции через 640 мс после начала предъявления стимула.
Что касается ограничений, то стоит отметить размер выборки, который может послужить ограничивающим фактором для статистической значимости наших результатов. Даже учитывая это, полученные результаты показали нам, что видео – лучший способ для зрительного представления стимульного движения. Это исследование также является первым исследованием, в котором изучается временная характеристика зеркальных нейронов во время и после предъявления стимулов, а также предоставляется важная информация о временной динамике зеркального эффекта как для связанных, так и для несвязанных мышц кисти руки по отношению к стимулам. Эти данные предоставляют важную и новую информацию о длительных эффектах зеркальных нейронов, которые ранее изучались лишь в единичных исследованиях, но не были систематизированы (Barchiesi, Cattaneo, 2013; Ubaldi et al., 2015; Taschereau-Dumouchel et al., 2016).
Полученные результаты могут быть полезны научному сообществу для разработки более совершенных методик исследования зеркальных нейронов и разработки эффективных протоколов реабилитации.
ЗАКЛЮЧЕНИЕ
Наблюдаемый эффект двойной диссоциации показывает, что экспериментальная схема предложенного нами исследования легко контролируется и соответствует парадигме с сильным эффектом повышенной активности мышцы, связанной с наблюдаемым движением (FDI – указательный палец; ADM – мизинец). Интересно, что показанный зеркальный эффект может быть модулирован и обеспечивает эффект обучения во время использования статических изображений (Catmur et al., 2007; Catmur et al., 2011). В нашем исследовании мы показали, что в будущем можно было бы рассмотреть возможность использования видео для стимуляции эффектов нейропластичности у пациентов, находящихся на реабилитации после перенесенного инсульта.
Для дальнейшего изучения наблюдаемых явлений необходимо продолжение исследований по этой теме, например, продолжительности зеркального эффекта. Эти исследования могут дополнить уже существующие методы лечения, такие как зеркальная терапия для реабилитации пациентов с инсультом или пациентов, перенесших ампутацию конечностей (Rothgangel et al., 2011; Thieme et al., 2012; Colomer et al., 2016; Gandhi et al., 2020).
Список литературы
Barker A.T., Freeston I.L., Jalinous R., Jarratt J.A. Magnetic stimulation of the human brain and peripheral nervous system: an introduction and the results of an initial clinical evaluation. Neurosurgery. 1987. 20 (1): 100–109. https://doi.org/10.1097/00006123-198701000-00024
Barchiesi G., Cattaneo L. Early and late motor responses to action observation. Social cognitive and affective neuroscience 2013. 8 (6): 711–719.
Bianco G., Feurra M., Fadiga L, Rossi A., Rossi S. Bi-hemispheric effects on corticospinal excitability induced by repeated sessions of imagery versus observation of actions. Restor. Neurol. Neurosci. 2012. 30: 481–9. https://doi.org/10.3233/RNN-2012-120241
Brighina F., La Bua V., Oliveri M., Piazza A., Fierro B. Magnetic stimulation study during observation of motor tasks. 2000. 174: 122–126.
Catmur C., Mars R.B., Rushworth M.F., Heyes C. Making mirrors: premotor cortex stimulation enhances mirror and counter-mirror motor facilitation. Journal of Cognitive Neuroscience. 2011. 23 (9): 2352–2362.
Catmur C., Walsh V., Heyes C. Sensorimotor Learning Configures the Human Mirror System. Current Biology. 2007. 17: 1527–31.https://doi.org/10.1016/j.cub.2007.08.006
Colomer C., Noé E., Lorens Rodríguez R. Mirror therapy in chronic stroke survivors with severely impaired upper limb function: a randomized controlled trial. European journal of physical and rehabilitation medicine. 2016. 52 (3): 271–278.
Dechent P., Frahm J. Functional somatotopy of finger representations in human primary motor cortex. Human brain mapping. 2003. 18 (4): 272–283.
Di Pellegrino G., Fadiga L., Fogassi L., Gallese V., Rizzolatti G. Understanding motor events: a neurophysiological study. Experimental brain research. 1992. 91 (1): 176–180.
Errante A., Fogassi L. Activation of cerebellum and basal ganglia during the observation and execution of manipulative actions. Scientific reports. 2020. 10 (1): 1–15.
Fadiga L., Craighero L., Olivier E. Human motor cortex excitability during the perception of others’ action. Current Opinion in Neurobiology. 2005. 15: 213–218. https://doi.org/10.1016/j.conb.2005.03.013
Fadiga L., Fogassi L., Pavesi G., Rizzolatti G. Motor facilitation during action observation: A magnetic stimulation study. Journal of Neurophysiology. 1995. 73: 2608–2611. https://doi.org/10.1152/jn.1995.73.6.2608
Feurra M., Blagovechtchenski E., Nikulin V.V., Nazarova M., Lebedeva A., Pozdeeva D., Yurevich M., Rossi S. State-Dependent Effects of Transcranial Oscillatory Currents on the Motor System during Action Observation. Sci. Rep. 2019. 9: 12858. https://doi.org/10.1038/s41598-019-49166-1
Fogassi L., Gallese V., Di Pellegrino G., Fadiga L., Gentilucci M., Luppino G., Rizzolatti G. Space coding by premotor cortex. Experimental Brain Research. 1992. 89 (3): 686–690.
Fogassi L., Ferrari P., Gesierich B., Rozzi S., Chersi F., Rizzolatti G. Parietal Lobe: From Action Organization to Intention Understanding. Science. 2005. 308: 662–7. https://doi.org/10.1126/science.1106138
Gandhi D.B., Sterba A., Khatter H., Pandian J.D. Mirror therapy in stroke rehabilitation: current perspectives. Therapeutics and clinical risk management. 2020. 16: 75.
Oztop E., Kawato M., Arbib M. Mirror neurons and imitation: a computationally guided review. Neural Networks. 2006. 19: 254–271.
Press C., Catmur C., Cook R., Widmann H., Heyes C., Bird G. fMRI evidence of “mirror” responses to geometric shapes. PLoS One. 2012. 7 (12): e51934.
Rizzolatti G., Fadiga L., Gallese V., Fogassi L. Premotor cortex and the recognition of motor actions. Brain Res Cogn Brain Res. 1996. 3: 131–41.
Rizzolatti G., Ferrari P.F., Rozzi S., Fogassi L. The inferior parietal lobule: where action becomes perception. Novartis Found Symp. 2006. 270: 129–40; discussion. 140–5, 164–169.
Rizzolatti G., Craighero L. The Mirror-Neuron System. Annual Review of Neuroscience. 2004. 27: 169–192. https://doi.org/10.1146/annurev.neuro.27.07020-3.144230
Rossini P.M., Barker A.T., Berardelli A., Caramia M.D., Caruso G., Cracco R.Q., Tomberg C. Non-invasive electrical and magnetic stimulation of the brain, spinal cord and roots: basic principles and procedures for routine clinical application. Report of an IFCN committee. Electroencephalography and clinical neurophysiology. 1994. 91 (2): 79–92.
Rothgangel A.S., Braun S.M., Beurskens A.J., Seitz R.J., Wade D.T. The clinical aspects of mirror therapy in rehabilitation: a systematic review of the literature. International Journal of Rehabilitation Research. 2011. 34 (1): 1–13.
Schneider W., Eschman A., Zuccolotto A. E-Prime User’s Guide 2012. Pittsburgh: Psychology Software Tools, Inc.
Strafella A., Paus T. Modulation of cortical excitability during action observation: A transcranial magnetic stimulation study. Neuroreport. 2000. 11: 2289–2292. https://doi.org/10.1097/00001756-200007140-00044
Taschereau-Dumouchel V., Hétu S., Michon P.E., Vachon-Presseau E., Massicotte E., De Beaumont L., Fecteau S., Poirier J., Mercier C., Chagnon Y.C., Jackson P.L. BDNF Val66Met polymorphism influences visuomotor associative learning and the sensitivity to action observation. Scientific reports. 2016. 6 (1): 1–10.
Thieme H., Mehrholz J., Pohl M., Behrens J., Dohle C. Mirror therapy for improving motor function after stroke. Cochrane database of systematic reviews. 2012. (3).
Ubaldi S., Barchiesi G., Cattaneo L. Bottom-up and top-down visuomotor responses to action observation. Cerebral cortex. 2015. 25 (4): 1032–1041.
Umiltà M., Kohler E., Gallese V., Fogassi L., Fadiga L., Keysers Ch., Rizzolatti G. I know what you are doing. A neurophysiological study. Neuron. 2001. 31: 155–165. https://doi.org/10.1016/S0896-6273(01)00337-3
Urgesi C., Moro V, Candidi M., Aglioti S. Mapping Implied Body Actions in the Human Motor System. The Journal of neuroscience: the official Journal of the Society for Neuroscience. 2006. 26: 7942–9. https://doi.org/10.1523/JNEUROSCI.1289-06.2006
Wagner T., Valero-Cabre A., Pascual-Leone A. Noninvasive human brain stimulation. Annual Review of Biomedical Engineering. 2007. 9: 527–565. https://doi.org/10.1146/annurev.bioeng.9.06120-6.133100
Дополнительные материалы отсутствуют.
Инструменты
Журнал высшей нервной деятельности им. И.П. Павлова


