Журнал высшей нервной деятельности им. И.П. Павлова, 2021, T. 71, № 2, стр. 237-243
Разнообразие и функциональные особенности кальций-зависимых калиевых каналов, определяющие их роль в пластичности нейронов головного мозга
Е. С. Никитин 1, *, П. М. Балабан 1
1 Федеральное государственное бюджетное учреждение науки Институт высшей нервной деятельности
и нейрофизиологии РАН
Москва, Россия
* E-mail: nikitin@ihna.ru
Поступила в редакцию 21.10.2020
После доработки 05.12.2020
Принята к публикации 22.12.2020
Аннотация
Уникальные характеристики кальций-зависимых калиевых каналов прочно переплетены с особенностью их функции, а также динамики и условий срабатывания и закрытия. В настоящем обзоре мы анализируем имеющиеся данные о кальций-зависимых калиевых каналах и их функциональное назначение, которое связано с механизмами кратковременной пластичности и обеспечением регуляции активности и возбудимости нейронов. Также будут рассмотрены эпигенетические механизмы регуляции экспрессии генов этих каналов как проявление одного из механизмов долговременной пластичности, лежащей в основе обучения и памяти.
Калиевые каналы являются важнейшими ионными каналами нейрона, отвечающими за реполяризацию мембраны при генерации потенциалов действия, а также за регуляцию общей возбудимости нейрона и значение мембранного потенциала в покое. Потенциал реверсии калиевого тока в норме находится ниже мембранного потенциала, поэтому открытие калиевых каналов приводит к гиперполяризации и играет критическую роль в регуляции активности нейрона. Некоторые типы калиевых каналов, называемые кальций-зависимыми, могут открываться при повышении уровня внутриклеточного кальция или модулироваться им, что позволяет этим каналам отставленно реагировать на активность, если она приводит к значительным изменениям в уровне внутриклеточного кальция. Эти уникальные характеристики кальций-зависимых калиевых каналов прочно переплетены с особенностью их функции, а также динамики и условий срабатывания и закрытия.
КЛАССИФИКАЦИЯ И СУБЪЕДИНИЦЫ КАНАЛОВ
Кальций-зависимые калиевые каналы разделяют по величине проводимости отдельного канала на три основных типа: SK – низкая проводимость (small conductance, 4–14 pS), IK – промежуточная проводимость (intermediate conductance, 32–39 pS) и BK – высокая проводимость (big conductance, 200–300 pS (Kshatri et al., 2018), рис. 1). Сначала кальций-зависимые каналы были открыты у не-нейрональных клеток, и были описаны их некоторые свойства (Marty, 1981; Bregestovski et al., 1988; McManus, 1991). BK-каналы также являются потенциал-активируемыми каналами, имеющими высокое сродство к кальцию (Cui, 2010), связывание с которым вызывает сдвиг кривой потенциал-зависимой активации канала (Cui et al., 2009), облегчающий его активацию при деполяризации. Это свойство BK-канала предполагает его участие в детекции совпадения повышения внутриклеточного Ca2+ и деполяризации, связанной с генерацией нейроном потенциалов действия (Contet et al., 2016; Pantazis, Olcese, 2016). Детекция совпадений сигналов играет ключевую роль в ассоциативном обучении и хэббовской пластичности.
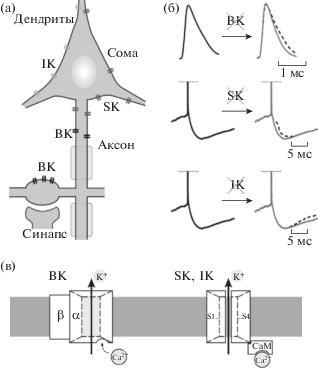
Рис. 1.
Кальций-зависимые калиевые каналы у нейронов ЦНС. (а) – схема локализации в нейроне каналов BK-типа (преимущественно аксон), SK-типа (аксон, дендриты и сома) и IK-типа (сома и дендриты). (б) – характерные изменения мембранного потенциала при нейрональной активности, вызванные блокадой BK-каналов (сверху, ибериотоксин: расширение потенциалов действия), SK-каналов (середина, апамин: средняя следовая гиперполяризация) и IK-каналов (снизу, TRAM-34: медленная следовая гиперполяризация). (в) – схемы субъединичного строения BK-канала (слева: канальная α-субъединица и регуляторная β-субъединица; сайт связывания Ca2+ на α-субъединице внутри клетки) и SK/IK каналов (справа: просвет канала образуют 4 субъединицы (S1…S4), соединенные в гомо- или гетеротетрамер; канал активируется комплексом CaM-Ca2+ изнутри клетки).
Fig. 1. Calcium-dependent potassium channels in central neurons. (а) – Scheme of the neuron with channel localization of BK-type (mainly at the axon), SK-type (axon, dendrites, and soma), and IK-type (soma and dendrites). (б) – Activity-related characteristic changes in membrane potential dynamics induced by blockers of BK-channels (top traces, iberiotoxin: broadening), SK-channels (middle traces, apamin: medium afterhyperpolarization), and IK-channels (bottom, TRAM-34: slow afterhyperpolarization). (в) – Scheme of subunit composition of BK-channels (left: pore-forming a-subunit and auxiliary β-subunit; a site of Ca2+-binding at α-subunit inside the cell) and of SK/IK channels (right: pore is formed by 4 subunits (S1…S4) i.e. by a homo- or heterotetramer; the channel is activated by a CaM-Ca2+ complex from inside the cell).
Каналы BK-типа в основном располагаются на аксоне и пресинаптических терминалях пирамидных нейронов (Hu et al., 2001; Trimmer, 2015; Roshchin et al., 2018) (рис. 1 (а)). В соответствии с локализацией, BK-каналы оказывают значительное влияние на возбудимость пресинаптического окончания и амплитуду нисходящего сигнала в синаптической передаче (Hu et al., 2001, Roshchin et al., 2018). Также эти каналы отчасти помогают реполяризации мембраны в дендритах и соме нейрона, но не влияют на обратное распространение потенциала действия (Bock, Stuart, 2016).
Кроме модулируемых кальцием потенциал-активируемых каналов BK-типа в нейронах присутствуют каналы, активируемые кальцием напрямую – это широко распространенные каналы SK-типа (small potassium), и близкие им по строению IK-каналы (intermediate potassium, KCa3.1). Это важное свойство позволяет SK- и IK-каналам открываться и реагировать на внутренние кальциевые сигналы даже в тех случаях, когда нейрон находится в состоянии покоя и не генерирует потенциалы действия. В нейронах были идентифицированы 3 подтипа субъединиц SK-каналов: SK1, SK2 и SK3 (Kohler et al., 1996; Bond et al., 2005). SK-каналы экспрессируются преимущественно в соматодендритной области нейрона (подтипы 1, 2, 3), однако подтип SK3 встречается также и в начальном сегменте аксона, где эти каналы могут подвергаться cAMP-PKA-зависимому эндоцитозу, обеспечивая пластические изменения (Abiraman et al., 2018). SK-каналы в дендритах пирамидных нейронов поля CA1 гиппокампа обеспечивают реполяризацию мембраны после дендритных плато-потенциалов (Cai et al., 2004). Ингибиторный анализ с помощью апамина и нокаут SK-каналов демонстрируют, что SK-каналы участвуют в формировании средней фазы следовой гиперполяризации (Bond et al., 2004).
В то время как SK-каналы повсеместно распространены в нервной системе, более медленные IK-каналы (рис. 1 (б)) представлены только в определенных областях/слоях мозга только у части нейронов. Кроме гиппокампа, IK-каналы были также найдены в неокортексе, преимущественно у нейронов 5-го слоя в дендросоматических компартментах (Turner et al., 2015). Ген IK-каналов (SK4/KCNN4) является близкородственным и демонстрирует гомологию ~40% с генами каналов SK типов 1-3 (Joiner et al., 1997). Недавние цитоиммунологические исследования с помощью сверхразрешения (super-resolution) показали, что субъединицы IK-каналов колокализуются вместе с субьединицами SK-каналов в одних и тех же компартментах нейрона, в то время как коэкспрессирующиеся SK1- и IK-субъединицы, по-видимому, объединены в канальные комплексы (Higham et al., 2019). Искусственная ко-экспрессия субъединиц IK и SK1 в модельной культуре не-нейрональных клеток показала наличие возможных химерных каналов, более близких по регистрируемым токам к гомомерным IK-каналам и сохраняющих чувствительность к блокатору IK-каналов TRAM-34, но в более высокой концентрации (Higham et al., 2019). Принимая во внимание низкую экспрессию субъединиц IK-каналов в ЦНС по сравнению с другими тканями, можно предположить на основании опубликованных данных, что IK-проводимость у нейронов ЦНС определяется химеризацией IK- и SK-канальных субъединиц.
РОЛЬ КАЛЬЦИЙ-ЗАВИСИМЫХ КАЛИЕВЫХ КАНАЛОВ В РЕГУЛЯЦИИ ДЛИТЕЛЬНОСТИ СНА
Переход головного мозга в состояние сна сопровождается циклическими изменениями возбудимости нейронов, определяемыми суточным ритмом. Было установлено, что важную роль в регуляции продолжительности сна играют кальций-зависимые каналы SK- и BK-типов (Colwell, 2006; Tatsuki et al., 2016). BK-каналы осциллирующих нейронов супрахиазматического ядра, контролирующего циркадианный ритм, вносят значительный вклад в модуляцию спонтанной активности этих нейронов. Мутация, приводящая к потере функции (loss-of-function) BK-каналов в нейронах супрахиазматического ядра, увеличивает их спонтанную активность, что изменяет пейсмейкерные выходы этого ядра и нарушает поведенческие проявления циркадианного ритма (Meredith et al., 2006). Показано, что в норме инактивация BK-каналов нейронов супрахиазматического ядра происходит в дневное время, в то время как ночью BK-токи максимальны (Whitt et al., 2016). Отключение инактивации на N-конце β2-субьединицы генетическими методами нарушает циркадианную ритмичность, которую можно селективно восстановить доставкой короткой части пептидной последовательности нативной β2-субъединицы (Whitt et al., 2016). Также известно, что активация каналов SK-типа нейронов таламуса ионами кальция, входящими в эти клетки через Ca2+-каналы T-типа, необходима для поддержания таламических осцилляций во время медленного сна (Cueni et al., 2008). Таким образом, связь функции калиевых каналов с циркадианными циклами возбудимости ЦНС представляется установленным фактом, хотя детали этих процессов на уровне отдельных белковых молекул все еще остаются не полностью изученными.
КЛЮЧЕВАЯ РОЛЬ КАЛЬЦИЙ-ЗАВИСИМЫХ КАЛИЕВЫХ КАНАЛОВ В КРАТКОВРЕМЕННОЙ ПЛАСТИЧНОСТИ, ВЫЗВАННОЙ НЕЙРОНАЛЬНОЙ АКТИВНОСТЬЮ
Кальций-зависимые калиевые каналы играют жизненно важную роль в отставленном снижении возбудимости нейрона, которое не могут обеспечивать “нормальные” потенциал-активируемые каналы из-за их инактивации. У пирамидных нейронов неокортекса ширина потенциала действия в аксоне регулируется каналами Kv1 быстрого типа, которые с помощью этого механизма ограничивают длительность деполяризации/количество выделяемого пресинаптическим окончанием медиатора и, соответственно, амплитуду вызванных постсинаптических потенциалов (ВПСП) на следующем нейроне в сети (Kole et al., 2007). Однако при медленных осцилляциях каналы Kv1 значительно инактивируются, что может привести к расширению потенциала действия и повышенному выбросу медиатора (Kole et al., 2007). Кроме того, подпороговая деполяризация этих нейронов, которая способна оказывать влияние на амплитуду ВПСП (Shu et al., 2006), также частично инактивирует каналы Kv1 и вызывает расширение потенциала действия (Foust et al., 2011). Однако длительная активность нейронов, которая может вызвать инактивацию Kv1-каналов, одновременно приводит к усилению активности BK-каналов из-за накопления кальция, входящего в нейрон в результате деполяризации через потенциал-активируемые кальциевые каналы (Yu et al., 2010). При регулярных электрических спайковых разрядах становится более выражена роль кальций-зависимых потенциал-активируемых каналов BK-типа (big potassium), активации которых предшествует накопление внутриклеточного кальция, вызванное предшествующими потенциалами действия (Roshchin et al., 2018). Этот важный механизм является основой кратковременной пластичности, проявляющейся при регулярной значительной активации аксона и синаптической передаче (“use-dependent plasticity”). Таким образом, можно сделать заключение, что BK-каналы обеспечивают нейрону надежный механизм предотвращения неконтролируемого усиления синаптической передачи при инактивации быстрых потенциал-активируемых калиевых каналов (Kv1) высокочастотными разрядами (Roshchin et al., 2018).
SK- и IK-каналы могут активироваться повышением внутриклеточного кальция вне зависимости от деполяризации мембраны и потенциалов действия, что позволяет отделить эти каналы от потенциал-активируемых в экспериментальных условиях (Roshchin et al., 2020). Физиологически охарактеризовать эти каналы у нейронов позволяют специфические блокаторы (рис.1): апамин для SK-каналов (Bock, Stuart, 2016) и TRAM-34 для IK-каналов (Tiwari et al., 2018). В качестве сенсора внутриклеточного кальция SK- и IK-каналы используют цитоплазматический белок кальмодулин (CaM): комплекс CaM/Ca2+ вызывает открытие этих каналов (Bean, 2007) (рис. 1 (в)). Однако возникновение потенциалов действия в нормальных условиях всегда сопровождается временным повышением кальция, и поэтому одним из наиболее заметных свойств каналов SK- и IK-типов является участие в продолжительной следовой гиперполяризации, отставленной от быстрой следовой гиперполяризации, которую вызывают потенциал-зависимые каналы (King et al., 2015; Roshchin et al., 2020).
Недавние исследования показали, что важное свойство адаптации у пирамидных нейронов 5-го слоя неокортекса находится в зависимости от следовой гиперполяризации, опосредованной IK(KCa3.1)-каналами (Roshchin et al., 2020). Наличие медленной следовой гиперполяризации находится в строгой корреляции с повышенной интенсивностью адаптации спайкового разряда у этих нейронов (Groh et al., 2010; Guan et al., 2015). Интересно, что нейроны 5-го слоя неокортекса, экспрессирующие IK-каналы/Kv2.2-каналы и имеющие замедленную фазу следовой гиперполяризации (Bishop et al., 2015; Roshchin et al., 2020), отличаются по знаку своей пластичности от неэкспрессирующих нейронов этого же слоя: у мышей IK+/Kv2.2+ нейроны демонстрируют депрессию, связанную с удалением вибрисс, и не демонстрируют потенциации (Jacob at al., 2012).
РОЛЬ КАЛЬЦИЙ-ЗАВИСИМЫХ КАЛИЕВЫХ КАНАЛОВ В ПАТОЛОГИЧЕСКОЙ ПЛАСТИЧНОСТИ ПРИ ЭПИЛЕПСИИ
Важнейшая функция кальций-зависимых калиевых каналов по отставленной регуляции нейрональной возбудимости предполагает их возможное участие в патологических процессах при развитии эпилепсии. Из всех кальций-зависимых калиевых каналов было продемонстрировано снижение активности только BK-каналов в гиппокампе хронических крыс-эпилептиков (Pacheco Otalora et al., 2008). Парадоксально, но исследования по поиску антиэпилептических препаратов показали умеренный эффект как активаторов, так и блокаторов BK-каналов (Leo et al., 2015). Мутации этих каналов были найдены у пациентов при некоторых видах эпилепсии (Du et al., 2005).
Угнетение функции SK1- и SK3-каналов было обнаружено у линии крыс, предрасположенных к эпилепсии (N’Gouemo et al., 2009). Судороги у этих крыс было возможно уменьшить с помощью фармакологической активации SK-каналов (Khandai et al., 2020). При экспериментальной фокальной эпилепсии в височной коре на моделях грызунов происходит значительное снижение следовой гиперполяризации у нейронов поля CA1 гиппокампа. Недавнее исследование (Tiwari et al., 2019) показало, что в этом случае угнетению подвергается компонент медленной следовой гиперполяризации, обеспечиваемый IK-каналами, что подтверждает участие IK-каналов в развитии этой формы судорог. В совокупности современные данные свидетельствуют о вовлеченности кальций-зависимых калиевых каналов в генезис эпилепсии, в то время как их аллели могут определять предрасположенность к некоторым видам этой болезни.
ДОЛГОВРЕМЕННАЯ ПЛАСТИЧНОСТЬ И УЧАСТИЕ КАЛЬЦИЙ-ЗАВИСИМЫХ КАЛИЕВЫХ КАНАЛОВ В ОБУЧЕНИИ И ФОРМИРОВАНИИ ПАМЯТИ
Современные генетические методы показывают непосредственное участие кальций-зависимых калиевых каналов в долговременной пластичности при обучении. При исследовании формирования долговременной памяти РНК-секвенированием небольших групп клеток было продемонстрировано специфическое изменение экспрессии целых кластеров генов в функциональных сетях нейронов. В частности, в списке дифференциально экспрессированных генов с помощью GO анализа (gene ontology analysis) были идентифицированы функциональные классы, включающие субъединицы рецепторов и ионных каналов (Rao-Ruiz et al., 2019). Из исследованных авторами 11 генов калиевых каналов нейронов зубчатой фасции гиппокампа, экспрессия транскриптов десяти генов понизилась в результате выработки обстановочного оборонительного рефлекса. Было зарегистрировано снижение экспрессии гена Kcnn3 (SK3) кальций-активируемого SK-канала в ~103 раз (Rao-Ruiz et al., 2019).
На клеточном уровне изменения в экспрессии каналов при метилировании ДНК могут отражаться в изменениях морфологических и функциональных характеристик как синапсов, так и возбудимости всего нейрона. На модели культуры кортикальных нейронов было обнаружено, что блокирование активности фермента ДНК-метилтрансферазы с помощью неспецифических ингибиторов приводит к повышению возбудимости мембран клеток и увеличению количества вызванных потенциалов действия (Meadows et al., 2016). На основании экспериментальных данных авторы предложили молекулярный механизм, стоящий за увеличением возбудимости мембран при блокировании активности ДНК-метилтрансферазы. Он заключается в изменении баланса метилирования/деметилирования ДНК в пользу последнего, что может быть достаточным условием для de novo транскрипции некоторых генов, кодирующих субъединицы потенциал-зависимых и кальций-зависимых каналов (Meadows et al., 2016). Анализ электрофизиологических характеристик нейронов показал, что применение ингибиторов DNMT снижает токи, ассоциированные с экспрессией кальций-активируемых каналов SK-типа и значительно снижает чувствительность этих нейронов к апамину – селективному блокатору SK-каналов (Meadows et al., 2016). Таким образом, снижение уровня метилирования ДНК этого гена может быть сопряжено с функциональными изменениями на мембране нейронов (увеличением электрической активности), которые надолго могут изменить значение и вес нейрона в активности нейронной сети, тем самым обеспечивая субстрат для долговременной памяти и обучения.
Искусственная сверхэкспрессия SK-каналов негативно сказывается на нейрональной пластичности. ~4-кратное увеличение общего тока SK-каналов значительно ухудшает долговременную потенциацию и обучение поведению с вовлечением гиппокампа и миндалины, в то время как блокирование SK-каналов блокатором апамином улучшает выработку долговременной потенциации в экспериментальных условиях (Hammond et al., 2006). В водном лабиринте Морриса предварительное введение блокатора SK-каналов апамина позволяет животным быстрее находить платформу, однако не влияет на извлечение долговременной памяти (Stackman et al., 2002).
ЗАКЛЮЧЕНИЕ
Кальций-зависимые калиевые каналы выполняют уникальную функцию отставленного торможения активности нейрона. Кроме того, их особенные свойства позволяют нейрону детектировать совпадение по времени потенциалов действия и повышение внутриклеточного кальция (BK-каналы), а также гиперполяризовать нейрон при накоплении кальция даже в отсутствие потенциалов действия (SK- и IK-каналы). Участие в регуляции возбудимости нейрона делает кальций-зависимые калиевые каналы важным звеном в переходе мозга ко сну и в развитии паталогических процессов при эпилепсии. При обучении и выработке долговременной памяти происходят значительные перестройки в экспрессии кальций-зависимых калиевых каналов, приводящие, по-видимому, к изменению возбудимости отдельных нейронов и сетей.
Работа поддержана грантом РФФИ 19-015-00022; анализ механизмов пластичности выполнен при поддержке гранта РНФ 20-15-00408.
Список литературы
Abiraman K., Tzingounis A.V., Lykotrafitis G. KCa2 channel localization and regulation in the axon initial segment. FASEB J. 2018. 32 (4): 1794–1805.
Bean B.P. The action potential in mammalian central neurons. Nat Rev Neurosci. 2007. 8 (6): 451–65.
Bishop H.I., Guan D., Bocksteins E., Parajuli L.K., Murray K.D., Cobb M.M., Misonou H., Zito K., Foehring R.C., Trimmer J.S. Distinct Cell- and Layer-Specific Expression Patterns and Independent Regulation of Kv2 Channel Subtypes in Cortical Pyramidal Neurons. J Neurosci. 2015. 35 (44): 14922–42.
Bock T., Stuart G.J. Impact of calcium-activated potassium channels on NMDA spikes in cortical layer 5 pyramidal neurons. J Neurophysiol. 2016. 115 (3): 1740–8.
Bond C.T., Herson P.S., Strassmaier T., Hammond R., Stackman R., Maylie J., Adelman J.P. Small conductance Ca2+-activated K+ channel knock-out mice reveal the identity of calcium-dependent afterhyperpolarization currents. The Journal of Neuroscience : the official journal of the Society for Neuroscience. 2004. 24 (23): 5301–5306.
Bond C.T., Maylie J., Adelman J.P. SK channels in excitability, pacemaking and synaptic integration. Curr Opin Neurobiol. 2005. 15 (3): 305–311.
Bregestovski P.D., Printseva O., Serebryakov V., Stinnakre J., Turmin A., Zamoyski V. Comparison of Ca2+-dependent K+ channels in the membrane of smooth muscle cells isolated from adult and foetal human aorta. Pflugers Arch. 1988. 413 (1): 8–13.
Cai X., Liang C.W., Muralidharan S., Kao J.P., Tang C.M., Thompson S.M. Unique roles of SK and Kv4.2 potassium channels in dendritic integration. Neuron. 2004. 44 (2): 351–364.
Colwell C.S. BK channels and circadian output. Nature neuroscience. 2006. 9 (8): 985–986.
Contet C., Goulding S.P., Kuljis D.A., Barth A.L. BK Channels in the Central Nervous System. Int Rev Neurobiol. 2016. 128: 281–342.
Cueni L., Canepari M., Luján R., Emmenegger Y., Watanabe M., Bond C.T., Franken P., Adelman J.P., Lüthi A. T-type Ca2+ channels, SK2 channels and SERCAs gate sleep-related oscillations in thalamic dendrites. Nat Neurosci. 2008. 11 (6): 683–692.
Cui J. BK-type calcium-activated potassium channels: coupling of metal ions and voltage sensing. J Physiol. 2010. 588 (Pt 23): 4651–4658.
Cui J., Yang H., Lee U.S. Molecular mechanisms of BK channel activation. Cellular and molecular life sciences : CMLS. 2009. 66 (5): 852–875.
Du W., Bautista J.F., Yang H., Diez-Sampedro A., You S.A., Wang L., Kotagal P., Luders H.O., Shi J., Cui J., Richerson G.B., Wang Q.K. Calcium-sensitive potassium channelopathy in human epilepsy and paroxysmal movement disorder. Nat Genet. 2005. 37 (7): 733–738.
Foust A.J., Yu Y., Popovic M., Zecevic D., McCormick D.A. Somatic membrane potential and Kv1 channels control spike repolarization in cortical axon collaterals and presynaptic boutons. J Neurosci. 2011. 31 (43): 15490–15498.
Groh A., Meyer H.S., Schmidt E.F., Heintz N., Sakmann B., Krieger P. Cell-type specific properties of pyramidal neurons in neocortex underlying a layout that is modifiable depending on the cortical area. Cereb Cortex. 2010. 20 (4): 826–836.
Guan D., Armstrong W.E., Foehring R.C. Electrophysiological properties of genetically identified subtypes of layer 5 neocortical pyramidal neurons: Ca (2) (+) dependence and differential modulation by norepinephrine. J Neurophysiol. 2015. 113 (7): 2014–2032.
Hammond R.S., Bond C.T., Strassmaier T., Ngo-Anh T.J., Adelman J.P., Maylie J., Stackman R.W. Small-conductance Ca2+-activated K+ channel type 2 (SK2) modulates hippocampal learning, memory, and synaptic plasticity. J Neurosci. 2006. 26 (6): 1844–1853.
Higham J., Sahu G., Wazen R.M., Colarusso P., Gregorie A., Harvey B.S.J., Goudswaard L., Varley G., Sheppard D.N., Turner R.W., Marrion N.V. Preferred Formation of Heteromeric Channels between Coexpressed SK1 and IKCa Channel Subunits Provides a Unique Pharmacological Profile of Ca (2+)-Activated Potassium Channels. Mol Pharmacol. 2019. 96 (1): 115–126.
Hu H., Shao L.R., Chavoshy S., Gu N., Trieb M., Behrens R., Laake P., Pongs O., Knaus H.G., Ottersen O.P., Storm J.F. Presynaptic Ca2+-activated K+ channels in glutamatergic hippocampal terminals and their role in spike repolarization and regulation of transmitter release. J Neurosci. 2001. 21 (24): 9585–9597.
Jacob V., Petreanu L., Wright N., Svoboda K., Fox K. Regular Spiking and Intrinsic Bursting Pyramidal Cells Show Orthogonal Forms of Experience-Dependent Plasticity in Layer V of Barrel Cortex. Neuron. 2012. 73 (2): 391–404.
Joiner W.J., Wang L.Y., Tang M.D., Kaczmarek L.K. hSK4, a member of a novel subfamily of calcium-activated potassium channels. Proc Natl Acad Sci U S A. 1997. 94 (20): 11013–8.
Khandai P., Forcelli P.A., N’Gouemo P. Activation of small conductance calcium-activated potassium channels suppresses seizure susceptibility in the genetically epilepsy-prone rats. Neuropharmacology. 2020. 163: 107865.
King B., Rizwan A.P., Asmara H., Heath N.C., Engbers J.D., Dykstra S., Bartoletti T.M., Hameed S., Zamponi G.W., Turner R.W. IKCa channels are a critical determinant of the slow AHP in CA1 pyramidal neurons. Cell Rep. 2015. 11 (2): 175–82.
Kohler M., Hirschberg B., Bond C.T., Kinzie J.M., Marrion N.V., Maylie J., Adelman J.P. Small-conductance, calcium-activated potassium channels from mammalian brain. Science. 1996. 273 (5282): 1709–14.
Kole M.H., Letzkus J.J., Stuart G.J. Axon initial segment Kv1 channels control axonal action potential waveform and synaptic efficacy. Neuron. 2007. 55 (4): 633–47.
Kshatri A.S., Gonzalez-Hernandez A., Giraldez T. Physiological Roles and Therapeutic Potential of Ca2+ Activated Potassium Channels in the Nervous System. Frontiers in Molecular Neuroscience. 2018. 11 (258).
Leo A., Citraro R., Constanti A., De Sarro G., Russo E. Are big potassium-type Ca (2+)-activated potassium channels a viable target for the treatment of epilepsy? Expert Opin Ther Targets. 2015. 19 (7): 911–926.
Marty A. Ca-dependent K channels with large unitary conductance in chromaffin cell membranes. Nature. 1981. 291 (5815): 497–500.
McManus O.B. Calcium-activated potassium channels: regulation by calcium. J Bioenerg Biomembr. 1991. 23 (4): 537–560.
Meadows J.P., Guzman-Karlsson M.C., Phillips S., Brown J.A., Strange S.K., Sweatt J.D., Hablitz J.J. Dynamic DNA methylation regulates neuronal intrinsic membrane excitability. Science signaling. 2016. 9 (442): ra83–ra83.
Meredith A.L., Wiler S.W., Miller B.H., Takahashi J.S., Fodor A.A., Ruby N.F., Aldrich R.W. BK calcium-activated potassium channels regulate circadian behavioral rhythms and pacemaker output. Nature Neuroscience. 2006. 9 (8): 1041–1049.
N’Gouemo P., Faingold C.L., Morad M. Calcium channel dysfunction in inferior colliculus neurons of the genetically epilepsy-prone rat. Neuropharmacology. 2009. 56 (3): 665–675.
Pantazis A., Olcese R. Biophysics of BK Channel Gating. Int Rev Neurobiol. 2016. 128: 1–49.
Rao-Ruiz P., Couey J.J., Marcelo I.M., Bouwkamp C.G., Slump D.E., Matos M.R., van der Loo R.J., Martins G.J., van den Hout M., van Ijcken W.F., Costa R.M., van den Oever M.C., Kushner S.A. Engram-specific transcriptome profiling of contextual memory consolidation. Nature Communications. 2019. 10 (1): 2232.
Roshchin M.V., Ierusalimsky V.N., Balaban P.M., Nikitin E.S. Ca (2+)-activated KCa3.1 potassium channels contribute to the slow afterhyperpolarization in L5 neocortical pyramidal neurons. Sci Rep. 2020. 10 (1): 14484.
Roshchin M.V., Matlashov M.E., Ierusalimsky V.N., Balaban P.M., Belousov V.V., Kemenes G., Staras K., Nikitin E.S. A BK channel-mediated feedback pathway links single-synapse activity with action potential sharpening in repetitive firing. Sci Adv. 2018. 4 (7): eaat1357.
Shu Y., Hasenstaub A., Duque A., Yu Y., McCormick D.A. Modulation of intracortical synaptic potentials by presynaptic somatic membrane potential. Nature. 2006. 441 (7094): 761–765.
Stackman R.W., Hammond R.S., Linardatos E., Gerlach A., Maylie J., Adelman J.P., Tzounopoulos T. Small conductance Ca2+-activated K+ channels modulate synaptic plasticity and memory encoding. J Neurosci. 2002. 22 (23): 10163–10171.
Tatsuki F., Sunagawa G.A., Shi S., Susaki E.A., Yukinaga H., Perrin D., Sumiyama K., Ukai-Tadenuma M., Fujishima H., Ohno R., Tone D., Ode K.L., Matsumoto K., Ueda H.R. Involvement of Ca (2+)-Dependent Hyperpolarization in Sleep Duration in Mammals. Neuron. 2016. 90 (1): 70–85.
Tiwari M.N., Mohan S., Biala Y., Yaari Y. Differential contributions of Ca (2+)-activated K (+) channels and Na (+) /K (+)-ATPases to the generation of the slow afterhyperpolarization in CA1 pyramidal cells. Hippocampus. 2018. 28 (5): 338–357.
Tiwari M.N., Mohan S., Biala Y., Yaari Y. Protein Kinase A-Mediated Suppression of the Slow Afterhyperpolarizing KCa3.1 Current in Temporal Lobe Epilepsy. The Journal of Neuroscience. 2019. 39 (50): 9914–9926.
Trimmer J.S. Subcellular localization of K+ channels in mammalian brain neurons: remarkable precision in the midst of extraordinary complexity. Neuron. 2015. 85 (2): 238–256.
Whitt J.P., Montgomery J.R., Meredith A.L. BK channel inactivation gates daytime excitability in the circadian clock. Nature Communications. 2016. 7 (1): 10837.
Yu Y., Maureira C., Liu X., McCormick D. P/Q and N channels control baseline and spike-triggered calcium levels in neocortical axons and synaptic boutons. J Neurosci. 2010. 30 (35): 11858–11869.
Дополнительные материалы отсутствуют.
Инструменты
Журнал высшей нервной деятельности им. И.П. Павлова


