Журнал высшей нервной деятельности им. И.П. Павлова, 2021, T. 71, № 1, стр. 72-85
Влияние инерции дневного сна на распознавание трудноразличимых звуков
М. О. Шилов 1, *, К. М. Левкович 1, О. В. Мартынова 1, 2, Ю. В. Украинцева 1
1 ФГБУН Институт высшей нервной деятельности и нейрофизиологии РАН
Москва, Россия
2 Центр нейроэкономики и когнитивных исследований,
Национальный исследовательский университет “Высшая школа экономики”
Москва, Россия
* E-mail: mixa@soi.su
Поступила в редакцию 18.06.2020
После доработки 05.10.2020
Принята к публикации 05.10.2020
Аннотация
Инерция сна – состояние перехода от сна к бодрствованию, которое характеризуется снижением внимания, производительности и дезориентацией. После пробуждения это состояние может длиться от нескольких минут до нескольких часов. Несмотря на довольно большую историю изучения данного явления, до сих пор отсутствуют исследования, направленные на оценку его эффекта на сенсорное распознавание. В данной работе мы исследовали влияние инерции дневного сна на распознавание трудноразличимых звуков, а также оценивали ее влияние на вызванные потенциалы мозга в ответ на распознававшиеся звуки. 45 здоровых добровольцев различали похожие звуки до и после одночасового дневного сна. Мы обнаружили, что неглубокий дневной сон улучшает распознавание звуков. При этом инерцию сна вызывает не столько наличие глубокого сна (третьей стадии) как таковое, сколько именно пробуждение из него – добровольцы, разбуженные во время третьей стадии дневного сна, хуже распознавали звуки, чем до сна. Это ухудшение сопровождалось увеличением латентности поздних когнитивных компонентов – Р3а и Р3b – и уменьшением амплитуды Р3b. При этом латентность ранних компонентов не изменилась, отмечено даже увеличение амплитуды компонента Р1 после сна. Полученные результаты позволяют заключить, что инерция сна не оказывает негативного влияния на ранние этапы анализа сигналов, на которых оцениваются сенсорные характеристики стимулов, но она нарушает поздние этапы, связанные с принятием решения и формированием ответа на стимул.
ВВЕДЕНИЕ
Наверное, каждому человеку знакомо состояние “оглушения”, которое случается сразу после пробуждения от сна, когда замедлена реакция, трудно сосредоточиться и невозможно нормально мыслить. У этого состояния есть специальный термин – инерция сна. Впервые в 1961 г. (Langdon, Hartman, 1961) было экспериментально показано, что сразу после сна эффективность выполнения задания ухудшается в сравнении с результатами, наблюдавшимися до сна. Далее в 1964 г. Вебб и Эгнью (Webb, Agnew, 1964) обнаружили, что в сенсомоторном задании, в котором испытуемым было необходимо как можно быстрее реагировать на зрительный стимул, испытуемые после пробуждения из глубокого сна показали существенно замедленную реакцию. Поэтому в дальнейшем в исследованиях инерции сна стали учитывать его глубину и стадию, во время которой произошло пробуждение. Было показано, что выраженное ухудшение сенсомоторных реакций наблюдается после пробуждения из самой глубокой, третьей стадии сна. При этом сон не оказывает существенного влияния на деятельность, если пробуждение произошло из более поверхностных стадий (первой или второй) либо из парадоксальной фазы сна (Feltin, Broughton, 1968; Scott J., 1968). Инерцию сна изучали также в задачах на кратковременную память. В частности, в одном исследовании (Stones, 1977) испытуемым через 1 мин после пробуждения демонстрировали список слов, после чего они должны были его воспроизвести. Было обнаружено, что производительность памяти после пробуждения из первой и второй стадии или из парадоксальной фазы была такой же высокой, как и в экспериментах без предшествующего сна. Однако пробуждение из третьей стадии значимо ухудшало воспроизведение слов. Таким образом, инерция сна вызывалась пробуждением из глубокого сна и негативно влияла на кратковременную память.
Каковы же нейрофизиологические механизмы влияния предшествующего сна на когнитивную деятельность? Было проведено несколько работ, в которых оценивалось изменение вызванных потенциалов мозга (ВП) после сна различной глубины и длительности. В частности, в работе, в которой изучалось влияние на когнитивные функции длительности дневного сна (Takahashi et al., 1998), было показано, что латентный период компонента Р300 зрительного ВП после 15 мин сна значительно короче, чем после 45 мин. Хотя различий в амплитуде этого компонента выявлено не было. Сходные результаты были получены и для слуховых стимулов – в экспериментах с использованием последовательности стимулов “odd-ball” (Takahashi, Arito, 2008). Было обнаружено, что после дневного сна длительностью 45 мин латентность Р300 увеличивалась и была положительно связана с продолжительностью третьей стадии. При этом инерция сна больше ухудшала точность выполнения тестов, чем скорость реакции. В исследовании Феррара и соавт. (Ferrara et al., 2001) было выявлено снижение амплитуды компонентов N1 и P2 после двухчасового ночного сна, которое коррелировало с длительностью третьей стадии перед пробуждением. Поскольку третья стадия сна характеризуется самым низким уровнем активности коры головного мозга, авторы делают предположение, что инерция сна может быть обусловлена пониженным уровнем активации, который не сразу восстанавливается после пробуждения из глубокого сна. Однако какого-либо влияния сна на латентность ВП авторы не выявили. Таким образом, результаты электрофизиологических исследований инерции сна довольно неоднородны. В частности, данные о воздействии на латентный период и амплитуду значительно расходятся.
Следует отметить, что среди довольно большого количества статей, посвященных инерции сна, преобладают работы, в которых оценивается ее влияние на когнитивную деятельность разной степени сложности, например, на устный счет (Jewett et al., 1999) или принятие решения (Bruck, Pisani, 1999). Но при этом отсутствуют исследования, направленные на оценку эффекта сна на относительно простые процессы, такие как сенсорное распознавание. До сих пор неясно, оказывает ли инерция сна влияние на распознавание трудноразличимых звуков. Хотя это важный вопрос, ведь по причине ухудшения распознавания схожих звуков могут возникать потенциально опасные ситуации. Например, в военной или медицинской области, сотрудникам которых приходится внезапно просыпаться ночью и сразу решать сложные задачи, в том числе связанные с различением звуковых сигналов. Более того, в большинстве исследований влияния инерции сна на когнитивные процессы анализировались поздние компоненты ВП, такие как Р300 (Takahashi, Arito, 1998; Takahashi, et al., 1998; Kaida et al., 2006), либо потенциалы, связанные с ошибкой (Asaoka et al., 2010; 2012), при этом мало внимания уделялось более ранним компонентам, отражающим анализ сенсорных характеристик стимулов, например, таким как Р2, N2, и негативность рассогласования (mismatch negativity/MMN). Поэтому остается открытым вопрос – на каком этапе нарушается когнитивная деятельность: происходят ли нарушения уже на раннем этапе анализа физических характеристик звуков или изменения возникают только на позднем этапе принятия решения.
В связи с этим мы поставили своей целью исследовать влияние инерции дневного сна на распознавание трудноразличимых звуков. А также проанализировать как сенсорные, так и когнитивные компоненты ВП мозга и определить, на каком этапе из-за инерции сна нарушается распознавание: на этапе анализа сенсорных характеристик звуков или на этапе принятия решения.
МЕТОДИКА
В исследовании приняли участие 45 здоровых добровольцев (правши, возраст от 19 до 25 лет, средний возраст 22 ± 0.3 года), 23 мужчины и 22 женщины. При наборе участников проводили анкетирование с целью оценки соматического и психического здоровья. Критерии исключения из эксперимента были следующими: острые или хронические заболевания, перенесенные черепно-мозговые травмы, снижение слуха, прием любых медикаментов, алкогольная или наркотическая зависимость, работа со сменным графиком, отсутствие регулярного режима сна и бодрствования, расстройства сна.
Перед началом экспериментальной сессии испытуемые были осведомлены о предмете и процедуре исследования и подтверждали свое добровольное участие подписанием Информированного согласия. По завершении каждого эксперимента они получали денежное вознаграждение (750 руб.). Протоколы исследования были составлены в соответствии с требованиями Хельсинкской декларации и одобрены этической комиссией ИВНД и НФ РАН.
Эксперимент заключался в распознавании трудноразличимых звуков до и после одночасового дневного сна. Схема эксперимента представлена на рис. 1.
Рис. 1.
Схема эксперимента. SSS – Stanford Sleepiness Scale. Остальные пояснения в тексте.
Fig. 1. Study design. SSS – Stanford Sleepiness Scale. Detailed explanation in the text.
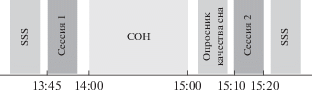
В начале эксперимента испытуемые заполняли Стэнфордскую шкалу сонливости (Stanford Sleepiness Scale – SSS) – опросник, определяющий уровень сонливости, а также опросник, оценивающий длительность и качество ночного сна накануне эксперимента. Далее они проходили аудиометрию для определения остроты слуха. После этого в течение 10 мин знакомились со звуками, которые им предстояло распознавать. После крепления датчиков для регистрации ЭЭГ испытуемые проходили в звукоизолированную комнату, оборудованную для сна, и, лежа на кушетке с закрытыми глазами, в течение 10 мин распознавали звуки, подававшиеся через наушники (сессия 1). Звуки предъявлялись в парадигме odd-ball, а именно – стандартный звук, который повторялся часто, в случайном порядке чередовался с двумя девиантными звуками, которые повторялись редко. Требовалось нажимать на кнопку в ответ на один из девиантов и игнорировать стандартный звук и второй девиант. После сессии распознавания звуков следовал дневной сон с регистрацией полисомнограммы. Через 1 ч испытуемых будили, после пробуждения следовал 10-минутный перерыв, в ходе которого испытуемые заполняли опросник субъективной оценки качества прошедшего дневного сна. Сразу после этого повторялась сессия распознавания звуков (сессия 2). В конце эксперимента испытуемые повторно заполняли SSS.
Определяли время реакции при нажатии на целевой девиант, количество правильных ответов, а также ошибочные нажатия на нецелевой девиант и на стандарт. В соответствии со Стэнфордской теорией обнаружения сигнала (Wickens, 2001), по числу правильных ответов, а также по числу ошибочных нажатий на нецелевой девиант рассчитывали индекс d' (d'-sensitivity).
Характеристики звуков. Звуки предъявляли с интенсивностью 60 дБ. Первый девиант (Д1) был выше по частоте, второй (Д2) – ниже стандартного с одинаковой разницей по частоте наполнения в Гц: стандарт 500–1000–1500 Гц; Д1 505–1010–1515 Гц; Д2 495–990–1485 Гц. Длительность стимулов 75 мс, межстимульный интервал (1000 ± 50) мс. Нарастание и спад интенсивности для каждого звука составляли 5 мс. Вероятность повторения стандартного звука составляла 80%, Д1 и Д2 – 10% для каждого. Для воспроизведения звуковых сигналов и фиксирования ответов использовали программное обеспечение E-Prime 1.2 (“Psychology Software Tools”, Pittsburgh, PA, США).
Регистрация ЭЭГ. Для регистрации ЭЭГ использовали 19-канальный энцефалограф “Энцефалан” (Медиком, Таганрог) с частотой дискретизации 250 Гц, применяли фильтр низких частот – 70 Гц, фильтр высоких частот – 0.05 Гц, режекторный фильтр – 50 Гц. Регистрацию ЭЭГ проводили при закрытых глазах в следующих отведениях: Fp1, Fp2, F3, F4, F7, F8, Fz, C3, C4, Cz, T3, T4, T5, T6, P3, P4, Pz, O1, O2. Также регистрировали окулограмму (2 канала для отслеживания движений глаз в вертикальном и горизонтальном направлении) и электромиограмму с подбородочной мышцы. По полисомнограмме анализировали архитектуру дневного сна. Полисомнограммы стадировали два независимых эксперта (У.Ю.В., Ш.М.О.) в соответствии со стандартными критериями (Rechtschaffen, Kales, 1968) и с учетом поправок Американской академии медицины сна (AASM) от 2007 г.
Обработка ВП. ВП анализировали в программе BrainVision Analyzer 2 (Brain Products GmbH, Гамбург, Германия). Фильтровали ЭЭГ в диапазоне 0.05–30 Гц; проводили вычитание окулографических артефактов при помощи анализа независимых компонент; удаляли мышечные артефакты с помощью визуального анализа. Запись сегментировали на эпохи (от –100 до 700 мс). Проводили отдельное усреднение эпох для стандартного звука и для целевого девианта (эпохи для стандартного звука усреднялись, начиная с 11-й). ВП анализировали во всех отведениях. Помимо ответов на стандарт и целевой девиант строились также разностные ВП, для этого проводили вычитание усредненных ВП на стандартный звук из ВП на целевой девиантный. Ответы на нецелевой девиант не анализировались.
Оценивались межгрупповые различия ВП на девиантные и стандартные звуки и разности между ними, а также внутригрупповые различия между ВП в сессии до сна и в сессии после сна. Для этого применяли пермутационный (метод Монте Карло, 500 пермутаций) кластерный анализ с использованием парного t-критерия Стьюдента для двух зависимых выборок (различия ВП на девиантный и стандартные звуки в сессии до сна и в сессии после сна) и F-критерия для трех независимых выборок (различия между тремя группами для ВП в сессии до сна и в сессии после сна) (MATLAB R2019a; пакет FieldTrip). Для анализа брали временное окно 700 мс от начала предъявления стимула, статистические сравнения проводили для каждого отсчета постстимульного интервала. Определяли максимальный размер временного кластера достоверных (p < 0.05) отличий. Для коррекции множественных сравнений использовали пермутации. Основываясь на результатах пермутационного теста, были выявлены временные окна, в которых ВП в одном или нескольких отведениях достоверно различались. В программе Brainvision для данных компонентов ВП были получены пики и определена их латентность.
Статистический анализ данных. Из статистического анализа были исключены 7 участников, которые плохо распознавали звуки – с d' < 0.5, а также двое испытуемых, у которых кроме ортодоксального сна регистрировалась также и парадоксальная фаза. Помимо этого, при анализе ВП исключили двоих испытуемых с высокой амплитудой альфа-ритма, затруднявшего анализ компонентов ВП. Таким образом, в окончательный анализ вошли данные 34 испытуемых.
На основании наличия третьей стадии сна всех испытуемых разделили на две группы: с поверхностным сном (была только первая или вторая стадия) и с глубоким сном (во время дневного сна зарегистрирована третья стадия). Затем вторую группу разбили еще на две в зависимости от стадии, из которой был разбужен испытуемый: разбуженные из третьей и разбуженные из первой или второй стадии. В итоге глубокий сон был зарегистрирован у 22 человек, поверхностный – у 12 человек, они вошли в 1-ю группу. Во 2-ю группу – с глубоким сном, но разбуженных из 1-й или 2-й стадии, вошли 10 испытуемых, и в группу 3 – разбуженных из третьей стадии – были отнесены 12 испытуемых.
С помощью критерия Колмогорова–Смирнова проверяли нормальность распределения показателей сна, доли правильных ответов, d', времени реакции, латентного периода компонентов ВП. Применяли t-критерий Стьюдента для сравнения показателей сна и латентного периода вызванных потенциалов до и после сна. Использовали дисперсионный анализ ANOVA для повторных измерений для оценки межгрупповых и внутригрупповых различий в показателях распознавания звуков до и после сна. Для апостериорного анализа показателей, имеющих нормальное распределение, применяли критерий Ньюмена–Кейлса; в том случае, когда данные были распределены ненормально (d') – использовали непараметрические критерии Манна–Уитни и Вилкоксона.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЙ
Архитектура и субъективные оценки дневного сна. Результаты анализа полисомнограмм дневного сна (табл. 1) показали, что общее время сна было больше у испытуемых с наличием глубокого сна по сравнению с испытуемыми, у которых наблюдались только первая и вторая стадии. При этом дольше всего спали те, кто был разбужен из третьей стадии, т.е. группа 3 (р < 0.001 в сравнении с 1-й группой, р = 0.01 по сравнению со 2-й группой). Они и засыпали значительно быстрее, чем представители групп 1 (р < 0.001) и 2 (р = 0.02). Помимо этого, группа 3 характеризовалась самой короткой первой стадией и самой продолжительной – третьей.
Таблица 1.
Показатели архитектуры и субъективных оценок сна в трех группах Table 1. Mean values of polysomnographic data and self-reported scores of sleep quality in three groups
| Параметры сна | Среднее значение | p | ||||
|---|---|---|---|---|---|---|
| Группа 1 (n = 12) | Группа 2 (n = 10) | Группа 3 (n = 12) | Для групп 1 и 2 | Для групп 2 и 3 | Для групп 1 и 3 | |
| Архитектура сна | ||||||
| Общая длительность сна (TST) | 18.08 | 35.65 | 49.04 | 0.002 | 0.011 | <0.001 |
| Длительность пробуждений (WASO) | 9.13 | 6.60 | 2.79 | 0.974 | 0.069 | 0.051 |
| Латентность засыпания | 21.25 | 13.60 | 9.54 | 0.080 | 0.020 | <0.001 |
| Латентность третьей стадии | 0.00 | 13.00 | 15.58 | <0.001 | 0.627 | <0.001 |
| Длительность первой стадии | 5.17 | 5.70 | 2.21 | 0.674 | 0.004 | 0.003 |
| Доля первой стадии от общей длительности сна | 30.79 | 13.17 | 4.87 | <0.001 | 0.002 | <0.001 |
| Длительность второй стадии | 12.92 | 18.05 | 15.00 | 0.159 | 0.417 | 0.377 |
| Доля второй стадии от общей длительности сна | 69.21 | 50.15 | 32.52 | <0.001 | 0.007 | <0.001 |
| Длительность третьей стадии | 0.00 | 12.25 | 31.58 | <0.001 | <0.001 | <0.001 |
| Доля третьей стадии от общей длительности сна | 0.00 | 34.64 | 62.14 | <0.001 | <0.001 | <0.001 |
| Субъективные оценки сонливости и сна | ||||||
| SSS до сна | 2.67 | 3.3 | 3.58 | 0.94 | 0.24 | 0.28 |
| SSS после сна | 2.58 | 2.5 | 3.41 | 1 | 0.17 | 0.2 |
| Качество сна дома | 7.75 | 6.42 | 7.9 | 0.32 | 0.2 | 0.82 |
| Сколько часов спали прошедшей ночью, ч | 6.7 | 7.35 | 6.54 | 0.41 | 0.4 | 0.67 |
| Глубина сна | 4.58 | 4.6 | 7 | 0.77 | 0.002 | 0.006 |
| Качество сна | 5.41 | 5.4 | 7.9 | 1 | 0.08 | 0.08 |
Примечание: В таблице представлены средние значения показателей и p-значения. Все показатели архитектуры сна представлены в минутах, доля представленности каждой из стадий сна – в процентах, субъективные оценки сонливости и сна – в баллах. Статистическая оценка значимости различий между группами в зависимости от стадии пробуждения получена с помощью парного t-теста. Значимые различия выделены жирным шрифтом. TST – длительность периода сна оценивалась как время от момента первого засыпания и до момента последнего пробуждения, включая и длительность пробуждений, если они были во время сна; WASO – длительность бодрствования в период пробуждений. SSS – Stanford Sleepiness Scale. Note: Data are mean values and p-values. All Polysomnographic indices are shown in minutes, ratio of each stage of sleep – in percentages, self-reported scores of the level of sleepiness and sleep quality – in marks. p-values are derived from a paired Student’s t-test. Significant differences are highlighted in bold. TST (total sleep time) – the duration of the sleep period was assessed as the time from the first time asleep and to the last time wake up, including the duration of awakenings, if they were during sleep; WASO (wakefulness after sleep onset) – duration of wakefulness during the awakening period. SSS – Stanford Sleepiness Scale.
Анализ данных опросника для оценки качества дневного сна выявил значимые различия между группами только по оценкам глубины сна. Испытуемые, которые были разбужены из третьей стадии, оценивали свой сон как более глубокий, чем испытуемые, которые этой стадии так и не достигли (p = 0.006), и те, у кого она была, но кто был разбужен из поверхностного сна (p = 0.002).
Анализ SSS и данных самоотчета о длительности ночного сна накануне эксперимента не выявил значимых различий между группами ни в уровне сонливости, ни в продолжительности предшествующего ночного сна.
Влияние глубины сна на долю правильных ответов при распознавании звуков. Для оценки влияния глубины сна анализировались внутри- и межгрупповые различия у лиц с наличием третьей стадии во время дневного сна (группа 2 + группа 3, n = 22) и у лиц с поверхностным сном (группа 1, n = 12). ANOVA показал различное влияние дневного сна на распознавание звуков в зависимости от его глубины, взаимодействие факторов “сессия распознавания” × “глубина сна”: F(1,32) = = 8.8669, p = 0.005 (рис. 2 (а)). Апостериорный анализ выявил достоверное (p = 0.038) снижение доли правильных нажатий на целевой девиант у испытуемых, спавших глубоким сном (группа 2 + группа 3). А у испытуемых, которые достигли только 2-й стадии (группа 1), обнаружил повышение доли правильных ответов (p = 0.042). Межгрупповое сравнение показало значимые различия между группами в сессии распознавания после сна (p = 0.002).
Рис. 2.
Эффективность распознавания звуков до и после сна. (а) – доля правильных ответов в зависимости от глубины сна (сплошная линия – не было 3-й стадии, n = 12, пунктирная линия – была 3-я стадия, n = 22). (б) – доля правильных ответов в зависимости от стадии пробуждения (сплошная линия – 2-я группа, n = 10, пунктирная линия – 3-я группа, n = 12). (в) – d' в зависимости от глубины сна (сплошная линия – не было 3-й стадии, n = 12, пунктирная – была 3-я стадия, n = 22). (г) – d' в зависимости от стадии пробуждения (сплошная линия – 2-я группа, n = 10, пунктирная линия – 3-я группа, n = 12). Ось абсцисс – сессии распознавания, ось ординат – значения показателя. На графиках отмечен 95%-й доверительный интервал. * и ** – различия значимы при р < 0.05 и р < 0.01 соответственно.
Fig. 2. Efficiency of sounds recognition before and after daytime sleep: (а) – the ratio of correct answers depending on the depth of sleep (the solid line – no Stage 3, n = 12, the dashed line – there was Stage 3, n = 22)). (б) – the ratio of correct answers depending on the stage of awakening (the solid line – Group 2, n = 10, the dashed line – Group 3, n = 12). (в) – d' depending on the depth of sleep (the solid line – no Stage 3, n = 12, the dashed line – there was Stage 3, n = 22). (г) – d' depending on the stage of awakening (the solid line – group 2, n = 10, the dashed line – group 3, n = 12). X-axis – 2 sessions of recognition: before and after sleep; Y-axis – values of recognition. 95% confidence interval is shown on the graph. * and ** are for significant differences for р < 0.05 and р < 0.01, respectively.
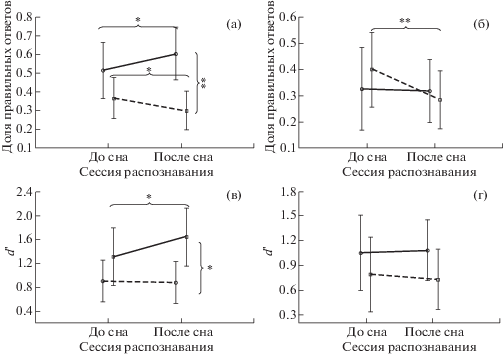
Влияние стадии пробуждения на долю правильных ответов при распознавании звуков. Анализировали также влияние стадии пробуждения на долю правильных ответов, для этого сравнивали между собой группы 2 и 3 – испытуемых, достигших третьей стадии во время дневного сна, но разбуженных во время сна различной глубины. ANOVA для повторных измерений выявил тенденцию к взаимодействию факторов “сессия” × “стадия пробуждения”: (F(1,20) = 4.0925, p = 0.056) (рис. 2 (б)). Апостериорный анализ показал, что разбуженные во время глубокого сна (группа 3) после пробуждения демонстрировали достоверно меньшее количество правильных ответов (р = 0.004) по сравнению с сессией до сна. Испытуемые, которые проснулись из легкого сна (группа 2), показали такую же долю правильных ответов, как и до сна (p = 0.860). Межгрупповое сравнение не выявило значимых различий между ними.
Влияние глубины сна на точность распознавания звуков. ANOVA для повторных измерений выявил тенденцию к взаимодействию факторов “сессия” × “глубина сна”: (F(1,32) = = 3.7784, p = 0.06). В ходе внутригруппового сравнения d' – показателя, характеризующего точность распознавания, – было обнаружено, что испытуемые из группы 1 – спавшие поверхностным сном – после пробуждения показали d' выше, чем до сна (p = 0.034.) Испытуемые с глубоким сном (группа 2 + группа 3) не продемонстрировали каких-либо изменений d' (p = 0.782) (рис. 2 (в)).
При этом межгрупповые сравнения показали, что до сна у испытуемых с поверхностным и глубоким сном d' значимо не различались. Однако после сна люди, достигшие третьей стадии, узнавали звуки достоверно хуже (p = 0.013), чем те, у кого была только первая или вторая стадия.
Влияние стадии пробуждения на точность распознавания звуков (по данным d'). Сравнение групп 2 и 3 – испытуемых, достигших третьей стадии во время дневного сна, но разбуженных во время сна различной глубины, показало сопоставимые значения d' в обеих сессиях распознавания. Внутригрупповой анализ также не выявил значимого влияния стадии пробуждения на точность распознавания в этих группах (рис. 2 (г)).
Время реакции. Анализ времени реакции при распознавании звуков не выявил достоверных межгрупповых различий и какого-либо значимого влияния дневного сна.
Влияние дневного сна на вызванные ответы мозга при распознавании звуков. В группе 1 в сессии распознавания до сна анализ вызванной активности не показал значимых различий в ВП на стандарт и девиант. Но после сна ответы на целевой девиант в теменной области отличались достоверно более выраженным негативным компонентом в окне 444–636 мс (p = 0.03, рис. 3 (а)). Таким образом, у лиц, не достигших глубокой стадии дневного сна, при распознавании звуков после пробуждения девиантный звук вызывает выраженное позднее негативное отклонение ВП.
Рис. 3.
Вызванные потенциалы (ВП) в ответ на целевой девиант и стандарт. (а) – у группы 1 (n = 12) после сна. Слева – топография разности ВП (девиант минус стандарт) через 544 мс после предъявления звука. Белые кресты – отведения ЭЭГ, вошедшие в значимый негативный кластер в окне 444–636 мс. Справа показаны усреднtнные вызванные потенциалы в ответ на девиант (сплошная линия) и стандарт (пунктирная линия) в отведении Pz. (б) – у группы 2 (n = 10) до сна. Слева – топография разности ВП (девиант минус стандарт) через 672 мс после предъявления звука. Белые кресты – отведения ЭЭГ, вошедшие в значимый негативный кластер в окне 644–696 мс. Справа – вызванные потенциалы в ответ на девиант (сплошная линия) и стандарт (пунктирная линия) в отведении Pz. Стрелка – начало подачи звука. Затемнение – временное окно, в котором выявлены значимые различия. Ось абсцисс – время в секундах, ось ординат – амплитуда в микровольтах.
Fig. 3. Event-related potentials (ERPs) in response to the target deviant and the non-target standard: (a) – in group 1 (n = 12) after sleep. On the left, topography of the ERPs difference (deviant minus standard) is shown at t = 544 ms after the sound presentation. White crosses are electrodes that were in a statistically significant negative cluster in 444–to–636-ms time window. On the right, the grand mean averaged waveform of evoked potentials (EP) in response to deviant (the solid line) and standard (the dashed line) at Pz electrode. (б) – in group 2 (n = 10) before sleep. On the left, topography of the ERPs difference (deviant minus standard) is shown at t = 672 ms after the sound presentation. White crosses are electrodes that were in a statistically significant negative cluster in 644–to–696-ms time window. On the right, the grand mean averaged waveform of EP in response to deviant (the solid line) and standard (the dashed line) at Pz electrode. The arrow is the start of presenting the sound. The grey shadowed region is a time window where the statistically significant differences were; X-axis – time in seconds; Y-axis – amplitude in microvolts.
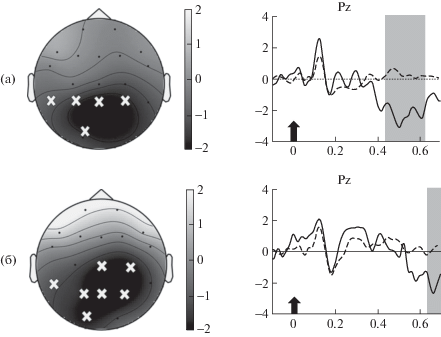
В группе 2 были выявлены различные ВП на целевой девиант и на стандарт в сессии распознавания до сна. Значимые (p = 0.046) отличия обнаружены в центральных и теменных отделах в негативном компоненте в окне 644–696 мс (рис. 3 (б)). Однако в сессии распознавания после сна ответы на стандартный и девиантный звук уже не различались. Таким образом, до сна у субъектов, спавших глубоким сном, но разбуженных из поверхностных стадий, сначала была выражена поздняя негативность в ответ на девиант, но после дневного сна этот компонент нивелируется.
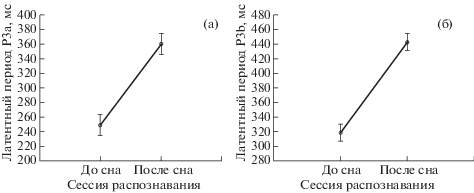
В группе 3 в сессии распознавания до сна ВП на целевой девиант отличается от ВП на стандарт более выраженным поздним субкомпонентом Р300 – Р3b. Достоверные различия обнаружены в окне 280–392 мс (p = = 0.004) в задних отделах коры, где в ответе на девиант этот субкомпонент имеет большую амплитуду, а также в окне 284–372 мс (p = = 0.012) в передних отделах, где он, наоборот, меньше по амплитуде, чем в ответе на стандарт (рис. 4 (а)). Помимо этого, различные ответы на девиант и стандарт отмечены и в сессии распознавания после сна: в позитивном компоненте Р1 в окне 8–64 мс (p = 0.048), а также в окне раннего субкомпонента Р300 Р3а – 296–408 мс (p = 0.014, рис. 4 (б)). Сравнение двух сессий – до сна и после сна – выявило значимое влияние сна на вызванные ответы. Различия достоверны для разностей между ответами на девиант и стандарт (между разностным ВП до сна и разностным ВП после сна) в передних отделах в негативном компоненте 300–404 мс: после сна этот компонент переходит в область позитивных значений (p = 0.028, рис. 4 (в)). Анализ латентностей компонентов ВП показал, что у группы 3 после сна наблюдается увеличение латентного периода P3a и P3b в ответ на девиантный звук. Значимое увеличение латентности наблюдалось во всех центральных отведениях: в Fz, (p < 0.001 для Р3а и p < 0.001 для P3b); в Cz, (p < 0.001 для Р3а и p < 0.001 для P3b); Pz, (p < < 0.001 для Р3а и p < 0.001 для P3b) (рис. 5 (а)–(б)). Латентность компонента Р1 не изменилась. Таким образом, у лиц, разбуженных во время третьей стадии, до сна присутствует теменная позитивность в ответ на девиант, которая представляет собой поздний субкомпонент P300 – Р3b. Хотя после сна позитивность в окне 300–404 мс в ответ на девиант сохраняется, но с учетом увеличившейся латентности она уже находится в окне раннего субкомпонента P300 – Р3а. Также и ее максимум локализуется уже не в теменных отделах, а смещается в передние отведения.
Рис. 4.
Вызванные потенциалы (ВП) в ответ на целевой девиант и стандарт у группы 3 (n = 12). (а) – до сна. Слева – топография разности (девиант минус стандарт) через 336 мс после предъявления звука. Белые кресты – отведения ЭЭГ, вошедшие в значимый негативный кластер в окне 284–372 мс. Черные кресты – отведения ЭЭГ, вошедшие в значимый позитивный кластер в окне 280–392 мс. Справа – вызванные потенциалы в ответ на девиант (сплошная линия) и стандарт (пунктирная линия) в отведении F7 (вверху) и в отведении Pz (внизу). (б) – после сна. Слева вверху – топография разности ВП (девиант минус стандарт) во временном окне 36 мс после предъявления звука. Черные кресты – отведения ЭЭГ, вошедшие в значимый позитивный кластер в окне 8–64 мс. Слева внизу – топография разности ВП (девиант минус стандарт) во временном окне 352 мс после предъявления звука. Черные кресты – отведения ЭЭГ, вошедшие в значимый позитивный кластер в окне 296–408 мс. Справа – вызванные потенциалы в ответ на девиант (сплошная линия) и стандарт (пунктирная линия) в отведении Cz. (в) – разность разностных ВП (девиант минус стандарт) до и после сна. Слева – топография разностей (разностный ВП до сна минус разностный ВП после сна) через 352 мс после предъявления звука. Белые кресты – отведения ЭЭГ, вошедшие в значимый негативный кластер в окне 300–404 мс. Справа – разность после сна (сплошная линия) и разность до сна (пунктирная линия) в отведении Fz. Остальные обозначения как на рис. 3.
Fig. 4. Event-related potentials (ERPs) in response to the target deviant and the non-target standard in group 3 (n = 12): (a) – before sleep. On the left, topography of the ERPs difference (deviant minus standard) is shown at t = 336 ms after the sound presentation. White crosses are electrodes that were in a statistically significant negative cluster in 284 to–372-ms time window. Black crosses are electrodes that were in significant positive cluster in 280–to–392-ms time window. On the upper right, the grand mean averaged waveform of ERPs in response to deviant (the solid line) and standard (the dashed line) at F7 electrode. On the lower right, the grand mean averaged waveform of ERPs in response to deviant (the solid line) and standard (the dashed line) at Pz electrode. (б) – after sleep. On the upper left, topography of the ERPs difference is shown at t = 36 ms after the sound presentation. Black crosses are electrodes that were in a statistically significant positive cluster in 8–to–64-ms time window. On the lower left, topography of the ERPs difference is shown at t = 352 ms after the sound presentation. Black crosses are electrodes that were in a statistically significant positive cluster in 296–to–408-ms time window. On the right, the grand mean averaged waveform of ERPs in response to deviant (the solid line) and standard (the dashed line) at Cz electrode. (в) – the difference of ERPs differences before and after sleep. On the left, topography of the difference of the ERPs differences (the ERPs difference before sleep minus the ERPs difference after sleep) is shown at t = 352 ms after the sound presentation. White crosses are electrodes that were in a statistically significant negative cluster in 300–to–404-ms time window. On the right, the ERPs difference before sleep (the solid line) and the ERPs difference after sleep (the dashed line) at Fz electrode. Other designations as in fig. 3.
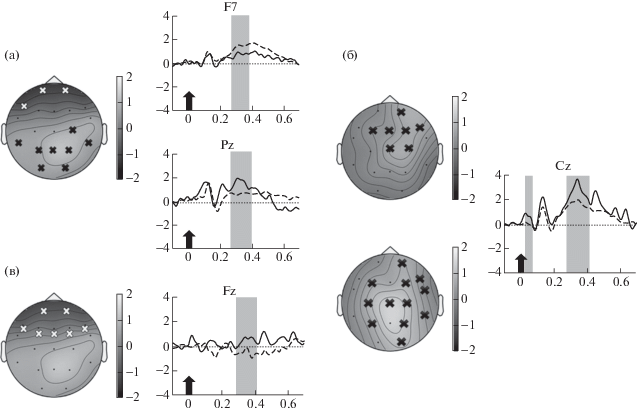
Рис. 5.
Латентный период субкомпонентов Р300 до и после сна. (а) – латентный период P3a в отведении Fz; (б) – латентный период P3b в отведении Pz. Остальные обозначения как на рис. 2.
Fig. 5. Latency of P300 subcomponents before and after sleep: (a) – latency of P3a at Fz electrode (б) – latency of P3b at Pz electrode. Other designations as in fig. 2.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Наши результаты свидетельствуют о том, что глубокий дневной сон может иметь инерцию, которая негативно влияет на распознавание звуков. Так, испытуемые, достигшие третьей стадии во время 1-часового дневного сна, после пробуждения правильно распознали меньше звуков, чем до сна.
Сравнив отдельно группы с разной стадией пробуждения, мы обнаружили, что выраженную инерцию вызывает форсированное пробуждение из глубокого сна. Добровольцы, разбуженные из третьей стадии, чаще ошибались, чем в сессии до сна, а у испытуемых, у которых присутствовала третья стадия, но которые были разбужены из первой или второй, количество правильных ответов не изменилось. Следовательно, инерцию сна вызывает не столько наличие глубокого сна как таковое, сколько именно пробуждение из него. В этом наши результаты согласуются с данными ранее опубликованной работы, в которой было показано, что пробуждение из третьей стадии ухудшает поведенческие показатели (Stones, 1977).
Помимо процента правильных ответов, у добровольцев с глубоким сном и точность распознавания звуков, оцениваемая по параметру d', была ниже, чем у субъектов с поверхностным сном. Однако статистически значимого влияния стадии пробуждения на d' мы не обнаружили. Поскольку данный параметр кроме количества правильных нажатий на целевой девиант учитывает также ошибочные нажатия на нецелевой девиант, можно заключить, что уменьшение числа правильных ответов сопровождалось также уменьшением количества ошибок. Такое снижение количества ответов после пробуждения из глубокого сна могло быть вызвано общим замедлением реакций, как правильных, так и ошибочных. Но, к сожалению, нам не удалось выявить достоверные межгрупповые различия и какое-либо значимое влияние дневного сна на время реакции, возможно, из-за того, что звуки предъявлялись в довольно быстром темпе (1 стимул в секунду), и если испытуемый не успевал ответить до конца межстимульного интервала, то такие реакции классифицировались как артефактные и не анализировались.
Помимо негативного влияния на распознавание звуков форсированного пробуждения из глубокого сна, наши результаты свидетельствуют также о том, что неглубокий дневной сон улучшает распознавание звуков. В частности, у тех субъектов, у которых наблюдалась только 2-я стадия, мы наблюдали рост доли правильных ответов и увеличение точности распознавания. Это улучшение можно объяснить одной из функций сна – консолидацией памяти. В обеих сессиях распознавания стандарт и девианты имели одни и те же характеристики, поэтому уже в первой сессии различения звуков у испытуемых могла сформироваться память об их свойствах, благодаря которым их можно отличить друг от друга. В течение дневного сна произошло закрепление полученного навыка, что позволило увеличить количество правильных ответов во второй сессии. Это подтверждает данные о том, что сон, по крайней мере, некоторые его стадии, способствует сенсорному распознаванию (Andrillon et al., 2017).
Чтобы прояснить механизмы нарушения распознавания звуков в состоянии инерции сна, мы попытались ответить на вопрос: на каком уровне нарушается распознавание звуков? На раннем этапе анализа физических характеристик звуков сенсорными отделами мозга? Или на позднем этапе принятия решения о сходстве либо различии звуков? Для этого мы анализировали вызванные потенциалы в ответ на распознававшиеся звуки.
В группе 1 у испытуемых, не достигших третьей стадии во время дневного сна, при распознавании звуков после пробуждения целевой девиант вызывает в теменных областях выраженное негативное отклонение в окне 444–636 мс. Этот компонент можно интерпретировать как подготовку моторного ответа, так как в заданиях, требующих двигательной реакции, ответ сопровождается поздней негативностью, которая начинается до начала движения и продолжается после него (Shibasaki et al., 1980; Brunia et al., 2011). Поскольку до сна этот компонент ВП на девиант не был выражен, то его появление после сна можно объяснить процессами сон-зависимой консолидации памяти (Украинцева и др., 2018), протекающими во время сна. То есть это изменение ВП можно рассматривать как следствие закрепления во время дневного сна навыка различения целевого девианта и реагирования на него. В итоге это привело к лучшему распознаванию звуков после пробуждения, что подтверждается значимым ростом доли правильных ответов у группы 1.
В группе 2 у лиц, достигших третьей стадии во время дневного сна, но разбуженных из поверхностных стадий, мы наблюдали противоположные сдвиги: если до сна у этих лиц регистрировалась выраженная поздняя негативность в ответ на целевой девиант, то после сна данный компонент не был обнаружен. Если интерпретировать этот компонент как возможный коррелят подготовки моторного ответа (Shibasaki et al., 1980; Brunia et al., 2011), то его исчезновение может говорить о том, что у данных испытуемых сон не способствовал улучшению навыка распознавания звуков. Либо, несмотря на то, что они были разбужены из поверхностного сна после естественного завершения третьей стадии, погружение в глубокий сон наложило отпечаток на их состояние, и через 10 мин после пробуждения, когда началась повторная сессия распознавания, их работоспособность еще не достигла оптимального уровня.
В группе 3, разбуженных во время третьей стадии дневного сна и характеризовавшихся выраженным негативным влиянием инерции сна на распознавание, было обнаружено, что до сна ВП на девиант отличался более высокоамплитудным позитивным отклонением в окне 284–392 мс в задних отделах. Теменная локализация максимума этого компонента, а также тот факт, что он представляет собой второй пик Р300, указывает на то, что это Р3b – поздний субкомпонент Р300, который регистрируется при активном направленном внимании (Escera et al., 1998). Однако после сна латентность Р3а и Р3b увеличивается, различия между ответами на стандарт и девиант в окне Р3b нивелируются, и девиант отличается от стандарта только более выраженным субкомпонентом Р3а, который рассматривается как коррелят пассивного, непроизвольного внимания (Escera et al., 1998). По-видимому, эти изменения можно рассматривать как проявления инерции сна, которая в этой группе была сильнее всего выражена, и на поведенческом уровне приводила к росту количества ошибок.
Однако несмотря на то, что под действием инерции сна пропадает выраженный P3b в ответ на девиант, в области более ранних, сенсорных компонентов ВП наблюдается увеличение амплитуды Р1 – компонента, связанного с обработкой физических характеристик стимула. В отличие от P3b, коррелята произвольного, направленного внимания, Р1 отражает более базовые, досознательные этапы анализа сенсорных сигналов (Ibrahim et al., 2018). Ранее было показано, что компонент P1 регистрируется (и его амплитуда даже может увеличиваться) при засыпании (de Lugt et al., 1996) и под анестезией (Hooff et al., 1997). Можно заключить, что ранние этапы сенсорного распознавания не нарушаются и при низких уровнях бодрствования, в том числе и на фоне инерции сна.
Таким образом, наши результаты свидетельствуют о негативном влиянии инерции сна на поздние, когнитивные, компоненты ВП. Прежде всего – на выраженность P300, и особенно его более позднего компонента Р3b, связанного с активным произвольным вниманием. После глубокого сна может также уменьшаться выраженность N400, компонента, связанного с подготовкой моторного ответа. Эти результаты могут указывать на то, что инерция сна нарушает концентрацию внимания, что в итоге затрудняет принятие решения и формирование ответа на значимые сигналы.
Интересно, что испытуемые, разбуженные из глубокого сна и характеризовавшиеся наиболее выраженной его инерцией, достоверно отличались от двух других групп по ряду показателей архитектуры сна. Анализ полисомнограмм показал, что у этих субъектов скорость засыпания и продолжительность сна были больше, чем у остальных групп, длительность третьей стадии выше, чем у группы, разбуженной из 1-й или 2-й стадии. Поэтому мы решили проверить, не были ли связаны эти различия с предшествующим дефицитом сна. Ведь было показано, что предварительная депривация медленноволнового сна увеличивает его длительность в последующий период восстановления, а также вызывает инерцию, что негативно сказывается на выполнении задания (Ferrara et al., 1999). Однако сравнение продолжительности ночного сна в ночь, предшествовавшую эксперименту, а также субъективных оценок сонливости в начале и в конце эксперимента не обнаружило значимых отличий между тремя группами. Значимые расхождения были выявлены только в субъективной оценке глубины сна в течение эксперимента. Таким образом, можно заключить, что три группы испытуемых имеют индивидуальные особенности механизмов инициации и поддержания сна, которые в результате могут обусловливать у некоторых из них, в частности, у субъектов с особенно длительной и глубокой третьей стадией, возникновение выраженной инерции сна при форсированном пробуждении. Чем обусловлены эти индивидуальные различия архитектуры сна – вопрос, который требует дальнейшего изучения.
ЗАКЛЮЧЕНИЕ
Полученные нами результаты позволяют заключить, что дневной сон способен иметь инерцию, которая ухудшает распознавание трудноразличимых звуков. При этом инерцию вызывает не столько наличие самой глубокой, третьей стадии сна как таковое, сколько именно пробуждение из нее. Также мы обнаружили, что неглубокий дневной сон улучшает различение звуков, по-видимому, этот эффект может объясняться одной из функций сна – консолидацией памяти. То есть дневной сон как таковой, при условии, что он не имеет инерции, благотворно влияет на сенсорное распознавание. Анализ ВП показал, что инерция сна затрагивает прежде всего поздние когнитивные компоненты. При этом она не оказывает негативного влияния на ранние компоненты ВП. По-видимому, инерция сна не нарушает ранние этапы сенсорного распознавания, связанные с анализом физических параметров стимула. Но она затрудняет поздние этапы, требующие активного, направленного внимания – этапы принятия решения и формирования ответа на стимул.
Исследование выполнено при финансовой поддержке Российского фонда фундаментальных исследований (в рамках научного проекта РФФИ № 19-313-90067 Аспиранты) и из средств государственного бюджета по госзаданию на 2019–2021 годы (№ г.р. АААА-А17-117092040004-0).
Список литературы
Украинцева Ю.В., Левкович К.М., Sake K.L., Полищук А.А., Мартынова О.В. Улучшение распознавания звуков после их предъявления во время сна. Журн. высш. нервн. деят. им. И.П. Павлова. 2018. 68 (5): 614–626.
Andrillon T., Pressnitzer D., Leger D., Kouider S. Formation and suppression of acoustic memories during human sleep. Nat. Commun. 2017. 8 (1): 179.
Asaoka S., Masaki H., Ogawa K., Murphy T., Fukuda K., Yamazaki K. Performance monitoring during sleep inertia after a 1-h daytime nap: Sleep inertia. J. Sleep Res. 2010. 19 (3): 436–443.
Asaoka S., Fukuda K., Murphy T., Abe T., Inoue Y. The Effects of a Nighttime Nap on the Error-Monitoring Functions During Extended Wakefulness. Sleep. 2012. 35 (6): 871–878.
Bruck D., Pisani D.L. The effects of sleep inertia on decision-making performance. J. Sleep Res. 1999. 8 (2): 95–103.
Brunia H.M., Hackley S.A., van Boxtel J.M., Kotani Y., Ohgami Y. Waiting to Perceive: Reward or Punishment? Clin Neurophysiol. 2011. 122 (5): 858–868.
De Lugt D.R., Loewy D.H., Campbell K.B. The Effect of Sleep Onset on Event Related Potentials With Rapid Rates of Stimulus Presentation. Electroencephalogr Clin Neurophysiol. 1996. 98(6): 484–492.
Escera C., Alho K., Winkler I., Naatanen R. Neural mechanisms of involuntary attention to acoustic novelty and change. J. Cogn. Neurosci. 1998. 10 (5): 590–604.
Feltin M., Broughton R. Differential effects of arousal from slow wave versus REM sleep.Psychophysiology. 1968. 5 (2): 231.
Ferrara M., Gennaro L. De, Ferlazzo F., Curcio G., Barattucci M., Bertini M. Auditory evoked responses upon awakening from sleep in human subjects. Neurosci. Lett. 2001. 310 (2–3): 145–148.
Ferrara M., Gennaro L., De Bertini M. The effects of slow-wave sleep (SWS) deprivation and time of night on behavioral performance upon awakening. Physiol. Behav. 1999. 68 (1–2): 55–61.
Ibrahim A.I., Ting H.N., Moghavvemi M. The Effects of Audio Stimuli on Auditory-Evoked Potential in Normal Hearing Malay Adults. Int J Health Sci (Qassim). 2018. 12 (5): 25–34.
Jewett M.E., Wyatt J.K., Ritz-De Cecco A., Khalsa S.B., Dijk D.J., Czeisler C.A. Time course of sleep inertia dissipation in human performance and alertness. J. Sleep Res. 1999. 8 (1): 1–8.
Kaida K., Ogawa K., Nittono H., Hayashi M., Takahashi M., Hori T. Self-awakening, sleep inertia, and P3 amplitude in elderly people. Percept. Mot. Skills. 2006. 102 (2): 339–351.
Langdon D.E., Hartman B. Performance upon sudden awakening. Tech. Doc. Rep. SAMTDR. USAF Sch. Aerosp. Med. 1961. 62 (8): 17.
Rechtschaffen A., Kales A. Manual of Standardized Terminology, Techniques and Scoring System for Sleep Stages of Human Subjects. Arch Gen Psychiatry. 1969. 20 (2): 246–247.
Scott J.S.F. ‘Critical reactivity' (Pieron) after abrupt awakenings in relation to EEG stages of sleep. Psychophysiology. 1968. 4: 370.
Shibasaki H., Barrett G., Halliday A.M., Halliday E. Scalp Topography of Movement-related Cortical Potentials. Prog. Brain Res. 1980. 54: 237–242.
Stones M.J. Memory performance after arousal from different sleep stages. Br. J. Psychol. 1977. 68 (2): 177–181.
Takahashi M., Arito H. Sleep Inertia and Autonomic Effects on Post-Nap P300 Event-Related Potential. Ind. Health. 2008. 36 (4): 347–353.
Takahashi M., Fukuda H., Arito H. Brief naps during post-lunch rest: Effects on alertness, performance, and autonomic balance. Eur. J. Appl. Physiol. Occup. Physiol. 1998. 78 (2): 93–98.
Van Hooff J.C., De Beer N.A., Brunia C.H., Cluitmans P.J., Korsten H.H. Event-related Potential Measures of Information Processing During General Anesthesia. Electroencephalogr Clin Neurophysiol. 1997. 103 (2): 268–281.
Webb W.B., Agnew H. Reaction time and serial response efficiency on arousal from sleep. Percept. Mot. Skills. 1964. 18 (3): 783–784.
Wickens T.D. Elementary signal detection theory. Oxford University Press. 2002. 271.
Дополнительные материалы отсутствуют.
Инструменты
Журнал высшей нервной деятельности им. И.П. Павлова


