Журнал высшей нервной деятельности им. И.П. Павлова, 2020, T. 70, № 6, стр. 738-751
Кортикомышечное взаимодействие при реальном и воображаемом движении кисти руки
М. Е. Курганская 1, *, П. Д. Бобров 1, А. А. Фролов 1, Е. И. Семенова 1
1 Институт высшей нервной деятельности и нейрофизиологии РАН
Москва, Россия
* E-mail: m-kurg@yandex.ru
Поступила в редакцию 01.03.2020
После доработки 21.05.2020
Принята к публикации 01.06.2020
Аннотация
В работе у десяти взрослых испытуемых регистрировали электроэнцефалограмму (ЭЭГ) и электромиограмму (ЭМГ) в состоянии покоя (глаза открыты), а также при выполнении реального и воображаемого ритмически повторяющегося движения. С помощью векторного авторегрессионного моделирования оценивали направленную передаточную функцию (НПФ) для шести билатерально симметричных каналов ЭЭГ (F1/2, C3/4, P5/6) и двух каналов ЭМГ (flexor capri ulnaris левой и правой руки). Испытуемые реально выполняли и представляли выполнение повторяющегося раскрытия и сжатия кисти правой и левой руки. Статистический анализ НПФ, усредненных в альфа- и гамма-диапазонах и соответствующих нисходящим и восходящим кортикомышечным влияниям, показал, что (1) при переходе от покоя к воображаемому и реальному движению нисходящие влияния изменяются по-разному для альфа- и гамма-диапазонов частот. В альфа-диапазоне эти влияния возрастают при совершении реального движения, но не отличаются от покоя при воображаемом движении. В гамма-диапазоне нисходящее влияние сигнала левого фронтального отведения на ЭМГ-канал правой руки возрастает по сравнению с покоем при выполнении как реального, так и воображаемого движения; (2) восходящие влияния демонстрируют лишь тенденции к изменению: при реальном движении эти влияния в обоих частотных диапазонах несколько превышают показатели условия покоя; (3) и в альфа-, и в гамма-диапазонах восходящие влияния при воображаемом движении имеют тенденцию быть ниже, чем в покое; (4) в обоих частотных диапазонах нисходящие влияния оказались значимо больше восходящих влияний; (5) в альфа-диапазоне максимальные нисходящие влияния как при реальном, так и воображаемом движении оказывают не центральные, а фронтальные регионы.
ВВЕДЕНИЕ
Феномен мысленного движения давно привлекает к себе внимание исследователей [Guillot, Collet, 2005; Jeannerod, 1995]. Этот интерес объясняется двумя причинами. Первая причина состоит в том, что воображаемое движение во многом сходно с реальным. Воображаемые движения вызывают психофизиологические изменения, сходные с теми, которые вызываются реальными движениями, хоть и более слабые. Так, при реальном и при воображаемом движении регистрируются сходные вегетативные ответы, наблюдается активация одних и тех же областей мозга [Столбков и др., 2018; Batula et al., 2017]. Известен также положительный эффект от так называемой ментальной тренировки – мысленного повторения движений, требующих ловкости и точности [Di Rienzo et al., 2014; Sheahan et al., 2018]. Такая тренировка наряду с реальным выполнением движения улучшает двигательный навык. M. Jeannerod предположил, что в основе мысленного движения лежит осознание обычно неосознанной внутренней репрезентации движения [Jeannerod, 1995]. Вторая причина интереса к мысленному движению заключается в возможности использовать его в интерфейсе мозг-компьютер [Мокиенко и др., 2013; Фролов и др., 2017; Graimann et al., 2009; Столбков, 2018].
Исследование изменений мышечного тонуса при мысленном выполнении движений с помощью оценок электромиограмм (ЭМГ) показало неоднозначные результаты [Demougeot et al., 2009; Guillot, Collet, 2005; Li et al., 2004]. Например, по данным работы [Demougeot et al., 2009], при мысленном поднятии ноги или переводе торса из горизонтального в вертикальное положение, т.е. при движениях, требующих значительного мышечного усилия, изменения амплитуды миограммы наблюдаются в тех же мышцах, что и при реальном выполнении этих движений. При этом мысленное выполнение сгибаний-разгибаний в лучезапястном суставе не приводило к изменению мышечного тонуса ни в одной из групп мышц – изменений амплитуды миограммы не было обнаружено ни в мышцах лучезапястного сустава, ни в мышцах ног и торса. В другой работе [Guillot, Collet, 2005] анализировались ЭМГ в ходе мысленного выполнения целого ряда движений, и ни в одном из них не было обнаружено значимых отклонений мышечного тонуса от фонового уровня. Не было зарегистрировано изменения амплитуд электромиограмм при повторяющемся мысленном изометрическом напряжении мышц, при изометрическом сгибании руки в лучезапястном суставе. Амплитуда ЭМГ не изменялась при мысленной ходьбе, при выполнении ногами различных упражнений, при мысленном сгибании-разгибании запястья, а также ног в голеностопном суставе. По данным еще одной работы [Guillot, Collet, 2005], наблюдается подпороговое возрастание электрической активности в мышцах во время прыжков и поворотов у горнолыжников при мысленном прохождении горнолыжной трассы, во время мысленного плавания, гребли, игры в баскетбол, катания на водных лыжах, во время представления ударов карате и жонглирования. При этом конкретное содержание мысленного образа отражается как на задействованных мышцах, так и на величине ЭМГ. В частности, было показано, что мысленное поднятие более тяжелого груза сопровождалось большей активацией в мышцах, чем поднятие более легкого груза (9 кг против 4.5 кг). Интересно, что по данным [Li et al., 2004] изменение ЭМГ при мысленном движении наблюдается не у всех испытуемых: во время мысленного сгибания пальцев изменение мышечного тонуса было обнаружено только у четырех испытуемых из девяти.
Мышечная биоэлектрическая активность при выполнении движений сложным образом связана с электрической активностью мозга [Kilner et al., 1999; Kilner et. al., 2000; Reyes et al., 2017; Halliday et al., 1998; Omlor et al., 1998; Farina et al., 2004; de Luca, 1997; Demougeot et al., 2009; Desmurget et al., 2009; Guillot, Collet, 2005].
Эта связь, т.е. взаимодействие между электрическими активностями мозга и мышц, проявляется в статистической связи между ЭЭГ и ЭМГ, которые являются временными рядами или дискретными последовательностями отсчетов. Эту связь исследуют при помощи таких мер, как функция когерентности, которая характеризует долю общего сигнала на определенной частоте в двух временных рядах. Следует отметить, что когерентность является ненаправленной мерой и не дает возможности отделить управляющий сигнал, идущий от мозга к мышцам, от сенсомоторного сигнала, идущего от периферии к мозгу [Yang et al., 2018]. Для исследования восходящего и нисходящего кортикомышечного влияния необходимо оценить эффективные связи, содержащие явное указание на причинно-следственные отношения между процессами, протекающими в разных структурах [Friston, 2011].
Целью настоящей работы была оценка особенности структуры кортикомышечных эффективных связей при выполнении реального и воображаемого ритмического движения. Оценка эффективных связей была выполнена на основе векторной авторегрессионной модели [Kaminsky et al., 2001; Курганский, 2010] многоканальных данных, включающих несколько каналов ЭЭГ и два канала ЭМГ. Для анализа мы выбрали сигналы от 6 энцефалографических отведений, соответствующих кортикальным регионам, вовлеченным в воображаемое движение [Ives-Deliperi, Butler, 2018]. Мы использовали два фронтальных отведения F1 и F2, соответствующие дорсолатеральной префронтальной коре, два центральных отведения С3 и С4, соответствующие проекции рук в первичной моторной коре [Ives-Deliperi Butler, 2018], и два париетальных отведения P5 и P6, соответствующие задней теменной коре. Миографические электроды были помещены в проекции локтевого сгибателя запястья (flexor capri ulnaris) правой и левой руки.
МЕТОДИКА
Испытуемые. В исследовании участвовали 10 здоровых праворуких испытуемых в возрасте от 20 до 53 лет, 6 мужчин и 4 женщины. Участники исследования подписывали информированное согласие, одобренное этической комиссией Института высшей нервной деятельности и нейрофизиологии РАН для здоровых испытуемых.
Структура эксперимента. Эксперимент включал пять экспериментальных условий: 1) покой с открытыми глазами (ПО); 2) воображаемое быстрое повторяющееся раскрытие левой кисти (ВЛ); 3) воображаемое быстрое повторяющееся раскрытие правой кисти (ВП); 4) быстрое повторяющееся раскрытие левой кисти (ДЛ); 5) быстрое повторяющееся раскрытие правой кисти (ДП). Экспериментальные условия ВЛ, ВП, ДЛ, ДП следовали в случайном порядке, а покой предшествовал каждому движению. В течение экспериментальной сессии каждое из экспериментальных условий повторялось по четыре раза.
Регистрация ЭЭГ и ЭМГ. Во всех пяти экспериментальных условиях непрерывно регистрировались 40 каналов ЭЭГ и 2 канала ЭМГ. Регистрация проводилась с помощью электроэнцефалографа “Нейровизор БММ” (Медицинские компьютерные системы, Москва, Зеленград, Россия) с частотой оцифровки 500 Гц. Электроды располагались на скальпе в соответствии с расширенной системой 10–20, в качестве референта использовалось отведение AFz. ЭМГ-сигнал регистрировался при помощи двух пар электродов, помещенных в проекции локтевого сгибателя запястья (flexor capri ulnaris) левой и правой руки.
Экспериментальная процедура. Во время эксперимента испытуемый сидел в кресле за столом, на котором на расстоянии 1 м от его лица располагался монитор компьютера. Предплечья и кисти испытуемого лежали на столе. Перед началом эксперимента испытуемого инструктировали: объясняли двигательные задачи и показывали символические команды, которые руководили действиями испытуемого в ходе эксперимента. Эти символические команды предъявлялись на мониторе в виде стрелок, направленных вовне от общего центра в пяти разных направлениях (рис. 1). Стрелка, направленная вверх, соответствовала состоянию покоя. Стрелки, направленные направо, соответствовали реальному (верхняя) и воображаемому (нижняя) движению правой руки. Соответственно, две стрелки, направленные налево, соответствовали реальному (верхняя) и воображаемому (нижняя) движению левой руки. Эти пять стрелок все время присутствовали на экране. Неактивные стрелки были серого цвета. Переход к выполнению очередного экспериментального условия начинался с того, что соответствующая стрелка становилась синей и оставалась таковой в течение фиксированного 5-секундного периода ожидания императивного сигнала. Императивным сигналом служила смена цвета стрелки с синего на зеленый. Выполнение задачи в каждом экспериментальном условии продолжалось 12 с. Сигналом к окончанию выполнения задачи служила смена цвета соответствующей стрелки с зеленого на серый.
Рис. 1.
Пример символической команды приступить к выполнению воображаемого движения левой рукой. Пять серых стрелок соответствуют пяти возможным символическим командам (подробности в тексте).
Fig. 1. An example of a symbolic command to proceed with an imaginary movement with the left hand. Five gray arrows correspond to five possible symbolic commands (details in the text).

Предварительная обработка сигналов ЭЭГ и ЭМГ. Сигналы ЭЭГ и ЭМГ подвергались предварительной обработке. Для удаления сетевой наводки 50 Гц использовался режекторный фильтр. Кроме того, исходные сигналы подвергались частотной фильтрации: многоканальная ЭЭГ обрабатывалась полосовым фильтром с граничными частотами 2 Гц и 200 Гц. К записям ЭМГ применялась процедура удаления тренда. Процедура цифровой фильтрации была двунаправленной для компенсации временной задержки каждого фильтра.
Анализ кортикомышечного взаимодействия. Для оценки эффективных связей использовалась векторная авторегрессионная модель (ВАР-модель). Эта модель связывает текущее значение сигнала в канале с предыдущими отсчетами по всем каналам модели. Значения коэффициентов ВАР-модели позволяют характеризовать относительную меру эффективной связи при помощи НПФ [Kamiński et al., 2001]. Однако эта функция зависит от соотношения масштабов сигналов в разных каналах. Поэтому в настоящей работе использовалась масштабно-инвариантная версия этой функции, предложенная в работе [Курганский, 2010] и качественно сходная с функцией направленной когерентности [Baccala et. al., 1998; Baccala, Sameshima, 2001]. Выбранная ВАР-модель включала 8 каналов: 6 ЭЭГ отведений – F1, F2, C3, C4, P5, P6 и 2 ЭМГ отведения – сгибатели на левом и правом предплечье. Данные ЭЭГ и ЭМГ делили на непрерывные неперекрывающиеся отрезки длительностью 2 с. Каждый такой отрезок с учетом частоты оцифровки содержал 1000 отсчетов. Для каждого испытуемого в каждом из пяти экспериментальных условий были выбраны безартефактные отрезки ЭЭГ. Для каждого такого отрезка была построена отдельная ВАР-модель 14-го порядка, т.е. были определены коэффициенты авторегрессии. Коэффициенты ВАР-модели использовались для вычисления направленной передаточной функции (НПФ). НПФ вычислялись для каждого двухсекундного отрезка, а затем усреднялись для каждого испытуемого по экспериментальному условию.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЙ
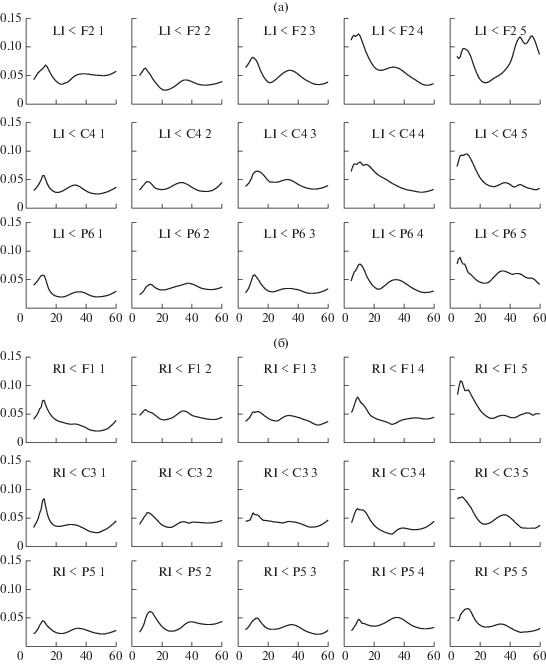
Мы построили кривые зависимости нисходящих и восходящих НПФ от частоты, усредненные по всем испытуемым, отдельно для каждого экспериментального условия (рис. 2). На большинстве этих кривых видны два максимума, соответствующих наиболее выраженному нисходящему, кортикомышечному влиянию. Один максимум лежит в районе 10 Гц и является более острым. Другой, более широкий и пологий максимум, находится в районе 35–40 Гц. Аналогичные кривые для восходящего влияния ЭМГ на ЭЭГ показали сходную, хотя и менее выраженную картину. Соответственно, для дальнейшего анализа мы выбрали две частотные полосы, охватывающие эти максимумы: одну в альфа-диапазоне (6–12 Гц), а другую – в низкочастотном гамма-диапазоне (30–60 Гц). Значения НПФ усреднили по выбранным частотным диапазонам и, таким образом, для каждого экспериментального условия, для каждого частотного диапазона и для каждой пары ЭЭГ- и ЭМГ-отведений получили два индивидуальных средних значения НПФ, соответствующих двум противоположным направлениям функции: от коры к мышцам и от мышц к коре.
Рис. 2.
Графики средней по группе направленной передаточной функции (НПФ), показывающей влияние ЭЭГ-каналов одного полушария (F1/2, C3/4, P5/6) на контралатеральный ЭМГ-канал (Li, Ri) для правого полушария и левой руки (а); для левого полушария и правой руки (б). Графики организованы в виде прямоугольной таблицы, в которой строки соответствуют влиянию ЭЭГ канала (F1/2, C3/4, P5/6) на ЭМГ-канал, а столбцы – пяти экспериментальным условиям (1 – ПО, 2 – ВЛ, 3 – ВП, 4 – ДЛ, 5 – ДП). На каждом графике (в каждой ячейке таблицы) по оси абсцисс показаны частоты в Гц, а по оси ординат – значения НПФ. Легенда над графиком показывает (слева направо) название миографического канала, название влияющего ЭЭГ-канала, номер экспериментального условия.
Fig. 2. Graphs of the group-average Directed Transfer Function (DTF) showing the effect of EEG channels of one hemisphere (F1/2, C3/4, P5/6) on the contralateral EMG channel (Li, Ri) for the right hemisphere and left arm (a); for the left hemisphere and right arm (б). The graphs are organized in the form of a rectangular table, in which the rows correspond to the influence of the EEG channel (F1/2, C3/4, P5/6) on the EMG channel, and the columns correspond to five experimental conditions (1 – rest with open eyes (RO), 2 – imaginary quick repeated opening of the left hand (IL), 3 – imaginary quick repeated opening of the right hand (IR), 4 – fast repeated opening of the left hand (ML) and 5 – fast repeated opening of the right hand (MR)). On each graph (in each cell of the table), the frequencies in the Hz are shown along the abscissa axis, and the DTF values along the ordinate axis. The legend above the graph shows (from left to right) the name of the myographic channel, the name of the affecting EEG channel, the number of the experimental condition.
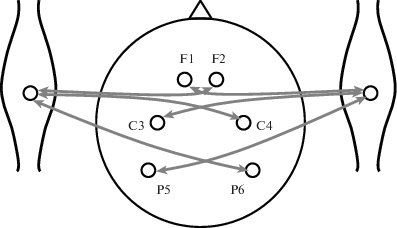
Для группового статистического анализа данных был применен дисперсионный анализ, выполненный по схеме с повторными измерениями (rmANOVA). Анализировались значения НПФ, соответствующие связям между ЭЭГ-отведениями одного полушария и ЭМГ-отведениями на контралатеральной руке (рис. 3). Внутрииндивидуальными факторами служили: экспериментальное условие (УСЛОВИЕ – 5 уровней), частотный диапазон (ДИАПАЗОН – 2 уровня: альфа и гамма), направление (НАПРАВЛЕНИЕ – 2 уровня: от кортикальных отведений к миографическим, или нисходящее влияние, и от миографических к кортикальным отведениям, или восходящее влияние), полушарие (ПОЛУШАРИЕ – 2 уровня: левое и правое) и отведение (ОТВЕДЕНИЕ – 3 уровня: F, C, P). Значимыми оказались генеральные эффекты фактора УСЛОВИЕ (F(4, 36) = 4.612, p = = 0.035), фактора ДИАПАЗОН (F(1, 9) = 27.8, p = 0.001), фактора НАПРАВЛЕНИЕ (F(1, 9) = = 9.0, p = 0.015) и фактора ОТВЕДЕНИЕ (F(2, 18) = 4.37, p = 0.045). Эффект фактора ПОЛУШАРИЕ не достигал уровня значимости (p = = 0.425).
Рис. 3.
Эффективные двунаправленные связи ЭЭГ-каналов и ЭМГ-канала на контралатеральной руке.
Fig. 3. Effective bidirectional connections of the EEG channels and the EMG channel on the contralateral arm.
Эффект фактора УСЛОВИЕ заключается в том, что при выполнении реального движения НПФ в среднем (для всех пар отведений, в обоих частотных диапазонах и в обоих направлениях) заметно выше (0.050 для правой и 0.047 для левой руки), чем в покое (0.036) или при воображаемом движении (0.035 для правой и 0.037 для левой руки). Это различие достигает значимости в следующих случаях: в альфа-диапазоне влияние от левого париетального отведения к правой руке (p = 0.049) и влияние от правого фронтального отведения к левой руке (p = 0.026) при реальном движении выше, чем в покое. В гамма-диапазоне доля влияния от левого фронтального отведения к правой руке была как при реальном движении (p = 0.029), так и при воображаемом движении (p = 0.004) выше, чем в покое.
Эффект фактора ДИАПАЗОН отражает тот факт, что НПФ в альфа-диапазоне (0.052) в среднем выше, чем в гамма-диапазоне (0.030). Детальное исследование парных сравнений показало, что все индивидуальные НПФ больше в альфа-диапазоне, чем в гамма-диапазоне.
Эффект фактора НАПРАВЛЕНИЕ отражает асимметрию силы эффективных связей между корой и мышцами: нисходящее влияние ЭЭГ на ЭМГ (0.048) в среднем выше, чем восходящее влияние ЭМГ на ЭЭГ (0.034). Интересно, что при индивидуальном парном сравнении этот эффект превышения величины нисходящего влияния над величиной восходящего достигал статистической значимости для пар отведений, включавших фронтальное и теменное отведения правого полушария и миографическое отведение на левой руке. В альфа-диапазоне этот эффект достигается для правого фронтального отведения и левой руки при реальном движении (р = 0.025) и для правого теменного и левой руки при воображаемом движении. В гамма-диапазоне нисходящее влияние от правого фронтального (р = 0.036) и правого теменного (р = 0.045) отведений, направленное к левой руке, значимо больше при воображаемом движении.
Наконец, эффект фактора ОТВЕДЕНИЕ обусловлен тем, что значения НПФ в парах отведений ЭЭГ-ЭМГ, где участвуют фронтальные отведения (0.045), в среднем больше, чем в парах с участием центральных отведений (0.040), а НПФ в последних, в свою очередь, выше, чем НПФ в парах с участием париетальных отведений (0.038). Парные сравнения не выявили четкой картины: присутствуют лишь отдельные статистически значимые парные отличия, которые, к тому же, не всегда совпадают по направлению со средним эффектом.
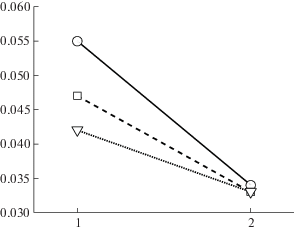
Единственным значимым двойным взаимодействием оказалось взаимодействие факторов НАПРАВЛЕНИЕ × ОТВЕДЕНИЕ (F(2, 18) = 4.26, p = 0.05). Смысл этого взаимодействия иллюстрирует рис. 4: значения нисходящих НПФ, направленных от коры к мышцам, неодинаковы для отведений F (0.055 ± ± 0.006), C (0.047 ± 0.006), P (0.042 ± 0.005), а значения восходящих НПФ практически одинаковы (F: 0.034 ± 0.003, C: 0.033 ± 0.004, P: 0.033 ± 0.004).
Рис. 4.
Значения нисходящих и восходящих НПФ, усредненные по двум частотным диапазонам. По оси абсцисс представлены направления эффективного взаимодействия: 1 – нисходящие влияния, 2 – восходящие влияния. Кружками обозначены связи, включающие фронтальные каналы ЭЭГ, квадратами – связи центральных каналов и треугольниками – связи теменных ЭЭГ-каналов.
Fig. 4. The values of the descending and ascending DTFs averaged over two frequency ranges. The directions of effective links are presented along the abscissa: 1 – descending links, 2 – ascending links. The circles indicate the connections, including the frontal EEG channels, the squares, the connections of the central channels, and the triangles, the connections of the parietal EEG channels.
Других значимых эффектов выявлено не было, однако обнаружились два двойных взаимодействия, имеющих тенденцию к значимости: ДИАПАЗОН × ОТВЕДЕНИЕ (F(2, 18) = = 3.8, p = 0.056) и ДИАПАЗОН × УСЛОВИЕ (F(4, 36) = 4.1, p = 0.053). Эти взаимодействия указывают на то, что влияние факторов ОТВЕДЕНИЕ и УСЛОВИЕ в разных частотных диапазонах может быть неодинаковым. Поэтому для каждого из диапазонов был проведен отдельный дисперсионный анализ с повторными измерениями и четырьмя внутрииндивидуальными факторами: экспериментальное условие (УСЛОВИЕ – 5 уровней), направление (НАПРАВЛЕНИЕ – 2 уровня: нисходящее и восходящее), полушарие (ПОЛУШАРИЕ – 2 уровня: левое и правое) и отведение (ОТВЕДЕНИЕ – 3 уровня: F, C, P).
В альфа-диапазоне генеральные эффекты факторов УСЛОВИЕ (F(4,36) = 6.082; p = = 0.024), НАПРАВЛЕНИЕ (F(1, 9) = 6.686; p = 0.029) и ОТВЕДЕНИЕ (F(2, 18) = 7.944; p = 0.013) оказались значимы. Нисходящие влияния, направленные от кортикальных отведений к миографическим, во всех экспериментальных условиях имеют наибольшие значения для фронтальных отведений и наименьшие для париетальных отведений (рис. 5 (а)). При этом нисходящие НПФ в покое и при воображаемом движении остаются на одном уровне, а при реальном движении принимают наибольшие значения. Восходящие влияния не демонстрируют систематических различий для разных отведений и имеют тенденцию достигать самых высоких значений в условиях реального движения (рис 5 (б)). При парных сравнениях тенденция не достигает уровня значимости.
Рис. 5.
Значения нисходящих и восходящих НПФ по каждому из частотных диапазонов. (а) – нисходящие и (б) восходящие влияния в альфа-диапазоне. (в) – нисходящие и (г) восходящие влияния в гамма-диапазоне. По оси абсцисс представлены экспериментальные условия: 1 – ПО, 2 – ВЛ, 3 – ВП, 4 – ДЛ, 5 – ДП, а по оси ординат – значения НПФ. Кружками обозначены связи, включающие фронтальные каналы ЭЭГ, квадратами – связи центральных каналов и треугольниками – связи теменных ЭЭГ-каналов.
Fig. 5. The values of the descending and ascending DTFs for each of the frequency ranges. (a) – descending and (б) ascending links in the alpha range. (в) – descending and (г) ascending links in the gamma range. The experimental conditions are presented along the abscissa axis: 1 – rest with open eyes (RO), 2 – imaginary quick repeated opening of the left hand (IL), 3 – imaginary quick repeated opening of the right hand (IR), 4 – fast repeated opening of the left hand (ML) and 5 – fast repeated opening of the right hand (MR), and along the ordinate axis – DTF values. The circles indicate the connections, including the frontal EEG channels, the squares, the connections of the central channels, and the triangles, the connections of the parietal EEG channels.
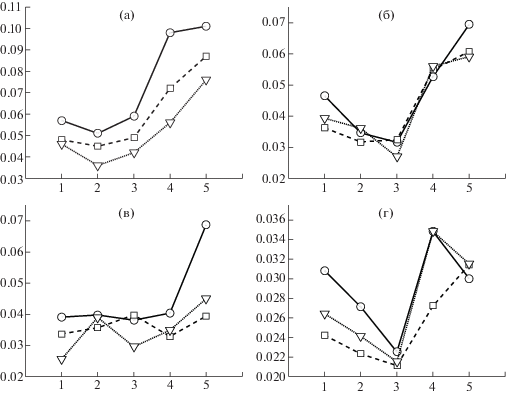
В гамма-диапазоне получен единственный значимый генеральный эффект фактора НАПРАВЛЕНИЕ (рис 5 (в) и (г)). (F(1, 9) = 7.726, p = 0.021): нисходящие НПФ значимо выше (0.039 ± 0.004), чем восходящие (0.027 ± 0.003). Других значимых эффектов для гамма-диапазона не выявлено.
Одной из задач настоящего исследования было оценить влияние воображаемого движения. Для этого мы применили дисперсионный анализ с повторными измерениями к нисходящим влияниям отдельно для фронтальных, центральных и теменных отведений. Поскольку нас интересовало влияние именно воображаемого движения, мы включили в анализ только три экспериментальных условия: покой и два условия, соответствующие воображаемому движению левой и правой рукой. Таким образом, факторами в этом дисперсионном анализе служили УСЛОВИЕ (3 уровня – покой, воображаемое движение левой рукой, воображаемое движение правой рукой) и ПОЛУШАРИЕ (2 уровня). Единственное значимое изменение нисходящего влияния при переходе от покоя к воображаемому движению было получено в гамма-диапазоне для нисходящего влияния, направленного от теменных отведений к контралатеральной руке (рис 5 (в)). (F(2, 18) = 4.051, p = 0.035). НПФ в условии воображаемого движения левой рукой заметно выше, чем в условии покоя как для правой, так и для левой руки (правая: 0.027 против 0.038, левая: 0.024 против 0.04).
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
В настоящем исследовании в условиях покоя с открытыми глазами, воображаемого и реального ритмически повторяющегося раскрытия-закрытия кисти руки, наблюдалось взаимодействие между мышцами руки и контралатеральными областями коры мозга во фронтальном, центральном и париетальном отделах. Обмен сигналами зарегистрирован в альфа- и гамма- частотных диапазонах. Исследования кортикомышечного взаимодействия с помощью функции когерентности показывают, что обычно выполнение двигательных задач сопровождается ее ростом, причем разным задачам соответствует рост когерентности в разных частотных диапазонах [Budini et al., 2014; Pfurtcheller et al., 2006; Grosse et al., 2002; Reyes et al., 2017; Halliday et al., 1998; Omlor et al., 1998].
Основные значимые эффекты, полученные в выполненном в настоящей работе дисперсионном анализе, отражают различия в величине НПФ в альфа-диапазоне. При выполнении реального движения кортикомышечное взаимодействие в этом диапазоне усиливается, причем возрастает как нисходящее, так и восходящее влияние. При переходе от покоя к воображаемому движению нисходящее и восходящее влияния вели себя по-разному: не наблюдалось существенного изменения нисходящего влияния, но восходящее влияние мышечной активности на активность в рассматриваемых кортикальных областях при этом имело тенденцию к снижению (рис 5 (б)).
Наличие кортикомышечного взаимодействия в альфа-диапазоне частот согласуется с данными по кортикомышечной когерентности при движении и в покое [Grosse et al., 2002; Budini et. al., 2014]. В состоянии покоя в центральных энцефалографических отведениях, которые расположены над первичными областями соматосенсорной и двигательной коры, на частоте, близкой к 10 Гц, наблюдается мю-ритм. При движениях, как реальных, так и воображаемых, наступает десинхронизация этого ритма [Pfurtcheller et al., 2006].
Поскольку была обнаружена значимая когерентность между ЭМГ-активностью мышц руки и ЭЭГ-активностями от контралатеральных центральных и центрально-париетальных отведений, соответствующих сенсомоторным отделам мозга, то считается, что за кортикомышечное взаимодействие на этой частоте отвечает именно мю-ритм [Pfurtcheller et al., 2006].
Нисходящие влияния в данном частотном диапазоне могут быть связаны с эфферентными и модулирующими сигналами, идущими от коры к сегментарным структурам спинного мозга при поддержании позы (в покое и при воображаемом движении) и необходимыми для выполнения движений.
По нашим данным, кортикомышечное влияние на частоте альфа-диапазона является двунаправленным, т.е. присутствует как нисходящее воздействие мозговой активности на мышечную активность, так и обратное, восходящее влияние мышечной активности на мозговую. Мышечная активность на частоте около 10 Гц является физиологическим тремором, присутствие которого не зависит от состояния движения [Grosse et al., 2002]. Можно предположить, что источником восходящего влияния в этом частотном диапазоне может быть сенсорный сигнал, возникающий в мышечных рецепторах за счет физиологического тремора в руке, частота которого как раз лежит в диапазоне от 8 до 12 Гц [Лихачев и др., 2010].
В ряде работ пик кортикомышечной когерентности обнаружен в бета-диапазоне частот (15–30 Гц) [Reyes et al., 2017; Halliday et al., 1998; Li et al., 2004]. Высокая кортикомышечная когерентность в бета-диапазоне наблюдается при поддержании стационарной позы [Halliday et al., 1998] и при поддержании изометрического мышечного усилия [Omlor et al., 1998; Reyes et al., 2017]. В частности, высокая кортикомышечная когерентность в этом диапазоне была зарегистрирована при удержании запястья в согнутом или разогнутом положении [Halliday et al., 1998] и при поддержании мышечного усилия сгибателя указательного пальца правой руки на постоянном уровне [Omlor et al., 1998]. Аналогичная картина наблюдалась и в другой работе, где при удержании пружины при помощи большого и указательного пальцев требовалось поддерживать фиксированное усилие и апертуру [Li et al., 2004]. Особенность этой задачи состояла в том, что чем мягче была пружина, тем большая точность требовалась, и именно в этих условиях (при наиболее мягкой пружине) кортикомышечная когерентность в диапазоне частот 15–30 Гц была максимальной. Интересно, что во время перехода от одного стационарного усилия к другому когерентность в диапазоне частот 15–30 Гц уменьшалась до незначимых величин.
Между тем, в наших данных мы не видим выраженного максимума взаимодействия между мышцами и корой в бета-диапазоне (15–30 Гц). Скорее всего, это несоответствие связано с характером двигательной задачи, использованной в настоящем исследовании. Действительно, об этом говорят результаты экспериментального исследования [Omlor et al., 2007]. В этом исследовании к указательному пальцу испытуемого прикладывалось некоторое усилие. Требовалось удерживать палец, оказывая сопротивление, равное приложенной внешней силе. На мониторе испытуемый видел, насколько точно развиваемое им усилие соответствует приложенному. Пока внешняя сила была постоянной, наблюдалась высокая кортикомышечная когерентность в бета-диапазоне. Однако, как только прикладывалась переменная внешняя сила, изменяющаяся по синусоидальному закону, когерентность в бета-диапазоне снижалась, зато повышалась в гамма-диапазоне [Halliday et al., 1998]. Таким образом, в динамическом режиме, т.е. при движении или при изменении мышечного усилия, кортикомышечное взаимодействие проявляется в росте когерентности в гамма-диапазоне (30–45 Гц) [Omlor et al., 1998]. Предполагается, что возросшая когерентность может отражать обмен большими объемами информации, необходимой при решении динамической задачи [Omlor et al., 1998]. В нашем исследовании ритмическое раскрытие и закрытие ладони, выполняемое испытуемыми, не включало периодов поддержания стационарного мышечного усилия или постоянной позы, т.е. задача была динамической, а не статической. Поэтому неудивительно, что в нашем случае НПФ в низкочастотном (30–60 Гц) гамма-диапазоне оказалась выше, чем в бета-диапазоне, в полном соответствии с данными работы [Omlor et al., 1998]. Примечательно, что по нашим данным такое соотношение между НПФ в бета- и гамма-диапазонах характерно не только для реального, но и для мысленного выполнения динамической задачи, хотя последнему соответствует статическая поза.
В настоящей работе в гамма-диапазоне частот обнаружено превышение уровня нисходящего влияния над восходящим. Действие остальных факторов обнаруживается лишь на уровне тенденций; тем не менее, некоторые из них заслуживают упоминания. Так, отличительной особенностью нисходящего кортико-мышечного влияния в этом диапазоне является некоторый его рост при переходе от покоя к воображаемому движению (рис. 5 (в)). При этом при дальнейшем переходе к реальному движению нисходящее влияние остается на прежнем уровне. Кроме того, в гамма-диапазоне, так же, как это имело место в альфа-диапазоне, сила восходящего влияния при воображаемом движении снижается по сравнению с покоем (рис. 5 (б), (г)). Такое снижение можно было бы объяснить дополнительной (по сравнению с покоем) блокировкой испытуемым возможных движений конечности, что выражается в уменьшении потока реафферентации, и, соответственно, меньшим влиянием мышечной активности на мозг. В этом случае следует ожидать снижения амплитуды ЭМГ при воображении движения сравнительно с покоем. Однако отсутствие снижения амплитуды ЭМГ не означает, что такое объяснение следует отвергнуть. Уменьшение восходящего влияния может быть результатом блокировки каналов поступления реафферентного сигнала в головной мозг: при этом влияние этого сигнала на кортикальную активность уменьшится без изменения мышечной активности. Еще одной причиной снижения восходящего влияния может быть возрастание кортико-кортикальных влияний без какого-либо изменения сигнала, поступающего с мышечной периферии в кору: НПФ характеризует не абсолютное, а относительное влияние. НПФ – это нормированная мера, показывающая долю влияния по отношению к влиянию всех остальных участников ВАР-модели. Для того чтобы выяснить, какая из перечисленных причин вызвала снижение восходящего влияния, потребуется дополнительное исследование.
Основное внимание в работах по кортикомышечному взаимодействию уделяется взаимодействию мышц с центральными отделами коры, где располагаются первичные моторные и сенсорные области мозга [Gross et al., 2000]. Между тем часть кортико-спинальных путей берет начало в премоторных областях [R.P.Dum, Strick, 1991; Jeannerod, 2001; R.P. Dum, Strick, 2005; Verstynen et. al., 2011]. Каждая из этих областей имеет прямой доступ к спинному мозгу и потенциально может оказывать влияние на мотонейроны независимо от первичной моторной коры. При этом, наряду с центральными и фронтальными отделами коры, в управление движением вовлекаются также и теменные отделы, как на этапе подготовки к движению, так и на этапе контроля за выполнением движения [Desmurget, Sirigu, 2009]. В силу сходства мысленного движения с процессами, протекающими в латентных фазах движения, такими как моторное планирование, особый интерес для нашей работы представляют данные по кортикальной организации латентных фаз реального движения. Так, в работе [Desmurget, Sirigu, 2009] показано, что за 1–1.5 с до начала движения активируется распределенная сеть, включающая заднюю теменную кору (posterior parietal cortex, PPC), переднюю поясную кору (anterior cingulate cortex, АСС), дополнительную моторную область (supplementary motor area, SMA) и дорсолатеральную префронтальную кору (dorsolateral prefrontal cortex, DLPFC). Инициация произвольного движения начинается с неосознаваемой активации в префронтальных регионах коры. Активация префронтальных областей ведет к активации репрезентаций движения в PPC. В свою очередь SMA, по-видимому, является источником латерализованного потенциала готовности (lateralized readiness potential, LRP). LRP возникает в среднем за 800 мс до начала движения. Электрическая стимуляция SMA вызывает осознанную интенцию выполнить вполне определенное движение, используя определенную конечность – поднять правый локоть, отставить левую ногу в сторону и т.д. Увеличение интенсивности стимуляции вызывает реальное движение. Считается, что SMA запускает движение, подавляя тормозящий сигнал, направленный к первичным моторным областям коры (M1). Прямая электрическая стимуляция премоторной коры (premotor cortex, PMC) вызывала в эксперименте M. Desmurget [Desmurget, Sirigu, 2009] открывание рта и движения контралатеральных конечностей. Однако в отсутствие зрительной обратной связи испытуемый уверенно отрицал, что совершал движения. Стимулирование задней теменной коры (PPC), которое, как мы помним, отвечало за намерение совершить конкретное движение, при повышении интенсивности стимуляции приводило к тому, что испытуемые утверждали, что совершили движение, которое намеревались сделать. При этом не наблюдалось ни реального движения, ни роста миографической активности. Это позволило [Desmurget, Sirigu, 2009] предположить, что PPC отвечает не только за формирование осознанного намерения совершить конкретное движение и за инициацию этого движения. PPC также отвечает за предсказание сенсорных последствий инициируемого движения, которое наступает до появления сенсорной обратной связи [Desmurget, Sirigu, 2009]. Такое предсказание сенсорных последствий еще не выполненного движения может быть интерпретировано как один из аспектов воображаемого движения. В обзоре [Мокиенко и др., 2013] приводятся данные по структурам мозга, которые активируются во время мысленного представления движений. Воображаемое движение сопровождается активацией премоторной коры (PMC), дополнительной моторной области (SMA), задней теменной коры (PPC), цингулярной коры, базальных ганглиев и мозжечка. Активация первичной моторной коры во время воображаемого движения происходит не всегда [Столбков и др., 2014] и, возможно, зависит от характера моторной задачи и от индивидуальной стратегии ментального выполнения движения. Обращает на себя внимание совпадение областей, отвечающих за воображаемое движение, областей, активация которых происходит при подготовке к движению, а также областей, активирующихся при осознании факта совершения движения. Поэтому при исследовании воображаемого движения, так же как и реального движения, представляет интерес взаимодействие миографического сигнала с сигналами ЭЭГ от всех областей коры, участвующих в управлении движением, а именно с сигналами, полученными при центральных, фронтальных и теменных отведениях.
Если рассмотреть полученную в данной работе зависимость силы нисходящего кортико-мышечного влияния от положения энцефалографического отведения на скальпе в альфа-диапазоне, то обнаружится любопытный факт: это влияние возрастает в заднепереднем направлении во всех экспериментальных условиях, принимая наибольшие значения во фронтальных отведениях, промежуточные в центральных и наименьшие в теменных отведениях (рис. 5 (а)). Высокая, даже в такой небольшой выборке как наша, значимость эффекта возрастания НПФ, описывающей влияние коры на мышцы в ряду P5/6, C3/4 и F1/2, говорит о том, что величины различий существенно превышают как индивидуальный разброс, так и ошибки измерения. Это свидетельствует, что мы имеем дело с каким-то базовым эффектом, не зависящим ни от состояния движения, ни от индивидуальных стратегий.
Сам факт влияния фронтальных каналов на миографические не удивителен: известно, что электрическая стимуляция не только моторной, но и премоторной коры вызывает координированные движения рук [Graziano et al., 2002]. Кроме того, влияние фронтальных областей в покое и при воображаемом движении можно объяснить модулирующим воздействием премоторных регионов на выходной сигнал первичной моторной коры, которое было обнаружено в работах Côté и соавт. [Côté et al., 2017]. В экспериментальной работе [Côté et al., 2017] было показано, что стимуляция премоторной дорзальной области (которая как раз соответствует положению электродов F1/2) оказывала преимущественно тормозящее влияние на выходной сигнал от М1. В этой работе рассматривались две конкурирующие гипотезы: модулирующее влияние может реализовываться при помощи горизонтальных связей, за счет торможения нейронов М1, либо модулирующее влияние может осуществляться за счет проекций из премоторной области на мотонейроны в спинном мозге. С учетом данных настоящей работы, предположение о тормозном влиянии премоторной зоны на М1 представляется более правдоподобным, так как в случае модулирующего влияния премоторной области на мотонейроны в спинном мозге можно было бы ожидать систематических различий в величине восходящей НПФ в зависимости от отведения. Таких различий в нашей работе обнаружено не было.
Удивительным и неожиданным для нас оказалось, что в ВАР-модели самым сильным влиянием на миографические каналы оказалось влияние каналов F1/2, а не центральных каналов С3/4. Причем превалирование нисходящего влияния от F1/2 сохранялось и при реальном движении, когда, казалось бы, роль первичной моторной коры должна быть основной. Отчасти это можно связать с тем, что управляющее влияние первичной моторной коры на мотонейроны при ритмических движениях носит фазический характер, в отличие от тонического модулирующего влияния на них премоторной коры. Однако тот факт, что максимальное влияние на миографические каналы оказывают каналы F1/2, а не C3/4, еще не означает, что влияние активности премоторной коры на мышечную активность больше, чем влияние на нее моторной коры. Действительно, доля нисходящего сигнала от M1 к мышцам в каналах С3/4 может быть меньше, чем доля нисходящего сигнала в каналах F1/2, просто за счет различий между моторной и премоторной корой в площади и геометрии. Площадь дорзальной премоторной коры больше, чем площадь М1, к тому же значительная часть М1 – 4-го поля по Бродманну – находится на боковой стенке центральной борозды, и активность от клеток с дендритными деревьями, параллельными поверхности скальпа, дает меньший вклад в ЭЭГ-сигнал, чем ориентированные перпендикулярно скальпу клетки премоторной коры.
ЗАКЛЮЧЕНИЕ
Выполненное в настоящей работе систематическое сравнение нисходящих и восходящих кортикомышечных влияний показало следующую картину.
В обоих исследованных частотных диапазонах, и в альфа- и в гамма-, нисходящее влияние оказалось значительно больше восходящего влияния.
В альфа-диапазоне, как в покое, так и при реальном или воображаемом движении, максимальные нисходящие кортикомышечные влияния оказывают фронтальные, т.е. премоторные отделы коры. Нисходящее влияние от моторных областей несколько ниже, чем от премоторных, а влияние постцентральных ниже, чем от моторных.
Нисходящие кортикомышечные влияния в альфа- и гамма-частотных диапазонах обеспечивают разные аспекты управления движением.
Данные работы показывают, что нисходящие кортикомышечные воздействия в альфа-диапазоне от фронтальных, центральных и париетальных отделов обслуживают выполнение реального движения, но не воображение движения, поскольку эти влияния возрастают по сравнению с покоем при выполнении реального движения, а при воображаемом движении величины этих влияний не отличимы от покоя.
Нисходящее кортикомышечное влияние от левого фронтального региона коры в гамма-диапазоне активизируется при выполнении как реального, так и воображаемого ритмически повторяющегося движения.
Восходящие кортикомышечные влияния как в альфа-, так и в гамма-диапазоне снижаются при выполнении воображаемых ритмически повторяющихся движений. Поток мышечной реафферентации таким образом блокируется, и афферентный сигнал от неподвижной конечности не вступает в противоречие с воображаемым движением.
В дальнейшем представляется целесообразным применение эффективных (направленных) мер к исследованию кортикомышечного взаимодействия при воображаемом движении у пациентов с нарушением движения сосудистого или травматического характера. Такое исследование может служить для повышения эффективности восстановительного обучения пациентов с использованием интерфейса мозг-компьютер на основе воображаемого движения.
Исследование поддержано грантом РФФИ 20-015-00370 и грантом Министерства науки и высшего образования Российской Федерации RFMEFI60519X0184.
Список литературы
Курганский А.В. Некоторые вопросы исследования кортико-кортикальных функциональных связей с помощью векторной авторегрессионной модели многоканальной ЭЭГ. Журн. высш. нервн. деят. им. И.П. Павлова. 2010. 60 (5). 630–649.
Лихачев С.А., Ващилин В.В., Дик С.К. Тремор: феноменология и способы регистрации. Медицинский журнал. 2010. № 2: 133–137.
Мокиенко О.А., Черникова Л.А., Фролов А.А., Бобров П.Д. Воображение движения и его практическое применение. Журн. высш. нервн. деят. им. И.П. Павлова. 2013. 63 (2): 195–204.
Столбков Ю.К., Мошонкина Т.Р., Орлов И.В., Козловская И.Б., Герасименко Ю.П. Воображаемые движения как средство совершенствования и реабилитации моторных функций. Успехи физиологических наук. 2018. 49 (2): 45–59.
Фролов А.А., Азиатская Г.А., Бобров П.Д., Люкманов Р.Х., Федотова И.Р., Гусек Д., Снашел В. Электрофизиологическая активность мозга при управлении интерфейсом мозг компьютер, основанным на воображении движений. Физиология человека. 2017. 43 (5): 17–28.
Baccala L.A., Sameshima K. Partial directed coherence: a new concept in neural structure determination. Biol. Cybern. 2001. 84: 463–474.
Baccala L.A., Sameshima K., Ballester G., Do Valle A.C., Timo-Iaria C. Studying the Interaction Between Brain Structures via Directed Coherence and Granger Causality. Applied Sig Process 1998. 5: 40–48.
Batula A.M., Mark J.A., Kim Y.E., Ayaz H. Comparison of Brain Activation during Motor Imagery and Motor Movement Using fNIRS. Computational Intelligence and Neuroscience. 2017. 2017: 5491296.
Budini F., McManus L.M., Berchicci M., Menotti F., Macaluso A. Alpha Band Cortico-Muscular Coherence Occurs in Healthy Individuals during Mechanically-Induced Tremor. PloS ONE 2014. 9 (12): e115012.
Côté S.L., Hamadjida X.A., Quessy X.S., Dancause X.N. Contrasting Modulatory Effects from the Dorsal and Ventral Premotor Cortex on Primary Motor Cortex Outputs. The Journal of Neuroscience. 2017. 37 (24): 5960–5973.
Demougeot L., Normand H., Denise P., Papaxanthis C. Discrete and Effortful Imagined Movements Do Not Specifically Activate the Autonomic Nervous System. 2009. PLoS ONE 4 (8): e6769. https://doi.org/10.1371/journal.pone.0006769
Desmurget M., Reilly K.T., Richard N., Szathmari A., Mottolese C., Sirigu A. Movement intention after parietal cortex stimulation in humans. Science. 2009: 811–813.
Desmurget M., Sirigu A. A parietal-premotor network for movement intention and motor awareness. Trends in Cognitive Sciences. 2009. 13 (10): 411–419.
Dum R.P., Strick P.L. The Origin of Corticospinal Projections from the Premotor Areas in the Frontal Lobe. The Journal of Neuroscience. 1991. 77 (3): 667–669.
Dum R.P., Strick P.L. Frontal Lobe Inputs to the Digit Representations of the Motor Areas on the Lateral Surface of the Hemisphere. The Journal of Neuroscience. 2005. 25 (6): 1375–1386.
Farina D., Merletti R., Enoka R.M. The extraction of neural strategies from the surface. 2004. EMG J Appl Physiol. 96: 1486–1495.
Friston K.J. Functional and Effective Connectivity: A Review. Brain connectivity. 2011. 1 (1): 13–36.
Graimann B., Allison B., Pfurtcheller G. Brain-computer interfaces: a gentle introduction. Brain-computer interfaces, part of the series. The frontiers collection. Berlin Heidelberg. Springer. 2009. 1–27.
Graziano M.S.A., Taylor C.S.R., Moore T., Cooke D.F. The Cortical Control of Movement Revisited. Neuron. 2002. 36: 349–362.
Gross J., Tass P.A., Salenius S., Hari R., Freund H.J., Schnitzler A. Cortico-muscular synchronization during isometric muscle contraction in humans as revealed by magnetoencephalography. Journal of Physiology. 2000. 527 (3): 623–631.
Grosse P., Cassidy M.J., Brown P. EEG–EMG, MEG–EMG and EMG–EMG frequency analysis: physiological principles and clinical applications. Clinical Neurophysiology. 2002. 113: 1523–1531.
Guillot A., Collet C. Contribution from neurophysiological and psychological methods to the study of motor imagery. Brain Res Brain Res Rev. 2005. 50: 387–397.
Halliday D.M., Conway B.A., Farmer S.F., Rosenberg J.R. Using electroencephalography to study functional coupling between cortical activity and electromyograms during voluntary contractions in humans. Neuroscience Letters. 1998. 241: 5–8.
Ives-Deliperi V.L., Butler J.T. Relationship Between EEG Electrode and Functional Cortex in the International 10 to 20 System. J Clin Neurophysiol. 2018. 35 (6): 504–509.
Jeannerod M. Mental Imagery In the motor Context. Neuropsychologia. 1995. 33 (I1): 1419–1432.
Jeannerod M. Neural Simulation of Action: A Unifying Mechanism for Motor Cognition. NeuroImage. 2001. 14. S103–S109.
Kamiński M., Ding M., Truccolo W.A., Bressler S.L. Evaluating causal relations in neural systems: Granger causality,directed transfer function and statistical assessment of significance. Biol. Cybern. 2001. 85: 145–157.
Kilner J.M., Baker S.N., Salenius S., Jousm aki, Hari R.V., Lemon R.N. Task-dependent modulation of 15–30 Hz coherence between rectified EMGs from human hand and forearm muscles. Journal of Physiology. 1999. 516.2: 559–570.
Kilner J.M., Baker S.N., Salenius S., Hari R., Lemon R.N. Human Cortical Muscle Coherence Is Directly Related to Specific Motor Parameters. The Journal of Neuroscience. 2000. 20 (23): 8838–8845.
Li S., Kamper D.G., Stevens J.A., Rymer W.Z. The effect of motor imagery on spinal segmental excitability. J. Neurosci. 2004. 27: 9674–9680.
De Luca C.J. The use of surface electromyography in biomechanics. J Appl Biomechanics. 1997. 13: 135–163.
Omlor W., Patino L., Hepp-Reymond M.C., Kristeva R. Gamma-range corticomuscular coherence during dynamic force output. NeuroImage. 2007. 34: 1191–1198.
Pfurtcheller G., Brunner C., Schlogl A., Lopes da Silva F.H. Mu rhythm (de)synchronization and EEG single-trial classification of different motor imagery tasks. Neuroimage. 2006. 31. 153–159.
Reyes A., Laine C.M., Kutch J.J., Valero-Cuevas F.J. Beta Band Corticomuscular Drive Reflects Muscle Coordination Strategies. Front. Comput. Neurosci. 2017. 11: 17.
Di Rienzo F., Collet C., Hoyek N., Guillot A. Impact of neurologic deficits on motor imagery: a systematic review of clinical evaluations. Neuropsychol. Rev. 2014. 24 (2): 116–147.
Sheahan H.R., Ingram J.N., Žalalytė G.M., Wolpert D.M. Imagery of movements immediately following performance allows learning of motor skills that interfere. Scientific reports. 2018. 8: 14330.
Verstynen T., Jarbo K., Pathak S., Schneider W. In Vivo Mapping of Microstructural Somatotopies in the Human Corticospinal Pathways. J Neurophysiol. 2011. 105: 336–346.
Yang Y., Dewald J.P.A., van der Helm F.C.T., Schouten A.C. Unveiling neural coupling within the sensorimotor system: directionality and nonlinearity. European Journal of Neuroscience. 2018. 48: 2407–2415.
Дополнительные материалы отсутствуют.
Инструменты
Журнал высшей нервной деятельности им. И.П. Павлова


