Журнал высшей нервной деятельности им. И.П. Павлова, 2020, T. 70, № 3, стр. 394-410
РИТМИЧЕСКАЯ АКТИВНОСТЬ ГИППОКАМПА И ЭНТОРИНАЛЬНОЙ КОРЫ НАРУШАЕТСЯ НА МОДЕЛИ КАИНАТНОЙ НЕЙРОТОКСИЧНОСТИ У КРЫС В СВОБОДНОМ ПОВЕДЕНИИ
А. Е. Мальков 1, *, Л. В. Шевкова 1, А. А. Латышкова 1, В. Ф. Кичигина 1
1 ФГБУН Институт теоретической и экспериментальной биофизики РАН
Пущино, Россия
* E-mail: malkovae@gmail.com
Поступила в редакцию 09.09.2019
После доработки 03.12.2019
Принята к публикации 16.12.2019
Аннотация
Гиппокамп и медиальная энторинальная кора (МЭК) взаимодействуют посредством двусторонних связей и играют важную роль в обработке, запоминании и воспроизведении информации. Данные, полученные на здоровых животных, указывают, что тета- и гамма-осцилляции являются критической активностью, необходимой для взаимодействия гиппокампа и МЭК при обработке сигналов. В то же время эти структуры являются одними из наиболее уязвимых областей мозга при гиперактивации, приводящей к эксайтотоксическим повреждениям и гибели нейронов. В данной работе токсичность провоцировали системным введением каиновой кислоты (КК), вызывающей развитие эпилептического статуса. У контрольных крыс с введением физиологического раствора и крыс с инъекцией КК регистрировали локальные полевые потенциалы одновременно в поле СА1 гиппокампа и МЭК во время исследовательского поведения в открытом поле. Обнаружена отчетливая выраженность тета- (4–10 Гц), медленного гамма- (25–50 Гц) и быстрого гамма-ритмов (55–100 Гц) в гиппокампе и МЭК у животных обеих групп. Перемещение контрольных животных в центр открытого поля сопровождалось повышением частоты тета-ритма и снижением частоты быстрого гамма-ритма в гиппокампе; в МЭК наблюдалось снижение мощности медленного гамма-ритма. В то же время у крыс с введением КК этого не наблюдалось. В этой группе выявлено также нарушение фазово-амплитудной модуляции активности МЭК гиппокампальным тета-ритмом: изменения такой модуляции при перемещении животных из периферических зон в центр открытого поля были значительно менее выражены, чем в контроле. Обнаружено также значительное повышение тета-когерентности между гиппокампом и МЭК при всех положениях животных в открытом поле. Изменения характеристик ритмов и гиппокампально-энторинальных взаимоотношений являются возможными биомаркерами нарушений кодирования пространственной информации и ее извлечения из памяти, наблюдаемых как следствие эпилептического статуса, часто приводящего к развитию судорожного очага в височных структурах мозга.
Гиппокамп и энторинальная кора, образующие систему навигации в мозге [Buzsáki, Moser, 2013], взаимодействуют друг с другом посредством двусторонних связей [Steward, 1976; Kloosterman et al., 2003]. Медиальная часть энторинальной коры (MЭК) так же, как и гиппокамп, содержит нейроны, активность которых зависит от положения животного в пространстве; эти две области мозга являются критическими для ориентации в окружающей обстановке и пространственной памяти [O’Keefe, 1976; O’Keefe, Nadel, 1978; Hafting et al., 2005, 2008; Steffenach et al., 2005; Buzsáki, Moser, 2013; Zheng et al., 2016; Tan et al., 2017]. Активность “пространственных” нейронов, от которых зависит способность ориентироваться на местности (“клетки места” в гиппокампе, “клетки поворота головы”, “клетки границы” и “клетки решетки” в MЭК) [O’Keefe, 1976; Moser et al., 2014], координируется и модулируется осцилляциями, или ритмами мозга [Buzsáki, Moser, 2013].
Основными типами полевой ритмической активности, генерируемой в гиппокампе и энторинальной коре, являются тета- и гамма-осцилляции. Эти ритмы наблюдаются у человека и приматов, а также у низших млекопитающих [Buzsáki, 2006]. Тета-ритм (4–12 Гц) представляет собой наиболее высокоамплитудные синусоидальные полевые потенциалы, регистрируемые во время исследовательского поведения (в частности, когда наблюдается обнюхивание), а также во время парадоксального сна [Green, Arduini, 1952; Vanderwolf, 1969; Livanov et al., 1977; Bland, 1986; Vinogradova, 1995; Виноградова и др., 2000; Buzsáki, 2002; Colgin, 2013]. Гамма-осцилляции (25–100 Гц), обычно регистрируемые одновременно с тета-ритмом в гиппокампе и неокортексе, наиболее отчетливы при выполнении когнитивных задач [Bouyer et al., 1981; Bragin et al., 1995; Strogatz, 2003; Montgomery et al., 2008; Benhenane 2010].
Механизмы генерации тета- и гамма-ритмов различаются. В литературе сложилось мнение, что тета-ритм, хотя генерируется в гиппокампе, зависит от септального и энторинального входов [Petsche, Stumpf, 1962; Stumpf et al., 1962; Vinogradova, 1995; Buzsáki, 2002, 2006], в то время как гамма-ритм имеет внутригиппокампальное происхождение и не зависит от афферентных путей, возникая как результат локальных межнейронных взаимодействий [Buzsáki, Wang 2012; Buzsáki, 2015]. При этом предполагается, что механизмы формирования медленных (25–50 Гц) и быстрых гамма-осцилляций (55–100 Гц) различаются участием разных типов гиппокампальных интернейронов и разных модулирующих входов в гиппокамп [Sutherland et al., 1983; Brun et al., 2002; Steffenach et al., 2002; Bastos et al., 2007; Belluscio et al., 2012; Kemere et al., 2013; Schomburg et al., 2014; Colgin, 2015]. Тета- и гамма-ритмы, необходимые для осуществления многих когнитивных процессов, выполняют в этом аспекте различные функции. Считается, что тета-ритм важен для активного приема и обработки новых сенсорных сигналов и выполняет их селекцию при сравнении с хранящейся в системе памяти информацией [Vinogradova, 1995, 2001; Buzsaki, 2006; Colgin, 2013]; предполагается также, что тета-ритм является критическим механизмом для связывания различных атрибутов события в единое контекстное представление, как у человека [Fell et al., 2001; Lega et al., 2012; Fell, Axmacher, 2011], так и у грызунов [Inostroza et al., 2013]. Главная функция гамма-ритма состоит в выборе значимых стимулов [Fries, 2009].
Внешние или внутренние события могут приводить к синхронизации ритмов, генерируемых в разных областях мозга, и формированию более сложного функционального явления, известного как фазовое сцепление (“phase coupling”), или фазовая когерентность [Fell et al., 2008; Cavanagh et al., 2009; Canolty, Knight, 2010]. Стандартная фазовая когерентность выявляет относительное постоянство фазовых различий между двумя осцилляциями одной и той же частоты, регистрируемых в разных областях, т.е. внутричастотную когерентность [Rodriguez еt al., 1999; Hurtado et al., 2004]. Было показано, что фазовая когерентность отражает различные когнитивные процессы у людей [Canolty et al., 2006; Axmacher et al., 2010], обезьян [Canolty et al., 2010), крыс [Montgomery et al., 2008; Tort et al., 2008, 2009; Nàcher et al., 2013], и мышей [Wulff et al., 2009].
Накопление данных, полученных на здоровых животных, указывает, что тета- и гамма-осцилляции являются основной активностью, необходимой для взаимодействия гиппокампа и МЭК при обработке информации, в частности, пространственной. В то же время эти структуры уязвимы при нейродегенеративных заболеваниях. Механизмы возникновения многих из них до конца не выяснены, вследствие чего они трудно излечимы. Каковы характеристики ритмической активности в этих структурах у животных в свободном поведении, и как взаимодействуют эти две области мозга в норме и в условиях нейродегенеративной патологии, – эти вопросы остаются малоизученными.
Используя модель каинатной нейротоксичности [Hellier et al., 1998; Bragin et al., 1999] и регистрируя локальные полевые потенциалы (ЛПП) одновременно в гиппокампе и МЭК во время исследовательского поведения крыс в открытом поле, мы получили новые данные о нарушениях тета- и гамма-осцилляций в височных структурах мозга при нейродегенеративной патологии.
МЕТОДИКА
Исследование проводилось в соответствии с этическими принципами, сформулированными в Хельсинкской декларации по уходу и использованию лабораторных животных и Регламентом Европейского парламента (86/609/ЕС).
Животные и хирургические операции. Эксперименты проводились на молодых взрослых крысах аутбредной линии Вистар (самцы, 150–250 г, n = 12), полученных в Центре экспериментальных животных Института теоретической и экспериментальной биофизики РАН (Пущино, Россия). Животных содержали по двое в контролируемых условиях (22–24°C, 12 ч цикл свет/темнота) с пищей и водой ad libitum. Их случайным образом распределяли на экспериментальную (“каинатную”) и контрольную группы. Животные в “каинатной” группе (n = 6) подвергались системным инъекциям каиновой кислоты (КК, 5 мг/кг, внутрибрюшинно) для вызова эпилептического статуса. Контрольным крысам (тот же вес и возраст, n = 6) инъецировали физиологический раствор аналогичным образом. Для характеристики эпилептического статуса применялась шкала Расина (Racine, 1972); стадии 4–5 (тонико-клонические припадки, круговые движения с потерей позы и падением) и длящиеся не менее 1.5 ч, определялись как развитие эпилептического статуса. Если спустя 2 эпилептический статус не прекращался, крысам (n = 2) внутримышечно вводили диазепам. Перед началом экспериментов животных подвергали хирургической операции под общей анестезией (30 мг/кг золетила и 12 мг/кг ксилазина, внутримышечно) в стереотаксическом аппарате (Kopf Instruments). Температуру тела поддерживали с помощью электрогрелки, а сердечно-легочное состояние контролировали во время операции с помощью пульсового оксиметра (Oxy9Vet Plus, Bionet, Южная Корея). Глубинные регистрирующие электроды (изолированный нихром, диаметр 0.05 мм) имплантировали с использованием атласа мозга [Paxinos, Watson, 1998] в гиппокамп (поле CA1: AP = –3,8, ML = 2, DV = 3) и медиальную энторинальную кору, слой III (MЭК: AP = –8.5, ML = 4,5, DV = 6). Референтный электрод ввинчивали в затылочную кость над мозжечком. Весь комплекс фиксировали на голове акриловым цементом. Затем в течение недели животные восстанавливались после операции и приучались к экспериментальной обстановке.
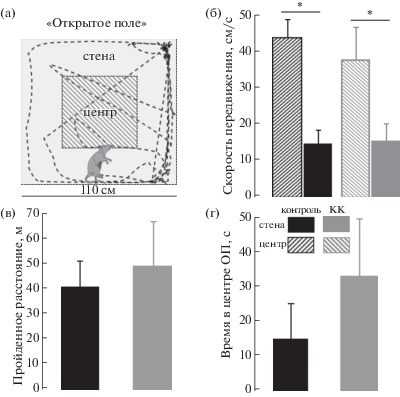
Поведение в открытом поле. Аппарат (“открытое поле”) представлял собой квадратную слабо освещенную площадку (110 × 110 × × 60 см); посторонние звуки маскировались генератором белого шума. Крыс всегда помещали в центр поля и их передвижение по арене контролировали посредством видеокамеры, расположенной на 180 см выше центра площадки, с помощью компьютерной системы слежения (Ethovision 1.90, Noldus IT). После ручного общения с животными их знакомили с новой обстановкой (“открытое поле”) в течение одного десятиминутного сеанса в день, три дня. Обычно в течение этих сессий животные почти не выходили в центр поля, что оценивалось как следствие стресса. Затем после трех пропущенных дней следующий десятиминутный сеанс рассматривали как тестовый. Были определены две зоны интереса: центральная зона (1/4 от площади открытого поля) и периферийные зоны (стены и углы между стенами, 3/4 от всей площади). В этих зонах отдельно автоматически определялась двигательная активность (рис. 1 (а)). В то время, когда животные исследовали площадку, параллельно с видеозаписью регистрировали локальные полевые потенциалы (ЛПП) в поле СА1 гиппокампа и МЭК. После каждого сеанса аппарат очищали 10% этанолом.
Рис. 1.
Параметры движения животных в открытом поле. (а) Схема разметки “открытого поля” и пример трека животного. (б) Средняя скорость передвижения животных в различных зонах открытого поля, параметр в центре – столбцы с диагональной штриховкой, параметр на периферии – столбцы со сплошной заливкой. (в) Расстояние, пройденное крысой за все время эксперимента (10 мин). (г) Суммарное время нахождения животного в центре открытого поля (ОП).
Fig. 1. The parameters of the movement of animals in the open field. (а) Scheme for marking the “open field” and an example of an animal’s track. (б) The average speed of movement of animals in different zones of the open field, the parameter in the center – columns with diagonal hatching, the parameter at the periphery – columns with solid fill. (в) The distance traveled by the rat over the entire duration of the experiment (10 min). (г) The total time spent by the animal in the center of the open field (ОП).
Электрофизиологические регистрации и анализ. Через месяц после введения КА у крыс регистрировали локальные полевые потенциалы (ЛПП) в поле СА1 гиппокампа и МЭК; регистрацию осуществляли в одно и то же время, между 17:00 и 21:00. У животных эпилептической группы регистрацию проводили в межсудорожный период. Запись осуществлялась с использованием многоканальной беспроводной системы (Multichannel W-systems, Германия), частота дискретизации 5 кГц; в данных экспериментах использовали записи по двум каналам. После окончания экспериментов поведение животных и параметры осцилляторной активности анализировали off-line с помощью специального программного обеспечения (Ethovision 1.90 и IgorPro v.6.35). Координаты животного на видеозаписи эксперимента и текущая скорость перемещения регистрировались с частотой 4 Гц (усреднение по 6 кадрам) и сопоставлялись с локальными полевыми потенциалами. Полученные данные автоматически сегментировались на эпохи длительностью 1 с, выделялись эпизоды движения и покоя (скорость < 5 cм/с). Для анализа были использованы все эпохи, соответствующие положению животного в центре поля, и эквивалентное по соотношению эпизодов движения и покоя количество эпох, зарегистрированных на периферии. Таким образом, в контрольной группе было проанализировано 180 эпох, в группе с введением каината – 390.
Нативные записи фильтровались по выбранным диапазонам (4–10 Гц на тета-, 25–50 Гц – медленный гамма-, 55–100 Гц – быстрый гамма-ритмы). Для анализа ЛПП использовали оконное преобразование Фурье (ширина окна 1 с, смещение 250 мс). Для каждой временной точки строились гистограммы спектральной плотности, вычислялись ведущая частота в данном диапазоне (Гц), пиковая и интегральная мощности (дБ, мВ2/Гц) ритмов.
Для оценки аномальной активности высокоамплитудные события (трехкратно превышающие стандартное отклонение базового сигнала, >3*SD) с помощью цифрового фильтра выделяли из общей записи, сигналы суммировали, далее вычисляли соотношение полученного сигнала к усредненным значениям в контроле.
Анализ фазовых взаимоотношений проводили с помощью преобразования Гилберта. Для анализа фазово-амплитудной модуляции строили гистограммы распределения ритмических событий, превышающих по амплитуде фоновую активность (>3*SD) в отфильтрованном сигнале для каждого частотного диапазона относительно фазы гиппокампальной тета-волны. В качестве показателя степени фазово-амплитудной модуляции у различных групп животных использовали специальный критерий, расстояние Кульбака–Лейблера.
Для оценки когерентности двух структур строили гистограммы распределения разности фаз между гиппокампом и энторинальной корой для каждого из выбранных частотных диапазонов. Для оценки степени когерентности, кроме максимального значения вероятностной плотности, использовали коэффициент эксцесса (крутизны) пика распределения.
Гистологический контроль. После окончания электрофизиологических экспериментов животных готовили к окраске ткани по методу Ниссля для проверки расположения электродов и для выявления повреждения клеток в дорзальном гиппокампе (поле СА3). Это осуществлялось посредством стандартного протокола, описанного нами ранее [Malkov et al., 2018]. Подсчет нейронов проводили по меньшей мере на 3 срезах на двух ростро-каудальных уровнях: AP = –3.5 мм и AP = –4.5 мм у каждого животного. Количественное определение клеток было выполнено вручную с использованием “Счетчика клеток” программного обеспечения ImageJ (1.50i, США). Наличие клеточных повреждений и снижение числа нейронов расценивали как критерий нейродегенерации.
Статистический анализ. Результаты представлены как среднее значение ± стандартное отклонение. Все статистические тесты были выполнены с использованием программного обеспечения IgorPro (версия 6.35, WaveMetrics, США) и библиотеки статистических онлайн-калькуляторов https://www.socscistatistics.com/. Перед анализом все исходные данные проверялись на нормальность с помощью теста Колмогорова–Смирнова. Внутригрупповые сравнения (центр – стена) выполнялись с помощью парного t-теста Стьюдента. Статистические сравнения между двумя группами были проведены с использованием непарного t-теста или U-критерия Манна–Уитни. Непараметрическая статистика использовалась, чтобы избежать предположений об однородности дисперсий или нормальности распределений; р < 0.05 считали статистически значимым.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЙ
1. Электрофизиологические эксперименты. Основная цель наших экспериментов состояла в том, чтобы выяснить, меняются ли тета- и гамма-ритмы, когда животные изменяют свое положение на арене. Для анализа были выбраны те периоды ЛПП, когда крысы находились либо на периферии, либо в центре поля.
Осцилляторная активность в CA1 и MЭК во время нахождения животных в открытом поле была отчетливо выражена как в тета-, так и в гамма-диапазонах (рис. 2 (б)). Графики спектральной плотности ритмических мощностей (СП) выявили четкие пики в тета- (4–10 Гц), медленном гамма- (25–50 Гц) и быстром гамма-диапазонах (55–100 Гц) (рис. 3), которые были аналогичны таковым в поле CA1 гиппокампа, описанным в более ранних работах [Buzsaki, 2006; O’Keefe, 2007; Colgin, 2016].
Рис. 2.
Изменения полевой активности и состояния ткани гиппокампа на модели каинатной нейротоксичности. (а) Примеры зарегистрированных ЛПП гиппокампа здоровых животных (контроль) и на модели каинатной нейротоксичности (КК). Видно, что у животных с моделью каинатной нейротоксичности наблюдаются частые высокоамплитудные пароксизмальные события. (б) Примеры ЛПП (те же, что и на (а) отфильтрованные в тета (4–10 Гц, вверху), медленном гамма (25–50 Гц, посередине) и быстром гамма (55–100 Гц, внизу) диапазонах. (в) Суммарный уровень аномальной активности по всем животным – интеграл всех высокоамплитудных (>3*SD) событий в ЛПП гиппокампа. Уровень в контроле принят за 100%. (г) Примеры фронтальных срезов гиппокампа, окрашенных методом Ниссля. Слева: демонстрация срезов, включающих все поля гиппокампа и зубчатую фасцию в контроле (“контроль”) и после введения каиновой кислоты (“КК”); Справа: гистограмма, представляющая среднюю плотность клеток в гиппокампе в целом (hip) и по отдельным областям (СА1, СА3, DG); достоверные изменения в числе клеток наблюдаются в поле СА3 (* р = 0.0483).
Fig. 2. Changes in the field activity and the state of the hippocampal tissue in the kainic model of neurotoxicity. (а) Examples of registered hippocampal LFP of healthy animals (control) and on a model of temporal lobe epilepsy (TLE). It can be seen that in animals with a model of SE, frequent high-amplitude paroxysmal events are observed. (б) Examples of LFPs (the same as those on (а) filtered in theta (4–10 Hz, top), slow gamma (25–50 Hz, middle) and fast gamma (55–100 Hz, bottom) ranges. (в) The total level of abnormal activity in all animals is the integral of all high-amplitude (>3 * SD) events in the hippocampal LFPs. The level in the control is taken as 100%. (г) Examples of frontal sections of the hippocampus stained with the Nissl method. Left: demonstration of sections including all fields of the hippocampus and dentate fascia in the control (“контроль”) and after administration of kainic acid (“КК”); Right: a histogram representing the average cell density in the hippocampus as a whole (hip) and in individual fields (CA1, CA3, DG); significant changes in the number of cells are observed in the CA3 field (* p = 0.0483).
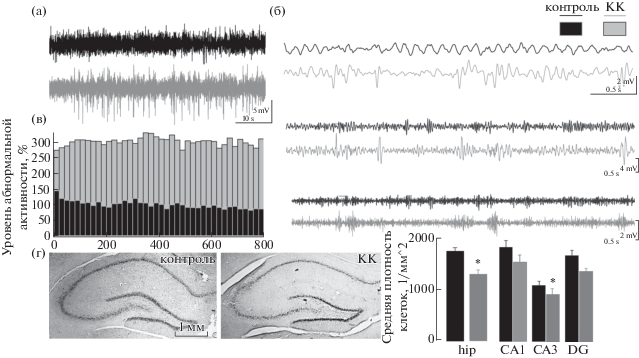
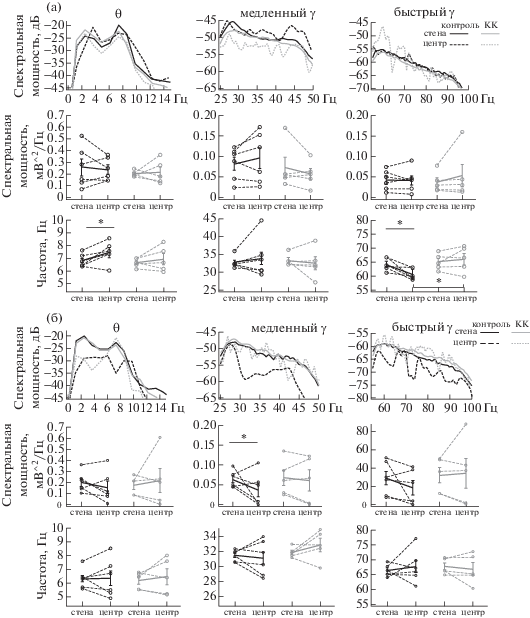
Рис. 3.
Параметры ЛПП гиппокампа и МЭК при движении животных в открытом поле. (а) Гиппокамп, (б) МЭК. На (а) и (б), параметры для тета-ритма (θ) слева, медленного гамма-ритма (“медленный γ”) посередине, и быстрого гамма-ритма (“быстрый γ”) справа). Верхний ряд – диаграммы спектральной мощности ЛПП для соответствующих частотных диапазонов. Спектрограммы ЛПП при нахождении животных в центре открытого поля обозначены пунктирной линией, на периферии – сплошной. Средний ряд – изменение интегральной мощности ритмов (тета-ритма (θ), медленного и быстрого гамма (γ) соответственно) при перемещении животных от периферии к центру. Нижний ряд – изменение ведущей частоты ритмов при перемещении крыс от периферии к центру. Кружками обозначены индивидуальные параметры по разным животным, параметры одного животного в центре и на периферии объединены пунктирными линиями. Средние значения и стандартная ошибка обозначены сплошными линиями.
Fig. 3. LFP parameters of the hippocampus and MEC when animals move in an open field. (а) Hippocampus, (б) MEC. On (а) and (б), parameters for the theta rhythm (θ) on the left, slow gamma rhythm (“медленный γ”) in the middle, and fast gamma rhythm (“быстрый γ”) on the right). The upper row shows the spectral power diagrams of the LFP for the corresponding frequency ranges. The LFP spectrograms in the center of the open field are indicated by a dashed line, on the periphery, by a solid line. The middle row is the change in the integral power of rhythms (theta rhythm (θ), slow and fast gamma (γ), respectively) when animal moving from the periphery to the center. The bottom row is the change in the leading frequency of the rhythms when rat moving from the periphery to the center. The circles indicate individual parameters for different animals, the parameters of one animal in the center and on the periphery are combined by dashed lines. Mean values and standard error are indicated by solid lines.
1.1. Контрольная группа. Животные этой группы иногда перемещались из периферической зоны (стены/углы) в центр поля, но проводили значительно больше времени на периферии, чем в центре (в течение 10 мин экспериментальной сессии суммарное время пребывания в центральной зоне составило в среднем 14.5 ± 10.2 с, рис. 1). Скорость передвижения в центре поля значительно превышала скорость на периферии (0.43 ± 0.05 м/с по сравнению с 0.14 ± 0.04 м/с, F(1.10) = = 106.51, p = 0.0005); в среднем за сессию животные проходили 39.9 ± 10.8 м).
Зарегистрированные ЛПП показали, что во время теста в гиппокампе и МЭК доминирует тета-ритм (рис. 3). Анализ параметров осцилляций в гиппокампе показал, что во время перемещения крысы от периферии к центру поля достоверно повышалась частота тета-ритма (7.46 ± 0. 4 Гц в центре, против 6.81 ± 0.14 Гц на периферии, F(1.10) = 6.913, p = 0.0465), а также наблюдалась тенденция к снижению пика его мощности (0.237 ± ± 0.039 мВ2/Гц против 0.257 ± 0.07 мВ2/Гц, F(1.10) = 0.211, р = 0.664). Существенно изменялся и быстрый гамма-ритм: он значимо снижался по частоте, когда крысы смещались из периферических зон в центр поля (с 64.0 ± ± 1.2 до 60.5 ± 1.85 Гц, р < 0.05, F = 10.924, р = = 0.02); мощность его при этом не изменялась. Относительно медленного гамма-ритма мы не выявили его достоверных изменений во время перемещения крысы от периферии к центру поля.
В МЭК нам не удалось обнаружить достоверных изменений в параметрах тета- и быстрых гамма-осцилляций, когда крысы изменяли свое положение, перемещаясь с периферии к центру арены (рис. 3 (б)). Относительно медленного гамма-ритма, в МЭК, в отличие от гиппокампа, при этом наблюдалось значительное (почти в два раза) снижение его мощности (0.036 ± 0.017 мВ2/Гц против 0.063 ± ± 0.009 мВ2/Гц, F(1.10) = 4.42, р = 0.047).
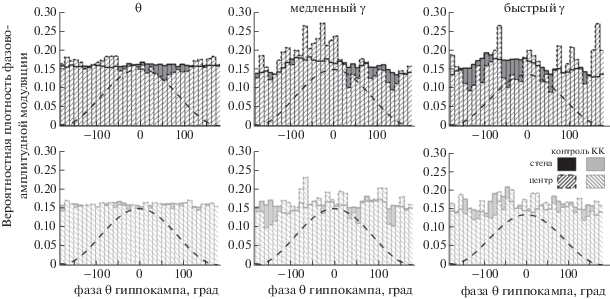
Фазово-амплитудная модуляция осцилляций МЭК гиппокампальным тета-ритмом. Амплитуда ритмической активности МЭК при нахождении крыс в центре поля в значительной мере модулировалась фазой тета-цикла гиппокампа. Для тета-ритма МЭК максимум амплитудной модуляции наблюдался на минимуме тета-цикла гиппокампа (от 100° до –100°). Характер фазово-амплитудной модуляции тета-ритма МЭК гиппокампальным тета-циклом не изменялся при перемещении животного между зонами арены (F(1.10) = = 3.86, р = 0.106). Для медленных и быстрых гамма-осцилляций максимум модуляции приходился на восходящую фазу и пик тета-цикла (от –100° до 0°). При движении на периферии распределение по тета-фазе амплитуды тета-, медленного и быстрого гамма-ритмов было более равномерным, показатель неоднородности распределения достоверно отличался от значений в центре, для всех ритмов (медленный гамма, F(1.10) = 11.5, р = 0.019, быстрый гамма, F(1.10) = 10.85, р = 0.022) (рис. 4).
Рис. 4.
Фазово-амплитудная модуляция активности МЭК гиппокампальным тета-ритмом. Распределение амплитуды тета-ритма (θ, слева), медленного гамма-ритма (“медленный γ”, посередине) и быстрого гамма-ритма (“быстрый γ”, справа), относительно фазы гиппокампального тета-ритма. Представлены усредненные данные по всем животным. Центр открытого поля – столбцы с диагональной штриховкой; периферия – сплошная заливка. Единичный тета-цикл для наглядности изображен пунктирной линией.
Fig. 4. Phase-amplitude modulation of MEC activity by hippocampal theta rhythm. Amplitude distribution of theta rhythm (θ, left), slow gamma rhythm (“медленный γ”, in the middle) and fast gamma rhythm (“быстрый γ”, right), relative to the phase of the hippocampal theta rhythm. Averaged data are presented for all animals. Center of the open field – columns with diagonal hatching; periphery – solid fill. A single theta cycle is shown by a dashed line for clarity.
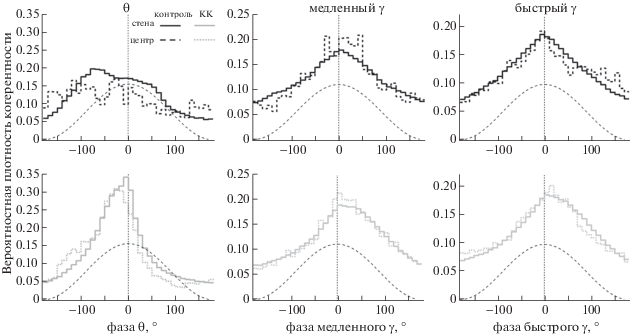
Внутричастная когерентность гиппокампа и МЭК. Анализ внутричастотной тета-когерентности между гиппокампом и МЭК показал, что у всех животных и во всех их положениях в поле тета-ритм гиппокампа был высоко когерентен с энторинальным (вероятностная плотность составляла 0.255 ± 0.04 у стенок и 0.31 ± 0.06 в центре, F(1.10) = 2.92, р = 0.148); т.е. в центре поля когерентность демонстрирует тенденцию к повышению. При этом разности тета-фаз в гиппокампе и МЭК были близки к нулю (–6.6 ± 15.8° на периферии и –12 ± 18.5° в центре (рис. 5). В то же время гамма-осцилляции в гиппокампе продемонстрировали относительно низкую когерентность с таковыми в МЭК во всех положениях крыс (рис. 5); разности фаз продемонстрировали большой разброс и в среднем также были близки к нулю. Таким образом, у контрольных животных ведущая (лидирующая) структура из двух исследованных не выявлялась. Так же, как и для тета-ритма, при перемещении от периферии в центр наблюдалась тенденция к увеличению гамма-когерентности (для медленного гамма ритма F(1.10) = 5.44, р = 0.067, для быстрого гамма ритма F(1.10) = = 4.1, р = 0.098)).
Рис. 5.
Когерентность активности гиппокампа и МЭК в различных частотных диапазонах. Демонстрируется распределение разности фаз ЛПП гиппокампа и МЭК относительно фазы гиппокампальных ритмов в соответствующих частотных диапазонах (θ – слева, медленного γ – посередине, и быстрого γ – справа). Распределение в центре открытого поля обозначено пунктирной линией, распределение на периферии – сплошной линией. Единичный цикл активности гиппокампа для наглядности изображен пунктирной линией.
Fig. 5. Coherence of the hippocampal and MEC activity in different frequency ranges. The distribution of the phase difference between the LFP of the hippocampus and MEC relative to the phase of the hippocampal rhythms in the corresponding frequency ranges (θ – on the left, slow γ – in the middle, and fast γ – on the right) is demonstrated. The distribution in the center of the open field is indicated by a dashed line, the distribution on the periphery by a solid line. A single hippocampus activity cycle is depicted by a dotted line for clarity.
Гистологический анализ. Всего было проанализировано 53 среза. Средняя плотность нейронов в гиппокампе контрольных животных составила 1742 ± 79 кл/мм2 (рис. 2 (г)). Плотность клеток в поле СА3 гиппокампа составила 1042 ± 82 кл/мм2 и была несколько ниже по сравнению с СА1 и зубчатой фасцией, 1770 ± 131 кл/мм2 и 1619 ± 102 кл/мм2 соответственно.
1.2. “Каинатная” группа. Мы не обнаружили значимой разницы в скорости движения по открытому полю у животных этой группы по сравнению с контрольными крысами: как и в контрольной группе, у животных с введением КК скорость движения в центре была достоверно выше, чем на периферии (рис. 1 (б)). Животные этой группы, так же, как и контрольные крысы, редко смещались от стен/углов к центру поля, хотя обнаруживалась тенденция перемещаться к центру чаще, чем у контрольных крыс. Мы не выявили существенных различий между группами и по времени, проведенному крысами в центре или на периферии; однако у “каинатных” крыс была выявлена тенденция проводить больше времени в центре по сравнению с контрольными (32.6 ± 16.9 c по сравнению с 14.5 ± 10.2 с в контроле, р = 0.2, U-test) (рис. 1 (г)).
При анализе активности гиппокампа было выявлено значительное более частое появление высокоамплитудной активности (“острых” волн), до 296 ± 32% по сравнению с контролем, принятым за 100%, U-test, p = 0.008). В большинстве случаев их амплитуда значительно (в два–три раза) превышала таковую у контрольных крыс (рис. 2 (а)). Однако как и у контрольных животных, зарегистрированные ЛПП показали доминирование тета-ритма в гиппокампе и МЭК (рис. 3).
При перемещении животных с периферии в центр поля мощность и частота тета-ритма в гиппокампе не изменялись; при этом также существенно не изменялись медленные и быстрые гамма-осцилляции (в контроле частота быстрого гамма-ритма снижалась). Однако необходимо отметить, что у крыс, находящихся в центре поля, быстрые гамма-осцилляции имели значительно более высокую частоту по сравнению с таковыми у здоровых крыс (66.0 ± 2.0 Гц по сравнению с 60.5 ± 1.8 Гц, F = 7.23, p = 0.025) (рис. 3). Частота медленного гамма-ритма не менялась при перемещении животных с периферии в центр поля, хотя в контроле наблюдалось незначительное повышение его частоты.
В МЭК параметры тета- и гамма-осцилляций не менялись, когда крысы изменяли свое положение на арене, и существенно не отличались от таковых в контрольной группе.
Фазово-амплитудная модуляция осцилляций МЭК гиппокампальным тета-ритмом. Модуляция амплитуды тета-активности была слабее по сравнению с контролем (U-тест: р = = 0.027). Для гамма-осцилляций изменения фазово-амплитудной модуляции при перемещении животных с периферии в центр также были менее выражены, чем в контроле (расстояние Кульбака–Лейблера было достоверно ниже; U-тест: медленный гамма, р = 0.027, быстрый гамма, р = 0.018). Необходимо отметить, однако, что фазово-амплитудная модуляция медленного гамма-ритма в центре поля была достоверно выше по сравнению с таковой на периферии (F(1.10) = 14.37, р = = 0.019) (рис. 4).
Внутричастотная когерентность гиппокампа и МЭК. Когерентность тета-активности двух структур не отличалась в центре и на периферии открытого поля (F(1.10) = 3.19, р = = 0.148), однако в значительной мере превышала контрольные значения; отличия были особенно заметны, когда животные находились на периферии (U-тест, p = 0.042 и p = = 0.027 для центра и периферии соответственно). Внутричастотные фазовые отношения между гиппокампом и МЭК в медленном и быстром гамма-диапазонах не отличались от контрольной группы (рис. 5).
Гистологический анализ. В результате проведения postmortem гистологического анализа у животных этой группы были выявлены повреждения в гиппокампе (поля СА1 и СА3) и зубчатой фасции (рис. 2 (г)). Было проанализировано 70 срезов. Средняя плотность нейронов по всему гиппокампу была существенно ниже по сравнению с контролем: 1291 ± 87 кл/мм2 (F(1.120) = 4.97, р = 0.037, см. рис. 2 (г)). Снижение числа клеток наблюдалось во всех проанализированных областях (в поле СА1 плотность равнялась 1485 ± 141 кл/мм2, в зубчатой фасции – 1319 ± 61 кл/мм2), достоверные отличия в плотности клеток были обнаружены в поле СА3: 873 ± 108 кл/мм2 (F(1.120) = 4.156, р = 0.0483).
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
В настоящей работе приведены свидетельства того, что через месяц после введения КК и возникающего при этом эпилептического статуса тета- и гамма-осцилляции изменялись во время исследовательского поведения животных в открытом поле. Выявлено также, что взаимодействия гиппокампа и МЭК, и амплитудная модуляция ритмов МЭК фазой гиппокампальной тета-волны нарушались у животных на каинатной модели нейротоксичности. Следует отметить, что эпилептический статус в большинстве случаев приводит к развитию хронической эпилепсии, когда наблюдаются повторяющиеся спонтанные судороги [Lothman et al., 1990; Hellier et al., 1998; Bragin et al., 1999]. Мы не обнаружили спонтанных судорог, вероятно, потому, что один месяц – это недостаточно длительный срок для их отчетливого проявления: по литературным данным, они возникают в среднем через 2.5 мес после эпилептического статуса, вызванного введением КК [Hellier et al., 1998]. С другой стороны, наблюдаемые нами электрофизиологические изменения могут использоваться как ранние биомаркеры нейродегенеративных процессов, развивающихся при эпилептогенезе [Betjemann, Lowenstein, 2015; Lin et al., 2019].
Одной из причин происходящих нарушений ритмов, обнаруженных в наших экспериментах, очевидно, являются повреждение и интенсивная гибель клеток в гиппокампе: как показано ранее, нейроны гиппокампа играют решающую роль в генерации тета- и гамма-осцилляций [Buzsáki, 2002, 2006; Buzsáki, Wang, 2010].
Тест “открытое поле” является одним из самых популярных этологических тестов для оценки тревожности и исследовательского поведения у грызунов [Broadhurst, 1957, 1958; Kuniishi et al., 2017]. Повышение или снижение частоты перемещения животного в центр ограниченного пространства указывает на снижение или повышение тревожности соответственно [Prut, Belzung, 2003]. Однако поскольку перед экспериментами мы помещали крыс в открытое поле для ознакомления с ним, то во время тестирования в их поведении не обнаруживалось выраженного беспокойства (не было длительного неподвижного сидения в углах). Таким образом, мы полагаем, что их основной мотивацией при нахождении в открытом поле было изучение окружающей среды.
При сравнении животных контрольной и “каинатной” групп нам не удалось обнаружить существенных различий в частоте их выхода в центр поля, а также во времени, которое крысы проводили на периферии и в центре; это означает, что эмоциональный уровень и исследовательский драйв были почти одинаковыми у животных обеих групп. Тот факт, что крысы с введением КК обнаруживали тенденцию перемещаться в центр несколько чаще, чем здоровые, и проводить там больше времени, может свидетельствовать о том, что они были более возбудимыми [Prut, Belzung, 2003]. Об этом же свидетельствует и то, что в полевой активности гиппокампа обнаруживалось почти в три раза больше высокоамплитудных “острых” волн. Периодическое возникновение таких пароксизмов отмечается в нормальном гиппокампе [Freund, Buzsáki, 1996]; однако резкое их учащение и повышение амплитуды свидетельствуют о формировании судорожного очага [Mazarati et al., 2002; Chauviėre et al., 2009]. В работе Мазарати и соавт. [2002] была выявлена статистически достоверная корреляция между частотой острых событий (спайков) во время эпилептического статуса и таковыми во время интериктального периода. Авторы также отмечают, что следующий после эпилептического статуса период “молчания”, т.е. отсутствия спонтанных судорог, наблюдается только в поведении, в то время как в ЭЭГ регистрируется пароксизмальная активность [Mazarati et al., 2002].
Основным нашим интересом в данном исследовании было выявление изменений тета- и гамма-осцилляций и ритмических взаимодействий структур в эпилептическом мозге по сравнению с контрольным.
В экспериментах на контрольных крысах нами была выявлена значительная реактивность гиппокампа и МЭК к изменению пространственного положения животных: в гиппокампе наблюдались увеличение частоты тета-ритма и снижение частоты быстрого гамма-ритма при перемещении животных в центр. Интересно, что в МЭК при этом наблюдалось значительное ослабление выраженности медленного гамма-ритма при относительной неизменности других изучаемых типов осцилляций.
Считается, что изменение положения животных в окружающем пространстве сопровождается включением внимания и обработкой пространственной информации; это обусловлено, в частности, активацией пространственно модулируемых пирамидных клеток в гиппокампе и МЭК [O’Keefe, 1976; O’Keefe, Nadel, 1978; Hafting et al., 2005, 2008]. В этих событиях тета- и гамма-ритмы играют важную роль [Jensen, Lisman, 2005; Colgin, Moser, 2010; Zheng et al., 2016]; полученные нами данные согласуются с этим утверждением. Тета-ритм, как известно, возрастает по частоте при увеличении притока внешней информации [Green, Arduini, 1954; Vinogradova, 1995; Buzsaki, 2002]; именно это наблюдается при смещении животных на арене. Кроме того, он участвует в модуляции активности пространственных клеток [O’Keefe et al., 1993; Hasselmo et al., 2014], и увеличение его частоты при перемещении крыс, возможно, объясняется функциональной связью с активностью этих нейронов. Таким образом, увеличение частоты тета-ритма при перемещении животных с периферии в центр площадки, наблюдаемое в наших экспериментах, вполне объяснимо.
Быстрый гамма-ритм в поле CA1 связан с афферентным входом от III слоя MЭК [Colgin et al., 2009], структурой, критической для кодирования информации и пространственной памяти [Sutherland et al., 1983; Brun et al., 2002; Steffenach et al., 2002]. В МЭК быстрые гамма-осцилляции в наших опытах не изменялись, тем не менее, пространственно модулируемые нейроны, присутствующие в этой области мозга [Hafting et al., 2005; Taube et al., 1990], могли изменять свою активность при смене положения животных в открытом поле и тем самым влиять на параметры быстрого гамма-ритма в гиппокампе. Специфическое изменение активности пространственных клеток, в частности, “клеток решетки” в МЭК при изменении положения животных в окружающем пространстве [Hafting et al., 2005] также может объяснять обнаруженное нами ослабление мощности медленных гамма-осцилляций в этой структуре.
Фазово-амплитудная модуляция осцилляций МЭК гиппокампальным тета-ритмом. Гиппокамп, являясь генератором тета-осцилляций, в значительной мере модулирует активность связанных с ним структур. Нами была обнаружена значительная зависимость фазово-амплитудной тета-модуляции активности МЭК во всех частотных диапазонах от пространственного положения крыс. На фоне увеличения частоты гиппокамального тета-ритма усиление фазово-амплитудной модуляции активности МЭК при переходе животного от периферии к центру открытого поля может отражать повышение внимания и активацию процессов кодирования и/или консолидации пространственной информации [Colgin, 2015b, 2016].
Внутричастотная когерентность гиппокампа и МЭК. Другим интересным фактом, полученным в данной работе на здоровых крысах, являлось то, что при вычислении внутричастотной тета-когерентности между гиппокампом и МЭК у всех животных и во всех их положениях на площадке тета-ритм в поле СА1 гиппокампа демонстрировал высокую когерентность с тета-ритмом в III слое МЭК, т.е. фазовая сцепленность (“phase locking”) тета-активности в двух структурах была высокой. При этом лидирующей структуры не выявлялось; разности фаз у различных животных несколько отличались, что привело уплощению пика вероятностной плотности на суммарной коррелограмме (рис. 5). В более ранней работе на свободно двигающихся мышах была показана высокая тета-когерентность между зубчатой фасцией гиппокампа и МЭК: разница фаз, как и в нашей работе, была близкой к нулю [Froriep et al., 2012]. Таким образом, наши данные совпадают с фактами, полученными в приведенной выше работе, несмотря на то, что эксперименты были проведены на разных видах грызунов, а регистрация гиппокампальной активности осуществлялась в разных локусах. Исходя из нашей и приведенной выше более ранней работы, можно заключить, что у свободно перемещающихся в открытом поле здоровых грызунов тета-осцилляции в гиппокампе и МЭК достаточно синхронны, независимо от их положения в пространстве. Высокая тета-когерентность гиппокампа и МЭК свидетельствует о тесном взаимодействии этих двух структур при обработке пространственной информации [Womelsdorf et al., 2006; Gregoriou et al., 2009; Siegel et al., 2009]. Однако гамма-осцилляции в гиппокампе продемонстрировали относительно низкую когерентность с таковыми в МЭК во всех положениях животных, при большом разбросе разности фаз. В отличие от наших данных, ранее было показано, что быстрые гамма-осцилляции в поле СА1 гиппокампа когерентны с таковыми в МЭК [Colgin et al., 2009]. Позднее, при множественной регистрации активности во всех слоях СА1 и вдоль проксимо-дистальной оси дорзального гиппокампа Schomburg и соавт. [Schomburg et al., 2014] смогли точно локализовать источники различных типов гамма-осцилляций и показали их независимость. Анализ выявил, что гамма-осцилляции в МЭК не “ведут за собой” гамма-осцилляции в СА1; это позволило авторам предположить ограниченность распространения гамма-волн в гиппокампе. Возможно, это объясняет различия в результатах, полученных нами и другими авторами.
У животных с введением каиновой кислоты, в отличие от контрольных, гиппокамп и МЭК оказались менее реактивными при перемещении крыс с периферии к центру. В гиппокампе мощность и частота тета-ритма, в отличие от контроля, не изменялись; также существенно не изменялись медленные и быстрые гамма-осцилляции, как это было у здоровых животных. Это может отражать нарушение процессов внимания и запоминания информации, в частности, пространственной [Tramoni-Negre et al., 2017; Lemesle et al., 2017]. Не было выявлено снижения частоты быстрого гамма-ритма, которое обнаруживалось у контрольных животных при их перемещении с периферии к центру; вследствие этого при движении в центральной части поля быстрые гамма-осцилляции имели достоверно более высокую частоту, чем у контрольных крыс. Такое изменение характеристик быстрого гамма-ритма в зависимости от положения животных в пространстве может быть связано с изменением активности гиппокампальных интернейронов, участвующих в его формировании [Freund, Buzsaki, 1996], или с их гибелью. Это может быть также вызвано изменением модулирующего влияния со стороны МЭК, так как нейроны этой структуры тоже гибнут после эпилептического статуса [Betjemann, Lowenstein, 2015; Lin et al., 2019]. В МЭК, в отличие от контрольных крыс, мы также не обнаружили изменений выраженности медленных гамма-осцилляций при перемещении животных в открытом поле, что может быть следствием нарушений клеточной активности и их гибели, как в гиппокампе, где этот ритм генерируется, так и в МЭК.
Фазово-амплитудная модуляция осцилляций МЭК гиппокампальным тета-ритмом. У животных с введением КК изменения фазово-амплитудной модуляции при перемещении животных в центр были выражены значительно слабее, чем в контроле. Это может отражать снижение уровня внимания и нарушение процессов кодирования и/или консолидации пространственной информации, наблюдаемое при изменении локации у нормальных крыс [Colgin, 2015b, 2016]. Эти нарушения могут объяснять снижение памяти при нейродегенеративных явлениях в гиппокампе.
Внутричастная когерентность гиппокампа и МЭК. Другим заметным изменением в мозге животных с введением каината при сравнении со здоровыми крысами было формирование гиперсинхронных тета-осцилляций в сети гиппокамп – МЭК, выражающееся в возрастании их когерентности. При этом у животных с каинатной моделью полевая активность гиппокампа и МЭК в меньшей степени по сравнению с контролем реагировала на изменение пространственного положения. Кроме того, у животных этой группы изменение фазово-амплитудной модуляции при перемещении крыс в центр было выражено значительно слабее, чем у здоровых. Вероятно, эти изменения, особенно формирование гиперсинхронных тета-осцилляций в энторинально-гиппокампальной сети, приводят к невозможности адекватной обработки информации.
Из полученных в настоящей работе данных по изменениям гамма-ритмов в мозге крыс с введением КК пока трудно конкретно заключить, какие последствия могут повлечь за собой их нарушения. Функциональная роль разных частотных полос гамма-осцилляций еще дебатируется в литературе, хотя известно, что они участвуют во многих аспектах когнитивной работы мозга [Colgin, 2015а, 2015b, 2016]. Относительно функций быстрого гамма-ритма предполагается, что он связан с кодированием информации [Newman et al., 2013; Zheng et al., 2016]; поэтому можно предположить, что обнаруженное нами у таких крыс отсутствие его изменений при перемещении животных с периферии в центр, которые выявляются у здоровых животных, связано с нарушением пространственного кодирования. Что касается функций медленных гамма-осцилляций, то, как предполагается, с их участием осуществляются временное хранение (удержание) и извлечение информации из памяти [Treves, Rolls, 1992; Steffenach et al., 2002]. Таким образом, можно сделать вывод, что обнаруженные на каинатной модели у крыс изменения характеристик быстрого и медленного гамма-ритмов свидетельствуют о нарушениях кодирования пространственной информации, ее хранения и извлечения из памяти при нейродегенеративной патологии. Необходимо подчеркнуть, что изменения характеристик осцилляторной активности при смене положения животных в открытом поле у животных с инъекцией КК не были вызваны различиями в скорости перемещения, поскольку разность в скорости движения в центре и на периферии у крыс двух групп значимо не различалась.
Таким образом, используя каинатную модель нейродегенеративных патологий, мы впервые обнаружили у свободно передвигающихся крыс нарушения параметров тета- и гамма-ритмов, гиперсинхронизацию активности гиппокампа и МЭК, а также нарушение фазово-амплитудной модуляции активности МЭК гиппокампальным тета-ритмом. Исходя из того, что все исследуемые в настоящей работе типы осцилляторной активности участвуют в познавательных функциях, можно полагать, что обнаруженные в наших экспериментах изменения являются частью механизма когнитивных нарушений, выявляемых в результате нейродегенеративных процессов в гиппокампе [Dupont et al., 2000; Helmstaedter, 2002; Inostroza et al., 2013], и могут быть использованы как ранние биомаркеры этой патологии.
ВЫВОДЫ
1. В тесте “открытое поле” контрольные крысы и крысы с введением нейротоксина каиновой кислоты не различались по частоте передвижения с периферических зон в центр поля и по времени нахождения в этих зонах. Обнаружена отчетливая выраженность тета- (4–10 Гц), быстрого (25–50 Гц) и медленного гамма-ритмов (55–100 Гц) в гиппокампе и МЭК у животных обеих групп.
2. У всех контрольных крыс и во всех их положениях на арене, тета-ритм гиппокампа был высоко когерентен с тета-ритмом в МЭК; при этом наблюдалась значительная вариабельность разницы фаз между экспериментальными животными. Для животных с моделью каинатной нейротоксичности было показано усиление когерентности в тета-диапазоне с разницей фаз, близкой к 0°.
3. У контрольных животных тета-ритм повышался, а быстрый гамма-ритм снижался по частоте, когда крысы смещались из периферических зон в центр поля. Медленные гамма-осцилляции при этом снижались по мощности. Подобных изменений при перемещении животных не наблюдалось на модели нейротоксичности.
4. Фазово-амплитудная модуляция активности МЭК гиппокампальным тета-ритмом у контрольных крыс в значительной мере изменялась в зависимости от пространственного положения животных; у “каинатных” крыс показано достоверное снижение фазово-амплитудной модуляции активности МЭК при выходе животных в центр открытого поля.
6. Выявленные у крыс с моделью нейротоксичности изменения характеристик тета-осцилляций, а также быстрого и медленного гамма-ритмов являются возможными биомаркерами нарушений запоминания пространственной информации и ее извлечения из памяти, наблюдаемых при нейродегенерации в гиппокампе.
Список литературы
Виноградова О.С., Кичигина В.Ф., Кудина Т.А., Кутырева Е.В. Осцилляторные тета-процессы в нейронах септо-гиппокампальной системы и их модуляция стволовыми структурами. Успехи современной биологии. 2000. 120: 103–112.
Axmacher N., Henseler M.M., Jensen O., Weinreich I., Elger C.E., Fell J. Cross-frequency coupling supports multi-item working memory in the human hippocampus. Proc. Natl. Acad. Sci. U.S.A. 2010. 107: 3228–3233.
Bastos A.M., Vezol J., Fries P. Communication through coherence with inter-areal delays. Curr. Opin. Neurobiol. 2015. 31: 173–180.
Belluscio M.A., Mizuseki K., Schmidt R., Kempte R., Buzsaki G. Cross-frequency phase-phase coupling between theta and gamma oscillations in the hippocampus. J. Neurosci. 2012. 32: 423–435.
Benchenane K., Peyrache A., Khamassi M., Tierney P.L., Gioanni Y., Battaglia F.P., Wiener S.I. Coherent theta oscillations and reorganization of spike timing in the hippocampal-prefrontal network upon learning. Neuron. 2010. 66 (6): 921–936.
Betjemann J.P., Lowenstein D.H. Status epilepticus in adults. Lancet Neurol. 2015. 14 (6): 615–624.
Bland B.H. The physiology and pharmacology of hippocampal formation theta rhythms. Prog. Neurobiol. 1986. 26: 1–54.
Bouyer J., Montaron M., Rougeul A. Fast fronto-parietal rhythms during combined focused attentive behaviour and immobility in cat: cortical and thalamic localizations. Electroencephalogr. Clin. Neurophysiol. 1981. 51: 244–252.
Bragin A., Engel J. Jr., Wilson C.L., Vizentin E., Mathern G.W. Electrophysiologic analysis of a chronic seizure model after unilateral hippocampal KA injection. Epilepsia. 1999. 40: 1210–1221.
Bragin A., Jandó G., Nádasdy Z., Hetke J., Wise K., Buzsáki G. γ (40–100 Hz) oscillation in the hippocampus of the behaving rat. J. Neurosci. 1995. 15: 47–60.
Brun V.H., Otnass M.K., Molden S., Steffenach H.A., Witter M.P., Moser M.B., Moser E.I. Place cells and place recognition maintained by direct entorhinal-hippocampal circuitry. Science. 2002. 296: 2243–2246.
Buzsáki G. Theta oscillations in the hippocampus. Neuron. 2002. 33: 325–340.
Buzsáki G. Rhythms of the Brain. New York, N.Y: Oxford University Press. 2006.
Buzsáki G., Moser E.I. Memory, navigation and theta rhythm in the hippocampal-entorhinal system. Nat. Neurosci. 2013. 16: 130–138.
Buzsáki G., Wang X.J. Mechanisms of gamma oscillations. Annu. Rev. Neurosci. 2010. 35: 203–225.
Cavanagh J.F., Cohen M.X., Allen J.J. Prelude to and resolution of an error: EEG phase synchrony reveals cognitive control dynamics during action monitoring. J. Neurosci. 2009. 29: 98–105.
Canolty R., Edwards E., Dalal S., Soltani M., Nagarajan S., Kirsch H., Berger M.S., Barbaro N., Knight R. High g power is phase-locked to theta oscillations in human neocortex. Science. 2006. 313: 1626–1628.
Canolty R.T., Edwards E., Dalal S.S., Soltani M., Nagarajan S.S., Kirsch H.E., Berger M.S., Barbaro N.M., Knight R.T. Oscillatory phase coupling coordinates anatomically dispersed functional cell assemblies. Proc. Natl. Acad. Sci. U.S.A. 2010. 107 (40): 17356–17361.
Canolty R.T., Knight R.T. The functional role of cross-frequency coupling. Trends Cogn. Sci. 2010. 14: 506–515.
Chauvière L., Rafrafi N., Thinus-Blanc C., Bartolomei F., Esclapez M., Bernard C. Early deficits in spatial memory and theta rhythm in experimental temporal lobe epilepsy. J. Neurosci. 2009. 29 (17): 5402–5410.
Colgin L.L. Mechanisms and functions of theta rhythms. Annu. Rev. Neurosci. 2013. 36: 295–312.
Colgin L.L. Do slow and fast gamma rhythms correspond to distinct functional states in the hippocampal network? Brain Res. 2015a, 1621: 309–315.
Colgin L L. Theta-gamma coupling in the entorhinal-hippocampal system. Curr. Opin. Neurobiol. 2015b. 31: 45–50.
Colgin L.L. Rhythms of the hippocampal network. Nat. Rev. Neurosci. 2016. 17 (4): 239–249.
Colgin L.L., Denninger T., Fyhn M., Hafting T., Bonnevie T., Jensen O., Moser M.B., Moser E.I. Frequency of gamma oscillations routes flow of information in the hippocampus. Nature. 2009. 462 (7271): 353–357.
Colgin L.L., Moser E.I. Gamma oscillations in the hippocampus. Physiology. 2010. 25: 319–329.
Dupont S., Van de Moortele P., Samson S., Hasboun D., Poline J., Adam C., Lehéricy S., Le Bihan D., Samso, Y., Baulac M. Episodic memory in left temporal lobe epilepsy: a functional MRI study. Brain. 2000. 123: 1722.
Fell J., Axmacher N. The role of phase synchronization in memory processes. Nat. Rev. Neurosci. 2011. 12: 105–118.
Fell J., Klave P., Lehnert K., Grunwald T., Schalle C., Elger C.E., Fernández G. Human memory formation is accompanied by rhinal-hippocampal couplingand decoupling. Nat. Neurosci. 2001. 4: 1259–1264.
Fell J., Ludowig E., Rosburg T., Axmache N., Elger C.E. Phase-locking within human mediotemporal lobe predicts memory formation. Neuroimage. 2008. 43: 410–419.
Freund T.F., Buzsaki G. Interneurons of the hippocampus. Hippocampus. 1996. 6: 347–470.
Fries P. Neuronal γ-band synchronization as a fundamental process incortical computation. Annu. Rev. Neurosci. 2009. 32: 209–224.
Froriep U.P., Kumar A., Cosandier-Rimélé D., Häussler U., Kilias A., Haas C.A., Egert U. Altered theta coupling between medial entorhinalcortex and dentate gyrus in temporal lobe epilepsy. Epilepsia. 2012. 53: 1937–1947.
Green J.D., Arduini A.A. Hippocampal electrical activity in arousal. J. Neurophysiol. 1954. 17 (6): 533–557.
Gregoriou G.G., Gotts S.J., Zhou H., Desimone R. High-frequency, long-range coupling between prefrontal and visual cortex during attention. Science. 2009. 324: 1207–1210.
Hafting T., Fyhn M., Molden S., Moser M.B., Moser E.I. Microstructure of a spatial map in the entorhinal cortex. Nature. 2005. 436: 801–806.
Hafting T., Fyhn M., Bonnevie T., Moser M.B., Moser E.I. Hippocampus-independent phase precession in entorhinal grid cells. Nature. 2008. 453: 1248–1252.
Hasselmo M.E., Stern C.E. Theta rhythm and the encoding and retrieval of space and time. Neuroimage. 2014. 85 (Pt 2): 656–666.
Helmstaedter C. Effects of chronic epilepsy on declarative memory systems. Prog. Brain Res. 2002. 135: 439–453.
Hellier J.L., Patrylo P.R., Buckmaster P.S., Buckmaster P.S., Dudek F.E. Recurrent spontaneous motor seizures after repeated low-dose systemic treatment with kainate: assessment of a rat model of temporal lobe epilepsy. Epilepsy Res. 1998. 31: 73–84.
Hurtado J.M., Rubchinsky L.L., Sigvardt K.A. Statistical method for detection of phase-locking episodes in neural oscillations. J. Neurophysiol. 2004. 91: 1883–1898.
Inostroza M., Brotons-Mas J.R., Laurent F., Cid E., de la Prida L.M. Specific impairment of ‘‘what-where-when’’ episodic-like memory inexperimental models of temporal lobe epilepsy. J. Neurosci. 2013. 33: 17749–17762.
Jensen O., Lisman J.E. Hippocampal sequence-encoding driven by a cortical multi-item working memory buffer. Trends Neurosci. 2005. 28: 67–72.
Kemere C., Carr M.F., Karlsson M.P., Frank L.M. Rapid and continuous modulation of hippocampal network state during exploration of new places. PLoS ONE. 2013. 8: e73114.
O’Keefe J. Place units in the hippocampus of the freely moving rat. Exp. Neurol. 1976. 51: 78–109.
O’Keefe J., Conway D.H. Hippocampal place units in the freely moving rat: why they fire where they fire. Exp. Brain Res. 1978, 31 (4): 573–590.
O’Keefe J., Recce M.L. Phase relationship between hippocampal place units and the EEG theta rhythm. Hippocampus. 1993. 3 (3): 317–330.
Kloosterman F., Van Haeften T., Witter M.P., Lopes Da Silva F.H. Electrophysiological characterization of interlaminar entorhinal connections: an essential link for re-entrance in the hippocampal-entorhinal system. Eur. J. Neurosci. 2003. 18: 3037–3052.
Kuniishi H., Ichisaka S., Yamamoto M., Ikubo N., Matsuda S., Futora E., Harada R., Ishihara K., Hata Y. Early deprivation increases high-leaning behavior, a novel anxiety-like behavior, in the open field test in rats. Neurosci. Res. 2017. 123: 27–35.
Lega B., Burke J., Jacobs J., Kahana M.J. Slow-theta-to-g phaseamplitude coupling in human hippocampus supports the formation of new episodic memories. Cereb. Cortex. 2016. 26: 268–278.
Lemesle B., Planton M., Pagès B., Pariente J. Accelerated long-term forgetting and autobiographical memory disorders in temporal lobe epilepsy: One entity or two? Rev. Neurol. (Paris). 2017. 173 (7–8): 498–505.
Lin D.Q., Cai X.Y., Wang C.H., Yang B., Liang R.S. Optimal concentration of necrostatin-1 for protecting against hippocampal neuronal damage in mice with status epilepticus. Neural Regen. Res. 2020. 15 (5): 936–943.
Livanov M.N., Krylov V.Yu., Ostrjakova T.V., Shulgina G.I. Slow field potential oscillations as one of the basic mechanisms of integrative activity of neurons [proceedings]. Act. Nerv. Super. (Praha). 1977. 19: 43–44.
Lothman E.W., Bertram E.H., Kapur J., Stringer J.L. Recurrent spontaneous hippocampal seizures in the rats as a chronic sequela to limbic status epilepticus. Epilepsy Res. 1990. 6: 110–118.
Malkov A.E., Shubina L.V., Kitchigina V.F. Effects of Endocannabinoid-Related Compounds on the Activity of Septal and Hippocampal Neurons in a Model of Kainic Neurotoxicity: Study ex vivo. Opera Med. Physiol. 2018. 4 (1): 23–34.
Mazarati A., Bragin A., Baldwin R., Shin D., Wilson C., Sankar R., Naylor D., Engel J., Wasterlain C.G. Epileptogenesis after self-sustaining status epilepticus. Epilepsia. 2002. 43 Suppl 5: 74–80.
Montgomery S.M., Sirota A., Buzsáki G. Theta and γ coordination of hippocampal networks during waking and rapid eye movement sleep. J. Neurosci. 2008. 28: 6731–6741.
Moser E.I., Roudi Y., Witter M., Kentros C., Bonhoeffer T., Moser M. Grid cells and cortical representation. Nat. Rev. Neurosci. 2014. 15: 466–481.
Nácher V., Ledberg A., Deco G., Romo R. Coherent delta-band oscillations between cortical areas correlate with decision making. Proc. Natl. Acad. Sci. U. S. A. 2013. 110: 15085–15090.
Newman E.L., Gillet S.N., Climer J.R., Hasselmo M.E. Cholinergic blockade reduces theta-g phase amplitude coupling and speed modulation of theta frequency consistent with behavioral effects on encoding. J. Neurosci. 2013. 33: 19635–19646.
Paxinos G., Watson C. The rat brain in stereotaxic coordinates. Sydney: Academic press. 1998. 321 p.
Petsche H., Stumpf C. The origin of theta-rhytm in the rabbit hippocampus. Wien. Klin. Wochenschr. 1962. 74: 696–700.
Prut L., Belzung C. The open field as a paradigm to measure the effects of drugs on anxiety-like behaviors: a review. Eur. J. Pharmacol. 2003. 463 (1–3): 3–33.
Rodriguez E., George N., Lachaux J.P., Martinerie J., Renault B., Varela F.J. Perception’s shadow: long-distance synchronization of human brain activity. Nature. 1999. 397: 430–433.
Schomburg E.W., Fernández-Ruiz A., Mizuseki K., Berényi A., Anastassiou C.A., Koch C., Buzsáki G. Theta phase segregation of input-specific gamma patterns in entorhinal-hippocampal networks. Neuron. 2014. 84: 470–485.
Siegel M., Warden M.R., Mille E.K. Phase-dependent neuronal coding of objects in short-term memory. Proc. Natl. Acad. Sci. U.S.A. 2009. 106: 21341–21346.
Steffenach H.A., Sloviter R S., Mose E.I., Moser M.B. Impaired retention of spatial memory after transection of longitudinally oriented axons of hippocampal CA3 pyramidal cells. Proc. Natl. Acad. Sci. U. S. A. 2002. 99: 3194–3198.
Steward O. Topographic organization of the projections from the entorhinal area to the hippocampal formation of the rat. J. Comp. Neurol. 1976. 167: 285–314.
Strogatz S.H. Nonlinear Dynamics and Chaos: With Applications to Physics, Biology, Chemistry and Engineering. Cambridge, MA: Perseus Books Publishing, 2003.
Stumpf C., Petsche H., Gogolak G. The significance of the rabbit’s septum as a relay station between the midbrain and the hippocampus. II. The differential influence of drugs upon both the septal cell firing pattern and the hippocampus theta activity. Electroenceph. Clin. Neurophysiol. 1962. 14: 212–219.
Sutherland R.J., Whishaw I.Q., Kolb B. A behavioural analysis of spatial localization following electrolytic, kainate- or colchicine-induced damage to the hippocampal formation in the rat. Behav. Brain Res. 1983. 7 (2): 133–153.
Tan H.M., Wills T.J., Cacucci F. The development of spatial and memory circuits in the rat. Wiley Interdiscip. Rev. Cogn. Sci. 2017. 8 (3).
Taube J.S., Muller R.U., Ranck J.B. Head-direction cells recorded from the postsubiculum in freely moving rats. II. Effects of environmental manipulations. J. Neurosci. 1990. 10: 36–447.
Tort A.B.L., Komorowski R.W., Manns J.R., Kopell N.J., Eichenbaum H. Theta-γ coupling increases during the learning of item-context associations. Proc. Natl. Acad. Sci. U. S. A. 2009. 106: 20942–20947.
Tramoni-Negre E., Lambert I., Bartolomei F., Felician O. Long-term memory deficits in temporal lobe epilepsy. Rev. Neurol. (Paris). 2017. 73 (7–8): 490–497.
Treves A., Rolls E.T. Computational constraints suggest the need for two distinct input systems to the hippocampal CA3 network. Hippocampus. 1992. 2: 189–199.
Vanderwolf C. Hippocampal electrical activity and voluntary movement in the rat. Electroencephalogr. Clin. Neurophysiol. 1969. 26: 407–418.
Vinogradova O.S. Expression, control, and probable functional significance of the neuronal theta-rhythm. Prog. Neurobiol. 1995. 45: 523–583.
Vinogradova O.S. Hippocampus as comparator: role of the two input and two output systems of the hippocampus in selection and registration of information. Hippocampus. 2001. 11: 578–598.
Womelsdorf T., Fries P., Mitra P.P., Desimone R. γ-band synchronization in visual cortex predicts speed of change detection. Nature. 2006. 439: 733–736.
Wulff P., Ponomarenko A.A., Bartos M., Korotkova T.M., Fuchs E.C., Bähner F., Both M., Tort A.B., Kopell N.J., Wisden W., Monyer H. Hippocampal theta rhythm and its coupling with γ oscillations require fast inhibition onto parvalbumin-positive interneurons. Proc. Natl. Acad. Sci. U.S.A. 2009. 106: 3561–3566.
Zheng C., Bieri K.W., Hwaun E., Colgin L.L. Fast Gamma Rhythms in the Hippocampus Promote Encoding of Novel Object-Place Pairings. eNeuro. 2016. 3 (2). pii: ENEURO.0001-16.2016.
Дополнительные материалы отсутствуют.
Инструменты
Журнал высшей нервной деятельности им. И.П. Павлова


