Журнал высшей нервной деятельности им. И.П. Павлова, 2020, T. 70, № 2, стр. 277-288
СРАВНИТЕЛЬНЫЙ АНАЛИЗ ИНФОРМАТИВНОСТИ МЕТОДОВ ОЦЕНКИ ПОЛОВОГО ПОВЕДЕНИЯ САМЦОВ КРЫС
С. Н. Субботина 1, *, А. А. Парфёнова 1, М. А. Юдин 1, А. Ф. Быкова 1
1 ФГБУ “Государственный научно-исследовательский испытательный институт военной медицины”
Министерства обороны Российской Федерации
Санкт-Петербург, Россия
* E-mail: gniiivm_15@mil.ru
Поступила в редакцию 15.04.2019
После доработки 28.08.2019
Принята к публикации 16.09.2019
Аннотация
В статье рассмотрены проблемы интерпретации результатов, полученных при оценке полового поведения грызунов на различных экспериментальных моделях. Показана низкая информативность методов с ограниченной длительностью тестирования. В качестве одного из способов повышения информативности тестов предложено проведение оценки не абсолютных, а относительных величин полученных показателей. Высокая вероятность обнаружения активирующего действия лекарственных средств показана при использовании экспериментальной модели, отражающей завершенный цикл полового поведения. Отмечено, что на животных с естественным высоким уровнем половой активности и наличием предшествующего полового опыта не целесообразно проводить оценку мотивационного компонента полового поведения по общепринятому показателю – латентному периоду садок или садок с интромиссиями. Показана перспективность использования модели “Камера с преградой” для изучения мотивации.
В связи с увеличением доли лиц с патологией репродуктивной системы и ростом количества различных нарушений полового поведения поиск новых средств и методов фармакологической коррекции изменений в сексуальной сфере приобретает все большее фундаментальное и практическое значение. Социальная значимость проблемы сексуальных дисфункций определяет актуальность разработки различных экспериментальных моделей полового поведения, позволяющих проводить оценку эффективности и безопасности новых лекарственных средств. Возможность такого моделирования основывается на общих принципах биологической регуляции паттернов сексуального поведения у людей и животных [Pfaus at al., 2003]. В условиях эксперимента значительно легче найти корреляцию между изменениями отдельных паттернов поведения и факторами различной этиологии, основываясь на статистических показателях поведения. В то же время при моделировании и анализе эффектов новых лекарственных средств необходимо учитывать структуру полового поведения животных, в которой выделяют несколько физиологических процессов: поисковая (мотивационная) фаза – фаза направленного поиска объекта, обладающего необходимыми стимульными свойствами, фаза генитальной стимуляции, длительность которой обратно пропорциональна уровню возбуждения, консумматорная фаза – завершающаяся эякуляцией фаза спаривания, фаза покоя (рефрактерная фаза) – состояние сексуальной удовлетворенности [Белозерцева, 2013].
В настоящее время разработан ряд общепринятых методик для исследования компонентов полового поведения экспериментальных животных. При исследовании мотивационной составляющей у грызунов используют: двухуровневые камеры [Van Furth, 1996b; Mendelson, Pfaus, 1989], камеры с перегородкой [Амстиславская, Осипов, 2003; Тихонова, Амстиславская, 2015], тест “открытого поля” [Van Furth, Van Ree, 1996а; Бугаева и др., 2004; Гетманенко и др., 2016], камеры с преградой [Буреш и др., 1991]. Половую мотивацию оценивают по показателям процептивного поведения (поведенческие реакции, побуждающие партнера спариваться): латентный период облизывания, обнюхивания, груминг, время, проведенное у перегородки, за которой находится рецептивная самка (в случае использования камеры с перегородкой), латентный период и количество переходов в отсек с рецептивной самкой (в случае использования камеры с преградой); по показателям прекопуляторного поведения: латентный период садок и интромиссий; по показателям копуляторного поведения: количество копулятивных серий в завершенном цикле, длительность межэякуляторных интервалов.
При исследовании собственно полового поведения экспериментальных животных принимаются во внимание их видоспецифические особенности. У грызунов сложный цикл полового поведения самца слагается из простых циклов – копулятивных серий, представляющих собой последовательность попыток садок и садок с интромиссиями, завершающихся садкой с эякуляцией. Количество копулятивных серий в цикле зависит от множества факторов: генотипа [Тихонова, Амстиславская, 2015], предшествующего полового опыта [Амстиславская и др., 2010], депримирующих факторов, обстановочных стимулов теста, поведения самки [Pfaus at al., 2012]. Изучение полового поведения крыс проводится методами с различной длительностью наблюдения – от 15 мин [Agmo, 1997] до достижения самцом полового истощения (метод завершенного цикла полового поведения) [Белозерцева и др., 2016]. Для оценки психостимулирующего действия лекарственных средств используют метод с предварительным снижением половой активности самца с помощью проведения процедуры “полового истощения” [Белозерцева и др., 2000]. Критерием завершения цикла (показателем полового “истощения” или “удовлетворения”) в условиях эксперимента принято считать отсутствие активности, направленной на самку, в течение 30 мин.
Сложная организация полового поведения самцов крыс определяет широкий спектр оцениваемых в эксперименте показателей: потенция самца и его психофизическая готовность реагировать на раздражитель оценивается по скорости инициации спаривания (латентный период садки и садки с интромиссией); уровень полового возбуждения – по частоте интромиссий или скорости копуляции (количество интромиссий за единицу времени) и коэффициенту эффективности садок (количество садок с интромиссиями, отнесенное к общему числу попыток садок и садок с интромиссиями); уровень генитальной стимуляции, обеспечивающей эякуляцию – по количеству интромиссий; длительность постэякуляторных рефрактерных периодов отражает действие эякуляций на механизм возбуждения. Для оценки функционального состояния копулятивно-эякулятивного механизма самцов используют такие показатели, как уровень генитальной стимуляции и длительность копулятивных серий. Многие авторы сходятся во мнении, что при оценке влияния лекарственных средств на половую функцию животных необходимо проводить анализ не изолированных показателей полового поведения, а их сопряженные изменения [Белозерцева, 2013].
Многообразие методов, а также показателей, оцениваемых в эксперименте, не избавляет исследователей от трудностей при интерпретации полученных результатов, что связано чаще всего с ошибочным выбором критериев оценки, длительности наблюдения, статистической обработкой данных и пр. Вероятность обнаружения как активирующего, так и угнетающего действия фармакологических средств на половую активность напрямую зависит от правильности выбора экспериментальной модели. В этой связи целью исследования являлось проведение сравнительного анализа информативности различных экспериментальных методов по оценке полового поведения при введении самцам крыс лекарственного средства, оказывающего стимулирующее влияние на их половую активность.
МЕТОДИКА
Исследования выполнены на 115 белых беспородных крысах обоего пола, полученных из питомника “Рапполово”. Эксперименты проводили в соответствии с Правилами надлежащей лабораторной практики (Приказ Министерства здравоохранения РФ от 1 апреля 2016 г. N 199н). Исследование одобрено Комитетом по этике биомедицинских исследований ФГБУ “ГНИИИ ВМ” МО РФ о соответствии планируемого экспериментального исследования гуманистическим и этическим нормам (протокол № 4 от 10.04.2018 г.).
Тестирование животных осуществляли в лабораторных условиях при температуре 18–24°С, относительной влажности 40–80%. Исключали воздействие постороннего шума и прочих раздражителей, не допускали присутствия в лаборатории животных других видов. В течение 2 нед до начала тестирования животных содержали в виварии с реверсивным светом и свободным доступом к воде и пище. Цель использования реверсивного света заключалась в формировании у крыс новых циркадных ритмов. Известно, что грызуны являются “ночными” животными, наибольшая интенсивность основных биологических процессов которых характерна для темного времени суток (в том числе и процессов, связанных с размножением). В связи с этим животных за 14 сут до начала эксперимента размещали в специально затемненном помещении с искусственным освещением. Цикл освещенности помещения, где размещались экспериментальные животные, включал 2 фазы: темная фаза с 10 ч до 22 ч, светлая фаза с 22 ч до 10 ч. Опыты проводили в течение темной фазы суточного цикла при тусклом красном освещении.
Подготовка экспериментальных животных к тестированию заключалась в формировании устойчивого уровня их половой активности. Подготовку самок осуществляли по модифицированной методике путем овариэктомии [Буреш и др., 1991; Jones et al., 2017; Цветкова, 2017]. Рецептивность самок достигали последовательным подкожным введением масляного раствора β-эстрадиола (“Sigma Aldrich”, США) в дозе 50 мкг на крысу в первый день цикла и масляного раствора прогестерона (“Дальхимфарм”, Россия) в дозе 500 мкг на крысу в третий день цикла. Рецептивность самок подтверждали вагинальным мазком и выраженностью лордоза. Через 7 сут после начала гормональной терапии (по завершению двух эстральных циклов), когда устанавливался регулярный половой цикл, приступали к тренировкам половой активности крыс-самок. Тренировка заключалась в подсадке к самке с гормонально вызванным эструсом самца с предшествующим половым опытом. За период 30-минутной экспозиции фиксировали компоненты полового поведения самок (замирание, вздрагивание, лордоз) и компоненты их антагонистического поведения по отношению к самцам (стойки, вокализация, удары задними лапами). По результатам трех экспозиций для дальнейшего исследования отбирали самок с выраженной рецептивностью и отсутствием антагонистичного поведения. Для экспериментальных исследований было отобрано 40 особей. Эксперименты проводили в третий день цикла спустя 4 ч после введения прогестерона.
Подготовка самцов крыс заключалась в последовательных тренировках, целью которых являлось формирование полового опыта животных. Тренировки проводили два раза в неделю на протяжении двух недель. Тренировка состояла в подсадке к самцу рецептивной самки на период 15 мин. Регистрировали элементы полового поведения: латентный период, число садок, интромиссий, количество эякуляций. В эксперименте использовали “клинически” здоровых половозрелых самцов с массой тела 180–300 г и высоким стабильным уровнем половой активности (1–2 эякуляции за период теста). Для экспериментальных исследований было отобрано 60 особей. Формирование групп осуществляли из животных с близкими средними значениями показателей полового поведения. Каждая контрольная и опытная группа включала шесть самцов крыс. В каждом экспериментальном тестировании использовались новые животные, не участвующие в предыдущих опытах.
Основным инструментом анализа информативности используемых в работе методов являлась сравнительная оценка полового поведения самцов крыс на фоне введения лекарственного средства, оказывающего стимулирующее влияние на половую функцию. В качестве такого средства использовали антагонист α2-адренорецепторов и агонист имидазолиновых рецепторов – йохимбина гидрохлорид (субстанция Sigma Aldrich) в дозе 2.6 мг/кг. Расчет дозы проводили на основании максимальной суточной дозы для человека с использованием межвидовых коэффициентов пересчета доз [Хабриев, 2005]. Препарат вводили самцам крыс опытных групп при всех вариантах тестирования однократно внутрижелудочно за 30 мин до эксперимента из расчета 1 мл на 100 г веса животного. Животные контрольных групп получали внутрижелудочно воду для инъекций в аналогичном объеме.
Половое поведение крыс изучали с использованием батареи тестов, позволяющих количественно оценить выраженность половой мотивации и сексуальной активности самцов крыс по показателям, характеризующим копуляторное поведение животных:
– оценка половой активности в течение 15-минутного парного взаимодействия самца с самкой (Тест 1);
– оценка половой активности в течение 30-минутного парного взаимодействия самца с самкой (Тест 2);
– оценка половой активности при парном взаимодействии самца с самкой до достижения самцом состояния “полового истощения” (Тест 3);
– оценка половой активности при парном взаимодействии самца с самкой после проведения процедуры “полового истощения” самца (Тест 4);
– оценка половой мотивации самца с помощью установки “Камера с преградой” (Тест 5).
В тестах 1–4 регистрировали показатели полового поведения животных: латентный период первой садки с интромиссией (ЛП интр., мин), количество интромиссий в каждой копулятивной серии, количество копулятивных серий, количество эякуляций, длительность взаимодействия самца с самкой (мин), длительность рефрактерных периодов между копулятивными сериями (мин), рассчитывали показатель частоты интромиссий, общее количество интромиссий, общее время копулятивной активности самца (мин).
В тесте 3 критериями завершения полового цикла (или критериями достижения состояния “полового истощения”) считали: отсутствие активности у самца в течение 30 мин после последней эякуляции (критерий насыщения), отсутствие копуляции в течение 60 мин после предъявления рецептивной самки (критерий инертности) или отсутствие эякуляции при сохранении копулятивной активности более 60 мин (критерий несостоятельности).
В тесте 4 введение йохимбина осуществляли сразу после достижения самцом одного из критериев “полового истощения”. Регистрацию показателей полового поведения самца проводили через 30 мин после введения лекарственного средства с новой рецептивной самкой.
В тесте 5 использовали установку “Камера с преградой”, с помощью которой оценивали мотивационную составляющую полового поведения самцов крыс. В основе методики лежало формирование у крыс мотивированного поведения, поддерживаемого положительным подкреплением (рецептивная самка в противоположном отсеке камеры). Во время обучения крысу обучали перебегать из одного отсека камеры в противоположный, где находилась рецептивная самка, по тоннелю с электрифицированным решетчатым полом при отсутствии электростимуляции. Для тестирования отбирали самцов с устойчивым навыком преодолевать тоннель между двумя отсеками. Для экспериментальных исследований было отобрано 15 особей. Общая длительность опытного тестирования составляла 20 мин. Во время тестирования первую побежку в отсек с рецептивной самкой осуществляли при отсутствии электростимуляции. В течение остального периода тестирования на решетку подавали ток силой 0.5 мА. В случае перехода самца через тоннель с включенным электрифицированным полом длительность пребывания самца в отсеке с рецептивной самкой ограничивали временем, требующимся самцу на совершение 3 садок с интромиссиями. Затем самца возвращали в исходный отсек. Регистрировали количество побежек в отсек с подкреплением и латентный период входа в тоннель. По готовности самцов преодолевать заряженную решетку пола для получения подкрепления судили о мотивационном компоненте полового поведения.
Статистическую обработку данных проводили с использованием пакета программ Statistica 10.0 и Excel 2010. Полученные данные выражали в виде медианы и процентилей [25; 75]. Для анализа данных использовали непараметрические методы статистики: для сравнения количественных показателей – критерий Манна–Уитни, для сравнения качественных показателей – критерий χ2 и точный метод Фишера. Критическое значение уровня статистической значимости принимали равным 0.05. Долю животных представляли в виде: количество животных с признаком по отношению к общему количеству животных в группе. Анализ взаимосвязи признаков проводили с использованием метода Спирмена. Сравнительный анализ времени до события осуществляли с помощью метода Каплана–Майера (Statistica 10.0).
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЙ
Сравнительный анализ копуляторного поведения самцов крыс в тестах 1–4 показал высокую значимость выбора длительности тестирования для оценки стимулирующих эффектов йохимбина (табл. 1).
Таблица 1.
Характеристика копуляторного поведения самцов крыс при парном взаимодействии с рецептивной самкой в тестах 1–4. Количество животных в каждой группе n = 6 Table 1. Characteristics of the copulatory behavior of male rats in paired interaction with a receptive female in tests 1–4. Number of animals in each group n = 6
| Показатель полового поведения | Группа | Тест 1 | Тест 2 | Тест 3 | Тест 4 |
|---|---|---|---|---|---|
| ЛП интр., мин | Контроль | 0.02 [0.02; 0.03] | 0.05 [0.03; 0.08] | 0.03 [0.02; 0.03] | 0.6 [0.15; 1.50] |
| Йохимбин | 0.15 [0.10; 0.20] | 0.06 [0.03; 0.13] | 0.06 [0.03; 0.10] | 1.4 [1.18; 2.35] | |
| Общее количество интромиссий | Контроль | 23.0 [16.0; 28.0] | 29.5 [27.0; 41.0] | 65.5 [56.0; 80.0] | 29.0 [4.0; 45.0] |
| Йохимбин | 27.5 [17.0; 37.0] | 36.5 [35.0; 40.0] | 62.5 [58.0; 68.0] | 40.5 [30.0; 67.0] | |
| Общее время копулятивной активности, мин | Контроль | 7.4 [5.2; 10.1] | 11.4 [8.1; 13.4] | 62.7 [32.6; 84.7] | 30.6 [15.6; 60.0] |
| Йохимбин | 10.8 [8.4; 11.9] | 14.2 [13.4; 14.5] | 93.1 [46.6; 113.0] | 63.8* [60.0; 84.8] | |
| Частота интромиссий, ед/мин | Контроль | 2.9 [2.7; 3.4] | 3.6 [3.5; 4.4] | 1.5 [0.8; 1,7] | 1.4 [0.5; 2.1] |
| Йохимбин | 2.8 [2.2; 3.3] | 2.8 [2.4; 3.4] | 0.7* [0.5; 1.2] | 0.5 [0.4; 0.8] | |
| Количество копулятивных серий | Контроль | 2.0 [2.0; 3.0] | 3.5 [3.0; 4.0] | 6.0 [6.0; 8.0] | 1.5 [1.0; 2.0] |
| Йохимбин | 2.0 [2.0; 3.0] | 4.0* [4.0; 5.0] | 9.0* [9.0; 10.0] | 3.0 [1.0; 3.0] | |
| Количество эякуляций | Контроль | 2.0 [2.0; 2.0] | 3.5 [2.0; 4.0] | 5.5 [5.0; 8.0] | 1.0 [1.0; 2.0] |
| Йохимбин | 2.0[1.0; 2.0] | 4.0 [4.0; 4.0] | 9.0* [8.0; 9.0] | 2.0 [1.0; 2.0] |
В тестах 1 и 2 отмечали отсутствие статистически значимых отличий показателей копулятивного поведения самцов между контрольными и опытными значениями. Во всех экспериментальных группах регистрировали высокую скорость инициации спаривания и скорость копуляции, оцениваемые по показателям латентный период садок с интромиссиями и частота интромиссий соответственно. Стимулирующие эффекты йохимбина на половое поведение самцов выявляли только по показателю количество копулятивных серий в тесте 2 (при р < 0.04). При этом различие с контролем значений показателя количество эякуляций в тесте 2 не достигло статистической значимости.
Стимулирующее влияние йохимбина на половое поведение самцов отмечали в тесте 3, что выражалось в практически двукратном снижении частоты интромиссий, 1.5-кратном увеличении количества копулятивных серий и эякуляций относительно контрольной группы.
При тестировании животных после достижения “полового истощения” (Тест 4) в ряде наблюдений фиксировали прирост времени копулятивной активности самцов за счет доли животных без эякуляции при сохранении копулятивной активности более 60 мин (критерий несостоятельности). Отмечали увеличение количества копулятивных серий и эякуляций, но различия значений с контролем статистически были незначимы.
С целью оценки уровня информативности тестов ограниченной длительности (15 мин) был проведен сравнительный анализ половой активности самцов в тестах 1–4 по показателю время копулятивной активности в течение первых 15 мин после предъявления рецептивной самки. Значения показателя в опытных группах находились в диапазоне 7.6–10.8 мин, в группах контроля диапазон значений составил 6.7–13.7 мин. Результаты оценки свидетельствовали об отсутствии возможности выявления стимулирующих эффектов йохимбина на копуляторное поведение самцов в начале полового цикла.
Анализ относительных величин показателей полового поведения самцов крыс позволил выявить активирующее действие йохимбина в тестах небольшой длительности (рис. 1). На примере показателя относительное время отдыха показано стимулирующее влияние йохимбина на потенцию самцов. Это выражалось в статистически значимом снижении значений показателя в тестах 1 и 4 (при p = = 0.05 и р = 0.02 соответственно).
Рис. 1.
Относительное время отдыха (%) самцов крыс во время парного взаимодействия с рецептивной
самкой в тестах 1–4. * – значимые отличия от показателя животных контрольных групп,
p < 0.05. Количество животных в каждой группе n = 6. Легенда:  – среднее значение;
– среднее значение;  – среднее значение ± стандартное отклонение;
– среднее значение ± стандартное отклонение;  – среднее значение ± 1.96 стандартное отклонение. 1, 2, 3, 4 – номер теста; К – контрольная
группа животных; О – опытная группа животных.
– среднее значение ± 1.96 стандартное отклонение. 1, 2, 3, 4 – номер теста; К – контрольная
группа животных; О – опытная группа животных.
Fig. 1. The relative rest time (%) of male rats during pairing with a receptive female in
tests 1–4. * – significant differences from control, p < 0.05. Number of animals in each group n = 6. Legend:  – mean;
– mean;  – mean ± standard deviation;
– mean ± standard deviation;  – mean ± ± 1.96*standard deviation. 1, 2, 3, 4 – test number; K – control group of
animals; O – experimental group of animals.
– mean ± ± 1.96*standard deviation. 1, 2, 3, 4 – test number; K – control group of
animals; O – experimental group of animals.
При оценке уровня возбуждения самцов крыс по показателям длительности постэякуляторного рефрактерного периода (РП) продемонстрирована возможность выявления позитивных эффектов фармакологических агентов в тестах 1–3 (рис. 2).
Рис. 2.
Длительность рефрактерного периода (РП) у самцов крыс при парном взаимодействии с
рецептивной самкой в тестах 1–4. По оси абсцисс: количество завершенных копулятивных
серий в течение всего периода тестирования. Данные представлены в виде медианы. *
– значимые отличия от показателей животных контрольных групп, p < 0.05. Животные, не закончившие последнюю серию, из подсчета исключались. Легенда:
 – медиана;
– медиана;  – межквартильный интервал 25%–75%;
– межквартильный интервал 25%–75%; 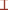 – диапазон значений: минимум – максимум.
– диапазон значений: минимум – максимум.
Fig. 2. The duration of the refractory period in male rats with paired interaction with a
receptive female in tests 1–4. Х-asis: the number of completed copulative episodes
during the entire testing period. Data are presented as medians. * – significant differences
from the animals of the control groups, p < 0.05. Animals that did not complete the last series were excluded from the calculation.
Legend:  – median;
– median;  – interquartile range 25%–75%;
– interquartile range 25%–75%;  – range of values: minimum – maximum.
– range of values: minimum – maximum.
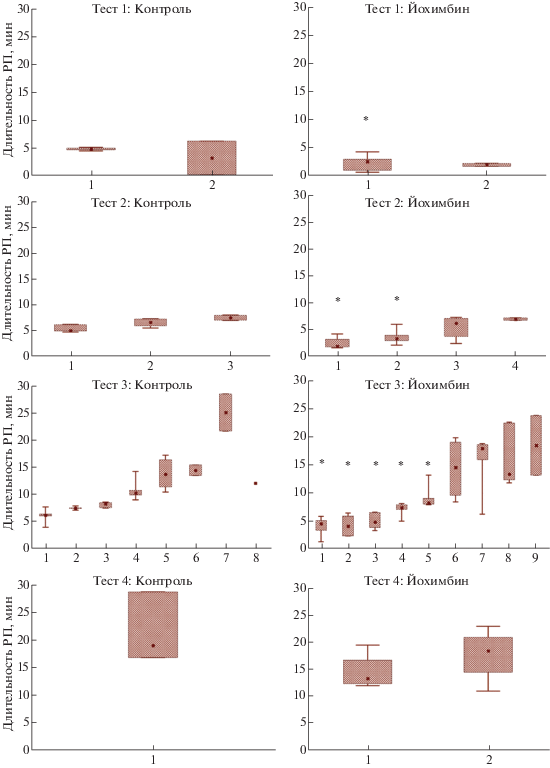
Статистически значимое снижение длительности РП в опытных группах фиксировали в тестах 1, 2 и 3 после первой, первой и второй, первой-пятой копулятивной серии соответственно. Следует учесть, что отсутствие значимости показателя после 3–4 копулятивной серии в тесте 2 и 6–9 копулятивной серии в тесте 3 связано со снижением доли животных с признаком в контрольной группе, что не позволило провести статистическое сравнение значений показателя.
Анализ изменения показателей “Количество копулятивных серий и эякуляций” показал высокую информативность теста 3 по сравнению с другими используемыми в работе методами. В табл. 2 приведены данные о влиянии йохимбина на количество копулятивных серий, совершенных самцами за период тестирования в тестах 1–4. Данные представлены в виде доли животных в группе, выполнивших определенное количество копулятивных серий.
Таблица 2.
Доля животных, совершивших копулятивные серии (с учетом незаконченных) при разных вариантах тестирования. Доля представлена в виде: количество животных с признаком по отношению к общему количеству животных в группе Table 2. The proportion of animals that committed the copulative series (including unfinished ones) with different testing options. The proportion is presented in the form: the number of animals is a symptom in relation to the total number of animals in the group
| Копуля-тивная серия | Группа | Тест 1 | Тест 2 | Тест 3 | Тест 4 |
|---|---|---|---|---|---|
| 1 | Контроль | 6/6 | 6/6 | 6/6 | 6/6 |
| Йохимбин | 6/6 | 6/6 | 6/6 | 6/6 | |
| 2 | Контроль | 5/6 | 6/6 | 6/6 | 3/6 |
| Йохимбин | 6/6 | 6/6 | 6/6 | 3/6 | |
| 3 | Контроль | 2/6 | 6/6 | 6/6 | 0/6 |
| Йохимбин | 2/6 | 6/6 | 6/6 | 3/6* (p ≤ 0.05) | |
| 4 | Контроль | – | 4/6 | 6/6 | – |
| Йохимбин | – | 6/6 | 6/6 | – | |
| 5 | Контроль | – | 0/6 | 6/6 | – |
| Йохимбин | – | 2/6 | 6/6 | – | |
| 6 | Контроль | – | – | 5/6 | – |
| Йохимбин | – | – | 6/6 | – | |
| 7 | Контроль | – | – | 2/6 | – |
| Йохимбин | – | – | 6/6* (p ≤ 0.01) | – | |
| 8 | Контроль | – | – | 2/6 | – |
| Йохимбин | – | – | 5/6 | – | |
| 9 | Контроль | – | – | 1/6 | – |
| Йохимбин | – | – | 5/6* (p ≤ 0.02) | – | |
| 10 | Контроль | – | – | 0/6 | – |
| Йохимбин | – | – | 2/6 | – |
На фоне развивающегося ингибирующего действия эякуляций на механизм возбуждения самцов стимулирующее влияние йохимбина отмечали в тестах 3 и 4 в 7–9 и 3 копулятивных сериях соответственно. Аналогичные результаты были получены при анализе количества эякуляций, совершенных самцами за период тестирования, в тестах 1–4.
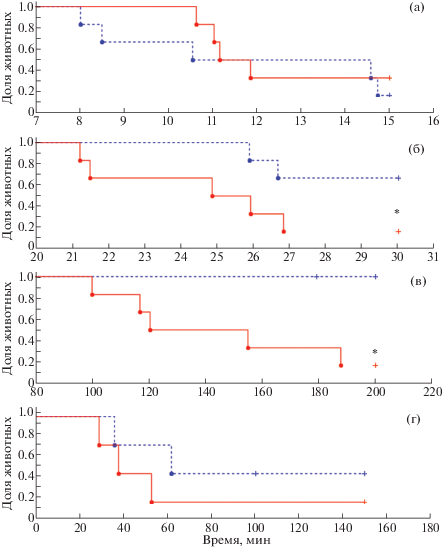
На примере распределения животных в контрольных и опытных группах по показателю “длительность завершающей копулятивной серии” (латентный период эякуляции) при различных вариантах тестирования показана высокая информативность тестов 2 и 3. Отмечали статистически значимое позитивное влияние йохимбина на потенцию самцов в середине (тесты 2 и 3) и конце полового цикла (тест 3) (рис. 3 (б), (в)). Высокий уровень естественной половой активности в начале копуляторного цикла (тест 1) и низкая стимулирующая эффективность йохимбина на возобновление половой активности самцов через 60 мин после достижения ими состояния “полового истощения” (тест 4) не позволили получить статистически значимых различий показателя от контрольных значений (рис. 3 (а), (г)). На рисунке для большей наглядности в качестве завершающей копулятивной серии представлены серии № 2, 4, 9 и 2 для тестов 1, 2, 3 и 4 соответственно.
Рис. 3.
Доля животных и латентный период эякуляций в завершающей копулятивной серии при различных
вариантах тестирования: (а) – вторая копулятивная серия в тесте 1; (б) – четвертая
копулятивная серия в тесте 2; (в) – девятая копулятивная серия в тесте 3; (г) – вторая
копулятивная серия в тесте 4. Распределение длительностей латентных периодов эякуляций
представлены в виде кривых Каплана–Майера. Легенда: • – обозначены животные, закончившие
копулятивную серию эякуляцией; + – обозначены животные без эякуляции; * – значимые
отличия от показателя животных контрольных групп, p < 0.05;  – контроль;
– контроль;  – йохимбин.
– йохимбин.
Fig. 3. Share of animals and latent period of ejaculation in the final copulative series
in various tests: (а) – second copulative series in test 1; (б) – fourth copulative
series in test 2; (в) – ninth copulative series in test 3; (г) – second copulative
series in test 4. The distribution of the durations of latent periods of ejaculation
are presented in the form of Kaplan–Meier curves. Legend: • – marked animals that
completed the copulative series of ejaculation; + – marked animals without ejaculation;
* – significant differences from the animals of the control groups, p < 0.05;  – the control;
– the control;  – yohimbine.
– yohimbine.
Оценку уровня половой мотивации самцов крыс в настоящей работе проводили по данным теста 3, отражающего полный цикл полового поведения самцов, и теста 5, показателями мотивации в котором являлись латентный период перехода в тоннель с электрифицированным полом и количество переходов в отсек с рецептивной самкой. Информативность тестов определяли по статистически значимым изменениям показателей мотивации через 30 мин после введения йохимбина (табл. 3).
Таблица 3.
Изменение показателей половой мотивации самцов крыс на фоне введения йохимбина. Доля представлена в виде: количество животных с признаком по отношению к общему количеству животных в группе. Количество животных в каждой группе n = 6 Table 3. Change in sexual motivation indicators of male rats on the background of yohimbine injection. The proportion is presented in the form: the number of animals is a symptom in relation to the total number of animals in the group. Number of animals in each group n = 6
| Группа | Тест 3 | Тест 5 | ||||
|---|---|---|---|---|---|---|
| ЛП интр, мин | Кол-во копулятивных серий | Доля животных, совершивших 8 и более копулятив-ных серий # | ЛП перехода, мин | Кол-во переходов | Доля животных, совершивших переход | |
| Контроль | 0.03 [0.02; 0.03] | 6.0 [6.0; 8.0] | 2/6 | 20.0 [1.3; 20.0] | 0.0 [0.0; 1.0] | 2/6 |
| Йохимбин | 0.06 [0.03; 0.10] | 9.0* [9.0; 10.0] | 5/6 | 2.0 [1.3; 2.4] | 6.5* [5.0; 10.0] | 6/6* |
Примечания: 1. – * – отличия от контрольных значений, p ≤ 0.02; 2. – # – для определения количества копулятивных серий использовали интервальную оценку показателя количество копулятивных серий в группе с введением йохимбина. Диапазон доверительного интервала составил 7.9–10.1. Считали, что все значения, находящиеся в пределах доверительного интервала, соответствуют развитию половой мотивации, значения ниже нижней границы интервала – отсутствию признака.
Notes: 1. – * – differences from control values, p ≤ 0.02; 2. – # – to determine the number of copulative series, we used an interval estimate of the indicator “number of copulative series” in the group with the introduction of yohimbine. The confidence interval range was 7.9–10.1. It was believed that all values within the confidence interval correspond to the development of sexual motivation, values below the lower boundary of the confidence interval correspond to the absence of a sing.
Йохимбин усиливал мотивацию самцов в исследуемых тестах по количеству копулятивных серий (тест 3) и количеству переходов (тест 5). Сравнение групп по качественному признаку (частота встречаемости признака) показало, что применение теста 5 позволяет выявить статистически значимые различия значений показателя с группой контроля. 10-кратное снижение значения показателя “латентный период перехода в отсек” с рецептивной самкой в опытной группе не достигло уровня статистической значимости (р = 0.22). Показатель прекопуляторного поведения (латентный период садок с интромиссиями) не изменялся на фоне введения йохимбина (p = 0.26), корреляционных связей с другими показателями не выявляли.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Оценка половой активности самцов крыс по показателям копуляторного поведения в тестах различной длительности показала высокую значимость выбора длительности тестирования. Отсутствие статистических различий показателей при кратковременном тестировании прежде всего были связаны с высоким уровнем половой активности животных, о чем свидетельствовали отсутствие садок без интромиссий, высокая скорость инициации спаривания, большие значения скорости копуляции. Важным фактором, осложняющим интерпретацию результатов по оценке стимулирующих эффектов йохимбина в начале полового цикла, являлось наличие у самцов предшествующего сексуального опыта. Известно, что поведение сексуально опытных самцов сложнее изменить, воздействуя на них фармакологически [Pfaus et al., 2012]. Отсутствие статистических различий при оценке показателя “время копулятивной активности животных” в тестах 1–4 в течение первых 15 мин после предъявления рецептивной самки, а также высокая скорость инициации спаривания затрудняли выявление стимулирующих эффектов йохимбина в тестах ограниченной длительности. Позитивное фармакологическое действие α2-адреноблокатора проявлялось только в отношении показателя “количество копулятивных серий”, совершенных в течение первых 30 мин после предъявления рецептивной самки (Тест 2). Количество эякуляций при этом значимо не отличалось от контроля, что могло быть обусловлено недостаточной продолжительностью тестирования.
Низкая информативность ограниченных временем тестов, как правило, связана с ошибочностью проведения количественной оценки абсолютных величин показателей полового поведения в отдельности. Любое изменение характера полового поведения автоматически приводит к изменению сопряженных показателей. Например, продолжительное взаимодействие самцов с рецептивными самками приводит к увеличению как количества интромиссий, необходимых для достижения эякуляции, так и длительности копулятивных серий. В связи с этим для выявления фармакологических эффектов в кратковременных тестах необходима оценка не абсолютных, а относительных величин показателей. На примере показателя “относительное время отдыха” продемонстрирована возможность выявления активирующего действия йохимбина в тестах небольшой длительности.
Наибольшая информативность по оценке биологической активности йохимбина показана для метода парного взаимодействия самца с самкой до достижения самцом состояния “полового истощения” (Тест 3). Уровень генитальной стимуляции, необходимый для достижения порога эякуляции и определяемый по общему количеству совершенных интромиссий, был практически вдвое ниже в опытной группе, при этом отмечали увеличение количества копулятивных серий и эякуляций. Полученные данные подтверждают мнение о том, что вероятность обнаружения активирующего действия лекарственных средств выше при анализе изменений в середине и на заключительных стадиях цикла полового поведения, когда активность животных снижена.
Тестирование животных после достижения “полового истощения” (Тест 4) не позволило выявить позитивных эффектов α2-адреноблокатора. Увеличение времени активности и незначительное снижение длительности периода восстановления копулятивной активности самцов отмечали в единичных случаях. Это противоречит данным И. Белозерцевой, в которых отмечено, что с использованием такой экспериментальной процедуры препарат в дозе 2 мг/кг значимо увеличивал долю сексуально активных самцов, скорость инициации спаривания, уровень генитальной стимуляции и среднее число эякуляций, необходимое для достижения полового насыщения [Белозерцева, 2013].
При оценке уровня возбуждения животных по показателю “длительность постэякуляторного рефрактерного периода” тесты 1–2 обладали схожей информативностью. Во всех экспериментальных группах отмечали более быстрое восстановление половой активности самцов после совершенной эякуляции. Наиболее полную информацию о характере влияния йохимбина на длительность восстановления половой активности самцов крыс получили в тесте 3, дающем представление о завершенном цикле полового поведения. Статистически значимые различия показателя с контрольными значениями отмечали после 1–5 копулятивных серий.
Оценка уровня половой мотивации самцов крыс в тестах 3 и 5 показала перспективность изучения стимулирующих эффектов фармакологических средств с помощью установки “Камера с преградой”. Об этом свидетельствовало наличие статистически значимых отличий от контрольных значений такого показателя половой мотивации, как количество переходов в отсек с рецептивной самкой. Сравнение групп по качественному признаку “доля животных, совершивших переход” также указывало на усиление половой мотивации у животных с введением йохимбина. Увеличение выборки животных, возможно, позволило бы получить достоверное подтверждение стимулирующего влияния йохимбина на половую мотивацию самцов по показателю теста 5 – “латентный период перехода в тоннель с электрифицированным полом”. Сравнительный анализ качественных признаков, полученных в результате проведения тестов 3 и 5, показал отсутствие статистической значимости между этими показателями, что позволяет говорить о взаимозаменяемости тестов при оценке половой мотивации самцов крыс в эксперименте.
Отсутствие корреляционных связей между показателем “латентный период садок с интромиссиями” и другими исследуемыми показателями может свидетельствовать о его низкой информативности в отношении мотивированного поведения самцов с высоким уровнем половой активности.
ЗАКЛЮЧЕНИЕ
Таким образом, сравнительный анализ информативности методов оценки полового поведения у животных показал низкую информативность тестов ограниченной длительности. Одним из способов повышения информативности ограниченных временем тестов является проведение оценки не абсолютных величин показателей, а их отнесенное ко времени количество. Вероятность обнаружения активирующего действия лекарственных средств значительно выше при использовании метода завершенного цикла полового поведения. Этот метод позволяет оценить стимулирующие эффекты препаратов на фоне общего утомления, наступающего вследствие интенсивности и энергоемкости совершаемых действий.
Если задачей исследования является оценка половой мотивации, то выбор метода исследования может быть ограничен небольшой длительностью тестирования. Высокая скорость инициации полового взаимодействия служит маркером выраженности мотивации животных. Однако на экспериментальных моделях с использованием самцов с высоким уровнем активности и предшествующим половым опытом этот показатель теряет свою информативную значимость. Наличие статистически значимых отличий показателей половой мотивации от контрольных значений в тесте 5, а также отсутствие отличий по качественному признаку (сравнение доли животных с признаком в тестах 3 и 5) позволяет рекомендовать применение метода “Камера с преградой” для оценки половой мотивации у животных.
Список литературы
Амстиславская Т.Г., Гладких Д.В., Белоусова И.И., Маслова Л.Н., Попова Н.К. Влияние сексуального опыта на половое мотивационное и копуляторное поведение самцов крыс. Российский физиологический журнал им. И.М. Сеченова. 2010. 96 (2): 154–162.
Амстиславская Т.Г., Осипов К.В. Половая активация самцов крыс: поведение и гормональный ответ. Бюл. СОРАМН. 2003. 3: 112–114.
Белозерцева И.В., Драволина О.А., Кривов В.О., Тур М.А., Полушин Ю.С. Экспериментальное моделирование послеоперационных когнитивных расстройств у крыс. Вестник анестезиологии и реаниматологии. 2016. 13 (5): 37–49.
Белозерцева И.В. К методике изучения фармакологической активации полового поведения самцов крыс. Журн. высш. нервн. деят. им. И.П. Павлова. 2000. 50 (4): 724–729.
Белозерцева И.В. Экспериментальная фармакология полового поведения. В кн. Фармакология поведения. Хрестоматия. Под ред. А.Ю. Беспалова, Э.Э. Звартау, П. Бирдсли, Д. Катца. СПб.: Издательство СПбГМУ, 2013. 105–137.
Бугаева Л.И., Спасов А.А., Кузубова Е.А. Влияние препарата бромантан на половое поведение и процессы зачатия у крыс. Экспериментальная и клиническая фармакология. 2004. 67 (3): 58–60.
Буреш Я., Бурешева О., Хьюстон Дж. Методики и основные эксперименты по изучению мозга и поведения. М.: Высшая школа, 1991. 210 с.
Гетманенко А.Ю., Бугаева Л.И., Спасов А.А., Лебедева С.А., Кузубова Е.А., Мальцев М.С. Исследование полового поведения и сперматогенеза у крыс-самцов с экспериментальным дефицитом магния. Вестник ВолгГМУ. 2016. 4 (60): 20–23.
Руководство по экспериментальному (доклиническому) изучению новых фармакологических веществ. Под. ред. Хабриева Р.У. 2-е изд., перераб. и доп. М.: Медицина, 2005. 832 с.
Тихонова М.А., Амстиславская Т.Г. Использование методики половой активации для фенотипирования самцов линии мышей и крыс с закрепленными селекцией нарушениями поведения. Вавиловский журнал генетики и селекции. 2015. 19 (4): 413–419.
Цветкова Д.А. Экспериментальная модель овариэктомии самок крыс. Материалы IX Международной студенческой научной конференции “Студенческий научный форум”. URL: https://scienceforum.ru/2017/article/2017039642
Agmo A. Male rat sexual behavior. Brain Res. Brain Res. Protoc. 1997. 1 (2): 203–209.
Jones S.L., Ismail N., Pfaus J.G. Facilitation of sexual behavior in ovariectomized rats by estradiol and testosterone: A preclinical model of androgen effects on female sexual desire. Psychoneuroendocrinology. 2017. 79: 122–123.
Mendelson S.D., Pfaus J. Level searching: A new assay of sexual motivation in the male rat. Physiol. Behav. 1989. 45: 337–341 pp.
Pfaus J.G., Kippin T.E., Goria-Avila G. What can animal models tell us about human sexual response? Annual Review of Sex Research. 2003. 14: 1–63.
Pfaus J.G., Kippin T.E., Goria-Avila G.A., Gelez H., Afonso V.M., Ismail N., Parada M. Who, what, where, when (and maybe even why?) How the experience of sexual reward connects sexual desire, preference, and performance. Arch Sex Behav. 2012. 41 (1): 31–62.
Van Furth W.R., Van Ree J.M. Appetitive sexual behavior in male rats. 1. The role of olfaction in level-changing behavior. Physiol. Behav. 1996a. 60 (3): 999–1005 pp.
Van Furth W.R., Van Ree J.M. Appetitive sexual behavior in male rats. 2. Sexual reward and level-changing behavior. Physiol. Behav. – 1996b. 60 (3): 1007–1012.
Дополнительные материалы отсутствуют.
Инструменты
Журнал высшей нервной деятельности им. И.П. Павлова


