Журнал высшей нервной деятельности им. И.П. Павлова, 2020, T. 70, № 2, стр. 147-162
МОДЕЛИ АУТИЗМА И МЕТОДИКИ ОЦЕНКИ АУТИСТИЧЕСКИ-ПОДОБНОГО ПОВЕДЕНИЯ У ЖИВОТНЫХ
А. А. Семёнова 1, 2, *, О. Л. Лопатина 1, 2, А. Б. Салмина 1, 2
1 Российско-японская лаборатория изучения социального мозга,
НИИ молекулярной медицины и патобиохимии
Красноярск, Россия
2 Кафедра биологической химии с курсами медицинской, фармацевтической и токсикологической химии,
Федеральное государственное бюджетное образовательное учреждение высшего образования
“Красноярский государственный медицинский университет имени профессора В.Ф. Войно-Ясенецкого” МЗ РФ
Красноярск, Россия
* E-mail: alina_shamsutdin@mail.ru
Поступила в редакцию 20.06.2019
После доработки 30.08.2019
Принята к публикации 16.09.2019
Аннотация
Расстройства аутистического спектра (РАС), включая аутизм, представлены широким диапазоном состояний и ассоциированы с дефицитом социальной коммуникации, ограниченными интересами и стереотипным поведением. Развитие трансляционной медицины и персонализированных подходов в терапии РАС объединяют усилия клиницистов и фундаментальной науки и смещают вектор исследований в сторону изучения молекулярных и генетических механизмов расстройств развития, поиска новых молекул-маркеров для таргетной коррекции данных состояний, что невозможно без использования моделей РАС на животных, в частности на грызунах. В данном обзоре описаны ключевые генетические и фармакологические модели РАС на грызунах, активно используемые в эксперименте, а также наиболее значимые поведенческие тесты для оценки дефицита социального поведения, стереотипий и аутистически-подобных состояний у экспериментальных животных.
Аутизм относят к расстройствам аутистического спектра (РАС). Аутистические расстройства ассоциированы с искажением и задержкой развития, проявляются в раннем детстве и сохраняются в подростковом и взрослом возрасте [Пичугина и др. 2018]. При постановке диагноза РАС выделяют наличие трех основных специфических симптомов: а) постоянный дефицит социальных связей и социального взаимодействия в разных контекстах; б) ограниченные, повторяющиеся модели поведения, интересов или деятельности; и в) наличие симптомов в раннем периоде развития, хотя они могут не проявляться, пока социальные потребности не превысят способности индивидуума [Лавров, Шабанов, 2018; Pelch et al., 2019]. В последние годы наблюдается рост заболеваемости. По данным ВОЗ (за 2016 г.) 1 из 160 детей страдает РАС, по данным Центра по контролю и профилактике заболеваний США (Centers for Disease Control and Prevention, 2018, США) за 2018 г. – 1 из 59 детей имеют диагноз РАС, при этом у мальчиков он встречается в 3 раза чаще [Loomes et al., 2017].
Имеющиеся научные данные указывают на различные факторы, повышающие вероятность появления у ребенка РАС, в том числе факторы окружающей среды и генетики [Pelch et al., 2019]. Диагноз РАС также может быть осложнен одним или несколькими сопутствующими состояниями, включая тревогу, синдром дефицита внимания и гиперактивности (СДВГ), эпилепсию, синдром Мартина-Белла, нейровоспалительные и иммунные расстройства, расстройства сенсорной обработки, обсессивно-компульсивное расстройство и/или развитие нарушения координации, все из которых делают РАС очень неоднородным состоянием, которое трудно изучать. Перекрывающиеся симптомы от коморбидных диагнозов могут маскировать и взаимодействовать со специфическими для РАС симптомами. РАС диагностируются на основе клинических шкал, и в настоящее время нет никакого лечения, а только симптоматическое облегчение некоторых сопутствующих заболеваний, таких как беспокойство, нарушения сна или судороги [Лущекина, Стрелец, 2014].
Поиски биологических маркеров РАС [Tordjman et al., 2014], вовлеченность различных генов [Tammimies, 2019], отсутствие релевантной терапии стимулируют исследователей все чаще обращаться к моделям аутизма и РАС на животных (в частности, грызунах) для анализа молекулярных путей развития расстройств, поиска новых молекул-маркеров РАС и стратегии фармакологической коррекции аутистически-подобного поведения. Аутизм представляет собой комплексное заболевание, характеризующееся триадой симптомов – дефицит социального поведения, проявление стереотипного поведения и нарушение коммуникационных способностей [Chang et al., 2017]. В экспериментах на животных данные симптомы оценивают соответствующими тестами (рис. 1) и говорят о степени выраженности аутистически-подобного поведения. В данном обзоре мы подробно рассмотрим основные тесты для оценки аутистически-подобного поведения животных, а также наиболее известные и широко применяемые фармакологические и генетические модели аутизма на крысах и мышах.
Рис. 1.
Тесты для оценки аутистически-подобного поведения.
Fig. 1. Tests for autistic-like behavior assessment.
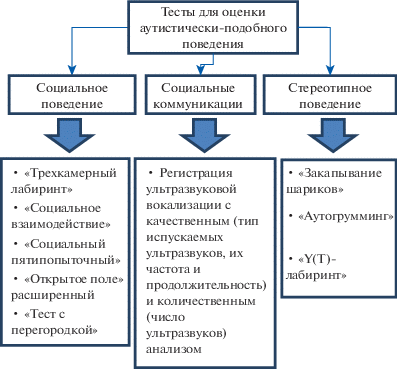
1. МЕТОДЫ ОЦЕНКИ АУТИСТИЧЕСКИ-ПОДОБНОГО ПОВЕДЕНИЯ У ЭКСПЕРИМЕНТАЛЬНЫХ ЖИВОТНЫХ
1.1.1. Тест “Трехкамерный лабиринт”
Тест “Трехкамерный лабиринт” был разработан Crowley и соавт. [Crawley, 2004] для оценки уровня социализации и социального предпочтения у мышей. В настоящее время тест активно применяется у грызунов с моделями аутизма [Cho et al., 2017; Wu et al., 2017; Campolongo et al., 2018]. В данном тесте используется аппарат, имеющий три камеры со свободными отверстиями для перемещения животного.
Тест начинается с сессии привыкания к пустому аппарату, при этом животное помещают в центральную камеру. Животное обычно проводит примерно одинаковое время в левом и правом отсеке аппарата, если наблюдается смещение, то, вероятно, нужно проверить условия освещенности или чистоты камер.
Во второй сессии (этап оценки социализации) животному предлагается выбор между новым неодушевленным объектом (металлическая клетка, игрушка и др.), расположенным в одном боковом отсеке, и новым незнакомым ранее животным того же пола и возраста (социальный объект, незнакомец 1), иммобилизованным в металлической клетке, находящимся в другом боковом отсеке.
В третьей сессии (этап оценки социальных предпочтений) неодушевленный предмет заменяют на второго незнакомого животного (незнакомец 2). Предполагают, что за вторую сессию незнакомец 1 становится уже хорошо знаком и в третьей сессии он выступает знакомым социальным объектом (рис. 2).
Рис. 2.
Схема “Трехкамерного лабиринта”: а) 1 сессия – привыкание; б) 2 сессия – социализация; в) 3 сессия – социальное предпочтение.
Fig. 2. The scheme of “3-chamber maze”: а) 1 session – adaptation; б) 2 session – sociability; в) 3 session – social preference.
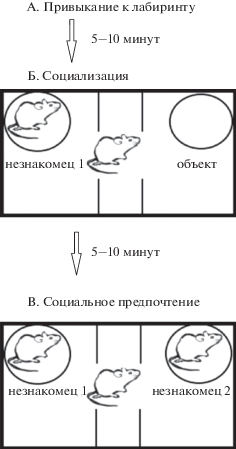
Предпочтение социальной новизны определяется увеличением времени, проведенного в камере с незнакомцем 2 по сравнению с временем в камере, содержащей уже знакомого (по предыдущей сессии) животного. Число входов в отсеки также является оценочным параметром и чаще всего соответствует уровню интереса к объекту. Кроме того, некоторые исследователи регистрируют время непосредственного контакта (обнюхивание) как с объектом, так и с незнакомыми животными, хотя показана корреляция времени, проведенного в камере с временем обнюхивания объекта или животного [Yang et al., 2016]. Для удобства представления данных рассчитывают индекс социализации и социального предпочтения (или социальной новизны):
где t1 – время в камере с незнакомцем 1, t0 – время в отсеке с неодушевленным предметом, t2 – время в отсеке с незнакомцем 2.1.1.2. Тест “Социальное взаимодействие”
Данный тест позволяет детально оценивать взаимодействие между животными, помещенными одновременно в новую пустую клетку или специальную камеру на промежуток времени от 10 до 20 мин. При этом можно регистрировать такие параметры, как число и время обнюхивания морды, генитального обнюхивания, преследования, облизывания, избегания и атак. Часто исследователи оценивают только время обнюхивания, общее или разделяя обнюхивание морды и генитальное [Hara et al., 2016; Yamaguchi et al., 2017]. В тесте используются ранее незнакомые животные, которые выравниваются по полу, возрасту и массе тела.
Тест не требует дополнительного оборудования, кроме видеокамеры, однако подсчет числа и времени взаимодействий требует неоднократного повтора просмотров видеозаписи, кроме того, на величину оцениваемых параметров может повлиять субъективное мнение экспериментатора. Несмотря на это, данный тест широко применяется для оценки аутистически-подобного поведения у мышей и крыс [Amin Edalatmanesh et al., 2013; Cuevas-Olguin et al., 2017; Hirsch et al., 2018].
1.1.3. Тест “Социальный пятипопыточный”
Этот тест позволяет оценить уровень социальной памяти грызунов. Распознавание сородичей является существенным свойством для установления иерархии, узнавания родителей и потомков, а также межвидового различия [Васильева, Бондарь, 2018]. К испытуемому грызуну 4 раза подсаживают одного и того же незнакомого грызуна на 1 мин с интервалом в 10 мин между сессиями. Таким образом, происходит последовательное снижение обонятельного исследования (времени обнюхивания гениталий) во время коротких встреч с социальным стимулом, что сигнализирует о привыкании и формировании социальной памяти. В пятой сессии подсаживают нового незнакомого грызуна, при этом у испытуемого грызуна снова наблюдается увеличение времени обнюхивания гениталий нового грызуна. Этот тест является разновидностью теста “социальное распознавание” (social recognition task), в котором всего две 5-минутные сессии, однако требуется большее число животных для анализа [Jacobs et al., 2016]. Поэтому протокол с пятью сессиями кажется более приемлемым [Mineur et al., 2006; Jin et al., 2007].
1.1.4. Тест “Открытое поле” расширенный
Данный тест проводится для оценки интереса к новому неодушевленному и социальному объекту [Lopatina et al., 2014]. Испытуемое животное помещают в арену на 10 мин для привыкания – сессия 1 – исследование нового пространства, привыкание к полю перед второй сессией. Далее в центр поля располагают новый для животного неодушевленный объект – металлическую клетку (или иной неодушевленный предмет), и вновь помещают животное на 10 мин – сессия 2 – интерес к новому неодушевленному предмету. В третьей сессии в центр арены помещают незнакомую особь того же пола и веса, как и исследуемое животное, заключенное в металлическую клетку, и вновь помещают животное на 10 мин – сессия 3 – интерес к новому социальному объекту. Перерыв между сессиями 3–10 мин в зависимости от поставленных задач. В каждой из трех сессий оценивают время, проведенное животным в центре и на периферии, число входов в зоны, количество вертикальных стоек.
1.1.5. “Тест с перегородкой”
Тест был основан на наблюдении, что грызуны увеличивают свою активность у перегородки, если за ней сидит незнакомый сородич, по сравнению с пустым отсеком [Kudryavtseva, 1994; Nolan et al., 2017]. Клетка разделяется пополам прозрачной пластиковой или металлической перегородкой с отверстиями. Испытуемое животное способно видеть, слышать и чувствовать запах подсаженного животного, но физический контакт невозможен. Время, проведенное у перегородки, представляет уровень социального интереса. Кроме того, подсаживая разных особей, можно оценить социальное предпочтение и социальную память.
1.2.1. Тест “Закапывание шариков”
Данный тест нашел широкое применение для изучения выраженности стереотипного поведения грызунов в моделях аутизма на животных [Mehta et al., 2011; Baronio et al., 2015; Choi et al., 2016; Wu et al., 2018]. Предполагается, что животные используют доступный материал подстилки, чтобы закопать нежелательные источники дискомфорта, находящиеся в домашнем окружении. В стандартную клетку плотно укладывают опилки слоем 3 см, после чего на поверхность слоя опилок раскладывают 20 стеклянных шариков диаметром 1 см в случайном порядке. Животное помещают в подготовленную клетку и оставляют на 30 мин. После чего животное аккуратно извлекают и проводят подсчет шариков, закопанных более чем на 2/3. Количество закопанных шариков отражает выраженность стереотипного поведения животного.
1.2.2. Тест “Аутогрумминг”
Мыши и крысы естественно поглаживают, почесывают и облизывают свою голову и тело с помощью передних лап (аутогрумминг). Однако слишком частый и продолжительный аутогрумминг можно рассматривать как стереотипное поведение [Mehta et al., 2011; Maraz et al., 2017]. Экспериментальное животное помещают в чистую пустую клетку (без подстила, чтобы исключить конкурентное стереотипное поведение – копание) на 10 мин для адаптации, и в течение следующих 10 мин ведут подсчет числа актов аутогрумминга и их продолжительности.
1.2.3. Тест “Y-лабиринт (T-лабиринт)”
Этот тест описан для оценки когнитивной функции грызунов [Deacon, Rawlins, 2006], однако также подходит для изучения стереотипного поведения [Amin Edalatmanesh et al., 2013; Campolongo et al., 2018]. Грызуны демонстрируют врожденное предпочтение чередовать ходы при исследовании незнакомой среды. Животное помещают у основания Y- или T-образного закрытого лабиринта и разрешают выбрать один из рукавов, во второй попытке испытуемое животное обычно выбирает рукав, который оно не посещало раньше. Выбор того же самого рукава отражает повторяющееся действие. Увеличение процента животных в группе, выбирающих один и тот же рукав, служит индикатором повторяющегося поведения.
1.3.1. Регистрация ультразвуковых вокализаций
Грызуны используют главным образом обоняние для узнавания своих сородичей, визуальные, тактильные и вкусовые сигналы тоже имеют место в реализации социальных связей. Большое внимание уделяется вокализации в ультразвуковом диапазоне и рассматривается как элемент социальной коммуникации [Merten et al., 2014; Zala et al., 2017] и способ взаимной передачи информации [Перцов и др., 2012]. Разнообразие паттернов продуцируемых ультразвуков и контекста побуждает ученых выстраивать проекции к речевой (социальной) коммуникации у человека [Seffer et al., 2014]. Это особенно актуально для моделей с нарушениями развития нервной системы у грызунов, поскольку существует огромная потребность в надежных поведенческих тестах для обнаружения дефицита социальной коммуникации, наблюдаемого при аутизме и других ассоциированных расстройствах.
Сложные вокализации в ультразвуковом диапазоне испускаются грызунами в разных социальных контекстах. Изоляция от матери является стимулом ультразвуковой вокализации у детенышей грызунов с 3-го по 12-й день постнатального развития [Higashida et al., 2010; Scattoni et al., 2010; Robison et al., 2016]. Детеныш призывает на помощь, сообщает о себе. Бедность паттернов (число продуцируемых ультразвуков в минуту, их частота, продолжительность и подтип) ультразвуковой вокализации считают отражением дефицита социальной коммуникации [Lopatina et al., 2017] и используют как критерий оценки аутистически-подобных черт в поведении у животных.
У взрослых особей именно контекст и наличие партнера являются стимулом продуцирования ультразвуковой вокализации: период ухаживания самца за самкой, совместной (самка и самец) заботы о потомстве [Liu et al., 2013; Liang et al., 2014; Akther et al., 2015]. В данном случае ультразвуковая вокализация помогает установлению социального контакта у зрелых животных. В эксперименте оценивают паттерны звуковой вокализации и судят о наличии или дефиците социальной коммуникации.
Запись ультразвуковой вокализации обычно проводят в звукоизолирующей камере с подведенным микрофоном и программным обеспечением для обработки сигналов.
2. МОДЕЛИ АУТИЗМА
Экспериментальные модели аутизма можно разделить на фармакологические и генетические (рис. 3), первых не так много, и среди них в настоящий момент вальпроатная модель выступает наиболее релевантной как на мышах, так и на крысах. Однако пропионовая модель в будущем может оказаться более востребованной, поскольку отражает влияние факторов окружающей среды на развитие РАС, и взаимосвязь изменений микробиома с данной патологией. Генетические модели аутизма – это либо линии мышей, такие как BTBR или BALB/c, которые изначально имеют черты аутистически-подобного поведения, либо большое многообразие мышей с экспериментальной делецией генов. Однако пока выключение одного гена не позволяет ответить на все возникающие вопросы относительно РАС, поскольку этиология данных расстройств сомнительна. Поэтому перспективным направлением является изучение взаимосвязи эффектов генома с эффектами окружающей среды, а также проведение исследований как на генетических, так и на фармакологических моделях, либо их комбинации.
Рис. 3.
Схема, отражающая наиболее известные и используемые из существующих моделей РАС на грызунах. Жирным шрифтом выделены модели аутизма, описанные в данной работе.
Fig. 3. Scheme describing the most famous and widely used of existing rodent ASD models. The autism models described in this paper are in bold.
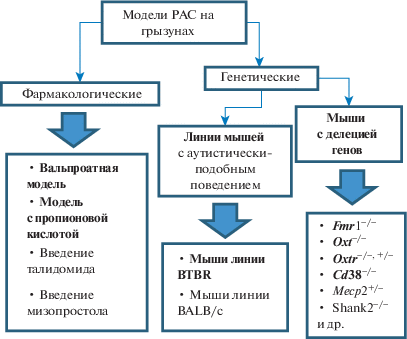
2.1.1. Индуцированный фетальный вальпроатный синдром – вальпроатная модель аутизма
Вальпроевая кислота (2-пропил-пентановая кислота) является одним из самых широко применяемых средств для лечения эпилепсии, а также биполярных расстройств и мигрени. Однако применение вальпроевой кислоты на ранних сроках беременности повышает риск нарушений развития мозга у плода, приводя к гиперактивности, дефициту внимания, задержке речи и аутизму [Moore et al., 2000].
Модель вальпроат-индуцированного аутизма является одной из самых распространенных моделей аутизма на грызунах. В 1996 г. Rodier и соавт. впервые применили введение вальпроевой кислоты беременным самкам крыс на 11.5–12.5-й дни эмбрионального развития (время закрытия нервной трубки и формирования ствола мозга) и обнаружили снижение числа нейронов в ядрах черепно-мозгового нерва у 60-дневного потомства, а также аномалии в развитии мозжечка [Rodier et al., 1996]. Так как такие нарушения в развитии мозга крыс подобны изменениям в мозге, наблюдаемым при аутизме у человека [Bauman, Kemper, 1985], вальпроатная модель была предложена как модель для изучения повреждений в развитии мозга, ассоциированных с РАС [Rodier et al., 1997].
В 2005 г. впервые было показано, что введение вальпроевой кислоты приводит не только к морфологическим изменениям в мозге, но и к нарушениям в поведении крыс, таким как снижение чувствительности к боли, снижение уровня исследовательской активности, увеличение двигательной активности, стереотипного поведения и гиперактивности, снижение социального исследования и увеличение латентного времени социального поведения [Schneider, Przewłocki, 2005]. Оценка влияния времени введения вальпроевой кислоты у беременных крыс показала, что именно 12-й эмбриональный день является критическим для появления устойчивого фенотипа (с дефицитом социального поведения) у потомства [Kim et al., 2011]. У мышей также 12.5-эмбриональный день был показательней по сравнению с 9 и 14.5 [Kataoka et al., 2013].
Многими исследователями было продемонстрировано, что пренатальное введение вальпроевой кислоты приводит впоследствии к снижению уровня социализации и социального предпочтения у взрослых крыс в тесте “Трехкамерный лабиринт” [Dufour-Rainfray et al., 2010; Bambini-Junior et al., 2011; Foley et al., 2012; K.C. Kim et al., 2013; P. Kim et al., 2013; Barrett et al., 2017; Kim et al., 2017; Li et al., 2017; Wu et al., 2017, 2018]. Кроме того, дефицит социального поведения животных в этой модели был обнаружен в тесте “Социальное взаимодействие” [Amin Edalatmanesh et al., 2013; Du et al., 2017; Yamaguchi et al., 2017; Zhang et al., 2017; Campolongo et al., 2018; Hirsch et al., 2018]. Выраженность стереотипного поведения у крыс с вальпроатной моделью аутизма была увеличена в тестах “Аутогрумминг” [Du et al., 2017; Kim et al., 2017; Zhang et al., 2017; Hirsch et al., 2018], “Закапывание шариков” [Wu et al., 2018] и “Y-лабиринт” [Markram et al., 2008; Amin Edalatmanesh et al., 2013; Campolongo et al., 2018].
Мыши разных линий, с пренатальным введением вальпроевой кислоты, в тесте “Трехкамерный лабиринт” демонстрировали снижение уровня социализации и социального предпочтения [Al-amin et al., 2015; Baronio et al., 2015; Kang, Kim, 2015; Choi et al., 2016; Ha et al., 2017]. В тесте “Cоциальное взаимодействие” мыши линии ICR, получавшие вальпроевую кислоту пренатально, также демонстрировали дефицит социального поведения [Kataoka et al., 2013; Hara et al., 2016, 2017; Yamaguchi et al., 2017]. Стереотипное поведение было показано под влиянием вальпроевой кислоты на мышах в тестах “Аутогрумминг” [Mehta et al., 2011; Kang, Kim, 2015; Ha et al., 2017] и “Закапывание шариков” [Mehta et al., 2011; Baronio et al., 2015; Choi et al., 2016]. У мышей с вальпроатной моделью РАС обнаружено снижение порога болевой чувствительности [Baronio et al., 2015].
Интересно, что показатели обучения и памяти в тесте “Водный лабиринт Морриса” у животных с данной моделью сильно варьируют. Например, было выявлено как увеличение [Foley et al., 2012; Li et al., 2017; Wu et al., 2017; Zhang et al., 2017], так и снижение времени нахождения платформы [Amin Edalatmanesh et al., 2013], а в одном случае показатели экспериментальной группы в данном тесте не отличались от показателей контрольных животных [Markram et al., 2008].
Таким образом, вальпроатная модель отвечает требованиям, предъявляемым к моделям психопатологий, таким как “face validity” (соответствие поведенческой симптоматики), “predictive validity” (соответствие фармакологической коррекции) и “construct validity” (сходство физиологических, нейробиологических и нейрохимических механизмов) [Willner, 1990]. Критерий “face validity” убедительно подтвержден экспериментально: крысы и мыши с пренатальным введением вальпроевой кислоты демонстрируют поведение, имеющее поразительные сходства с основными симптомами аутизма, такими как дефицит социального поведения, нарушение коммуникации и наличие стереотипного поведения [Baronio et al., 2015; Choi et al., 2016; Yamaguchi et al., 2017]. А среди детей, пренатально получавших вальпроат, 12–15% имели аутизм-подобные черты в поведении [Moore et al., 2000; Bromley et al., 2013].
“Конструктивная достоверность” (construct validity) подтверждается тем фактом, что нейроанатомические данные животных с вальпроатной моделью аутизма указывают на изменения в развитии мозжечка [Rodier et al., 1996; Main, Kulesza, 2017], что согласуется с сокращением числа клеток Пуркинье у людей, страдающих аутизмом [Wegiel et al., 2014].
Доказательство критерия сходства фармакологической коррекции (predictive validity) в моделях аутизма усложняется тем, что для расстройств аутистического спектра не имеется четкого принципа лечения. Однако на мышах было показано, что обогащение окружающей среды во время раннего развития приводит к нормализации уровня социального поведения [Yamaguchi et al., 2017], что напоминает успех раннего поведенческого вмешательства у людей [Aronoff et al., 2016].
2.1.2. Модель с введением пропионовой кислоты
Длительные инфекции, лечение антибиотиками и влияние ксенобиотиков во время беременности и в период раннего детства могут воздействовать на микробиом кишечника, обеспечивая повышение уровня продуктов жизнедеятельности бактерий, таких как пропионовая кислота и липополисахариды, что может отрицательно сказаться на развитии нервной системы. Пропионовая кислота – это короткоцепочечная жирная кислота, синтезируемая из амино- и жирных кислот бактериями кишечника человека. Кроме того, она используется как консервант для продуктов питания, а также применяется для приготовления лекарственных средств, гербицидов, растворителей, пластмасс.
В плазме крови пациентов, страдающих аутизмом, были найдены аномально низкие уровни ненасыщенных и, наоборот, высокие уровни насыщенных жирных кислот, в том числе и пропионовой кислоты [El-Ansary et al., 2011; Jory, 2016].
Модель аутизма с интрацеребровентрикулярным введением пропионовой кислоты впервые была предложена в 2007 г. [MacFabe et al., 2007]. У подопытных крыс с данной моделью были обнаружены повышенный уровень двигательной активности и дистония конечностей, что сопровождалось увеличением экспрессии маркеров окислительного стресса, а также числа астроцитов и микроглии, что свидетельствует о нейровоспалении [MacFabe et al., 2007]. Рядом исследователей также было показано нарушение социального поведения животных, получавших пропионовую кислоту интрацеребровентрикулярно [Shultz et al., 2008, 2015; MacFabe et al., 2011]. Стереотипное поведение, характерное для лиц, страдающих аутизмом, было оценено на модели с пропионовой кислотой. Так, в тестах “Открытое поле” [MacFabe et al., 2010] и “Т-образный лабиринт” [MacFabe et al., 2011] было обнаружено увеличение выраженности стереотипного поведения крыс после внутрижелудочкового введения пропионовой кислоты.
Интересно, что подкожное введение пропионовой кислоты беременным самкам в течение 5 дней не вызывало дефицита социального поведения, а лишь увеличивало уровень двигательной активности у потомства [Foley et al., 2014]. Однако подкожное введение данной кислоты трехнедельным крысятам в течение 5 дней приводило к нарушению поведения в тесте “Социальное взаимодействие” [Choi et al., 2018].
Эффекты орального введения пропионовой кислоты на поведение животных не были изучены, однако было показано увеличение уровня маркеров окислительного стресса, провоспалительных цитокинов, каспазы-3, а также фрагментов ДНК, что указывает на проапоптотическое и нейротоксическое действие пропионовой кислоты [El-Ansary et al., 2012].
Известно, что внутривенное введение пропионовой кислоты вызывает дозозависимое повышение уровня данной кислоты в мозге экспериментальных животных, вплоть до летального исхода. Исследователи объясняют это возрастанием внеклеточного уровня тормозного нейромедиатора ГАМК, что в свою очередь нарушает проводимость нейронов [Morland et al., 2018].
По-видимому, увеличение уровня пропионовой кислоты в органах и тканях приводит к снижению внутриклеточного рН и вызывает системное воспаление путем повышения концентрации провоспалительных цитокинов в ЦНС, что в свою очередь может стимулировать развитие аутизм-подобных черт поведения. Однако моделирование аутизма у животных с помощью пропионовой кислоты не лишено недостатков, изучая литературу, мы не выявили четкого и удобного способа введения кислоты, вызывающего характерное аберрантное поведение.
2.2.1. Синдром ломкой Х-хромосомы (синдром Мартина-Белла)
Синдром ломкой Х-хромосомы – наиболее частая причина наследственной умственной отсталости, имеющая высокий риск развития аутизма. Многократное увеличение повторов ЦГГ в Х-хромосоме приводит к гиперметилированию промотора гена fmr1 и формированию так называемого сайта ломкости и снижению количества продукта гена fmr1 – РНК связывающего белка, модулирующего созревание аксонов, дендритов и синаптическую пластичность. Среди лиц с синдромом ломкой Х-хромосомы 25–67% мужчин и 6–23% женщин страдают заболеваниями аутистического спектра [Clifford et al., 2007].
Для исследования данного синдрома были созданы мыши, дефицитные по гену fmr1 – нокаутные мыши по fmr1 (Fmr1-KO) [Mineur et al., 2006]. Обнаружено, что гомозиготные Fmr1-KO мыши проявляют аутистически-подобное поведение. В тестах “Социальный пятипопыточный” [Mineur et al., 2006] и “Трехкамерный лабиринт” Fmr1-KO мыши отличались от мышей дикого типа снижением времени взаимодействия с социальным объектом (“уровню социализации”) [Sethna et al., 2017; Sinclair et al., 2017]. У Fmr1-KO мышей показано усиление выраженности повторяющегося (стереотипного) поведения в тесте “Закапывание шариков” по сравнению с мышами дикого типа [Gholizadeh et al., 2014; Sethna et al., 2017; Bausch et al., 2018]. В других исследованиях фенотипа Fmr1-KO мышей было обнаружено либо нарушение социального распознавания [Pietropaolo et al., 2011; Qin et al., 2015], либо, что интересно, отсутствие дефицита социального взаимодействия [Nolan et al., 2017]. Различия в поведении мышей у разных исследователей могут зависеть от генетического фона (ICR, C57BL/6 или др.), на котором создавалась нокаутная линия [Spencer et al., 2012].
У мышей Fmr1-KO обнаружили аномальную морфологию дендритных шипиков в соматосенсорной коре, которая заключалась в увеличении их плотности. При этом большинство шипиков были удлиненные и незрелые [Galvez, Greenough, 2005]. Раннее социальное обогащение предотвращало развитие социального дефицита у Fmr1-KO мышей и нивелировало аномальную морфологию дендритных шипиков в гиппокампе и миндалине [Oddi et al., 2015].
Таким образом, нокаутные мыши по гену fmr1 всегда демонстрируют ярко выраженное гиперактивное поведение и аномальную нейроанатомию, тогда как выраженность аутистически-подобного поведения зависит от фона, на котором была создана нокаутная линия [Kazdoba et al., 2014].
2.2.2. Мыши линии BTBR
Первоначально линия мышей BTBR T+Itpr3tf/J (BTBR) была создана для исследований резистентности к инсулину, диабет-индуцированной нефропатии и фенилкетонурии, однако оказалось, что мыши данной линии характеризуются аутизм-подобным поведением [Moy et al., 2007]. Позднее было обнаружено, что мыши BTBR демонстрируют снижение уровня социализации в тесте “Трехкамерный лабиринт”, хотя социальное предпочтение у мышей данной линии в норме [Silverman et al., 2009; Chao et al., 2018; Cristiano et al., 2018]. Кроме того, мыши BTBR характеризуются повышением уровня стереотипного поведения в тестах “Закапывание шариков” [Cai et al., 2017; Cristiano et al., 2018] и “Аутогрумминг” [Silverman et al., 2009; Cai et al., 2017]. Были открыты также анатомические дефекты, такие как полное отсутствие мозолистого тела [Wahlsten et al., 2003], редуцированные толщина и объем коры, а также уменьшенная дорсальная часть гиппокампа [Faraji et al., 2018]. Стоит подчеркнуть, что мышей линии BTBR нередко используют в исследованиях последних лет как подходящую модель для поиска стратегии лечения РАС [Cristiano et al., 2018; Wang et al., 2018].
2.2.3. Нокауты по окситоцину и рецепторам к окситоцину
Окситоцин (ОТ) – гормон пептидной природы, который синтезируется в гипоталамусе, по проекциям нейронов транспортируется в нейрогипофиз, где накапливается и в дальнейшем высвобождается в кровь. К центральным эффектам ОТ относят регуляцию социального поведения (социального распознавания, социальной памяти, социального взаимодействия), включая родительское поведение [Hammock, 2015]. ОТ способствует проявлению родительской заботы и привязанности у особей обоего пола. Было выявлено, что гомозиготные нокаутные самки по ОТ не способны к лактации, хотя и проявляют заботу о потомстве, а нокаутные детеныши испускают меньше вокализаций по сравнению с мышами дикого типа [Winslow et al., 2002]. Взрослые самцы не распознают знакомых сородичей при повторных встречах, что было обнаружено в тесте “Социальный пятипопыточный”, несмотря на нормальное обоняние и когнитивные способности [Winslow, Insel, 2002]. В то же время они имеют нормальный уровень социализации и предпочтения при оценке в тесте “Трехкамерный лабиринт” [Crawley et al., 2007]. Более значимые эффекты наблюдались после полного нокаута по рецепторам к ОТ: такие мыши проявляют дефицит социальных коммуникаций в тестах “Трехкамерный лабиринт” и “Социальное взаимодействие”, а также повышение уровня стереотипного поведения в тесте “Аутогрумминг” [Pobbe et al., 2012]. Интересно, что и гетерозиготные нокаутные мыши по рецепторам к ОТ демонстрируют снижение уровня социализации и предпочтения к незнакомым сородичам [Sala et al., 2013]. Примечательно, что фармакологическое ингибирование микроглии компенсировало дефицит социальных взаимодействий между матерью и потомством у мышей с делецией гена рецепторов к ОТ [Miyazaki et al., 2016]. Таким образом, нокаутные мыши по ОТ рецепторам являются подходящей моделью для исследования роли ОТ и его рецепторов в поведенческих аномалиях, включая аутистически-подобное поведение.
2.2.4. CD38 нокаутные мыши
Было обнаружено, что CD38, трансмембранный гликопротеин, бифункциональный рецептор-энзим [Jin et al., 2007; Salmina et al., 2010; Higashida et al., 2011] с активностью АДФ-рибозилциклазы, экспрессируется в гипоталамусе и имеет решающее значение для высвобождения ОТ из окситоцинергических нейронов [Jin et al., 2007]. Интересно, что CD38 не оказывает никакого влияния на синтез и высвобождение аргинин-вазопрессина [Jin et al., 2007].
У мышей-самцов с делецией гена CD38 нарушены социальная память и социальное распознавание в тесте “Социальный пятипопыточный” [Jin et al., 2007], обнаружен дефицит родительской заботы и родительского поведения [Akther et al., 2013]. Уровень окситоцина в плазме крови и спинномозговой жидкости статистически значимо снижен у Cd38 –/– мышей по сравнению с контрольной группой, а введение экзогенного окситоцина восстанавливает параметры нарушенного поведения до уровня параметров контрольной группы [Jin et al., 2007; Cherepanov et al., 2017].
Учитывая роль CD38 в социальном распознавании через высвобождение окситоцина у мышей было предположено, что CD38 может играть роль в этиологии РАС. Выявлено, что однонуклеотидные полиморфизмы (SNPs) CD38 связаны с РАС или представляют слабый фактор риска РАС у жителей США, Израиля и Японии [Munesue et al., 2010; Higashida et al., 2012; Sauer et al., 2012].
Таким образом, модель с делецией гена CD38 у мышей является релевантной для исследований молекулярных причин развития аутизма и поиска новых стратегий фармакологической коррекции дефицита социального поведения.
ЗАКЛЮЧЕНИЕ
Оценка фенотипа животных на разных этапах онтогенеза является одним из ключевых элементов при работе с экспериментальными моделями РАС на грызунах. Выявление аутистически-подобного поведения на разных этапах служит положительным критерием релевантности используемой модели. Наличие поведенческих особенностей позволяет с уверенностью подходить к молекулярным и генетическим исследованиям, поиску новых элементов фармакологической коррекции.
Использование многообразных поведенческих тестов, усовершенствование уже существующих протоколов и видоизменение лабиринтов являются неотъемлемой составляющей при работе с моделями РАС на грызунах. Далеко не всегда достаточно пары классических тестов для подтверждения фенотипа у модели, а разные периоды онтогенеза требуют изменений в протоколах тестов и введения дополнительных поведенческих исследований. Только комплексное поведенческое тестирование может подтвердить или опровергнуть ожидаемый фенотип.
Если речь идет о нокаутных моделях, то ситуация упрощается проведением полного фенотипирования в начале работы с моделью и возможностью пропустить данный этап при последующих экспериментах, если в этом есть необходимость. Однако в случае с моделями аутизма на грызунах особенностью является многообразие генов, ассоциированных с РАС, что усложняет выбор нокаутной модели. Также не каждая модель позволяет скрещивание нокаут х нокаут, а требует работы с гетерозиготами, что приводит к дополнительным временным и финансовым затратам.
Из описанных в данном обзоре генетических моделей наиболее адекватными и широко применяемыми можно назвать мышей линии BTBR, характеризующихся сниженным уровнем социализации и выраженным стереотипным поведением. А также нокаутных мышей по ОТ рецепторам, у которых снижен уровень социализации, социального предпочтения и повышен уровень стереотипного поведения. Остальные генетические модели имеют менее полное соответствие фенотипу аутистически-подобного поведения, поскольку у них либо не изучено стереотипное поведение, как у CD38 нокаутных мышей, либо в зависимости от фона, на котором создается линия, поведенческие характеристики могут меняться, как у Fmr1-KO мышей.
При работе с фармакологическими моделями фенотипирование необходимо проводить у каждого помета грызунов, чтобы быть уверенным в том, что модель эффективна и исследователь имеет дело именно с фенотипом дефицита социального поведения и распознавания, а не с иным видом нарушения. Этот процесс делает работу исследователя более трудоемкой. Однако данные модели могут быть использованы на разных видах мышей и крыс, что делает их более доступными.
Развитие молекулярной и трансляционной медицины неразрывно связано с использованием экспериментальных моделей заболеваний на животных. Результаты, полученные с использованием генетических и фармакологических моделей, уточняют и дополняют друг друга, способствуя развитию трансляционного компонента в эксперименте. Из описанных фармакологических моделей аутизма стоит выделить пропионовую модель, поскольку эта кислота является продуктом жизнедеятельности микробиома млекопитающих, и чрезмерное повышение пропионата в кишечнике, в крови, а значит и в мозге эмбриона, может приводить к нарушениям развития ЦНС и возникновению аутизма. Вальпроевая же кислота не синтезируется в организме млекопитающих, и изучать механизмы ее действия на пренатальный мозг кажется занятием более абстрактным, несмотря на это вальпроатная модель наиболее изучена и широко применяется исследователями. Однако ввиду того, что пропионовая модель менее изучена, перед исследователями, начинающими работать с данной моделью, стоит проблема усовершенствования протоколов введения пропионата и оценки индукции аутистически-подобного поведения.
Работа выполнена при поддержке внутривузовского гранта КрасГМУ им. проф. В.Ф. Войно-Ясенецкого (грант № 2.4).
Список литературы
Васильева Л.Н., Бондарь И.В. Распознавание зрительных социальных стимулов: поведенческие и нейрофизиологические механизмы. Журн. высш. нерв. деят. 2018. 68 (3): 273–291.
Лавров Н.В., Шабанов П.Д. Расстройства аутистического спектра: этиология, лечение, экспериментальные подходы к моделированию. Обзоры клин. фармакол. лек. тер. 2018. 16 (1): 21–27.
Лущекина Е.А., Стрелец В.Б. Расстройства аутистического спектра. Обзор современных экспериментальных исследований. Журн. высш. нерв. деят. 2014. 64 (6): 585–599.
Перцов С.С., Коплик Е.В., Сахаров Д.С., Судаков К.В., Каркищенко Н.Н. Информационное ультразвуковое взаимодействие у крыс. Рос. мед.-биол. вестн. им. акад. И.П. Павлова. 2012. (2): 109–118.
Пичугина Ю.А., Арапиев Ю.У., Лопатина О.Л., Салмина А.Б., Хигашида Х. Анализ возможностей современных методов диагностики расстройств аутистического спектра. Неврологический вестник. 2018. (1): 44–53.
Akther S., Huang Z., Liang M., Zhong J., Fakhrul A.A.K.M. Paternal Retrieval Behavior Regulated by Brain Estrogen Synthetase (Aromatase) in Mouse Sires that Engage in Communicative Interactions with Pairmates. Front. Neurosci. 2015. 9 (450): 1–12.
Akther S., Korshnova N., Zhong J., Liang M., Cherepanov S.M., Lopatina O., Komleva Y.K., Salmina A.B., Nishimura T., Fakhrul A.A.K.M., Hirai H., Kato I., Yamamoto Y., Takasawa S., Okamoto H., Higashida H. CD38 in the nucleus accumbens and oxytocin are related to paternal behavior in mice. Molecular Brain. 2013. 6 (41): 1–10.
Al-amin M., Rahman M., Khan F.R., Zaman F., Reza H.M. Astaxanthin improves behavioral disorder and oxidative stress in prenatal valproic acid-induced mice model of autism. Behav. Brain Res. 2015. 286: 112–121.
Amin Edalatmanesh M., Nikfarjam H., Vafaeec F., Moghadas M. Increased hippocampal cell density and enhanced spatial memory in the valproic acid rat model of autism. Brain Res. 2013. 1526: 15–25.
Aronoff E., Hillyer R., Leon M. Environmental Enrichment Therapy for Autism: Outcomes with Increased Access. Neural. Plast. 2016. 2016: 1–23.
Bambini-Junior V., Rodrigues L., Behr G.A., Moreira J.C.F., Riesgo R., Gottfried C. Animal model of autism induced by prenatal exposure to valproate: Behavioral changes and liver parameters. Brain Res. 2011. 1408: 8–16.
Baronio D., Castro K., Gonchoroski T., Mueller de Melo G., Della-Flora Nunes G., Bambini-Junior V., Gottfried C., Riesgo R. Effects of an H3R Antagonist on the Animal Model of Autism Induced by Prenatal Exposure to Valproic Acid. PLoS ONE. 2015. 10 (1): 1–11.
Barrett C.E., Hennessey T.M., Gordon K.M., Ryan S.J., McNair M.L., Ressler K.J., Rainnie D.G. Developmental disruption of amygdala transcriptome and socioemotional behavior in rats exposed to valproic acid prenatally. Mol. Autism. 2017. 8 (42): 1–17.
Bauman M., Kemper T.L. Histoanatomic observations of the brain in early infantile autism. Neurology. 1985. 35 (6): 866–874.
Bausch A.E., Ehinger R., Straubinger J., Zerfass P., Nann Y., Lukowski R. Loss of sodium-activated potassium channel Slack and FMRP differentially affect social behavior in mice. Neuroscience. 2018. 384: 361–374.
Bromley R.L., Mawer G.E., Briggs M., Cheyne C., Clayton-smith J., García-fiñana M., Lucas S.B., Shallcross R., Baker G.A. The prevalence of neurodevelopmental disorders in children prenatally exposed to antiepileptic drugs. J. Neurol. Neurosurg. Psychiatry. 2013. 84 (6): 637–643.
Cai Y., Wang L., Xiao R., Li X., He X., Gao J., Xu H., Fan X. Autism-like behavior in the BTBR mouse model of autism is improved by propofol. Neuropharmacology. 2017. 118: 175–187.
Campolongo M., Kazlauskas N., Falasco G., Urrutia L., Salgueiro N., Höcht C., Depino A.M. Sociability deficits after prenatal exposure to valproic acid are rescued by early social enrichment. Mol. Autism. 2018. 9 (36): 1–17.
Chang Y.C., Cole T.B., Costa L.G. Behavioral phenotyping for autism spectrum disorders in mice. Curr. Protoc. Toxicol. 2017. 72: 1–21.
Chao O.Y., Yunger R., Yang Y. Behavioral assessments of BTBR T + Itpr3tf / J mice by tests of object attention and elevated open platform: Implications for an animal model of psychiatric comorbidity in autism. Behavioural Brain Research. 2018. 347: 140–147.
Cherepanov S.M., Yokoyama S., Mizuno A., Ichinose W., Lopatina O., Shabalova A.A., Salmina A.B., Yamamoto Y., Okamoto H., Shuto S., Higashida H. Structure-specific effects of lipidated oxytocin analogs on intracellular calcium levels, parental behavior, and oxytocin concentrations in the plasma and cerebrospinal fluid in mice. 2017. 5 (1): 1–14.
Cho H., Kim C.H., Knight E.Q., Oh H.W., Park B., Kim D.G., Park H.J. Changes in brain metabolic connectivity underlie autistic-like social deficits in a rat model of autism spectrum disorder. Sci. Rep. 2017. 7 (1): 1–16.
Choi C.S., Gonzales E.L., Kim K.C., Yang S.M., Kim J.W., Mabunga D.F., Cheong J.H., Han S.H., Bahn G.H., Shin C.Y. The transgenerational inheritance of autism-like phenotypes in mice exposed to valproic acid during pregnancy. Sci. Rep. 2016. 6: 1–11.
Choi J., Lee S., Won J., Jin Y., Hong Yunkyung, Hur T.Y., Kim J.H., Lee S.R., Hong Yonggeun. Pathophysiological and neurobehavioral characteristics of a propionic acid-mediated autism-like rat model. PLoS ONE. 2018. 13 (2): 1–17.
Clifford S., Dissanayake C., Bui Q.M., Huggins R., Taylor A.K., Loesch D.Z. Autism Spectrum Phenotype in Males and Females with Fragile X Full Mutation and Premutation. J. Autism Dev. Disord. 2007. 37: 738–747.
Crawley J.N.Designing mouse behavioral tasks relevant to autistic-like behaviors. Ment. Retard. Dev. Disabil. Res. Rev. 2004. 10 (4): 248–258.
Crawley J.N., Chen T., Puri A., Washburn R., Sullivan T.L., Hill J.M., Young N.B., Nadler J.J., Moy S.S., Young L.J., Caldwell H.K., Young W.S. Social approach behaviors in oxytocin knockout mice: Comparison of two independent lines tested in different laboratory environments. Neuropeptides. 2007. 41 (3): 145–163.
Cristiano C., Pirozzi C., Coretti L., Cavaliere G., Lama A., Russo R., Lembo F., Pina M., Meli R., Calignano A. Palmitoylethanolamide counteracts autistic-like behaviours in BTBR T + tf / J mice: Contribution of central and peripheral mechanisms. Brain Behav. Immun. 2018. 74: 166–175.
Cuevas-Olguin R., Roychowdhury S., Banerjee A., Garcia-Oscos F., Esquivel-Rendon E., Bringas M.E., Kilgard M.P., Flores G., Atzori M. Cerebrolysin prevents deficits in social behavior, repetitive conduct, and synaptic inhibition in a rat model of autism. J. Neurosci. Res. 2017. 95 (12): 2456–2468.
Deacon R.M.J., Rawlins J.N.P. T-maze alternation in the rodent. Nat. Protoc. 2006. 1 (1): 7–12.
Du L., Zhao G., Duan Z., Li F. Behavioral improvements in a valproic acid rat model of autism following vitamin D supplementation. Psychiatry Res. 2017. 253: 28–32.
Dufour-Rainfray D., Vourc’h P., Le Guisquet A.M., Garreau L., Ternant D., Bodard S., Jaumain E., Gulhan Z., Belzung C., Andres C.R., Chalon S., Guilloteau D. Behavior and serotonergic disorders in rats exposed prenatally to valproate: A model for autism. Neurosci. Lett. 2010. 470 (1): 55–59.
El-Ansary A.K., Bacha A.B., Kotb M. Etiology of autistic features: the persisting neurotoxic effects of propionic acid. J. Neuroinflammation. 2012. 9 (74): 1–14.
El-Ansary A.K., Ben Bacha A.G., Al- Ayahdi L.Y. Impaired plasma phospholipids and relative amounts of essential polyunsaturated fatty acids in autistic patients from Saudi Arabia. Lipids Health Dis. 2011. 10 (63): 1–9.
Faraji J., Karimi M., Lawrence C., Mohajerani M.H., Metz G.A.S. Non-diagnostic symptoms in a mouse model of autism in relation to neuroanatomy: the BTBR strain reinvestigated. Transl. Psychiatry. 2018. 8 (1): 1–18.
Foley A.G., Gannon S., Rombach-Mullan N., Prendergast A., Barry C., Cassidy A.W., Regan C.M. Class I histone deacetylase inhibition ameliorates social cognition and cell adhesion molecule plasticity deficits in a rodent model of autism spectrum disorder. Neuropharmacology. 2012. 63 (4): 750–760.
Foley K.A., MacFabe D.F., Vaz A., Ossenkopp K.P., Kavaliers M. Sexually dimorphic effects of prenatal exposure to propionic acid and lipopolysaccharide on social behavior in neonatal, adolescent, and adult rats: Implications for autism spectrum disorders. Int. J. Dev. Neurosci. 2014. 39: 68–78.
Galvez R., Greenough W.T. Sequence of Abnormal Dendritic Spine Development in Primary Somatosensory Cortex of a Mouse Model of the Fragile X Mental Retardation Syndrome. Am. J. Med. Genet. A. 2005. 135 (2): 155–160.
Gholizadeh S., Arsenault J., Cong I., Xuan Y., Pacey L.K., Hampson D.R. Reduced Phenotypic Severity Following Adeno-Associated Virus-Mediated Fmr1 Gene Delivery in Fragile X Mice. Neuropsychopharmacology. 2014. 39 (13): 3100–3111.
Ha S., Park H., Mahmood U., Ra J.C., Suh Y.H., Chang K.A. Human adipose-derived stem cells ameliorate repetitive behavior, social deficit and anxiety in a VPA-induced autism mouse model. Behav. Brain Res. 2017. 317: 479–484.
Hammock E.A.D. Developmental perspectives on oxytocin and vasopressin. Neuropsychopharmacology. 2015. 40 (1): 24–42.
Hara Y., Ago Y., Higuchi M., Hasebe S., Nakazawa T., Hashimoto H., Matsuda T., Takuma K. Oxytocin attenuates deficits in social interaction but not recognition memory in a prenatal valproic acid-induced mouse model of autism. Horm. Behav. 2017. 96: 130–136.
Hara Y., Ago Y., Taruta A., Katashiba K., Hasebe S., Takano E., Onaka Y., Hashimoto H., Matsuda T., Takuma K. Improvement by methylphenidate and atomoxetine of social interaction deficits and recognition memory impairment in a mouse model of valproic acid-induced autism. Autism Res. 2016. 9 (9): 926–939.
Higashida H., Lopatina O., Yoshihara T., Pichugina Y.A., Soumarokov A.A., Munesue T., Minabe Y., Kikuchi M., Ono Y., Korshunova N., Salmina A.B.Oxytocin signal and social behaviour: Comparison among adult and infant oxytocin, oxytocin receptor and CD38 gene knockout mice. J. Neuroendocrinol. 2010. 22 (5): 373–379.
Higashida H., Yokoyama S., Huang J.J., Liu L., Ma W.J., Akther S., Higashida C., Kikuchi M., Minabe Y., Munesue T. Social memory, amnesia, and autism: Brain oxytocin secretion is regulated by NAD+ metabolites and single nucleotide polymorphisms of CD38. Neurochem. Int. 2012. 61 (6): 828–838.
Higashida H., Yokoyama S., Munesue T., Kikuchi M., Minabe Y., Lopatina O. Cd38 Gene Knockout Juvenile Mice: A Model of Oxytocin Signal Defects in Autism. Biological & Pharmaceutical Bulletin. 2011. 34 (9): 1369–1372.
Hirsch M.M., Deckmann I., Fontes-Dutra M., Bauer-Negrini G., Della-Flora Nunes G., Nunes W., Rabelo B., Riesgo R., Margis R., Bambini-Junior V., Gottfried C. Behavioral alterations in autism model induced by valproic acid and translational analysis of circulating microRNA. Food Chem. Toxicol. 2018. 115: 336–343.
Jacobs S., Huang F., Tsien J., Wei W. Social Recognition Memory Test in Rodents. Bio-Protocol. 2016. 6 (9): 1–12.
Jin D., Liu H.X., Hirai H., Torashima T., Nagai T., Lopatina O., Shnayder N.A., Yamada K., Noda M., Seike T., Fujita K., Takasawa S., Yokoyama S., Koizumi K., Shiraishi Y., Tanaka S., Hashii M., Yoshihara T., Higashida K., Islam M.S., Yamada N., Hayashi K., Noguchi N., Kato I., Okamoto H., Matsushima A., Salmina A., Munesue T., Shimizu N., Mochida S., Asano M., Higashida H. CD38 is critical for social behaviour by regulating oxytocin secretion. Nature. 2007. 446 (7131): 41–45.
Jory J. Abnormal fatty acids in Canadian children with autism. Nutrition. 2016. 32 (4): 474–477.
Kang J., Kim E. Suppression of NMDA receptor function in mice prenatally exposed to valproic acid improves social deficits and repetitive behaviors. Front. Mol. Neurosci. 2015. 8 (17): 1–9.
Kataoka S., Takuma K., Hara Y., Maeda Y., Ago Y., Matsuda T. Autism-like behaviours with transient histone hyperacetylation in mice treated prenatally with valproic acid. Int. J. Neuropsychopharmacol. 2013. 16 (1): 91–103.
Kazdoba T.M., Leach P.T., Silverman J.L., Crawley J.N. Modeling fragile X syndrome in the Fmr1 knockout mouse. Intractable Rare Dis. Res. 2014. 3 (4): 118–133.
Kim J.W., Seung H., Kim K.C., Gonzales E.L.T., Oh H.A., Yang S.M., Ko M.J., Han S.H., Banerjee S., Shin C.Y. Agmatine rescues autistic behaviors in the valproic acid-induced animal model of autism. Neuropharmacology. 2017. 113: 71–81.
Kim K.C., Kim P., Go H.S., Choi C.S., Park J.H., Kim H.J., Jeon S.J., Dela Pena I.C., Han S.H., Cheong J.H., Ryu J.H., Shin C.Y. Male-specific alteration in excitatory post-synaptic development and social interaction in pre-natal valproic acid exposure model of autism spectrum disorder. J. Neurochem. 2013. 124 (6): 832–843.
Kim K.C., Kim P., Go H.S., Choi C.S., Yang S.Il, Cheong J.H., Shin C.Y., Ko K.H. The critical period of valproate exposure to induce autistic symptoms in Sprague-Dawley rats. Toxicol. Lett. 2011. 201 (2): 137–142.
Kim P., Park J.H., Kwon K.J., Kim K.C., Kim H.J., Lee J.M., Kim H.Y., Han S.H., Shin C.Y. Effects of Korean red ginseng extracts on neural tube defects and impairment of social interaction induced by prenatal exposure to valproic acid. Food Chem. Toxicol. 2013. 51: 288–296.
Kudryavtseva N.N. Experience of defeat decreases the behavioural reactivity to conspecifics in the partition test. Behav. Processes. 1994. 32 (3): 297–304.
Li Y., Zhou Y., Peng L., Zhao Y. Reduced protein expressions of cytomembrane GABAARβ3 at different postnatal developmental stages of rats exposed prenatally to valproic acid. Brain Res. 2017. 1671: 33–42.
Liang M., Zhong J., Liu H., Lopatina O., Nakada R. Pairmate-dependent pup retrieval as parental behavior in male mice. Front. Neurosci. 2014. 8 (186): 1–10.
Liu H.X., Lopatina O., Higashida C., Fujimoto H., Akther S., Inzhutova A., Liang M., Zhong J., Tsuji T., Yoshihara T., Sumi K., Ishiyama M., Ma W.J., Ozaki M., Yagitani S., Yokoyama S., Mukaida N., Sakurai T., Hori O., Yoshioka K., Hirao A., Kato Y., Ishihara K., Kato I., Okamoto H., Cherepanov S.M., Salmina A.B., Hirai H., Asano M., Brown D.A., Nagano I., Higashida H. Displays of paternal mouse pup retrieval following communicative interaction with maternal mates. Nat. Commun. 2013. 4: 1346–1348.
Loomes R., Hull L., Mandy W.P.L.What Is the Male-to-Female Ratio in Autism Spectrum Disorder? A Systematic Review and Meta-Analysis. J. Am. Acad. Child. Adolesc. Psychiatry. 2017. 56 (6): 466–474.
Lopatina O., Yoshihara T., Nishimura T., Zhong J., Akther S., Fakhrul A.A.K.M., Liang M., Higashida C., Sumi K., Furuhara K., Inahata Y., Huang J.-J., Koizumi K., Yokoyama S., Tsuji T., Petugina Y., Sumarokov A., Salmina A.B., Hashida K., Kitao Y., Hori O., Asano M., Kitamura Y., Kozaka T., Shiba K., Zhong F., Xie M.-J., Sato M., Ishihara K., Higashida H. Anxiety- and depression-like behavior in mice lacking the CD157/BST1 gene, a risk factor for Parkinson’s disease. Front. Behav. Neurosci. 2014. 8 (133): 1–18.
Lopatina O.L., Furuhara K., Ishihara K., Salmina A.B., Higashida H. Communication impairment in ultrasonic vocal repertoire during the suckling period of Cd157 knockout mice: Transient improvement by oxytocin. Front. Neurosci. 2017. 11 (266): 1–11.
MacFabe D.F., Cain D.P., Rodriguez-Capote K., Franklin A.E., Hoffman J.E., Boon F., Taylor A.R., Kavaliers M., Ossenkopp K.P. Neurobiological effects of intraventricular propionic acid in rats: Possible role of short chain fatty acids on the pathogenesis and characteristics of autism spectrum disorders. Behav. Brain Res. 2007. 176 (1): 149–169.
MacFabe D.F., Cain N.E., Boon F., Ossenkopp K.P., Cain D.P. Effects of the enteric bacterial metabolic product propionic acid on object-directed behavior, social behavior, cognition, and neuroinflammation in adolescent rats: Relevance to autism spectrum disorder. Behav. Brain Res. 2011. 217 (1): 47–54.
MacFabe D.F., Thomas R.H., Foley K.A., Mepham J.R., Tichenoff L.J., Possmayer F. Altered brain phospholipid and acylcarnitine profiles in propionic acid infused rodents: Further development of a potential model of autism spectrum disorders. J. Neurochem. 2010. 113 (2): 515–529.
Main S.L., Kulesza R.J. Repeated prenatal exposure to valproic acid results in cerebellar hypoplasia and ataxia. Neuroscience. 2017. 340: 34–47.
Maraz A., Hende B., Urban R., Demetrovics Z. Pathological grooming: Evidence for a single factor behind trichotillomania, skin picking and nail biting. PLoS ONE. 2017. 12 (9): 1–13.
Markram K., Rinaldi T., Mendola D. La, Sandi C., Markram H. Abnormal fear conditioning and amygdala processing in an animal model of autism. Neuropsychopharmacology. 2008. 33 (4): 901–912.
Mehta M.V., Gandal M.J., Siegel S.J. mGluR5-antagonist mediated reversal of elevated stereotyped, repetitive behaviors in the VPA model of autism. PLoS ONE. 2011. 6 (10): 1–6.
Merten S. Von, Hoier S., Pfeifle C., Tautz D. A Role for Ultrasonic Vocalisation in Social Communication and Divergence of Natural Populations of the House Mouse (Mus musculus domesticus). PLoS ONE. 2014. 9 (5): 1–18.
Mineur Y.S., Huynh L.X., Crusio W.E.Social behavior deficits in the Fmr1 mutant mouse. Behav. Brain Res. 2006. 168 (1): 172–175.
Miyazaki S., Hiraoka Y., Hidema S., Nishimori K. Prenatal minocycline treatment alters synaptic protein expression, and rescues reduced mother call rate in oxytocin receptor-knockout mice. Biochem. Biophys. Res. Commun. 2016. 472 (2): 319–323.
Moore S.J., Turnpenny P.D., Quinn A., Glover S., Lloyd D.J., Montgomery T., Dean J.C.S. A clinical study of 57 children with fetal anticonvulsant syndromes. J. Med. Genet. 2000. 37 (7): 489–497.
Morland C., Frøland A.-S., Pettersen M.N., Storm-Mathisen J., Gundersen V., Rise F., Hassel B. Propionate enters GABAergic neurons, inhibits GABA transaminase, causes GABA accumulation and lethargy in a model of propionic acidemia. Biochem. J. 2018. 475 (4): 749–758.
Moy S.S., Nadler J.J., Young N.B., Perez A., Holloway L.P., Barbaro R.P., Barbar, J.R., Wilson L.M., Threadgill D.W., Lauder J.M., Magnuson T.R., Crawley J.N. Mouse behavioral tasks relevant to autism: Phenotypes of 10 inbred strains. Behav Brain Research. 2007. 176 (1): 4–20.
Munesue T., Yokoyama S., Nakamura K., Anitha A., Yamada K., Hayashi K., Asaka T., Liu H.X., Jin D., Koizumi K., Islam M.S., Huang J.J., Ma W.J., Kim U.H., Kim S.J., Park K., Kim D., Kikuchi M., Ono Y., Nakatani H., Suda S., Miyachi T., Hirai H., Salmina A.B., Pichugina Y.A., Soumarokov A.A., Takei N., Mori N., Tsujii M., Sugiyama T., Yagi K., Yamagishi M., Sasaki T., Yamasue H., Kato N., Hashimoto R., Taniike M., Hayashi Y., Hamada J., Suzuki S., Ooi A., Noda M., Kamiyama Y., Kido M.A., Lopatina O.L., Hashii M., Amina S., Malavasi F., Huang E.J., Zhang J., Shimizu N., Yoshikawa T., Matsushima A., Minabe Y., Higashida H.Two genetic variants of CD38 in subjects with autism spectrum disorder and controls. Neurosci. Res. 2010. 67 (2): 181–191.
Nolan S.O., Reynolds C.D., Smith G.D., Holley A.J., Escobar B., Chandler M.A., Volquardsen M., Jefferson T., Pandian A., Smith T., Huebschman J., Lugo J.N. Deletion of Fmr1 results in sex-specific changes in behavior. Brain Behav. 2017. 7 (10): 1–13.
Oddi D., Subashi E., Middei S., Bellocchio L., Lemaire-mayo V., Crusio W.E., Amato F.R.D., Pietropaolo S. Early Social Enrichment Rescues Adult Behavioral and Brain Abnormalities in a Mouse Model of Fragile X Syndrome. Neuropsychopharmacology. 2015. 40 (5): 1113–1122.
Pelch K.E., Bolden A.L., Kwiatkowski C.F. Environmental Chemicals and Autism: A Scoping Review of the Human and Animal Research. Environ. health perspect. 2019. 127 (4): 1–12.
Pietropaolo S., Guilleminot A., Martin B., D’Amato F.R., Crusio W.E. Genetic-background modulation of core and variable autistic-like symptoms in Fmr1 knock-out mice. PLoS ONE. 2011. 6 (2): 1–11.
Pobbe L., Pearson B.L., Defensor E.B., Bolivar V.J., IIId W.S.Y., Lee H.J., Blanchard D.C., Blanchard R.J. Oxytocin receptor knockout mice display deficits in the expression of autism-related behaviors. Horm. Behav. 2012. 61 (3): 436–444.
Qin M., Huang T., Kader M., Krych L., Xia Z., Burlin T., Zeidler Z., Zhao T., Smith C.B. R-Baclofen Reverses a Social Behavior Deficit and Elevated Protein Synthesis in a Mouse Model of Fragile X Syndrome. Int. J. Neuropsychopharmacol. 2015. 18 (9): 1–13.
Robison W.T., Myers M.M., Hofer M.A., Shair H.N., Welch M.G. Prairie vole pups show potentiated isolation-induced vocalizations following isolation from their mother, but not their father. Dev. Psychobiol. 2016. 58 (6): 687–699.
Rodier P.M., Ingram J.L., Tisdale B., Croog V.J. Linking etiologies in humans and animal models: Studies of autism. Reprod. Toxicol. 1997. 11 (2–3): 417–422.
Rodier P.M., Ingram J.L., Tisdale B., Nelson S., Romano J. Embryological origin for autism: Developmental anomalies of the cranial nerve motor nuclei. Journal of Comparative Neurology. 1996. 370 (2): 247–261.
Sala M., Braida D., Donzelli A., Martucci R., Busnelli M., Bulgheroni E., Rubino T., Parolaro D., Nishimori K., Chini B. Mice Heterozygous for the Oxytocin Receptor Gene (Oxtr+/-) Show Impaired Social Behaviour but not Increased Aggression or Cognitive Inflexibility: Evidence of a Selective Haploinsufficiency Gene Effect. J. Neuroendocrinol. 2013. 25 (2): 107–118.
Salmina A.B., Lopatina O., Ekimova M.V., Mikhutkina S.V., Higashida H. CD38/cyclic ADP-ribose system: A new player for oxytocin secretion and regulation of social behaviour. J. Neuroendocrinology. 2010. 22 (5): 380–392.
Sauer C., Montag C., Worner C., Kirsch P., Reuter M. Effects of a Common Variant in the CD38 Gene on Social Processing in an Oxytocin Challenge Study: Possible Links to Autism. Neuropsychopharmacology. 2012. 37 (6): 1474–1482.
Scattoni M.L., Crawley J., Ricceri L. Ultrasonic vocalizations: a tool for behavioural phenotyping of mouse models of neurodevelopmental disorders. Neurosci. Biobehav. Rev. 2010. 33 (4): 508–515.
Schneider T., Przewłocki R. Behavioral alterations in rats prenatally to valproic acid: Animal model of autism. Neuropsychopharmacology. 2005. 30 (1): 80–89.
Seffer D., Schwarting R.K.W., Wöhr M. Pro-social ultrasonic communication in rats: Insights from playback studies. J. Neurosci. Methods. 2014. 234: 73–81.
Sethna F., Feng W., Ding Q., Robison A.J., Feng Y., Wang H. Enhanced expression of ADCY1 underlies aberrant neuronal signalling and behaviour in a syndromic autism model. Nature Commun. 2017. 8: 1–11.
Shultz S.R., Aziz N.A.B., Yang L., Sun M., MacFabe D.F., O’Brien T.J. Intracerebroventricular injection of propionic acid, an enteric metabolite implicated in autism, induces social abnormalities that do not differ between seizure-prone (FAST) and seizure-resistant (SLOW) rats. Behav. Brain Res. 2015. 278: 542–548.
Shultz S.R., MacFabe D.F., Ossenkopp K.P., Scratch S., Whelan J., Taylor R., Cain D.P. Intracerebroventricular injection of propionic acid, an enteric bacterial metabolic end-product, impairs social behavior in the rat: Implications for an animal model of autism. Neuropharmacology. 2008. 54 (6): 901–911.
Silverman J.L., Tolu S.S., Barkan C.L., Crawley J.N. Repetitive Self-Grooming Behavior in the BTBR Mouse Model of Autism is Blocked by the mGluR5 Antagonist MPEP. Neuropsychopharmacology. 2009. 35 (4): 976–989.
Sinclair D., Featherstone R., Naschek M., Nam J., Du A., Wright S., Pance K., Weger R., Akuzawa S., Matsumoto M., Siegel S.J. GABA-B Agonist Baclofen Normalizes Auditory- Evoked Neural Oscillations and Behavioral Deficits in the Fmr1 Knockout Mouse Model of Fragile X Syndrome. eNeuro. 2017. 4 (1): 1–13.
Spencer C.M., Alekseyenko O., Hamilton S.M., Thomas A.M., Serysheva E., Yuva-Paylor L.A., Paylor R. Modifying Behavioral Phenotypes in Fmr1 KO Mice: Genetic Background Differences Reveal Autistic-Like Responses. Autism Res. 2012. 4 (1): 40–56.
Tammimies K. Genetic mechanisms of regression in autism spectrum disorder. Neurosci. Biobehav. Rev. 2019. 102: 208–220.
Tordjman S., Somogyi E., Coulon N., Kermarrec S., Cohen D., Bronsard G., Bonnot O., Weismann-Arcache C., Botbol M., Lauth B., Ginchat V., Roubertoux P., Barburoth M., Kovess V., Geoffray M.M., Xavier J. Gene × environment interactions in autism spectrum disorders: Role of epigenetic mechanisms. Front. Psychiatry. 2014. 5 (53): 1–17.
Wahlsten D., Metten P., Crabbe J.C. Survey of 21 inbred mouse strains in two laboratories reveals that BTBR T / 1 tf / tf has severely reduced hippocampal commissure and absent corpus callosum. Brain Res. 2003. 971 (1): 47–54.
Wang L., Cai Y., Fan X. Metformin Administration During Early Postnatal Life Rescues Autistic-Like Behaviors in the BTBR T+ Itpr3tf/J Mouse Model of Autism. Front. Behav. Neurosci. 2018. 12 (290): 1–10.
Wegiel Jerzy, Flory M., Kuchna I., Nowicki K., Ma S.Y., Imaki H., Wegiel J., Cohen I.L., London E., Wisniewski T., Brown W.T. Stereological study of the neuronal number and volume of 38 brain subdivisions of subjects diagnosed with autism reveals significant alterations restricted to the striatum, amygdala and cerebellum. Acta Neuropathol. Commun. 2014. 2 (141): 1–18.
Willner P. Animal models of depression: an overview. Pharmacol. ther. 1990. 45 (3): 425–455.
Winslow J.T., Insel T.R. The social deficits of the oxytocin knockout mouse. Neuropeptides. 2002. 36 (2–3): 221–229.
Winslow J.T., Young L.J., Matzuk M.M., Ferguson J., Hearn E.F., Insel T.R. Infant Vocalization, Adult Aggression, and Fear Behavior of an Oxytocin Null Mutant Mouse. Hormones and Behavior. 2002. 37 (2): 145–155.
Wu H., Wang X., Gao J., Liang S., Hao Y., Sun C., Xia W., Cao Y., Wu L. Fingolimod (FTY720) attenuates social deficits, learning and memory impairments, neuronal loss and neuroinflammation in the rat model of autism. Life Sci. 2017. 173: 43–54.
Wu H.F., Chen P.S., Hsu Y.T., Lee C.W., Wang T.F., Chen Y.J., Lin H.C. D-Cycloserine Ameliorates Autism-Like Deficits by Removing GluA2-Containing AMPA Receptors in a Valproic Acid-Induced Rat Model. Mol. Neurobiol. 2018. 55 (6): 4811–4824.
Yamaguchi H., Hara Y., Ago Y., Takano E., Hasebe S., Nakazawa T., Hashimoto H., Matsuda T., Takuma K. Environmental enrichment attenuates behavioral abnormalities in valproic acid-exposed autism model mice. Behav. Brain Res. 2017. 333: 67–73.
Yang M., Silverman J.L., Crawley J.N. Automated Three-Chambered Social Approach Task for Mice. Curr. Protoc. Neurosci. 2016. 8 (8.26): 1–23.
Zala S.M., Reitschmidt D., Noll A., Balazs P., Penn D.J. Sex-dependent modulation of ultrasonic vocalizations in house mice (Mus musculus musculus). PLoS ONE. 2017. 12 (12): 1–15.
Zhang J., Liu L.M., Ni J.F. Rapamycin modulated brain-derived neurotrophic factor and B-cell lymphoma 2 to mitigate autism spectrum disorder in rats. Neuropsychiatr. Dis. Treat. 2017. 13: 835–842.
Дополнительные материалы отсутствуют.
Инструменты
Журнал высшей нервной деятельности им. И.П. Павлова


