Журнал высшей нервной деятельности им. И.П. Павлова, 2020, T. 70, № 2, стр. 243-258
ПОЛОВЫЕ РАЗЛИЧИЯ В ТРЕВОЖНО-ДЕПРЕССИВНОМ И ОБОРОНИТЕЛЬНОМ ПОВЕДЕНИИ КРЫС ВИСТАР
И. В. Павлова 1, *, Н. Д. Брошевицкая 1, М. В. Онуфриев 1, Ю. В. Моисеева 1
1 Федеральное государственное бюджетное учреждение науки Институт высшей нервной деятельности
и нейрофизиологии РА
Москва, Россия
* E-mail: pavlovfml@mail.ru
Поступила в редакцию 25.06.2019
После доработки 05.09.2019
Принята к публикации 16.09.2019
Аннотация
С целью выявления половых различий поведения животных в аверсивных ситуациях сопоставляли поведение самцов и самок крыс Вистар в тестах на тревожность, депрессивно-подобное поведение, динамику выработки и угашения классического оборонительного рефлекса, рефлекса пассивного избегания, а также выработку рефлекса активного избегания. В тестах на тревожность самки отличались от самцов более низким уровнем тревожности, большей двигательной и исследовательской активностью. В тесте Порсолта у самок наблюдалось меньше признаков депрессивно-подобного поведения. После стрессирующего воздействия содержание кортикостерона в крови самок было выше, чем у самцов. У самок наблюдалась более высокая болевая чувствительность. Проявление условнорефлекторного страха при рефлексе пассивного избегания было больше у самцов, чем у самок; при классическом оборонительном рефлексе – не отличалось у животных разного пола. Угашение условнорефлекторного страха при этих двух формах рефлексов проходило быстрее у самок, чем у самцов. Выработка рефлекса активного избегания легче проходила у самок, чем у самцов. Предполагается, что самки в большей степени склонны к активной оборонительной стратегии и переоценивают опасность, самцы, наоборот, предпочитают пассивно-оборонительное реагирование.
Как известно, существуют половые различия в предрасположенности к развитию многих психических заболеваний у человека. Так, например, женщины в большей степени, чем мужчины, подвержены депрессии [Najjar et al., 2018], развитию тревожных расстройств [Park et al., 2017; Daviu et al., 2014], хронического болевого синдрома и аутоиммунных заболеваний [Sorge, Totsch, 2016]. Вопрос о том, какие особенности реагирования женского организма на стрессирующие или эмоционально-негативные воздействия делает его уязвимым для развития патологии, крайне актуален и далек от разрешения.
В подавляющем большинстве нейрофизиологических экспериментов на животных используются самцы. Тем не менее к настоящему времени в литературе имеются данные о половых различиях у крыс в выработке, угашении и восстановлении условнорефлекторного страха [Park et al., 2017; Daviu et al., 2014], активности гипоталамо-гипофизарно-надпочечниковой оси [Daviu et al., 2014], реакциях на стрессирующие воздействия [Toledo-Rodriguez, Sandi, 2007; Guadagno et al., 2018; Kosten et al., 2005; 2006; Sun et al., 2014; Claypoole et al., 2017]. Основной экспериментальной моделью для изучения проявления и угашения условнорефлекторного страха является выработка классического оборонительного условного рефлекса как на обстановку, так и на звуковые сигналы. Работы с другими моделями оборонительного поведения (условным рефлексом пассивного избегания или активного избегания) либо отсутствуют, либо крайне малочисленны. Половые различия в оборонительном поведении крыс выявлены и при действии неболевых стимулов (запах или присутствие кошки) [Blanchard et al., 1991].
В качестве основной причины разного реагирования у самцов и самок на угрожающие стимулы рассматривается влияние половых гормонов, эстрогенов у самок и тестостерона у самцов [Graham, Daher, 2016; Milad et al., 2009; Graham, Scott, 2018; Domonkos et al., 2017; Yang et al., 2014; Frye et al., 2000; Van Haaren et al., 1990]. Роль половых гормонов убедительно демонстрируется в опытах с гонадоэктомией и искусственным введением половых гормонов [Domonkos et al., 2017; Naslund et al., 2016; Carrier, Kabbaj, 2012], а также при сопоставлении поведения самок на разных стадиях эстрального цикла, когда содержание эстрогена и прогестерона может существенно отличаться [Milad et al., 2009; Graham, Daher, 2016; Graham, Scott, 2018; Frye et al., 2000].
Наше исследование было предпринято с целью комплексного сопоставления поведения самцов и самок крыс Вистар при выработке и угашении различных оборонительных рефлексов, а также при тестировании на тревожно-депрессивное поведение. В задачи работы входило сопоставление у самцов и самок 1) уровня тревожности в тесте открытого поля и приподнятого крестообразного лабиринта, 2) депрессивноподобного поведения в тесте Порсолта, 3) уровня кортикостерона и провоспалительного цитокина в крови, 4) болевой чувствительности к действию электрокожного раздражения, 5) выработки и угашения классического оборонительного рефлекса на звук, 6) выработки и угашения условного рефлекса пассивного избегания в темно-светлой камере, 7) выработки рефлекса активного избегания в челночной камере.
МЕТОДИКА
Объект исследования. Опыты проводили на 54 крысах Вистар в возрасте от 25 дней до 6 мес (30 самцов и 24 самки). Крысята (7 пометов) были выведены в виварии ИВНД и НФ РАН от крыс, полученных из филиала “Столбовая” ФГБУН НЦБМТ ФМБА России. В возрасте 30 дней крысят отлучали от матери и разделяли на группы в зависимости от пола, в одной клетке размером 35 × 55 × 20 см в дальнейшем содержалось 3–5 крыс одного пола из одного помета. В возрасте 1 мес вес самцов составлял 77.2 ± 4.8 г, самок 80.2 ± 5.3 г. В возрасте 3 мес вес самцов (326.9 ± 5.9 г) был больше, чем у самок (217.5 ± 7.9 г), различие статистически значимо (р < 0.001, post hoc анализ, Factorial ANOVA). Животные содержались в виварии при обычном 12-часовом световом режиме со свободным доступом к воде и стандартному корму. Опыты проводили в светлое время суток с 12 до 18 ч. Все животные участвовали во всех поведенческих тестах, иммуноферментный анализ и соответственно последнее тестирование в тесте Порсолта проводилось у половины животных. В экспериментах соблюдали принципы гуманности, изложенные в директивах Европейского Совета (2010/63/ЕU), и положения ИВНД и НФ РАН о работе с экспериментальными животными.
Тестирование уровня тревожности. В работе изучали поведение крыс в двух тестах на тревожность: в “открытом поле” (ОП) и в “приподнятом крестообразном лабиринте” (ПКЛ). Перед первым тестированием для снижения стрессирующей нагрузки на животных проводился 15-минутный хендлинг в течение 4–5 дней, при этом животных брали в руки, пересаживали из домашней клетки в переноску и обратно. Первый раз крыс тестировали в возрасте 30 дней, второй раз – в возрасте 3 мес. Использовали общепринятые размеры и конфигурации лабиринта и ОП, которые были подробно описаны ранее [Павлова, Рысакова, 2015]. Время наблюдения в каждом тесте 5 мин. Для фиксирования траектории движения крыс и элементов поведения использовали программу Etho Vision, а также видеорегистрацию. Анализировали показатели, отражающие тревожность/смелость крыс (время нахождения на периферии ОП, число и длительность выходов в центр ОП, в открытые рукава ПКЛ), двигательную активность крыс (пройденную дистанцию, скорость движения, время движения, число переходов между рукавами в ПКЛ), исследовательское поведение (стойки, выглядывания в открытые рукава в ПКЛ), поведение по оценке риска (свешивания в ПКЛ, вытягивания), элементы замещающего поведения (число и длительность груминга), а также ряд показателей, отражающих вегетативные реакции (число дефекаций и уринаций). Перед помещением в камеру животного другого пола лабиринт тщательно мыли и протирали 20% раствором этилового спирта. Для переноски самцов и самок из вивария в экспериментальную комнату и для ожидания своей очереди использовали разные клетки.
Тестирование на депрессивно-подобное поведение. В один, три и шесть месяцев через 2–3 дня после тестирования на тревожность проводили тест Порсолта. Для теста Порсолта использовали цилиндры из оргстекла диаметром 20 см и высотой 50 см, которые заполнялись водой температурой 25–26°С на 30 см. В первый день в возрасте 1 мес (обучение, выработка “поведенческого отчаяния”) крыс помещали в воду на 15 мин. Во второй день (тест) и далее в 3 и 6 мес крысы находились в воде 5 мин. При зависании крысы могли осуществлять небольшие движения лапами и хвостом для коррекции положения тела около поверхности воды. Во время опыта проводили видеорегистрацию. При обработке подсчитывали время зависания поминутно и суммарно за весь опыт, число эпизодов зависания и среднюю длительность таких эпизодов за опыт.
Определение порогов болевых реакций. Опыты проводили в камере Startle and Fear Combined System производства PanLab Harvard apparatus, Spain, 2000. Внутренняя камера размером 24 × 24 × 24 см, куда помещали животное, располагалась на 4 датчиках, фиксирующих движения крысы. Пол камеры представлял собой решетку, на которую подавался ток нарастающей силы (0, 25, 50, 100, 150 и 200 мкА) с межстимульным интервалом 90–120 с, длительностью 0.3 с. В опытах участвовали крысы в возрасте 3.5 мес. Реакцию крысы на ток определяли визуально, а также по записи механограммы, которую анализировали в интервалах 5 с до, во время и 50 с после стимула. Определяли порог вздрагивания, прыжков, побежки и вокализации в слышимом ухом человека диапазоне частот. После опыта с определением порогов в течение двух дней проводили угашение страха на обстановку камеры, для чего крыс помещали в камеру на 10 мин. Во всех последующих экспериментах в данной камере значительно меняли контекст: опилками покрывали пол, стены заклеивали бумагой.
Выработка, тестирование и угашение классического условного оборонительного рефлекса (УОР). Для выработки классического Павловского условного оборонительного рефлекса использовали камеру Startle and Fear Combined System производства PanLab Harvard apparatus (Spain, 2000). При обучении после 120 с интервала исследования камеры животным давали 3 сочетания звука (30 с, 80 дБ, 2000 Гц) и электрокожного раздражения (2 с, 0.8 мА, задержка 28 с от начала действия звука) с 40–50 с межсигнальными интервалами. Затем через 24 ч после обучения проводили тестирование условнорефлекторного страха (Тест 1), при этом предъявляли только звук (120 с, 80 дБ, 2000 Гц). Далее в двух опытах проводили угашение условнорефлекторного страха, при этом давали 10 изолированных звуковых стимулов (30 с, 80 дБ, 2000 Гц) без электрокожных раздражений. После опытов с угашением тестировали сохранность рефлекса (Тест 2) без подачи тока. Более подробно методика была описана ранее [Павлова, Рысакова, 2015].
Поведение крыс анализировали в интервалы времени до, во время и после действия звука. Замирание – периоды неподвижности длительностью не менее 2 с, когда можно было наблюдать только дыхательные движения животного, определяли с помощью амплитудного и временного порогов. Амплитудный порог зависел от веса крысы, усиления и выставлялся таким образом, чтобы отсечь интервалы с активным движением животного. Обработка проводилась с помощью стандартной программы, прилагающейся к установке фирмы Panlab. Программа позволяла детектировать эпизоды замирания, определять их длительность и рассчитывать процент времени замирания от времени регистрации. Кроме того, для оценки уровня эмоционального напряжения подсчитывали число дефекаций и уринаций.
Выработка условного рефлекса пассивного избегания (УРПИ) проходила в возрасте 4 мес в темно-светлой камере (аппаратно-программный комплекс Шелтер, ООО “Нейроботикс”, 2017). Детекция положения крысы проводилась с использованием инфракрасного излучения, а также с помощью видеорегистрации. Освещенность светлого отсека (24 см × 24 см × 35 см) была 115 лк, темного (24 см × 24 см × 35 см) – 2 лк. Через 30 с после помещения крысы в светлый отсек открывалась дверца между светлым и темным отсеком и в течение 180 с у крысы была возможность переходить из одного отсека в другой. Вначале проводили два контрольных опыта, в которых замеряли латентность ухода из светлого отсека и время нахождения в темном отсеке. В третьем опыте вырабатывали УРПИ путем подачи тока на пол темного отсека (3 с, 0.8 мА) после захода в него крысы. В последующих 7 опытах, проводившихся в течение 7 дней, смотрели сохранность и угашение навыка. Определяли латентность ухода в темный отсек и время пребывания в нем, число заглядываний, стоек, актов груминга, число дефекаций и уринаций. Выделяли заглядывания с упором на 1–3 лапы о пол темного отсека и заглядывания с засовыванием только головы в аверсивный отсек. Кроме того, делали оценку качества УРПИ в баллах: 5 баллов – крыса не заходит и не заглядывает в темный отсек; 4 балла – крыса не заходит, но заглядывает в темный отсек, засовывая только голову; 3 балла – крыса не заходит, но заглядывает, ставя 1–3 лапы на пол темного отсека; 2 балла – крыса заходит в темный отсек с большей латентностью, чем в контрольных опытах; 1 балл – крыса заходит в темный отсек с такой же латентностью, как в контрольных опытах.
Выработка условного рефлекса активного избегания (УРАИ) проходила в камере, разделенной на два равноценных отсека (24 см × × 24 см × 35 см) с проходом (6 × 8 см) между ними (аппаратно-программный комплекс Шелтер, ООО “Нейроботикс”, 2017). Контекст камеры меняли по сравнению с опытами с УРПИ путем размещения черно-белых панелей с геометрическим рисунком на стенах камеры. После 2 мин исследования крысой камеры с посещением обоих отсеков начинали выработку УРАИ. В качестве условного стимула использовали комплексный световой (100 лкс) и звуковой стимул (60 дБ), в качестве безусловного стимула – ток на решетку пола (0.4 мА). Задержка подачи тока от начала условного стимула составляла 10 с, максимальная длительность тока достигала 30 с. При переходе крысы в другой отсек все стимулы автоматически выключались. Межсигнальные интервалы варьировали от 20 до 60 с. Каждый опыт давалось по 12 сочетаний условных и безусловных стимулов, выработка проходила 7 дней. Выделяли два вида реакций крысы – избавление (крыса совершала переход в другой отсек после начала действия тока) и избегание (животное переходило в другой отсек до начала действия тока). В опыте подсчитывали частоту избеганий, избавлений, число межсигнальных реакций, латентность избеганий или избавлений от начала действия звуковых стимулов, число дефекаций и уринаций. Частота избегания (избавления) = число реакций избегания (избавления) за опыт/ общее число сочетаний за опыт (12). Считали, что животное обучилось, если частота реакций избегания за опыт превышала 0.7.
Иммуноферментный анализ крови. Через 20–30 мин после последнего 5-минутного тестирования в тесте Порсолта в возрасте 6 мес крыс выводили из эксперимента, умерщвляли декапитацией и собирали периферическую кровь, которую центрифугировали 15 мин при 4°С и 1500 g для получения сыворотки. Аликвоты сыворотки хранили при –80°С до проведения иммуноферментного анализа.
Для определения уровня кортикостерона в сыворотке крови использовали наборы для иммуноферментного анализа (DRG, Германия), с помощью которых детектировали как свободный, так и связанный с транспортными белками кортикостерон методом конкурентного иммуноферментного анализа. Содержание провоспалительного интерлейкина-1β (ИЛ-1β) в сыворотке крови определяли с помощью наборов производства R&D Systems (США) согласно инструкции производителя.
Статистическая обработка результатов. Для вторичной обработки результатов использовали стандартную программу STATISTICA 8.0. Распределение параметров, проанализированных в статье, было проверено на нормальность по критерию Kolmogorov-Smirnov (Basic Statistics, раздел Descriptive Statistics). Если анализируемый параметр удовлетворял данному критерию, в этом случае при сопоставлении групп крыс использовали дисперсионный анализ ANOVA, раздел многофакторный анализ (factorial ANOVA) или One-Way ANOVA. При post-hoc анализе применяли критерий Fisher LSD. Различия считали статистически значимыми при p < 0.05, отмечали наличие тенденции при 0.05 ≤ р ≤ 0.1. Анализировали влияние двух факторов “ПОЛ” и “ВОЗРАСТ”. При отсутствии нормальности распределения поведенческих параметров использовали Mann–Whitney U test (Nonparametric Statistics). При сравнении процентных соотношений использовали 2 × 2 Table (Nonparametric Statistics), применяли критерий χ2. Данные на рисунках представлены в виде среднее ± ± ошибка среднего.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЙ
Поведение самцов и самок в тестах на тревожность и депрессивно-подобное поведение. На рис. 1 и 2 представлены результаты сопоставления различных показателей поведения крыс в ОП и ПКЛ соответственно в зависимости от их пола и возраста. В ОП в случае нормальности распределения значений показателей поведения при применении Factorial ANOVA было обнаружено влияние фактора “ПОЛ” на пройденную дистанцию (F1,104 = = 44.06, p = 0.000), время движения (F1,104 = 31.44, p = 0.000), стойки (F1,104 = 10.67, p = 0.001), а также взаимодействие факторов “ПОЛ” и “ВОЗРАСТ” при анализе дистанции (F1,104 = = 15.74, p = 0.000), времени движения (F1,104 = = 9.28, p = 0.003). Post hoc анализ и сопоставление с помощью Mann–Whitney U test показали, что в возрасте 1 мес поведение самцов и самок не имело значимых различий в ОП, небольшие отличия наблюдались только на уровне тенденций (рис. 1 (б), (в), (г). В возрасте 3 мес по сравнению с 1 мес у самцов уменьшалась пройденная дистанция, время движения, увеличивалось число уринаций, у самок, наоборот, происходило увеличение пройденной дистанции, числа выходов в центр поля, числа стоек. Это приводило к появлению половых различий по многим параметрам поведения крыс в возрасте 3 мес. У самок по сравнению с самцами было больше выходов в центр (рис. 1 (а)), больше пройденная дистанция (в), время движения (г), число стоек (д). У самцов в 3 мес было больше время движения на периферии ОП (б), число уринаций и длительность груминга (е). Полученные результаты свидетельствуют о том, что в возрасте 3 мес самки по сравнению с самцами демонстрировали меньший уровень тревожности, большую двигательную и исследовательскую активность в ОП.
Рис. 1.
Различные показатели поведения самцов и самок в ОП в возрасте 1 и 3 мес. ↓↑ снижение/увеличение показателя в три месяца по сравнению с 1 мес, * – статистически значимые отличия между самцами и самками (p < 0.05), # – тенденция (0.05 < р < 0.1), на (в), (г), (д) – post hoc анализ, Factorial ANOVA, на (а), (б), (е) – Mann–Whitney U test). n – число крыс. Данные представлены в виде среднее±ошибка среднего.
Fig. 1. Various indicators of the behavior of males and females in the open field at the age of 1 and 3 months. ↓↑ decrease/increase in three months compared with 1 month, * – statistically significant differences between males and females (p < 0.05), # – trend (0.05 < p < 0.1), by (в), (г), (д) – post hoc analysis, Factorial ANOVA, on (а), (б), (е) – Mann–Whitney U test). n – the number of rats. Data are presented as mean ± mean error.
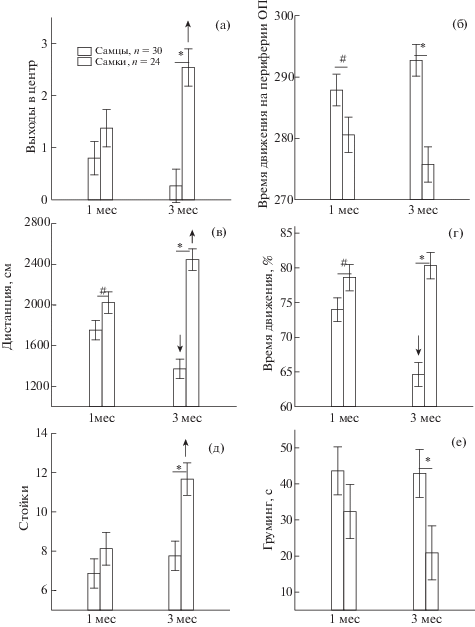
Рис. 2.
Различные показатели поведения самцов и самок в ПКЛ (а)–(е) и тесте Порсолта (ж), (з) в возрасте 1 и 3 мес ↓↑ снижение/увеличение показателя в три месяца по сравнению с 1 мес, * – статистически значимые различия между самцами и самками (p < 0.05), # – тенденция (0.05 < р < 0.1, post hoc анализ, Factorial ANOVA). На (ж) и (з) по оси абсцисс – время в мин. Т – время, ОР – открытые рукава лабиринта.
Fig. 2. Various indicators of the behavior of males and females in elevated plus-maze test (а)–(е) and the Porsolt test (ж), (з) at the age of 1 and 3 months. ↓↑ decrease/increase in three months compared with 1 month, * – statistically significant differences between males and females (p < 0.05), # – trend (0.05 < p < 0.1, post hoc analysis, Factorial ANOVA). T – time, OP – open arms.
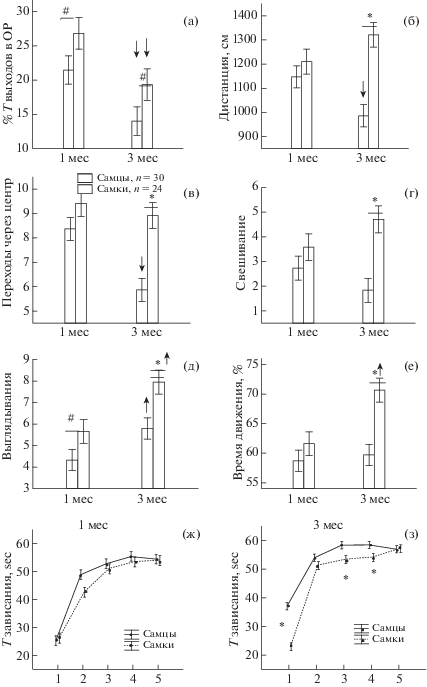
Анализ поведения животных в ПКЛ показал, что фактор “ПОЛ” оказывал влияние на процент времени выходов в открытые рукава (F1,104 = 5.89, p = 0.017), дистанцию (F1,104 = 16.68, p = 0.000), число переходов через центр (F1,104 = = 16.19, p = 0.000), время движения (F1,104 = = 13.04, p = 0.000), число свешиваний (F1,104 = = 13.02, p = 0.000) и выглядываний (F1,104 = = 10.98, p = 0.001). Взаимодействие фактора ПОЛ и ВОЗРАСТ наблюдалось при анализе дистанции (F1,104 = 7.79, p = 0.006), времени движения (F1,104 = 4.45, p = 0.037). В возрасте 1 мес post hoc анализ обнаружил слабые половые различия, проявляющиеся на уровне тенденции (рис. 2 (а), (д)). В три месяца по сравнению с 1 мес у самцов происходило снижение процента времени выходов в открытые рукава, числа переходов через центр, длины пройденной дистанции, но увеличение числа выглядываний (р < 0.05). У самок в этом возрасте также происходило снижение процента времени выходов в открытые рукава, увеличение числа выглядываний, а также, в отличие от самцов, увеличение времени движения. В три месяца наблюдались отчетливые половые различия: у самок была больше (р < < 0.05, post hoc анализ) пройденная дистанция (рис. 2 (б)), число переходов через центр (в), время движения (е), число свешиваний (г) и выглядываний (д). Процент времени выходов в открытые рукава у самок был незначительно больше, чем у самцов ((а), р = 0.090). Таким образом, у самок по сравнению с самцами в три месяца в ПКЛ была больше двигательная и исследовательская активность, по уровню тревожности отличия были небольшие.
В тесте Порсолта на депрессивноподобное поведение фактор ПОЛ оказывал слабое воздействие на уровне тенденции на время зависания крысы в возрасте 1 мес (F1,435 = 3.13, p = = 0.077, рис. 2 (ж)), в возрасте 3 мес влияние данного фактора становилось статистически значимым (F1,340 = 38.1, p = 0.000, рис. 2 (з)), данная закономерность сохранялась и в 6 мес (F1,160 = 4.21, p = 0.042). На число и длительность эпизодов зависания фактор ПОЛ не оказывал влияния (р > 0.05). Post-hoc анализ показал, что самки зависали на меньшее время, чем самцы на 1-й, 3-й и 4-й минутах (рис. 2 (з)). Полученные результаты свидетельствуют о меньшем проявлении депрессивноподобного поведения у взрослых самок, чем у самцов.
Сопоставление болевой чувствительности и поведенческой реактивности у самцов и самок. В используемой нами методике определения болевой чувствительности “flinch-jump” основными показателями являются пороги вздрагивания и прыжков. В нашей работе эти показатели были дополнены порогами побежек и вокализации. Результаты сопоставления различных порогов на ток увеличивающейся силы у самцов и самок представлены в табл. 1. Видно, что пороги вздрагивания, прыжков и побежек были выше у самцов, чем у самок. Пороги вокализации в слышимом человеком диапазоне не отличались у самцов и самок. Необходимо отметить, что вызвать побежки на используемый низкий ток до 200 мкА удалось только у 43% самцов и у 78% самок, причем пороги у самцов были существенно выше, чем у самок. Таким образом, болевая чувствительность у самок была выше, чем у самцов. Кроме того, характер поведенческих ответов отличался, самки чаще предпочитали совершать побежки в ответ на сравнительно небольшой ток.
Таблица 1.
Сопоставление порогов вздрагивания, прыжков, побежек и вокализации у самцов и самок с помощью One Way ANOVA Table 1. Comparison of flinching, jumping, running and vocalization thresholds in males and females with One Way ANOVA
| Порог | Самцы | Самки | F | p |
|---|---|---|---|---|
| Вздрагивания, мкА | 35.8 ± 2.2* | 28.3 ± 2.2* | F1,51 = 5.1 | 0.028 |
| Прыжки, мкА | 122.4 ± 7.2* | 90.0 ± 8.7* | F1,47 = 8.2 | 0.006 |
| Побежки, мкА | 134 ± 11.3* | 81.9 ± 9.6* | F1,29 = 12.67 | 0.001 |
| Вокализации, мкА | 66.4 ± 9.1 | 60.9 ± 10.2 | F1,50 = 0.16 | 0.687 |
Половые различия при выработке и угашении классического оборонительного рефлекса. Анализ процента времени замирания не выявил половых различий между крысами при выработке и тестировании (Тест 1) условного оборонительного рефлекса (фактор ПОЛ F1,355 = = 0.078, p = 0.779 и F1,153 = 0.037, p = 0.869 соответственно, рис. 3 (а) – (в). Также не было обнаружено различий (р > 0.05) в этих опытах между самцами и самками по числу дефекаций, уринаций, числу и длительности эпизодов замирания. Фактор ПОЛ оказывал влияние на замирание крыс после сеансов угашения в Тесте 2 (F 1,153 = 15.3, p = 0.000). При этом время замирания у самок было меньше, чем у самцов при действии звука и в последействии (р < 0.05, post hoc анализ, рис. 3 (г)).
Рис. 3.
Процент времени замирания самок и самцов при выработке, тестировании и угашении классического оборонительного рефлекса. (а) – схематичное изображение последовательности опытов. (б) – выработка рефлекса, по оси абсцисс – интервалы времени: До – до сочетаний, Зв1-3 – первый-третий звук, МС 1-2 – межсигнальный интервал 1 и 2, После – после сочетаний. (в) – Тест 1, (г) – Тест 2. На (в) и (г) интервалы времени: До – до начала звука, Звук – во время действия звука, После – после действия звука. * – статистически значимые отличия между самцами и самками (p < 0.05, post hoc анализ, Factorial ANOVA). (д) – запись механограммы пола камеры, эпизоды высокоамплитудного редкого дыхания отмечены снизу горизонтальной линией. Т – время.
Fig. 3. The percentage of freezing time of females and males in the acquisition, testing and extinction of fear conditioning. (а) – Scheme of the experiment. (б) – acquisition of a reflex, on the x-axis – time intervals: До – before stimulus, Зв1-3 – first-third sound, МС 1-2 – inter-signal interval 1 and 2, После – after combinations. (в) – Test 1, (г) – Test 2. On (в) and (г) time intervals: До – before the sound begins, Звук – during the sound action, После – after the sound. * – statistically significant differences between males and females (p < 0.05, post hoc analysis, Factorial ANOVA). (д) – the mechanogram of the camera floor, episodes of high-amplitude rare breathing are marked below with a horizontal line. T – time.
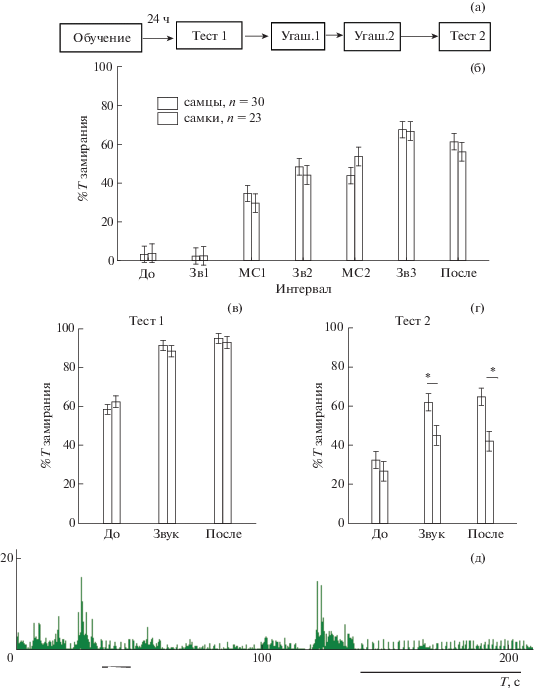
Для самцов было характерно появление высокоамплитудного редкого дыхания после обучения (рис. 3 (д)), которое детектировалось на записи механограммы пола клетки, а также визуально. Периоды такого дыхания возникали при замирании крысы, в большинстве случаев при действии звука, в редких случаях непродолжительные эпизоды возникали и при исследовании обстановки камеры до условного сигнала. Высокоамплитудное дыхание наблюдали у самцов в Тесте 1 в 60%, а в Тесте 2 в 27% случаев. У самок кратковременные эпизоды (до 10 с) такого дыхания встречались только у 4% животных в Тесте 1 и 2.
Таким образом, выработка классического оборонительного рефлекса и его проявление в тесте через 24 ч не отличались по уровню замирания у самцов и самок. Вместе с тем у самок рефлекс быстрее угашался. Замирание самцов коррелирует в отличие от самок с появлением высокоамплитудного редкого дыхания.
Половые различия при выработке и угашении УРПИ. Фактор ПОЛ оказывал влияние на латентность входа в темный отсек камеры (F1,460 = 7.87, p = 0.005), число переходов между отсеками (F1,413 = 35.71, p = 0.000), число заглядываний с упором на отдельные лапы о пол в темном отсеке (F1,322 = 14.61, p = 0.000). Проведенный post hoc анализ не выявил статистически значимых половых различий в первом опыте после обучения ни по латентности входа в темный отсек (рис. 4 (а)), ни по числу крыс, заходящих в темный отсек (4% среди самцов и 14% среди самок, рис. 4 (г)). Вместе с тем качественный анализ показал, что среди самцов в первом опыте процент крыс с УРПИ на 5 баллов (не заходят и даже не заглядывают в темный отсек) был выше (78%), чем у самок (43%, р = 0.013, χ2 = 6.15). Эти данные свидетельствуют о том, что условнорефлекторный страх у самцов проявлялся в большей мере, чем у самок.
Рис. 4.
Сопоставление выработки и угашения УРПИ у самцов и самок. (а) – латентность входа в темный отсек (с), (б) – число переходов между отсеками, (в) – число заглядываний с упором на 1–3 лапы в темном отсеке. (г) – процент крыс, заходящих в темный отсек в 1 и 7 опыт, (д) – процент крыс с УРПИ на 5 баллов в опыте 1, (е) – процент крыс с УРПИ на 4–5 баллов в опыте 7. На (а)–(в) по оси абсцисс – номер опыта (отрицательные значения – контрольные опыты до выработки, 0 – день выработки, 1–7 – после выработки). * – статистически значимые различия между самцами и самками, p < 0.05 (на (а)–(в) – post hoc анализ Factorial ANOVA, на (г)–(е) – критерий χ2).
Fig. 4. Comparison of acquisition and extinction of passive avoidance in males and females. (а) – the latency of the entrance to the dark compartment (s), (б) – the number of transitions between the compartments, (в) – the number of peeks with 1–3 paws in the dark compartment. (г) – the percentage of rats entering the dark compartment in 1 and 7 experience, (д) – the percentage of rats with passive avoidance reaction on 5 points in experiment 1, (е) – the percentage of rats with passive avoidance reaction on 4–5 points in experiment 7. On the (а)–(в) along the x-axis – number of experience (negative values – control experiments before learning, 0 – learning, 1–7 – extinction). * – statistically significant differences between males and females, p < 0.05 (on (а)–(в) – post hoc analysis of the Factorial ANOVA, on (г)–(е) – the χ2 criterion).
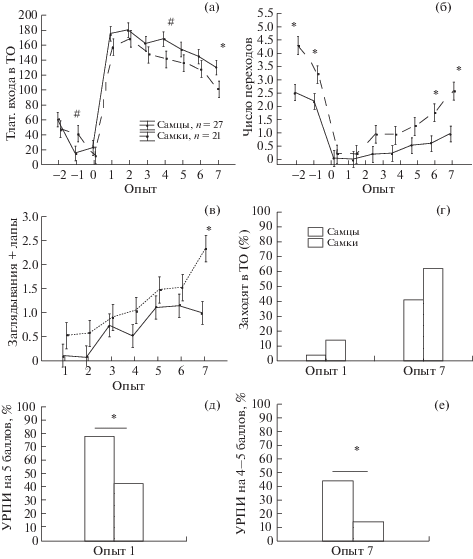
Угашение в течение семи дней привело к тому, что у самок по сравнению с самцами латентность входа в темный отсек в седьмом опыте была ниже (р < 0.05, рис. 4 (а)), число заглядываний с упором на отдельные лапы о пол в темном отсеке было больше (в), число переходов между отсеками больше (б). Число самок с УРПИ на 4 и 5 баллов (не заходят, но могут заглядывать в темный отсек) в седьмом опыте было меньше (14%, рис. 4 (е), чем среди самцов (44%, р = 0.025, χ2 = 5.00). Эти данные свидетельствовали о том, что у самок УРПИ угашался быстрее, чем у самцов, и условнорефлекторный страх проявлялся у них к 7-му дню в меньшей степени.
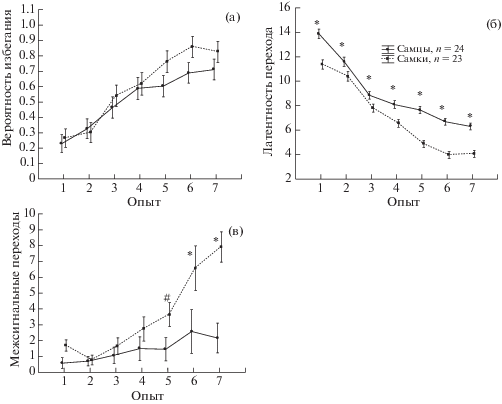
Половые различия при выработке УРАИ. Фактор ПОЛ не оказывал существенного влияния на частоту появления реакций избегания (F1,45 = 1.14, p = 0.292, рис. 5 (а)). За семь дней обучилось (достигли критерия “обученности” – 0.7 реакций избегания в опыте) 71% самцов и 87% самок, различие статистически не значимо (χ2 = 1.82, р = 0.177). Вместе с тем фактор ПОЛ оказывал существенное влияние на латентность переходов (F1,562 = 43.5, p = 0.000), при этом у самок во все дни была меньше латентность переходов из одного отсека в другой (рис. 5 (б)). Фактор ПОЛ влиял на число межсигнальных переходов (F1,45 = 9.37, p = 0.004). Post hoc анализ показал, что число межсигнальных переходов преобладало у самок по сравнению с самцами, начиная с пятого дня обучения (рис. 5 (в)). По числу уринаций и дефекаций самцы и самки имели незначительные отличия. Таким образом, при УРАИ имелись половые различия в обучении, у самок по сравнению с самцами была меньше латентность переходов между отсеками и больше межсигнальных переходов.
Рис. 5.
Сопоставление динамики выработки УРАИ у самцов и самок. По оси абсцисс – № опыта, по оси ординат на (а) – частота реакции избегания, на (б) – латентность перехода между отсеками, на (в) – число межсигнальных переходов. * – статистически значимые отличия между самцами и самками (p < 0.05, post hoc анализ, Repeated measures ANOVA). # – тенденция (0.05 < р < 0.1).
Fig. 5. Comparison of active avoidance learning in males and females. The abscissa axis is the number of the experiment, the ordinate on the (а) – the probability of avoidance reaction, on (б) – the latency of the transition between compartments, on (в) – the number of intersignal transitions. * – statistically significant differences between males and females (p < 0.05, post hoc analysis, Repeated measures ANOVA). # – the trend (0.05 < p < 0.1).
Половые различия в уровне кортикостерона и ИЛ-1β. Проведенный иммуноферментный анализ сыворотки крови, взятой через 20–30 мин после стрессирующего воздействия (тест Порсолта) у крыс в возрасте 6 мес, показал (табл. 2), что у самок уровень кортикостерона был выше, чем у самцов (F1,32 = 32.14, р = = 0.000, One-Way ANOVA). Уровень ИЛ-1β не отличался у животных разного пола.
Таблица 2.
Сопоставление уровня кортикостерона и ИЛ-1β в сыворотке крови у самцов и самок с помощью One Way ANOVA Table 2. Comparison of serum levels of corticosterone and IL-1β in males and females using One Way ANOVA
| Самцы | Самки | F | p | |
|---|---|---|---|---|
| Кортикостерон (нмоль/л) n = 15/19 | 722.7 ± 62.8* | 1198.9 ± 55.8* | F1,32 = 32.14 | 0.000 |
| ИЛ-1β (пг/мл) n = 13/18 | 98.9 ± 36.2 | 158.9 ± 30.8 | F1,29 = 1.59 | 0.217 |
Примечание: * – статистически значимые различия у самцов и самок (р < 0.05), n – число животных (самцы/самки). Данные представлены в виде среднее ± ошибка среднего. Note: * – statistically significant differences in males and females (p < 0.05), n – number of animals (males/females). The data are presented as mean ± standard error of mean.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
В нашей работе в аверсивных ситуациях были выявлены различия в поведении самцов и самок. При потенциальной угрозе в двух разных тестах на тревожность были получены сходные результаты. Если в подростковый период до полового созревания в возрасте 1 мес половые различия проявлялись слабо на уровне тенденции, то в три месяца у взрослых крыс различия в поведении самцов и самок обнаруживались по многим параметрам. В ОП и ПКЛ у самок была больше двигательная и исследовательская активность, ниже уровень тревожности. Сопоставление поведения в тесте вынужденного плавания показало, что самки зависают на меньшее время, чем самцы, т.е. показывают меньшие признаки депрессивноподобного поведения. Наши данные подтверждают сведения, имеющиеся в литературе, о половых различиях поведения крыс в тестах на тревожность и депрессивноподобное поведение. Ранее меньшая тревожность и большая двигательная и исследовательская активность самок в ОП и ПКЛ была описана во многих работах [Johnston, File, 1991; Verma et al., 2010; Belviranli et al., 2012; Azogu et al., 2018; Domonkos et al., 2017; Ou et al., 2019; Кривопалов, Юшков, 2015], в темно-светлой камере половых различий в поведении не было обнаружено [Domonkos et al., 2017]. Вместе с тем в тесте социального взаимодействия и в тесте Фогеля самки демонстрировали более тревожное поведение, чем самцы [Johnston, File, 1991]. В тесте вынужденного плавания самцы показывали большую иммобильность (зависание), чем самки, что свидетельствовало об их большем депрессивноподобном поведении [Borbelyova et al., 2016; Azogu et al., 2018].
В качестве основной причины возникновения половых различий в тревожном поведении самок и самцов рассматривается разная концентрация половых гормонов в крови животных, высокий уровень эстрогенов у самок и тестостерона у самцов. Кастрация животных перед половым созреванием была способна уменьшить половые различия по уровню тревожности [Domonkos et al., 2017]. Известно, что введение эстрадиола овариэктомированным самкам приводит к увеличению числа выходов в центр открытого поля, увеличению времени нахождения в открытых рукавах ПКЛ, снижению времени иммобильности (зависания) в тесте вынужденного плавания, т.е. оказывает анксиолитическое и антидепрессивное действие [Yang et al., 2014]. В специальных исследованиях было показано, что бета-изоформы рецепторов эстрадиола играют большую роль, чем альфа-изоформы для анксиолитического и антидепрессивного действия эстрадиола [Walf, Frye, 2007]. С помощью локальной инъекции модуляторов данных рецепторов через канюли, вживленные в гиппокамп, было показано вовлечение клеток гиппокампа в эффекты эстрадиола. Вместе с тем введение эстрадиола через канюли в вентральный тегментум (контроль) не влияло на тревожное поведение. Известно, что в зависимости от стадии эстрального цикла концентрация половых гормонов в крови самок меняется, в проэструс уровень эстрогена и прогестерона высокий. Сопоставление тревожного поведения самок в разные стадии эстрального цикла показало, что именно в проэструс самки показывают менее тревожное поведение в тестах ПКЛ, социального взаимодействия и оборонительного зарывания [Frye et al., 2000].
В некоторых работах был показан анксиолитический и антидепрессивный эффект тестостерона, который проявлялся только у гонадоэктомированных самцов после социальной изоляции, на овариэктомированных самок тестостерон не оказывал влияния [Carrier, Kabbaj, 2012]. Уровень тестостерона в крови связан с индивидуальными особенностями поведения крыс самцов в тестах на тревожность [Naslund et al., 2016]. Показано, что гонадоэктомия увеличивала тревожность у низкотревожных крыс, при этом различия с высокотревожными животными исчезали. Вместе с тем введение тестостерона не влияло на поведение старых крыс в возрасте 30 мес [Borbelyova et al., 2016].
Кроме половых гормонов, в литературе большая роль отводится метилированию ДНК для возникновения половых различий в тревожном поведении [Li et al., 2017]. Введение крысятам с первого по третий день постнатальной жизни ингибитора метилирования (5-Aza) устраняло половые различия в тревожном и депрессивноподобном поведении у взрослых крыс, при этом авторы отводят большую роль нарушению метилирования в гене BDNF.
Тест Порсолта, широко применяемый для оценки тревожно-депрессивного поведения и эффектов антидепрессантов, сам по себе является стрессогенным (Drossopoulou et al., 2004; de Kloet et al., 2016). Данная особенность теста позволяет выявить половые различия в активации гипоталамо-гипофизарно-надпочечниковой оси и провоспалительного сигналинга в ответ на стресс вынужденного плавания. В нашей работе был обнаружен более высокий уровень кортикостерона у самок после теста Порсолта, чем у самцов. Эти данные свидетельствуют о большей активации структур гипоталамо-гипофизарно-надпочечниковой оси у самок, чем у самцов. В литературе описан более высокий базовый и вызванный стрессом или выработкой условнорефлекторного страха уровень кортикостерона в крови самок по сравнению с самцами [Azogu et al., 2018; Yang et al., 2014; Verma et al., 2010; Daviu et al., 2014]. Отсутствие половых различий по уровню ИЛ-1β в крови после стресса вынужденного плавания свидетельствует о недостаточной интенсивности данного типа стресса для активации провоспалительного сигналинга, усиление которого наблюдается при более интенсивном стрессе (Hueston, Deak, 2014).
В нашей работе была показана большая болевая чувствительность к электрическому току у самок по сравнению с самцами, у самок пороги вздрагивания, прыжков и побежек были ниже, чем у самцов. Эти данные подтверждают сведения, имеющиеся в литературе о большей чувствительности к болевой стимуляции самок, чем самцов у крыс [Sorge, Totsch, 2016; Van Haaren et al., 1990; Beatty, Beatty, 1970]. Такие же закономерности выявлены и на людях, девочки более чувствительны и менее устойчивы к болевой стимуляции, причем половые различия усиливаются с 12 лет [Sorge, Totsch, 2016]. Это приводит к тому, что число пациентов с хронической болью больше среди женщин, чем мужчин. Иммунная система, как известно, играет существенную роль в выражении, развитии и поддержании хронической боли. Авторы рассматривают в качестве причины половых различий разное функционирование иммунной системы у самцов и самок, самцы используют микроглию в спинном мозге для передачи болевого сигнала, самки в основном задействуют Т-клетки, при этом тестостерон подавляет активность данных клеток [Sorge, Totsch, 2016].
В двух моделях, при выработке классического оборонительного условного рефлекса и рефлекса пассивного избегания, были получены близкие результаты. Необходимо отметить, что эти две модели объединяет проявление пассивно-оборонительного поведения после обучения – замирания в первом случае и торможение двигательной активности во втором случае. При выработке классического оборонительного рефлекса процент времени замирания не отличался у самцов и самок при обучении и тестировании через 24 ч, как при изолированном действии контекста, так и влиянии контекста и звукового стимула. При рефлексе пассивного избегания самцы и самки успешно обучились, однако проявление условнорефлекторного страха у самцов было больше, в первый опыт после обучения больше животных не заходили и даже не заглядывали в аверсивный отсек. Существенные половые различия возникали при угашении рефлексов, у самок рефлексы быстрее угашались, чем у самцов, что проявлялось у самок в меньшем времени замирания на звук в Тесте 2 при классическом рефлексе и меньшей латентности входов в темный отсек при рефлексе пассивного избегания. В литературе имеются противоречивые сведения о половых различиях в выработке условнорефлекторного страха на контекст. Самцы демонстрировали больший уровень замирания при условном рефлексе на контекст [Pettersson et al., 2016; Colon et al., 2018; Daviu et al., 2014], когнитивная генерализация страха на нейтральные контексты также больше проявлялась у самцов, чем у самок [Daviu et al., 2014]. В других работах, наоборот, у самок был обнаружен более сильный условнорефлекторный страх на контекст и большая генерализация страха на нейтральные контексты [Keiser et al., 2017]. Половые различия в проявлении стартл-рефлекса после выработки условнорефлекторного страха не были обнаружены [Zhao et al., 2018]. Что касается угашения условнорефлекторного страха, данные литературы малочисленны, у самок скорость угашения страха на контекст была больше, чем у самцов [Daviu et al., 2014]. Вместе с тем отмечается, что для самок в большей степени, чем для самцов характерно восстановление угашенного страха после напоминания или спонтанное восстановление [Park et al., 2017]. Такая особенность восстановления страха, по мнению авторов, может объяснить большую распространенность тревожных расстройств среди женщин.
В качестве причин половых различий в проявлении и угашении условнорефлекторного страха в литературе рассматривается влияние половых гормонов, которые могут вызывать разное функционирование некоторых структур мозга. Введение эстрадиола овариэктомированным самкам приводило к ускорению угашения условнорефлекторного страха, введение прогестерона оказывало бифазный эффект, результат сильно зависел от интервала времени между введением гормона и угашением [Graham, Daher, 2016]. Введение гормонов в фазу метэструс перед угашением рефлекса способствовало угашению, а блокада соответствующих рецепторов – нарушала угашение [Milad et al., 2009; Graham, Scott, 2018]. Отмечается, что для успешного угашения важно оптимальное содержание эстрадиола, поскольку вводимый эстрадиол взаимодействует с эндогенным уровнем гормона, введение эстрадиола в проэструс при высоком эндогенном уровне способно нарушить угашение рефлексов [Graham, Scott, 2018]. Скорость угашения рефлексов зависела от стадии эстрального цикла самок. Угашение в проэструс (высокий уровень эстрогена и прогестерона) было более успешным, чем в метэструс (низкий уровень гормонов) [Milad et al., 2009; Graham, Daher, 2016].
Половые гормоны способны оказывать влияние на клетки миндалины, так нейроны латерального ядра миндалины были более заторможены в проэструс, при этом быстро угашался страх на звук, а нейроны базального ядра – в диэструс, когда отмечается более быстрое угашение на контекст [Blume et al., 2017]. Обнаружены половые различия в функционировании нейронов базолатеральной миндалины (BLA) – возбудительный синаптический приток к нейронам BLA у самок был больше, чем у самцов [Blume et al., 2017]. При напоминании у самок была обнаружена большая активация базальной миндалины, судя по экспрессии с-Fos генов; у самцов в большей степени при этом происходила активация дорзального гиппокампа [Keiser et al., 2017].
В нашей работе были обнаружены половые различия при выработке рефлекса активного избегания в челночной камере. Самки по сравнению с самцами быстрее обучались, и латентность переходов между отсеками у них была меньше все время обучения. Эти результаты подтверждают данные, описанные ранее в литературе, о более быстрой выработке активного избегания и более медленном его угашении у самок, чем у самцов [Van Haaren et al., 1990; Beatty, Beatty, 1970]. Для самок, как показали опыты с определением порогов различных реакций, были характерны более низкие пороги побежек, у самцов побежки возникали гораздо реже и в ответ на больший ток. Вероятно, такая половая особенность реагирования на ток способствовала более быстрой выработке рефлекса активного избегания у самок.
Суммируя результаты настоящей работы, полученные на разных моделях оборонительного поведения, вызванного действием болевых стимулов, можно сделать вывод, что для самцов более характерна пассивная форма реагирования на сигналы опасности в виде замирания или торможения двигательной активности, а для самок – активные формы реагирования в виде активного убегания и избегания. При потенциальной опасности в тестах на тревожность самки по сравнению с самцами также демонстрировали большую двигательную и исследовательскую активность. Ранее другие авторы высказывали близкую точку зрения, согласно которой аверсивные стимулы вызывают поведенческое торможение у самцов, но не у самок [Van Haare et al., 1990]. Учитывая, что согласно представлениям [Blanchard, Blanchard, 1988] замирание возникает в ответ на удаленную угрозу, а убегание или агрессия – в ответ на близкую опасность, можно предположить, что самки по сравнению с самцами переоценивают опасность, предпочитая активное реагирование. Разному восприятию опасности, вероятно, способствуют разные болевые пороги у самцов и самок. Возможно, переоценка опасности, низкие болевые пороги и большее напряжение гипоталамо-гипофизарно-надпочечниковой оси делают самок более уязвимыми для развития тревожно-депрессивных расстройств.
ВЫВОДЫ
1. Тестирование крыс на тревожность в ОП и ПКЛ, а также на депрессивно-подобное поведение в тесте Порсолта показало, что в возрасте три месяца взрослые самки отличаются от самцов более низким уровнем тревожности, большей двигательной и исследовательской активностью, меньшей выраженностью депрессивно-подобного поведения. В возрасте один месяц до полового созревания данные различия проявлялись на уровне тенденций.
2. Болевая чувствительность к действию электрического тока, подаваемого на решетку пола, у самок была выше, чем у самцов. Пороги вздрагивания, прыжков и побежек были ниже у самок, чем у самцов.
3. У самцов и самок одинаково успешно вырабатывался классический оборонительный условный рефлекс на звук, время замирания не отличалось у животных разного пола. Угашение рефлекса быстрее проходило у самок, чем у самцов.
4. У самцов и самок успешно вырабатывался УРПИ, однако условнорефлекторный страх после обучения проявлялся в большей степени у самцов, чем у самок. У самок рефлекс лучше угашался за 7 дней.
5. У самок по сравнению с самцами быстрее вырабатывался УРАИ, у самок латентность переходов была меньше, а число межсигнальных реакций больше, чем у самцов.
6. Содержание кортикостерона после стрессирующего воздействия в крови самок было выше, чем у самцов.
Работа частично поддержана грантами РФФИ (проекты № 19-015-00129A и № 19-34-90022) и средствами государственного бюджета по госзаданию на 2019–2021 годы (№ г.р. АААА-А17-117092040002-6).
Список литературы
Кривопалов С.А., Юшков Б.Г. Половые особенности припадка и поведения крыс линии Крушинского–Молодкиной. Журн. высш. нервн. деят. 2015. 65 (6): 756–765.
Павлова И.В., Рысакова М.П. Проявление тревожности крыс Вистар при выработке условнорефлекторного страха. Журн. высш. нерв. деят. 2015. 65 (6): 719–735.
Azogu I., Liang J., Plamondon H. Sex-specific differences in corticosterone secretion, behavioral phenotypes and expression of TrkB.N1 and TrkB.FL receptor isoforms: impact of systemic TrkB inhibition and combinatory stress exposure in adolescence. Prog. Neuropsychopharmacol. Biol. Psychiatry. 2018. 86: 10–23.
Beatty W.W., Beatty P.A. Hormonal determinants of sex differences in avoidance behavior and reactivity to electric shock in the rat. J. of Comp. and Physiol. Psych. 1970. 73 (3): 446–455.
Belviranli M., Atalik K.E., Okudan N., Gokbel H. Age and sex affect spatial and emotional behaviors in rats: the role of repeated elevated plus maze test. Neuroscience. 2012. 227: 1–9.
Blanchard D.C., Blanchard R.J. Ethoexperimental approaches to the biology of emotion. Annu. Rev. Psychol. 1988. 39: 43–68.
Blanchard D.C., Shepherd J.K., De Padua Carobrez A., Blanchard R.J. Sex effects in defensive behavior: baseline differences and drug interactions. Neurosci. Biobehav. Rev. 1991. 15 (4): 461–468.
Blume S.R., Freedberg M., Vantrease J.E., Chan R., Padival M., Record M.J., DeJoseph M.R., Urban J.H., Rosenkranz J.A. Sex- and estrus-dependent differences in rat basolateral amygdala. J. Neurosci. 2017. 37 (44): 10567–10586.
Borbelyova V., Domonkos E., Babickova J., Totnova L., Bosy M., Hodosy J., Celec P. No effect of testosterone on behavior in aged Wistar rats. Aging (Albany N.Y.) 2016. 8 (11): 2848–2861.
Carrier N., Kabbaj M. Testosterone and imipramine have antidepressant effects in socially isolated male but not female rats. Horm. Behav. 2012. 61 (5): 678–685.
Claypoole L.D., Zimmerberg B., Williamson L.L. Neonatal lipopolysaccharide treatment alters hyppocampal neuroinflammation, microglia morphology and anxiety-like behavior in rats selectively bred for an infantile trait. Brain Behav. Immun. 2017. 59: 135–146.
Colon L., Odynocki N., Santarelli A., Poulos A.M. Sexual differentiation of contextual fear responses. Learn. Mem. 2018. 25 (5): 230–240.
Daviu N., Andero R., Armario A., Nadal R. Sex differences in the behavioral and hypothalamic-pituitary-adrenal response to contextual fear conditioning in rats. Horm. Behav. 2014. 66 (5): 713–723.
Domonkos E., Borbelyova V., Csongova M., Bosy M., Kacmarova M., Ostatnokova D., Hodosy J., Celec P. Sex differences and sex hormones in anxiety-like behavior of aging rats. Horm. Behav. 2017. 93: 159–165.
Drossopoulou G., Antoniou K., Kitraki E., Papathanasiou G., Papalexi E., Dalla C., Papadopoulou-Daifoti Z. Sex differences in behavioral, neurochemical and neuroendocrine effects induced by the forced swim test in rats. Neuroscience. 2004. 126 (4): 849–857.
Frye C.A., Petralia S.M., Rhodes M.E. Estrous cycle and sex differences in performance on anxiety tasks coincide within creases in hippocampal progesterone and 3alpha, 5alpha-THP. Pharmacol. Biochem. Behav. 2000. 67 (3): 587–596.
Graham B.M., Daher M. Estradiol and progesterone have opposing roles in the regulation of fear extinction in female rats. Neuropsychopharmacology 2016. 41 (3): 774–780.
Graham B.M., Scott E. Effects of systemic estradiol on fear extinction in female rats are dependent on interactions between dose, estrous phase, and endogeneous estradiol levels. Horm. Behav. 2018. 97: 67–74.
Guadagno A., Wong T.P., Walker C.D. Morphological and functional changes in the preweaning basolateral amygdala induced by early chronic stress associate with anxiety and fear behavior in adult male, but not female rats. Prog. Neuropsychopharmacol. Biol. Psychiatry. 2018. 81: 25–37.
Hueston C.M., Deak T. The inflamed axis: the interaction between stress, hormones, and the expression of inflammatory-related genes within key structures comprising the hypothalamic-pituitary-adrenal axis. Physiol Behav. 2014 Jan 30; 124: 77–91.
Johnston A.L., File S.E. Sex differences in animal tests of anxiety. Physiol. Behav. 1991. 49 (2): 245–250.
Keiser A.A., Turnbull L.M., Darian M.A., Feldman D.E., Song I., Tronson N.C. Sex differences in context fear generalization and recruitment of hippocampus and amygdala during retrieval. Neuropsychopharmacology. 2017. 42 (2): 397–407.
de Kloet E.R., Molendijk M.L. Coping with the Forced Swim Stressor: Towards Understanding an Adaptive Mechanism. Neural Plast. 2016. 2016: 6503162.
Kosten T.A., Lee H.J., Kim J.J. Early life stress impairs fear conditioning in adult male and female rats. Brain Res. 2006. 1087 (1): 142–150.
Kosten T.A., Miserendino M.J., Bombace J.C., Lee H.J., Kim J.J. Sex-selective effects of neonatal isolation on fear conditioning and foot shock sensitivity. Behav. Brain Res. 2005.157 (2): 235–244.
Li Y., Ma Q., Dasgupta C., Halavi S., Hartman R.E., Xiao D., Zhang L. Inhibition of DNA methylation in the developing rat brain disrupts sexually dimorphic neurobehavioral phenotypes in adulthood. Mol. Neurobiol. 2017. 54 (6): 3988–3999.
Milad M.R., Igoe S.A., Lebron-Milad K., Novales J.E. Estrous cycle phase and gonadal hormones influence conditioned fear extinction. Neuroscience. 2009. 164 (3): 887–895.
Najjar F., Ahmad M., Lagace D., Leenen F.H.H. Sex differences in depression-like behavior and neuroinflammation in rats post-MI: role of estrogens. Am.J.Physiol. Heart Circ. Physiol. 2018. 315 (5): H1159–H1173.
Naslund J., Studer E., Johansson E., Eriksson E. Effects of gonadectomy and serotonin depletion on inter-individual differences in anxiety-like behaviour in male Wistar rats. Behav. Brain. Res. 2016. 308: 160–165.
Ou C., Dringenberg H.C., Souter C.N. Is hippocampal theta frequency related to individual and sex differences in anxiety-like behavior? An analysis in male and female Long-Evans rats. Behav. Brain. Res. 2019. 364: 366–373.
Park C.H.J., Ganella D.E., Kim J.H. Juvenile female rats, but not male rats, show renewal, reinstatement, and spontaneous recovery following extinction of conditioned fear. Learn. Mem. 2017. 24 (12): 630–636.
Pettersson R., Hagsater S.M., Eriksson E. Serotonine depletion eliminates sex differences with respect to context-conditioned immobility in rat. Psychopharmacology. 2016. 233 (8): 1513–1521.
Sorge R.E., Totsch S.K. Sex differences in pain. J. Neurosci. Research. 2016. 95 (6):1271–1281.
Sun X.M., Tu W.Q., Shi Y.W., Hue L., Zhao H. Female-dependent impaired fear memory of adult rats induced by maternal separation, and screening of possible related genes in the hippocampal CA1. Behav. Brain Res, 2014. 267: 111–118.
Toledo-Rodriguez M., Sandi C. Stress before puberty exerts a sex- and age-related impact on auditory and contextual fear conditioning in the rat. Neural. Plast. 2007. 2007: 71203.
Van Haaren F., Hest A., Heinsbroek R.P.W. Behavioral differences between male and female rats: effects of gonadal hormones on learning and memory. Neurosci. Biobehav. Reviews. 1990. 14: 23–33.
Verma P., Hellemans K.G., Choi F.Y., Yu W., Weinberg J. Circadian phase and sex effects on depressive/anxiety-like behaviors and HPA axis responses to acute stress. Physiol. Behav. 2010. 99 (3): 276–285.
Walf A.A., Frye C.A. Administration of estrogen receptor beta-specific selective estrogen receptor modulators to the hippocampus decrease anxiety and depressive behavior of ovariectomized rats. Pharmacol. Biochem. Behav. 2007. 86 (2): 407–414.
Yang F., Tao J., Xu L., Zhao N., Chen J., Chen W., Zhu Y., Qiu J. Estradiol decreases rat depressive behavior by estrogen receptor beta but not alpha: no correlation with plasma corticosterone. Neuroreport. 2014. 25 (2): 100–104.
Zhao Y., Bijlsma E.Y., Verdouw M.P., Groenink L. No effect of sex and estrous cycle on the fear potentiated startle response in rats. Behav. Brain Res. 2018. 351: 24–33.
Дополнительные материалы отсутствуют.
Инструменты
Журнал высшей нервной деятельности им. И.П. Павлова


