Журнал высшей нервной деятельности им. И.П. Павлова, 2020, T. 70, № 2, стр. 163-173
ВЫЗВАННЫЕ ИЗМЕНЕНИЯ ТЕТА- И АЛЬФА-АКТИВНОСТИ ПРИ ВЫПОЛНЕНИИ ТЕСТА СТРУПА У ЛИЦ, РАНЕЕ УПОТРЕБЛЯВШИХ КАННАБИНОИДЫ
Е. В. Ларионова 1, *, А. Б. Ребрейкина 1
1 Федеральное государственное бюджетное учреждение науки
Институт высшей нервной деятельности и нейрофизиологии РАН
Москва, Россия
* E-mail: larionova.ekaterin@gmail.com
Поступила в редакцию 22.01.2019
После доработки 02.04.2019
Принята к публикации 03.06.2019
Аннотация
Исследовали вызванные изменения тета- и альфа-активности при выполнении теста Струпа у испытуемых, ранее употреблявших каннабиноиды, и группы контроля. Показано, что десинхронизация тета2- и альфа1-ритмов у экспериментальной группы была меньше, чем у контрольной, что, вероятно, указывает на сохраняющиеся нарушения процессов внимания и когнитивного контроля при прекращении употребления данного наркотического вещества. У лиц, ранее употреблявших каннабиноиды, в отличие от испытуемых контрольной группы на поведенческом и на нейрофизиологическом уровне не наблюдался эффект Струпа. Можно предположить, что успешное выполнение задачи экспериментальной группой, а также отсутствие интерферирующего эффекта обусловлено наблюдавшейся у них большей десинхронизацией альфа-ритма в правом полушарии по сравнению с левым.
За последние годы в Российской Федерации отмечается рост показателей обращаемости за наркологической помощью лиц, употребляющих каннабиноиды. За период с 2012 по 2016 г. в структуре первичных больных наркоманией удельный вес больных опиоидной наркоманией в общем числе пациентов снизился с 76 до 38%, при этом доля пациентов с зависимостью от каннабиноидов увеличилась с 9.7 до 17.7% [Киржанова и др., 2017]. В современном мире рекреационное употребление этого наркотика является наиболее распространенным после алкоголя.
Употребление каннабиноидов вызывает нарушения когнитивных функций как во время острой интоксикации, так и после окончания употребления [Broyd et al., 2016; Gordon, 2018; Levar et al., 2018]. Основное психоактивное соединение каннабиноидов – тетрагидроканнабинол – связывается с эндогенными рецепторами каннабиноидов CB1, расположенными в различных областях мозга, вовлеченными в процессы обработки информации и связанными с вербальной памятью, когнитивным контролем, вниманием. Вероятно, поэтому у лиц, употребляющих каннабиноиды, часто отмечают нарушения этих процессов [Broyd et al., 2016; Rentzsch et al., 2016], однако вопрос компенсации нарушений при длительном воздержании от употребления наркотика остается спорным. В некоторых работах говорится об уменьшении когнитивного дефицита уже спустя 72 ч после употребления [Scott et al., 2018], в других работах изменения мозговой активации различных областей мозга выявляют даже спустя 25 дней воздержания от употребления наркотика [Aloi et al., 2018; Blest-Hopley et al., 2019; Gruber et al., 2013]. В настоящем исследовании мы предполагаем, что когнитивный дефицит у лиц, ранее употреблявших каннабиноиды, может сохраняться и после выведения наркотика из организма.
Перспективным методом для изучения сложных интегративных процессов является анализ вызванной ритмической активности. Вызванная десинхронизация и вызванная синхронизация представляют собой частотно-специфические изменения ритмической активности ЭЭГ – уменьшение и увеличение мощности в соответствующих полосах частот, которые связаны с уменьшением или увеличением синхронности основных популяций нейронов [Pfurtscheller, Lopes da Silva, 1999]. Исследование особенностей вызванных изменений ритмической активности мозга у лиц, ранее употреблявших каннабиноиды, может помочь в выявлении когнитивных нарушений, аномалии синхронизации или десинхронизации осцилляторной активности нейронов могут играть центральную роль в этих нарушениях.
В качестве предъявляемой испытуемым задачи мы выбрали модификацию теста Струпа, который широко применяется в настоящее время для диагностики мозговых дисфункций и для оценки различных психических патологий. Успешное выполнение этого теста связано с процессами внимания и когнитивного контроля [Atkinson et al., 2003; Sahinoglu, Dogan, 2016]. Имеются данные о том, что в норме тета- и альфа-колебания связаны с производительностью в задаче Струпа [Hanslmayr, 2008]. В ряде работ подчеркивается роль этих ритмов в процессах когнитивного контроля [Cooper et al., 2016] и внимания [Klimesch et al., 1996; Clayton et al., 2015; Kitaura et al., 2017]. При этом поддиапазоны этих ритмов могут иметь разную топографию и отражать разные процессы: десинхронизацию нижнего альфа-диапазона связывают общими процессами внимания, которые не зависят от конкретной задачи, а десинхронизация в верхнем альфа-диапазоне развивается во время обработки сенсорно-смысловой информации [Pfurtscheller, Lopes da Silva, 1999; Pfurtscheller et al., 2000]. В отличие от альфа-диапазона, вызванные изменения ритмической активности в тета-диапазоне связывают с процессами кодирования новой информации [Klimesch, 1996].
В большинстве работ, касающихся влияния каннабиноидов на когнитивные процессы, использовался метод вызванных потенциалов [Campanella et al., 2014; Hart et al., 2010]. При этом данные, полученные с помощью метода вызванных потенциалов, довольно противоречивы: в некоторых исследованиях сообщается о снижении амплитуды P300 у лиц, употребляющих каннабиноиды [Kempel et al., 2003], а в других – об ее увеличении [Skosnik et al., 2008] или об отсутствии различий [de Sola et al., 2008]. Ритмическая активность ЭЭГ исследовалась в основном в работах, посвященных острым эффектам каннабиноидов: были показаны нарушения синхронности тета-ритма, коррелирующие с нарушениями рабочей памяти [Böcker et al., 2010], а также снижение мощности альфа-ритма при выполнении когнитивных задач [Hart et al., 2010].
Таким образом, целью настоящей работы является изучение отсроченных эффектов употребления каннабиноидов на внимание и когнитивный контроль. Основная задача данного исследования – сравнение пространственно-временных особенностей вызванных изменений альфа- и тета- ритмов при выполнении теста Струпа у лиц, ранее употреблявших каннабиноиды, и группы испытуемых, не употреблявших психоактивные вещества.
МЕТОДИКА
Испытуемые. Исследование выполнено с соблюдением принципов Хельсинкской декларации, проведение исследования было одобрено Этическим комитетом Института высшей нервной деятельности и нейрофизиологии РАН. Все испытуемые давали письменное информированное согласие на участие в исследовании. Исследование проводилось на базе Московского научно-практического центра наркологии Департамента здравоохранения Минздравсоцразвития. В исследовании приняли участие 52 мужчины без черепно-мозговых травм, с нормальным или скорректированным до нормального зрением, без нарушений цветового зрения, правши. В экспериментальную группу вошли 26 человек, состоящих на профилактическом учете в филиалах Московского научно-практического центра наркологии Департамента здравоохранения Минздравсоцразвития: испытуемые употребляли каннабиноиды (марихуану и/или гашиш) от полугода и более (средний стаж употребления примерно 2–4 года) от двух до восьми раз в месяц, но на момент исследования воздерживались от употребления этого наркотика более четырех месяцев, что устанавливалось врачами-наркологами. Средний возраст испытуемых экспериментальной группы составил 24.4 ± 2.9 лет, уровень образования 14.8 ± 1.4 года. В контрольную группу вошли 26 человек, не употреблявших каннабиноиды, средний возраст испытуемых составил 25.0 ± 3.5 лет, уровень образования 14.2 ± 1.7 лет. Употребление других наркотических веществ в каждой из групп допускалось, но не более 5 раз суммарно.
Экспериментальная процедура. ЭЭГ записывали на усилителе “Neuroscan Synamps” от 29 отведений, расположенных по схеме 10–10 , частота квантования 200 Гц. Использовали тест Струпа с двумя типами стимулов – конгруэнтными и неконгруэнтными, которые предъявляли в псевдослучайном порядке. В качестве конгруэнтных стимулов выступали слова “ЗЕЛЕНЫЙ”, окрашенные в зеленый цвет и слова “КРАСНЫЙ”, окрашенные в красный цвет. В качестве неконгруэнтных – слова “ЗЕЛЕНЫЙ”, окрашенные в красный цвет и слова “КРАСНЫЙ”, окрашенные в зеленый цвет. Длительность стимула составляла 200 мс, межстимульный интервал варьировался от 1000 до 1300 мс. Испытуемым необходимо было с помощью нажатия кнопки как можно быстрее определять цвет, в который окрашено слово.
Аппаратура, регистрация и анализ ЭЭГ данных. В данной работе мы учитывали тот факт, что использование узких частотных диапазонов при анализе вызванной ритмической активности уменьшает опасность того, что специфические эффекты частоты останутся незамеченными или будут наложены друг на друга [Klimesch W., 1999; Pandey et al., 2016], поэтому разделяли исследуемые частотные диапазоны на поддиапазоны. Анализировали показатели связанной с событиями синхронизации/десинхронизации в следующих частотных диапазонах: тета1 (4–6 Гц), тета2 (6–8 Гц), альфа1 (8–9.5 Гц), альфа2 (9.5–11 Гц) и альфа3 (11–13 Гц). Для удаления артефактов использовали метод, разработанный Новотоцким-Власовым и др. [2007]. ЭЭГ фильтровали цифровыми фильтрами для выделения каждой из исследуемых полос частот, затем значения отфильтрованной ЭЭГ возводили в квадрат (для получения мощности) и усредняли по группам в выбранных интервалах отдельно для каждого типа стимула. Неправильные ответы исключали из анализа. Интервалы для усреднения выбирали на основе топографических карт таким образом, чтобы в них попадали пиковые значения синхронизации/десинхронизации. Полученные усредненные мощности нормировали на среднее значение мощности по базовому интервалу (300 мс до стимула) и переводили в децибелы (Prel(dB) = 10lg(Pinst/Pbase)) для нормализации распределения данных.
На конгруэнтные и неконгруэнтные стимулы у двух групп в исследуемых диапазонах наблюдалась схожая по топографии картина вызванной ритмической активности мозга (рис. 1), поэтому интервалы для усреднения были одинаковые для всех стимулов и всех испытуемых. Если максимум вызванной ритмической активности не превышал 0.5 Дб, то этот интервал не анализировали. Статистически анализировали следующие частотные диапазоны и временные окна: тета1 – во временных окнах от 100 до 340 мс и от 150 до 520 мс; тета2 – от 50 до 220 мс, от 160 до 400 мс и от 270 до 670 мс; альфа1 – от 300 до 540 мс; альфа2 – от 260 до 500 мс; альфа3 – от 235 до 505 мс после начала предъявления стимула.
Рис. 1.
Усредненные по группам вызванные изменения ритмической активности мозга. Сплошной линией обозначена контрольная группа, пунктиром – экспериментальная. Черная линия – неконгруэнтные стимулы; серая – конгруэнтные стимулы.
Fig. 1. Grand average ERD/ERS. The solid line – control group, the dotted line – experimental group. The black line – ERD/ERS in response to the incongruent stimuli; the gray line – ERD/ERS in response to the congruent stimuli.
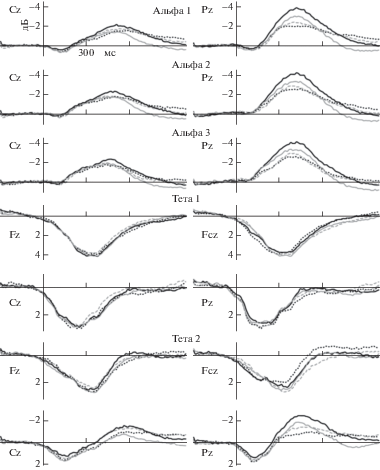
Для статистической обработки данных использовали программный пакет STATISTICA 8. Применяли дисперсионный анализ с повторяющимися эффектами (RM ANOVA). В случае если визуально выделенные максимумы синхронизации/десинхронизации наблюдались в задних областях – статистический анализ проводили для отведений P3, P4, O1, O2, T5, T6, Cp3, Cp4, Tp7, Tp8 с учетом факторов Группа, Условие, Электрод, Полушарие и отдельно для отведений центральной линии Cz, Pz без учета фактора Полушарие. В случае если синхронизация/десинхронизация наблюдалась в передних областях – статистический анализ проводился для отведений F3, F4, F7, F8, Fp1, Fp2, Ft7, Ft8 и отдельно для отведений центральной линии Fz, Fcz без учета фактора Полушарие. Для определения достоверности эффектов применяли поправку Гринхауса–Гейссера, для апостериорного анализа – критерий Фишера.
В качестве поведенческих показателей анализировали процент ошибок и время реакции отдельно на конгруэнтные и неконгруэнтные стимулы для каждой группы испытуемых. Для сравнения поведенческих показателей между группами использовали U-критерий Манна–Уитни. Критерий Вилкоксона применяли для оценки внутригрупповых различий на конгруэнтные и неконгруэнтные стимулы.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЙ
Поведенческие показатели. Различия между группами по поведенческими показателям – проценту ошибок и времени реакции, не достигали статистической значимости (табл. 1).
Таблица 1.
Поведенческие показатели Table 1. Behavioral data
| Показатель | Неконгруэнтные стимулы | Конгруэнтные стимулы | ||||||
|---|---|---|---|---|---|---|---|---|
| Me (Q1; Q3) | U(кг; эг) | р | Me (Q1; Q3) | U(кг; эг) | р | |||
| КГ | ЭГ | КГ | ЭГ | |||||
| Время реакции, мс | 410 (375; 455) | 405 (370; 530) | 326.0(26; 26) | 0.83 | 402.5 (365; 440) | 420 (365; 465) | 297.0(26; 26) | 0.45 |
| Процент ошибок, % | 6 (4; 9) | 5 (3; 8) | 272.0(26; 26) | 0.23 | 6 (3; 9) | 5 (4; 6) | 299.5(26; 26) | 0.48 |
Далее анализировали различия на конгруэнтные и неконгруэнтные стимулы внутри каждой группы. У контрольной группы время реакции на неконгруэнтные стимулы достоверно превышало этот показатель на неконгруэнтные (Т = 70.5, р = 0.04), т.е. наблюдался эффект Струпа. В экспериментальной группе достоверных различий между временем реакции на конгруэнтные и неконгруэнтные стимулы не было (Т = 87.5, р = 0.12). Внутригрупповых различий по показателю ошибок не было.
Межгрупповые различия вызванных изменений ритмической активности. Дисперсионный анализ показал межгрупповые различия в тета2-, альфа1-, альфа2- и альфа3-диапазонах (табл. 2). Десинхронизация тета2 в задних отведениях и альфа1 в задних центральных отведениях была больше в контрольной группе по сравнению с экспериментальной независимо от типа стимула. В альфа2- и альфа3-диапазонах обнаружены значимые взаимодействия факторов Условие × Группа и Условие × Электрод × Группа, т.е. различия в группах зависели от типа стимула. Апостериорный анализ для каждого из электродов достоверных эффектов не выявил.
Таблица 2.
Результаты RM ANOVA: значимые эффекты, включающие фактор Группа Table 2. ANOVA results: significant effects including factor of Group
| Эффект | Тета2 [270–670 мс] | Альфа1 [300–540 мс] | Альфа2 [260–500 мс] | Альфа3 [235–505 мс] | ||||
|---|---|---|---|---|---|---|---|---|
| задние | центра-льные | задние | центра-льные | задние | центра-льные | задние | центра-льные | |
| Условие × × Группа | F (1, 50) = = 8.02 | F (1, 50) = 12.37 | F (1, 50) = = 5.90 | F (1, 50) = = 17.24 | F (1, 50) = = 4.97 | F (1, 50) = = 11.1 | F (1, 50) = = 4.56 | F (1, 50) = = 6.75 |
| p = 0.007 | p = 0.001 | p = 0.02 | p = 0.0001 | p = 0.03 | p = 0.002 | p = 0.04 | p = 0.01 | |
| Электрод × × Группа | F (4, 200) = = 3.46 | F (1, 50) = 3.47 | F (4, 200) = = 1.5 | F (1, 50) = = 4.14 | F (4, 200) = = 0.78 | F (1, 50) = = 3.17 | F (4, 200) = = 0.59 | F (1, 50) = = 2.92 |
| p = 0.02 | р = 0.07 | р = 0.23 | p = 0.047 | р = 0.54 | p = 0.08 | р = 0.67 | p = 0.09 | |
| Полушарие × × Группа | F (1, 50) = = 0.01 | – | F (1, 50) = = 0.13 | – | F (1, 50) = = 0.35 | – | F (1, 50) = = 0.43 | – |
| р = 0.9 | р = 0.72 | р = 0.56 | р = 0.51 | |||||
| Условие × × Электрод × × Группа | F (4, 200) = = 5.19 | F (1, 50) = 0.25 | F (4, 200) = = 5.36 | F (1, 50) = = 1.4 | F (4, 200) = = 1.99 | F (1, 50) = 4.15 | F (4, 200) = = 0.80 | F (1, 50) = = 4.52 |
| p = 0.004 | р = 0.62 | p = 0.004 | р = 0.24 | p = 0.1 | р = 0.047 | p = 0.53 | р = 0.04 | |
| Условие × × Полушарие × × Группа | F (1, 50) = = 0.16 | – | F (1, 50) = = 0.06 | – | F (1, 50) = = 0.28 | – | F (1, 50) = = 0.93 | – |
| р = 0.69 | р = 0.8 | р = 0.6 | р = 0.34 | |||||
| Электрод × Полушарие × × Группа | F (4, 200) = = 1.56 | – | F (4, 200) = = 1.4 | – | F (4, 200) = = 0.97 | – | F (4, 200) = = 0.57 | – |
| р = 0.2 | р = 0.25 | р = 0.42 | р = 0.69 | |||||
| Условие × × Электрод × × Полушарие × × Группа | F (4, 200) = = 0.59 | – | F (4, 200) = = 0.75 | – | F (4, 200) = = 0.43 | – | F (4, 200) = = 0.23 | – |
| р = 0.61 | р = 0.51 | р = 0.79 | р = 0.92 | |||||
Внутригрупповые различия вызванных изменений ритмической активности. Для диапазонов, в которых наблюдались значимые эффекты, включающие фактор Группа, проводили дисперсионный анализ с повторяющимися эффектами отдельно для каждой группы.
В тета2-диапазоне в контрольной группе для задних отведений были значимы эффекты Условие F (1, 25) = 4.82, p = 0.04 и Условие × Электрод F (4, 100) = 3.40, p = 0.03. В экспериментальной группе для задних отведений значимых эффектов не наблюдалось. В контрольной группе для центральных отведений был значим эффект Условие F (1, 25) = = 7.92, p = 0.009, в экспериментальной группе также был значим эффект Условие F (1, 25) = = 4.49, p = 0.04. Результаты апостериорного анализа представлены на рис. 2. У контрольной группы значимо отличалась десинхронизация верхнего тета-ритма на неконгруэнтные и конгруэнтные стимулы для отведений Р3 (р < 0.01), P4 (р < 0.01), Cz (р < 0.01), Pz (р < 0.01), Cp3 (р < 0.01), Cp4 (р < 0.01), и Tp8 (р < 0.01): на неконгруэнтные стимулы тета2 десинхронизация была больше, чем на конгруэнтные. У экспериментальной группы значимые различия десинхронизации верхнего тета-ритма на неконгруэнтные и конгруэнтные стимулы наблюдались только в центральных отведениях Cz (р < 0.01) и Pz (р < 0.01), причем наблюдался противоположный контрольной группе эффект: на неконгруэнтные стимулы тета2 десинхронизация была меньше, чем на конгруэнтные.
Рис. 2.
Внутригрупповые различия средних значений десинхронизации тета2, альфа1, альфа2, альфа3 (Дб) для неконгруэнтных и конгруэнтных стимулов. Вертикальные линии над каждым столбиком соответствуют стандартной ошибке средней величины. ** – p < 0.01; * – p < 0.05; # – p < 0.1.
Fig. 2. The difference in means of event related desynchronization of theta2, alpha1, alpha2, alpha3 waves (dB) between congruent and incongruent trials in the control group and in abstinent cannabinoid users. The vertical lines show standard errors of means. ** – p < 0.01; * – p < 0.05; # – p < 0.1.

В альфа1 в контрольной группе для задних отведений были значимы эффекты Условие F (1, 25) = 5.48, p = 0.03 и Условие × Электрод F (4, 100) = 3.48, p = 0.04, в экспериментальной группе Условие × Электрод F (4, 100) = 2.89, p = 0.049 и Полушарие F (1, 25) = 5.23, p = = 0.03. В контрольной группе для центральных отведений был значим эффект Условие F (1, 25) = 15.86, p = 0.0005, в экспериментальной группе для центральных отведений значимых различий не наблюдалось. Результаты апостериорного анализа представлены на рис. 2. У контрольной группы значимо отличалась десинхронизация альфа1-ритма на неконгруэнтные и конгруэнтные стимулы для отведений Р3 (р < 0.01), P4 (р < 0.01), T6 (p < < 0.05), Cz (р < 0.01), Pz (р < 0.01), Cp3 (р < 0.01), Cp4 (р < 0.01), Tp7 (р < 0.01) и Tp8 (р < 0.01), тенденция к значимости имелась для отведения О1 (р = 0.082): на неконгруэнтные стимулы десинхронизация альфа1-ритма была больше, чем на конгруэнтные. У экспериментальной группы значимых отличий на неконгруэнтные и конгруэнтные стимулы не было, тенденция к значимости имелась для отведений Cp3 (р = 0.05) и Cp4 (р = 0.09), причем альфа1 десинхронизация была больше на конгруэнтные стимулы, чем на неконгруэнтные. В отличие от контрольной группы в экспериментальной группе был значим эффект Полушарие. Независимо от типа стимула десинхронизация альфа1-ритма была больше в правом полушарии по сравнению с левым.
В альфа2-диапазоне в контрольной группе для задних отведений был значим эффект Условие F (1, 25) = 5.70, p = 0.025. В экспериментальной группе – эффект Полушарие F (1, 25) = 5.71, p = 0.025: альфа2 десинхронизация была больше в правом полушарии как на конгруэнтные, так и на неконгруэнтные стимулы. В контрольной группе для центральных отведений были значимы эффекты Условие F (1, 25) = 12.78, p = 0.001 и Условие × × Электрод F (1, 25) = 6.61, p = 0.02, в экспериментальной группе для центральных отведений значимых эффектов не наблюдалось. Результаты апостериорного анализа представлены на рис. 2. У контрольной группы значимо отличалась десинхронизация альфа2-ритма на неконгруэнтные и конгруэнтные стимулы для отведений Р3 (р < 0.01), P4 (р < 0.01), О1 (р < 0.01), Т5 (р < 0.01), Т6 (р < < 0.01), Cz (р < 0.05), Pz (р < 0.01), Cp3 (р < 0.01), Cp4 (р < 0.01), Tp7 (р < 0.01) и Tp8 (р < 0.01): на неконгруэнтные стимулы десинхронизация в альфа2-диапазоне была больше, чем на конгруэнтные.
В альфа3-диапазоне в контрольной группе для задних отведений был значим эффект Условие F (1, 25) = 5.36, p = 0.03. В экспериментальной группе – эффект Полушарие F (1, 25) = 4.9, p = 0.04: альфа3 десинхронизация была больше в правом полушарии как на конгруэнтные, так и на неконгруэнтные стимулы. В контрольной группе для центральных отведений были значимы эффекты Условие F (1, 25) = 7.89, p = 0.01 и Условие × Электрод F (1, 25) = 6.98, p = 0.01, в экспериментальной группе для центральных отведений значимых эффектов не наблюдалось. Результаты апостериорного анализа представлены на рис. 2. У контрольной группы значимо отличалась десинхронизация альфа3-ритма на неконгруэнтные и конгруэнтные стимулы для отведений Р3 (р < 0.01), P4 (р < 0.01), О1 (р < 0.01), Т5 (р < 0.01), Т6 (р < 0.01), Cz (р < 0.05), Pz (р < 0.01), Cp3 (р < 0.01), Cp4 (р < 0.01), Tp7 (р < 0.01) и Tp8 (р < 0.01), тенденция к значимости имелась для отведения О2 (р = 0.051): на неконгруэнтные стимулы десинхронизация в альфа3-диапазоне была больше, чем на конгруэнтные.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
В настоящем исследовании различия между группами касались исключительно процессов десинхронизации в тета2-, альфа1-, альфа2- и альфа3-диапазонах в задних отведениях в районе 300 мс. При этом специфических эффектов для какого-либо из этих поддиапазонов выявлено не было: сходные статистические эффекты наблюдались в тета2- и альфа1-диапазонах, а в альфа2 были схожие эффекты с альфа3.
У экспериментальной группы вызванные изменения тета2- и альфа1-активности были меньше, чем у контрольной группы испытуемых. Десинхронизацию альфа-ритма связывают с процессами снижения торможения во время сосредоточения внимания [Cooper et al., 2016; Friese et al., 2016]. Десинхронизация в верхнем тета-диапазоне также отражает активацию соответствующих областей и указывает на успешное кодирование информации [Mapelli, Özkurt, 2019]. Таким образом, снижение десинхронизации в экспериментальной группе по сравнению с контрольной, вероятно, указывает на сохраняющиеся нарушения процессов внимания и когнитивного контроля у лиц, ранее употреблявших каннабиноиды.
В настоящей работе показано, что в контрольной группе десинхронизация в тета2-, альфа1-, альфа2- и альфа3-диапазонах на неконгруэнтные стимулы была больше, чем на конгруэнтные. Эти результаты соответствуют полученным ранее для здоровых испытуемых [Hanslmayr et al., 2008]: интерферирующий эффект между значением цвета и значением слова проявлялся во временном окне около 400 мс в тета- (4–7 Гц) и альфа-диапазонах (7–10 Гц), бóльшая десинхронизация последнего наблюдалась на неконгруэнтные стимулы.
Степень десинхронизации связывают с процессами семантического кодирования: большая десинхронизация в нижнем альфа-диапазоне отражает более высокий уровень внимания во время кодирования [Klimesch, 1999]. В тесте Струпа семантическое кодирование направлено на извлечение названия цвета слова. Усиление десинхронизации альфа-ритма на неконгруэнтные стимулы в контрольной группе отражает более длительные усилия при их обработке и предполагает более высокий уровень внимания из-за влияющих на успешное выполнение задания автоматических процессов чтения [Ergen et al., 2014]. В настоящем исследовании на поведенческом уровне это отражается в виде увеличения времени реакции на неконгруэнтные стимулы в контрольной группе, то есть в виде эффекта Струпа.
В настоящей работе у испытуемых, употреблявших каннабиноиды, показано увеличение десинхронизации альфа-ритма в правом полушарии по сравнению с левым независимо от типа стимула. Десинхронизацию альфа-ритма в височных и теменных областях левого полушария связывают с извлечением значения различных вербальных стимулов: слов, предложений [Magazzini et. al., 2016; Vassileiou et. al., 2018]. Вероятно, меньшая активация левого полушария по сравнению с правым у экспериментальной группы свидетельствует о нарушении у них процессов автоматической семантической обработки информации и в результате приводит к отсутствию у них интерферирующего эффекта в тесте Струпа как на поведенческом уровне, так и на нейрофизиологическом – в виде увеличения десинхронизации альфа-ритма на неконгруэнтные стимулы, то есть является тем механизмом, за счет которого экспериментальная группа в итоге успешно справляется с заданием. Это согласуется и с данными, полученными в других исследованиях: во многих работах у лиц, употреблявших каннабиноиды, не выявлены отличия от нормы в поведенческих результатах выполнения теста Струпа и других заданий, связанных с когнитивным контролем [Eldreth et al., 2004; Kober et al, 2014; Tapert et al., 2007; Thayer et al., 2015; Hester et al., 2009; Aloi et al., 2018], однако при этом отмечаются изменения активации ряда мозговых регионов. Так, в исследовании с использованием ПЭТ [Eldreth et al., 2004] было показано снижение активности в передней части поясной извилины левого полушария и латеральной префронтальной коре левого полушария, а также повышение активности гиппокампа у испытуемых, употреблявших каннабиноиды, по сравнению с контрольной группой, при выполнении теста Струпа. В исследовании Хестер при выполнении теста Струпа у потребителей каннабиса по сравнению с контрольной группой активация была выше в правой нижней париетальной доле, скорлупе и поясной извилине [Hester et al., 2009], а в работе Таперта у курильщиков марихуаны после 28 дней воздержания активность мозга была увеличена в правом полушарии для всех стимулов, и в некоторых билатеральных областях (средней и верхней лобных извилинах, нижней и верхней теменных долях) на стимулы “no go” [Tapert et al., 2007]. Было предположено, что злоупотребление каннабисом может привести к нарушению функционирования определенных регионов, так что эти регионы активируются более интенсивно, чтобы обеспечить успешное выполнение задач [Gruber et al., 2013; Tapert et al., 2007; Aloi et al., 2018]. Таким образом, данные этих исследований и полученные нами результаты говорят об использовании иных кортикальных процессов для успешного выполнения теста лицами, ранее употреблявшими каннабиноиды.
Стоит также отметить, что выявленные особенности десинхронизации альфа-ритма у экспериментальной группы связаны с увеличением активности правого полушария по сравнению с левым. У пациентов с психозом, вызванным употреблением каннабиноидов, была показана генерализованная гиперактивация правого полушария со смещением функционального доминирования в правое полушарие в отличие от здоровых правшей [Flor-Henry, Shapiro, 2018]. В других работах также отмечают изменение активности правого полушария у лиц, употреблявших каннабиноиды [Hester et al., 2009; Tapert et al., 2007; Colizzi et al., 2018]. Алои с коллегами сделали предположение о неэффективности дорзальной системы внимания у лиц, зависимых от каннабиса [Aloi et al., 2018]. Вероятно, выявленное нами увеличение активности правого полушария у лиц, употреблявших каннабиноиды, может также говорить о “компенсаторной” функции вентральной системы внимания, которая является правосторонней и состоит из правого височно-теменного соединения и правого вентрального лобного отдела коры [Fox et al., 2006]. У здоровых испытуемых показана негативная корреляция мощности альфа-ритма с активностью билатеральной дорзальной теменно-фронтальной нейронной сети когнитивного контроля, которая лежит в основе нисходящего (top-down) селективного внимания к специфическим характеристикам стимула [Fox et al., 2006; Sadaghialani et al., 2016]. В настоящем исследовании в группе контроля выявлены схожие результаты: десинхронизация альфа-ритма была больше на стимулы, требующие большего внимания, на неконгруэнтные стимулы. Таким образом, в экспериментальной группе, в отличие от контрольной, активируется преимущественно правосторонняя вентральная система внимания.
ЗАКЛЮЧЕНИЕ
В настоящем исследовании была показана меньшая по сравнению с контрольной группой десинхронизация тета2- и альфа1-ритмов у лиц, ранее употреблявших каннабиноиды, что, вероятно, указывает на сохраняющиеся нарушения процессов внимания и когнитивного контроля у лиц, употреблявших каннабиноиды, но воздерживающихся от наркотика достаточно длительный период времени.
В экспериментальной группе в отличие от контрольной на поведенческом и на нейрофизиологическом уровне не наблюдался эффект Струпа. При этом с задачей они справлялись также успешно, как и испытуемые контрольной группы. Можно предположить, что успешное выполнение задачи экспериментальной группой, а также отсутствие у них интерферирующего эффекта обусловлено наблюдавшейся у них большей десинхронизацией альфа-ритма в правом полушарии по сравнению с левым, что, в свою очередь, вероятно, говорит о нарушении у этой группы процессов автоматической семантической обработки информации.
Список литературы
Киржанова В.В., Григорова Н.И., Киржанов В.Н. Основные показатели деятельности наркологической службы в Российской Федерации в 2015–2016 годах: статистический сборник. М.: ФГБУ “ФМИЦПН им. В.П. Сербского” Минздрава России, 2017. 183 с.
Новотоцкий-Власов В.Ю., Гарах Ж.В., Ковалев В.П. Метод подавления повторяющихся артефактов в многоканальной записи ЭЭГ. Физиология человека. 2007. 33 (2): 115–120.
Aloi J., Blair K.S., Crum K.I., Meffert H., White S.F., Tyler P.M., Thornton L.C., Mobley A.M., Killanin A.D., Adams K.O., Filbey F., Pope K., Blair R.J.R. Adolescents show differential dysfunctions related to Alcohol and Cannabis Use Disorder severity in emotion and executive attention neuro-circuitries. Neuroimage Clin. 2018. 19: 782–792. https://doi.org/10.1016/j.nicl.2018.06.005
Atkinson C.M., Drysdale K.A., Fulham W.R. Event related potentials to Stroop and reverse Stroop stimuli. Int. J. Psychophysiol. 2003. 47 (1): 1–21.
Blest-Hopley G., Giampietro V., Bhattacharyya S. Regular cannabis use is associated with altered activation of central executive and default mode networks even after prolonged abstinence in adolescent users: Results from a complementary meta-analysis. Neurosci Biobehav Rev. 2019. 96: 45–55. https://doi.org/10.1016/j.neubiorev.2018.10.026
Böcker K.B., Hunault C.C., Gerritsen J., Kruidenier M., Mensinga T.T., Kenemans J.L. Cannabinoid modulations of resting state EEG θ power and working memory are correlated in humans. Journal Of Cognitive Neuroscience. 2010. 22 (9): 1906–1916.
Broyd S.J., van Hell H.H., Beale C., Yücel M., Solowij N. Acute and Chronic Effects of Cannabinoids on Human Cognition-A Systematic Review. Biological Psychiatry. 2016. 79 (7): 557–567. https://doi.org/10.1016/j.biopsych.2015.12.002
Campanella S., Pogarell O., Boutros N. Event-related potentials in substance use disorders: a narrative review based on articles from 1984 to 2012. Clin. EEG Neurosci. 2014. 45 (2): 67–76. https://doi.org/10.1177/1550059413495533
Clayton M.S., Yeung N., Cohen Kadosh R. The roles of cortical oscillations in sustained attention. Trends Cogn. Sci. 2015. 19 (4): 188–95. https://doi.org/10.1016/j.tics.2015.02.004
Colizzi M., McGuire P., Giampietro V., Williams S., Brammer M., Bhattacharyya S. Modulation of acute effects of delta-9-tetrahydrocannabinol on psychotomimetic effects, cognition and brain function by previous cannabis exposure. Eur. Neuropsychopharmacol. 2018. 28 (7): 850–862. https://doi.org/10.1016/j.euroneuro.2018.04.003
Cooper P.S., Darriba Á., Karayanidis F., Barceló F. Contextually sensitive power changes across multiple frequency bands underpin cognitive control. Neuroimage. 2016. 132: 499–511. https://doi.org/10.1016/j.neuroimage.2016.03.010
de Sola S., Tarancon T., Pena-Casanova J., Espadaler J.M., Langohr K., Poudevida S. Auditory event-related potentials (P3) and cognitive performance in recreational ecstasy polydrug users: evidence from a 12-month longitudinal study. Psychopharmacology (Berl). 2008. 200: 425–437.
Eldreth D.A., Matochik J.A., Cadet J.L., Bolla K.I. Abnormal brain activity in prefrontal brain regions in abstinent marijuana users. Neuroimage. 2004. 23 (3): 914–920.
Ergen M., Saban S., Kirmizi-Alsan E., Uslu A., Keskin-Ergen Y., Demiralp T. Time-frequency analysis of the event-related potentials associated with the Stroop test. Int. J. Psychophysiol. 2014. 94 (3): 463–72. https://doi.org/10.1016/j.ijpsycho.2014.08.177
Flor-Henry P., Shapiro Y. Brain Changes during Cannabis-Induced Psychosis: Clarifying the Marijuana Medicine/Harm Dichotomy. J. Psychiatry Brain Sci. 2018. 3 (5): 9. https://doi.org/10.20900/jpbs.20180009
Fox M.D., Corbetta M., Snyder A.Z., Vincent J.L, Raichle M.E. Spontaneous neuronal activity distinguishes human dorsal and ventralattention systems. Proc. Natl. Acad. Sci U. S. A. 2006. 103 (26): 10046–10051.
Friese U., Daume J., Göschl F., König P., Wang P., Engel A.K. Oscillatory brain activity during multisensory attention reflects activation, disinhibition, and cognitive control. Sci Rep. 2016. 6: 32775. https://doi.org/10.1038/srep32775
Gordon H.W. Differential Activation of the Left and Right Cerebral Hemispheres of Individuals Who Use or are Dependent on Drugs of Abuse. J. Drug Abuse. 2018. 4 (2): 10. https://doi.org/10.21767/2471-853X.100077
Gruber S.A., Dahlgren M.K., Sagar K.A., Gonenc A., Killgore W.D.S. Age of onset of marijuana use impacts inhibitory processing. Neurosci. Lett. 2013. 511: 89–94.
Hanslmayr S., Pastötter B., Bäuml K.H., Gruber S., Wimber M., Klimesch W. The electrophysiological dynamics of interference during the Stroop task. J. Cogn. Neurosci. 2008. 20 (2): 215–25. https://doi.org/10.1162/jocn.2008.20020
Hart C.L., Ilan A.B., Gevins A., Gunderson E.W., Role K., Colley J., Foltin R.W Neurophysiological and cognitive effects of smoked marijuana in frequent users. Pharmacol. Biochem. Behav. 2010. 96 (3): 333–341.
Hester R., Nestor L., Garavan H. Impaired error awareness and anterior cingulate cortex hypoactivity in chronic cannabis users. Neuropsychopharmacology. 2009. 34: 2450–2458.
Kempel P., Lampe K., Parnefjord R., Hennig J., Kunert H.J. Auditory-evoked potentials and selective attention: different ways of information processing in cannabis users and controls. Neuropsychobiology. 2003. 48: 95–101.
Kitaura Y., Nishida K., Yoshimura M., Mii H., Katsura K., Ueda S., Ikeda S., Pascual-Marqui R.D., Ishii R., Kinoshita T. Functional localization and effective connectivity of cortical theta and alpha oscillatory activity during an attention task. Clin. Neurophysiol. Pract. 2017. 2: 193–200.
Klimesch W., Schimke H., Doppelmayr M., Ripper B., Schwaiger J., Pfurtscheller G. Event-related desynchronization (ERD) and the Dm effect: does alpha desynchronization during encoding predict later recall performance? Int. J. Psychophysiol. 1996. 24 (1-2): 47–60.
Klimesch W. EEG alpha and theta oscillations reflect cognitive and memory performance: a review and analysis. Brain Res. Brain Res. Rev. 1999. 29 (2–3): 169–195.
Kober H., DeVito E.E., DeLeone C.M., Carroll K.M., Potenza M.N. Cannabis abstinence during treatment and one-year follow-up: relationship to neural activity in men. Neuropsychopharmacology. 2014. 39 (10): 2288–2298.
Levar N., Francis A.N., Smith M.J., Ho W.C., Gilman J.M. Verbal Memory Performance and Reduced Cortical Thickness of Brain Regions Along the Uncinate Fasciculus in Young Adult Cannabis Users. Cannabis Cannabinoid Res. 2018. 3 (1): 56–65. https://doi.org/10.1089/can.2017.0030
Magazzini L., Ruhnau P., Weisz N. Alpha suppression and connectivity modulations in left temporal and parietal cortices index partial awareness of words. Neuroimage. 2016. 133: 279–287. https://doi.org/10.1016/j.neuroimage.2016.03.025
Mapelli I., Özkurt T.E. Brain Oscillatory Correlates of Visual Short-Term Memory Errors. Front. Hum. Neurosci. 2019. 13: 33. https://doi.org/10.3389/fnhum.2019.00033
Pandey A.K., Kamarajan C., Manz N., Chorlian D.B., Stimus A., Porjesz B. Delta, theta, and alpha event-related oscillations in alcoholics during Go/NoGo task: Neurocognitive deficits in execution, inhibition, and attention processing. Progress in Neuro-Psychopharmacology and Biological Psychiatry. 2016. 65: 158–171. https://doi.org/10.1016/j.pnpbp.2015.10.002
Pfurtscheller G., Lopes da Silva F.H. Event-related EEG/MEG synchronization and desynchronization: basic principles. Clin. Neurophysiol. 1999. 110 (11): 1842–1857.
Pfurtscheller G., Neuper C., Krausz G. Functional dissociation of lower and upper frequency mu rhythms in relation to voluntary limb movement. Clin. Neurophysiol. 2000. 111 (10): 1873–1879.
Rentzsch J., Stadtmann A., Montag C., Kunte H., Plöckl D., Hellweg R., Gallinat J., Kronenberg G., Jockers-Scherübl M.C. Attentional dysfunction in abstinent long-term cannabis users with and without schizophrenia. Eur. Arch. Psychiatry Clin. Neurosci. 2016. 266 (5): 409–21. https://doi.org/10.1007/s00406-015-0616-y
Sadaghiani S., Kleinschmidt A. Brain Networks and α-Oscillations: Structural and Functional Foundations of Cognitive Control. Trends Cogn. Sci. 2016. 20 (11): 805–817. https://doi.org/10.1016/j.tics.2016.09.004
Sahinoglu B., Dogan G. Event-Related Potentials and the Stroop Effect. Eurasian J. Med. 2016. 48 (1): 53–57. https://doi.org/10.5152/eurasianjmed.2016.16012
Scott J.C., Slomiak S.T., Jones J.D., Rosen A.F.G., Moore T.M., Gur R.C. Association of Cannabis With Cognitive Functioning in Adolescents and Young Adults: A Systematic Review and Meta-analysis. JAMA Psychiatry. 2018. 75 (6): 585–595. https://doi.org/10.1001/jamapsychiatry.2018.0335
Skosnik P.D., Park S., Dobbs L., Gardner W.L. Affect processing and positive syndrome schizotypy in cannabis users. Psychiatry Res. 2008. 157: 279–282.
Tapert S.F., Schweinsburg A.D., Drummond S.P., Paulus M.P., Brown S.A. Functional MRI of inhibitory processing in abstinent adolescent marijuana users. Psychopharmacology. 2007. 194: 173–183.
Thayer R.E., Feldstein Ewing S.W., Dodd A.B., Hansen N.S., Mayer A.R., Ling J.M., Bryan A.D. Functional activation during the Stroop is associated with recent alcohol but not marijuana use among high-risk youth. Psychiatry Res. 2015. 234 (1): 130–136. https://doi.org/10.1016/j.pscychresns.2015.09.009
Vassileiou B., Meyer L., Beese C., Friederici A.D. Alignment of alpha-band desynchronization with syntactic structure predicts successful sentence comprehension. Neuroimage. 2018. 175: 286–296. https://doi.org/10.1016/j.neuroimage.2018.04.008
Дополнительные материалы отсутствуют.
Инструменты
Журнал высшей нервной деятельности им. И.П. Павлова


