Журнал высшей нервной деятельности им. И.П. Павлова, 2019, T. 69, № 6, стр. 752-767
ВЫЯВЛЕНИЕ ИЗМЕНЕНИЙ НАПРАВЛЕННЫХ МЕЖСТРУКТУРНЫХ СВЯЗЕЙ ПРИ ЛИМБИЧЕСКИХ СУДОРОГАХ, ВЫЗВАННЫХ ВВЕДЕНИЕМ АНТАГОНИСТА ЭНДОКАННАБИНОИДНЫХ РЕЦЕПТОРОВ, МЕТОДОМ НЕЛИНЕЙНОЙ ПРИЧИННОСТИ ПО ГРЕЙНДЖЕРУ
М. В. Сысоева 1, Л. В. Виноградова 2, М. Перескис 3, 4, К. М. ван Рейн 3, И. В. Сысоев 5, 6, *
1 ФГБОУ ВО Саратовский государственный технический университет им. Ю. А. Гагарина
Саратов, Россия
2 ФГБУН Институт высшей нервной деятельности и нейрофизиологии РАН
Москва, Россия
3 Donders centre for cognition, Radboud university
Неймеген, Нидерланды
4 HAS University of applied sciences
Хертогенбос, Нидерланды
5 ФГБОУ ВО Саратовский национальный исследовательский государственный университет
имени Н.Г. Чернышевского
Саратов, Россия
6 Саратовский филиал ФГБУН Институт радиотехники и электроники им. В.А. Котельникова РАН
Саратов, Россия
* E-mail: ivssci@gmail.com
Поступила в редакцию 05.09.2018
После доработки 25.04.2019
Принята к публикации 03.06.2019
Аннотация
Височная эпилепсия, наиболее распространенная и фармакорезистентная форма эпилепсии, характеризуется значительными изменениями связанности между структурами мозга. В данной работе, используя переменную во времени нелинейную причинности по Грейнджеру, удалось по временным рядам сигналов локальных потенциалов мозга, измеренных в таламусе, лобной коре, среднем мозге и гиппокампе крыс, выявить изменения в структуре взаимодействий (как усиления, так и ослабления) при развитии спонтанных лимбических судорог после хронического введения антагониста эндоканнабиноидных CB1 рецепторов SLV326. Частотно-временной анализ выявил двухфазную структуру спонтанных лимбических судорог с начальной высокочастотной фазой и последующей низкочастотной активностью, что частично подтверждается анализом связанности.
Спонтанные эпилептические судороги, в которые вовлекаются гиппокамп и парагиппокампальные области, являются основным проявлением височной эпилепсии – наиболее тяжелой и фармакорезистентной ее формы. В ходе вторичной генерализации эта локальная эпилептическая активность может распространяться по синаптическим связям широко за пределы лимбических структур [Bertram, 1997; Spenser, 2002]. У экспериментальных животных спонтанные лимбические судороги развиваются после эпилептического статуса, вызываемого фармакологической [Cavalheiro, 1995] или электрической стимуляцией [Curia et al., 2008]. Развитие эпилепсии часто связывают с дегенеративными изменениями в гиппокампе [Mello et al., 1993; Borges et al., 2003]. В то же время для пациентов с височной эпилепсией (и экспериментальных моделей этого заболевания) показано, что лимбические судороги могут развиваться не вследствие нейродегенерации, а как результат увеличения связанности между возбуждающими нейронами гиппокампа [Lehmann et al., 2000]. Ранее нами было обнаружено, что лимбические судороги также могут развиваться у неэпилептических крыс в ответ на введение антагониста эндоканнабиноидных CB1 рецепторов [van Rijn et al., 2011].
Известно, что эндоканнабиноидная система участвует в регуляции чувствительности мозга к эпилептической активации [Wallace et al., 2003; Alger, 2004]. Эндоканнабиноиды синтезируются по требованию в ответ на активацию постсинаптических нейронов и ретроградно подавляют выброс нейротрансмиттеров из пресинаптических терминалей через локализованные на них CB1 рецепторы. Активация эндоканнабиноидных рецепторов при избыточной активности глутаматергических синапсов участвует в поддержании необходимого физиологического уровня нейронной возбудимости [Katona, Freund, 2012]. Эпилептическое гипервозбуждение быстро активирует этот защитный механизм [Lutz, 2004]. Таким образом, CB1 рецепторы играют основополагающую роль в механизме эндоканнабиноидной защиты от эпилептических приступов [Fernandez-Ruiz, Gonzales, 2005; Herkenham et al., 1990], и блокирование этих рецепторов, прежде всего в гиппокампе приводит к повышению чувствительности мозга к судорогам [Monory et al., 2006].
В постстатусных моделях эпилептогенеза агонисты CB1 рецепторов снижают выраженность эпилептического статуса и последующую смертность [Suleymanova et al., 2016], предотвращают появление спонтанной эпилептической активности у крыс [Wallace et al., 2003] и морских свинок [Шубина, Кичигина, 2011]. Протекторное антиэпилептогенное влияние агониста эндоканнабиноидных рецепторов WIN 55.212-2 показано на пост-статусной модели височной эпилепсии in vivo [Shubina et al., 2017; Wallace et al., 2003] и на модели аудиогенного киндлинга [Vinogradova, van Rijn 2015]. С другой стороны, антагонисты CB1 рецепторов снижают устойчивость мозга к эпилепсии [van Rijn et al., 2011]. Хроническое введение антагонистов СВ1 рецепторов вызывает быструю генерализацию судорожной активности из среднего мозга в лимбическую систему у крыс с генетической аудиогенной эпилепсией [Vinogradova et al., 2011] и вызывает развитие спонтанных лимбических судорог у здоровых крыс [van Rijn et al., 2011]. Динамика межструктурных связей во время этих судорожных приступов исследуется в данной работе.
Известно, что многие области за пределами лимбической системы, включая кору больших полушарий и подкорковые структуры, вовлекаются в процесс вторичной генерализации лимбических разрядов у экспериментальных животных [Norden, Blumenfeld, 2002; Blumenfeld et al., 2009] и у пациентов со сложными парциальными приступами [Blumenfeld et al., 2009; Haneef et al., 2014]. Данное исследование имеет своей целью проанализировать направленную функциональную связанность между неокортексом, гиппокампом, таламусом и средним мозгом во время спонтанных эпилептических приступов лимбического типа, вызванных введением SLV326. Гиппокамп считается основным генератором эпилептиформной активности при височной (лимбической) эпилепсии. Средний мозг активно вовлечен в генерацию тонико-клонических судорог [Browning, Nelson, 1986; McCown et al., 1987; Gale, 1992]. Таламус – важная область мозга, участвующая в распространении эпилептиформной активности из коры больших полушарий и наряду с гиппокампом генерирующая наиболее выраженную эпилептическую активность при разных формах эпилепсии [Blumenfeld et al., 2009; He et al., 2015; Dinkelacker et al., 2015].
Большинство исследований посвящено изучению паттерна начальной фазы лимбических судорог, так как предполагается его тесная связь с локализацией фокуса эпилептической активности в лимбической системе [King, Spenser, 1995]. Однако сильная нестационарность электроэнцефалографических сигналов при лимбических судорогах, очевидно, обусловлена процессами вторичной генерализации эпилептического возбуждения и его прекращения. Целью данной работы является определение характера межструктурных взаимодействий при лимбических судорогах, вызванных хроническим введением антагониста эндоканнабиноидных СВ1 рецепторов на протяжении всего лимбического разряда. Значимость результатов анализа функциональной связанности для изучения эпилепсии уже неоднократно подчеркивалась в литературе, см. обзор [van Mierlo et al., 2014].
Так как при этом важно использовать методы, способные, во-первых, учесть нелинейность сигналов, во-вторых, определить направленность взаимодействия, в-третьих, надежно диагностировать связанность и отличить ее от случайного совпадения ритмов или опосредованного взаимодействия вследствие наличия общего источника [Kaminski et al., 2001; Gourevitch et al., 2006], в данном исследовании использовался метод нелинейной адаптивной причинности по Грейнджеру [Sysoeva et al., 2014]. Этот подход принимает во внимание основные свойства экспериментальных сигналов, в частности, временные масштабы, нелинейность и эффективную размерность. Его высокое временное разрешение в сочетании с неплохим пространственным разрешением было продемонстрировано в работах [Sysoev, Sysoeva, 2015; Kornilov et al., 2016]. Другим достоинством данного подхода является его слабая чувствительность к опосредованным связям [Sysoev, Sysoeva, 2015].
МЕТОДИКА
Животные и запись сигналов локальных потенциалов мозга
Эпилептиформные разряды, анализируемые в данной работе, были зарегистрированы во время спонтанных поведенческих судорог лимбического типа, развившихся после хронического введения антагониста CB1 рецепторов SLV326 [van Rijn et al., 2011]. Все исследования проводились строго в соответствии с нормами Европейского Сообщества, разработанными для экспериментов на животных и одобренными этической комиссией по экспериментам над животными. Эксперименты проводились на 24 крысах линии Wistar. В возрасте 8–9 мес животным начинали ежедневно перорально вводить антагонист эндоканнабиноидных рецепторов SLV326 в дозировке 2–3 мг/кг в полужидкой форме. Препарат SLV326 был закуплен у компании-разработчика – Solvay Pharmaceuticals, Нидерланды.
Всем 24 животным под изофлурановой анестезией вживляли внутричерепные электроды (Plastics One, MS-332/2-A) во фронтальную кору (FC) (АР+2; L-2; V-1; в гиппокамп (HP) (AP-4.2; L-3.6; V-4.1); в таламус (TH) (AP-2.6; L-2.7; V-7.3) и средний мозг (MB) (AP-8.8; L-1.7; V-5.2). Референтный электрод и электрод заземления устанавливали билатерально над мозжечком. Восстановительный период после операции длился не менее двух недель.
Записи локальных потенциалов мозга и видеонаблюдение проводили в течение 24 ч. Сигналы локальных потенциалов усиливались биоусилителем, аппаратно фильтровались в полосе 1–100 Гц и оцифровывались с частотой 100 Гц, используя систему съема Windaq от DATAQ Instruments, Akron, США. Из 24 животных 6 демонстрировали спонтанные поведенческие судороги. Часть данных оказалась непригодна для анализа из-за технических проблем регистрации. В результате в нашем распоряжении оказались 38 разрядов достаточной длительности и приемлемого качества, полученные у шести животных. Для двух крыс с максимальным числом разрядов (17 и 12 в сутки) был проведен полный анализ с усреднением по разрядам и статистическим анализом значимости. Для остальных животных анализ проводили в той степени, в которой это было возможно (только по нескольким разрядам либо между частью каналов).
Применение переменной во времени нелинейной причинности по Грейнджеру
Для анализа сигналов был использован метод переменной во времени нелинейной причинности по Грейнджеру [Sysoeva et al., 2014], существенно доработанный по сравнению с оригинальным подходом, изложенным в [Granger, 1969], в том числе с использованием наработок [Chen et al., 2004]. Метод основан на построении двух прогностических моделей в скользящем временном окне: индивидуальной модели для сигнала $\left\{ {{{x}_{n}}} \right\}_{n}^{N} = 1$, возможное воздействие на который исследуется (ошибку прогноза этой модели обозначим как (1)), и совместной модели, включающей данные из сигнала $\left\{ {{{y}_{n}}} \right\}_{n}^{N} = 1$, воздействие со стороны которого предполагается (соответствующая ошибка прогноза дается формулой (2) и, как правило, меньше, чем ошибка, задаваемая формулой (1)). Улучшение прогноза (3) является основной мерой связанности и лежит в диапазоне от 0 до 1.
где xn суть измеренные значения, $x_{n}^{'}$ суть соответствующие им предсказанные индивидуальной моделью (4) значения, а $x_{n}^{{''}}$ суть одновременные значения, предсказанные совместной моделью (5) – см. приложение А, нижние индексы s и j здесь и далее соответствуют индивидуальной и совместной моделям соответственно.Поскольку метод является существенно параметрическим, т.е. его результаты в решающей степени зависят от выбора параметров, были использованы специально разработанные модели. Они первоначально основывались на моделях, применявшихся для исследования абсансной эпилепсии, но были модифицированы для адаптации к специфике лимбических разрядов в работе [Сысоева, Медведева, 2018] в соответствии с полученными ранее на модельных системах рекомендациями [Kornilov et al., 2016], как это показано в приложении А. Оптимальный подбор параметров прогностических моделей в методе нелинейной причинности по Грейнджеру в приложении к сигналам, характеризуемым хорошо выраженными временными масштабами.
Как было показано в работе [Smirnov, Mokhov, 2009], абсолютные значения улучшения прогноза имеют малую ценность. Однако увеличение или уменьшение PI может служить диагностическим критерием изменения силы связи, см. [Sysoev, Sysoeva, 2015]. Таким образом могут быть детектированы изменения в силе связей, в том числе в скользящем временном окне [Hesse et al., 2003]. В данной работе использовалось временное окно длиной в 1 с (512 отсчетов) со сдвигом окон относительно друг друга 0.1 с.
Разметка и частотно-временной анализ сигналов локальных потенциалов
Все приступы начинались внезапно с небольшого по амплитуде пика, детектируемого одновременно во всех четырех точках регистрации. На спектрограмме в это время появлялась выраженная активность частотой 20 Гц и выше, сначала довольно низкоамплитудная, но быстро нараставшая по амплитуде с сопутствующим снижением по частоте, что видно на рис. 1, особенно в коре и таламусе. Общая длительность приступов составляла от 35.0 с до 115.3 с при средней длительности в 53.1 с. С помощью частотно временного анализа (см. рис. 1) для всех разрядов были выделены две основные стадии протекания приступа:
Рис. 1.
Временные ряды (а, в, д, ж) и спектрограммы (б, г, е, з) – более темный цвет соответствует большей мощности – сигналов локальных потенциалов мозга на промежутке за 10 с до начала лимбического эпилептического приступа, включая весь приступ и первые 10 с после его окончания. Фрагменты (а, б) соответствуют лобной коре, (в, г) – таламусу, (д, е) – гиппокампу, (ж, з) – среднему мозгу. Три черные вертикальные линии показывают начало приступа, переход от высокочастотной стадии к низкочастотной и его окончание.
Fig. 1. Time series (а, в, д, ж) and spectra (б, г, е, з) – higher power is colored darker – of local field potential signals in the time range from 10 s before a limbic seizure till 10 s after its termination. Panels (а, б) correspond to frontal cortex, (в, г) correspond to thalamus, (д, е) correspond to hippocampus, (ж, з) correspond to midbrain. Three black vertical lines indicate seizure onset, transition to low frequency stage and seizure termination correspondingly.
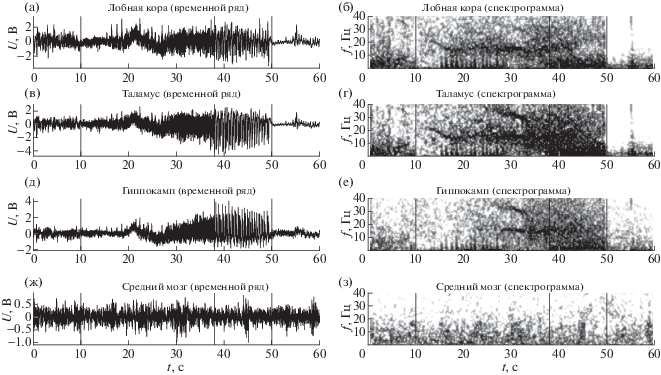
1. высокочастотная стадия, начинающаяся с выраженных колебаний на частоте около 20 Гц, затем в течение первых 5 с спадающая до 15 Гц;
2. низкочастотная стадия с основной частотой колебаний около 2 Гц.
Длительность высокочастотной стадии составляла 23.3–55.7 с при среднем значении 36.0 с. На протяжении этой стадии приступа амплитуда колебаний постепенно увеличивалась. Вся эта стадия, как правило, сильно нестационарна (изменения статистических и спектральных свойств сигнала происходят на временах, много меньших общей длительности стадии), и основной ритм мог быть выражен сразу на нескольких частотах.
Переход между стадиями диагностировался по появлению хорошо выраженной активности на частоте порядка 2 Гц. Этот момент также легко определялся по изменению формы колебаний, что видно из рис. 1 для всех каналов, кроме среднего мозга. Низкочастотная стадия длилась от 5.7 до 59.6 с, 17.1 с в среднем. В ее начале еще заметна высокочастотная компонента колебаний, но низкочастотная составляющая уже доминирует и вскоре остается единственной. Когда амплитуда низкочастотной компоненты резко падает, разряд заканчивается одновременно с прекращением моторных судорог.
Окончание разряда отмечалось по падению мощности сигнала и исчезновению ритмической активности на спектрограмме. При этом окончание не может быть установлено с большою точностью, поскольку сам основной ритм перед окончанием имеет период порядка 0.5 с (частота 2 Гц).
Статистический анализ оценок связанности
Для каждого разряда строились индивидуальные зависимости PI(t), используя временной интервал, целиком покрывающий не только сам разряд, но и 10 с до него и 10 с после. Для дальнейшего усреднения из индивидуальных графиков извлекались следующие 20-секундные фрагменты:
1. начало разряда – 10 с до начала разряда и его первые 10 с;
2. переход к низкочастотной стадии – последние 10 с высокочастотной стадии и первые 10 с низкочастотной стадии;
3. завершение разряда – 10 с непосредственно перед концом приступа и 10 с сразу после его окончания.
Полученные для отдельных разрядов зависимости PI(t) усреднялись, для чего совмещались начала и концы трех описанных выше фрагментов. Без разрезания на фрагменты и совмещения усреднение было бы невозможно, поскольку все разряды были различной длины. Далее для каждой усредненной зависимости рассчитывался фоновый уровень связанности PIbg как среднее значение по 3 с (промежуток от –10 до –7 с до начала разряда, см. рис. 2–5) по всем разрядам для данного животного. Используя данное значение, рассчитывалась нормированная зависимость PI0(t) = PI(t) – PIbg. Таким образом, значение PI0 = 0 соответствовало уровню связанности в фоне, положительные значения – повышению уровня связанности, а отрицательные – снижению.
Рис. 2.
Зависимость нормированного усредненного по всем разрядам для крысы №3 улучшения прогноза $P{{I}_{0}}\left( t \right)$ от времени для пар каналов, где одной из взаимодействующих структур является лобная кора, в том числе (а) для пары лобная кора–средний мозг, (б) лобная кора–таламус, (в) лобная кора–гиппокамп. Во всех случаях приведены зависимости для связей в обе стороны, направление воздействия обозначено слева по оси ординат. Серые точки соответствуют значениям, не отличающимся значимо от фоновых на уровне 0.05, черные – отличающимся; при этом если соответствующее значение выше нуля, то значит, связанность выросла, а если ниже – упала. Черными линиями обозначены начало и конец разряда, начало низкочастотной стадии и конец интервала, взятого за фоновую активность, серыми до ближайшей черной справа – длина временного окна.
Fig. 2. Dependency of normalized averaged over all seizures prediction improvement $P{{I}_{0}}\left( t \right)$ on time for rat No 3 for channelpairs, in which frontal cortex participates. In particular, (а) frontal cortex – midbrain, (б) frontal cortex – thalamus, (в) frontal cortex – hippocampus. In all cases dependencies of coupling in both directions are plotted, with direction being indicated at Y-axis. Gray dots correspond to PI values, which do not differ significantly on the p-value level equal to 0.05 from baseline and black dots correspond to values which are different significantly. Black vertical lines indicate seizure onset, start of low frequency stage, seizure termination and baseline termination. Gray vertical lines (to the next black line) indicate length of the time window, used for PI calculation.
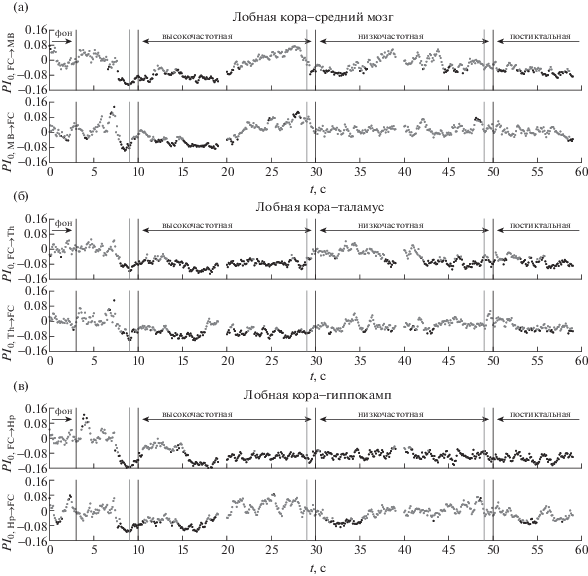
Рис. 3.
Зависимость нормированного усредненного по всем разрядам для крысы № 9 улучшения прогноза $P{{I}_{0}}\left( t \right)$ от времени для пар каналов, где одной из взаимодействующих структур является лобная кора, в том числе (а) для пары лобная кора–средний мозг, (б) лобная кора–таламус, (в) лобная кора–гиппокамп. Во всех случаях приведены зависимости для связей в обе стороны, направление воздействия обозначено слева по оси ординат. Серые точки соответствуют значениям, не отличающимся значимо от фоновых на уровне 0.05, черные – отличающимся; при этом если соответствующее значение выше нуля, то, значит, связанность выросла, а если ниже – упала. Черными линиями обозначены начало и конец разряда, начало низкочастотной стадии и конец интервала, взятого за фоновую активность, серыми до ближайшей черной справа – длина временного окна.
Fig. 3. Dependency of normalized averaged over all seizures prediction improvement $P{{I}_{0}}\left( t \right)$ on time for rat No 9 for channel pairs, in which frontal cortex participates. In particular, (а) frontal cortex – midbrain, (б) frontal cortex – thalamus, (в) frontal cortex – hippocampus. In all cases dependencies of coupling in both directions are plotted, with direction being indicated at Y-axis. Gray dots correspond to PI values, which do not differ significantly on the p-value level equal to 0.05 from baseline and black dots correspond to values which are different significantly. Black vertical lines indicate seizure onset, start of low frequency stage, seizure termination and baseline termination. Gray vertical lines (to the next black line) indicate length of the time window, used for PI calculation.
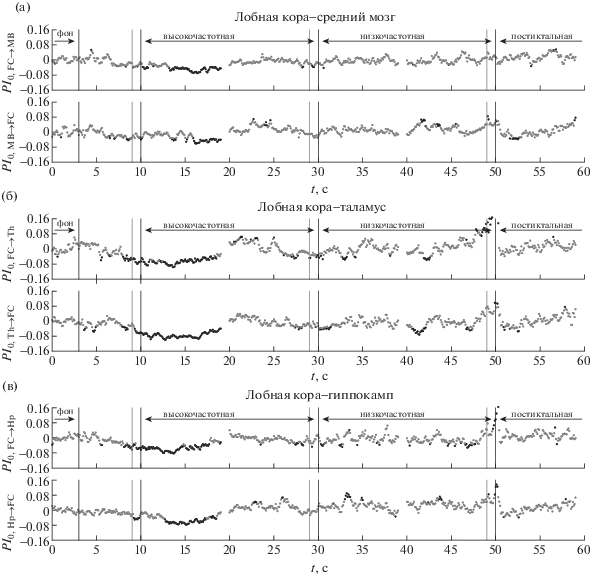
Рис. 4.
Зависимость нормированного усредненного по всем разрядам для крысы № 3 улучшения прогноза $P{{I}_{0}}\left( t \right)$ от времени для пар каналов, включающих только глубокие структуры мозга, в том числе (а) для пары таламус–средний мозг, (б) гиппокамп–средний мозг, (в) гиппокамп–таламус. Во всех случаях приведены зависимости для связей в обе стороны, направление воздействия обозначено слева по оси ординат. Серые точки соответствуют значениям, не отличающимся значимо от фоновых на уровне 0.05, черные – отличающимся; при этом если соответствующее значение выше нуля, то значит, связанность выросла, а если ниже – упала. Черными линиями обозначены начало и конец разряда, начало низкочастотной стадии и конец интервала, взятого за фоновую активность, серыми до ближайшей черной справа – длина временного окна.
Fig. 4. Dependency of normalized averaged over all seizures prediction improvement $P{{I}_{0}}\left( t \right)$ on time for rat No 3 for channelpairs, including only deeper brain structures. In particular, (а) thalamus – midbrain, (б) hippocamp – midbrain, (в) hippocampus – thalamus. In all cases dependencies of coupling in both directions are plotted, with direction being indicated at Y-axis. Gray dots correspond to PI values, which do not differ significantly on the p-value level equal to 0.05 from baseline and black dots correspond to values which are different significantly. Black vertical lines indicate seizure onset, start of low frequency stage, seizure termination and baseline termination. Gray vertical lines (to the next black line) indicate length of the time window, used for PI calculation.
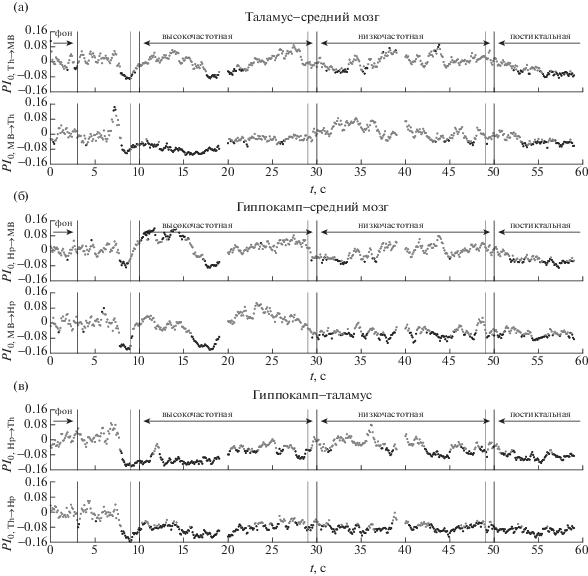
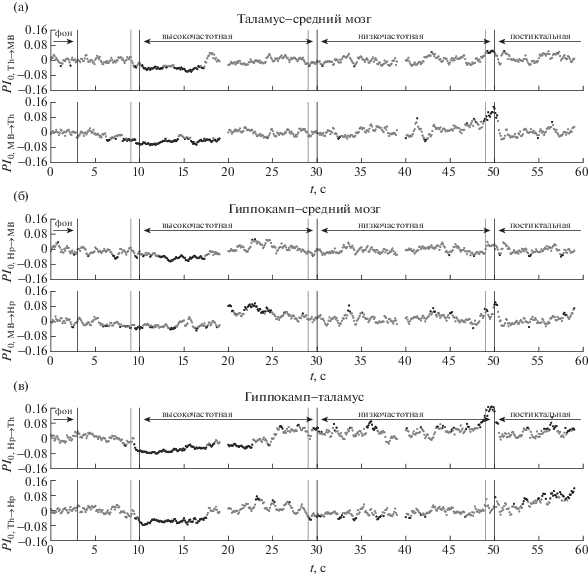
Рис. 5.
Зависимость нормированного усредненного по всем разрядам для крысы № 3 улучшения прогноза $P{{I}_{0}}\left( t \right)$ от времени для пар каналов, включающих только глубокие структуры мозга, в том числе (а) для пары таламус–средний мозг, (б) гиппокамп–средний мозг, (в) гиппокамп–таламус. Во всех случаях приведены зависимости для связей в обе стороны, направление воздействия обозначено слева по оси ординат. Серые точки соответствуют значениям, не отличающимся значимо от фоновых на уровне 0.05, черные – отличающимся; при этом если соответствующее значение выше нуля, то, значит, связанность выросла, а если ниже – упала. Черными линиями обозначены начало и конец разряда, начало низкочастотной стадии и конец интервала, взятого за фоновую активность, серыми до ближайшей черной справа – длина временного окна.
Fig. 5. Dependency of normalized averaged over all seizures prediction improvement $P{{I}_{0}}\left( t \right)$ on time for rat No 3 for channelpairs, including only deeper brain structures. In particular, (а) thalamus – midbrain, (б) hippocampus – midbrain, (в) hippocampus – thalamus. In all cases dependencies of coupling in both directions are plotted, with direction being indicated at Y-axis. Gray dots correspond to PI values, which do not differ significantly on the p-value level equal to 0.05 from baseline and black dots correspond to values which are different significantly. Black vertical lines indicate seizure onset, start of low frequency stage, seizure termination and baseline termination. Gray vertical lines (to the next black line) indicate length of the time window, used for PI calculation.
Значения PI(t), полученные для различных разрядов в один и тот же момент времени, рассматривались как выборка, и их отличие от нуля тестировалось с помощью t-теста Стьюдента для среднего. Поскольку тестирование проводилось для множества значений времени, вводилась поправка по типу поправки Бонферрони, но учитывающая, что полученные значения рассчитаны по частично перекрывающимся интервалам. Если после введения поправки значимое различие наблюдалось на уровне значимости $p < 0.05$, то оно отмечалось на рисунках 2–5 черным, а незначимые – серым.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
Обнаружена высокая индивидуальная вариабельность в частоте возникновения спонтанных лимбических судорог у крыс, которым хронически вводился антагонист СВ1 рецепторов, с высоким числом судорог у одних (17 и 12 в сутки у двух крыс) и низким числом приступов у других (1–4 у четырех крыс). Так как для некоторых приступов сигнал был частично утерян, мы отказались от усреднения по всем животным и тестирования на статистическую значимость по ансамблю животных, как это, например, делалось при исследовании абсансных приступов [Сысоева и др., 2016]. Вместо этого усреднялись результаты по отдельным животным и проводилась статистическая обработка для животных с максимальным числом зарегистрированных спонтанных судорог. Поскольку индивидуальные особенности связанности выражены в данном случае значительнее, чем для абсансных судорог [Papadopoulou et al., 2017], такой подход представляется оптимальным. В работе представлены только те результаты, которые являются общими для всех крыс со спонтанными лимбическими судорогами и значимыми для животных, для которых удалось провести статистический анализ.
Начало разряда
У всех рассмотренных животных за 2–3 с до начала разряда отмечается падение уровня связанности в четырех направлениях: со стороны лобной коры на гиппокамп и таламус (см. рис. 2, 3 (б, в)), со стороны среднего мозга на таламус (см. рис. 4, 5 (а)) и со стороны таламуса на лобную кору. У ряда животных также отмечается одновременное падение связанности и в других парах каналов, в том числе при взаимодействии гиппокампа и таламуса (см. рис. 4 (в)). Никакого повышения связанности при этом не наблюдается.
Низкий уровень связанности по отношению к фону наблюдается также во многих парах отведений в первые 5–10 с приступа. В частности, у всех животных была значимо снижена связанность в направлении с лобной коры на таламус и гиппокамп (рис. 2, 3 (б, в)), хотя зачастую это снижение имело место с некоторым запаздыванием по отношению к началу разряда.
Переход к низкочастотной стадии
За несколько секунд до окончания высокочастотной стадии у всех животных отмечалось повышение связанности со стороны гиппокампа и среднего мозга на лобную кору (см. рис. 2, 3 (а, в)), что также соответствует ранее изложенным данным из литературы. В то же время предложенный подход благодаря своему временному разрешению позволяет обнаружить, что падение воздействия со стороны коры на глубокие структуры предшествует их гиперактивации, в то время как при изучении всего разряда в целом предполагалось, что эти процессы происходят одновременно. В подавляющем числе случаев также наблюдается повышение двустороннего взаимодействия в паре гиппокамп-средний мозг (рис. 4, 5 (б)), хотя у различных животных уровень значимости этих выводов и преимущественное направление воздействия различны.
В начале низкочастотной стадии повышенная связанность возвращается к норме, по крайней мере, у части животных. Единственное значимое отличие от фона, наблюдающееся у всех животных, – это снижение воздействия таламуса на гиппокамп (рис. 4, 5 (в)).
Завершение разряда
Проведенный анализ не позволил выявить общих закономерностей в изменениях связанности между рассмотренными структурами, сопровождающих окончание разрядов. В то время как у части животных эти изменения отсутствовали, у других наблюдался подъем связанности в направлении от гиппокампа к таламусу (см. рис. 5 (в)) или со стороны лобной коры на таламус (см. рис. 3 (б)). Переход к постиктальному состоянию у одних крыс сопровождался нормализацией связанности (см. рис. 2, 4 для крысы № 9), у других животных многие связи оставались сниженными в течение длительного времени после завершения приступа (см. рис. 3, 5 для крысы № 3).
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Эволюция связанности в мозге, сопутствующая развитию эпилептиформной активности, наиболее полно изучена при абсансной эпилепсии [Lüttjohann, van Luijtelaar, 2012; Sysoeva et al., 2016; Сысоева и др., 2016], поскольку эта форма эпилепсии наиболее проста для изучения из-за наличия подтвержденных генетических моделей, регулярности и воспроизводимости самих приступов [Coenen, Luijtelaar, 2003]. Однако она имеет достаточно невысокое клиническое значение [Вольнова и Ленков, 2012]. Для височной эпилепсии – наиболее клинически значимой и фармакорезистентной формы заболевания – подобный анализ затруднен рядом обстоятельств, основными из которых являются отсутствие генетических моделей, высокая индивидуальная вариабельность частоты и паттерна спонтанных судорог и выраженная нестационарность разрядов. Попытка использования метода причинности по Грейнджеру для исследования паттерна лимбических судорог была предпринята в работе [Cadotte et al., 2010], где был проведен анализ 15 спонтанных приступов, зарегистрированных у трех животных. Прямое сопоставление результатов, однако, затрудняется тем, что авторы [Cadotte et al., 2010] использовали линейную попарную неадаптированную ко временным масштабам сигнала причинность, которая часто дает систематические ошибки в выявлении направления связанности, что было неоднократно показано [Chen et al., 2004; Marinazzo et al., 2006; Smirnov, 2014; Sysoev, Sysoeva, 2015; Kornilov et al., 2016]. Тем не менее существует ряд работ, результаты в которых были получены другими методами и могут быть сопоставлены с результатами данной работы.
Сниженное воздействие со стороны лобной коры больших полушарий на подкорковые структуры было ранее обнаружено как для экспериментальных лимбических судорог [Englot et al., 2009], так и для парциальных судорог у пациентов с височной эпилепсией [Blumenfeld et al., 2009; Haneef et al., 2014]. Эти работы показали активацию глубоких структур мозга и деактивацию коры больших полушарий во время лимбических разрядов. Предполагалось, что в результате активации таламуса и частично среднего мозга происходит подавление активности лобной и теменной коры, что определяет поведенческий и клинический паттерн судорожного приступа [Norden, Blumenfeld, 2002; Blumenfeld et al., 2009]. Наши результаты также указывают на то, что, несмотря на явное вовлечение коры больших полушарий, она играет в основном пассивную роль в экспрессии лимбических судорог. Полученные результаты подчеркивают важность использования нелинейных адаптированных подходов, поскольку расчет функции когерентности и иных линейных спектральных мер указывает на увеличение синхронности в коре и таламусе во время лимбических приступов без понимания того, чем эта синхронность обусловлена [Guye et al., 2006].
Как гиппокамп, так и средний мозг могут, как было показано ранее, являться источниками эпилептической активности при лимбической и аудиогенной эпилепсии [Gale, 1992; McCown et al., 1987]. Эти две структуры также имеют как прямые, так и опосредованные глутаматергические проекции в новую кору и таламус, а также связи друг с другом. На основе приведенного анализа можно сформулировать гипотезу, согласно которой усиление эпилептической активности в конце первой высокочастотной фазы разряда связано с образованием положительной петли обратной связи между гиппокампом и средним мозгом, которые, “раскачивая” и синхронизуя друг друга, также вовлекают в эпилептическую активацию кору и таламус.
Наблюдаемое нами снижение воздействия таламуса на гиппокамп во время поздней низкочастотной стадии может быть свидетельством того, что гиппокамп все еще генерирует некую патологическую активность, мешающую таламической активности, поскольку гиппокамп остается невосприимчивым к воздействию таламуса. Этот признак является косвенным, и для прояснения данного положения необходимы дополнительные измерения, в том числе от большего числа структур мозга, включая энторинальную кору – важнейшего компонента лимбической системы, участвующего в том числе в поддержании эпилептической активности [Barbarosie, Avoli, 1997].
Анализ наших экспериментальных данных показал отсутствие специфического механизма завершения лимбических судорог. Возможно, что эти приступы оканчиваются вследствие исчерпания энергетических ресурсов. На это может указывать постепенное падение амплитуды и частоты колебаний к концу приступа (см. рис. 1). Если же механизм активного прекращения эпилептического разряда все же существует, не исключено, что он может быть локализован в пределах одной из лимбических структур, например, в гиппокампе, повышенная связанность между нейронами которого может играть фундаментальную роль в генерации судорог [Lehmann et al., 2000], и поэтому не проявляться в связях между ними.
Значительное число изменений в связанности на всех этапах протекания судорог оказались выражены у одних животных и не выражены у других. По всей видимости, это характеризует индивидуальную степень чувствительности/устойчивости к эпилептической активации лимбических структур мозга.
В данной работе для реализации причинности по Грейнджеру мы использовали нелинейные модели с полиномами общего вида, как предложено в [Chen et al., 2004], поскольку они показали свою высокую эффективность в приложении к изучению абсансных разрядов [Sysoeva et al, 2014; Сысоева и др., 2016], в то время как линейные [Sysoev, Sysoeva, 2015] и кусочно-линейные [Kornilov et al., 2016] модели показали низкую специфичность и чувствительность как на тестовых, так и на реальных данных. В то же время использование нелинейности другого типа, например, радиальных базисных функций [Ancona et al., 2004] или ядерных функций [Marinazzo et al., 2008] может быть не менее эффективно.
ЗАКЛЮЧЕНИЕ
На основе частотно-временного анализа локальных потенциалов поля, зарегистрированных в гиппокампе, таламусе, среднем мозге и лобной коре во время лимбических судорог, вызванных введением антагониста СВ1 рецепторов, выделено две основные стадии разряда: первая – высокочастотная (доминирующие частоты 15–20 Гц) и вторая – низкочастотная, характеризуемая релаксационными по форме колебаниями на частоте порядка 2 Гц. Такое деление разряда на две стадии подтверждается анализом связанности.
Используя метод переменной во времени нелинейной причинности по Грейнджеру, показано, что в начале разряда влияние коры больших полушарий на глубокие структуры мозга (гиппокамп, таламус, средний мозг) падает, а связность между гиппокампом и средним мозгом и их влияние на кору возрастают. Нам впервые удалось выявить, что первый процесс (ослабление влияния коры на подкорковые структуры, см. рис. 6 (a)) предшествует по времени второму (усилению роли подкорковых структур в генерации эпилептической активности, см. рис. 6 (б)). При этом наши результаты показывают, что важную роль во втором процессе играет двустороннее взаимодействие таламуса и гиппокампа.
Рис. 6.
Схема эволюции связанности между рассматриваемыми областями мозга, сопутствующей началу разряда (а), переходу от высокочастотной стадии к низкочастотной (б) и завершению (в). Синим показано ослабление взаимодействия относительно фонового уровня, красным – усиление, пунктиром отмечены изменения, значимые не для всех животных.
Fig. 6. A scheme of the evolution of connectivity between the considered brain regions, accompanying the beginning of the discharge (а), the transition from the high-frequency stage to the low-frequency one (б), and the seizure termination (в). Decreased comparing to baseline level coupling is depicted in blue, while increased coupling is depicted in red. Dotted lines mark changes which are significant not for all animals.
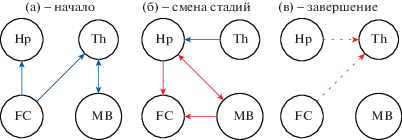
Переход к низкочастотной стадии сопровождается ослаблением взаимодействия между средним мозгом и гиппокампом и их воздействия на кору до фонового уровня у почти всех рассмотренных животных. Однако воздействие на гиппокамп со стороны таламуса все еще снижено (см. рис. 6 (б)), что может в том числе обусловливать отсутствие многих сенсорных реакций во время приступа.
Нам не удалось обнаружить значимых для всех животных изменений связанности во время окончания разряда, хотя ряд животных демонстрировали некоторые изменения связи в направлении таламуса (см. рис. 6 (в)). Однако частотно-временной анализ выявил постепенное падение амплитуды колебаний к концу приступа, что может свидетельствовать об общем истощении энергетических субстратов и нарастающем дефиците нейромедиаторов (в первую очередь, глутамата).
Интересно и важно, что все обнаруженные нами и схематически показанные на рис. 6 изменения являются специфичными для каждой стадии развития эпилептической активности в ходе развития спонтанных лимбических судорог: нет таких изменений, которые сопутствовали бы как началу приступа, так и его завершению или переходу между стадиями.
Данная работа была выполнена при поддержке Стипендии Президента РФ для молодых ученых СП-3605.2018.4 (расчет связанности методом причинности по Грейнджеру) и Российским фондом фундаментальных исследований, грант №18-015-00418 (разметка и частотно-временной анализ, статистический анализ результатов).
ПРИЛОЖЕНИЕ А. ЭМПИРИЧЕСКИЕ МОДЕЛИ
Для расчета улучшения прогноза по формуле (3), чтобы оценить ошибки аппроксимации (1) и (2), использовались две модели: индивидуальная (4) и совместная (5). Использованная индивидуальная модель имеет вид:
(4)
$\begin{gathered} {{x}_{{n + \tau }}} = {{f}_{s}}({{x}_{n}},{{x}_{{n - l}}}, \ldots ,{{x}_{{n - \left( {{{D}_{s}} - 1} \right)l}}}) + {{\alpha }_{{{{Z}_{s}} + 1}}}{{x}_{{n - {{l}_{T}}}}}, \\ {{Z}_{s}} = C_{{({{D}_{s}} + P)}}^{{{{D}_{s}}}}, \\ \end{gathered} $Параметры, ответственные за временные масштабы (дальность прогноза τ и лаги l и lT) были выбраны исходя из основных временных масштабов колебаний, как это было предложено в [Kornilov et al., 2016]. Поскольку в первой и второй фазах основной временной масштаб существенно отличался, а использование различных значений τ, l и lT не позволило бы сопоставлять полученные по формуле (3) значения PI для различных частей ряда, был использован меньший из двух масштабов, так как это менее критично для специфичности модели, как показано в [Сысоева и Медведева, 2018] на различных моделях нейронной динамики [Дмитричев и др., 2018] – простых, но относительно близких к наблюдаемым данным системах. Степень полинома P и размерность индивидуальной модели Ds подбирались с использованием критерия Шварца, как в работе [Сысоева, Сысоев, 2012]. При этом накладывалось дополнительное эмпирическое условие на общее число коэффициентов ${{Z}_{j}} \leqslant {{N}^{{1/2}}}$, рекомендованное в ряде работ, в том числе в [Smirnov, 2014].
Используемая совместная модель по структуре аналогична индивидуальной: иначе полученные оценки будут смещены, как это не раз упоминалось в [Granger, 1969; Chen et al., 2004; Marinazzo et al., 2006]. Размерность совместной модели увеличена на Da = 1 по сравнению с индивидуальной, чтобы обеспечить максимально возможную специфичность (уменьшить число ложно положительных выводов о связанности). Уравнения имеют вид:
(5)
$\begin{gathered} {{x}_{{n + \tau }}} = {{f}_{s}}({{x}_{n}},{{x}_{{n - l}}}, \ldots ,{{x}_{{n - \left( {{{D}_{s}} - 1} \right)l}}},{{y}_{n}}, \ldots ,{{x}_{{n - \left( {{{D}_{a}} - 1} \right)l}}}) + \\ \, + {{\beta }_{{{{Z}_{j}} + 1}}}{{x}_{{n - {{l}_{T}}}}} + {{\beta }_{{{{Z}_{j}} + 2}}}{{y}_{{n - {{l}_{T}}}}}, \\ {{Z}_{j}} = C_{{({{D}_{s}} + {{D}_{a}} + P)}}^{{{{D}_{s}} + {{D}_{a}}}}, \\ \end{gathered} $Коэффициенты моделей (4) и (5) ${{\alpha }_{i}}$ и ${{\beta }_{i}}$ подгонялись методом наименьших квадратов в каждом временном окне заново, в то время как структура моделей всегда сохранялась, что дает возможность сравнивать результаты, полученные для различных временных окон между собой.
Список литературы
Вольнова А.Б., Ленков Д.Н. Абсансная эпилепсия: механизмы гиперсинхронизации нейронных ансамблей. Медицинский академический журнал. 2012. 12 (1): 7–19.
Дмитричев А.С., Касаткин Д.В., Клиньшов В.В., Кириллов С.Ю., Масленников О.В., Щапин Д.С., Некоркин В.И. Нелинейные динамические модели нейронов: Обзор // Известия вузов. Прикладная нелинейная динамика. 2018. 26 (4): 5–58. https://doi.org/10.18500/0869-6632-2018-26-4-5-58
Сысоева М.В., Ситникова Е.Ю., Сысоев И.В. Таламо-кортикальные механизмы инициации поддержания и прекращения пик-волновых разрядов у крыс WAG/Rij. Журнал высшей нервной деятельности им. И.П. Павлова. 2016. 66 (1): 103–112.
Сысоева М.В., Медведева Т.М. Оптимизация параметров метода причинности по Грейнджеру для исследования лимбической эпилепсии. Известия вузов. Прикладная нелинейная динамика. 2018. 26 (5): С. 39–62. https://doi.org/10.18500/0869-6632-2018-26-5-39-62
Сысоева М.В., Сысоев И.В. Математическое моделирование динамики энцефалограммы во время эпилептического припадка. Письма в ЖТФ, 2012. 38 (3): 103–110.
Шубина Л.В., Кичигина В.Ф. Протекторное влияние агониста СВ1-рецепторов WIN 55.212-2 при развитии судорожной активности в мозге на моделях височной эпилепсии in vivo. Журнал высшей нервной деятельности им. И.П. Павлова. 2011. 61 (1): 94–101.
Alger B.E. Endocannabinoids and their implication for epilepsy. Epilepsy Curr., 2004. (4): 169–173.
Ancona N., Marinazzo D., Stramaglia S. Radial basis function approach to nonlinear Granger causality of time series. Phys. Rev. E, 2004. 70: 056221.
Barbarosie M., Avoli M. CA3-Driven Hippocampal-Entorhinal Loop Controls Rather than Sustains in Vitro Limbic Seizures. Journal of Neuroscience, 1997. 17 (23): 9308–9314.
Bertram E.H. The functional anatomy of spontaneous seizures in a rat model of chronic limbic epilepsy. Epilepsia, 1997, 38: 95–105.
Blumenfeld H., Varghese G.I., Purcaro M.J., Motelow J.E., Enev M., McNally K.A., Levin A.R. Hirsch L.J, Tikofsky R., Zubal I.G., Paige A.L., Spencer S.S. Cortical and subcortical networks in human secondarily generalized tonic–clonic seizures. Brain, 2009. 132 (4): 999–1012.
Borges K., Gearing M., McDermott D.L., Smith A.B., Almonte A.G., Wainer B.H., Dingledine R. Neuronal and glial pathological changes during epileptogenesis in the mouse pilocarpine model. Experimental Neurology, 2003. 182 (1): 21–34.
Browning R.A., Nelson D.K. Modification of electroshock and pentylenetetrazol seizure patterns in rats after precollicular transections. Experimental Neurology, 1986. 93 (3): 546–556.
Cadotte Alex J., DeMarse Thomas B., Mareci Thomas H., Parekh Mansi B., Talathi Sachin S., Hwang Dong-Uk, Ditto William L., Ding Mingzhou, Carney Paul R. Granger causality relationships between local field potentials in an animal model of temporal lobe epilepsy. Journal of Neuroscience Methods. 2010. 189: 121–129.
Cavalheiro E.A. The pilocarpine model of epilepsy. The Italian Journal of Neurological Sciences, 1995. 16 (1–2): 33–37.
Chen Y., Rangarajan G., Feng J., Ding M. Analyzing Multiple Nonlinear Time Series with Extended Granger Causality. Phys. Lett. A, 2004. 324 (1): 26–35.
Coenen A.M.L., van Luijtelaar E.L.J.M. Genetic animal models for absence epilepsy: a review of the WAG/Rij strain of rats. Behaviour Genetics 2003, 33: 635–655.
Curia G., Longo D., Biagini G., Jones R.S.G., Avoli M. The pilocarpine model of temporal lobe epilepsy. Journal of Neuroscience Methods, 2008. 172: 143–157.
Dinkelacker V., Valabregue R., Thivard L., Lehéricy S., Baulac M., Samson S., Dupont S. Hippocampal-thalamic wiring in medial temporal lobe epilepsy: Enhanced connectivity per hippocampal voxel. Epilepsia, 2015. 56: 1217–1226.
Englot D.J., Modi B., Mishra A.M., De Salvo M., Hyder F., Blumenfeld H. Cortical Deactivation Induced by Subcortical Network Dysfunction in Limbic Seizures. Journal of Neuroscience, 2009. 29 (41): 13006–13018.
Fernandez-Ruiz J., Gonzales S. Cannabinoid control of motor function at the basal ganglia. In: Handbook of Experimental Pharmacology: Cannabinoids, 2005. Springer, 479–507.
Gale K. Subcortical structures and pathways involved in convulsive seizure generation. J Clin. Neurophysiol., 1992. 9 (2): 264–277.
Gourevitch B., Le Bouquin-Jeannes R., Faucon G. Linear and nonlinear causality between signals: methods, examples and neurophysiological applications. Biological Cybernetics, 2006. 95: 349–369.
Granger C.W.J. Investigating Causal Relations by Econometric Models and Cross-Spectral Methods. Econometrica, 1969. 37 (3): 424–438.
Guye M., Régis J., Tamura M., Wendling F., McGonigal A., Chauvel P., Bartolomei F. The role of corticothalamic coupling in human temporal lobe epilepsy. Brain, 2006. 129 (7): 1917–1928.
Haneef Z., Lenartowicz A., Yeh H.J., Levin H.S., Engel J.Jr., Stern J.M. Functional connectivity of hippocampal networks in temporal lobe epilepsy. Epilepsia, 2014. 55 (1): 137–145.
He X., Doucet G.E., Sperling M., Sharan A., Tracy J.I. Reduced thalamocortical functional connectivity in temporal lobe epilepsy. Epilepsia, 2015. 56: 1571–1579.
Herkenham H., Lynn A.B., Little M.D., Johnson M.R., Melvin L.S., de Costa B.R., Rice K.C. Cannabinoid receptor localization in brain. Proceedings of the National Academy of Sciences, 1990. 87 (5): 1932–1936.
Hesse W., Möller E., Arnold M., Schack B. The use of time-variant EEG Granger causality for inspecting directed interdependencies of neural assemblies. Journal of Neuroscience Methods, 2003. 124: 27–44.
Kamiński M., Ding M., Truccolo W.A., Bressler S.L. Evaluating causal relations in neural systems: Granger causality, directed transfer function and statistical assessment of significance. Biological Cybernetics, 2001. 85 (2): 145–157.
Katona I., Freund T.F. Multiple functions of endocannabinoid signaling in the brain. Ann. Rev. Neurosci, 2012. 35: 529–558.
King D., Spenser S. Invasive electroencephalography in mesial temporal lobe epilepsy. J. Clin. Neurophysiol. 1995; 2: 32–45.
Kornilov M.V., Medvedeva T.M., Bezruchko B.P., Sysoev I.V. Choosing the optimal model parameters for Granger causality in application to time series with main timescale. Chaos, Solitons & Fractals, 2016. 82: 11–21.
Kugiumtzis D. State space reconstruction parameters in the analysis of chaotic time series–the role of the time window length. Physica D. 1996. 95 (1): 13–28.
Lehmann T., Gabriel S., Kovacs R., Eilers A., Kivi A., Schulze K., Lanksch W.R., Meencke H.J., Heinemann U. Alterations of Neuronal Connectivity in Area CA1 of Hippocampal Slices from Temporal Lobe Epilepsy Patients and from Pilocarpine Treated Epileptic Rats. Epilepsia, 2000. 41: S190–S194.
Lüttjohann A., van Luijtelaar G. The dynamics of cortico-thalamo-cortical interactions at the transition from pre-ictal to ictal LFPs in absence epilepsy; Neurobiology of Disease, 2012. 47:47–60.
Lutz B. On-demand activation of the endocannabinoid system in the control of neuronal excitability and epileptiform seizures. Biochemical Pharmacology, 2004. 68: 1691–1698.
Marinazzo D., Pellicoro M., Stramaglia S., Nonlinear parametric model for Granger causality of time series. Phys. Rev. E, 2006. 73: 066216.
Marinazzo D., Pellicoro M., Stramaglia S. Kernel-Granger causality and the analysis of dynamical networks. Phys. Rev. E, 2008. 77: 056215.
McCown T.J., Greenwood R.S., Breese G.R. Inferior Collicular Interactions with Limbic Seizure Activity. Epilepsia, 1987. 28 (3): 234–241.
Mello L.E.A.M., Cavalheiro E.A., Tan A.M., Kupfer W.R., Pretorius J.K., Babb T.L., Finch D.M. Circuit Mechanisms of Seizures in the Pilocarpine Model of Chronic Epilepsy: Cell Loss and Mossy Fiber Sprouting. Epilepsia, 1993. 34 (6): 985–995.
Monory K., Massa F., Egertová M., Eder M., Blaudzun H. et al. The Endocannabinoid System Controls Key Epileptogenic Circuits in the Hippocampus. Neuron, 2006. 51 (4): 455–466.
Norden A.D., Blumenfeld H. The role of subcortical structures in human epilepsy. Epilepsy and Behavior, 2002. 3 (3): 219–231.
Papadopoulou M., Cooray G., Rosch R., Moran R., Marinazzo D., Friston K. Dynamic causal modelling of seizure activity in a rat model. Neuroimage, 2017. 146: 518–532.
Schwarz G. Estimating the Dimension of a Model. The Annals of Statistics, 1978. 6 (2): 461–464.
Smirnov D.A. Quantifying causal couplings via dynamical effects: A unifying perspective. Phys. Rev. E, 2014. 90: 062921.
Smirnov D.A., Mokhov I.I. From Granger causality to long-term causality: Application to climatic data. Phys. Rev. E, 2009. 80: 016208.
Spenser S. S. Neural networks in human epilepsy: evidence of and implications for treatment. Epilepsia, 2002. 43: 219–227.
Shubina L., Aliev R., Kitchigina V. Endocannabinoid-dependent protection against kainic acid-inducedlong-term alteration of brain oscillations in guinea pigs. Brain Research, 2017. 1661: 1–14.
Suleymanova E.M., Shangaraeva V.A., van Rijn C.M., Vinogradova L.V. The cannabinoid receptor agonist WIN55.212 reduces consequences of status epilepticus in rats. Neuroscience, 2016. 334: 191–200.
Sysoev I.V., Sysoeva M.V. Detecting changes in coupling with Granger causality method from time series with fast transient processes. Physica D, 2015. 309: 9–19.
Sysoeva M.V., Sitnikova E., Sysoev I.V., Bezruchko B.P., van Luijtelaar G. Application of adaptive nonlinear Granger causality: Disclosing network changes before and after absence seizure onset in a genetic rat model. Journal of Neuroscience Methods, 2014. 226: 33–41.
Sysoeva M.V., Lüttjohann A., van Luijtelaar G., Sysoev I.V. Dynamics of directional coupling underlying spike-wave discharges. Neuroscience 2016. 314: 75–89.
van Mierlo P., Papadopoulou M., Carrette E., Boon P., Vandenberghe S., Vonck K., Marinazzo D. Functional brain connectivity from EEG in epilepsy: Seizure prediction and epileptogenic focus localization. Progress in Neurobiology, 2014. 121: 19–35.
van Rijn C.M., Perescis M.F.J., Vinogradova L., van Luijtelaar G. The endocannabinoid system protects against cryptogenic seizures. Pharmacological Reports, 2011. 63: 165–168.
Vinogradova L.V., Shatskova A.B., van Rijn C.M. Pro-epileptic effects of the endocannabionoid receptor antagonist SR141716 in a model of audiogenic epilepsy. Epilepsy Res, 2011. 96: 250–256.
Vinogradova L.V., van Rijn C.M. Long-term disease-modifying effect of the endocannabinoid agonist WIN55,212-2 in a rat model of audiogenic epilepsy. Pharmacological Reports, 2015. 67 (3): 501–503.
Wallace M.J., Blair R.E., Falenski K.W., Martin B.R., De Lorenzo R.J. The endogenous cannabinoid system regulates seizure frequency and duration in a model of temporal lobe epilepsy. J Pharmacol. Exp. Ther., 2003. 307: 129–137.
Дополнительные материалы отсутствуют.
Инструменты
Журнал высшей нервной деятельности им. И.П. Павлова


