Журнал высшей нервной деятельности им. И.П. Павлова, 2019, T. 69, № 6, стр. 657-679
РОЛЬ БАЗАЛЬНЫХ ГАНГЛИЕВ В ПЕРЕСТРОЙКАХ РЕЦЕПТИВНЫХ ПОЛЕЙ НЕЙРОНОВ ПЕРВИЧНОЙ СЛУХОВОЙ КОРЫ И В ВЫБОРЕ ДВИЖЕНИЯ ПРИ ОБУЧЕНИИ (ГИПОТЕТИЧЕСКИЙ МЕХАНИЗМ)
И. Г. Силькис *
Институт высшей нервной деятельности и нейрофизиологии РАН
Москва, Россия
* E-mail: isa-silkis@mail.ru
Поступила в редакцию 15.05.2018
После доработки 18.01.2019
Принята к публикации 11.02.2019
Аннотация
Предложен нейронный механизм обучения, в котором условным сигналом является чистый тон с частотой F. Механизм базируется на дофамин-зависимых длительных изменениях эффективности межнейронных связей в слуховых, лимбических и моторных цепях кора – базальные ганглии – таламус – кора. Эти изменения лежат в основе перестроек рецептивных полей нейронов первичной слуховой коры (А1) и выбора движения при обучении. Дофамин, выделившийся в ответ на тон с частотой F и на подкрепление, воздействуя на Д1 рецепторы на шипиковых клетках слуховой части дорзального стриатума, способствует индукции длительной потенциации эффективности входов к этим клеткам только от нейронов поля А1 с предпочтительной частотой настройки F или близкой к ней. В результате усиливается растормаживание со стороны базальных ганглиев нейронов вентральной части внутреннего коленчатого тела с предпочтительной частотой настройки F и дополнительно увеличивается активность тонотопически связанных с ними нейронов поля А1. Одновременно на остальных кортико-стриатных входах развивается длительная депрессия. Вследствие этого ингибируется активность тех тонотопически связанных нейронов таламуса и поля А1, чья предпочтительная частота настройки отличалась от F. Произвольное внимание облегчает обучение за счет дополнительного увеличения активности нейронов поля А1, чья предпочтительная частота настройки совпадает с частотой F. Эффект вызван как усилением активности префронтальной коры и ее взаимодействия с полем А1, так и выделением дофамина и растормаживанием нейронов таламуса со стороны лимбической части базальных ганглиев, включающей вентральный стриатум. Влияние эмоций на обучение реализуется благодаря конвергенции входов из миндалины и префронтальной коры на шипиковых клетках вентрального стриатума, что также способствует растормаживанию нейронов таламуса. Эти же структуры влияют на выбор движения в ответ на тон с частотой F вследствие спиральной организации нейронных цепей кора – базальные ганглии – таламус – кора, благодаря которой изменения активности в лимбических цепях приводят к изменениям сначала в слуховых цепях, а затем в моторной цепи. Предлагаемый механизм может лежать в основе выбора движения в задаче на различение тонов. Он может быть полезен при поиске способов лечения тонального тиннитуса и других видов нарушений слухового восприятия.
СПИСОК СОКРАЩЕНИЙ
А1 – первичная слуховая кора; БЛМ – базолатеральная миндалина; ВКТ – внутреннее коленчатое тело; ВКТв и ВКТм – вентральная и медиальная части внутреннего коленчатого тела; ВП – вентральный паллидум;
ВПП – вентральное поле покрышки; ДП – длительная потенциация; МДЯ – медиодорзальное ядро таламуса; НД – нижнее двухолмие; НДц – центральная часть нижнего двухолмия; ПЧН – предпочтительная частота настройки. ПЯ – прилежащее ядро; ПфК – префронтальная кора; РП – рецептивное поле; УС – условный сигнал; ЧВр и ЧВк – ретикулярная и компактная часть черного вещества соответственно.
ВВЕДЕНИЕ
Ранее сенсорным системам (в частности, слуховой) приписывали только роль анализаторов, но их не рассматривали как потенциальные структуры для запоминания информации в процессах обучения. Однако недавно получены данные в поддержку того, что в запоминание вовлекаются те же области мозга, которые участвуют в обработке слуховой информации [Huang et al., 2016]. Поведенчески значимые аспекты обработки звуковых стимулов в слуховой коре хорошо развиты, а результаты обработки отображаются в виде паттернов нейронной активности в коре [Ohl, Scheich, 2005]. Вызванные обучением пластические перестройки активности происходят как в высших областях слуховой коры, так и в первичном слуховом поле А1 [Polley et al., 2007]. В режиме реального времени выявлены изменения рецептивных полей (РП) нейронов поля А1 у хорьков, которых обучали реакции избегания. Эти изменения зависели от характера стимула и выполняемой задачи (включая детектирование чистого тона и различение двух тонов) [Fritz et al., 2007a]. Авторы указанной работы пришли к заключению, что функциональные особенности нейронов поля А1 позволяют им динамически адаптироваться к свойствам стимула при условно-рефлекторном классическом или инструментальном обучении. Особенности изменений активности нейронов слуховой коры и их РП при этих типах обучении описаны в работе [Weinberger, 2007a]. В частности, продемонстрировано увеличение ответов нейронов поля А1 только на ту частоту тона, которая подкреплялась, а также увеличение числа клеток, отвечавших на этот тон. Эти изменения рассматривают как расширение нейронного отображения подкрепляемого тона на тонотопической карте поля А1. Важно подчеркнуть, что специфические изменения РП в поле А1 происходили лишь при ассоциативном обучении, тогда как предъявление только условного сигнала (УС), используемого при классическом обусловливании в качестве положительного или отрицательного, не оказывало значительного влияния на синаптическую пластичность [Weinberger, 2007a]. Изменения были высокоспецифичными, избирательными, быстро приобретались, сохранялись в течение часов, дней и могли поддерживаться неопределенно долго, т.е. обладали всеми характеристиками ассоциативной памяти [Weinberger, 2007a]. С учетом результатов работ [Huang et al., 2016; Weinberger, 2007a] появляются основания предположить, что при обучении информация об УС – тоне определенной частоты, отображается, запоминается и хранится в измененных РП нейронов поля А1 в виде увеличения ответов на этот тон и вовлечения большего числа нейронов, отвечающих на этот тон.
Проведенный нами ранее анализ возможных механизмов обработки чистых тонов позволил указать на то, что в формировании РП нейронов нижнего двухолмия (НД), внутреннего коленчатого тела (ВКТ) и поля А1 участвуют также базальные ганглии (БГ), выходные ядра которых оказывают тормозное воздействие на нейроны ВКТ и НД [Силькис, 2015а]. В свою очередь активность выходных ядер БГ зависит от активности шипиковых клеток входных ядер БГ – дорзального стриатума и вентрального стриатума (прилежащего ядра, ПЯ), получающих возбуждение из коры. Согласно гипотетическому механизму участия БГ в обработке чистых тонов, в формировании РП нейронов поля А1, а также тонотопически связанных с ними нейронов вентральной части внутреннего коленчатого тела (ВКТв), участвуют дофамин-зависимые пластические перестройки активности в ассоциативной нейронной цепи кора – базальные ганглии – таламус – кора (К–БГ–Т–К), включающей поле А1, ВКТв и преимущественно “прямой” путь через БГ, а также центральную часть НД (НДц), нейроны которой проецируются в ВКТв. В предложенной нами модели в основе пластических перестроек РП нейронов поля А1 лежит модификация эффективности синаптической передачи между всеми элементами таламо-кортикального круга, между корой и стриатумом, а также между выходными ядрами БГ и их мишенями в подкорковых структурах и среднем мозге. Кроме того, в обработке чистых тонов параллельно участвует лимбическая нейронная сеть К–БГ–Т–К, включающая префронтальную кору (ПфК), ПЯ, вентральный паллидум (ВП) и медиодорзальное ядро таламуса (МДЯ) [Силькис, 2015 а; Силькис, 2015 б]. Такой механизм отличается от общепринятого, в котором в основе формирования РП нейронов слуховой коры и ВКТ лежат кортико-кортикальные связи [Suga, 2012], а также тонотопически организованный таламо-кортикальный путь [Liu et al., 2011].
В настоящей работе выдвигается гипотеза о том, что при выработке ассоциации чистого тона с подкреплением, в формировании нейронного паттерна в поле А1, отображающего подкрепляемый тон, и в выборе движения в ответ на этот УС существенную роль играют дофамин-зависимые пластические перестройки межнейронных связей в параллельных нейронных цепях К–БГ–Т–К: слуховой, включающей поле А1, ВКТв и дорзомедиальный стриатум; лимбической, включающей ПфК, миндалину и ПЯ; и моторной, включающей моторные области таламуса и коры, а также скорлупу стриатума. Важную роль в обучении должны играть эмоциональная значимость УС, выделение дофамина при подкреплении, а также внимание, влияние которого на сенсорную обработку определяется выделением дофамина. Задачей настоящей работы являлось обоснование этой гипотезы.
ВЫЗВАННЫЕ ОБУЧЕНИЕМ ИЗМЕНЕНИЯ РЕАКЦИЙ И РЕЦЕПТИВНЫХ ПОЛЕЙ НЕЙРОНОВ ПЕРВИЧНОЙ СЛУХОВОЙ КОРЫ (ОБЗОР ИЗВЕСТНЫХ ЭКСПЕРИМЕНТАЛЬНЫХ ДАННЫХ)
Характер изменений рецептивных полей и реакций нейронов поля А1 при обучении, в котором условным сигналом являлся чистый тон
К настоящему времени накоплен ряд свидетельств того, что при обусловливании, в котором в качестве УС используется чистый тон определенной частоты, предпочтительная частота настройки (ПЧН) части нейронов поля А1 сдвигается в сторону подкрепляемого тона. Эта ассоциативная, высокоспецифичная и быстро приобретаемая пластичность РП, которая наблюдалась как при классическом обучении, так и при инструментальном, является важной характеристикой памяти [Bakin et al., 1996]. В экспериментах, в которых крыс тренировали нажимать на педаль на подкрепляемый водой тон 5 кГц, было обнаружено усиление активности в той области поля А1, в которой отображался тон этой частоты, а также увеличение числа клеток, отвечающих на этот тон [Bieszczad, Weinberger, 2012]. При этом магнитуда усиления ответа была пропорциональна степени мотивационной значимости тона. В отсутствие подкрепления (при угашении) область активации коры уменьшалась, а выраженность подавления была пропорциональна степени угашения. Более того, у части животных область отображения тона стала даже меньше, чем до обучения [Bieszczad, Weinberger, 2012]. Авторы указанной работы пришли к заключению, что нейронное отображение стимула в поле А1 связано с его поведенческой значимостью. Обращает на себя внимание тот факт, что когда крыс обучали следить за тоном определенной частоты, наблюдалось усиление активности именно на этот тон, но не было изменений ответов на разную интенсивность тона [Polley, et al., 2006]. Когда крыс обучали следить за тоном определенной интенсивности, наблюдалось увеличение активности именно на эту интенсивность, но не было изменений тонотопической карты в поле А1. С учетом данных о том, что для нейронов поля AI характерны коротколатентные ответы с преобладанием монотонной зависимости от интенсивности тона [Polley et al., 2007], было выдвинуто предположение, что на пластичность РП влияют также процессы сверху-вниз, которые взаимодействуют с сенсорными процессами снизу-верх и выделением нейромодулятора при подкреплении [Polley et al., 2006]. Результаты указанной работы свидетельствуют о том, что процессы сверху-вниз могут способствовать избирательности, необходимой для модификации нейронного отображения определенного свойства стимула без того, чтобы влиять на отображение других свойств стимула, которые обрабатываются в этой же нейронной сети.
Реорганизация РП нейронов поля А1, проявляющаяся в изменении ответов на тоны определенной частоты, наблюдалась и при аверзивном обучении [Scheich et al., 1997]. В задачах на дискриминацию двух тонов примерно у половины нейронов наблюдалось значительное усиление активности на тон, сочетанный с аверзивным безусловным стимулом, по сравнению с тоном, который не сочетали [Whalen et al., 1994]. Связанная с обучением ассоциация отражалась в смещении РП нейронов в сторону подкрепляемого тона уже через 1 ч после обучения реакции избегания на один из двух разных тонов у всех животных, участвовавших в опыте [Bakin et al., 1996]. В поле А1 ответ на подкрепляемый УС (тон определенной частоты) усиливался не только у нейронов с ПЧН на этот тон, но и у нейронов с первоначально другой ПЧН [Weinberger, 2007]. Сочетание чистого тона с легким электрокожным раздражением лапы приводило к увеличению амплитуды первого компонента ответа в поле А1 с латентным периодом примерно 21 мс и второго компонента ответа с латентным периодом примерно 50 мс, причем латентный период этого компонента уменьшался [Leon et al., 2017]. Изменения активности в поле А1 при сочетании чистого тона с электрокожным раздражением наблюдались и в работе [Ohl, Scheich, 1996], в которой длительная, сохраняющаяся реорганизация активности и усиление первых компонентов ответов на сочетаемый тон (с латентным периодом десятки мс) имели место, только если тон сочетали с безусловным стимулом. То, что изменение активности в поле А1 при обучении является специфичным, а не генерализованным эффектом, показано в работе [Wigestrand et al., 2016].
Обращают на себя внимание данные о том, что увеличение нейронной активности в слуховой коре обезьян, связанное с получением подкрепления при правильном ответе, не зависело от величины самого подкрепления, но если при неправильном ответе подкрепление не подавалось, активность нейронов коры уменьшалась [Brosch et al., 2011]. Пластические перестройки в слуховой коре при обучении наблюдались только у тех участников экспериментов, которые научились различать тоны определенной частоты [Puschmann et al., 2013]. У тех испытуемых, которые не обучились, не наблюдалось различий в активности нейронов в ответ на тон, связанный с подкреплением, или на тон, за которым не следовало подкрепление.
Участие базальных ганглиев и дофамин-зависимой пластичности в изменениях рецептивных полей и реакций нейронов поля А1 при обучении, в котором условным сигналом являлся чистый тон
Участие БГ в обучении исследуется в течение длительного времени [Суворов, Шуваев, 2002]. Показано, в частности, что в обучении, связанном с дискриминацией звуковых стимулов, участвуют проекции из слуховой коры в слуховую часть стриатума [Xiong et al., 2015]. Важно отметить, что это обучение приводило к потенциации кортикальных входов только к тем нейронам стриатума, которые реагируют на условный подкрепляемый тон (низкой или высокой частоты). Кортико-стриатные входы в слуховых областях стриатума не модифицировались, если обучение проводилось с использованием зрительных стимулов. Из результатов работы [Xiong et al., 2015] следует, что при обучении изменения происходят только в тех цепях К–БГ–Т–К, которые включают области сенсорной модальности, участвующей в обучении. Важно отметить, что у обучившихся испытуемых изменения реакций на тоны наблюдались не только в коре, но и в ПЯ [Puschmann et al., 2013].
Предполагают, что дофаминергический вход из вентрального поля покрышки (ВПП) может вносить значительный вклад в реорганизацию РП и в те изменения активности нейронов в поле А1, которые имеют место при ассоциативном обучении [Brosch et al., 2011; Thiel, 2007]. С выделением дофамина при получении подкрепления связывают усиление нейронной активности в первичных сенсорных областях коры [Pleger et al., 2008]. Наличием дофаминергического входа в слуховую кору объясняют улучшение дискриминации тонов разной частоты во время приобретения навыка и непосредственно после него [Schicknick et al., 2012]. Изменение реакций на тон нейронов в поле А1 при аверзивном обучении также связывают с изменением концентрации дофамина в этом поле [Scheich et al., 1997]. Роль дофамина в изменениях активности в коре при обучении продемонстрирована в экспериментах, в которых искусственно увеличивали концентрацию дофамина или активность дофаминергических клеток. Например, увеличение концентрации дофамина с помощью L-DOPA могло усиливать как реакции нейронов в сенсорных областях, так и поведенческие эффекты [Pleger et al., 2009]. Электрическая стимуляция дофаминергических клеток в ВПП и компактной части черного вещества (ЧВк) способствовала коротколатентной (примерно 35 мс) фазической активации нейронов во всех слоях слуховой коры, причем эта активация была сходна с той, которая наблюдалась в ПфК [Mylius et al., 2015]. Модификация активности в слуховой коре приматов, вызванная электрической стимуляцией дофаминергических клеток в ВПП, могла длиться в течение нескольких секунд [Huang et al., 2016]. Важно отметить, что сочетание стимуляции ВПП с чистым тоном определенной частоты приводило к увеличению активности в той области поля А1, в которой нейроны реагировали на эту частоту [Bao et al., 2001]. При этом не только повышалась избирательность нейронов к сочетаемому тону, но и подавлялись ответы на тоны другой частоты. На вклад в обучение дофаминергического входа из ЧВк указывает тот факт, что при гибели части клеток ЧВк дискриминация звуков ухудшалась [Kudoh, Shibuki, 2006]. При решении задачи на дискриминацию чистых тонов разной частоты ответы дофаминергических клеток в ЧВк менялись [McGovern et al., 2015]. Известно, что дофаминергические клетки находятся под контролем тормозных нейронов черного вещества, которые отвечают на значимые звуковые стимулы пачечными разрядами, а их ответы возникают раньше фазических разрядов дофаминергических клеток [Pan et al., 2013]. При угашении рефлекса активность тормозных клеток увеличивалась, тогда как активность дофаминергических клеток снижалась. Результаты работы [Pan et al., 2013] указывают на уменьшение выделения дофамина в коре и стриатуме при угашении.
Предположено, что усиление ответов нейронов поля А1 на тоны той частоты, при предъявлении которой в ответ на подкрепление выделяется дофамин, связано с улучшением условий для индукции ДП возбудительных кортико-кортикальных и таламо-кортикальных входов [Bao et al., 2001]. Из предложенных нами унифицированных правил модификации и модуляции [Силькис, 2002] следует, что индукции ДП возбудительных входов к постсинаптическим нейронам и увеличению их активности должна способствовать активация НМДА-рецепторов и дофаминовых Д1/Д5 рецепторов. Действительно показано, что обучение дискриминации тонов связано с активацией НМДА- и Д1-рецепторов в слуховой коре [Schicknick, Tischmeyer, 2006; Schicknick et al., 2012]. Наоборот, антагонист Д1 рецепторов мог обратимо подавлять на несколько десятков минут ответы нейронов слуховой коры [Mylius et al., 2015]. Кроме того, введение антагониста Д1/Д5 рецепторов в слуховую кору после обучения приводило к дозозависимому нарушению выполнения задачи, тогда как агонист Д1/Д5 рецепторов способствовал восстановлению навыка после повторного обучения [Schicknick et al., 2012]. Консолидации памяти препятствовало введение антагонистов НМДА рецепторов непосредственно в стриатум после обучения реакции избегания в ответ на УС, сопровождаемым слабым ударом тока в лапу [Kishioka et al., 2013]. На участие стриатума в обучении указывает и тот факт, что повреждение нейронов этой структуры у взрослых животных сильно ухудшало появление реакции страха на чистый тон [Kishioka et al., 2009]. Приведенные данные свидетельствуют о том, что за счет облегчения условий для индукции ДП в стриатуме и коре дофамин может влиять на улучшение отображения чистых тонов в поле А1 и обеспечивать формирование ассоциаций. Примечательно, что дофамин может влиять на обработку чистых тонов уже на ее ранних стадиях, поскольку на нейронах НД также имеются дофаминовые рецепторы и поскольку НД получает модулирующую дофаминергическую иннервацию из субпарафасцикулярного ядра таламуса, являющегося частью группы дофаминергических клеток А11 [Nevue et al., 2016].
Нейронная активность в слуховой коре усиливалась, если испытуемый получал ожидаемое подкрепление, а также, если правильным оказывалось ожидание, что подкрепления не будет [Weis et al., 2013]. Следует отметить, однако, что дофамин модулирует активность нейронов в слуховой коре как в ответах на стимулы, за которыми следует подкрепление, так и в ответах на стимулы, которые не подкрепляются [Weis et al. 2012]. Кроме того, дофаминергические клетки в ВПП реагируют не только на сочетанные, но и на несочетанные сенсорные стимулы. Дофамин может выделяться нейронами ВПП в ответ на новые стимулы и неожиданное подкрепление [Bao et al., 2001], а также как на положительное подкрепление, так и в ответ на аверзивные стимулы [Brischoux et al., 2009; Bromberg-Martin et.al., 2010].
Вклад эмоций, внимания и активности в префронтальной коре в изменения рецептивных полей и реакций нейронов поля А1 при обучении, в котором условным сигналом являлся чистый тон
Показано, что одна только реорганизация активности нейронов в поле А1, вызванная микростимуляцией этого поля, не приводит к изменению поведенческой реакции, связанной с дискриминацией тонов или их распознаванием [Talwar, Gerstein, 2001]. Авторы указанной работы выдвинули предположение, что для изменения поведения, кроме подкрепления и увеличения отображения сигнала в поле А1, необходимы изменения активности в ПфК и в моторной коре. Имеются и экспериментальные свидетельства важной роли ПфК в рабочей памяти и целенаправленном поведении обезьян в ответ на звуковой сигнал [Huang, Brosch, 2016]. Полагают, что входы сверху-вниз из ПфК в сенсорные области коры способствуют выбору значимых стимулов и подавлению стимулов, отвлекающих от выполнения задачи [Barbas et al., 2011]. Хотя изменения РП нейронов в поле А1 направлены на максимально хорошее различение стимулов независимо от характера требуемой реакции, они зависят от задачи [David et al., 2002]. Например, усиливались ответы на стимулы, которые сигнализировали об аверзивном воздействии. На основании этих данных было сделано заключение, что контроль сверху-вниз влияет на сенсорную обработку и в дополнение к дискриминации стимула связан с характером подкрепления. Участие ПфК в пластичности РП при обучении также зависит от выделения дофамина в этой области коры. С помощью оптогенетической стимуляции дофаминергических клеток ВПП показано, что повторяющееся сочетание УС и выделения дофамина в медиальной ПфК (мПфК) ускоряют обучение задаче на дискриминацию этого стимула от несочетанного [Popescu et al., 2016]. Однако если выделение дофамина в медиальной ПфК не сочетали ни с подкрепляющим, ни с аверзивным сигналом, то оно не влияло на выработанное ранее обучение. С помощью экстраклеточной регистрации показано, что сочетание УС с повышением концентрации дофамина увеличивает срабатывание нейронов мПфК на УС, а введение антагонистов дофаминовых рецепторов ухудшает дискриминацию [Popescu et al., 2016]. По мнению авторов указанной работы, выделение дофамина во время обучения способствует настройке нейронов мПфК на распознавание поведенчески значимых событий. В ПфК также выявлена хоть и слабая, но значимая корреляция между реакцией на звуковой стимул и его эмоциональной (приятной или неприятной) значимостью [Hori et al., 2017].
Известно, что эмоциональная значимость модулирует активность чувствительных к голосу нейронов в первичных и высших областях слуховой коры [Pannese et al., 2015]. Показано, что в обработке звуковых стимулов, когда это важно для дискриминации связанных с ними эмоций, участвует миндалина [Pannese, et al., 2016]. При этом нейроны миндалины чувствительны к частоте основного тона и уровню голоса, когда требуется различить такие эмоции, как страх и гнев. Высота основного тона – мгновенно узнаваемое свойство голоса, которое воспринимается нейронами миндалины. Примечательно, что в обработке слуховой и зрительной информации участвуют топологически разделенные группы нейронов миндалины, реагирующие на стимулы разной модальности [Montes-Lourido et al., 2015]. Так, в задней части базолатеральной миндалины (БЛМ) 4.4% нейронов отвечали только на слуховые стимулы, а в передней части – 6.8% нейронов отвечали только на зрительные стимулы [Nishijo et al., 1988]. Эти данные позволяют предположить, что при обучении выполнению задач, в которых УС являются разномодальные стимулы, пластические перестройки происходят в разных нейронных цепях. После эмоционального возбуждения связанные с обучением изменения, происходящие в слуховой коре, являются специфическими, ассоциативными и долго длящимися [Grosso et al., 2015]. На основании имевшихся данных авторы указанной работы пришли к заключению, что уже на ранних стадиях связанного с эмоциями обучения важную роль играют связи слуховой коры с миндалиной, а также с ПЯ. Показано, что при обучении задаче на избегание условный сигнал сильнее всего активирует центральную правую часть миндалины [Kiyokawa et al., 2016]. В выработке реакции страха на УС, представляющий собой чистый тон, участвует и латеральная часть миндалины, причем при обучении наблюдалась ДП в возбудительном пути от этого УС к нейронам миндалины, тогда как искусственно (оптогенетически) вызванная депотенциация в этом пути подавляла выработку реакции страха на УС [Kim, Cho, 2017]. Отмечено, что ДП наблюдалась только в пути к миндалине от звука, сочетанного с аверзивным стимулом, тогда как в пути от дискриминируемого тона другой частоты ДП не индуцировалась. Инактивация миндалины до обучения также нарушала реакцию страха на тон определенной частоты, который сочетали с электрическим раздражением [Guimarãis et al., 2011]. При угашении активность убывала не только в поле А1, но и в миндалине [Apergis-Schoute et al., 2014].
Современные исследования указывают на роль внимания в пластических перестройках РП нейронов слуховой коры при обучении. Так, в экспериментах, в которых внимание животных (хорьков) было направлено на выделение одного тона или на различение двух тонов, наблюдали изменения формы РП нейронов поля А1, позволявшие усилить значимую акустическую цель и одновременно отфильтровать шум [Fritz et al., 2007b]. Предполагают, что внимание играет ключевую роль в запуске каскада процессов, ведущих к динамическим изменениям РП, и что во влиянии внимания на очерчивание РП участвуют взаимодействующие процессы сверху-вниз и снизу-вверх [Fritz et al., 2007a]. В опытах, в которых испытуемые должны были запоминать низкий либо высокий тон, показано, что активность в слуховой коре увеличивается только в том случае, когда испытуемых предварительно инструктировали запоминать только один тон, на который направлялось внимание [Kumar et al., 2016]. В произвольной направленности внимания к слуховым сигналам участвует ростральная латеральная ПфК [Mayer et al., 2017; Voisin et al., 2006]. Современные данные указывают на участие различных механизмов в выделении стимулов, на которые направлено внимание, с целью связать их с двигательной системой [David et al., 2012].
ГИПОТЕТИЧЕСКИЙ МЕХАНИЗМ ИЗМЕНЕНИЙ РЕЦЕПТИВНЫХ ПОЛЕЙ НЕЙРОНОВ ПОЛЯ А1 ПРИ ОБУЧЕНИИ
При анализе возможных механизмов участия БГ, а также влияния внимания и эмоций на пластические перестройки РП нейронов поля А1 при обучении, нами были приняты во внимание приведенные выше данные о том, что для обучения, в котором УС является чистый тон, необходимо внимание, а также что в обучении участвуют ПфК и миндалина. Предъявление УС, наличие внимания к нему и подкрепления приводят к выделению дофамина. Естественно предположить, что связанные с обучением пластические перестройки РП нейронов поля А1 и ВКТв происходят в тех нейронных цепях, которые участвуют в формировании РП, и что эти перестройки проявляются в виде дофамин-зависимых длительных изменений эффективности связей между нейронами. Воздействие разных факторов на перестройки РП в поле А1 должно зависеть от входов в это поле из разных структур, причем необходимо учитывать влияния как снизу-вверх, так и сверху-вниз. Влияние эмоций осуществляется благодаря входам из латеральной миндалины [Budinger et al., 2008]. Информация о звуках поступает в поле А1 снизу-вверх через НДц и ВКТв; влияние сверху-вниз реализуется через входы в поле А1 из ПфК [Francis et al., 2018]. В свою очередь нейроны поля А1 проецируются в ВКТв, стриатум, латеральную и базолатеральную части миндалины. Дофаминергическая иннервация поступает из ВПП и ЧВк. Коротколатентные реакции дофаминергических клеток на звуковые стимулы могут быть вызваны благодаря наличию афферентов в вентролатеральную часть ВПП (ВППл) (дофаминергическую структуру, участвующую в аудио-моторном поведении) из внешней части НД, дорзального и вентрального кохлеарных ядер, а также из глубоких слоев верхнего двухолмия [Herbert et al., 1997] (рис. 1). Именно в эти слои верхнего двухолмия поступают сигналы от структур, участвующих в обработке звуков [Ghose et al., 2014]. Кроме того, дофаминергические клетки ЧВк и ВПП получают возбуждение из ПфК, субталамического ядра и педункулопонтийного ядра (рис. 1). Нейроны НД, верхнего двухолмия и педункулопонтийного ядра находятся под тормозным контролем со стороны нейронов выходных ядер БГ – ретикулярной части черного вещества (ЧВр) и вентрального паллидума (ВП) (рис. 1). Условный сигнал, приводящий к активации стрионигральных нейронов и последующему растормаживанию по прямому пути через стриатум и ЧВр клеток в педункулопонтийном и субталамичском ядрах, может способствовать увеличению спайковой активности дофаминергических клеток. В коротколатентных ответах дофаминергических клеток на сенсорные стимулы вероятность пачечных разрядов в 5 раз больше, чем в фоне, поэтому выделение дофамина в соответствующих сенсорных областях намного больше, чем было бы при такой же частоте регулярных разрядов [Horvitz et al., 1997]. Поэтому вызванное УС существенное повышение концентрации дофамина создает благоприятные условия для модификации эффективности межнейронных связей.
Рис. 1.
Схема организации связей в слуховой и лимбической цепях кора – базальные ганглии – таламус – кора. А1 – первичная слуховая кора; ПфК – префронтальная кора; ВКТв – вентральная часть внутреннего коленчатого тела; МДЯ – медиодорзальное ядро таламуса; РЯ – ретикулярное ядро таламуса; НДц – центральная часть нижнего двухолмия; ВД – верхнее двухолмие; ЧВр и ЧВк – ретикулярная и компактная части черного вещества соответственно; ВПП – вентральное поле покрышки; ВП – вентральный паллидум; СТЯ – субталамическое ядро; ППЯ – педункулопонтийное ядро; С-Н и С-П – стрионигральные и стриопаллидарные шипиковые нейроны соответственно; ДА – дофамин; большие светлые и темные кружки – возбудительные и тормозные проекционные нейроны соответственно; маленькие светлые, темные и заштрихованные кружки – возбудительные, тормозные и холинергические входы соответственно; маленькие светлые треугольники и квадраты – потенциированные и депрессированные возбудительные синапсы соответственно; утолщенные и тонкие линии – сильные и слабые связи соответственно. Штрихпунктирные стрелки – дофаминергические входы; двойная стрелка – сигнал, вызванный чистым тоном.
Fig. 1. A scheme of organization of connections in auditory and limbic circuits neocortex – basal ganglia – thalamus – neocortex. А1 – primary auditory cortex; ПфК – prefrontal cortex; ВКТв – ventral part of the medial geniculate body; МДЯ – mediodorsal thalamic nucleus; РЯ – reticular thalamic nucleus; НДц – a central part of inferior colliculus; ВД – superior colliculus; ЧВр and ЧВк – substantia nigra pars reticulate and compacta, respectively; ВПП – ventral tegmental area; ВП – ventral pallidum; СТЯ – subthalamic nycleus; ППЯ – pedunculopontine nucleus; С-Н and С-П – striatonigral and striatopallidal spiny cells, respectively; ДА – dopamine; big light and dark circuits – excitatory and inhibitory projection neurons, respectively; small light, dark and shaded circuits – excitatory, inhibitory and cholinergic inputs, respectively; small light triangles and squares – potentiated and depressed excitatory synapses, respectively; thick and thin lines – strong and weak connections, respectively; dash-dotted arrows – dopaminergic inputs; a double arrow – arriving signal evoked by pure tone.
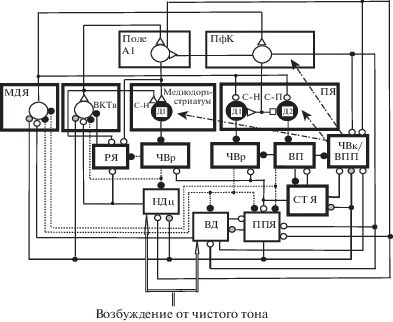
При анализе участия БГ в обучении следует иметь в виду, что в этой структуре имеются специфические параллельные каналы обработки. Например, нейроны из слуховой части стриатума проецируются в более вентральные слои ЧВр, а части стриатума, связанные с ПфК и цингулярной извилиной, проецируются в вентромедиальные слои ЧВр [Deniau et al., 1996]. Нейроны сердцевины ПЯ влияют на таламические ядра средней линии – медиодорзальное ядро (МДЯ) и вентромедиальное ядро – преимущественно через дорзомедиальную часть ЧВр, тогда как нейроны раковины ПЯ влияют на МДЯ и ретикулярное ядро таламуса преимущественно через ВП [Groenewegen et al., 1999b] (рис. 1). Полагают, что содержащее ГАМКергические нейроны ретикулярное ядро таламуса является важным компонентом петли, опосредующей обработку сенсорной информации, и представляет собой тормозный интерфейс или “затвор внимания”, регулирующий поток информации из таламуса в кору [McAlonan, Brown, 2002]. Следует отметить, что входы из ретикулярного ядра таламуса в ВКТ организованы тонотопически [Cotillon-Williams et al., 2008], как и проекции в ретикулярное ядро таламуса из ВКТв и поля А1 [Budinger et al., 2013; Kimura et al., 2007]. Нейроны ПЯ, которые иннервируют ЧВр, располагаются в ограниченном локусе сердцевины ПЯ, причем в этой области на большей части нейронов (61%) конвергируют афференты из ограниченных частей ПфК – прелимбической/медиальной орбитальной и дорзальной агранулярной инсулярной [Montaron et al., 1996]. Проецирующиеся в ВП нейроны ПЯ, которые получают иннервацию из таламических ядер средней линии и БЛМ, т.е. участвуют во влиянии эмоций и мотивации на обработку сигналов и поведение, не имеют входов из мПфК [Papp et al., 2012]. Для входов из ПЯ в ВП также характерна топическая организация. Так, медиальная часть раковины ПЯ проецируется в вентромедиальную часть ВП, а латеральная часть раковины ПЯ – в вентролатеральную часть ВП [Groenewegen, 1999a]. Топическая организация характерна и для проекций в ПЯ из ПфК и таламических ядер [Brog et al., 1993; Groenewegen et al., 1999a]. Важно подчеркнуть, что таламические клетки иннервируют те же области стриатума, что и нейроны ПфК, на которые проецируются эти таламические клетки. Например, прелимбическая ПфК, которая проецируется в медиальную часть ПЯ, получает входы из паравентрикулярного таламического ядра и парвоцеллюлярной части БЛМ, нейроны которых также проецируются в медиальную часть ПЯ [Wright, Groenewegen, 1996]. Приведенные данные свидетельствуют о том, что обработка информации происходит в замкнутых цепях К–БГ–Т–К. Проекции в другие структуры дофаминергических нейронов из двух ядер ВПП – парабрахиального пигментного и пранигрального – тоже организованы определенным образом. Нейроны задней медиальной части ВПП, включающей пранигральное ядро и медиальную часть парабрахиального ядра, избирательно проецируются в раковину и сердцевину медиальной части ПЯ, в мПфК и БЛМ, а дофаминергические клетки из задней латеральной части ВПП, включающей латеральную часть парабрахиального ядра, проецируются в латеральную часть раковины ПЯ [Lammel et al., 2014]. Если дофаминергические клетки в ЧВк примерно однородны по свойствам, то субпопуляции дофаминергических клеток в других структурах имеют различные анатомические и электрофизиологические свойства. Это позволило предположить, что они могут быть вовлечены в разные поведенческие реакции, вызванные специфическими внешними стимулами [Bromberg-Martin et al., 2010].
Возможный механизм участия дофамин-зависимых изменений эффективности межнейронных связей в цепях кора – базальные ганглии – таламус – кора в пластических перестройках рецептивных полей нейронов поля А1 при обучении
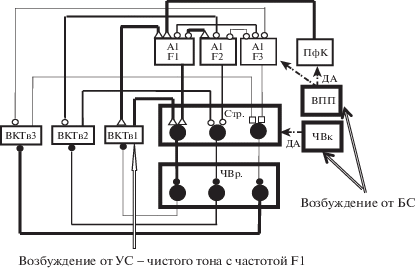
Составной частью механизма модификации РП нейронов поля А1 при обучении является механизм формирования РП при обработке чистых тонов в нейронной цепи А1–БГ–ВКТв–А1. Согласно предложенному нами ранее механизму формировании этих РП [Силькис, 2015а], дофамин, выделяющийся в стриатуме в ответ на УС – чистый тон определенной частоты или на подкрепление, воздействует на Д1 рецепторы на стрионигральных нейронах, дающих начало прямому пути через БГ. Это способствует индукции ДП эффективности “сильных” кортико-стриатных входов и одновременной длительной депрессией “слабых” кортико-стриатных входов (рис. 2). “Сильными” являются входы в стриатум от тех нейронов поля А1, ПЧН которых совпадала или была близка частоте подкрепляемого тона (выбрана частота F1), поскольку эти нейроны первоначально сильно активируются стимулом, и поэтому поступающее от них возбуждение позволяет открыть НМДА-каналы на шипиковых клетках. “Слабыми” являются входы от тех нейронов, чья ПЧН (F3) отличалась от частоты этого УС, поэтому их активность в ответ на этот стимул первоначально мала, так что поступающее от них возбуждение не позволяет открыть НМДА-каналы на шипиковых клетках. Последующая реорганизация активности нейронов в цепях А1–БГ–ВКТв–А1 должна приводить к растормаживанию со стороны ЧВр активности нейронов ВКТв, имеющих ПЧН, близкую частоте подкрепляемого тона, контрастному усилению нейронного отображения чистого тона этой частоты в ВКТв и в тонотопически связанном с ним локусе в поле А1. Это выразится в сужении РП отдельных нейронов в поле А1 и ВКТв [Силькис, 2015а]. Одновременно будет усиливаться ингибирование со стороны ЧВр активности нейронов ВКТв, имеющих ПЧН (F3). В локусе поля А1, расположенном близко к локусу с “сильно” активированными клетками, первоначальная ПЧН, равная F2, может сместиться в сторону частоты F1, в частности, за счет усиления кортико-кортикального взаимодействия между соседними клетками (рис. 2). Как указано в предыдущей главе, именно такие изменения РП наблюдались у нейронов поля А1 при обучении, в котором УС имел частоту F1.
Рис. 2.
Схема тонотопической организации нейронных цепей А1 – базальные ганглии – ВКТв – А1, участвующих в обработке чистых тонов разной частоты. 1, 2, 3 – локусы ВКТв, в которых нейроны характеризуются предпочтительной частотой настройки F1, F2 и F3 соответственно. БС – безусловный стимул. Остальные обозначения как на рис. 1.
Fig. 2. A scheme of tonotopic organization of neuronal loops A1– basal ganglia – MGBv– А1 that participate in processing of pure tones with different frequencies. 1, 2, 3 – loci of the MGBv which neurons are initially characterized by preferred frequency to tones F1, F2 and F3 respectively. БС – unconditioned stimulus. Other designations are the same as in the Fig. 1.
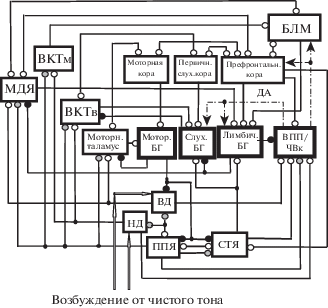
Поскольку ГАМКергические нейроны латеральной части ЧВ проецируется и в НДц [Yasui et al., 1991], из предлагаемой модели следует, что растормаживающее действие со стороны БГ на нейроны НДц может способствовать усилению активности нейронов на более низком уровне обработки. Обращает на себя внимание тот факт, что классическое аверзивное обучение на чистый тон сохраняется при повреждении слуховой коры, но не при повреждении ВКТ или НД [LeDoux et al., 1986]. Участие ВКТ в оборонительном обучении, в котором УС являлся чистый тон, показано в работе [Weinberger, 2011]. Необходимость вовлечения ВКТ в обучение связывают с тем, что это таламическое ядро возбуждающе действует на стриатум и на миндалину [LeDoux et al., 1986] (см. рис. 3). С точки зрения предлагаемой нами модели, результаты работы [LeDoux et al., 1986] указывают на то, что для аверзивного обучения задаче, в которой УС является чистый тон, достаточно обеспечить пластические перестройки в цепи ВКТв–БГ–ВКТв и последующую модификацию РП нейронов ВКТв. Мы полагаем, что необходимость вовлечения НД в аверзивное обучение на чистый тон может быть связана с участием этой структуры не только в интеграции слуховой информации, но и в модуляции активности сенсомоторной цепи [Tostes et al, 2013], участвующей в выборе и осуществлении движения.
Рис. 3.
Схема функциональной организации лимбической, слуховой и моторной цепей кора – базальные ганглии – таламус – кора. ВКТм – медиальная часть внутреннего коленчатого тела; БЛМ – базолатеральная миндалина. Остальные обозначения как на рис. 1 и 2.
Fig. 3. A scheme of functional organization of limbic, auditory and motor circuits cortex – basal ganglia – thalamus – cortex. ВКТм – medial part of the medial geniculate body; БЛМ – basolateral amygdala. Other designations are the same as in Fig. 1 and 2.
Важно отметить, что обработка чистых тонов осуществляется в цепи А1–БГ–ВКТв–А1, включающей медиодорзальную часть стриатума, в которую проецируются нейроны ВКТв и поля А1 [Gangarossa et al., 2013] (рис. 1). Именно эта часть стриатума участвует в формировании ассоциации “действие – следующий из него результат” [Balleine et al., 2009; Li et al., 2016]. Известно, что нейроны фронтальной части поля А1, которые предпочтительно отвечают на тоны высокой частоты, проецируются в слуховую часть стриатума более латерально, а нейроны каудальной части поля А1, предпочтительно реагирующие на низкочастотные тоны, проецируются в более медиальную часть стриатума [Xiong et al., 2015]. Можно полагать, что благодаря такой топической организации кортико-стриатных проекций (рис. 2), обучение приведет к различным изменениям реакций нейронов в разных локусах поля А1 и стриатума. Действительно, у крыс, обученных ассоциировать тоны низких частот с выбором подкрепления в правом поле, кортико-стриатный вход был сильнее в медиальной части стриатума, т.е. в той части, где нейроны предпочтительно отвечают на низкочастотные тоны, тогда как в латеральной части стриатума ответы нейронов даже уменьшались [Xiong et al., 2015]. Кроме того, у животных, обученных брать подкрепление в правом поле, потенциировались кортико-стриатные входы, образованные нейронами левых частей слуховой коры и стриатума, тогда как у животных, обученных ассоциировать низкочастотные тоны с выбором подкрепления в левом поле, наблюдалось обратное соотношение [Xiong et al., 2015]. У необученных крыс вообще не наблюдалось различий в эффективности входов из коры к нейронам стриатума, расположенным в разных частях тонотопической оси.
Возможные механизмы участия внимания, кортико-кортикальных связей и таламо-кортикального круга в пластических перестройках рецептивных полей нейронов поля А1 при обучении
Представление о том, что кортико-кортикальные возбудительные связи важны для обучения, в котором УС является тон определенной частоты, является общепринятым. Участием этих связей были объяснены данные о том, что в результате обучения изменяются ответы нейронов не только в той области поля А1, в которой располагались нейроны с ПЧН, совпадающей с частотой подкреплявшегося УС, но и нейронов, расположенных в соседней области коры, чья ПЧН отличалась от частоты УС на 5 кГц, а также у нейронов в отдаленной области поля А1. Однако у нейронов, у которых ПЧН отличалась от частоты УС на 15 кГц, ответы не изменялись [Guo et al., 2013]. С точки зрения нашей модели для специфических связанных с обучением изменений РП нейронов поля А1 недостаточно участия только кортико-кортикальных взаимодействий вследствие их большой конвергенции и дивергенции. Необходимо также изменение эффективности тонотопических связей коры с таламусом и с БГ. Поскольку при предъявлении УС – чистого тона с частотой F1 должна увеличиться активность нейронов поля А1 и ВКТв, имеющих ПЧН F1, можно полагать, что в таламо-кортикальной сети произойдут изменения, сходные с теми, которые были вызваны в наших экспериментах искусственно с помощью микростимуляции группы нейронов поля А1 с ПЧН F1. В результате наблюдали смещение в сторону частоты F1 ПЧН нейронов в соседнем локусе поля А1 и в тонотопически связанном с ним локусе ВКТв, которые первоначально характеризовались ПЧН F2 [Силькис, Рапопорт, 1994]. Аналогичный эффект наблюдался в работе [Tang et al., 2012], в которой локальная стимуляция нейронов поля А1 вызывала тоно-специфические пластические изменения частотной настройки нейронов ВКТв. Электрическая стимуляция нейронов ВКТв, характеризующихся узкой частотной настройкой, также вызывала сдвиг ПЧН нейронов поля А1 в сторону той ПЧН, которая была характерна для нейронов стимулируемого локуса ВКТв [Ma, Suga, 2009; Tang et al., 2012]. Имеются данные о том, что стимуляция слуховой коры приводит к пластическим перестройкам ответов нейронов и в НДц, т.е. на более ранней стадии обработки чистых тонов [Ma, Suga, 2009; Zhang et al., 2005]. Одновременно с изменениями РП нейронов поля А1 и ВКТв нами была выявлена и модификация (потенциация и депрессия) моносинаптических связей между всеми элементами таламо-кортикального круга [Силькис, 1994а; Силькис, 1994б], т.е. установлено, что в пластических перестройках РП участвуют изменения эффективности связей в цепи К–ВКТ–К. С точки зрения предлагаемого в настоящей работе механизма, в этих экспериментах in vivo при стимуляции коры имели место также изменения эффективности связей между корой и ВКТ, между корой и БГ, а также между БГ и ВКТ, так что они тоже могли вносить вклад в перестройки РП.
Известно, что для обучения необходимо произвольное внимание. Нами было предположено, что произвольное внимание является частью сенсорной обработки и запускается активацией ПфК [Силькис, 2015 б]. Влияние ПфК на РП нейронов в поле А1 может быть достаточно эффективным, поскольку аксоны нейронов ПфК оканчиваются в слоях 2/3 поля А1 [Francis et al., 2018]. Оптогенетическая стимуляция орбитофронтальной области ПфК приводила к коротколатентному возбуждению нейронов поля А1, а сочетанная стимуляция орбитофронтальной коры со звуком приводила к улучшению как отображения этого звука в поле А1, так и дискриминации звуков [Winkowski et al., 2013; Winkowski et al., 2018]. Эти данные согласуются с предполагаемой ролью орбитофронтальной коры в модуляции РП нейронов поля А1 с целью улучшения сенсорной обработки и регулирования поведенческой значимости сенсорных входов.
Поскольку внимание обычно направляется на подкрепляемый УС, например, на чистый тон частоты F1, можно полагать, что в результате дополнительного возбуждения со стороны ПфК больше всего увеличится активность тех нейронов поля А1, чья ПЧН совпадала с частотой F1 и чья реактивность первоначально была высокой (рис. 2). Эффект связан с выполнением правила Хебба (совпадения активности пре- и постсинаптической клеток) и индукцией ДП на входе в поле А1 из ПфК. Вследствие этого именно эти нейроны поля А1 начнут сильнее возбуждать шипиковые клетки медиодорзального стриатума, что будет способствовать открыванию НМДА-каналов и индукции ДП на сильном кортико-стриатном входе (рис. 1). В свою очередь это приведет к лучшей выраженности РП нейронов поля А1, реагирующих на подкрепляемый тон с частотой F1. Кроме того, при произвольном увеличении активности нейронов ПфК должно усилиться их возбуждающее действие на дофаминергические клетки (рис. 1). Дофамин, воздействуя на Д1 рецепторы на шипиковых нейронах медиодорзального стриатума, способствует ДП кортико-стриатных входов, усилению ингибирования ГАМКергических клеток ЧВр и последующему увеличению растормаживания нейронов ВКТв, имеющих ПЧН F1. Это приведет к дальнейшему усилению активности тех нейронов поля А1, на которые было направлено внимание и которые имели ПЧН F1. В дополнение активация ПфК, запускающая произвольное внимание, приводит к реорганизации активности в лимбической цепи ПфК–БГ–МДЯ–ПфК (рис. 1). Из предложенной нами модели функционирования лимбической цепи [Силькис, 2015 б] следует, что при выделении дофамина в ПЯ за счет воздействия на Д1 рецепторы на стрионигральных нейронах на сильном входе из ПфК к эти клеткам будет индуцироваться ДП, что приведет к усилению ингибирования нейронов ЧВр по прямому пути через ПЯ [Силькис, 2014]. Одновременно за счет воздействия на Д2 рецепторы на стриопаллидарных нейронах ПЯ, на сильных кортико-стритных входах из ПфК будет индуцироваться длительная депрессия. Это приведет к ослаблению тормозного действия на нейроны ВП и последующему усилению ингибирующего действия со стороны ПЯ на ЧВр [Силькис, 2014]. В пользу такого механизма свидетельствуют данные о сильном ингибировании тонической активности клеток ЧВр в результате электрической стимуляции нейронов мПфК [Montaron, et al., 1996]. Поскольку нейроны той части ЧВр, в которой оканчиваются аксоны шипиковых клеток ПЯ, ингибируют нейроны МДЯ, проецирующееся в ПфК, в результате усиления ингибирования нейронов ЧВр и последующего растормаживания нейронов МДЯ, активность нейронов мПфК дополнительно увеличится и, следовательно, усилится их возбуждающее действие на нейроны поля А1.
Предлагаемая нами модель отличается от широко распространенного представления о важной роли латерального внутрикоркового торможения в формировании РП нейронов в первичных сенсорных областях. Латеральное торможение в поле А1 (как и в первичной зрительной коре V1) вряд ли может обеспечить такое входоспецифичное изменение, как направленное изменение РП, вследствие немногочисленности корковых тормозных интернейронов (единицы процентов) и большой дивергентности и конвергентности их взаимодействий с пирамидными клетками. По-видимому, с этим связано отсутствие ориентационной чувствительности у тормозных нейронов первичной зрительной коры, хотя существуют ориентационные колонки из пирамидных клеток. Авторы работы [Oswald et al., 2006] также подвергли сомнению роль латерального торможения, поскольку оно не имеет тонкой настройки на тон и не может ограничить РП. Из предлагаемого нами механизма следует, что в формировании и модификации хорошо очерченных РП нейронов поля А1 (как и РП нейронов в колонках в поле V1) основную роль играет не латеральное торможение в коре, а дофамин-зависимые перестройки активности в слуховой (зрительной) и лимбической цепях К–БГ–Т–К. Мы полагаем, что именно разнонаправленный знак модификации эффективности сильных и слабых кортико-стриатных входов может привести к усилению активности одной группы корковых нейронов и одновременному подавлению активности в других нейронных группах.
Примечательно, что функциональные связи между слуховыми и другими областями коры избирательны к частоте. Так, с помощью функционального магнитного резонанса показано, что при обработке низкочастотных тонов (200 и 400 Гц) слуховая кора связана с премоторной, соматосенсорной/ассоциативной и дорзолатеральной префронтальной областями; для средних частот (800 и 1600 Гц) выявлены связи с передней/задней верхневисочной извилиной и нижней фронтальной областью; для высоких частот (3200 и 6400 Гц) характерны связи с передней цингулярной корой и левой дорзолатеральной ПфК [Yuan, et al., 2018]. Не исключено, что эти различия связаны с разной ролью тонов низкой и высокой частоты для жизнедеятельности и выбора необходимых двигательных реакций.
Механизм влияния эмоций на пластические перестройки рецептивных полей нейронов поля А1 при обучении
Современные исследования указывают на то, что эмоции являются следствием взаимодействия нейронных цепей 1) зрительного восприятия, включающих первичную и высшие зрительные области коры; 2) слухового восприятия, включающих первичную слуховую кору; 3) внимания к эмоционально значимому стимулу, включающих инсулярную область, переднюю цингулярную и подкорковые области; 4) оценки и предвидения эмоциональных событий, включающих мПфК, заднюю цингулярную область; 5) индукции эмоциональной реакции, включающей миндалину и фузиформную извилину [Riedel et al., 1996]. В предлагаемой модели рассматривается функционирование только цепей, связанных со слуховым восприятием и обучением, в котором УС является чистый тон. Как уже указывалось, нейроны миндалины, участвующие во влиянии эмоций и мотивации на обучение, реагируют на сенсорные стимулы, в частности, на звуковые. Нейроны латеральной миндалины могут участвовать в обработке звуковых стимулов, поскольку получают иннервацию из медиальной и дорзальной частей ВКТ [Doron, Ledoux, 1999]. Латентные периоды ответов нейронов миндалины на звуковые стимулы могут быть очень короткими (4–6 мс), меньше латентных периодов ответов нейронов стриатума (12–30 мс) [Bordi et al., 1993]. На крысах в свободном поведении показано, что входы из слуховых областей таламуса и коры в латеральное ядро миндалины достаточно сильные и могут потенциироваться. При этом выраженность ДП на входе из коры в миндалину в первые 24 ч наибольшая и сохраняется в течение 3 дней, а в пути из таламуса в миндалину ДП меньше по амплитуде, но сохраняется, по крайней мере, в течение 6 дней [Doyère et al., 2003]. Примечательно, что изменения АМПА рецепторов на нейронах миндалины, вызванные Павловским обучением, сходны с изменениями АМПА рецепторов при посттетанической ДП, причем имеет место окклюзия этих эффектов [Maren, 2005]. Эти данные указывают на связь синаптической пластичности на сенсорном входе в миндалину с ассоциативным обучением [Maren, 2005]. Недавно показано, что афференты из таламических ядер средней линии паравентрикулярного и срединного медиального (на схеме не показаны с целью упрощения) оканчиваются преимущественно на основных клетках БЛМ [Amir et al., 2018], поэтому афферентное торможение в этом пути слабое и не должно препятствовать индукции ДП на входах в БЛМ от этих ядер, связанных также с ПфК. Полагают, что от пластичности входов в миндалину зависит быстрая сочетаемость ответов на потенциально опасные стимулы, тогда как изменения в слуховых областях коры могут быть вовлечены в когнитивные функции, связанные с вниманием и запоминанием [Quirk et al., 1997]. Полагают также, что мотивационная значимость различных подкреплений может отражаться в активности орбитофронтальной области ПфК [Hollerman et al., 2000]. По-видимому, это связано с наличием возбудительных входов из миндалины в орбитофронтальную кору и мПфК и входов из коры в миндалину [Aggleton et al., 2015; Reppucci, Petrovich, 2016].
Согласно предложенному нами ранее гипотетическому механизму влияния эмоций на функционирование лимбических и сенсорных нейронных сетей К–БГ–Т–К [Силькис, 2014], в функционирование лимбической цепи К–БГ–Т–К, которая включает ПЯ и ВП, существенный вклад вносит то обстоятельство, что входы из мПфК и из БЛМ конвергируют на шипиковых клетках ПЯ (рис. 3). Показано, что латентные периоды ответов шипиковых нейронов ПЯ на стимуляцию как мПфК, так и БЛМ, примерно одинаковы и варьируют от 8 до 20 мс (в среднем 14 мс), что соответствует моносинаптическому проведению [McGinty, Grace, 2009]. При одновременном срабатывании проецирующихся на шипиковые клетки ПЯ нейронов миндалины и ПфК суммация возбуждения от этих структур может привести к появлению разрядов шипиковых клеток. Показано, что афференты из БЛМ, ПфК и срединных таламических ядер активируют метаботропные глутаматные рецепторы, расположенные на шипиковых клетках раковины и сердцевины ПЯ [Mitrano et al., 2010], что должно способствовать ДП этих входов. В результате последующего растормаживания со стороны БГ нейронов МДЯ и срединных таламических ядер должна повыситься активность клеток-мишеней этих ядер как в БЛМ, так и в ПфК. При этом усилится влияние ПфК на выбор поведения. В пользу предлагаемого механизма влияния эмоций на обучение могут свидетельствовать данные о том, что удаление раковины ПЯ или прерывание связей между БЛМ и раковиной ПЯ устраняло влияние эмоций на выбор стимула, который вызывал действие, приводящее к подкреплению [Laurent, 2012]. Повреждение сердцевины ПЯ или связей БЛМ с сердцевиной ПЯ препятствовало и влиянию эффективности подкрепления на выбор поведения [Laurent, 2012]. Мы полагаем, что эти эффекты можно объяснить особенностями организации связей БЛМ с разными частями ПЯ [Силькис, 2014]. Так, те афференты из БЛМ, которые оканчиваются в матриксе раковины ПЯ, воздействуя на стрионигральные и стриопаллидарные нейроны (рис. 1), могут через выходные ядра БГ и МДЯ влиять на активность ПфК. Поэтому через указанный путь миндалина может влиять на целенаправленный выбор стимула. Те афференты из БЛМ, которые оканчиваются в стриозомах сердцевины ПЯ, через стрионигральные ГАМКергические нейроны могут изменять активность дофаминергических клеток и количество выделяемого дофамина и таким образом влиять на эффективность подкрепления [Силькис, 2014]. С предлагаемым механизмом согласуются результаты работы [FitzGerald et al., 2014], в которой с помощью функционального магнитного резонанса показано, что активность ПЯ отражает ценность сенсорного стимула при выборе действия в ответ на этот стимул.
ВОЗМОЖНАЯ РОЛЬ СПИРАЛЬНОЙ ОРГАНИЗАЦИИ НЕЙРОННЫХ ЦЕПЕЙ, ВКЛЮЧАЮЩИХ БАЗАЛЬНЫЕ ГАНГЛИИ, В ВЫБОРЕ ДВИЖЕНИЯ В ОТВЕТ НА ЧИСТЫЙ ТОН ПРИ ОБУЧЕНИИ
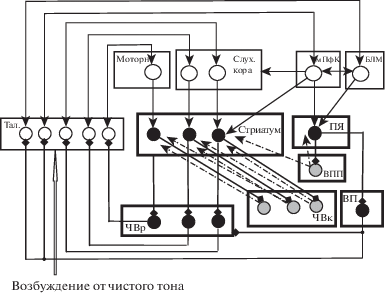
В настоящей работе выдвигается гипотеза о том, что отображение УС (чистого тона) трансформируется в моторную команду благодаря одновременной дофамин-зависимой модификации кортико-стриатных входов в лимбической, слуховой и моторной цепях К–БГ–Т–К (рис. 3). На этом рисунке с целью упрощения представлены только три цепи, но следует иметь в виду более сложную топографию лимбических цепей. Отмечают, что ПЯ получает информацию об эмоциях и мотивации из подкорковых структур, информацию о когнитивной деятельности из фронтальных областей коры, полисенсорные сигналы и сигналы о запоминании из височных областей коры [Choi et. al., 2017]. При этом в ПЯ имеются гетерогенные подобласти, включающие вентромедиальный сектор, получающий иннервацию из височной извилины, вентромедиальной ПфК, цингулярной коры и миндалины; а также связанный с когнитивной и сенсомоторной информацией дорзолатеральный сектор, получающий входы из дорзолатеральной ПфК, вентролатеральной ПфК, премоторной коры, височных областей, включая энторинальную кору. Поскольку каждый из этих секторов разделяется на более мелкие области с разной пропорцией указанных входов, существует возможность формирования огромного количества ассоциаций [Choi et al., 2017]. В предлагаемой нами модели принятие решения в значительной степени зависит от лимбической нейронной цепи К–БГ–Т–К, которая влияет как на сенсорную обработку, так и на выбор действия вследствие спиральной организации цепей К – БГ – Т – К [Buot, Yelnik, 2012; Haber, 2003; Nakano, 2000; Joel, Weiner, 2000] (рис. 4). Спираль образуется благодаря тому, что стрионигральные нейроны, расположенные в ПЯ, проецируются на дофаминергические клетки, которые иннервируют шипиковые клетки не только в этой же вентральной части стриатума, но и в областях стриатума, расположенных более дорзально, сначала в сенсорных, а затем в моторных. Влияние на модификацию РП и выбор действия исходит из ПфК, которая контролирует выделение дофамина нейронами ВПП и ЧВк за счет проекций в дофаминергические структуры через субталамическое ядро и опосредованного воздействия через ПЯ и ВП (рис. 1). Вследствие спиральной организации изменения в лимбической цепи способствуют контрастному усилению РП тонотопически связанных нейронов ВКТв и поля А1, для которых частота подкрепляемого УС (чистого тона) была или стала предпочтительной. Выбор действия в ответ на этот УС определяется дофамин-зависимым изменением функционирования моторной цепи К–БГ–Т–К, включающей моторные области таламуса и коры, которые проецируются в дорзальную часть БГ – скорлупу стриатума. В эту моторную цепь включены также вентро-латеральное ядро таламуса и нейроны латеральной части ЧВр [Haber, 2016]. Шипиковые клетки ПЯ могут оказывать ингибирующее действие на клетки определенных локусов в латеральной части ЧВр через нейроны ВП (рис. 4). Из предложенной нами ранее модели функционирования моторной цепи К–БГ–Т–К следует, что выделение дофамина в скорлупе стриатума, за счет ДП на входах из моторной коры к стрионигральным нейронам, дающим начало прямому пути через БГ, и одновременной длительной депрессией на входах к стриопаллидарным нейронам, дающим начало непрямому пути через БГ, способствует синергичному растормаживанию нейронов вентро-латерального ядра таламуса и облегчению формирования в моторной коре паттерна активности, запускающего движение [Silkis, 2001]. Именно такой разнонаправленный характер изменений на стрионигральных и стриопаллидарных нейронах наблюдался в дорзомедиальном стриатуме мышей во время целенаправленного действия при обучении [Shan et al., 2014]. Судя по результатам работы [Kobayashi et al., 2013], при решении задачи на дискриминацию звуков оба пути через БГ (прямой и непрямой) действуют совместно, причем инактивация непрямого пути через дорзолатеральный стриатум ухудшала аккуратность выбора выученной двигательной реакции. Поскольку обычно в задачах на дискриминацию чистых тонов подкрепляется движение в ответ на тон только одной из частот, выделение дофамина должно увеличиваться при предъявлении именно этого тона. В результате будет не только контрастно усиливаться РП нейронов с ПЧН на частоту подкрепляемого тона, но и усиливаться паттерн активности в моторной коре, что облегчит выполнение движения в ответ на этот тон. Эффект может проявиться, например, в укорочении латентного периода реакции на тон. Поскольку в разных структурах усиливаются ответы только при предъявлении подкрепляемого тона определенной частоты, предлагаемый механизм может лежать в основе выбора движения в задаче на различение тонов.
Рис. 4.
Схема спиральной организации взаимодействий между лимбической, слуховой и моторной цепями кора – базальные ганглии – таламус – кора. Тал. – таламус. Остальные обозначения как на рис. 1, 2 и 3.
Fig. 4. A scheme of spiral organization of interactions between limbic, auditory and motor circuits cortex – basal ganglia – thalamus – cortex. Тал. – thalamus. Other designations are the same as in Fig. 1, 2 and 3.
Кроме взаимозависимого функционирования лимбической, ассоциативной (слуховой) и моторной цепей К–БГ–Т–К, важный вклад в двигательную активность при обучении, в котором УС является чистый тон, могут вносить связи моторной коры с другими корковыми областями. Например, ПфК непосредственно связана с моторными и премоторными областями коры [Nakano, 2000]. Авторы указанной работы полагают, что изменения этих связей играют роль в усилении двигательных реакций на звук. Изменения активности в дополнительной моторной и премоторной областях коры при обработке чистых тонов продемонстрированы в работе [Lima et al, 2016]. При этом остается открытым вопрос о том, какие процессы приводят к произвольной активации ПфК.
Предлагаемая модель согласуется с результатами работы [Znamenskiy, Zador, 2013], в которой с целью решения вопроса о том, как отображение УС – чистого тона трансформируется в моторную команду, было проведено исследование связей между нейронами коры и стриатума при решении задач на восприятие определенных чистых тонов и принятие решения. В этих опытах было показано, в частности, что стимуляция проецирующихся в стриатум нейронов слуховой коры способствует принятию решения о движении в направлении, определяемом ПЧН стимулируемых нейронов. Наоборот, инактивация кортико-стриатных нейронов меняла решение на противоположное. На основании этих данных было сделано заключение, что проекции из коры в стриатум могут являться основным механизмом контроля принятия решения о выборе двигательной активности при участии сенсорной коры. Согласно нашей модели, в случае правильного выбора действия, приводящего к получению желаемого подкрепления, в стриатуме должен выделиться дофамин. По мере обучения это должно привести к дальнейшему контрастному очерчиванию РП нейронов в поле А1 и более четкому выделению паттерна активности в моторной коре, облегчающему движение в ответ на УС. То, что по мере улучшения обучения РП нейронов сужаются, показано в работе [Takahashi et al., 2010; Takahashi et al., 2011]. Однако оказалось, что концентрация дофамина в сердцевине ПЯ увеличивается только в начале обучения, а по мере выработки инструментального рефлекса концентрация дофамина уменьшается и движение становится стереотипным [Collins et al., 2016]. Обращает на себя внимание и то обстоятельство, что в разных видах поведения участвуют разные участки БГ и связанных с ними структур. Так, в формировании ассоциации “действие – следующий из него результат”, приводящей к целенаправленному поведению, участвует дорзомедиальный стриатум, тогда как в контроле привычного действия участвует дорзолатеральный стриатум [Balleine et al, 2009; Li et al., 2016]. Понимание механизмов, лежащих в основе этих эффектов, требует специального анализа, который предполагается провести в дальнейшем.
ЗАКЛЮЧЕНИЕ
Предложен нейронный механизм обучения, в котором условным сигналом является чистый тон с частотой F. Механизм базируется на дофамин-зависимых длительных изменениях эффективности межнейронных связей в слуховых, лимбических и моторных цепях кора – базальные ганглии – таламус – кора. Эти изменения лежат в основе перестроек рецептивных полей нейронов первичной слуховой коры (А1) и выбора движения при обучении. Дофамин, выделившийся в ответ на тон с частотой F и на подкрепление, воздействуя на Д1 рецепторы на шипиковых клетках слуховой части дорзального стриатума, способствует индукции длительной потенциации эффективности входов к этим клеткам только от нейронов поля А1 с предпочтительной частотой настройки F или близкой к ней. В результате усиливается растормаживание со стороны базальных ганглиев нейронов вентральной части внутреннего коленчатого тела с предпочтительной частотой настройки F и дополнительно увеличивается активность тонотопически связанных с ними нейронов поля А1. Одновременно на остальных кортико-стриатных входах развивается длительная депрессия. Вследствие этого ингибируется активность тех тонотопически связанных нейронов таламуса и поля А1, чья предпочтительная частота настройки отличалась от F.
Мы полагаем, что предложенный нами механизм модификации рецептивных полей нейронов поля А1 может лежать в основе лечения некоторых видов тиннитуса (шума в ушах, не связанного с внешним акустическим стимулом). Так показано, что транскраниальная магнитная стимуляция поля А1 или электрическая стимуляция первичной и вторичной слуховых области коры через вживленные электроды приводили к существенному подавлению тиннитуса, при котором унилатерально слышится чистый тон [De Ridder et al., 2007; De Ridder et al., 2006]. При этом восприятие в области частот, близких к этому тону, не подавлялось. Исследования на человеке и животных выявили корреляцию между интенсивностью тиннитуса и степенью реорганизации активности в поле А1, вызванной Хеббовской пластичностью, которая проявлялась в синхронизированной гиперактивности в определенном участке коры. Этот эффект связывают с изменениями в таламо-кортикальном круге и ослаблением латерального торможения в коре [De Ridder et al., 2007]. Эффект от такого метода лечения тиннитуса согласуется с описанными выше результатами наших экспериментов, в которых микростимуляция участка поля А1 позволяла сместить предпочтительную частоту настройки нейронов в другом участке поля А1. Однако с точки зрения нашей модели, эффект лечения связан с пластическими (Хеббовскими) перестройками эффективности нейронных связей между всеми элементами цепи А1 – БГ – ВКТ –А1. Мы также предложили объяснение, почему в основе входоспецифичных изменений рецептивных полей не может лежать латеральное торможение. Показано, что транскраниальная стимуляция не только слуховой коры, но и фронтальной коры, приводит к подавлению тиннитуса у некоторых групп пациентов [Langguth, De Ridder, 2013; Shekhawat, Vanneste, 2018]. Подавление тиннитуса вызывала и высокочастотная стимуляция внутреннего коленчатого тела [van Zwieten et al., 2018]. Эти результаты также свидетельствуют в пользу предложенного нами механизма влияния активности разных структур на перестройки РП нейронов поля А1. В работе [Zhang, 2013] выдвинута гипотеза, что эффективность лечения тиннитуса стимуляцией разных структур связана с наличием “ворот”, образованных взаимодействием внутреннего коленчатого тела и ретикулярного ядра таламуса, на которое влияют сверху-вниз слуховая кора и лимбические области, а снизу-вверх – слуховые структуры ствола мозга и среднего мозга. Предложенный нами механизм включает не только эти влияния, но и воздействие на ретикулярное таламическое ядро со стороны базальных ганглиев. Мы полагаем, что предлагаемая модель является более полной и потому может быть полезной для поиска подходов к лечению различных видов нарушений слухового восприятия.
Работа выполнена при поддержке гос. задания, номер государственной регистрации ВНТИЦ: 01201371231.
Список литературы
Силькис И.Г. О возбудительных взаимодействиях в нейронных сетях, включающих клетки слуховой коры и медиального коленчатого тела. Журн. высш. нерв. деят. им. И.П. Павлова. 1994а. 44 (4–5): 762–776.
Силькис И.Г. О механизмах взаимозависимого влияния префронтальной коры, гиппокампа и миндалины на функционирование базальных ганглиев и выбор поведения. Журн. высш. нерв. деят. им. И.П. Павлова. 2014. 64 (1): 1–19.
Силькис И.Г. О роли базальных ганглиев в формировании рецептивных полей нейронов первичной слуховой коры и механизмы их пластичности. Успехи физиол. наук. 2015a. 46 (3): 60–75.
Силькис И.Г. О роли базальных ганглиев в обработке сложных звуковых стимулов и слуховом внимании. Успехи физиол. наук. 2015b. 46 (3): 76–92.
Силькис И.Г. О тормозных взаимодействиях в нейронных сетях, включающих клетки слуховой коры и медиального коленчатого тела. Журн. высш. нерв. деят. им. И.П. Павлова. 1994б. 44 (6): 1046–1058.
Силькис И.Г. Унифицированный постсинаптический механизм влияния различных нейромодуляторов на модификацию возбудительных и тормозных входов к нейронам гиппокампа (Гипотеза). Успехи физиол. наук. 2002. 33 (1): 40–56.
Силькис И.Г., Рапопорт С.Ш. Пластические перестройки рецептивных полей нейронов слуховой коры и медиального коленчатого тела. Журн. высш. нерв. деят. им. И.П. Павлова. 1994. 44 (3): 548–568.
Суворов Н.Ф., Шуваев В.Т. Участие базальных ганглиев в организации движения. Росс. физиол. журн. им. И.М. Сеченова. 2002. 88 (10): 1233–1240.
Aggleton J.P., Wright N.F., Rosene D.L, Saunders R.C. Complementary patterns of direct amygdala and hippocampal projections to the macaque prefrontal cortex. Cereb. Cortex. 2015. 25 (11): 4351–4373.
Amir A., Pare J-F., Smith J., Pare D. Midline thalamic inputs to the amygdala: ultrastructure and synaptic targets. J. Comp. Neurol. 2019. 527 (5): 942–956.
Apergis-Schoute A.M., Schiller D., LeDoux J.E., Phelps E.A. Extinction resistant changes in the human auditory association cortex following threat learning. Neurobiol. Learn. Mem. 2014. 113: 109–114.
Bakin J.S., South D.A., Weinberger N.M. Induction of receptive field plasticity in the auditory cortex of the guinea pig during instrumental avoidance conditioning. Behav. Neurosci. 1996. 110 (5): 905–913.
Balleine B.W., Liljeholm M., Ostlund S.B. The integrative function of the basal ganglia in instrumental conditioning. Behav. Brain Res. 2009. 199 (1): 43–52.
Bao S., Chan V.T., Merzenich M.M. Cortical remodelling induced by activity of ventral tegmental dopamine neurons. Nature. 2001. 412: 79–83.
Barbas H., Zikopoulos B., Timbie C. Sensory pathways and emotional context for action in primate prefrontal cortex. Biol. Psychiatry. 2011. 69 (12): 133–1139.
Bieszczad K.M., Weinberger N.M. Extinction reveals that primary sensory cortex predicts reinforcement outcome. Eur. J. Neurosci. 2012. 35 (4): 598–613.
Bordi F., LeDoux J., Clugnet M.C., Pavlides C. Single-unit activity in the lateral nucleus of the amygdala and overlying areas of the striatum in freely behaving rats: rates, discharge patterns, and responses to acoustic stimuli. Behav. Neurosci. 1993. 107 (5): 757–769.
Brog J.S., Salyapongse A., Deutch A.Y., Zahm D.S. The patterns of afferent innervation of the core and shell in the “accumbens” part of the rat ventral striatum: immunohistochemical detection of retrogradely transported fluoro-gold. J. Comp. Neurol. 1993. 338: 255–278.
Bromberg-Martin E.S., Matsumoto M., Hikosaka O. Dopamine in motivational control: rewarding, aversive, and alerting. Neuron. 2010. 68: 815–834.
Brosch M., Selezneva E., Scheich H. Formation of associations in auditory cortex by slow changes of tonic firing. Hear. Res. 2011. 271 (1–2): 66–73.
Budinger E., Brosch M., Scheich H., Mylius J. The subcortical auditory structures in the Mongolian gerbil: II. Frequency-related topography of the connections with cortical field AI. J. Comp. Neurol. 2013. 521 (12): 2772–2797.
Budinger E., Laszcz A., Lison H., Scheich H., Ohl F.W. Non-sensory cortical and subcortical connections of the primary auditory cortex in Mongolian gerbils: bottom-up and top-down processing of neuronal information via field AI. Brain Res. 2008. 1220: 2–32.
Buot A., Yelnik J. Functional anatomy of the basal ganglia: limbic aspects. Rev. Neurol. (Paris). 2012. 168 (8–9): 569–575.
Choi E.Y., Ding S.L., Haber S.N. Combinatorial inputs to the ventral striatum from the temporal cortex, frontal cortex, and amygdala: implications for segmenting the striatum. eNeuro. 2017. 4 (6): 1–15.
Collins A.L., Greenfield V.Y., Bye J.K., Linker K.E., Wang A.S., Wassum K.M. Dynamic mesolimbic dopamine signaling during action sequence learning and expectation violation. Sci. Rep. 2016. 6: 20231.
Cotillon-Williams N., Huetz C., Hennevin E., Edeline J.M. Tonotopic control of auditory thalamus frequency tuning by reticular thalamic neurons. J. Neurophysiol. 2008. 99 (3): 1137–1151.
David S.V., Fritz J.B., Shamma S.A. Task reward structure shapes rapid receptive field plasticity in auditory cortex. Proc. Natl. Acad. Sci. USA. 2012. 109 (6): 2144–2149.
Deniau J.M., Menetrey A., Charpier S. The lamellar organization of the rat substantia nigra pars reticulata: segregated patterns of striatal afferents and relationship to the topography of corticostriatal projections. Neuroscience. 1996. 73 (3): 761–781.
De Ridder D., De Mulder G., Verstraeten E., Seidman M., Elisevich K., Sunaert S., Kovacs S., Van der Kelen K., Van de Heyning P., Moller A. Auditory cortex stimulation for tinnitus. Acta Neurochir. Suppl. 2007. 97 (Pt 2): 451–462.
De Ridder D., De Mulder G., Verstraeten E., Van der Kelen K., Sunaert S., Smits M., Kovacs S., Verlooy J., Van de Heyning P., Moller A.R. Primary and secondary auditory cortex stimulation for intractable tinnitus. ORL J. Otorhinolaryngol. Relat. Spec. 2006. 68 (1): 48–54.
Doron N.N., Ledoux J.E. Organization of projections to the lateral amygdala from auditory and visual areas of the thalamus in the rat. J. Comp. Neurol. 1999. 412 (3): 383–409.
Doyère V., Schafe G.E., Sigurdsson T., LeDoux J.E. Long-term potentiation in freely moving rats reveals asymmetries in thalamic and cortical inputs to the lateral amygdala. Eur. J. Neurosci. 2003. 17 (12): 2703–2715.
FitzGerald T.H., Schwartenbeck P., Dolan R.J. Reward-related activity in ventral striatum is action contingent and modulated by behavioral relevance. J. Neurosci. 2014. 34 (4): 1271–1279.
Francis N.A., Winkowski D.E., Sheikhattar A., Armengol K., Babadi B., Kanold P.O. Small networks encode decision-making in primary auditory cortex. Neuron. 2018. 97 (4): 885–897.
Fritz J.B., Elhilali M., David S.V., Shamma S.A. Auditory attention-focusing the searchlight on sound. Curr. Opin. Neurobiol. 2007a. 17 (4): 437–455.
Fritz J.B., Elhilali M., David S.V., Shamma S.A. Does attention play a role in dynamic receptive field adaptation to changing acoustic salience in A1? Hear. Res. 2007b. 229 (1–2): 186–203.
Gangarossa G., Espallergues J., Mailly P., De Bundel D., de Kerchove d’Exaerde A., Hervé D., Girault J.A., Valjent E., Krieger P. Spatial distribution of D1R- and D2R-expressing medium-sized spiny neurons differs along the rostro-caudal axis of the mouse dorsal striatum. Front. Neural Circuits. 2013. 7. Article 124.
Ghose D., Maier A., Nidiffer A., Wallace M.T. Multisensory response modulation in the superficial layers of the superior colliculus. J. Neurosci. 2014. 34 (12): 4332–4344.
Groenewegen H.J., Galis-de Graaf Y., Smeets W.J. Integration and segregation of limbic cortico-striatal loops at the thalamic level: an experimental tracing study in rats. J. Chem. Neuroanat. 1999b. 16 (3): 167–185.
Groenewegen H.J., Wright C.I., Beijer A.V., Voorn P. Convergence and segregation of ventral striatal inputs and outputs. Ann. NY Acad. Sci. 1999a. 877: 49–63.
Grosso A., Cambiaghi M., Concina G., Sacco T., Sacchetti B. Auditory cortex involvement in emotional learning and memory. Neuroscience. 2015. 299: 45–55.
Guimarãis M., Gregório A., Cruz A., Guyon N., Moita M.A. Time determines the neural circuit underlying associative fear learning. Front. Behav. Neurosci. 2011. 5: 89.
Guo F., Intskirveli I., Blake D.T., Metherate R. Tone-detection training enhances spectral integration mediated by intracortical pathways in primary auditory cortex. Neurobiol. Learn. Mem. 2013. 101: 75–84.
Haber S. Perspective on basal ganglia connections as described by Nauta and Mehler in 1966: Where we were and how this paper effected where we are now. Brain Res. 2016. 1645: 4–7.
Haber S.N. The primate basal ganglia: parallel and integrative networks. J. Chem. Neuroanat. 2003. 26 (4): 317–330.
Herbert H., Klepper A., Ostwald J. Afferent and efferent connections of the ventrolateral tegmental area in the rat. Anat. Embryol. (Berl.). 1997. 196 (3): 235–259.
Hollerman J.R., Tremblay L., Schultz W. Involvement of basal ganglia and orbitofrontal cortex in goal-directed behavior. Prog. Brain Res. 2000. 126: 193–215.
Hori S., Mori K., Mashimo T., Seiyama A. Effects of light and sound on the prefrontal cortex activation and emotional function: A functional near-infrared spectroscopy study. Front. Neurosci. 2017. 11: 321.
Horvitz J.C., Stewart T., Jacobs B.L. Burst activity of ventral tegmental dopamine neurons is elicited by sensory stimuli in the awake cat. Brain Res. 1997. 759 (2): 251–258.
Huang Y., Matysiak A., Heil P., König R., Brosch M. Persistent neural activity in auditory cortex is related to auditory working memory in humans and nonhuman primates. Elife. 2016. 5. pii: e15441.
Joel D., Weiner I. The connections of the dopaminergic system with the striatum in rats and primates: an analysis with respect to the functional and compartmental organization of the striatum. Neuroscience. 2000. 96 (3): 451–474.
Kim W.B., Cho J.H. Encoding of discriminative fear memory by input-specific LTP in the amygdala. Neuron. 2017. 95 (5): 1129–1146.
Kimura A., Imbe H., Donishi T., Tamai Y. Axonal projections of single auditory neurons in the thalamic reticular nucleus: implications for tonotopy-related gating function and cross-modal modulation. Eur. J. Neurosci. 2007. 26 (12): 3524–3535.
Kishioka A., Fukushima F., Ito T., Kataoka H., Mori H., Ikeda T., Itohara S., Sakimura K., Mishina M. A novel form of memory for auditory fear conditioning at a low-intensity unconditioned stimulus. PLoS One. 2009. 4(1): e4157.
Kishioka A., Uemura T., Fukushima F., Mishina M. Consolidation of auditory fear memories formed by weak unconditioned stimuli requires NMDA receptor activation and de novo protein synthesis in the striatum. Mol. Brain. 2013. 6: 17.
Kiyokawa Y., Takahashi D., Takeuchi Y., Mori Y. The right central amygdala shows greater activation in response to an auditory conditioned stimulus in male rats. J. Vet. Med. Sci. 2016. 78 (10): 1563–1568.
Kobayashi K., Fukabori R., Nishizawa K. Neural circuit mechanism for learning dependent on dopamine transmission: roles of striatal direct and indirect pathways in sensory discrimination. Adv. Pharmacol. 2013. 68: 143–153.
Kudoh M., Shibuki K. Sound sequence discrimination learning motivated by reward requires dopaminergic D2 receptor activation in the rat auditory cortex. Learn. Mem. 2006. 13 (6): 690–698.
Kumar S., Joseph S., Gander P.E., Barascud N., Halpern A.R., Griffiths T.D. A brain system for auditory working memory. J. Neurosci. 2016. 36 (16): 4492–4505.
Lammel S.1., Lim B.K., Malenka R.C. Reward and aversion in a heterogeneous midbrain dopamine system. Neuropharmacology. 2014. 76 (Pt B): 351–359.
Langguth B., De Ridder D. Tinnitus: therapeutic use of superficial brain stimulation. Handb Clin Neurol. 2013. 116: 441–467.
Laurent V., Leung B., Maidment N., Balleine B.W. μ- and δ-opioid-related processes in the accumbens core and shell differentially mediate the influence of reward-guided and stimulus-guided decisions on choice. J. Neurosci. 2012. 32 (5): 1875–1883.
LeDoux J.E., Sakaguchi A., Iwata J., Reis D.J. Interruption of projections from the medial geniculate body to an archi-neostriatal field disrupts the classical conditioning of emotional responses to acoustic stimuli. Neuroscience. 1986. 17 (3): 615–627.
Leon M.I., Miasnikov A.A., Wright E.J. 3rd, Weinberger N.M. CS-specific modifications of auditory evoked potentials in the behaviorally conditioned rat. Brain Res. 2017. 1670: 235–247.
Li Y., He Y., Chen M., Pu Z., Chen L., Li P., Li B., Li H., Huang Z., Li Z., Chen J.F. Optogenetic Activation of Adenosine A2A Receptor Signaling in the Dorsomedial Striatopallidal Neurons Suppresses Goal-Directed Behavior. Neuropsychopharmacology. 2016. 41 (4): 1003–1013.
Lima C.F., Krishnan S., Scott S.K. Roles of Supplementary Motor Areas in Auditory Processing and Auditory Imagery. Trends Neurosci. 2016. 39 (8): 527–542.
Liu X., Basavaraj S., Krishnan R., Yan J. Contributions of the thalamocortical system towards sound-specific auditory plasticity. Neurosci. Biobehav. Rev. 2011. 35 (10): 2155–2161.
Ma X., Suga N. Specific and nonspecific plasticity of the primary auditory cortex elicited by thalamic auditory neurons. J. Neurosci. 2009. 29 (15): 4888–4896.
Maren S. Synaptic mechanisms of associative memory in the amygdala. Neuron. 2005. 47 (6): 783–786.
Mayer A.R., Ryman S.G., Hanlon F.M., Dodd A.B., Ling J.M. Look hear! The prefrontal cortex is stratified by modality of sensory input during multisensory cognitive control. Cereb. Cortex. 2017. 27 (5): 2831–2840.
McAlonan K., Brown V.J. The thalamic reticular nucleus: more than a sensory nucleus? Neuroscientist 2002. 8 (4): 302-5.
McGinty V.B., Grace A.A. Timing-dependent regulation of evoked spiking in nucleus accumbens neurons by integration of limbic and prefrontal cortical inputs. J. Neurophysiol. 2009. 101 (4): 1823–1835.
McGovern R.A., Chan A.K., Mikell C.B., Sheehy J.P., Ferrera V.P., McKhann G.M. 2nd. Human substantia nigra neurons encode decision outcome and are modulated by categorization uncertainty in an auditory categorization task. Physiol. Rep. 2015. 3 (9). pii: e12422.
Mitrano D.A., Pare J-F., Smith Y. Ultrastructural relationships between cortical, thalamic, and amygdala glutamatergic inputs and group I metabotropic glutamate receptors in the rat accumbens. J. Comp. Neurol. 2010. 518 (8): 1315–1329.
Montes-Lourido P., Vicente A.F., Bermudez M.A., Gonzalez F. Neural activity in monkey amygdala during performance of a multisensory operant task. J. Integr. Neurosci. 2015. 14 (3): 309–323.
Montaron M.F., Deniau J.M., Menetrey A., Glowinski J., Thierry A.M. Prefrontal cortex inputs of the nucleus accumbens-nigro-thalamic circuit. Neuroscience. 1996. 71 (2): 371–382.
Mylius J., Happel M.F., Gorkin A.G., Huang Y., Scheich H., Brosch M. Fast transmission from the dopaminergic ventral midbrain to the sensory cortex of awake primates. Brain Struct. Funct. 2015. 220 (6): 3273–3294.
Nakano K. Neural circuits and topographic organization of the basal ganglia and related regions. Brain Dev. 2000. Suppl. 1: S5–S16.
Nevue A.A., Elde C.J., Perkel D.J., Portfors C.V. Dopaminergic Input to the Inferior Colliculus in Mice. Front. Neuroanat. 2016. 9: 168.
Nishijo H., Ono T., Nishino H. Topographic distribution of modality-specific amygdalar neurons in alert monkey. J. Neurosci. 1988. 8 (10): 3556–3569.
Ohl F.W., Scheich H. Differential frequency conditioning enhances spectral contrast sensitivity of units in auditory cortex (field Al) of the alert Mongolian gerbil. Eur. J. Neurosci. 1996. 8 (5): 1001–1017.
Ohl F.W., Scheich H. Learning-induced plasticity in animal and human auditory cortex. Curr. Opin. Neurobiol. 2005. 15 (4): 470–477.
Oswald A.M., Schiff M.L., Reyes A.D. Synaptic mechanisms underlying auditory processing. Curr. Opin. Neurobiol. 2006. 16 (4): 371–376.
Pan W.X., Brown J., Dudman J.T. Neural signals of extinction in the inhibitory microcircuit of the ventral midbrain. Nat. Neurosci. 2013. 16 (1): 71–78.
Pannese A., Grandjean D., Frühholz S. Amygdala and auditory cortex exhibit distinct sensitivity to relevant acoustic features of auditory emotions. Cortex. 2016. 85: 116–125.
Pannese A., Grandjean D., Frühholz S. Subcortical processing in auditory communication. Hear. Res. 2015. 328: 67–77.
Pleger B., Blankenburg F., Ruff C.C., Driver J., Dolan R.J. Reward facilitates tactile judgments and modulates hemodynamic responses in human primary somatosensory cortex. J. Neurosci. 2008. 28: 8161–8168.
Pleger B., Ruff C.C., Blankenburg F., Klöppel S., Driver J., Dolan R.J. Influence of dopaminergically mediated reward on somatosensory decision-making. PLoS Biol. 2009. 7(7): e1000164.
Polley D.B., Steinberg E.E., Merzenich M.M. Perceptual learning directs auditory cortical map reorganization through top-down influences. J. Neurosci. 2006. 26 (18): 4970–4982.
Polley D.B., Read H.L., Storace D.A., Merzenich M.M. Multiparametric auditory receptive field organization across five cortical fields in the albino rat. J. Neurophysiol. 2007. 97 (5): 3621–3538.
Popescu A.T., Zhou M.R., Poo M.M. Phasic dopamine release in the medial prefrontal cortex enhances stimulus discrimination. Proc. Natl. Acad. Sci. USA. 2016. 113 (22): E3169–E3176.
Puschmann S., Brechmann A., Thiel C.M. Learning-dependent plasticity in human auditory cortex during appetitive operant conditioning. Hum. Brain Mapp. 2013. 34 (11): 2841–2851.
Quirk G.J., Armony J.L., LeDoux J.E. Fear conditioning enhances different temporal components of tone-evoked spike trains in auditory cortex and lateral amygdala. Neuron. 1997. 19 (3): 613–624.
Reppucci C.J., Petrovich G.D. Organization of connections between the amygdala, medial prefrontal cortex, and lateral hypothalamus: a single and double retrograde tracing study in rats. Brain Struct. Funct. 2016. 221 (6): 2937–2962.
Riedel M.C., Yanes J.A., Ray K.L., Eickhoff S.B., Fox P.T., Sutherland M.T., Laird A.R. Dissociable meta-analytic brain networks contribute to coordinated emotional processing. Hum. Brain Mapp. 2018. 39 (6): 2514–2531.
Scheich H., Stark H., Zuschratter W., Ohl F.W., Simonis C.E. Some functions of primary auditory cortex in learning and memory formation. Adv. Neurol. 1997. 73: 179–193.
Schicknick H., Reichenbach N., Smalla K.H., Scheich H., Gundelfinger E.D., Tischmeyer W. Dopamine modulates memory consolidation of discrimination learning in the auditory cortex. Eur. J. Neurosci. 2012. 35 (5): 763–774.
Schicknick H., Tischmeyer W. Consolidation of auditory cortex-dependent memory requires N-methyl-D-aspartate receptor activation. Neuropharmacology. 2006. 50 (6): 671–676.
Shekhawat G.S., Vanneste S. High-definition transcranial direct current stimulation of the dorsolateral prefrontal cortex for tinnitus modulation: a preliminary trial. J Neural Transm (Vienna). 2018. 125 (2): 163–171.
Shan Q., Ge M., Christie M.J., Balleine B.W. The acquisition of goal-directed actions generates opposing plasticity in direct and indirect pathways in dorsomedial striatum. J. Neurosci. 2014. 34 (28): 9196–9201.
Silkis I. The cortico-basal ganglia-thalamocortical circuit with synaptic plasticity. II. Mechanism of synergistic modulation of thalamic activity via the direct and indirect pathways through the basal ganglia. Biosystems. 2001. 59 (1): 7–14.
Suga N. Tuning shifts of the auditory system by corticocortical and corticofugal projections and conditioning. Neurosci. Biobehav. Rev. 2012. 36 (2): 969–988.
Takahashi H., Funamizu A., Mitsumori Y., Kose H., Kanzaki R. Progressive plasticity of auditory cortex during appetitive operant conditioning. Biosystems. 2010. 101 (1): 37–41.
Takahashi H., Yokota R., Funamizu A., Kose H., Kanzaki R. Learning-stage-dependent, field-specific, map plasticity in the rat auditory cortex during appetitive operant conditioning. Neuroscience. 2011. 199: 243–258.
Talwar S.K., Gerstein G.L. Reorganization in awake rat auditory cortex by local microstimulation and its effect on frequency-discrimination behavior. J. Neurophysiol. 2001. 86 (4): 1555–1572.
Tang J., Yang W., Suga N. Modulation of thalamic auditory neurons by the primary auditory cortex. J. Neurophysiol. 2012. 108 (3): 935–942.
Thiel C.M. Pharmacological modulation of learning-induced plasticity in human auditory cortex. Restor. Neurol. Neurosci. 2007. 25 (3–4): 435–443.
Tostes J.G., Medeiros P., Melo-Thomas L. Modulation of haloperidol-induced catalepsy in rats by GABAergic neural substrate in the inferior colliculus. Neuroscience. 2013. 255: 212-218.
Voisin J., Bidet-Caulet A., Bertrand O., Fonlupt P. Listening in silence activates auditory areas: a functional magnetic resonance imaging study. J. Neuroscience. 2006. 26: 273–278.
van Zwieten G., Janssen M.L.F., Smit J.V., Janssen A.M.L., Roet M., Jahanshahi A., Stokroos R.J., Temel Y. Inhibition of experimental tinnitus with high frequency stimulation of the rat medial geniculate body. Neuromodulation. 2019. 22 (4): 416–424.
Weinberger N.M. The medial geniculate, not the amygdala, as the root of auditory fear conditioning. Hear. Res. 2011. 274 (1–2): 61–74.
Weinberger N.M. Associative representational plasticity in the auditory cortex: a synthesis of two disciplines. Learn. Mem. 2007a. 14 (1–2): 1–16.
Weinberger N.M. Auditory associative memory and representational plasticity in the primary auditory cortex. Hear. Res. 2007b. 229 (1–2): 54–68.
Weis T., Brechmann A., Puschmann S., Thiel C.M. Feedback that confirms reward expectation triggers auditory cortex activity. J. Neurophysiol. 2013. 110 (8): 1860–1868.
Weis T., Puschmann S., Brechmann A., Thiel C.M. Effects of L-dopa during auditory instrumental learning in humans. PLoS One. 2012. 7 (12): e52504.
Whalen P.J., Kapp B.S., Pascoe J.P. Neuronal activity within the nucleus basalis and conditioned neocortical electroencephalographic activation. J. Neurosci. 1994. 14 (3 Pt. 2): 1623–1633.
Wigestrand M.B., Schiff H.C., Fyhn M., LeDoux J.E., Sears R.M. Primary auditory cortex regulates threat memory specificity. Learn. Mem. 2016. 24 (1): 55–58.
Winkowski D.E., Bandyopadhyay S., Shamma S.A., Kanold P.O. Frontal cortex activation causes rapid plasticity of auditory cortical processing. J. Neurosci. 2013. 33 (46): 18134–18148.
Winkowski D.E., Nagode D.A., Donaldson K.J., Yin P., Shamma S.A., Fritz J.B., Kanold P.O. Orbitofrontal Cortex Neurons Respond to Sound and Activate Primary Auditory Cortex Neurons. Cereb. Cortex. 2018. 28 (3): 868–879.
Wright C.I., Groenewegen H.J. Patterns of overlap and segregation between insular cortical, intermediodorsal thalamic and basal amygdaloid afferents in the nucleus accumbens of the rat. Neuroscience. 1996. 73 (2): 359–373.
Xiong Q., Znamenskiy P., Zador A.M. Selective corticostriatal plasticity during acquisition of an auditory discrimination task. Nature. 2015. 521 (7552): 348–351.
Yasui Y., Nakano K., Kayahara T., Mizuno N. Non-dopaminergic projections from the substantia nigra pars lateralis to the inferior colliculus in the rat. Brain Res. 1991. 559 (1): 139–144.
Yuan G., Liu G., Wei D., Wang G., Li Q., Qi M., Wu S. Functional connectivity corresponding to the tonotopic differentiation of the human auditory cortex. Hum. Brain Mapp. 2018. 39 (5): 2224–2234.
Zhang J. Auditory cortex stimulation to suppress tinnitus: mechanisms and strategies. Hear Res. 2013. 295: 38–57.
Zhang Y., Hakes J.J., Bonfield S.P., Yan J. Corticofugal feedback for auditory midbrain plasticity elicited by tones and electrical stimulation of basal forebrain in mice. Eur. J. Neurosci. 2005. 22 (4): 871–879.
Znamenskiy P., Zador A.M. Corticostriatal neurons in auditory cortex drive decisions during auditory discrimination. Nature. 2013. 497 (7450): 482–485.
Дополнительные материалы отсутствуют.
Инструменты
Журнал высшей нервной деятельности им. И.П. Павлова


