Журнал высшей нервной деятельности им. И.П. Павлова, 2019, T. 69, № 6, стр. 680-699
НЕОНАТАЛЬНЫЙ ПРОВОСПАЛИТЕЛЬНЫЙ СТРЕСС И СОЗРЕВАНИЕ МЕЖКЛЕТОЧНОЙ КОММУНИКАЦИИ В ГИППОКАМПЕ
И. В. Кудряшова 1, *, М. Ю. Степаничев 1, Н. В. Гуляева 1
1 Федеральное государственное бюджетное учреждение науки
Институт высшей нервной деятельности и нейрофизиологии РАН
Россия, Москва
* E-mail: iv_kudryashova@mail.ru
Поступила в редакцию 06.03.2019
После доработки 15.05.2019
Принята к публикации 03.06.2019
Аннотация
Нейровоспалительные процессы, в частности, вызванные инфекционными агентами, ассоциированы с активацией микроглии и последующим увеличением секреции провоспалительных цитокинов. Провоспалительные стимулы, действующие в раннем постнатальном онтогенезе, являются стрессорным фактором и наряду с нейровоспалением запускают механизмы стрессорного ответа. Если провоспалительный стимул достаточно мощный, реакция на него может приводить к модификации стрессоустойчивости организма и повышению риска развития психопатологий, сопровождающихся когнитивными нарушениями, на более поздних этапах онтогенеза, в том числе у взрослых. В обзоре рассмотрены некоторые механизмы, связанные, в частности, с функциями медиаторных систем, систем нейротрофинов, цитокинов и глюкокортикоидов, которые определяют созревание межклеточных коммуникаций в гиппокампе на фоне нейровоспаления и последствий нарушений этого процесса.
ВВЕДЕНИЕ
Инфекционные заболевания в пренатальном и неонатальном возрасте создают неблагоприятный фон для развития мозга, увеличивая риск развития церебральных патологий [Blume et al., 2011; Capuron, Miller, 2011; Krishnadas, Cavanagh, 2012; Maes et al., 2012]. Например, дети, родившиеся с высокой степенью недоношенности вследствие развития воспалительных процессов, таких как некротизирующий энтероколит или менингит, демонстрируют выраженные нарушения психического и физического развития [van Vliet et al., 2013]. Одним из факторов риска является нейровоспаление, ассоциированное с активацией микроглии [Krishnadas, Cavanagh, 2012; Kettenmann et al., 2013]; такая активация может поддерживаться в течение длительного времени [Williamson et al., 2011; Sominsky et al., 2012; Wang et al., 2013]. Роль микроглии в развивающемся мозге связывают с оптимизацией формирующихся нейронных структур за счет элиминации неработающих или малоактивных синапсов и “лишних” нейронов [Bilimoria, Stevens, 2015; Wu et al., 2015; Mosser et al., 2017; Tay et al., 2017]. Нарушение нормального функционирования микроглии может быть одной из причин развития хронических заболеваний мозга, прежде всего расстройств аутистического спектра и шизофрении [Stephan et al., 2012; Eyo, Wu, 2013; Mosser et al., 2017; Neniskyte, Gross, 2017]. Структурно-функциональное созревание высших отделов мозга происходит постнатально в течение достаточно длительного времени [Dumas, 2005], в частности, в гиппокампе крыс наиболее интенсивный процесс синаптогенеза приходится на 2–3 нед жизни. Можно предположить, что патологические последствия нейровоспаления именно в этот критический период развития наиболее существенны.
Нейровоспалительные процессы, вызванные инфекционными агентами, сопровождаются увеличением концентрации в ликворе провоспалительных цитокинов, в т.ч. интерлейкина (ИЛ)-1β, фактора некроза опухоли (ФНО)-α и ИЛ-6 [Krebs et al., 2005], что отражает изменения их содержания в мозге. Провоспалительные цитокины активируют основную нейроэндокринную систему, гипоталамо-гипофизарно-надпочечниковую систему (ГГНС), центральное звено стрессорной реакции организма [Mouihate, 2013]. Активация ГГНС приводит к синтезу и секреции глюкокортикоидов (кортизола у человека, кортикостерона (КС) у грызунов), действие которых на воспалительные процессы зависит от ткани и конкретной ситуации. С одной стороны, глюкокортикоиды обладают выраженным антивоспалительным эффектом (и это их свойство давно используют в клинике), а с другой стороны могут усиливать секрецию цитокинов в мозге, инициируя нейровоспаление. Увеличение секреции кортизола рассматривают как проявление ответа на действие инфекции как интероцептивного стрессора [Григорьян и др., 2014; Stepanichev et al., 2014]. Повышенный уровень КС оказывает влияние на метапластичность синапсов [Sharvit et al., 2015; Radahmadi et al., 2014; Kamal et al., 2014; Park et al., 2015], хотя увеличение содержания глюкокортикоидов не коррелирует однозначно с изменением свойств долговременной пластичности [Kim et al., 2006; Joels, Krugers, 2007; Кудряшова, Гуляева, 2016].
Выраженный рост психических расстройств в последние годы привлек внимание исследователей к долговременным последствиям действия стресса, в т.ч. инфекционного, на ранних этапах онтогенеза, поскольку аверсивные события в раннем возрасте демонстрируют очевидные ассоциации с развитием психопатологий у подростков и взрослых. Поскольку психические расстройства стрессорного генеза, как правило, ассоциированы с нарушениями когнитивной сферы, мы рассмотрим возможные механизмы модификации межклеточных, включая синаптическую, коммуникаций в гиппокампе, которые происходят при активации нейровоспаления в раннем онтогенезе.
НЕЙРОВОСПАЛЕНИЕ В РАННЕМ ОНТОГЕНЕЗЕ И ЕГО МОДЕЛИРОВАНИЕ У ЖИВОТНЫХ
Термин “нейровоспаление” активно используется в литературе с середины 1990-х годов Нейровоспаление определяют как стереотипную неспецифическую к инициирующему стимулу реакцию нервной ткани, для которой характерна активация тканевых макрофагов (микроглии), сопровождающаяся увеличением уровня провоспалительных цитокинов в ткани и активацией системы комплемента. Микроглия сегодня рассматривается как основной компонент иммунной защиты мозга, что определяет важность исследования микроглии для клеточной нейроиммунологии и нейровоспаления как такового. Нейровоспаление не является аналогом иммунного ответа организма на действие патогенов, связанного с работой набора специализированных Т-лимфоцитов и продукцией антител. Напротив, нейровоспаление представляет собой часть врожденной иммунной системы, которая и реализует адаптивный иммунный ответ [Medzhitov, Janeway, 2000]. В настоящее время принято считать, что нейровоспаление является патогенным фактором многочисленных заболеваний ЦНС, которые развиваются без инфильтрации лейкоцитов, вовлеченных в адаптивный иммунный ответ, но с участием активированных микроглиоцитов и астроцитов [Тишкина и др., 2014; Streit et al., 2004].
В развивающемся мозге нейровоспаление является следствием действия многих факторов, которые могут иметь инфекционную (инфекция плода или матери) и неинфекционную природу (гипоксия/ишемия) [Mottahedin et al., 2017]. Новорожденные младенцы также уязвимы к бактериальным инфекциям, которые могут приводить к развитию менингитов и накоплению провоспалительных цитокинов в ткани мозга с последующим нарушением созревания процессов межклеточной коммуникации [Krebs et al., 2005]. В экспериментальных моделях нейровоспаление индуцируют введением суспензий бактериальных клеток, комбинации полиинозиновой и полицитидиловой кислот или липополисахарида [Григорьян и др., 2014; Малиновская и соавт., 2016; Dinel et al., 2014; Williamson, Bilbo, 2014]. Даже при периферическом введении эти вещества провоцируют центральный ответ, сопровождающийся изменением состояния микроглии и астроглии и усилением продукции провоспалительных цитокинов (рис. 1).
Рис. 1.
Принципиальная схема экспериментов по исследованию влияния провоспалительного стресса в раннем онтогенезе на изменения долговременной пластичности. Провоспалительные стимулы, применяемые в течение первых двух недель после рождения, вызывают развитие нейровоспаления в мозге на клеточном и молекулярном уровне. Это способствует поддержанию воспалительных процессов в мозге подростков и взрослых животных. Активация пластических процессов (обучение или индукция долговременной потенциации (ДП)/депрессии (ДД)) также провоцирует нейровоспаление у животных, перенесших провоспалительный стресс в неонатальный период развития. ГГНО – гипоталамо-гипофизарно-надпочечниковая ось; КС – кортикостерон; ПНД – постнатальный день; АФК – активные формы кислорода.
Fig. 1. General protocol of experiments to study the effects of proinflammatory stress in early ontogeny on modifications of long-term plasticity. Proinflammatory stimuli, applied during the first two weeks after birth, induce neuroinflammation in the brain on cellular and molecular levels. This allows maintaining inflammatory processes in the brain of adolescents and adult animals. Activation of plasticity, including learning, or induction of long-term potentiation (ДП)/depression (ДД), also provokes neuroinflammation in the animals experienced proinflammatory stress in the neonatal period. ГГНО – hypothalamo-pituitary-adrenal axis; КС – corticosterone; ПНД – postnatal day; АФК – reactive oxygen species.
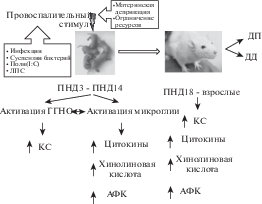
Введение бактериального липополисахарида (ЛПС) является одним из наиболее распространенных способов индукции нейровоспаления у новорожденных грызунов. Периферическое введение ЛПС приводит к выраженной активации микроглии и увеличению содержания цитокинов в структурах мозга [Sominsky et al., 2012]. Важно, что при этом происходит ингибирование процесса закономерной гибели избыточного числа нейронов и олигодендроцитов в онтогенезе, что, несомненно, способствует патологиям формирования зрелого мозга [Pang et al., 2016]. Наряду с непосредственным провоспалительным воздействием, введение ЛПС в раннем онтогенезе вызывает выраженный стрессорный ответ: усиленный синтез и секреция стрессорных гормонов и изменения сигнальных каскадов глюкокортикоидов в мозге [Amath et al., 2012; Stepanichev et al., 2014; Tishkina et al., 2016]. Взрослые животные, подвергнутые однократной или повторным инъекциям ЛПС разных серотипов в раннем постнатальном периоде, демонстрируют признаки тревожного и депрессивно-подобного поведения [Walker et al., 2004; 2009; Wang et al., 2013; Sominsky et al., 2012, 2013; Tishkina et al., 2016]; при этом в мозге наблюдается нарушение экспрессии генов, связанных с серотонергической системой [Sidor et al., 2010].
Нейровоспаление не обязательно является последствием периферического действия провоспалительных стимулов. Внешние стрессорные факторы в период раннего развития способны вызывать клеточные и молекулярные изменения нейровоспалительной природы в мозге животных. Так, нарушения памяти, обусловленные содержанием матери и приплода в условиях ограничения ресурсов для строительства гнезда [Brunson et al., 2005; Walker et al., 2017] и сопровождающиеся дегенерацией отростков нейронов, ассоциированы с активацией иммунного ответа в гиппокампе [Hoeijmakers et al., 2015]. Активация микроглии и рост показателей нейровоспаления были обнаружены и в другой популярной модели депрессивно-подобного состояния, индуцированного нарушением материнской заботы (maternal separation/deprivation). Эти признаки наблюдались у животных подросткового возраста и взрослых особей [Giridharan et al., 2019; Réus et al., 2017].
Поскольку было показано, что развитие ЦНС в условиях нейровоспаления ассоциировано с дефицитом памяти [Bilbo et al., 2005; Harré et al., 2008; Kohman et al., 2008; Tishkina et al., 2016], были предприняты исследования, в которых продемонстрированы нарушения основополагающих механизмов, лежащих в основе обучения и, в частности, долговременной пластичности синапсов. На первый взгляд, представляется весьма заманчивым напрямую связать когнитивные нарушения с неспособностью к образованию между популяциями нейронов эффективных функциональных взаимодействий, необходимых для реализации новых форм приобретенного поведения. Относительно гиппокампа как структуры, прочно связанной с механизмами памяти, такая точка зрения представлена в целом ряде работ [Kim et al., 2006; Howland, Wang, 2008; Finsterwald, Alberini, 2014].
Механизмы долговременной пластичности, так же как и способность к обучению, ослабленные на фоне нейровоспаления у взрослых животных, постепенно восстанавливаются до нормального уровня [Maggio et al., 2013; Liraz-Zaltsman et al., 2013]. Прямой эффект неонатального нейровоспаления с возрастом, возможно, проходит [Wang et al., 2013], и поэтому не всегда удается выявить очевидные нарушения памяти в экспериментах на животных без дополнительных, повторно провоцирующих нейровоспаление воздействий [Järlestedt et al., 2013; MacRae et al., 2015; Foley et al., 2014; Osborne et al., 2017]. Тем не менее в ряде случаев дефицит долговременной потенциации и памяти у взрослых крыс, перенесших нейровоспаление в раннем возрасте, наблюдается и без применения явно провоцирующих факторов [Dinel et al., 2014; Lan et al., 2015; Tishkina et al., 2016; Onufriev et al., 2017; Trofimov et al., 2017]. Однако весьма вероятно, что в качестве провоцирующего фактора может выступать сама процедура обучения [Bilbo et al., 2008; Williamson et al., 2011] или некоторые процедуры тестирования поведения [Yirmiya, Goshen, 2011; Trofimov et al., 2017], которые для животных являются значимыми стрессорными факторами. Следует учитывать, что высокая вариабельность свойств долговременной потенциации затрудняет детекцию и оценку значимости эффектов неонатального нейровоспалительного процесса на эту форму долговременной пластичности, которую ассоциируют с механизмами памяти. Влияние условий стимуляции на результат, отсутствие прямых корреляций с нарушениями памяти и ряд других проблем осложняют интерпретацию этих данных. В следующих разделах мы рассмотрим возможные механизмы, которые влияют на созревание межклеточной коммуникации в гиппокампе в условиях стресса, вызванного неонатальным провоспалительным стимулом, и оказывают воздействие на свойства долговременной пластичности.
СОЗРЕВАНИЕ ГЛУТАМАТЕРГИЧЕСКОЙ ТРАНСМИССИИ И ДОЛГОВРЕМЕННАЯ ПОТЕНЦИАЦИЯ В ГИПОКАМПЕ ПОСЛЕ НЕОНАТАЛЬНОГО ПРОВОСПАЛИТЕЛЬНОГО СТРЕССА
Долговременная пластичность синапсов ЦНС считается одним из основополагающих механизмов, лежащих в основе индивидуального опыта. Феномен долговременной потенциации представляет одну из наиболее распространенных моделей долговременной синаптической пластичности, которая позволяет изучать процессы, происходящие в синапсах при формировании памяти [Скребицкий, Штарк, 2012]. Модель долговременной потенциации широко используется при исследовании влияния разнообразных факторов на долговременную пластичность синапсов в условиях нормы и при патологии. В основе долговременной потенциации лежит комплекс модификаций, последовательность которых регулируется множеством внеклеточных и внутриклеточных сигналов [Gulyaeva, 2017a]. Индукция долговременных модификаций происходит в ответ на увеличение внутриклеточного содержания кальция. В гиппокампе это имеет место преимущественно при активации N-метил-D-аспартатных (NMDA) рецепторов, хотя дополнительным источником может служить вход кальция по потенциал-управляемым каналам.
Характер модификаций во многом зависит от величины и длительности Сa2+ сигнала и, следовательно, от степени деполяризации при индукции. Активация Ca2+-зависимых ферментов приводит к посттрансляционным изменениям синаптических белков, в частности фосфорилированию глутаматных рецепторов [Routtenberg, Rekart, 2005]. Необходимо, однако, отметить, что такие состояния белков, как правило, нестабильны и нуждаются в постоянном присутствии соответствующего фермента. По этой причине сами по себе они не способны обеспечить поддержание потенциации в отдаленные сроки [Abraham, Williams, 2008]. Помимо самопроизвольного восстановления, например, при недостаточно интенсивной тетанизации, депотенциация может развиваться в ходе текущей синаптической активации [Rex et al., 2009]. Это означает, что модификации постсинаптических рецепторов, несмотря на их преимущественный вклад в суммарную потенциацию, недостаточно для длительного поддержания долговременной потенциации [Blundon, Zakharenko, 2008], которое зависит от молекулярных процессов, протекающих в период консолидации, когда принимается решение о необходимости сохранения долговременных синаптических модификаций [Gal-Ben-Ari et al., 2012; Кудряшова, 2013].
Один из важных факторов, которые могут оказывать влияние на процессы долговременной пластичности в условиях нейровоспаления или вызванных им последствий – модификация глутаматной нейротрансмиссии. При активации микроглии образуется хинолиновая кислота, природный агонист NMDA-рецепторов [Krishnadas, Cavanagh 2012], что приводит к их тонической активации. В сочетании с низкой активностью глутаматных транспортеров этот механизм может представлять эффективный путь нейродегенеративных изменений, сходный с таковым, описанным при депрессивных расстройствах [Gulyaeva, 2017b]. Даже если выраженные нейродегенеративные изменения не происходят, нейровоспаление, учитывая роль NMDA-зависимой долговременной пластичности в процессах обучения и памяти [Скребицкий, Штарк, 2012; Gulyaeva, 2017a], может приводить к отклонениям в формировании индивидуального опыта, что в период созревания нейронных ансамблей является одним из факторов риска развития устойчивых психопатологических состояний.
Провоспалительное воздействие в период внутриутробного созревания ЦНС плода приводит к дефициту долговременной потенциации в гиппокампе [Lante et al., 2008; Escobar et al., 2011; Chen et al., 2013; Rideau Batista Novais et al., 2014]. Неонатальное введение ЛПС грызунам также приводит к нарушениям долговременной потенциации [Кудряшова и др., 2018; Onufriev et al., 2017; Harré et al., 2008; Escobar et al., 2011; Tishkina et al., 2016]. В наших экспериментах было обнаружено, что развитие гиппокампа в условиях неонатального провоспалительного стресса приводит к изменению свойств долговременной пластичности синапсов, делая их более устойчивыми к индукции долговременной потенциации [Кудряшова и др., 2018]. Несмотря на то что двукратное введение ЛПС новорожденным животным в среднем приводит к снижению долговременной потенциации, высокая индивидуальная вариабельность такой реакции дает основание предполагать наличие комплекса разнонаправленных модификаций, определяющих разную устойчивость к действию неонатального провоспалительного стресса на межклеточную коммуникацию.
Оказалось, что главной причиной дефицита долговременной потенциации является низкая вероятность ее индукции в срезах гиппокампа, полученных от крыс, перенесших инъекцию ЛПС. Было показано, что это прежде всего сказывается на средней величине ранней потенциации, вследствие чего снижена поздняя долговременная потенциация [Кудряшова и др., 2018; Onufriev et al., 2017; Tishkina et al., 2016]. Тем не менее нет полной уверенности в том, что при этом страдают основополагающие механизмы долговременной пластичности. В поле СА1 индукция долговременной потенциации в основном зависит от входящего по NMDA-каналам Са2+, и это один из базовых механизмов, вовлеченных во многие функции нейрона. Вряд ли корректно было бы объяснять дефицит долговременной потенциации нарушением жизненно важных функций, опосредованных глутаматной трансмиссией с участием NMDA-рецепторов. К тому же долговременная пластичность вносит существенный вклад в развитие нейропатологии, причем в основе нормальной и аберрантной пластичности лежат одни и те же молекулярные механизмы [Балабан, Гуляева, 2006; Gulyaeva, 2017а; McEachern, Shaw, 1999]. Полагают, что “изменение нормальной пластичности при нейропатологии не означает исчезновения способности к пластичности, но свидетельствует об изменении формы пластичности” [Gulyaeva, 2017а].
Непосредственно в момент нейровоспаления NMDA-зависимая долговременная пластичность чаще всего действительно нарушена и при этом снижается экспрессия некоторых важных для долговременной пластичности субъединиц NMDA-рецепторов [Riazi et al., 2015; Liraz-Zaltsman et al., 2016]. Считают, что такое нарушение функций NMDA-рецепторов может быть связано не столько с прямым действием ЛПС, сколько с вызванным им окислительным стрессом [Cambonie et al., 2004; Lante et al., 2007; MacRae et al., 2015]. Тем неожиданнее было обнаружение двух возрастных периодов, в течение которых введение ЛПС вызывает увеличение экспрессии ключевых для долговременной пластичности субъединиц NMDA-рецепторов NR1, NR2B и D [Harré et al., 2008]. Эта работа демонстрирует падение экспрессии NR1 субъединиц только к 77 постнатальному дню. Изменения экспрессии NMDA-рецепторов в гиппокампе происходят в условиях продолжающегося развития и созревания межнейронных взаимодействий и, в частности, тех функций, которые в норме опосредованы NMDA-рецепторами [Wenzel et al., 1997]. Следовательно, функции NMDA-рецепторов у достаточно молодых животных не нарушаются, а возможно, и активируются, тем более, что показано, как активное состояние микроглии и связанное с ним перманентное увеличение продукции цитокинов оказывают активирующее влияние на некоторые компоненты NMDA-трансмиссии [Viviani et al., 2003; Hayashi et al., 2006]. Не исключено, что в активации NMDA-рецепторов может участвовать секретируемый активной микроглией мозговой нейротрофический фактор (brain-derived neurotrophic factor, BDNF) [Parkhurst et al., 2013]. На фоне возрастных изменений может преобладать тот или иной тип реакции [Spencer et al., 2006; Harré et al., 2008].
РОЛЬ ЦИТОКИНОВ В МОДИФИКАЦИИ ДОЛГОВРЕМЕННОЙ ПЛАСТИЧНОСТИ ВСЛЕДСТВИЕ НЕОНАТАЛЬНОГО ПРОВОСПАЛИТЕЛЬНОГО СТРЕССА
Как отмечалось выше, одним из последствий неонатального провоспалительного стресса является усиление эксайтотоксичности, обусловленное модификацией глутаматной трансмиссии. Ассоциированная с нейровоспалением активация микроглии в критический период развития может способствовать более интенсивной элиминации синапсов [Schafer et al., 2012; Stephan et al., 2012; Ji et al., 2013]. В пользу этого свидетельствуют экспериментальные данные о снижении плотности нейронов и синапсов [Fan et al., 2008; Kellom et al., 2012; Han et al., 2017]. Аномальные изменения в структурной организации нейронных ансамблей коррелируют с содержанием ИЛ-6 [Harrison et al., 2009], так что увеличение его экспрессии после неонатального введения ЛПС [Onufriev et al., 2017] можно, по-видимому, рассматривать как свидетельство возникновения “анатомической” основы не только депрессивно-подобного поведения [Kubera et al., 2010; Piser, 2010; Eyre, Baune, 2012], но и нарушений индукции долговременной потенциации. Одной из причин дефицита долговременной потенциации при этом может оказаться слишком слабый входной сигнал [Кудряшова и др., 2018].
Функции микроглии включают в том числе и гомеостатическую регуляцию активности нейронов [Schafer et al., 2013; Pribiag, Stellwagen, 2014; Wu et al., 2015; Matcovitch-Natan et al., 2016]. Ограничение избыточного возбуждения нейронов [Li et al., 2012; Pascual et al., 2012], и соответственно пресинаптические механизмы наблюдаемой после ЛПС депрессии синаптических потенциалов связывают с увеличением содержания ИЛ-1β [Vereker et al., 2013; Anaeigoudari et al., 2016; Han et al., 2017]. Секреция ФНОα, напротив, способствует активации нейронных ансамблей после длительного периода относительного молчания [Golan et al., 2004; Stellwagen, Malenka, 2006] предположительно за счет подавления активности тормозных синапсов [Pribiag, Stellwagen, 2013, Gullo et al., 2014]. В тех случаях, когда вследствие нейровоспаления происходит увеличение содержания ФНОα, амплитуда α-амино-3-гидрокси-5-метил-4-изоксазолпропионатных (AMPA)- и NMDA-токов в нейронах гиппокампа становится значимо больше нормы [Riazi et al. 2015]; этот эффект обнаружен при прямом действии ЛПС на нейроны переживающих срезов гиппокампа [Pascual et al., 2012]. Таким образом, нарушение цитокинового сигналинга вследствие нейровоспаления может приводить как к снижению, так и к увеличению фоновой активности и синаптических реакций на поступающие извне сигналы [Khairova et al., 2009; Yirmiya et al., 2011; Pascual et al., 2012; Wu et al., 2015], при этом оба типа отклонений отрицательно сказываются на индукции долговременной потенциации [Кудряшова, 2017]. Тип нарушений, по всей видимости, зависит от возраста [Harré et al., 2008], половых особенностей, связанных с рапределением микроглии в ЦНС [Schwarz, Bilbo, 2012], а также индивидуальной предрасположенности и, возможно, индивидуального опыта [Williamson et al., 2011].
Постинфекционное увеличение реактивности микроглии может модифицировать ее участие в долговременной пластичности и, в частности, в долговременной потенциации [Ben Achour, Pascual, 2010; Schafer et al., 2013]. Известно, что активация нейронов стимулирует двигательную активность микроглиальных филоподий и их взаимодействие с синапсами [Li al., 2012, Eyo, Wu, 2013, Morris et al., 2013, Schafer et al., 2013]. Тот же эффект наблюдается при активации NMDA-рецепторов [Dissing-Olesen et al., 2014]. Активная микроглия реагирует на увеличение концентрации глутамата и участвует в его захвате [Schwartz et al., 2003], тем самым истощая запас синаптического медиатора. Увеличение концентрации цитокинов выше оптимального уровня отрицательно сказывается на индукции долговременной потенциации [Goshen et al., 2007; Besedovsky, del Rey, 2011; Santello, Volterra, 2012]. К быстрым реакциям на высвобождаемые в ответ на тетанизацию цитокины относятся модификации свойств ионных каналов, причем эффекты, в зависимости от дозы, могут быть противоположными [Viviani et al., 2007; Park, Bowers, 2010]. ИЛ-1β подавляет фосфорилирование и экспрессию AMPA-, но не NMDA-рецепторов [Lai et al., 2006].
Цитокины являются модуляторами долговременной пластичности синапсов [Степаничев, 2005; Levin, Godukhin, 2017; Donzis, Tronson, 2014] и могут быть сигналом для структурной реорганизации синапсов [Khairova et al., 2009; Yirmiya, Goshen, 2011; Wu et al., 2015]. Неонатальный провоспалительный стресс не приводит к заметным изменениям фонового содержания ИЛ-1β и ФНО-α в мозге молодых животных в состоянии покоя [Bilbo et al., 2005; Onufriev et al., 2017], однако повышение ИЛ-1β в ответ на соответствующие сигналы существенно больше у таких животных, чем в норме [Bilbo et al., 2005, 2008], и этот эффект более выражен у молодых самок [Osborne et al., 2017]. В качестве сигналов, провоцирующих увеличение ИЛ-1β в гиппокампе, могут выступать процедура обучения [Bilbo et al., 2008] и долговременная потенциация [Bilbo et al., 2005], которые сопровождаются увеличением экспрессии рецепторов ИЛ-1β [Schneider et al., 199; Bilbo et al., 2008], а блокада этих рецепторов приводит к нарушениям долговременной потенциации и обучения [Goshen et al., 2007; Labrousse et al., 2009; Schmid et al., 2009].
Секреция интерлейкинов повышается в различных патологических ситуациях, и это становится звеном развития патологии, однако оптимальная концентрация ИЛ-1β [Brennan et al., 2003; Spulber et al., 2009], ФНО-α [Beattie et al., 2002] и ИЛ-6 [Eyre, Baune, 2012] необходима для успешного обучения и запоминания, а также для поддержания долговременной потенциации [Yirmiya, Goshen, 2011; Eyre, Baune, 2012]. ИЛ-1β участвует в регуляции экспрессии металопротеиназ [Wu et al., 2009], стимулирует взаимодействие с астроцитами и их метаболическую и трофическую поддержку, необходимую в процессе консолидации, в том числе и при долговременной потенциации [Del Rey et al., 2006; Ben Menachem-Zidon et al., 2011]. Реакция астроцитов на увеличение концентрации ИЛ-1β сопровождается секрецией ФНО-α и ИЛ-6 [Eyre, Baune, 2012]. Влияние неонатального провоспалительного стресса на индуцируемые долговременной потенциацией сигнальные каскады, включающие ФНО-α и ИЛ-6, изучено слабо, хотя эти цитокины, так же как и ИЛ-1β, могут блокировать индукцию долговременной потенциации при увеличении концентрации выше порогового уровня [Eyre, Baune, 2012]. ФНО-α способствует растормаживанию и встраиванию в мембрану AMPA- и NMDA-рецепторов [Khairova et al., 2009; Pribiag, Stellwagen, 2013]. Он оказывает дифференцированное влияние на раннюю и позднюю фазу долговременной потенциации [Butler et al., 2004]. Долговременная потенциация сопровождается не зависимым от NMDA-рецепторов увеличением экспрессии ИЛ-6 [Balschun et al., 2004], которое облегчает консолидацию [Viviani et al., 2007], повышая вклад процессов, связанных с экспрессией генов [Islam et al., 2009]. При высокой концентрации ИЛ-6, обнаруженной в гиппокампе крыс в отдаленный период после перенесенного неонатального провоспалительного стресса [Abareshi et al., 2016; Onufriev et al., 2017; Osborne et al., 2017], может быть ослаблена межклеточная адгезия, что способствует дестабилизации синапсов [Wei et al., 2011] и, как следствие, их большей подверженности структурным модификациям, в том числе более активному обновлению в процессе консолидации. В пользу этого свидетельствует также постинфекционное увеличение ИЛ-10 [Osborne et al., 2017], который, как полагают, стимулирует синаптогенез [Lim et al., 2013]. Остается открытым вопрос, может ли тетанизация даже в патологических условиях обеспечить достаточный для подавления долговременной потенциации прирост цитокинов.
ИЗМЕНЕНИЯ НЕЙРОТРОФИНОВОГО ОБЕСПЕЧЕНИЯ ДОЛГОВРЕМЕННОЙ ПЛАСТИЧНОСТИ ВСЛЕДСТВИЕ НЕОНАТАЛЬНОГО ПРОВОСПАЛИТЕЛЬНОГО СТРЕССА
Обсуждая проблему созревания процессов межклеточной коммуникации в гиппокампе животных, перенесших неонатальный провоспалительный стресс, невозможно обойти вопрос нейротрофического обеспечения. Существует ли корреляция между дефицитом долговременной потенциации и уровнем трофической поддержки, в первую очередь обеспечения BDNF? Полагают, что долговременная потенциация хуже развивается без трофической поддержки [Williamson, Bilbo, 2013; Mottahedin et al., 2017], однако после периферического введения ЛПС содержание BDNF, за редким исключением [Guan, Fang, 2006], не только не снижается [Перегуд и др., 2016; Shaw et al., 2001; Bilbo et al., 2008; Dinel et al., 2014; Onufriev et al., 2017], но может даже увеличиваться [Chen et al., 2014] вне зависимости от пола животных [Custódio et al., 2017]. Обнаруженный после неонатального введения ЛПС меньший прирост BDNF в ответ на индуцирующие долговременную пластичность сигналы внешней среды [Williamson et al., 2012], по нашему мнению, может объясняться не столько нарушением процессинга BDNF, сколько исходно слабым входным сигналом, недостаточным для активации трансдукции сигнала BDNF. Так, периферическое введение ЛПС блокирует долговременную потенциацию и одновременно увеличивает экспрессию пан-нейротрофинового рецептора p75NTR [Hennigan et al., 2007]. В отличие от специфичных для зрелых форм нейротрофинов тирозинкиназных рецепторов, способствующих поддержанию долговременной пластичности, p75NTR обеспечивает развитие долговременной депрессии [Rösch et al., 2005], и повышение его экспрессии может опосредовать склонность к синаптической депрессии, которую вызывает неонатальный провоспалительный стресс [Кудряшова и др., 2018].
Источником BDNF в гиппокампе животных, перенесших ранний провоспалительный стресс, может быть активная микроглия, участие которой в регуляции нейросетевой пластичности и структурно-функциональной адаптации нейронных ансамблей к нуждам приспособительного поведения не ограничивается ранним онтогенезом [Yirmiya, Goshen, 2011; Kohman, Rhodes, 2013]. Эксперименты подтверждают, что у взрослых животных взаимодействие нейронов и глии также является необходимым условием формирования памяти [Rogers et al., 2011]. Процесс консолидации тесно связан с реорганизацией шипикового аппарата, включающей элиминацию старых и образование новых шипиков [Yirmiya, Goshen, 2011; Parkhurst et al., 2013]. Вполне вероятно, что элиминация шипиков может способствовать их более активному обновлению [Bitzer-Quintero, Gonzalez-Burgos, 2012], тем более, что контакты микроглиальных отростков с синапсом коррелируют как с элиминацией, так и с появлением новых шипиков [Tremblay, Majewska, 2011]. Секретируемый микроглией BDNF принимает участие в образовании шипиков [Parkhurst et al., 2013]. Косвенным свидетельством изменения свойств структурной пластичности является влияние периферического введения ЛПС на экспрессию металлопротеиназ [Trofimov et al., 2017], участвующих в ремоделинге дендритных шипиков и синапсов [Michaluk et al., 2011; Vafadari et al., 2016]. К тому же от активности металлопротеиназ зависит поздняя фаза долговременной потенциации [Okulski et al., 2007; Wang et al., 2008]. Можно предположить, что более активное участие микроглии в процессе консолидации может способствовать структурной пластичности синапсов и, как следствие, поддержанию долговременной потенциации.
Как было отмечено ранее, дефицит долговременной потенциации в поле СА1 гиппокампа крыс, возникающий вследствие нейровоспаления, связан преимущественно с нарушением механизмов ее индукции. Вместе с тем, если порог индукции был преодолен, то поддержание потенциации существенно не меняется [Кудряшова и др., 2018], а согласно нашим данным, до некоторой степени улучшается. Такое сочетание дефицита индукции с нормальной экспрессией долговременной потенциации характерно для новорожденных животных [Liao, Malinow, 1996]. Вполне вероятно, что ослабление необходимого для индукции долговременной потенциации сигнала частично компенсируется влиянием раннего провоспалительного стресса на развитие тормозных интернейронов и синапсов [Nouel et al., 2012], что ограничивает вклад тормозных синапсов в реакцию на тетанизацию, в том числе в поле СА1 [Rideau Batista Novais et al., 2014]. Это улучшает синхронизацию постсинаптических реакций [Chen et al., 2014], но может провоцировать развитие судорожной активности [Galic et al., 2008; Vezzani et al., 2008] и эксайтотоксическое повреждение нервной ткани [Chen et al., 2013]. Изменения такого типа наблюдались в наших собственных экспериментах на срезах гиппокампа самцов крыс, перенесших ранний провоспалительный стресс [Кудряшова и др., 2018].
Известно, что тормозный медиатор ГАМК ограничивает двигательную реакцию микроглиальных отростков [Fontainhas et al., 2011], и, возможно, именно поэтому успешность консолидации долговременной потенциации зависит от степени растормаживания [Кудряшова, 2015]. Не исключено, что улучшение поддержания долговременной потенциации может быть связано с изменением реактивности микроглии. Однако даже если реакция микроглии на высвобождаемый при высокочастотном раздражении глутамат остается неизменной, ограничение тормозных влияний позволяет стимулировать постсинаптические механизмы консолидации даже в условиях недостаточно интенсивного входного сигнала. В частности, дефицит деполяризации может компенсировать деполяризационный сдвиг потенциала реверсии для ГАМК-тока под влиянием секретируемого микроглией BDNF [Schafer et al., 2013].
МЕХАНИЗМЫ СТРЕССА И ПОЛОВЫЕ ОСОБЕННОСТИ ЭФФЕКТОВ НЕОНАТАЛЬНОГО ПРОВОСПАЛИТЕЛЬНОГО СТИМУЛА НА ДОЛГОВРЕМЕННУЮ ПЛАСТИЧНОСТЬ
Действие неонатального провоспалительного стимула и вызываемого им нейровоспаления приводит к изменению стресс-реактивности, наблюдающемуся на более поздних стадиях онтогенеза [Dinel et al., 2014; Tishkina et al., 2016; Trofimov et al., 2017]. Считается, что повышенный уровень КС, базового или индуцированного стрессом [Bilbo et al., 2005; Girard-Joyal et al., 2015; Tishkina et al., 2016], может влиять на метапластичность синапсов, меняя порог модификаций в сторону преобладания долговременной депрессии [Sharvit et al., 2015; Radahmadi et al., 2014; Kamal et al., 2014; Park et al., 2015]. Тем не менее увеличение содержания глюкокортикоидов не коррелирует однозначно с изменением свойств долговременной пластичности [Кудряшова, Гуляева, 2016; Kim et al., 2006; Joels, Krugers, 2007]. Оказалось, что КС может как активировать, так и ингибировать долговременную потенциацию [Joels et al., 2009; Martin et al., 2009]. Более того, ряд фактов свидетельствуют о том, что глюкокортикоиды способствуют консолидации [Кудряшова, Гуляева, 2016; Huang et al., 2005; Joels, Krugers, 2007; Maggio, Segal, 2012]. Агонисты глюкокортикоидных рецепторов усиливают NMDA-зависимый Са2+ ток [Joels et al., 2003; Yuen et al., 2011; Yang et al., 2008]. Активация глюкокортикоидных и минералокортикоидных рецепторов считается одним из факторов, участвующих в регуляции транскрипции генов [McEwen, 2007; Polman et al., 2013], а на фоне блокады глюкокортикоидных рецепторов активации ключевых для консолидации ферментов не происходит [Huang et al., 2005; Yang et al., 2008]. Блокада глюкокортикоидных рецепторов приводит к нарушению долговременной потенциации, а их агонисты, наоборот, улучшают процесс консолидации [Nikzad et al., 2011]. При дефиците глюкокортикоидов снижается эффективность поддержания долговременной потенциации [Diamond et al., 1992; Yamada et al., 2003], а слабая потенциация неонатально стрессированных крыс восстанавливается до нормального уровня после аппликации КС [Champagne et al., 2008]. Улучшение процесса консолидации может быть связано с участием глюкокортикоидов в структурной пластичности синапсов [Lin, Koleske, 2010; Liston, Gan, 2011].
Циркадианные пики глюкокортикоидов и усиление их секреции при умеренных стрессорных нагрузках приводят к адаптивным изменениям, при этом за счет нескольких петель обратной связи избыток глюкокортикоидов снижает активность ГГНС, ограничивая собственные синтез и секрецию [Besedovsky et al., 1986; Finsterwald, Alberini, 2014; Trofimov et al., 2017]. В ЦНС животных КС взаимодействует с глюкокортикоидными рецепторами, а в некоторых структурах, в т.ч. гиппокампе, эксперессированы также минералокортикоидные рецепторы. Последние имеют более высокое сродство к лиганду и считаются основными в первичной, быстрой реакции на КС [de Kloet et al., 2005; Joels et al., 2008]. При небольшой концентрации выбрасываемого в ответ на сигнал КС он взаимодействует в первую очередь с мембранными минералокортикоидными рецепторами, оказывая быстрые негеномные эффекты [Joëls et al., 2012], а активация этих рецепторов способствует поддержанию долговременной потенциации [Joels, Krugers, 2007; Maggio, Segal, 2012]. Повышение уровня КС может приводить к адаптационному подавлению активности внутриклеточных глюкокортикоидных рецепторов [Joels, Krugers, 2007; Maggio, Segal, 2012]. В частности, плотность и уровень экспрессии и фосфорилирования глюкокортикоидных рецепторов снижены в гиппокампе животных после неонатального провоспалительного стресса [Shanks et al., 1995; Dinel et al., 2014], что может быть связано с повышением уровня КС и секретируемых активной микроглией цитокинов [Pace et al., 2007].
Известно, что реакция организма на стресс имеет половые особенности, и особи женского пола более склонны к развитию пост-стрессорной депрессии [Wang et al., 2013; Sachs et al., 2014; Custódio et al., 2017]. Противоречивость результатов поведенческих тестов [Wang et al., 2013; Lan et al., 2015; Osborne et al., 2017; Custódio et al., 2017] и отсутствие данных о различиях в свойствах долговременной потенциации оставляют открытым вопрос о том, действительно ли неонатальное нейровоспаление по-разному влияет на обучение и память у самцов и самок. В пользу этого свидетельствует тот факт, что половые различия обнаружены при исследовании влияния некоторых видов неонатального стресса на обучение [McFadden et al., 2011] и долговременную пластичность синапсов [Bronzino et al., 1996; Derks et al., 2016]. Половые особенности также выявлены при исследовании последствий пренатального провоспалительного стресса [Rideau Batista Novais et al., 2014], однако в отличие от эффектов постнатального нейровоспаления, авторы обнаружили дефицит долговременной депрессии, а не долговременной потенциации [Lante et al., 2008; Rideau Batista Novais et al., 2014], причем преимущественно у самцов. Интересно, что при этом появляется склонность к абберантной долговременной потенциации [Escobar et al., 2011; Rideau Batista Novais et al., 2014]. Видимо, эффект ЛПС зависит от стадии созревания нервной системы в момент аппликации. К тому же плод в определенной степени защищен от воспалительных процессов в организме матери. Тем не менее сам факт активирующего влияния дает основание задуматься о принципиальной возможности сосуществования разных локусов влияния нейровоспаления, вклад которых определяет характер изменения свойств долговременной пластичности синапсов.
В работе Harré et al. [2008], выполненной на самцах, наблюдались заметные нарушения NMDA-зависимой долговременной потенциации, в то время как в наших экспериментах в срезах гиппокампа самцов наблюдались минимальные нарушения индукции долговременной потенциации [Кудряшова и др., 2018]. Нейровоспаление, несомненно, сопровождается стресс-реакцией [Maggio et al., 2013], а ранний стресс, как известно, влияет на постнатальное развитие опосредованных NMDA-функций [Rodenas-Ruano et al., 2012; Bath et al., 2016; Derks et al., 2016], которое заключается в постепенном замещении незрелых NMDA-NR2B-рецепторов NMDA-NR2A-рецепторами за счет увеличения экспрессии субъединиц NR2A [Rodenas-Ruano et al., 2012; Derks et al., 2016]. Существенно, что в гиппокампе самцов крыс 22-24-дневного возраста обнаружено активирующее влияние раннего стресса на долговременную потенциацию. Тот же эффект обнаружен только у взрослых самок [Derks et al., 2016]. Авторы считают, что неонатальный стресс по-разному влияет на скорость созревания функций NMDA-рецепторов у самцов и самок [Derks et al., 2016]. Поэтому не исключено, что дефицит долговременной потенциации, выявляемый преимущественно у самок, может быть связан с задержкой развития [Foley et al., 2014].
Обращает на себя внимание тот факт, что тип реакции на неонатальный стресс по сути не зависит от пола животных, что подразумевает сходство провоцирующих такие модификации факторов. Остается открытым вопрос, может ли гиппокамп самцов в период постнатального созревания в меньшей степени реагировать на изменения условий созревания. Нет четкого понимания того, может ли более выраженная реактивность самок приводить к изменениям условий созревания гиппокампа в постнатальный период, и, в итоге, к изменению базовых характеристик возбуждающих и тормозных синапсов, которые наблюдаются в эксперименте [Bronzino et al., 1996; Rideau Batista Novais et al., 2014]. Не исключено, что в основе половых различий лежат разные способы адаптации [Mathews et al., 2008; Zoladz et al., 2013], возможно, связанной с разной биологической ролью самцов и самок. В частности, для самцов, по-видимому, важнее сохранить способность обучаться новым навыкам даже при неблагоприятных условиях, тогда как улучшение консолидации в гиппокампе самок может иметь отношение к эмоциональной памяти и избеганию ситуаций, угрожающих личной безопасности.
ЗАКЛЮЧЕНИЕ
Формирование нейронных ансамблей на фоне последствий нейровоспаления определяется их структурным и функциональным отклонением от нормы [Mottahedin et al., 2017] и изменяет базовые характеристики синаптической передачи. В этих условиях невозможно непосредственно оценить степень нарушения долговременной пластичности. С другой стороны, нейровоспаление на ранних этапах онтогенеза вызывает изменения, которые требуют активации компенсаторных процессов, и запускает в широком смысле адаптационные процессы (рис. 2). Нейровоспаление снижает потенциал нейропластических механизмов, на клеточном уровне ингибируя процессы нейрогенеза в герминативных областях мозга, а на молекулярном – изменяя эффективность деятельности рецепторного аппарата и, таким образом, межклеточной коммуникации в целом (рис. 2). Это приводит, с одной стороны, к увеличению порога индукции механизмов долговременной пластичности, но после его преодоления возможна даже генерация судорожных разрядов. С другой стороны, модификация тормозной нейротрансмиссии и процессов гомеостатической пластичности может способствовать преобладанию долговременной депрессии в межклеточной коммуникации. В обоих случаях на первое место выходит микроглия как менеджер и активный участник механизмов долговременной пластичности. Наряду с этими общими тенденциями важным в понимании созревания межклеточной коммуникации в условиях модифицированной нейровоспалением микросреды гиппокампа и мозга в целом становится учет индивидуальных и обусловленных полом отклонений от нормы, которые определяются балансом всех действующих механизмов адаптации. Некоторые из них могут противодействовать снижению эффективности механизмов пластичности, тогда как другие направлены на защиту нервных клеток от повреждения в условиях экзайтотоксичности.
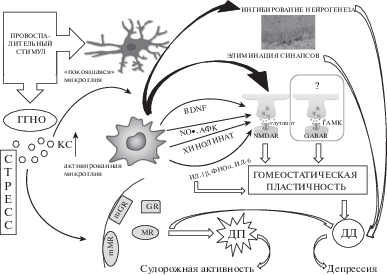
Рис. 2.
Модификация межклеточной коммуникации вследствие неонатального провоспалительного стресса. Провоспалительные факторы инициируют переход микроглии из “покоящегося” в активное состояние. Активированная глия является источником биологически активных молекул, включая цитокины, нейротрофины, агонисты NMDA-рецепторов. Кроме того, воспаление связано с избыточной генерацией активных форм кислорода (АФК) и азота (NO). Микроглия элиминирует синапсы, способствуя структурной модификации нейронов, и ингибирует нейрогенез в гиппокампе. Это приводит к увеличению порога индукции механизмов долговременной пластичности или снижению возбудимости рецепторного аппарата нейронов, оказывая тем самым долговременный эффект на гомеостатическую пластичность. Все это вместе с возможным изменением тормозной трансмиссии может способствовать преобладанию долговременной депрессии (ДД) в межклеточной коммуникации. В то же время, если проблема индукции преодолевается, то это приводит к нормальному поддержанию долговременной потенциации (ДП) и даже генерации судорожной активности. Активация стрессорного ответа на провоспалительный стимул в раннем онтогенезе приводит к изменению гипоталамо-гипофизарного контроля секреции глюкокортикоидов. Поддержание высокого уровня циркулирующего кортикостерона (КС) также способствует активации микроглии и модификации механизмов долговременной пластичности. Эффекты КС опосредованы цитозольными минерало- и глюкокортикоидными рецепторами (соответственно MR и GR) и их мембранными формами (mMR, mGR).
Fig. 2. Modification of intercellular communication after neonatal proinflammatory stress. Proinflammatory factors promote transition of microglia from the “resting” to activated state. Activated glia is a source of biologically active molecules, such as cytokines, neurotrophins, and agonists of NMDA-receptors. Additionally, neuroinflammation is associated with excessive production of reactive oxygen (АФК) and nitrogen (NO) species. Microglia eliminates synapses, promoting structural alterations of neurons, and inhibits neurogenesis in the hippocampus. This leads to an increase in the threshold of induction of long-term plasticity mechanisms or the reduced excitability of neuronal receptors, thus having a long-term effect on homeostatic plasticity. All these processes together with a putative change in the inhibitory transmission can contribute to the prevalence of long-term depression (ДД) in intercellular communication. However, if the problem of induction is overcome, it results in the normal maintenance of long-term potential (ДП) or even seizure activity. Activation of stress response to proinflammatory stimulus in early ontogeny leads to changes in hypothalamic-pituitary control of glucocorticoid secretion. Maintaining a high level of circulating corticosterone (КС) also promotes activation of microglia and modification of mechanisms of long-term plasticity. Corticosterone effects are mediated by cytosolic mineralo- and glucocorticoid receptors (MR and GR, respectively) and their membrane forms (mMR and mGR).
Работа выполнена при поддержке Российского Фонда фундаментальных исследований (проект № 18-00-00125).
Список литературы
Балабан П.М., Гуляева Н.В. Общность молекулярных механизмов нейропластичности и нейропатологии: интегративный подход. Рос. физиол. журн. им. И.М. Сеченова, 2006. 92: 145–151.
Григорьян Г.А., Дыгало Н.Н., Гехт А.Б., Степаничев М.Ю., Гуляева Н.В. Молекулярно-клеточные механизмы депрессии. Роль глюкокортикоидов, цитокинов, нейротрансмиттеров и трофических факторов в генезе депрессивных расстройств. Усп. физиол. наук. 2014. 45: 3–19.
Кудряшова И.В. Анализ условий, необходимых для начала процесса консолидации на модели долговременной синаптической потенциации. Нейрохимия. 2013. 30: 207–215.
Кудряшова И.В. Зависимость долговременной потенциации от исходных свойств СА3-СА1 синапсов: значение для исследования влияния внешних факторов на синаптическую пластичность гиппокампа. Журн. высш. нервн. деят. им. И.П. Павлова. 2017. 67: 831–846.
Кудряшова И.В. Пластичность тормозных синапсов как фактор долговременных модификаций. Нейрохимия. 2015. 32: 181–191.
Кудряшова И.В., Гуляева Н.В. “Непредсказуемый стресс”: неоднозначность стресс-реактивности при исследовании долговременной пластичности. Журн. высш. нерв. деят. им. И.П. Павлова. 2016. 66: 414–428.
Кудряшова И.В., Тишкина А.О., Гуляева Н.В. Неонатальный провоспалительный стресс и дефицит индукции долговременной потенциации в гиппокампе крыс: гендерные различия. Журн. высш. нерв. деят. им. И.П. Павлова. 2018. 68: 524–536.
Малиновская Н.А., Моргун А.В., Лопатина О.Л., Панина Ю.А., Волкова В.В., Гасымлы Э.Д., Таранушенко Т.Е., Салмина А.Б. Стресс раннего периода жизни: последствия для развития головного мозга. Журн. высш. нерв. деят. им. И.П. Павлова. 2016. 66: 643–668.
Перегуд Д.И., Фрейман С.В., Тишкина А.О., Сохраняева Л.С., Лазарева Н.А., Онуфриев М.В., Степаничев М.Ю., Гуляева Н.В. Влияние раннего провоспалительного стресса на экспрессию различных транскриптов BDNF в отделах мозга самцов крыс препубертатного возраста. Вавиловский журн. генетики селекции. 2016. 20: 191–197.
Скребицкий В.Г., Штарк М.Б. Фундаментальные основы пластичности нервной системы. Вест. РАМН. 2012. 9: 39–44.
Степаничев М.Ю. Цитокины как нейромодуляторы в центральной нервной системе. Нейрохимия. 2005. 22: 5–11.
Тишкина А.О., Степаничев М.Ю., Аниол В.А., Гуляева Н.В. Функции микроглии в здоровом мозге: фокус на нейропластичность. Усп. физиол. наук. 2014. 45: 3–18.
Abareshi A., Hosseini M., Beheshti F., Norouzi F., Khazaei M., Sadeghnia H.R., Boskabady M.H., Shafei M.N., Anaeigoudari A. The effects of captopril on lipopolysaccharide induced learning and memory impairments and the brain cytokine levels and oxidative damage in rats. Life Sci. 2016. 167: 46–56.
Abraham W.C., Williams J.M. LTP maintenance and its protein synthesis-dependence. Neurobiol. Learn. Mem. 2008. 89: 260–268.
Anaeigoudari A., Soukhtanloo M., Reisi P., Beheshti F., Hosseini M. Inducible nitric oxide inhibitor aminoguanidine, ameliorates deleterious effects of lipopolysaccharide on memory and long term potentiation in rat. Life Sci. 2016. 158: 22–30.
Balschun D., Wetzel W., Del Rey A., Pitossi F., Schneider H., Zuschratter W., Besedovsky H.O. Interleukin-6: a cytokine to forget. FASEB J. 2004. 18: 1788–1790.
Bath K.G., Manzano-Nieves G., Goodwill H.. Early life stress accelerates behavioral and neural maturation of the hippocampus in male mice. Horm. Behav. 2016. 82: 64–71.
Beattie E.C., Stellwagen D., Morishita W., Bresnahan J.C., Ha B.K., Von Zastrow M., Beattie M.S., Malenka R.C. Control of synaptic strength by glial TNFalpha. Science. 2002. 295: 2282–2285.
Ben Achour S., Pascual O. Glia: the many ways to modulate synaptic plasticity. Neurochem. Int. 2010. 57: 440–445.
Ben Menachem-Zidon O., Avital A., Ben-Menahem Y., Goshen I., Kreisel T., Shmueli E.M., Segal M., Ben Hur T., Yirmiya R. Astrocytes support hippocampal-dependent memory and long-term potentiation via interleukin-1 signaling. Brain Behav. Immun. 2011. 25: 1008–1016.
Besedovsky H., del Rey A., Sorkin E., Dinarello C.A. Immunoregulatory feedback between interleukin-1 and glucocorticoid hormones. Science. 1986. 233: 652–654.
Besedovsky H.O., del Rey A. Central and peripheral cytokines mediate immune-brain connectivity. Neurochem. Res. 2011. 36: 1–6.
Bilbo S.D., Biedenkapp J.C., Der-Avakian A., Watkins L.R., Rudy J.W., Maier S.F. Neonatal infection-induced memory impairment after lipopolysaccharide in adulthood is prevented via caspase-1 inhibition. J. Neurosci. 2005. 25: 8000–8009.
Bilbo S.D., Barrientos R.M., Eads A.S., Northcutt A., Watkins L.R., Rudy J.W., Maier S.F. Early-life infection leads to altered BDNF and IL-1beta mRNA expression in rat hippocampus following learning in adulthood. Brain Behav. Immun. 2008. 22: 451–455.
Bilimoria P.M., Stevens B. Microglia function during brain development: new insights from animal models. Brain Res. 2015. 1617: 7–17.
Bitzer-Quintero O.K., Gonzalez-Burgos I. Immune system in the brain: a modulatory role on dendritic spine morphophysiology? Neural Plast. 2012. 2012: 348642.
Blume J., Douglas S.D., Evans D.L. Immune suppression and immune activation in depression // Brain Behav. Immun. 2011. V. 25. P. 221–229.
Blundon J.A., Zakharenko S.S. Dissecting the components of long-term potentiation. Neuroscientist. 2008. 14: 598–608.
Brennan F.X., Beck K.D., Servatius R.J. Low doses of interleukin-1beta improve the leverpress avoidance performance of Sprague-Dawley rats. Neurobiol. Learn. Mem. 2003. 80: 168–171.
Bronzino J.D., Kehoe P., Austin-LaFrance R.J., Rushmore R.J., Kurdian J. Neonatal isolation alters LTP in freely moving juvenile rats: sex differences. Brain Res. Bull. 1996. 41: 175–183.
Brunson K.L., Kramár E., Lin B., Chen Y., Colgin L.L., Yanagihara T.K., Lynch G., Baram T.Z. Mechanisms of late-onset cognitive decline after early-life stress. J. Neurosci. 2005. 25: 9328–9338.
Butler M.P., O’Connor J.J., Moynagh P.N. Dissection of tumor-necrosis factor-alpha inhibition of long-term potentiation (LTP) reveals a p38 mitogen-activated protein kinase-dependent mechanism which maps to early-but not late-phase LTP. Neuroscience. 2004. 124: 319–326.
Cambonie G., Hirbec H., Michaud M., Kamenka J.M., Barbanel G. Prenatal infection obliterates glutamate-related protection against free hydroxyl radicals in neonatal rat brain. J. Neurosci. Res. 2004. 75: 125–132.
Capuron L., Miller A.H. Immune system to brain signaling: neuropsychopharmacological implications. Pharmacol. Therap. 2011. 130: 226–238.
Champagne D.L. Bagot R.C., van Hasselt F., Ramakers G., Meaney M.J., de Kloet E.R., Joëls M., Krugers H. Maternal care and hippocampal plasticity: evidence for experience-dependent structural plasticity, altered synaptic functioning, and differential responsiveness to glucocorticoids and stress. J. Neurosci. 2008. 28: 6037–6045.
Chen Y.H., Kuo T.T., Chu M.T., Ma H.I., Chiang Y.H., Huang E.Y. Postnatal systemic inflammation exacerbates impairment of hippocampal synaptic plasticity in an animal seizure model. Neuroimmunomodulation. 2013. 20: 223–232.
Chen Z., Jalabi W., Hu W., Park H.J., Gale J.T., Kidd G.J., Bernatowicz R., Gossman Z.C., Chen J.T., Dutta R., Trapp B.D. Microglial displacement of inhibitory synapses provides neuroprotection in the adult brain. Nat. Commun. 2014. 5: 4486.
Custódio C.S., Mello B.S.F., Filho A.J.M.C., de Carvalho Lima C.N., Cordeiro R.C., Miyajima F., Réus G.Z., Vasconcelos S.M.M., Barichello T., Quevedo J., de Oliveira A.C., de Lucena D.F., Macedo D.S. Neonatal immune challenge with lipopolysaccharide triggers long-lasting sex- and age-related behavioral and immune/neurotrophic alterations in mice: relevance to autism spectrum disorders. Mol. Neurobiol. 2018. 55: 3775–3788.
de Kloet E.R., Joëls M., Holsboer F. Stress and the brain: from adaptation to disease. Nat. Rev. Neurosci. 2005. 6: 463–475.
Del Rey A., Roggero E., Randolf A., Mahuad C., McCann S., Rettori V., Besedovsky H.O. IL-1 resets glucose homeostasis at central levels. Proc. Natl. Acad. Sci. USA. 2006. 103: 16039–16044.
Derks N.A., Krugers H.J., Hoogenraad C.C., Joëls M., Sarabdjitsingh R.A. Effects of early life stress on synaptic plasticity in the developing hippocampus of male and female rats. PLoS One. 2016. 11: e0164551.
Diamond D.M., Bennett M.C., Fleshner M., Rose G.M. Inverted-U relationship between the level of peripheral corticosterone and the magnitude of hippocampal primed burst potentiation. Hippocampus. 1992. 2: 421–430.
Dinel A., Joffre C., Trifilieff P., Aubert A., Foury A., Le Ruyet P., Layé S. Inflammation early in life is a vulnerability factor for emotional behavior at adolescence and for lipopolysaccharide-induced spatial memory and neurogenesis alteration at adulthood // J. Neuroinflammation 2014. V. 11: P. 155.
Dissing-Olesen L., LeDue J.M., Rungta R.L., Hefendehl J.K., Choi H.B., MacVicar B.A. Activation of neuronal NMDA receptors triggers transient ATP-mediated microglial process outgrowth. J. Neurosci. 2014. 34: 10511–10527.
Donzis E.J., Tronson N.C. Modulation of learning and memory by cytokines: signaling mechanisms and long term consequences. Neurobiol. Learn. Mem. 2014. 115: 68–77.
Dumas T.C. Late postnatal maturation of excitatory synaptic transmission permits adult-like expression of hippocampal-dependent behaviors. Hippocampus. 2005. 15: 562–578.
Escobar M., Crouzin N., Cavalier M., Quentin J., Roussel J., Lanté F., Batista-Novais A.R., Cohen-Solal C., De Jesus Ferreira M.C., Guiramand J., Barbanel G., Vignes M. Early, time-dependent disturbances of hippocampal synaptic transmission and plasticity after in utero immune challenge. Biol. Psychiatry. 2011. 70: 992–999.
Eyo U.B. Wu L.J. Bidirectional microglia-neuron communication in the healthy brain. Neural. Plast. 2013. 2013: 456857.
Eyre H., Baune B.T. Neuroplastic changes in depression: a role for the immune system. Psychoneuroendocrinology. 2012. 37: 1397–1416.
Fan L.W., Tien L.T, Mitchell H.J., Rhodes P.G., Cai Z. Alpha-phenyl-n-tert-butyl-nitrone ameliorates hippocampal injury and improves learning and memory in juvenile rats following neonatal exposure to lipopolysaccharide. Eur. J. Neurosci. 2008. 27: 1475–1484.
Finsterwald C., Alberini C.M. Stress and glucocorticoid receptor-dependent mechanisms in long-term memory: from adaptive responses to psychopathologies. Neurobiol. Learn. Mem. 2014. 112: 17–29.
Foley K.A., Ossenkopp K.-P., Kavaliers M., MacFabe D.F. Pre- and Neonatal exposure to lipopolysaccharide or the enteric metabolite, propionic acid, alters development and behavior in adolescent rats in a sexually dimorphic manner. PLoS One. 2014. 9: e87072.
Fontainhas A.M., Wang M., Liang K.J., Chen S., Mettu P., Damani M., Fariss R.N., Li W., Wong W.T. Microglial morphology and dynamic behavior is regulated by ionotropic glutamatergic and GABAergic neurotransmission. PLoS One. 2011. 6: e15973.
Gal-Ben-Ari S., Kenney J.W., Ounalla-Saad H., Taha E., David O., Levitan D., Gildish I., Panja D., Pai B., Wibrand K., Simpson T.I., Proud C.G., Bramham C.R., Armstrong J.D., Rosenblum K. Consolidation and translation regulation. Learn. Mem. 2012. 19: 410–422.
Galic M.A., Riazi K., Heida J.G., Mouihate A., Fournier N.M., Spencer S.J., Kalynchuk L.E., Teskey G.C., Pittman Q.J. Postnatal inflammation increases seizure susceptibility in adult rats. J. Neurosci. 2008. 28: 6904–6913.
Girard-Joyal O., Faragher A., Bradley K., Kane L., Hrycyk L., Ismail N. Age and sex differences in c-Fos expression and serum corticosterone concentration following LPS treatment. Neuroscience. 2015. 305: 293–301.
Giridharan V.V., Réus G.Z., Selvaraj S., Scaini G., Barichello T., Quevedo J. Maternal deprivation increases microglial activation and neuroinflammatory markers in the prefrontal cortex and hippocampus of infant rats. J. Psychiatr. Res. 2019. 115: 13–20.
Golan H., Levav T., Mendelsohn A., Huleihel M. Involvement of tumor necrosis factor alpha in hippocampal development and function. Cerebral Cortex. 2004. 14: 97–105.
Goshen I., Kreisel T., Ounallah-Saad H., Renbaum P., Zalzstein Y., Ben-Hur T., Levy-Lahad E., Yirmiya R. A dual role for interleukin-1 in hippocampal-dependent memory processes. Psychoneuroendocrinology. 2007. 32: 1106–1115.
Guan Z., Fang J. Peripheral immune activation by lipopolysaccharide decreases neurotrophins in the cortex and hippocampus in rats. Brain Behav. Immun. 2006. 20: 64–71.
Gullo F., Amadeo A., Donvito G., Lecchi M., Costa B., Constanti A., Wanke E. Atypical “seizure-like” activity in cortical reverberating networks in vitro can be caused by LPS-induced inflammation: a multi-electrode array study from a hundred neurons. Front. Cell. Neurosci. 2014. 8: 361.
Gulyaeva N.V. Molecular mechanisms of neuroplasticity: an expanding universe. Biochemistry (Mosc). 2017a. 82: 237–242.
Gulyaeva N.V. Interplay between brain BDNF and glutamatergic systems: a brief state of the evidence and association with the pathogenesis of depression. Biochemistry (Mosc). 2017b. 82: 301–307.
Han Q., Lin Q., Huang P., Chen M., Hu X., Fu H., He S., Shen F., Zeng H., Deng Y. Microglia-derived IL-1β contributes to axon development disorders and synaptic deficit through p38-MAPK signal pathway in septic neonatal rats. J. Neuroinflammation. 2017. 14: 52.
Harré E.M., Galic M.A., Mouihate A., Noorbakhsh F., Pittman Q.J. Neonatal inflammation produces selective behavioural deficits and alters N-methyl-D-aspartate receptor subunit mRNA in the adult rat brain. Eur. J. Neurosci. 2008. 27: 644–653.
Harrison N.A., Brydon L., Walker C., Gray M.A., Steptoe A., Critchley H.D. Inflammation causes mood changes through alterations in subgenual cingulate activity and mesolimbic connectivity. Biol. Psychiatr. 2009. 66: 407–414.
Hayashi Y., Ishibashi H., Hashimoto K., Nakanishi H. Potentiation of the NMDA receptor-mediated responses through the activation of the glycine site by microglia secreting soluble factors. Glia. 2006. 53: 660–668.
Hennigan A., Trotter C., Kelly A.M. Lipopolysaccharide impairs long-term potentiation and recognition memory and increases p75NTR expression in the rat dentate gyrus. Brain Res. 2007. 1130: 158–166.
Hoeijmakers L., Lucassen P.J., Korosi A. The interplay of early-life stress, nutrition, and immune activation programs adult hippocampal structure and function. Front. Mol. Neurosci. 2015. 7: 103.
Howland J.G., Wang Y.T. Synaptic plasticity in learning and memory: stress effects in the hippocampus. Prog. Brain Res. 2008. 169: 145–158.
Huang C.C., Yang C.H., Hsu K.S. Do stress and long-term potentiation share the same molecular mechanisms? Mol. Neurobiol. 2005. 32: 223–235.
Islam O., Gong X., Rose-John S., Heese K. Interleukin-6 and neural stem cells: more than gliogenesis. Mol. Biol. Cell. 2009. 20: 188–199.
Järlestedt K., Naylor A.S., Dean J., Hagberg H., Mallard C. Decreased survival of newborn neurons in the dorsal hippocampus after neonatal LPS exposure in mice. Neuroscience. 2013. 253: 21–28.
Ji K., Akgul G., Wollmuth L.P., Tsirka S.E. Microglia actively regulate the number of functional synapses. PLoS One. 2013. 8: e56293.
Joels M., Krugers H.J. LTP after stress: up or down? Neural Plast. 2007. 2007: 93202.
Joels M., Krugers H., Karst H. Stress-induced changes in hippocampal function. Prog. Brain Res. 2008. 167: 3–15.
Joels M., Krugers H.J., Lucassen P.J., Karst H. Corticosteroid effects on cellular physiology of limbic cells. Brain Res. 2009. 293: 91–100.
Joels M., Velzing E., Nair W., Verkuyl J.M., Karst H. Acute stress increases calcium current amplitude in rat hippocampus: temporal changes in physiology and gene expression. Eur. J. Neurosci. 2003. 18: 1315–1324.
Joëls M., Sarabdjitsingh R.A., Karst H. Unraveling the time domains of corticosteroid hormone influences on brain activity: rapid, slow, and chronic modes. Pharmacol. Rev. 2012. 64: 901–938.
Kamal A., Ramakers G.M., Altinbilek B., Kas M.J. Social isolation stress reduces hippocampal long-term potentiation: effect of animal strain and involvement of glucocorticoid receptors. Neuroscience. 2014. 256: 262–270.
Kellom M., Basselin M., Keleshian V.L., Chen M., Rapoport S.I., Rao J.S. Dose-dependent changes in neuroinflammatory and arachidonic acid cascade markers with synaptic marker loss in rat lipopolysaccharide infusion model of neuroinflammation. BMC Neurosci. 2012. 13: 50.
Kettenmann H., Kirchhoff F., Verkhratsky A. Microglia: new roles for the synaptic stripper. Neuron. 2013. 77: 10–18.
Khairova R.A., Machado-Vieira R., Du J., Manji H.K. A potential role for pro-inflammatory cytokines in regulating synaptic plasticity in major depressive disorder. Int. J. Neuropsychopharmacol. 2009. 12: 561–578.
Kim J.J., Song E.Y., Kosten T.A. Stress effects in the hippocampus: synaptic plasticity and memory. Stress. 2006. 9: 1–11.
Kohman R.A., Rhodes J.S. Neurogenesis, inflammation and behavior. Brain Behav. Immun. 2013. 27: 22–32.
Kohman R.A., Tarr A.J., Sparkman N.L., Bogale T.M.H., Boehm G.W. Neonatal endotoxin exposure impairs avoidance learning and attenuates endotoxin-induce d sickness behavior and central IL-1 gene transcription in adulthood. Behav. Brain Res. 2008. 194: 25–31.
Krebs V.L., Okay T.S., Okay Y., Vaz F.A. Tumor necrosis factor-alpha, interleukin-1beta and interleukin-6 in the cerebrospinal fluid of newborn with meningitis. Arq. Neuropsiquiatr. 2005. 63: 7–13.
Krishnadas R., Cavanagh J. Depression: an inflammatory illness? J. Neurol. Neurosurg. Psychiatry 2012. 83: 495–502.
Kubera M., Obuchowicz E., Goehler L., Brzeszcz J., Maes M. In animal models, psychosocial stress-induced (neuro)inflammation, apoptosis and reduced neurogenesis are associated to the onset of depression. Prog. Neuropsychopharmacol. Biol. Psychiatry. 2010. 35: 744–759.
Labrousse V.F., Costes L., Aubert A., Darnaudery M., Ferreira G., Amedee T., Laye S. Impaired interleukin-1beta and c-Fos expression in the hippocampus is associated with a spatial memory deficit in P2X(7) receptor-deficient mice. PLoS One. 2009. 4: e6006.
Lai A.Y., Swayze R.D., El-Husseini A., Song C. Interleukin-1 beta modulates AMPA receptor expression and phosphorylation in hippocampal neurons. J. Neuroimmunol. 2006. 175: 97–106.
Lan K.M. Tien L.T., Pang Y., Bhatt A.J., Fan L.W. IL-1 receptor antagonist attenuates neonatal lipopolysaccharide-induced long-lasting learning impairment and hippocampal injury in adult rats. Toxicol. Lett. 2015. 234: 30–39.
Lante F., Meunier J., Guiramand J., De Jesus Ferreira M.C., Cambonie G., Aimar R., Cohen-Solal C., Maurice T., Vignes M., Barbanel G. Late N-acetylcysteine treatment prevents the deficits induced in the offspring of dams exposed to an immune stress during gestation. Hippocampus. 2008. 18: 602–609.
Lante F., Meunier J., Guiramand J., Maurice T., Cavalier M., de Jesus Ferreira M.C., Aimar R., Cohen-Solal C., Vignes M., Barbanel G. Neurodevelopmental damage after prenatal infection: role of oxidative stress in the fetal brain. Free Radic. Biol. Med . 2007. 42: 1231–1245.
Levin S.G., Godukhin O.V. Modulating effect of cytokines on mechanismsof synaptic plasticity in the brain. Biochemistry (Mosc). 2017. 82: 264–274.
Li Y., Du X.F., Liu C.S., Wen Z.L., Du J.L. Reciprocal regulation between resting microglial dynamics and neuronal activity in vivo. Dev. Cell. 2012. 23: 1189–1202.
Liao D., Malinow R. Deficiency in induction but not expression of LTP in hippocampal slices from young rats. Learn. Mem. 1996. 3: 138–149.
Lim S.H., Park E., You B., Jung Y., Park A.R., Park S.G., Lee J.R. Neuronal synapse formation induced by microglia and interleukin 10. PLoS One. 2013. 8: e81218.
Lin Y.C., Koleske A.J. Mechanisms of synapse and dendrite maintenance and their disruption in psychiatric and neurodegenerative disorders. Annu. Rev. Neurosci. 2010. 33: 349–378.
Liraz-Zaltsman S., Yaka R., Shabashov D., Shohami E., Biegon A. Neuroinflammation-induced memory deficits are amenable to treatment with D-cycloserin. J. Mol. Neurosci. 2016. 60: 46–62.
Liston C., Gan W.B. Glucocorticoids are critical regulators of dendritic spine development and plasticity in vivo. Proc. Natl. Acad. Sci. USA. 2011. 108: 16074–16079.
MacRae M., Macrina T., Khoury A., Migliore M.M., Kentner A.C. Tracing the trajectory of behavioral impairments and oxidative stress in an animal model of neonatal inflammation. Neuroscience. 2015. 298: 455–466.
Maes M., Mihaylova I., Kubera M., Ringel K. Activation of cell-mediated immunity in depression: association with inflammation, melancholia, clinical staging and the fatigue and somatic symptom cluster of depression. Prog. Neuropsychopharmacol. Biol. Psychiatry. 2012. 36: 169–175.
Maggio N., Shavit-Stein E., Dori A., Blatt I., Chapman J. Prolonged systemic inflammation persistently modifies synaptic plasticity in the hippocampus: modulation by the stress hormones. Front. Mol. Neurosci. 2013. 6: 46.
Maggio N., Segal M. Cellular basis of a rapid effect of mineralocorticosteroid receptors activation on LTP in ventral hippocampal slices. Hippocampus. 2012. 22: 267–275.
Martin S., Henley J.M., Holman D., Zhou M., Wiegert O., van Spronsen M., Joëls M., Hoogenraad C.C., Krugers H.J. Corticosterone alters AMPAR mobility and facilitates bidirectional synaptic plasticity. PLoS One. 2009. 4: e4714.
Matcovitch-Natan O., Winter D.R., Giladi A., Vargas Aguilar S., Spinrad A., Sarrazin S., Ben-Yehuda H., David E., Zelada González F., Perrin P., Keren-Shaul H., Gury M., Lara-Astaiso D., Thaiss C.A., Cohen M., Bahar Halpern K., Baruch K., Deczkowska A., Lorenzo-Vivas E., Itzkovitz S., Elinav E., Sieweke M.H., Schwartz M., Amit I. Microglia development follows a stepwise program to regulate brain homeostasis. Science 2016. 353: aad8670.
Mathews I.Z., Wilton A., Styles A., McCormick C.M. Increased depressive behaviour in females and heightened corticosterone release in males to swim stress after adolescent social stress in rats. Behav. Brain Res. 2008. 190: 33–40.
McEachern J.C., Shaw CA. The plasticity pathology continuum: defining a role for the LTP phenomenon. J. Neurosci. Res. 1999. 58: 42–61.
McEwen B.S. Physiology and neurobiology of stress and adaptation: central role of the brain. Physiol. Rev. 2007. 87: 873–904.
McFadden L.M., Paris J.J., Mitzelfelt M.S., McDonough S., Frye C.A., Matuszewich L. Sex-dependent effects of chronic unpredictable stress in the water maze. Physiol. Behav. 2011. 102: 266–275.
Medzhitov R., Janeway C. Advances in immunology: innate immunity. N. Engl. J. Med. 2000. 343: 338–344.
Michaluk P., Wawrzyniak M., Alot P., Szczot M., Wyrembek P., Mercik K., Medvedev N., Wilczek E., De Roo M., Zuschratter W., Muller D., Wilczynski G.M., Mozrzymas J.W., Stewart M.G., Kaczmarek L., Wlodarczyk J. Influence of matrix metalloproteinase MMP-9 on dendritic spine morphology. J. Cell Sci. 2011. 124: 3369–3380.
Mosser C.A., Baptista S., Arnoux I., Audinat E. Microglia in CNS development: Shaping the brain for the future. Prog Neurobiol. 2017. 149-150: 1–20.
Mottahedin A., Ardalan M., Chumak T., Riebe I., Ek J., Mallard C. Effect of neuroinflammation on synaptic organization and function in the developing brain: implications for neurodevelopmental and neurodegenerative disorders. Front. Cell Neurosci. 2017. 11: 190.
Mouihate A. Long-lasting impact of early life immune stress on neuroimmune functions. Med. Princ. Pract. 2013. 22: 3–7.
Neniskyte U., Gross C.T. Errant gardeners: glial-cell-dependent synaptic pruning and neurodevelopmental disorders. Nat. Rev. Neurosci. 2017. 18: 658–670.
Nikzad S., Vafaei A.A., Rashidy-Pour A., Haghighi S. Systemic and intrahippocampal administrations of the glucocorticoid receptor antagonist RU38486 impairs fear memory reconsolidation in rats. Stress. 2011. 14: 459–464.
Nouel D., Burt M., Zhang Y., Harvey L., Boksa P. Prenatal exposure to bacterial endotoxin reduces the number of GAD67- and reelin-immunoreactive neurons in the hippocampus of rat offspring. Eur. Neuropsychopharmacol. 2012. 22: 300–307.
Okulski P., Jay T.M., Jaworski J., Duniec K., Dzwonek J., Konopacki F.A., Wilczynski G.M., Sánchez-Capelo A., Mallet J., Kaczmarek L. TIMP-1 abolishes MMP-9-dependent long-lasting long-term potentiation in the prefrontal cortex. Biol. Psychiatry. 2007. 62: 359–362.
Onufriev M.V., Freiman S.V., Peregud D.I., Kudryashova I.V., Tishkina A.O., Stepanichev M.Yu., Gulyaeva N.V. Neonatal proinflammatory stress induces accumulation of corticosterone and interleukin-6 in the hippocampus of juvenile rats: potential mechanism of synaptic plasticity impairments. Biochemistry (Moscow). 2017. 82: 275–281.
Osborne B.F., Caulfield J.I., Solomotis S.A., Schwarz J.M. Neonatal infection produces significant changes in immune function with no associated learning deficits in juvenile rats. Dev. Neurobiol. 2017. 77: 1221–1236.
Pace T.W., Hu F., Miller A.H. Cytokine-effects on glucocorticoid receptor function: relevance to glucocorticoid resistance and the pathophysiology and treatment of major depression. Brain Behav. Immun. 2007. 21: 9–19.
Pang Y., Dai X., Roller A., Carter K., Paul I., Bhatt A.J., Lin RC, Fan LW. Early postnatal lipopolysaccharide exposure leads to enhanced neurogenesis and impaired communicative functions in rats. PLoS ONE 2016. 11: e0164403.
Park H.J., Lee S., Jung J.W., Kim B.C., Ryu J.H., Kim D.H. Glucocorticoid- and long-term stress-induced aberrant synaptic plasticity are mediated by activation of the glucocorticoid receptor. Arch. Pharm. Res. 2015. 38: 1204–1212.
Park K.M., Bowers W.J. Tumor necrosis factor-alpha mediated signaling in neuronal homeostasis and dysfunction. Cell Signal. 2010. 22: 977–983.
Parkhurst C.N., Yang G., Ninan I., Savas J.N., Yates J.R. 3rd, Lafaille J.J., Hempstead B.L., Littman D.R., Gan W.B. Microglia promote learning-dependent synapse formation through brain-derived neurotrophic factor. Cell. 2013. 155: 1596–1609.
Pascual O., Achour S.B., Rostaing P., Triller A., Bessis A. Microglia activation triggers astrocyte-mediated modulation of excitatory neurotransmission. Proc. Natl. Acad. Sci. USA. 2012. 109: E197–E205.
Polman J.A., de Kloet E.R., Datson N.A. Two populations of glucocorticoid receptor-binding sites in the male rat hippocampal genome. Endocrinology. 2013. 154: 1832–1844.
Pribiag H., Stellwagen D. TNF-alpha downregulates inhibitory neurotransmission through protein phosphatase 1-dependent trafficking of GABA(A) receptors. J. Neurosci. 2013. 33: 15879–15893.
Pribiag H., Stellwagen D. Neuroimmune regulation of homeostatic synaptic plasticity. Neuropharmacology. 2014. 78: 13–22.
Radahmadi M., Hosseini N., Nasimi A. Effect of chronic stress on short and long-term plasticity in dentate gyrus; study of recovery and adaptation. Neuroscience. 2014. 280: 121–129.
Rex C.S., Chen L.Y., Sharma A., Liu J., Babayan A.H., Gall C.M., Lynch G. Different Rho GTPase-dependent signaling pathways initiate sequential steps in the consolidation of long-term potentiation. J. Cell Biol. 2009. 186: 85–97.
Réus G.Z., Fernandes G.C., de Moura A.B., Silva R.H., Darabas A.C., de Souza T.G., Abelaira H.M., Carneiro C., Wendhausen D., Michels M., Pescador B., Dal-Pizzol F., Macêdo D.S., Quevedo J. Early life experience contributes to the developmental programming of depressive-like behaviour, neuroinflammation and oxidative stress. J. Psychiatr. Res. 2017. 95: 196–207.
Riazi K., Galic M.A., Kentner A.C., Reid A.Y., Sharkey K.A., Pittman Q.J. Microglia-dependent alteration of glutamatergic synaptic transmission and plasticity in the hippocampus during peripheral inflammation. J. Neurosci. 2015. 35: 4942–4952.
Rideau Batista Novais A., Crouzin N., Cavalier M., Boubal M., Guiramand J., Cohen-Solal C., de Jesus Ferreira M.C., Cambonie G., Vignes M., Barbanel G. Tiagabine improves hippocampal long-term depression in rat pups subjected to prenatalinflammation. PLoS One. 2014. 9: e106302.
Rodenas-Ruano A., Chávez A.E., Cossio M.J., Castillo P.E., Zukin R.S. REST-dependent epigenetic remodeling promotes the developmental switch in synaptic NMDA receptors. Nat. Neurosci. 2012. 15: 1382–1390.
Rogers J.T., Morganti J.M., Bachstetter A.D., Hudson C.E., Peters M.M., Grimmig B.A., Weeber E.J., Bickford P.C., Gemma C. CX3CR1 deficiency leads to impairment of hippocampal cognitive function and synaptic plasticity. J. Neurosci. 2011. 31: 16241–16250.
Rösch H., Schweigreiter R., Bonhoeffer T., Barde Y.A., Korte M. The neurotrophin receptor p75NTR modulates long-term depression and regulates the expression of AMPA receptor subunits in the hippocampus. Proc. Natl. Acad. Sci. USA. 2005. 102: 7362–7367.
Routtenberg A., Rekart J.L. Post-translational protein modification as the substrate for long-lasting memory. Trends Neurosci. 2005. 28: 12–19.
Sachs B.D., Ni J.R., Caron M.G. Sex differences in response to chronic mild stress and congenital serotonin deficiency. Psychoneuroendocrinology 2014. 40: 123–129.
Santello M., Volterra A. TNFalpha in synaptic function: switching gears. Trend. Neurosci. 2012. 35: 638–647.
Schafer D.P., Lehrman E.K., Stevens B. The “quad-partite” synapse: microglia-synapse interactions in the developing and mature CNS. Glia. 2013. 61: 24–36.
Schafer D.P., Lehrman E.K., Kautzman A.G., Koyama R., Mardinly A.R., Yamasaki R., Ransohoff R.M., Greenberg M.E., Barres B.A., Stevens B. Microglia sculpt postnatal neural circuits in an activity and complement-dependent manner. Neuron. 2012. 74: 691–705.
Schmid A.W., Lynch M.A., Herron C.E. The effects of IL-1 receptor antagonist on beta amyloid mediated depression of LTP in the rat CA1 in vivo. Hippocampus. 2009. 19: 670–676.
Schneider H., Pitossi F., Balschun D., Wagner A., del Rey A., Besedovsky H.O. A neuromodulatory role of interleukin-1beta in the hippocampus. Proc. Nat. Acad. Sci. USA. 1998. 95: 7778–7783.
Schwartz M., Shaked I., Fisher J., Mizrahi T., Schori H. Protective autoimmunity against the enemy within: fighting glutamate toxicity. Trends Neurosci. 2003. 26: 297–302.
Schwarz J.M., Bilbo S.D. Sex, glia, and development: Interactions in health and disease. Horm. Behav. 2012. 62: 243–253.
Shanks N., Larocque S., Meaney M.J. Neonatal endotoxin exposure alters the development of the hypothalamic-pituitary-adrenal axis: early illness and later responsivity to stress. J. Neurosci. 1995. 15: 376–384.
Sharvit A., Segal M., Kehat O., Stork O., Richter-Levin G. Differential modulation of synaptic plasticity and local circuit activity in the dentate gyrus and CA1 regions of the rat hippocampus by corticosterone. Stress. 2015. 18: 319–327.
Shaw K.N., Commins S., O’Mara S.M. Lipopolysaccharide causes deficits in spatial learning in the watermaze but not in BDNF expression in the rat dentate gyrus. Behav. Brain Res. 2001. 124: 47–54.
Sidor M.M., Amath A., MacQueen G., Foster J.A. A developmental characterization of mesolimbocortical serotonergic gene expression changes following early immune challenge. Neuroscience 2010. 171: 734–746.
Sominsky L., Walker A.K., Ong L.K., Tynan R.J., Walker F.R., Hodgson D.M. Increased microglial activation in the rat brain following neonatal exposure to a bacterial mimetic. Behav. Brain Res. 2012. 226: 351–356.
Sominsky L., Fuller E.A., Bondarenko E., Ong L.K., Averell L., Nalivaiko E., Dunkley P.R., Dickson P.W., Hodgson D.M. Functional programming of the autonomic nervous system by early life immune exposure: implications for anxiety. PLoS One. 2013. 8: e57700.
Spencer S.J., Martin S., Mouihate A., Pittman Q.J. Early-life immune challenge: defining a critical window for effects on adult responses to immune challenge. Neuropsychopharmacology. 2006. 31: 1910–1918.
Spulber S., Mateos L., Oprica M., Cedazo-Minguez A., Bartfai T., Winblad B., Schultzberg M. Impaired long term memory consolidation in transgenic mice overexpressing the human soluble form of IL-1ra in the brain. J. Neuroimmunol. 2009. 208: 46–53.
Stellwagen D., Malenka R.C. Synaptic scaling mediated by glial TNF-alpha. Nature. 2006. 440: 1054–1059.
Stepanichev M., Dygalo N.N., Grigoryan G., Shishkina G.T., Gulyaeva N. Rodent models of depression: neurotrophic and neuroinflammatory biomarkers. Biomed. Res. Int. 2014. 2014: 932757.
Stephan A.H., Barres B.A., Stevens B. The complement system: an unexpected role in synaptic pruning during development and disease. Annu. Rev. Neurosci. 2012. 35: 369–389.
Streit W.J., Mrak R.E., Griffin W., Sue T. Microglia and neuroinflammation: a pathological perspective. J. Neuroinflammation. 2004. 1: 14.
Tay T.L., Savage J.C., Hui C.W., Bisht K., Tremblay M.E. Microglia across the lifespan: from origin to function in brain development, plasticity and cognition. J. Physiol. 2017. 595: 1929–1945.
Tishkina A., Stepanichev M., Kudryashova I., Freiman S., Onufriev M., Lazareva N., Gulyaeva N. Neonatal proinflammatory challenge in male Wistar rats: Effects on behavior, synaptic plasticity, and adrenocortical stress response. Behav. Brain Res. 2016. 304: 1–10.
Tremblay M.E., Majewska A.K. A role for microglia in synaptic plasticity? Commun. Integr. Biol. 2011. 4: 220–222.
Trofimov A., Strekalova T., Mortimer N., Zubareva O., Schwarz A., Svirin E., Umriukhin A., Svistunov A., Lesch K.-P., Klimenko V. Postnatal LPS challenge impacts escape learning and expression of plasticity factors Mmp9 and Timp1 in rats: effects of repeated training. Neurotox. Res. 2017. 32: 175–186.
Vafadari B., Salamian A., Kaczmarek L. MMP-9 in translation: from molecule to brain physiology, pathology, and therapy. J. Neurochem. 2016. S2: 91–114.
van Vliet E.O., de Kieviet J.F., Oosterlaan J., van Elburg R.M. Perinatal infections and neurodevelopmental outcome in very preterm and very low-birth-weight infants: a meta-analysis. JAMA Pediatr. 2013. 167: 662–668.
Vereker E., Campbell V., Roche E., McEntee E. Lynch M.A. Lipopolysaccharide inhibits long term potentiation in the rat dentate gyrus by activating caspase-1. http://www.jbc.org/content/275/34/26252.long – fn-1. J. Biol. Chem. 2000. 275: 26252–26258.
Vezzani A., Balosso S., Ravizza T. The role of cytokines in the pathophysiology of epilepsy. Brain Behav. Immun. 2008. 22: 797–803.
Viviani B., Bartesaghi S., Gardoni F., Vezzani A., Behrens M.M., Bartfai T., Binaglia M., Corsini E., Di Luca M., Galli C.L., Marinovich M. Interleukin-1beta enhances NMDA receptor-mediated intracellular calcium increase through activation of the Src family of kinases. J. Neurosci. 2003. 23: 8692–8700.
Viviani B., Gardoni F., Marinovich M. Cytokines and neuronal ion channels in health and disease. Int. Rev. Neurobiol. 2007. 82: 247–263.
Walker F.R., March J.D. Hodgson M. Endotoxin exposure in early life alters the development of anxiety-like behaviour in the Fischer 344 rat. Behav. Brain Res. 2004. 154: 63–69.
Walker A.K., Nakamura T., Byrne R.J., Naicker S., Tynan R.J., Hunter M., Hodgson D.M. Neonatal lipopolysaccharide and adult stress exposure predisposes rats to anxiety-like behaviour and blunted corticosterone responses: implications for the double-hit hypothesis. Psychoneuroendocrinol. 2009. 34: 1515–1525.
Walker C.D., Bath K.G., Joels M., Korosi A., Larauche M., Lucassen P.J., Morris M.J., Raineki C., Roth T.L., Sullivan R.M., Taché Y., Baram T.Z. Chronic early life stress induced by limited bedding and nesting (LBN) material in rodents: critical considerations of methodology, outcomes and translational potential. Stress. 2017. 20: 421–448.
Wang K.C., Fan L.W., Kaizaki A., Pang Y., Cai Z., Tien L.T. Neonatal lipopolysaccharide exposure induces long-lasting learning impairment, less anxiety-like response and hippocampal injury in adult rats. Neuroscience. 2013. 234: 146–157.
Wang X., Bozdagi O., Nikitczuk J.S., Zhai Z.W., Zhou Q., Huntley G.W. Extracellular proteolysis by matrix metalloproteinase-9 drives dendritic spine enlargement and long-term potentiation coordinately. Proc. Natl. Acad. Sci. USA. 2008. 105: 19520–19525.
Wei H., Zou H., Sheikh A.M., Malik M., Dobkin C., Brown W.T., Li X. IL-6 is increased in the cerebellum of autistic brain and alters neural cell adhesion, migration and synaptic formation. J. Neuroinflammation. 2011. 8: 52.
Wenzel A., Fritschy J.M., Mohler H., Benke D. NMDA receptor heterogeneity during postnatal development of the rat brain: differential expression of the NR2A, NR2B, and NR2C subunit proteins. J. Neurochem. 1997. 68: 469–478.
Williamson L.L., Sholar P.W., Mistry R.S., Smith S.H., Bilbo S.D. Microglia and memory: modulation by early-life infection. J. Neurosci. 2011. 31: 15511–15521.
Williamson L.L., Bilbo S.D. Chemokines and the hippocampus: a new perspective on hippocampal plasticity and vulnerability. Brain Behav. Immun. 2013. 30: 186–194.
Williamson L.L., Bilbo S.D. Neonatal infection modulates behavioral flexibility and hippocampal activation on a Morris Water Maze task. Physiol. Behav. 2014. 129: 152–159.
Williamson L.L., Chao A., Bilbo S.D. Environmental enrichment alters glial antigen expression and neuroimmune function in the adult rat hippocampus. Brain Behav. Immun. 2012. 26: 500–510.
Wu C.Y., Hsieh H.L., Sun C.C., Yang C.M. IL-1β induces MMP-9 expression via a Ca2+−dependent CaMKII/JNK/c-Jun cascade in rat brain astrocytes. Glia. 2009. 57: 1775–1789.
Wu Y., Dissing-Olesen L., MacVicar B.A., Stevens B. Microglia: dynamic mediators of synapse development and plasticity. Trend. Immunol. 2015. 36: 605–613.
Yamada K., McEwen B.S., Pavlides C. Site and time dependent effects of acute stress on hippocampal long-term potentiation in freely behaving rats. Exp. Brain Res. 2003. 152: 52–59.
Yang P.-C., Yang C.-H., Huang C.-C. Hsu K.-S. Phosphatidylinositol 3-kinase activation is required for stress protocol-induced modification of hippocampal synaptic plasticity. J. Biol. Chem. 2008. 283: 2631–2643.
Yirmiya R., Goshen I. Immune modulation of learning, memory, neural plasticity and neurogenesis. Brain Behav. Immun. 2011. 25: 181–213.
Yuen E.Y., Liu W., Karatsoreos I.N., Ren Y., Feng J., McEwen B.S., Yan Z. Mechanisms for acute stress-induced enhancement of glutamatergic transmission and working memory. Mol. Psychiatry. 2011. 16: 156–170.
Zoladz P.R., Warnecke A.J., Woelke S.A., Burke H.M., Frigo R.M., Pisansky J.M., Lyle S.M., Talbot J.N. Pre-learning stress that is temporally removed from acquisition exerts sex-specific effects on long-term memory. Neurobiol. Learn. Mem. 2013. 100: 77–87.
Дополнительные материалы отсутствуют.
Инструменты
Журнал высшей нервной деятельности им. И.П. Павлова


