Журнал высшей нервной деятельности им. И.П. Павлова, 2019, T. 69, № 6, стр. 711-725
ИСТОЧНИКИ ЭЛЕКТРИЧЕСКОЙ АКТИВНОСТИ ОБЛАСТЕЙ МОЗГА, ВОВЛЕЧЕННЫХ В ВООБРАЖЕНИЕ ДВИЖЕНИЙ
Я. В. Керечанин 1, 2, Д. Гусек 3, П. Д. Бобров 1, 2, И. Р. Федотова 1, А. А. Фролов 1, 2, *
1 Институт высшей нервной деятельности и нейрофизиологии РАН
Москва, Россия
2 Российский национальный исследовательский медицинский университет им. Н.И. Пирогова
Москва, Россия
3 Институт информатики, Чешская Академия наук
Прага, Чешская Республика
* E-mail: aafrolov@mail.ru
Поступила в редакцию 15.02.2019
После доработки 22.04.2019
Принята к публикации 03.06.2019
Аннотация
Описаны наиболее значимые источники электрофизиологической активности мозга, выделяемые при управлении интерфейсом мозг–компьютер, основанном на распознавании паттернов ЭЭГ при воображении движений. Главным инструментом их выделения являются 6 методов независимых компонент (ICA), базирующихся на различных критериях независимости. Показателями значимости источников являются: частота их встречаемости в различных экспериментальных сессиях; повторяемость их выделения в каждой сессии различными методами ICA; влияние каждого источника на точность распознавания паттернов ЭЭГ, соответствующих воображению различных движений, и возможность их аппроксимации активностью единичного токового диполя. По совокупности показателей выделены 5 источников, расположенных в первичной соматосенсорной коре обоих полушарий, в левой премоторной области, в дополнительной моторной области и предклинье. Обсуждается функциональное значение этих источников в рамках современных представлений о взаимодействии областей мозга, обеспечивающих выполнение двигательных функций.
ВВЕДЕНИЕ
Интерфейс мозг–компьютер (ИМК) – это программно-аппаратный комплекс, обеспечивающий управление внешними техническими устройствами непосредственно сигналами мозга, минуя естественную для этого мышечную активность. Наиболее широкое применение ИМК связано с двигательной реабилитацией постинсультных и посттравматических больных. К настоящему времени уже выполнено несколько объемных исследований, показавших эффективность тренировок на управление ИМК, основанном на воображении движений, для восстановления двигательных функций у таких больных [Ang et al., 2015; Frolov et al., 2017; Cervera et al., 2018]. Однако, кроме прикладного значения, следует отметить важность таких тренировок и для исследования фундаментальных проявлений активности мозга, впервые отмеченную в [Frolov et al., 2012]. За счет биологической обратной связи испытуемые тренируются стабилизировать и контрастировать паттерны активности мозга при выполнении ментальных задач, используемых для управления ИМК [Sitaram et al., 2016]. Это обеспечивает более надежное устойчивое и достоверное выделение и исследование этих паттернов и лучшее понимание особенностей функционирования мозга при выполнении соответствующих ментальных задач.
Основными инструментами, используемыми в наших работах для исследования активности мозга при управлении ИМК, основанном на воображении различных движений, являются методы независимых компонент (Independent Component Analysis, ICA) и решение обратной задачи ЭЭГ, учитывающее индивидуальную геометрии мозга и его покровов [Frolov et al., 2012]. ICA представляет многоканальный сигнал ЭЭГ в виде суперпозиции активностей статистически независимых компонент, каждая из которых характеризуется фиксированным распределением (топографической картой) потенциалов на поверхности головы и меняющейся по времени активностью. Методы ICA все шире используются для анализа ЭЭГ в целом и, в частности, при управлении ИМК [Kachenoura et al., 2008]. Во многом это стимулируется работами группы С. Макейга, декларирующего, что методы ICA в сочетании с методами решения обратной задачи вновь позволят вывести ЭЭГ на “передний фронт” (forefront) исследований мозга [Onton et al., 2006]. Однако остается открытым вопрос, насколько выделенные компоненты действительно отражают специфическую физиологическую активность мозга, а насколько – математические особенности методов их выделения. Этот вопрос особенно актуален в связи с тем, что многие компоненты имеют очевидную шумовую природу, и на начальном этапе применения ICA к ЭЭГ этот метод использовался главным образом только для удаления шумов [Bobrov et al., 2011].
В применении к анализу ЭЭГ предполагается, что каждая физиологически значимая компонента соответствует некоторому токовому диполю, положение и ориентация которого задают ее топографическую карту, а ее активность задается переменной величиной дипольного момента. Поэтому для ответа на вопрос об адекватности выделенной компоненты для анализа активности мозга мы предлагаем использовать следующие два формальных критерия. Считается, что компонента имеет физиологическую природу, если: 1) топографическая карта распределения потенциалов на поверхности головы, соответствующая выделенной компоненте, может быть хорошо приближена моделью одиночного токового диполя; 2) она выделяется несколькими методами ICA, в которых используются разные способы оценки независимости компонент.
Токовые диполи являются общепринятой моделью для описания источников электрофизиологической активности мозга, регистрируемой с поверхности головы [Grech et al., 2008]. Предположение о том, что каждая компонента соответствует единственному токовому диполю, основано на анатомических данных о том, что ближние связи между нейронами коры выражены гораздо больше, чем дальние. Поэтому локально синхронизованная активность в пределах участка коры размером порядка десятков квадратных миллиметров (характерный размер, например, источника сенсомоторного мю-ритма [Jones et al., 2009]) может рассматриваться как независимая от активности других удаленных участков такого же размера [Delorme et al., 2012].
В качестве других менее формальных критериев для оценки физиологической значимости каждой компоненты мы предлагаем использовать повторяемость ее выделения у разных испытуемых и у одного и того же испытуемого в различных экспериментальных сессиях и возможность интерпретации ее активности в связи с выполняемыми ментальными задачами. Следует заметить, что функционально идентичные компоненты никогда не являются идентичными по топографическим картам у разных испытуемых и даже в различных экспериментальных сессиях у одного и того же испытуемого. Это обусловлено различием анатомии мозга у разных испытуемых, различием установки электродов в разных экспериментальных сессиях и наличием специфических шумов в каждой сессии. Все эти факторы влияют на вид топографических карт у функционально идентичных компонент. Однако можно предположить, что для таких компонент топографические карты хотя и не идентичны, но все-таки схожи. Поэтому для поиска функционально идентичных компонент необходимо их классифицировать или объединить в кластеры по сходству топографических карт. Эта задача оказалась достаточно сложной и не имеющей однозначного решения, т.к. кластеры непрерывно переходят друг в друга и их границы зависят от метода кластеризации. В настоящей статье мы использовали для кластеризации топографических карт выделенных независимых компонент метод, основанный на применении аттракторной нейронной сети с увеличивающейся активностью ANNIA [Frolov et al., 2009], позволяющий выделять кластеры с максимальным средним уровнем попарного сходства элементов кластера [Bobrov et al., 2014].
Для физиологической интерпретации выделенных компонент мы сопоставляем локализацию соответствующих им токовых диполей с локализацией фокусов гемодинамической активности, найденных с помощью функциональной магниторезонансной томографии (фМРТ) при выполнении тех же ментальных задач. Метод фМРТ является в настоящее время наиболее продуктивным для локализации функций мозга и интерпретации функциональной роли различных его областей при исполнении, наблюдении и воображении движений. По результатам метаанализа данных фМРТ отмечается 32 области мозга, активность которых повышается при воображении движений, в 10 из них ее повышение отмечается регулярно практически во всех работах [Hetu et al., 2013]. Мы ограничиваемся здесь обсуждением только 5 источников электрофизиологической активности мозга, наиболее часто выделяемых методами ICA. Области мозга, содержащие эти источники, входят в число тех 10 областей мозга, которые отмечаются в [Hetu et al., 2013] как наиболее регулярно активируемые при воображении движений. Кроме данных фМРТ, для интерпретации функционального значения этих источников используются теоретические представления об организации двигательного управления, полученные в экспериментах на обезьянах [Risolatti et al., 2014].
Хотя мы располагаем данными ЭЭГ для более сотни постинсультных больных, прошедших двигательную реабилитацию с помощью тренировки на управление ИМК в рамках мультицентрового исследования imove [Frolov et al., 2017], мы не включили их анализ в настоящее исследование, которое рассматривается нами как описание нормы для будущего специального сравнения с данными для больных.
МЕТОДИКА
В исследовании приняли участие 27 человек (20 мужчин и 7 женщин) без явных психических и неврологических нарушений в возрасте от 21 до 36 лет. Испытуемые были заранее ознакомлены с экспериментальным протоколом и дали письменное согласие на участие в эксперименте. Протокол был одобрен этической комиссией Института высшей нервной деятельности и нейрофизиологии РАН.
Экспериментальная процедура
Для каждого испытуемого было проведено от 10 до 20 экспериментальных сессий по тренировке на управление ИМК, по 1–2 сессии в день. Интервал между экспериментальными днями составлял от 1 до 4 дней. Все испытуемые были проинструктированы воображать движения с помощью кинестетических, а не зрительных ощущений. Испытуемые должны были исполнять 3 инструкции, предъявляемые на экране компьютера: расслабиться или воображать открытие левой или правой кисти. Каждая инструкция предъявлялась в течение 10 с. Две инструкции для левой руки и две для правой, предъявляемые в случайном порядке, составляли блок. В каждой сессии было 10 таких блоков. Каждой инструкции на воображение движения предшествовала инструкция расслабиться. Подробнее протокол предъявления инструкций и условия проведения экспериментов описаны в [Mokienko et al., 2013].
Для управления ИМК использовался Байесовский классификатор, описанный в [Бобров и др., 2012], который, как показано в [Frolov et al., 2011], лишь незначительно уступает в точности более сложным классификаторам, при этом значительно превосходя их по экономии вычислений. Классификатор обучался распознавать воображение раскрытия левой или правой кисти и состояние расслабления по данным первого блока, а затем дополнительно обучался после каждого нового блока. Биологическая обратная связь, информирующая испытуемого о качестве выполнения ментальной задачи, заданной инструкцией, осуществлялась изменением яркости центрального кружка на экране компьютера в зависимости от вероятности распознавания именно того паттерна ЭЭГ, который соответствует инструкции.
Регистрация ЭЭГ осуществлялась при помощи энцефалографа gUSBamp (g-tec, Австрия) с 48 активными электродами и частотой оцифровки 256 Гц. Перед разложением ЭЭГ на независимые компоненты все записи последовательно фильтровались при помощи фильтра, подавляющего 50 Гц сетевую наводку, и фильтра с полосой пропускания 5–30 Гц.
Методы независимых компонент
Разложение на независимые компоненты представляет многоканальный сигнал ЭЭГ в виде:
где X является матрицей, каждая строка которой представляет сигнал ЭЭГ на некотором электроде для всех моментов времени, а каждый столбец – сигнал ЭЭГ на всех электродах в некоторый момент времени. Таким образом, число столбцов матрицы X равно числу отсчетов сигнала, а число строк – числу электродов Ne = 48. Вектор-столбец Wi задает распределение электрического потенциала по регистрирующим электродам, т.е. топографическую карту компоненты, вектор-строка ξi задает активность компоненты для всех моментов времени, k – число выделенных компонент. Векторы Wi нормировались на 1.Для поиска независимых компонент использовались 6 методов ICA.
Метод KURT [Hyvarinen et al., 2001] основан на минимизации отличия куртозиса активности компоненты от 3, т.е. от его значения для нормально распределенных сигналов. Известно, что суперпозиция независимых сигналов всегда имеет куртозис, более близкий к значению 3, чем каждый из них в отдельности, поэтому данный метод “декоррелирует” суперпозицию активностей источников на электродах, извлекая комбинацию каналов ЭЭГ, дающую куртозис, наиболее отличный от 3. Для сигналов ЭЭГ куртозис при этом, как правило, изменяется по сравнению с сигналами на отдельных электродах в сторону его увеличения, т.е. активности компонент имеют супергауссово распределение.
Метод FASTICA [Hyvarinen et al., 2001] основан на предположении, что активности независимых источников имеют наименьшую взаимную информацию. Так как минимизация точного выражения для взаимной информации нереализуема на практике, используются различные методы ее оценки. Алгоритм данного метода ищет такую смесь каналов, которая минимизирует значение взаимной информации между данной комбинацией и всеми остальными каналами.
Метод RUNICA [Bell, Sejnowski, 1995] является модификацией метода FUSTICA, использующей сразу несколько функций в качестве приближения выражения для взаимной информации. Смысл подобного усложнения состоит в том, что источники разделяются на супергауссовые (куртозис больше 3) и субгауссовые (куртозис меньше 3). Вычислительная сложность алгоритма значительно выше предыдущих двух, однако он позволяет вычислить большее число значимых источников.
Метод AMICA [Palmer et al., 2011] основан на представлении каждой компоненты как смеси сигналов, имеющих супергауссово распределение. Метод ищет параметры этих сигналов методом максимального правдоподобия. В используемой реализации этого подхода смеси содержат по 4 супергауссовых сигнала. Вычислительная сложность метода еще больше, чем у RUNICA, однако он позволяет находить наибольшее число значимых (см. далее) источников ЭЭГ.
Метод CUMUL [Hyvarinen et al., 2001] аналогичен методу KURT, но в нем находится максимальное отличие от нормального значения для кумулянта четвертого порядка с некоторым сдвигом по времени. В настоящей работе использовался сдвиг 80 мсек. Время сдвига соответствует периоду для сигнала со спектральным пиком 12 Гц, характерным для частоты альфа-ритма. Тем самым метод настроен на выделение компонент, имеющих частоту альфа-ритма.
Метод SOBI [Belouchrani et al, 1997] основан на том, чтобы сделать ковариационные матрицы активностей независимых компонент ξi, рассчитанные для нескольких сдвигов по времени, как можно ближе к диагональным, т.е. минимизировать корреляцию между активностями компонент в заданном диапазоне сдвигов по времени.
Для всех использованных методов число компонент k, выделяемых для каждой сессии, было равно числу строк в матрице X, т.е. числу Ne регистрирующих электродов. Разложение на независимые компоненты проводилось для каждой сессии тренировки на управление ИМК.
Показатель дипольности
Среди выделенных компонент большая их часть являются заведомо шумовыми, отражающими движения глаз, моргание, активность мышц головы, движения головы и потерю контактов электродов с кожей. Такие компоненты разумно сразу удалять из процедуры кластеризации и поиска значимых. Критерием удаления являлась невозможность приблизить их топографическую карту распределением потенциалов на поверхности головы от единичного токового диполя, расположенного в коре мозга. Для этого для топографической карты каждой компоненты искались положение и ориентация токового диполя, для которых распределение потенциалов на поверхности головы наилучшим образом описывало топографическую карту компоненты по показателю остаточной дисперсии. Распределение потенциалов на поверхности головы от токовых диполей, расположенных в коре мозга, рассчитывалось по стандартной модели головы, представленной в атласе Монреальского института неврологии (MNI). В качестве артефактных отсеивались компоненты, для которых не удавалось найти токовый диполь, приближающий топографическую карту с точностью до 5% остаточной дисперсии. Следует заметить, что компоненты, связанные с движением глаз и морганий, хотя и имеют топографические карты, которые могут быть достаточно хорошо аппроксимированы приближением единичного диполя, также отсеивались как артефактные, потому что аппроксимирующий их диполь располагался не в коре мозга. В результате отсеивания компонент, не удовлетворяющих критерию дипольности, для дальнейшего анализа использовалась примерно треть от их общего числа.
Отбор компонент по показателю их нахождения несколькими методами ICA
Кроме критерия дипольности, для отбора компонент, отражающих природу регистрируемого сигнала, а не особенности методов ICA, учитывалось также, сколькими методами ICA выделялась каждая компонента в каждой экспериментальной сессии. Поскольку в различных методах используются разные критерии независимости, можно считать, что компонента, выделяемая несколькими методами, содержит информацию именно о сигнале ЭЭГ, а не является артефактом метода. Для дальнейшего анализа отбирались только компоненты, которые выделялись по крайней мере двумя методами. Число методов, которыми компонента выделялась в одной сессии, мы назвали ее “рангом”. Считалось, что компоненты, выделяемые несколькими методами, соответствуют одному источнику ЭЭГ, если близки их топографические карты и корреляция между их активностями близка к единице (больше 0.8). Близость между топографическими картами задавалась косинусом между соответствующими им векторами Wi в формуле (1). Считалось, что топографические карты близки, если косинусы между векторами Wi превышали 0.95.
Компоненты, отнесенные к одному источнику, объединялись в одну компоненту, топографическая карта и активность которой задавались осреднением карт и активностей соответствующих компонент, найденных разными методами ICA. В результате этого число компонент в каждой экспериментальной сессии, используемых для дальнейшего анализа, еще уменьшалось примерно в два раза после отбора компонент, удовлетворяющих критерию дипольности.
Кластеризация топографических карт
В соответствии с использованным методом ANNIA (Attractor Neural Network with Increasing Activity, Аттракторная нейронная сеть с увеличивающейся активностью, [Frolov et al., 2009]), каждой топографической карте, полученной для каждой экспериментальной сессии, имеющей ранг больше 1 и удовлетворяющей критерию дипольности, ставился в соответствие один нейрон. Нейроны объединялись в сеть, в которой “синаптические” связи между нейронами задавались сходством между соответствующими картами. Сходство между топографическими картами с номерами i и j задавалось косинусом между векторами Wi и Wj, которые определяли распределения потенциала на поверхности головы для этих компонент по формуле (1) [Bobrov et al., 2014]. Поиск каждого кластера, группирующего топографические карты по максимальному их сходству, проводился с помощью двухходовой процедуры, определяющей траекторию активности сети. На каждом шаге внешнего цикла движения по траектории увеличивалось число активных нейронов со значения K до значения K + 1. На каждом шаге внутреннего цикла при фиксированном числе нейронов активировался их набор с большей суммарной синаптической связью, чем на предыдущем шаге, пока активность сети не стабилизировалась в состоянии некоторого аттрактора, соответствующего комбинации нейронов, имеющих максимальное значение суммы их синаптических связей при фиксированном числе нейронов [Frolov et al., 2009]. Поиск такой комбинации происходил за несколько шагов изменения активности сети по синхронной динамике. Таким образом, на каждом шаге внешнего цикла формировался кластер из K топографических карт, имеющих максимальное сходство. Внешний цикл начинался активацией случайно выбранных 5 нейронов и заканчивался, когда средняя сила синаптических связей уменьшалась до уровня 95% от ее максимальной величины на траектории.
После того, как один кластер был найден, нейроны, соответствующие этому кластеру, удалялись из сети, и начинался поиск нового кластера, пока не исчерпывались все нейроны сети.
Выделение компонент, значимых для управления ИМК
Для выбора значимых компонент использовался подход, предложенный в [Frolov et al. 2012]. В соответствии с этим подходом значимыми считались компоненты, комбинация которых обеспечивала максимальную эффективность управления ИМК. Эффективность управления оценивалась по показателю “каппа Коэна” κ [Kohavi, Provost, 1998], принимающему значение 1 при идеальном управлении, когда классификатор ИМК точно распознает выполнение ментальной задачи по инструкции, и значение 0, когда оно распознается случайно. Для каждой экспериментальной сессии и каждого метода ICA оценка показателя κ проводилась методом перекрестной проверки, когда классификатор обучался по комбинации из четырех блоков и тестировался по секундным отрезкам оставшихся шести блоков. Значение рассчитывалось усреднением по всем комбинациям из четырех блоков. Так как число возможных комбинаций компонент ${{2}^{{{{N}_{e}}}}}$ очень велико, то для выбора их оптимальной комбинации использовался “жадный” алгоритм, при котором оптимальная комбинация из трех компонент находилась с помощью их полного перебора, а в качестве каждой следующей компоненты, добавляемой к их оптимальной комбинации, выбиралась та, добавление которой обеспечивало наибольшее значение κ при увеличении числа компонент на 1. Значимость каждой компоненты оценивалась долей случаев, когда она выделялась как одна из оптимальных.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
Всего для 27 испытуемых было проведено 386 экспериментальных сессий, по 10–20 сессий для каждого испытуемого. Данные для каждой сессии были обработаны шестью методами ICA. На рис. 1 приведены средние значения показателя κ по всем сессиям каждого испытуемого, полученные по всем (светлые столбики) и по оптимальным (темные столбики) компонентам для всех методов ICA. Следует заметить, что расчет показателя качества управления ИМК по всем компонентам для случая классификации ЭЭГ по используемому методу Байеса эквивалентен расчету этого показателя просто по исходным данным [Frolov et al., 2012], поэтому показатель κ, рассчитанный по всем компонентам, от метода ICA не зависит. На рис. 1 испытуемые ранжированы по убыванию показателя κ, рассчитанному по всем компонентам. Рисунок демонстрирует широкое распределение испытуемых по качеству управления ИМК, которое уже отмечалось нами ранее [Фролов и др., 2017 а,б], и согласуется с данными других исследований [Blankertz et al., 2007].
Рис. 1.
Распределение испытуемых по показателю качества управления ИМК κ (каппа Коэна), осредненного по всем экспериментальным сессиям. Светлые столбики – управление по всем компонентам. Для используемого классификатора ИМК это эквивалентно управлению непосредственно по исходному многоканальному сигналу ЭЭГ, поэтому качество управления не зависит от метода ICA (светлые столбики для каждого испытуемого одинаковы). Более темные столбики – управление по оптимальному набору компонент, полученному разными методами ICA для разных сессий. Соответствие между методом ICA и темнотой столбика показано в таблице в верхней правой части рисунка.
Fig. 1. Distribution of subjects according to the BCI control quality index (Cohen’s kappa), averaged over all experimental sessions. Light bars – control by all components. For the used BCI classifier, controlling by all components is equivalent to controlling by the original multi-channel EEG signal, so the control quality does not depend on the ICA method (light bars for each subject are equal). The darker bars are quality indices for optimal sets of components obtained the by different ICA methods. The correspondence between the ICA method and the bar darkness is shown in the table in the upper right part of the figure.
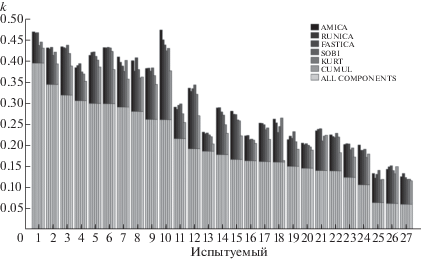
В целом качество управления ИМК значительно увеличивается при отсеивании незначимых (шумовых) компонент. В среднем по всем испытуемым и всем методам ICA оно возрастает по показателю κ от значения 0.18, полученному по всем компонентам, до значения 0.29, полученному по оптимальным. Таким образом, использование оптимальных компонент значительно увеличивает эффективность ИМК как технического устройства. Средние значения κ, полученные каждым методом по оптимальным компонентам, составляют: RUNICA – 0.3, AMICA – 0.3, KURT – 0.29, CUMUL – 0.25, SOBI – 0.29, FASTICA – 0.30.
Анализ методом ANOVA не выявил статистически значимых различий между оптимальными показателями κ, полученными разными методами ICA, хотя парные сравнения всех методов по тесту Манна–Уитни показали, что метод SOBI уступает большинству остальных методов по степени увеличения κ за счет выделения оптимальных компонент. Сходство оптимальных значений κ, полученных разными методами ICA, говорит о том, что широкое распределение испытуемых по качеству управления ИМК отражает скорее их физиологические различия, а не свойства методов классификации и анализа паттернов ЭЭГ.
После отбора компонент, удовлетворяющих критерию дипольности и имеющих ранг больше 1, осталось около десяти тысяч топографических карт. В результате их кластеризации по методу ANNIA получено около 200 кластеров, содержащих более 10 компонент. На рис. 2 показаны средние топографические карты для кластеров, компоненты которых выделяются относительно регулярно по всем сессиям. Кластеры ранжированы по частоте выделения компонент в сессиях. Как показано на рис 3 (а), компоненты первого из показанных кластеров выделяются более, чем в 60%, а компоненты последнего – в 5% сессий.
Рис. 2.
Средние топографические карты и средние спектральные плотности активностей компонент в первых 12 кластерах, упорядоченных по частоте выделения компонент кластеров в экспериментальных сессиях всех испытуемых, как показано на рис. 3 (а). Спектральные плотности показаны в условных единицах в диапазоне частот от 5 до 30 Гц для трех выполняемых заданий: сплошные линии – покой, штриховые линии – воображение движения кисти левой руки, пунктирные линии – правой руки.
Fig. 2. Topographic maps and spectral densities of the activities of the components averaged over all components in each cluster and ordered by the frequency of cluster component extraction in all the experimental sessions of all the subjects, as shown in fig. 3 (а). The spectral densities are shown in arbitrary units in the frequency range from 5 to 30 Hz for three tasks performed: solid lines – rest, dashed lines – imagination of the movement of the left hand, and dotted lines – of the right hand.
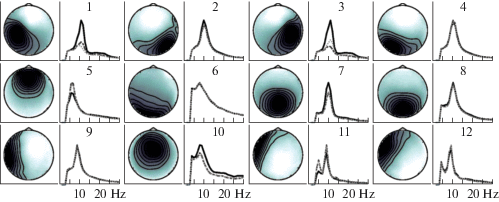
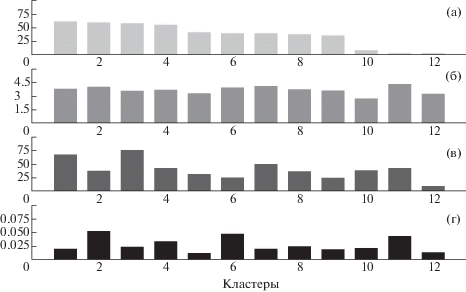
Рис. 3.
Показатели значимости источников электрофизиологической активности мозга, выделяемых при управлении ИМК, основанном на воображении движений. Источникам соответствуют компоненты, полученные разными методами ICA и объединенные в 12 кластеров, ранжированных по частоте выделения компонент кластера во всех экспериментальных сессиях. (а) – частота выделения компонент кластера в % от общего числа всех экспериментальных сессий. (б) – ранг компонент, осредненный по всем компонентам каждого кластера. (в) – частота вхождения компонент кластера в число оптимальных для управления ИМК в % от общего числа компонент кластера. (г) – осредненный показатель дипольности (относительная остаточная дисперсия наилучшего приближения топографической карты компоненты единичным токовым диполем) для всех компонент кластера.
Fig. 3. Indices of the significance for the sources of brain electrophysiological activity revealed in subjects controlling BCI, based on motor imagery. The sources correspond to components obtained by different ICA methods and combined into 12 clusters, ordered by the frequency of cluster component extraction. (а) – the frequency of cluster component extraction in % of the total number of all experimental sessions. (б) – rank of components, averaged over all components of each cluster. (в) – the frequency of cluster components to be optimal for BCI control in % of the total number of cluster components. (г) – dipole index (relative residual variance for the best approximation of the topographic map of the component by a single current dipole) averaged over all components of each cluster.
Для оценки ранга каждой независимой компоненты по числу методов ICA, которыми она была найдена, покажем вначале, что используемые методы не являются тождественными, хотя некоторые из них (например, RUNICA и FASTICA) и используют близкие критерии независимости компонент. В табл. 1 показано среднее “расстояние” r между методами, вычисленное по всем экспериментальным сессиям всех испытуемых. Для каждой экспериментальной сессии и каждой пары методов оно вычислялось как отношение числа различающихся компонент, найденных этими методами, к общему числу компонент. Таким образом, если методы дают тождественные результаты, то r = 0, и если результаты полностью различаются, то r = 1.
Таблица 1.
Средние “расстояния” между различными методами ICA Table 1. Average “distance” between ICA methods
| Методы | AMICA | KURT | CUMUL | SOBI | FASTICA |
|---|---|---|---|---|---|
| RUNICA | 0.69 | 0.92 | 0.97 | 0.96 | 0.82 |
| AMICA | 0.92 | 0.97 | 0.96 | 0.84 | |
| KURT | 0.97 | 0.97 | 0.93 | ||
| CUMUL | 0.98 | 0.97 | |||
| SOBI | 0.96 |
Из табл. видно, что все методы в среднем имеют большие расстояния друг от друга, т.е. находят сильно различающиеся наборы компонент, поэтому нахождение этими методами совпадающих компонент можно интерпретировать как нахождение компонент, заведомо отражающих природу сигнала, а не особенности методов. Тогда ранг каждой компоненты можно вычислять как число методов, которыми эта компонента была найдена, игнорируя возможность ее нахождения несколькими методами из-за их сходства.
На рис. 3 (б) приведены средние значения рангов для компонент кластеров. Для всех кластеров, кроме десятого, средний ранг компонент больше трех, т.е. в среднем каждая компонента кластера выделена более, чем тремя методами ICA. Наибольший ранг у компонент одиннадцатого кластера, он составляет примерно 4.5. Таким образом, можно считать, что компоненты действительно отражают физиологическую природу сигнала.
На рис. 3 (г) приведены средние показатели дипольности для компонент каждого кластера. Относительная величина остаточной дисперсии при аппроксимации топографической карты компоненты распределением потенциала от единичного токового диполя достигает порогового значения 0.05, установленного для отбора компонент по критерию дипольности, у кластеров 2, 6 и 11. Для остальных кластеров она не превышает 0.03.
Наконец, на рис. 3 (в) приведены оценки значимости каждого кластера для управления ИМК. За показатель значимости принята средняя по кластеру частота определения компонент как значимых. Наибольшую значимость имеют компоненты кластеров 1 и 3. Они соответствуют источникам мю-ритма в левом и правом полушариях, описанных нами ранее [Frolov et al., 2012; Фролов и др., 2017а]. Эти источники демонстрируют хорошо выраженную реакцию десинхронизации при воображении движений рук, причем она более выражена при воображении движений контралатеральной руки. Следующими по значимости являются компоненты кластеров 7, 10 и 11. Особенностью компонент кластера 10 является выраженность реакции десинхронизации в бета-диапазоне.
По совокупности всех показателей для дальнейшего обсуждения выбраны кластеры 1, 3, 7, 9 и 10. Компоненты кластера 2 имеют относительно малую значимость, компоненты кластеров 2, 6 и 11 на пороге их отбрасывания по критерию дипольности. У компонент кластеров 2, 5, 6 и 12 малая значимость, кроме того, компоненты кластера 12 относительно редко выделяются методами ICA.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Выбранные для обсуждения компоненты пяти кластеров соответствуют компонентам, выделенным ранее в работе [Фролов и др., 2017б] методом AMICA по данным для 7 здоровых испытуемых и 4 больных с незначительными подкорковыми очагами инсульта. Таким образом, приведенные здесь результаты, полученные для большого числа испытуемых и несколькими методами ICA, подтверждают правильность выбора этих компонент ранее. По аналогии с компонентами, описанными в работе [Фролов и др., 2017б], компоненты кластера 1 названы SIL, кластера 3 – SIR, кластера 7 – PRC, кластера 9 – PRM и кластера 10 – SMA, что соответствует локализации источников этих компонент, соответственно, в первичной соматосенсорной коре левого и правого полушарий (SIL, SIR), предклинье (PRC), вентральной премоторной коре левого полушария (PRM) и дополнительной моторной коре (SMA). Источники были локализованы в работе [Фролов и др., 2017б] с помощью решения обратной задачи ЭЭГ с учетом индивидуальной геометрии мозга и его покровов [Frolov et al., 2012].
Выделенные нами источники электрофизиологической активности принадлежат набору областей мозга, наиболее регулярно активирующихся по данным фМРТ при наблюдении, воображении, подготовке и исполнении движений [Grezes, Decety, 2001; Hetu et al., 2013]. Далее дается интерпретация функционального значения их активации.
Источники SIL и SIR в первичных соматосенсорных областях
Ритмическая активность в коре человека в диапазоне 7–13 Гц (альфа-диапазон) обслуживает работу коркового представительства различных сенсорных систем и делится согласно своей пространственной локализации на затылочный (зрительный) альфа-ритм, роландический (соматосенсорный) мю-ритм и тау-ритм (слуховой, регистрирующийся в средней височной области) [Hughes, Crunelli, 2005]. Корковые ритмы альфа-диапазона регистрируются не только в первичных сенсорных проекционных зонах, они выделяются во многих областях коры и значимы при решении широкого класса задач [Klimesch, 2012]. Известно, что увеличение амплитуды ритма (реакция синхронизации) соответствует торможению соответствующей области коры, а ее уменьшение (реакция десинхронизации) – снятию торможения [Pfurtscheller, Lopes da Silva, 1999]. Перераспределение возбудимости областей коры при перераспределении амплитуд ритмов альфа-диапазона, дающее приоритет одним сигналам перед другими, носит название воротного механизма [Jones , Kerr , 2010].
В задаче сенсорного внимания, при поступлении достаточно интенсивного сигнала той или иной модальности, происходит десинхронизация альфа-ритма в первичной области восприятия сигнала [Jones, Kerr, 2010; Anderson, Ding, 2011], наблюдается также реакция синхронизации вне этой области [Jones, Kerr, 2010], в частности, в симметричной области противоположного полушария и областях мозга, обслуживающих другую модальность [Anderson, Ding, 2011; Pfurtscheller, 1992]. Таким образом, в задаче сенсорного внимания воротный механизм регулируется непосредственно сенсорным сигналом, приходящим извне.
Похожее перераспределение амплитуд корковой активности диапазона альфа происходит при участии системы зеркальных нейронов в задачах, связанных с целенаправленным действием. Считается даже, что депрессию мю-ритма можно рассматривать как “меру активации” этой системы, т.е как “электрофизиологический маркер механизма зеркальных нейронов у человека” [Altschuler et al, 1997]. Собственно, это и является одной из функций зеркальных нейронов – подготовить первичную соматосенсорную область и, возможно, другие области коры к вероятному приходу сигналов о выполнении действия.
Депрессия альфа-ритма в первичной соматосенсорной области, контралатеральной актуальной конечности, в задачах наблюдения, воображения, подготовки и выполнения целенаправленного действия описывается в большом числе работ [Cochin at al., 1999; McFarland, Miner, 2000; Francuz, Zapala, 2011; Pfurtscheller et al, 2006]. Однако в симметричном отведении ипсилатерального полушария изменения не являются такими однозначными, как во время поступления внешнего сенсорного сигнала. Может наблюдаться как увеличение амплитуды мю-ритма [Nam et al., 2011], так и ее уменьшение [Васильев и др., 2016]. Как показано на рис. 2 (панели 1 и 3), в наших экспериментах десинхронизация мю-ритма при воображении движений кисти наблюдается в обоих полушариях, хотя в контралатеральном полушарии она выражена больше. Возможно исполнение или воображение движений кисти одной руки активирует расширенную нейронную сеть, включающую и области коры другого полушария хотя бы, например, потому, что весь опыт движений у человека требует, как правило, согласованного движения пальцев обеих рук [Васильев и др., 2016].
Источник PRM в премоторной области
В систему зеркальных нейронов человека входят передняя часть нижней теменной дольки, нижняя часть прецентральной извилины PMv и задняя часть нижней лобной извилины ВА44, которые образуют нижний круг взаимодействия лобных и теменных областей мозга [Rizzolatti, Craighero, 2004]. Выделенный нами источник электрофизиологической активности PRM находится в нижней премоторной коре PMv.
Как обсуждалось выше, одной из функций системы зеркальных нейронов является подготовка к восприятию сенсорных сигналов с помощью регуляции возбудимости коры. При этом амплитуда ритма альфа-диапазона регулируется не только в первичных областях коры, но и во вторичных и высокопорядковых ассоциативных областях. Считается, что при активации системы зеркальных нейронов происходит рассылка так называемых эфферентных копий ожидаемых сенсорных сигналов одновременно в различные области коры [Rizzolatti, Craighero, 2004]. При этом происходят соответствующие изменения амплитуды ритма по пути рассылки.
Именно с поступлением эфферентных копий можно связать активацию первичных соматосенсорных областей при отсутствии возможности естественного поступления туда сенсорного сигнала, например, в условиях ишемической блокады сенсорного входа [Christensen et al., 2007] у парализованных больных при попытке выполнения различных движений [Wang et al., 2013] и в многочисленных экспериментах с воображением движений [Pfurtscheller et al., 2006; Васильев и др., 2016; Фролов и др., 2017а].
В работе [Sun et al., 2015] была показана последовательная активация во времени премоторной, первичной соматосенсорной (через 53 мс) и затем первичной моторной области (через 136 мс) еще перед началом движения. Активация первичной и моторных областей более высокого порядка, по-видимому, является проявлением рассылки моторных команд все той же системой зеркальных нейронов. Моторная команда формируется при понимании действия через активацию словаря моторных действий, находящегося во фронтальной части системы зеркальных нейронов [Rizzolatti et al., 2014].
Таким образом, при получении инструкции о воображении движения или его выполнении происходит осознание инструкции и планирование движения, сопровождающееся рассылкой моторных команд в первичную и вторичные моторные области, а также рассылкой соответствующих эфферентных копий как в первичные проекционные сенсорные области, так и, возможно, в другие области, участвующие в создании условий для выполнения движения. При этом в этих областях создаются условия для улучшенного восприятия ожидаемых сигналов, сопровождающиеся депрессией ритма в альфа-диапазоне. Источник PMR в нижней премоторной коре (PMv) отражает работу системы зеркальных нейронов при кинестетическом воображении движения.
Источник в дополнительной сенсомоторной области SMA
Кроме системы зеркальных нейронов, в организации целенаправленных движений участвуют и другие области мозга, связанные с ней анатомически и функционально. Эти области обеспечивают сопряжение действия с реальным периперсональным пространством, учет положения тела в нем, а также учет целей и намерений субъекта, совершающего действие. В работе [Rizzolatti et al., 2014] описана совокупность таких областей, объединенных в так называемые фронто-париетальные круги, расположенные как бы параллельно друг другу. При этом система зеркальных нейронов, как уже отмечалось, образует нижний круг. Выделенные нами источники SMA и PRC расположены в областях, образующих верхний круг.
Как известно, функциональная роль SMA заключается в глобальном контроле моторной активности: торможение движения, организация последовательности движений, подготовка позы для наилучшего выполнения движения [Rizzolatti et al., 2014]. Регулярное стабильное выделение источника в SMA, видимо, соответствует тонической активации этой области при воображении движения, отражающей тонический запрет на его выполнение [Guillot et al., 2014].
Такое представление подкрепляется следующими данными. SMA и пре-SMA по данным fMRT активируются как при воображении, так и выполнении движений, но их активация выше при воображении, чем при выполнении движений [Gerardin et al., 2000; Malouin et al., 2003]. В [Kasess et al., 2008] было показано, что меньшая активация первичной моторной области при воображении движения по сравнению с активацией при его выполнении является результатом подавляющего влияния на нее со стороны SMA. О том, что при воображении движений моторная команда в первичной моторной коре все-таки представлена, говорит, например, работа [Ehrson et al., 2003], где авторы показали, что воображение движения руки, стопы и языка специфически активировало соответствующие представительства руки, ноги и языка в первичной моторной области. Однако в противоположность однозначным данным об активации SMA и пре-SMA данные по активации первичной моторной коры, полученные в работах, использующих методики fMRI и PET при кинестетическом воображении движения, являются противоречивыми. В некоторых работах ее активация была показана [Ehrsson et al., 2003; Guillot et al., 2009; Lotze et al., 1999; Nair et al., 2003; Porro et al., 2000; Solodkin et al., 2004], а в некоторых – нет [Binkofski et al., 2000, Gerardin et al., 2000, Hanakawa et al., 2003]. Однако транскраниальная магнитная стимуляция все же выявила увеличение возбудимости первичной моторной коры при кинестетическом воображении движения [Fadiga et al., 1999; Hashimoto, Rothwell, 1999; Stinear, 2010] и даже увеличение этой возбудимости при тренировке на управление ИМК [Mokienko et al., 2013]. Кроме того, активность электромиограммы в течение кинестетического воображения движения увеличилась в мышцах, которые задействуются при реальном выполнении этого движения [Fadiga et al., 1999]. Таким образом, четвертый выделенный источник в SMA, видимо, явился отражением торможения моторной команды, поступающей в первичную моторную кору при воображаемом движении.
Источник в предклинье PRC
Как уже упоминалось, предклинье, как и SMA, входит в верхний фронто-париетальный круг. Согласно данным литературы, в задачах, требующих длительного сохранения представлений о периперсональном пространстве, например, при отставленном задании повторить увиденное движение или вообразить его, область предклинья активируется достаточно стабильно [Rizzolatti, 2004]. Активация этой области происходит, когда при выполнении задачи задействуются представления о положении предметов или частей тела в пространстве [Cavanna, Trimble, 2006]. Предклинье активируется также в таких задачах, как выучивание последовательности движения пальцев [Catalan et al., 1998] и задачах ментального вращения [Alivisatos, Petride, 1997; Dong et al., 2000]. Таким образом, выделение нами источника в данной области может отражать осознание положения руки относительно частей тела и в пространстве.
Кроме того, предклинье – высокопорядковая ассоциативная зона коры, в которой объединяется информация от нескольких модальностей. В связи с этим можно предположить, что рассылка эфферентных копий в первичные сенсорные зоны может происходить и отсюда.
ЗАКЛЮЧЕНИЕ
Общая трудность интерпретации данных ЭЭГ заключается в том, что сигналы, регистрируемые каждым электродом на поверхности головы, являются результатом суперпозиции электрофизиологической активности множества источников, широко разнесенных по коре мозга. Поэтому сложилось общее мнение, что ЭЭГ обладает достаточно хорошим временным, но плохим пространственным разрешением. В последние годы делается много попыток увеличить это разрешение [Muler, Lemieux, 2010]. Одним из наиболее эффективных способов представляется применение к анализу многоканальных записей ЭЭГ методов независимых компонент ICA [Kachenoura et al., 2008; Onton et al., 2006; Delorme et al., 2012]. Они позволяют представить ЭЭГ как суперпозицию активностей отдельных дипольных корковых источников. Однако среди компонент, выделяемых этими методами, всегда присутствует большое количество заведомо артефактных, отражающих движения глаз и головы, специфические шумы на электродах и т.д. Поэтому актуальной является проблема выделения компонент, соответствующих именно электрофизиологической активности мозга. В настоящей работе предлагается несколько критериев для их выделения: регулярность повторения компоненты разными методами ICA в различных экспериментальных сессиях одного и того же и разных испытуемых, значимость компоненты для управления ИМК, возможность интерпретировать ее как связанную с активностью единичного дипольного источника и возможность ее физиологической интерпретации с точки зрения современных представлений о системе организации двигательного контроля в мозге. Все первые критерии имеют формальный технический характер. Они позволили выделить пять компонент, наиболее полно удовлетворяющих этим критериям. Последнему наименее формальному критерию уделено специальное внимание. Показано, что эти пять компонент хорошо соответствуют современным представлениям об организации двигательного управления ЦНС.
Выделение двух источников мю-активности в первичной соматосенсорной области SIL и SIR хорошо согласуется с представлениями о том, что при воображении движения мю-ритм меняется больше всего именно в этой области [Фролов и др., 2017а]. Уменьшение амплитуды мю-ритма при воображении движения является проявлением работы воротного механизма. Депрессия мю-ритма в первичной соматосенсорной области является следствием прихода туда эфферентных копий, сформированных системой зеркальных нейронов и рассылаемых в сходных задачах воображения, наблюдения и подготовки движения [Anderson, Ding, 2011; Jones S.R., Kerr C.E., 2010; Penna et al., 2004].
Выделение источника PMR в вентральной премоторной области PMv соответствует активности нижнего фронто-париетального круга, образованного системой зеркальных нейронов, в который она входит.
Источники SMA и PRC находятся в дополнительной моторной коре и предклинье, входящих в верхний фронто-париетальный круг, который обеспечивает связь воображаемого движения с периперсональным пространством, а также запрет на осуществление этого действия и, возможно, тоническую коррекцию воображаемого движения для удержания и усиления кинестетического ощущения по сигналам биологической обратной связи, получаемым от ИМК.
Работа выполнена при поддержке Российского фонда фундаментальных исследований (гранты № 16-29-08247 офи-м и № 16-29-08206 офи_м).
Список литературы
Бобров П.Д., Коршаков А.В., Рощин В.Ю., Фролов А.А. Байесовский подход к реализации интерфейса мозг–компьютер, основанного на представлении движений. Журн. высш. нервн. деят. 2012; 62 (1): 89–99.
Васильев А.Н., Либуркина С.П., Каплан А.Я. Латерализация паттернов ЭЭГ у человека при представлении движений руками в интерфейсе мозг–компьютер. Журн. высш. нерв. деят. 2016. 66 (3): 302–312.
Фролов А.А., Федотова И.Р., Гусек Д., Бобров П.Д. Ритмическая активность мозга и интерфейс мозг-компьютер, основанный на воображении движений. Успехи физиологических наук. 2017а. 48 (3): 72–91.
Фролов А.А., Азиатская Г.А., Бобров П.Д., Люкманов Р.Х., Федотова И.Р., Гусек Д., Снашел В. Электрофизиологическая активность мозга при управлении интерфейсом мозг-компьютер, основанном на воображении движений. Физиология человека. 2017б. 43 (5): 17–28.
Alivisatos B., Petrides M. Functional activation of human brain during mental rotation. Neuropsychologia. 1997. 35 (2): 111–118.
Altschuler E.L., Vankov A., Wang V., Ramachandran V.S., Pineda J.A. Person see, person do: human cortical electrophysiological correlates of monkey see monkey do cells. In: Poster Session Presented at the 27th Annual Meeting of the Society for Neuroscience; New Orleans: LA. 1997.
Anderson K.L., Ding M. Attentional modulation of the somatosensory mu rhythm. Neuroscience. 2011. 180: 165–180.
Ang K.K., Chua K.S., Phua K.S., Wang C., Chin Z.Y., Kuah C.W., Low W., Guan C. A Randomized Controlled Trial of EEG-Based Motor Imagery Brain–Computer Interface Robotic Rehabilitation for Stroke. Clin EEG Neurosci. 2015. 46 (4): 310–320.
Bell A.J., Sejnowski T.J. An information-maximization approach to blind separation and blind deconvolution. Neural comput. 1995. 7 (6): 1129–1159.
Belouchrani A., Abed-Meraim K., Cardoso J.-F., Moulines E. A blind source separation technique using second-order statistics. IEEE Transactions on signal processing. 1997. 45 (2): 434–444.
Binkofski F., Amunts K., Stephan K.M., Posse S., Schormann T., Freund H.J., Zilles K., Seitz R.J. Broca’s region subserves imagery of motion: a com-bined cytoarchitectonic and fMRI study. Hum Brain Mapp. 2000. 11 (4): 273–285.
Blankertz B., Dornhege G., Krauledat M., Müller K.R., Curio G. The non-invasive Berlin brain–computer interface: fast acquisition of effective performance in untrained subjects. NeuroImage. 2007. 37 (2). 539–550.
Bobrov P., Frolov A., Cantor C., Bakhnyan M., Zhavoronkov A. Brain-computer interface based on generation of visual images. PloS one. 2011. 6 (6): e20674.
Bobrov P., Frolov A., Husek D., Snášel, V. Clustering the Sources of EEG Activity during Motor Imagery by Attractor Neural Network with Increasing Activity (ANNIA). Proceedings of the Fifth International Conference on Innovations in Bio-Inspired Computing and Applications IBICA. Cham: Springer, 2014. 183–191 pp.
Catalan M.J., Honda M., Weeks R.A., Cohen L.G., Hallett M. The functional neuroanatomy of simple and complex sequential finger movements: a PET study. Brain. 1998. 121 (2): 253–264.
Cavanna A.E., Trimble M.R. The precuneus: a review of its functional anatomy and behavioural correlates. Brain. 2006. 129 (3): 564–583.
Cervera M.A., Soekadar S.R., Ushiba J., Millán J.D.R., Liu M., Birbaumer N., Garipelli G. Brain-computer interfaces for post-stroke motor rehabilitation: a meta-analysis. Annals of clinical and translational neurology. 2018. 5 (5). 651–663.
Christensen M.S., Lundbye-Jensen J., Geertsen S.S., Petersen T.H., Paulson O. B. Premotor cortex modulates somatosensory cortex during voluntary movements without proprioceptive feedback. Neurosci. 2007. 10 (4): 417–419.
Cochin S., Barthelemy C., Roux S., Martineau J. Observation and execu-tion of movement: similarities demonstrated by quantified electroen-cephalography. Eur J Neurosci. 1999. 11 (5): 1839–1842.
Delorme A., Palmer J., Onton J., Oostenveld R. Makeig S. Independent EEG sources are dipolar. PloS one. 2012. 7 (2): e30135.
Dong Y., Fukuyama H., Honda M., Okada T., Hanakawa T., Nakamura K., Nagahama Y., Nagamine T., Konishi J., Shibasaki H. Essential role of right superior parietal cortex in Japanse kana mirror reading. Brain. 2000. 123 (4): 790–799.
Ehrsson H.H., Geyer S., Naito E. Imagery of voluntary movement of fingers, toes and tongue activates corresponding body-part-specific motor representations. Journal of Neurophysiology. 2003. 90 (5): 3304–3316.
Fadiga L., Buccino G., Craighero L., Fogassi L., Gallese V., Pavesi G. Corticospinal excitability is specifically modulated by motor imagery: a magnetic stimulation study. Neuropsychologia. 1999. 37 (2): 147–158.
Francuz P., Zapata D. The suppression of the μ rhythm during the creation of imagery representation of movement. Neurosci Lett. 2011. 495 (1): 39–43.
Frolov A.A., Husek D., Polyakov P.Y. Recurrent-neural-network-based Boolean factor analysis and its application to word clustering. IEEE transactions on neural networks. 2009. 20 (7): 1073.
Frolov A., Husek D., Bobrov P. Comparison of four classification methods for brain–computer interface. Neural Network World. 2011. 21 (2): 101–115.
Frolov A., Husek D., Bobrov P., Korshakov A., Chernikova L., Konovalov R., Mokienko O. Sources of EEG activity most relevant to performance of brain-computer interface based on motor imagery. Neural Network World. 2012. 22 (1): 21–37.
Frolov A.A., Mokienko O., Lyukmanov R., Biryukova E., Kotov S., Turbina L., Nadareyshvily G., Bushkova Y. Post-stroke rehabilitation training with a motor-imagery-based brain-computer interface (BCI)-controlled hand exoskeleton: a randomized controlled multicenter trial. Frontiers in neuroscience. 2017.11. 400.
Gerardin E., Sirigu A., Lehericy S., Poline J.B., Gaymard B., Marsault C., Agid Y., Le Bihan D. Partially overlapping neural networks for real and imagined hand movements. Cereb Cortex. 2000. 10 (11): 1093–1104.
Grech R., Cassar T., Muscat J., Camilleri K.P., Fabri S.G., Zervakis M., Xanthopoulos P., Sakkalis V., Vanrumste B. Review on solving the inverse problem in EEG source analysis. Journal of Neuroengineering and Rehabilitation. 2008. 5. 25: 1–33.
Grezes J., Decety J. Functional anatomy of execution, mental simulation, observation, and verb generation of actions: a meta-analysis. Hum Brain Mapp. 2001. 12 (1): 1–19.
Guillot A., Collet C., Nguyen V.A., Malouin F., Richards C., Doyon J. Brain Activity During Visual Versus Kinesthetic Imagery: An fMRI Study. Hum Brain Mapp. 2009. 30 (7): 2157–2172.
Guillot A., Di Rienzo F., Collet C. The Neurofunctional Architecture of Motor Imagery. In Advanced Brain Neuroimaging Topics in Health and Disease – Methods and Applications. IntechOpen. 2014.
Hanakawa T., Immisch I., Toma K., Dimyan M.A., Van Gelderen P., Hallett M. Functional properties of brain areas associated with motor execution and imagery. J Neurophysiol. 2003. 89 (2): 989–1002.
Hashimoto R., Rothwell J.C. Dynamic changes in corticospinal excitability during motor imagery. Exp Brain Res. 1999. 125 (1): 75–81.
Hetu S., Gregoire M., Saimpont A., Coll M.P., Eugene F., Michon P.E. Jackson P.L. The neural network of motor imagery: an ALE meta-analysis. Neuroscience and Biobehavioral Reviews. 2013. 37 (5): 930–949.
Hyvarinen A., Karhunen J., Oje E. Independent component analysis. New-York: Wiley, 2001. 480 pp.
Hughes S.W., Crunelli V. Thalamic mechanisms of EEG alpha rhythms and their pathological implications. Neuroscientist. 2005. 11 (4): 357–372.
Jones S.R., Pritchett D.L., Sikora M.A., Stufflebeam S.M., Hämäläinen M., Moore C.I. Quantitative analysis and biophysically realistic neural modeling of the MEG mu rhythm: rhythmogenesis and modulation of sensory-evoked responses. Journal of neurophysiology. 2009. 102 (6): 3554–3572.
Jones S.R., Kerr C.E., Wan Q., Pritchett D.L., Hamalainen M., Moore C.I. Cued spatial attention drives functionally relevant modulation of the mu rhythm in primary somatosensory cortex. J. Neurosci. 2010. 30 (41): 13760–13775.
Kachenoura A., Albera L., Senhadji L., Comon P. ICA: a potential tool for BCI systems. IEEE Signal Processing Magazine. 2008. 25 (1): 57–68.
Kasess C.H., Windischberger C., Cunnington R., Lanzenberger R, Pezawas L., Moser E. The suppressive influence of SMA on M1 in motor imagery revealed by fMRI and dynamic causal modeling. NeuroImage. 2008. 40 (2): 828–837.
Klimesch W. Alpha-band oscillations, attention, and controlled access to stored information. Trends in Cognitive Sciences. 2012. 16 (12): 606–617.
Kohavi R., Provost F. Glossary of terms. Special Issue on Applications of Machine Learning and the Knowledge Discovery Process. Machine Learning. 1998. 30: 271–274.
Lotze L., Montoya P., Erb M., Hulsmann E., Flor H., Klause U., Birbaumer N., Grodd W. Activation of cortical and cerebellar motor areas during executed and imagined hand movements: an fMRI study. Journal of Cognitive Neuroscience. 1999. 11 (5): 491–501.
Malouin F., Richards C.L., Jackson P.L., Dumas F., Doyon J. Brain activations during motor imagery of locomotor-related tasks: a PET study. Human Brain Mapping. 2003. 19 (1): 47–62.
McFarland D.J., Miner L.A., Vaughan T.M., Wolpaw J.R. Mu and beta rhythm topographies during motor imagery and actual movements. Brain Topogr. 2000. 12 (3): 177–186.
Mokienko O., Chervyakov A., Kulikova S., Bobrov P., Chernikova L., Frolov A., Piradov M. Increased motor cortex excitability during motor imagery in brain-computer interface trained subjects. Frontiers in computational neuroscience. 2013. 7 (168).
Muler C., Lemieux L. EEG-fMRI. Physiological basis, techniques and application. Berlin: Springer. 2010.
Nair D.G., Purcott K.L., Fuchs A., Steinberg F., Kelso J.A.K. Cortical and cerebellar activity of the human brain during imagined and executed unimanual and bimanual action sequences: a functional MRI study. Cognitive Brain Research. 2003. 15 (3): 250–260.
Nam C.S., Jeon Y., Kim Y.J., Lee I., Park K. Movement imagery-related lateralization of event-related (de)synchronization (ERD/ERS): motor- imagery duration effects. Clin Neurophysiol. 2011. 122 (3): 567–77.
Onton J., Westerfield M., Townsend J., Makeig S. Imaging human EEG dynamics using independent component analysis. Neurosci Biobehav Rev. 2006. 30 (6): 808–822.
Palmer J.A., Kreutz-Delgado K., Makeig S. AMICA: An Adaptive Mixture of Independent Component Analyzers with Shared Components. San Diego, CA: Technical report, Swartz Center for Computational Neuroscience. 2011.
Penna S.D., Torquati K., Pizzella V., Babiloni C., Franciotti R., Rossini P.M., Romani G.L. Temporal dynamics of alpha and beta rhythms in human SI and SII after galvanic median nerve stimulation. A MEG study. NeuroImage. 2004. 22 (4): 1438–1446.
Pfurtscheller G. Event-related synchronization (ERS): an electrophysiological correlate of cortical areas at rest. Electroencephalogr Clin Neurophysiol. 1992. 83 (1): 62–69.
Pfurtscheller G., Lopes da Silva F.H. Event-related EEG/MEG synchronization and desynchronization: basic principles. Clin Neurophysiol. 1999. 110 (11). 1842–1857.
Pfurtscheller G., Brunner C., Schlogl A., Lopes da Silva F.H. Mu rhythm (de)synchronization and EEG single-trial classification of different motor imagery tasks. NeuroImage. 2006. 31 (1): 153–159.
Porro C.A., Cettolo V., Francescato M.P., Baraldi P. Ipsilateral involvement of primary motor cortex during motor imagery. European Journal of Neuroscience. 2000. 12 (8): 3059–3063.
Rizzolatti G., Craighero L. The mirror-neuron system. Annual Review of Neuroscience. 2004. 27: 169–192.
Rizzolatti G., Cattaneo L., Fabbri-Destro M., Rozzi S. Cortical mechanisms underlying the organization of goal-detected actionsand mirror neuron based action understanding. Physiol Rev. 2014. 94 (2). 655–706.
Sitaram R., Ros T., Stoeckel L., Haller S., Scharnowski F., Lewis-Peacock J., Weiskopf N., Blefari M., Rana M., Oblak E., Birbaumer N., Sulzer J. Closed-loop brain training: the science of neurofeedback. Nature Reviews Neuroscience. 2016. 18 (2): 86–100.
Solodkin A., Hlustik P., Chen E.E., Small S.L. Fine modulation in network activation during motor execution and motor imagery. Cereb Cortex. 2004. 14 (11): 1246–1255.
Stinear C.M. Corticospinal facilitation during motor imagery The neuro-physiological foundations of mental and motor imagery. Ed. Guillot A., Collet C. Oxford University Press. 2010. 47–61 pp.
Sun H., Blakely T.M., Darvas F., Wander J.D., Johnson L.A., Su D.K., Miller K.J., Fetz E.E., Ojemann J.G. Sequential activation of premotor, primary somatosensory and primary motor areas in humans during cued finger movements. Clinical Neurophysiology. 2015. 126 (11): 2150–2161.
Wang W., Collinger J.L., Degenhar A.D., Tyler-Kabara E.C., Schwartz A.B., Moran D.W., Weber D.J., Wodlinger B., Vinjamuri R.K., Ashmore R.C., Kelly J.W., Boninger M.L. An electrocorticographic brain interface in an individual with tetraplegia. PloS one. 2013. 8(2), e55344.
Дополнительные материалы отсутствуют.
Инструменты
Журнал высшей нервной деятельности им. И.П. Павлова


