Журнал высшей нервной деятельности им. И.П. Павлова, 2019, T. 69, № 5, стр. 618-628
ОТСРОЧЕННЫЕ ЭФФЕКТЫ ХИРУРГИЧЕСКОГО ВОЗДЕЙСТВИЯ В ПЕРИОД РАННЕЙ БЕРЕМЕННОСТИ НА РАЗВИТИЕ МОЗГА У КРЫС ЛИНИИ OXYS
И. Н. Рожкова 1, Е. Ю. Брусенцев 1, Т. Н. Игонина 1, Д. С. Рагаева 1, О. М. Петрова 1, 2, В. А. Напримеров 1, 4, М. А. Тихонова 1, 3, Т. Г. Амстиславская 2, 3, С. Я. Амстиславский 1, 2, *
1 Федеральное государственное бюджетное научное учреждение “Федеральный исследовательский центр
Институт цитологии и генетики Сибирского отделения Российской академии наук”
г. Новосибирск, Россия
2 Федеральное государственное автономное образовательное учреждение высшего образования
“Новосибирский национальный исследовательский государственный университет”
г. Новосибирск, Россия
3 Федеральное государственное бюджетное научное учреждение
“Научно-исследовательский институт физиологии и фундаментальной медицины”
г. Новосибирск, Россия
4 Новосибирский государственный аграрный университет
г. Новосибирск, Россия
* E-mail: amstis@bionet.nsc.ru
Поступила в редакцию 19.06.2018
После доработки 02.10.2018
Принята к публикации 20.11.2018
Аннотация
Целью настоящей работы было изучение эффектов стресса, вызванного хирургическим вмешательством в период ранней стадии беременности, на плотность нейронов в префронтальной коре и в CA1 и CA3 областях гиппокампа, а также нейрогенез в зубчатой извилине гиппокампа у взрослых потомков крыс линии OXYS. Самки линии OXYS были спарены с фертильными самцами той же линии и через 96 ч после обнаружения сперматозоидов во влагалищных мазках им была проведена хирургическая операция, имитирующая трансплантацию эмбрионов. Потомство этих самок (OXYS-PS) было исследовано в сравнении с интактными крысами линии OXYS и WAG в возрасте пяти месяцев. В префронтальной коре интактных крыс OXYS плотность пирамидных нейронов была достоверно больше, чем у крыс контрольной линии WAG. При этом плотность нейронов в области CA1 гиппокампа у интактных крыс OXYS была меньше, а в области CA3 больше по сравнению с крысами WAG. Достоверных различий в интенсивности нейрогенеза между интактными крысами линий WAG и OXYS обнаружено не было. У крыс экспериментальной группы OXYS-PS плотность пирамидных нейронов была снижена в префронтальной коре и в области CA1 гиппокампа по сравнению с обеими контрольными линиями, а в области CA3 – только по сравнению с интактными крысами OXYS. Кроме того, у крыс группы OXYS-PS наблюдался более высокий уровень нейрогенеза в зубчатой извилине гиппокампа по сравнению с обеими контрольными линиями.
ВВЕДЕНИЕ
Здоровье будущего ребенка во многом зависит от того, каким было его пренатальное развитие, и, в частности, от влияния, оказываемого материнским организмом на развивающийся эмбрион. Имеются данные о том, что стресс и другие негативные воздействия, испытываемые матерью в течение беременности, способны вызвать долгосрочные последствия, такие как нарушение динамики роста потомков, гипертонию и инсулиннезависимый диабет в постнатальный период [Barker, 2000]. Эти наблюдения легли в основу гипотезы DOHaD (Developmental Origin of Health and Disease), которая подкрепляется различными данными. Так, существуют работы по исследованию влияния пренатального стресса на изменения в поведении потомков во взрослом возрасте и возникновение у них различных неврологических расстройств [Barker, Thornburg, 2013; Wilson et al., 2013; Said et al., 2015; Badache et al., 2017].
Гипотеза DOHaD также применима к преимплантационной стадии пренатального онтогенеза и имеет различные экспериментальные подтверждения [Kwong et al., 2000; Рожкова и др., 2017; Igonina et al., 2018]. Например, хирургическое вмешательство, используемое при трансплантации эмбрионов, является стрессирующим фактором для самки-рецепиента. В работе на мышах было показано, что хирургические воздействия вызывают длительный и существенный подъем кортикостерона в крови беременных самок [Barlow et al., 1974]. Стресс может влиять на развивающийся организм в пренатальный период и иметь отсроченные последствия, что требует подробного изучения. Выявлено, что стресс у самки в преимплантационный период беременности приводил к замедлению неонатального развития потомков и в то же время к большему набору массы тела в месячном возрасте [Burkus et al., 2015], а также повышению уровня кортикостерона [Lerch et al., 2016].
Крысы линии OXYS были впервые выведены в ИЦиГ СО РАН и являются уникальной генетической моделью преждевременного старения и сопряженных с ним патологий. На настоящий момент эта линия насчитывает свыше 100 поколений селекции (и более 75 поколений инбридинга) и имеет различные нарушения [Kolosova et al., 2014], в том числе нейродегенеративного характера [Stefanova et al., 2014; 2015]. В большинстве предыдущих исследований, выполненных на крысах линии OXYS, в качестве контроля использовали крыс аутбредной линии Wistar [см. Kolosova et al., 2014; Stefanova et al., 2014 в качестве обзорных статей], мы выбрали крыс инбредной линии WAG (Wistar Albino Glaxo) с той же целью. В последнее время, когда исследование проводится на инбредных линиях крыс или мышей, настоятельно рекомендуется использовать в качестве контроля инбредные, а не аутбредные линии [Festing, 2014]. Крысы линии WAG были получены в процессе селекции и инбридинга от крыс линии Wistar также, как и крысы линии OXYS [Suckow et al., 2005]. К настоящему времени крысы линии WAG и OXYS всесторонне охарактеризованы, и вся соответствующая информация доступна через всемирную базу данных генома крыс [http://rgd.mcw.edu]. Было показано, что крысы линии WAG имеют “нормальный” фенотип без признаков катаракты и/или ретинопатии [Korbolina et al., 2012]. Крысы линии WAG, наряду с крысами Wistar, уже использовались в качестве контроля в исследованиях на крысах линии OXYS [Korbolina et al., 2012, 2014, 2016].
В недавней работе было показано, что для крыс OXYS характерно более медленное формирование неврологических рефлексов в неонатальном онтогенезе по сравнению с крысами WAG, в частности рефлекса переворачивания, рефлекса захвата и реакции избегания обрыва [Igonina et al., 2018]. В этой же работе было установлено, что на шестой день постнатального онтогенеза пирамидные нейроны в префронтальной коре головного мозга крысят OXYS были меньшего размера, и их плотность была ниже по сравнению с данными крысят WAG. В этом же возрасте плотность нейронов в области CA1 гиппокампа у крысят обеих линий не различалась, а в области CA3 была выше у крысят линии OXYS [Igonina et al., 2018].
Предыдущее исследование показало, что у взрослых потомков крыс линии OXYS от матерей, перенесших хирургическое воздействие в ранний период беременности, наблюдается снижение исследовательской активности в тесте открытое поле, о которой судили по следующим параметрам: сниженное время, проведенное в центре арены; меньшая исследованная область; сниженное число стоек и их продолжительность. Однако с чем именно связаны эти изменения поведения, остается неизвестным [Рожкова и др., 2017]. Мы предполагаем, что у быстро стареющих крыс линии OXYS наблюдаемое отклонение в поведении связано с нарушениями в таких отделах головного мозга, как префронтальная кора и гиппокамп, так как нарушения именно в этих структурах зачастую происходят при старении человека [Peinado, 1998; Yamada, Jinno, 2016]. Ранее у взрослых крыс были обнаружены нейродегенеративные изменения в гиппокампе [Максимова и др., 2014] и префронтальной коре [Stefanova et al., 2015].
Префронтальная кора является интегральным центром нервной системы [Franz, 1902; Feliciano, Bordey, 2013] и имеет связи с ядрами таламуса и гиппокампом, также она получает информацию от различных областей коры: теменной и сенсорной; образует связи с черной субстанцией, миндалиной, гипоталамусом и средним мозгом [Kolb, 1990; Groenewegen et al., 1997]. Так, префронтальная кора может влиять на работу всех вышеперечисленных структур, как путем тормозных, так и путем возбуждающих сигналов [Dalley et al., 2004].
Целью нашей работы являлось изучение отсроченных эффектов у взрослых потомков крыс линии OXYS, матери которых были подвергнуты хирургическому вмешательству в преимплантационный период беременности, на плотность нейронов в префронтальной коре и в CA1, CA3 областях гиппокампа, а также на интенсивность нейрогенеза в зубчатой извилине.
МЕТОДИКА
Экспериментальные животные. В эксперименте использовали крыс линий WAG и OXYS, которые содержались в SPF-виварии Института цитологии и генетики в индивидуально вентилируемых клетках (OptiRAT, Animal Care, США) при температуре 22–24°C и влажности 40–50%; в качестве подстилки использовались опилки. Суточный цикл состоял из 12 ч дня (с 4 ч утра до16 ч) и 12 ч ночи. Животные имели постоянный доступ к автоклавируемому стандартизированному корму (V1534-300, Sniff, Soest, Германия) и очищенной воде, обогащенной минеральными добавками (“Северянка”, “Экопроект”, Россия). Взрослые самцы и самки крыс в возрасте 12–14 недель содержались в группах по 2–3 животных перед началом эксперимента. Самцы перед началом спаривания были отсажены в отдельные клетки. Самки с потомством также содержались отдельно.
Самцы крыс линий WAG и OXYS были разделены на 3 группы: WAG – интактные животные (n = 4), OXYS – интактные животные (n = 4), OXYS-PS – потомки самок OXYS, подвергавшихся хирургическому воздействию во время беременности (n = 4). Все группы формировались из четырех пометов.
Все экспериментальные процедуры были одобрены комитетом по биоэтике Института цитологии и генетики (протокол № 12 от 6 декабря 2012 г.) и согласуются с Европейской конвенцией о защите позвоночных животных, используемых для экспериментальных и других научных целей. Исследования были проведены в Центре генетических ресурсов лабораторных животных Института цитологии и генетики Сибирского отделения Российской академии наук (RFMEFI62117X0015).
Хирургическое воздействие. У самок линии OXYS (n = 11) определяли стадию эструса по влагалищным мазкам. По достижении этой стадии их ссаживали с фертильными самцами этой же линии на ночь. Наличие вагинальных пробок свидетельствовало о фертильном спаривании. Именно таких самок брали в эксперимент. Через 96 ч после спаривания с фертильными самцами самкам линии OXYS экспериментальной группы (OXYS-PS, n = 5) проводили хирургическую операцию, аналогичную той, которую проводят при трансплантации эмбрионов. Для анестезии самке-реципиенту вводили медитин (0.02 мл на крысу) в.м. и через 10 мин внутрибрюшинно кетамин (0.2 мл на крысу). Затем подкожно вводили 0.02 мл амоксициллина (тригидрат амоксициллина, 150 мг/мл). Волосы в области операционного поля (правая сторона спины один см от нижнего ребра в вентральном направлении) выбривали, а кожу обрабатывали 70%-ным спиртом. Кожу и лежащий под ней мышечный слой в области матки разрезали дорсовентрально. Висцеральный жир вместе с яичником, яйцеводом и верхней частью матки захватывали пинцетом и доставали наружу. В правый рог матки с помощью стеклянного капилляра вводили 5 мкл среды FertiCult Flushing medium (FertiPro, Бельгия). Самок OXYS интактной группы (n = 6) не подвергали хирургической операции во время беременности, и они служили контролем.
Измерение плотности нейронов в префронтальной коре и гиппокампе взрослых крыс. Крысы WAG, OXYS и OXYS-PS в возрасте пяти месяцев были подвергнуты эвтаназии путем декапитации, и головной мозг каждой особи был перенесен на лед для гистологического исследования. После выделения из черепной коробки мозг переносили в фосфатный буфер, содержащий 4% параформальдегида, на 24 ч. Затем помещали мозг в 30%-ный раствор сахарозы в фосфатном буфере, содержащий 4% параформальдегида при +4°С для дегидратации и последующей фиксации в течение следующих 3–4 нед до того состояния, когда фиксированный материал погружается на дно колбы. После чего образцы мозга были заморожены с использованием Tissue-Tek O.C.T. (Sakura, США) и выдержаны при –70°С. Для получения гистологических препаратов изготавливали замороженные серийные срезы префронтальной коры и гиппокампа толщиной 30 мкм на криотоме Microcut-SADV (Histosafe, Китай) и помещали на предметные стекла, обработанные желатином. Затем срезы окрашивали по Нисслю для идентификации клеток в префронтальной коре и гиппокампе, как описано ранее [Ho et al., 2014; Weng et al., 2016]. При типе окрашивания с использованием тионина маркируются как нервные, так и ненервные, в частности, глиальные клетки. Однако нейроны окрашиваются намного более интенсивно, благодаря наличию вещества Ниссля (тигроида), представляющего собой скопление уплощенных цистерн гранулярного эндоплазматического ретикулyма. При подсчете оператор настраивает программу на распознавание именно этой интенсивности окраски. Таким образом, происходит учет именно нейронов.
Исследовали плотность нейронов в III–IV слоях префронтальной коры и в слое пирамидных нейронов CA1 и СА3 областей гиппокампа.
Так как нейроны в изучаемых областях гиппокампа плотно упакованы, плотность клеток измеряли с использованием полуколичественного метода, включающего в себя вычисление процента интересующей области, занятой окрашенными по Нисслю клетками [Ho et al., 2014]. Изображения одинаковых полей зрения были получены для всех участков каждой области гиппокампа, для этого использовался микроскоп Eclipse, CI-L (Nikon, Япония), соединенный с DS-2 камерой (Nikon, Япония) при увеличении 100×. Размер области интереса составил: 10 892 μм2 для префронтальной коры и 55 521 μм2 в CA1 и СА3 областях гиппокампа. Плотность нейронов подсчитывали при помощи Image Pro Plus Software 6.0 (Media Cybernetics, США).
Исследование нейрогенеза в гиппокампе взрослых крыс. Нейрогенез исследовали иммуногистохимическим методом у интактных крыс WAG, OXYS и OXYS-PS согласно методике, описанной ранее [Tikhonova et al., 2017]. Для рандомизации эксперимента срезы мозга для исследования нейрогенеза и подсчета плотности нейронов брали случайным образом у одних и тех же животных.
В возрасте пяти месяцев животных перфузировали 4% раствором параформальдегида в фосфатном буфере, после чего мозг быстро извлекали и фиксировали в фосфатном буфере, содержащем 30% сахарозы при +4°C. Впоследствии мозг погружали в Tissue-Tek O.C.T. compound (Sakura Finetek, США), замораживали и хранили при температуре –70°C. После этого делали срезы мозга толщиной 30 мкм при помощи криостата MicroCut – SADV (HistoSafe, Китай). Срезы инкубировали в Trilogy solution (Sigma-Aldrich Co., Германия) в течение одного часа при температуре +65°C. В целях исключения неспецифического фона срезы обрабатывали раствором Protein Block (Spring Bioscience, США) при комнатной температуре 30 мин. Для окрашивания в качестве первичных антител применяли кроличьи поликлональные антитела anti-doublecortin (DCX) (ab18723, 1:1000 dilution, Abcam, Великобритания), позволяющие пометить незрелые нейроны, при +4°C в течение ночи.
Для визуализации и подсчета помеченных нейронов применяли вторичные антитела с флуоресцентными метками Alexa Fluor 488 goat anti-rabbit IgG (ab150077, 1:400 dilution, Abcam, Великобритания), с которыми образец выдерживали при комнатной температуре в течение двух часов. Для предотвращения выцветания флуорохрома (снижения интенсивности флюоресценции) была использована гистологическая среда Fluoromount (Sigma-Aldrich Co., Германия). Флуоресцентные изображения были получены при помощи микроскопа Axioplan 2 (Carl Zeiss, Германия) при увеличении 200×.
DCX-положительные клетки были идентифицированы по зеленой флуоресценции и подсчитаны в субгранулярной зоне зубчатой извилины (DG) по всей протяженности гиппокампа (начиная от Bregma = –2.92 мм в каудальном направлении), за основу брали координаты атласа мозга крысы [Paxinos, Watson, 2013]. Всего было получено по 54 среза от каждого животного, из них проанализировано по девять срезов на животное. То есть нейроны подсчитывали в каждом шестом срезе с использованием программы ImageJ (NIH, США). Интервал между исследуемыми срезами составлял 150 мкм. Программа ImageJ позволяет полуавтоматически произвести подсчет выбранных оператором (вручную) клеток.
Статистический анализ. Результаты в таблице по плотности нейронов в префронтальной коре (число пирамидных нейронов в 1 мм3) и гиппокампе (процент площади занятой пирамидными нейронами), а также интенсивности нейрогенеза (число DCX-позитивных клеток) представлены как медиана с квартилями. Число DCX-положительных клеток пересчитывали на всю зубчатую извилину, то есть высчитывали среднее значение по исследованным срезам и умножали на общее число полученных срезов (всего 54 среза на каждое животное). Статистический анализ проведен с использованием критерия Краскела–Уоллиса. Различия при p < 0.05 считали статистически значимыми. Для проведения статистического анализа использовали стандартный пакет программного обеспечения STATISTICA v. 10 Stat Soft Inc.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
Измерение плотности нейронов в префронтальной коре взрослых крыс
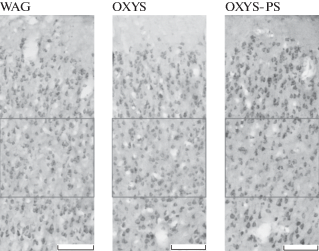
Данные по гистологическому анализу префронтальной коры у взрослых крыс WAG, OXYS и OXYS-PS представлены в табл. 1 и на рис. 1. У интактных крыс линии OXYS в префронтальной коре было обнаружено большее число нейронов (p < 0.05) по сравнению с крысами линии WAG. Однако плотность пирамидных нейронов в префронтальной коре у крыс экспериментальной группы OXYS-PS была ниже (p < 0.01) по сравнению с крысами интактных групп WAG и OXYS.
Таблица 1.
Плотность нейронов в префронтальной коре Table 1. The density of neurons in the prefrontal cortex
| Тестируемая группа | Число пирамидных нейронов (тыс. в 1 мм3), n |
|---|---|
| WAG | 73.1 [71.7; 74.5]а |
| OXYS | 74.6 [74.1; 78.8]б |
| OXYS-PS | 70.9 [67.6; 72.7]в |
Рис. 1.
Плотность нейронов у крыс WAG, OXYS, OXYS-PS в III–IV слое префронтальной коры. Увеличение – 100×, шкала = 100 мкм.
Fig. 1. The density of neurons in WAG, OXYS, OXYS-PS rats in the III–IV layers of the prefrontal cortex. Magnification, 100×; scale bar = 100 µm.
Измерение плотности нейронов в гиппокампе взрослых крыс
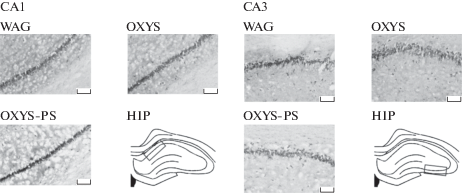
Результаты гистологического анализа CA1 и CA3 областей гиппокампа у взрослых крыс WAG, OXYS и OXYS-PS представлены в табл. 2 и на рис. 2. Был показан достоверно больший процент нейронов в области CA3 гиппокампа (p < 0.001) у интактных крыс OXYS по сравнению с крысами WAG. При этом в области CA1 гиппокампа процент пирамидных нейронов был меньше (p < 0.05) у интактных крыс OXYS по сравнению с крысами линии WAG. У крыс экспериментальной группы OXYS-PS процент пирамидных нейронов в области CA1 гиппокампа был меньше (p < 0.01) по сравнению с крысами интактных групп WAG и OXYS. Также наблюдался меньший процент пирамидных нейронов в области CA3 гиппокампа у крыс OXYS-PS (p < 0.01) по сравнению с крысами интактной группы OXYS.
Таблица 2.
Плотность нейронов в областях CA1 и CA3 гиппокампа Table 2. The density of neurons in the CA1 and CA3 regions of the hippocampus
| Тестируемая группа | % пирамидных нейронов* | |
|---|---|---|
| CA1 область гиппокампа | CA3 область гиппокампа | |
| WAG | 24.7 [21.8; 25.3]а | 18.5 [17.1; 19.6]г |
| OXYS | 21.3 [20.4; 22.0]б | 23.7 [23.4; 24.1]д |
| OXYS-PS | 17.2 [15.5; 18.5]в | 20.5 [19.8; 21.7]е |
Примечание. аб – p < 0.05; ав, бв, ге, де – p < 0.01; гд – p < 0.001; * – процент площади, занимаемой пирамидными нейронами на срезах в области интереса размером 55 521 μм2. Note. аб – p < 0.05; ав, бв, ге, де – p < 0.01; гд – p < 0.001: * – the percentage of the area occupied by pyramidal neurons on slices in the area of interest with a size of 55 521 μм2.
Рис. 2.
Плотность нейронов у крыс WAG, OXYS, OXYS-PS в областях CA1 и CA3 гиппокампа (HIP). Слой пирамидных нейронов. Увеличение – 100×, шкала = 100 мкм.
Fig. 2. The density of neurons in WAG, OXYS, OXYS-PS rats in the CA1 and CA3 regions of the hippocampus (HIP). Pyramidal neurons layer. Magnification, 100×; scale bar = 100 µm.
Исследование нейрогенеза в гиппокампе взрослых крыс
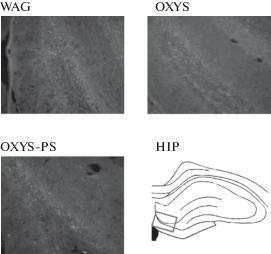
Данные иммуногистохимического анализа нейрогенеза в субгранулярной зоне DG гиппокампа у взрослых крыс WAG, OXYS и OXYS-PS представлены в табл. 3 и на рис. 3. Достоверных различий в интенсивности нейрогенеза между интактными крысами линий WAG и OXYS обнаружено не было. Однако число DCX-позитивных клеток, которые являются незрелыми нейронами, было больше у крыс OXYS-PS по сравнению с интактными группами WAG (p < 0.05) и OXYS (p < 0.01), что указывает на усиленный нейрогенез в гиппокампе у крыс, подвергнутых пренатальному стрессу.
Таблица 3.
Нейрогенез в субгранулярной зоне DG гиппокампа Table 3. Neurogenesis in the subgranular zone of the hippocampal DG
| Тестируемая группа | Число DCX-позитивных клеток, n |
|---|---|
| WAG | 1356 [1089; 1703]а |
| OXYS | 1350 [891; 1662]б |
| OXYS-PS | 2235 [1650; 2766]в |
Рис. 3.
Нейрогенез у крыс WAG, OXYS, OXYS-PS в субгранулярной зоне DG гиппокампа (HIP). Иммуногистохимический анализ с применением кроличьих поликлональных антител anti-doublecortin (DCX) и вторичных антител с флуоресцентными метками Alexa Fluor 488 goat anti-rabbit IgG. Увеличение – 200×.
Fig. 3. Neurogenesis in WAG, OXYS, OXYS-PS rats in the subgranular zone of the hippocampal DG. Immunohistochemical analysis with the use of rabbit polyclonal anti-doublecortin (DCX) antibody and secondary antibody (Alexa Fluor 488 goat anti-rabbit IgG). Magnification, 200×.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Как было установлено нами ранее, у крысят линии OXYS в возрасте 6 дней наблюдается достоверно меньшая плотность пирамидных нейронов в префронтальной коре и более высокая плотность нейронов в области CA3 гиппокампа по сравнению с контрольной линией WAG [Igonina et al., 2018]. В настоящей работе показано, что в возрасте 5 мес. плотность нейронов в префронтальной коре головного мозга у контрольных крыс обеих линий была ниже, чем в возрасте 6 дней, как было продемонстрировано в нашей прошлой работе [Igonina et al., 2018], что объясняется нормальной возрастной динамикой снижения числа пирамидных нейронов в изученных нами структурах головного мозга и согласуется с результатами других исследователей. Известно, что как в гиппокампе, так и в коре мозга крысы число нейронов существенно возрастает в течение первой недели после рождения и снижается в ходе дальнейшего онтогенеза [Bandeira et al., 2009]. Число других клеток в мозге крыс увеличивается в течение первых трех недель жизни, оставаясь на этом уровне и в дальнейшем [Bandeira et al., 2009].
Из результатов нашей работы следует, что у интактных крыс OXYS плотность пирамидных нейронов в III–IV слое префронтальной коры была выше, чем у крыс WAG. Это согласуется с выводами более ранней работы, в которой также было обнаружено, что у крыс этой линии число пирамидных нейронов в III–IV слое префронтальной коры и гиппокампе повышено по сравнению с крысами Wistar в возрасте четырех месяцев на фоне выраженных нейродегенеративных изменений в данных структурах мозга, что интерпретируют как эндогенный компенсаторный механизм тканевой репарации [Stefanova et al., 2015].
В нашей работе были обнаружены более высокая плотность нейронов в области CA3 гиппокампа у крыс линии OXYS и меньшая плотность в области CA1 по сравнению с крысами линии WAG. В работе Stefanova et al. [2014] было показано, что у взрослых крыс OXYS плотность нейронов в областях CA1 и CA3 гиппокампа больше, чем у крыс линии Wistar, хотя в более поздней работе у крыс OXYS наблюдалась более низкая плотность нейронов в области CA1 по сравнению с тем же контролем [Tikhonova et al., 2017]. Противоречия в результатах этих работ, возможно, могут быть связаны с тем, что в качестве контроля к инбредной линии крыс OXYS в обеих работах были взяты аутбредные крысы Wistar. Согласно современным рекомендациям, для получения воспроизводимых результатов следует использовать стандартизированных животных (SPF-статуса), и наиболее адекватным контролем к инбредным линиям считается инбредная линия [Festing et al., 1998; Festing, 2014].
Восстановление после операции, по нашим наблюдениям, занимает не менее недели. В исследованиях на лабораторных животных показано, что после хирургических воздействий, в том числе и на беременных самках мышей, происходит существенный подъем уровня кортикостерона, который может превышать исходный уровень в сто и более раз [Barlow et al., 1975] и хирургическое воздействие на мать в преимплантационный период беременности имеет следствием возрастание уровня кортикостерона у потомков [Lerch et al., 2016]. Таким образом, его последствия оказывают действие не только на преимплантационной стадии, которая у крыс происходит на 5–6-й день после спаривания [Sposito, Santos, 2011], но и на более поздних этапах развития зародыша. По всей видимости, именно с этими воздействиями в раннем пренатальном онтогенезе связаны обнаруженные нами эффекты у потомков: уменьшение плотности пирамидных нейронов в префронтальной коре, в областях CA1, CA3 гиппокампа и усиление нейрогенеза в DG у взрослых особей. Материнский стресс, по всей вероятности, спровоцировал ускорение нейродегенеративных процессов у потомков крыс OXYS, что согласуется с гипотезой DOHaD, которая предполагает, что некоторые болезни, такие как артериальная гипертензия, метаболические и нейрокогнитивные расстройства, закладываются еще в перинатальный период, хотя проявляются на поздних этапах постнатального онтогенеза [Barker, 1999; Wadhwa et al., 2009; Goldstein et al., 2017]. Из наблюдений, полученных на людях, известно, что дети, матери которых перенесли стресс, вызванный неоптимальной диетой во время беременности, имели различные неврологические заболевания [Barker, Thornburg, 2013]. Ретроспективный анализ показал, что люди, которые были зачаты в период “Голодной зимы 1944–45-х годов” в Нидерландах, во время которой их матери голодали, начиная с ранних стадий беременности в течение пяти месяцев, во взрослом возрасте имели повышенный риск наступления шизофрении и депрессии, были более восприимчивы к стрессу, а также хуже выполняли когнитивные задачи по сравнению с детьми, чьи матери испытывали голод на поздних стадиях беременности [Roseboom et al., 2011].
Обнаруженная нами меньшая плотность пирамидных нейронов в префронтальной коре и исследуемых областях гиппокампа у животных экспериментальной группы OXYS-PS, возможно, связана с нейродегенеративными процессами, которые характерны для крыс линии OXYS в более позднем возрасте [Stefanova et al., 2015]. Так, в возрасте 18 мес нейродегенерация в префронтальной коре и в областях CA1 и CA3 гиппокампа у крыс OXYS прогрессирует и приводит уже к значительному снижению плотности нейронов в гиппокампе [Stefanova et al., 2015]. Более низкая плотность пирамидных нейронов у крыс OXYS-PS по сравнению с интактными OXYS, описанная в настоящей работе, может также указывать на развитие нейродегенеративных процессов и более раннее изменение уровня экспрессии некоторых генов в нейронах префронтальной коры [Stefanova et al., 2014; Rudnitskaya et al., 2017] у потомков, рожденных матерями, перенесшими стресс на ранних этапах беременности. Нарушение или задержка в развитии структуры может привести к изменению ее функционирования и, как следствие, развитию дефицитов памяти, планирования, внимания и обучения [Kesner, Churchwell, 2011]. Поскольку гиппокамп и префронтальная кора участвуют в когнитивных процессах [Thierry et al., 2000; Hernandez-Hernandez, 2016], выявленные различия в морфометрических показателях этих структур мозга у крыс OXYS-PS могут влиять на когнитивные функции и, возможно, связаны с наблюдаемым ранее изменением поведения у этих животных в возрасте трех месяцев [Рожкова и др., 2017].
В последние десятилетия изучению нейрогенеза и нейральных стволовых клеток придают большое значение; эти исследования существенно расширили фундаментальные знания о процессах развитии и функционирования мозга млекопитающих и человека [Александрова, Марей, 2015]. В нашей работе не обнаружено различий в интенсивности нейрогенеза между интактными крысами линии OXYS и WAG, хотя у потомков от самок OXYS, подвергнутых хирургическому воздействию в ходе ранней беременности, наблюдалась более высокая интенсивность нейрогенеза. Более ранние исследования показали, что у взрослых крыс OXYS отмечаются усиленный нейрогенез в DG по сравнению с контрольными крысами линии Wistar и одновременно нейродегенеративные изменения в областях CA1 и CA3 гиппокампа [Максимова и др., 2014; Stefanova et al., 2014; 2015; Tikhonova et al., 2017].
В отличие от перечисленных работ, мы не обнаружили усиленный нейрогенез у интактных взрослых крыс OXYS, что может быть связано с тем, что во всех этих исследованиях в качестве контроля были использованы крысы линии Wistar. В нашем же исследовании в качестве контроля были использованы инбредные крысы линии WAG. Усиление нейрогенеза в области DG гиппокампа у экспериментальных крыс OXYS-PS, возможно, также является компенсаторной реакцией на дегенерацию нейронов в возрасте пяти месяцев [Максимова и др., 2014]. Ранее было показано, что молодые (3–4 мес.) крысы OXYS отличаются высоким уровнем нейротрофического фактора мозга (BDNF), ключевого нейротрофического фактора, регулирующего нейрогенез, выживаемость нейронов и синаптическую пластичность [Rudnitskaya et al., 2015]. Возможно, у крыс OXYS-PS могут быть нарушения и в этой системе, что приводит к наблюдаемым изменениям, требуется дальнейшее изучение для подтверждения предположения.
В исследованиях на мышах было показано, что рестрикционный стресс на ранних этапах беременности, соответствующих преимплантационному развитию эмбрионов, сопровождался замедлением неонатального развития потомков и большей массой тела в возрасте одного месяца [Burkus et al., 2015]. В работе Lerch et al. [2016] при хирургическом воздействии на самок мышей в первые дни беременности, аналогичном тому, которое было использовано нами, авторы обнаружили возрастание уровня кортикостерона у потомков женского пола в возрасте 8–10 нед. Наши результаты находятся в соответствии с выводами этих работ и свидетельствуют о том, что воздействие на беременную самку крысы в период преимплантационного развития эмбрионов отражается на морфологическом состоянии головного мозга потомков.
ЗАКЛЮЧЕНИЕ
Хирургическое воздействие на самку в преимплантационный период беременности может негативно влиять на развивающийся эмбрион, в частности, как показано в настоящей работе, приводить к снижению плотности пирамидных нейронов в префронтальной коре и в областях CA1, CA3 гиппокампа, что согласуется с гипотезой DOHaD. Усиление нейрогенеза в области DG гиппокампа у этих животных, по-видимому, носит компенсаторный характер.
Исследования поддержаны бюджетным проектом (№ 0324-2019-0041) и выполнены с использованием оборудования ЦКП “SPF-виварий”, поддержанного Минобрнауки России (Уникальный идентификатор проекта RFMEFI62117X0015).
Список литературы
Александрова М.А., Марей М.В. Стволовые клетки в мозгу млекопитающих и человека: фундаментальные и прикладные аспекты. Журн. высш. нерв. деят. 2015. Т. 65. № 3. С. 271–305.
Максимова К.Ю., Стефанова Н.А., Логвинов С.В. Морфологические изменения нейронов в гиппокампе крыс при преждевременном старении. Бюлл. Сиб. Мед. 2014. Т. 13. №1. С. 56–61.
Рожкова И.Н., Игонина Т.Н., Рагаева Д.С., Петрова О.М., Брусенцев Е.Ю., Напримеров В.А., Амстиславский С.Я. Отсроченные эффекты хирургического воздействия, перенесенного матерью в период ранней беременности, на артериальное давление и поведение потомков у крыс линии OXYS. Вавилов. журн. генет. и селекции. 2017. Т.21. № 8. С. 937–942.
Badache S., Bouslama S., Brahmia O., Baïri A.M., Tahraoui A.K., Ladjama A. Prenatal noise and restraint stress interact to alter exploratory behavior and balance in juvenile rats, and mixed stress reverses these effects. Stress. 2017. 20: 320–328.
Bandeira F., Lent R., Herculano-Houzel S. Changing numbers of neuronal and non-neuronal cells underlie postnatal brain growth in the rat. Proc. Natl. Acad. Sci. U S A. 2009. 106 (33): 14108–14113.
Barker D.J. Fetal undernutrition and adult hypertension. Hand. Hyperten. 1999. 19: 587–599.
Barker D.J. In utero programming of cardiovascular disease. Theriogenology. 2000. 53: 555–574.
Barker D.J., Thornburg K.L. The obstetric origins of health for a lifetime. Clin. Obstet. Gynecol. 2013. 56: 511–519.
Barlow S.M., Morrison P.J., Sullivan F.M. Effects of acute and chronic stress on plasma corticosterone levels in the pregnant and non-pregnant mouse. J. Endocrinol. 1975. 66 (1): 90–99.
Burkus J., Kacmarova M., Kubandova J., Kokosova N., Fabianova K., Fabian D., Koppel J., Cikos S. Stress exposure during the preimplantation period affects blastocyst lineages and offspring development. J. Reprod. Dev. 2015. 61 (4): 325–331.
Dalley J.W., Cardinal R.N., Robbins T.W. Prefrontal executive and cognitive functions in rodents: neural and neurochemical substrates. Neurosci. Biobehav. Rev. 2004. 28 (7): 771–784.
Feliciano D.M., Bordey A. Newborn cortical neurons: only for neonates? Trends in Neurosci. 2013. 36 (1): 51–61.
Festing M.F., Baumans V., Combes R.D., Halder M., Hendriksen C.F., Howard B.R., Lovell D.P., Moore G.J., Overend P., Wilson M.S. Reducing the use of laboratory animals in biomedical research: problems and possible solutions. Altern. Lab. Anim. 1998. 26 (3): 283–301.
Festing M.F. Evidence should trump intuition by preferring inbred strains to outbred stocks in preclinical research. ILAR J. 2014. 55 (3): 399–404.
Franz S.I. On the functions of the cerebrum. I. The frontal lobes in relation to the production and retention of simple sensory-motor habits. Am. J. Physiol. 1902. 8: 1–22.
Ho S.C., Hsu C.C., Pawlak C.R., Tikhonova M.A., Lai T.J., Amstislavskaya T.G., Ho Y.J. Effects of ceftriaxone on the behavioral and neuronal changes in an MPTP-induced Parkinson’s disease rat model. Behav. Brain. Res. 2014. 268: 177–184.
Goldstein J.A., Norris S.A., Aronoff D.M. DOHaD at the intersection of maternal immune activation and maternal metabolic stress: a scoping review. J. Dev. Orig. Heal. Dis. 2017. 1–11.
Groenewegen H.J., Wright C.I., Uylings H.B.M. The anatomical relationships of the prefrontal cortex with limbic structures and the basal ganglia. J. Psychopharm. 1997. 11 (2): 99–106.
Hernandez-Hernandez M.E., Serrano-Garcia C., Antonio Vazquez-Roque R., Diaz A., Monroy E., Rodriguez-Moreno A., Floran B., Flores G. Chronic administration of resveratrol prevents morphological changes in prefrontal cortex and hippocampus of aged rats. Synapse. 2016. 70 (5): 206–217.
Igonina T.N., Ragaeva D.S., Tikhonova M.A., Petrova O.M., Herbeck Yu.E., Rozhkova I.N., Amstislavskaya T.G., Amstislavsky S.Ya. Neurodevelopment and behavior in neonatal OXYS rats with genetically determined accelerated senescence. Brain. Res. 2018. 1681: 75–84.
Kolb B. Prefrontal cortex. In: The Cerebral Cortex of the Rat. Bryan Kolb and Richard C. Tees, Eds. MIT Press, Cambridge, MA, 1990. 645 p.
Korbolina E.E., Kozhevnikova O.S., Stefanova N.A., Kolosova N.G. Quantitative trait loci on chromosome 1 for cataract and AMD-like retinopathy in senescence-accelerated OXYS rats. Aging. 2012. 4 (1): 49–59.
Korbolina E.E., Ershov N.I., Bryzgalov L.O., Kolosova N.G. Application of quantitative trait locus mapping and transcriptomics to studies of the senescence-accelerated phenotype in rats. BMC Genomics. 2014. 15: S3.
Korbolina E.E., Zhdankina A.A., Fursova A.Z., Kozhevnikova O.S., Kolosova N.G. Genes of susceptibility to early neurodegenerative changes in the rat retina and brain: analysis by means of congenic strains. BMC Genetics. 2016. 17: 153.
Kolosova N.G., Stefanova N.A., Korbolina E.E., Fursova A.Zh., Kozhevnikova O.S. Senescence-accelerated OXYS rats: A genetic model of premature aging and age-related diseases. Advanc. Gerontol. 2014. 4: 294–298.
Kesner R.P., Churchwell J.C. An analysis of rat prefrontal cortex in mediating executive function. Neurobiol. Learn. Mem. 2011. 96 (3): 417–431.
Kwong W.Y., Wild A.E., Roberts P., Willis A.C., Fleming T.P. Maternal undernutrition during the preimplantation period of rat development causes blastocyst abnormalities and programming of postnatal hypertension. Development. 2000. 127: 4195–4202.
Lerch S., Tolksdorf G., Schutz P., Brandwein C., Dormann C., Gass P., Chourbaji S. Effects of embryo transfer on emotional behaviors in C57BL/6 mice. J. Am. Assoc. Lab. Anim. Sci. 2016. 55 (5): 510–519.
Paxinos G., Watson C. The Rat Brain in Stereotaxic Coordinates 7th Edition. Academic Press. 2013. 472 p.
Peinado M.A. Histology and histochemistry of the aging cerebral cortex: an overview. Microsc. Res. Tech. 1998. 43 (1): 1–7.
Roseboom T.J., Painter R.C., van Abeelen A.F., Veenendaal M.V., de Rooij S.R. Hungry in the womb: what are the consequences? Lessons from the Dutch famine. Maturitas. 2011. 70 (2): 141–145.
Rudnitskaya E.A., Maksimova K.Y., Muraleva N.A., Logvinov S.V., Yanshole L.V., Kolosova N.G., Stefanova N.A. Beneficial effects of melatonin in a rat model of sporadic Alzheimer’s disease. Biogerontology. 2015. 16: 303–316.
Rudnitskaya E.A., Kolosova N.G., Stefanova N.A. Impact of Changes in Neurotrophic Supplementation on Development of Alzheimer’s Disease-Like Pathology in Oxys Rats. Biochemistry (Mosc). 2017. 82 (3): 318–329.
Said N., Lakehayli S., Battas O., Hakkou F., Tazi A. Effects of prenatal stress on anxiety-like behavior and nociceptive response in rats. J. Integr. Neurosci. 2015. 14: 223–234.
Sposito D.R., Santos A.R. Histochemical Study of Early Embryo Implantation in Rats. Int. J. Morphol. 2011. 29 (1): 187–192.
Stefanova N.A., Kozhevnikova O.S., Vitovtov A.O., Maksimova K.Y., Logvinov S.V., Rudnitskaya E.A., Korbolina E.E., Muraleva N.A., Kolosova N.G. Senescence-accelerated OXYS rats: a model of age-related cognitive decline with relevance to abnormalities in Alzheimer disease. Cell. Cycle. 2014. 13: 898–909.
Stefanova N.A., Muraleva N.A., Korbolina E.E., Kiseleva E., Maksimova K.Y., Kolosova N.G. Amyloid accumulation is a late event in sporadic Alzheimer’s disease-like pathology in nontransgenic rats. Oncotarget. 2015. 6 (3): 1396–1413.
Suckow M.A., Weisbroth S.H., Franklin C.L. The Laboratory Rat. Academic Press. 2005. 928 p.
Thierry A.M., Gioanni Y., Degenetais E., Glowinski J. Hippocampo-prefrontal cortex pathway: Anatomical and electrophysiological characteristics. Hippocampus. 2000. 10: 411–419.
Tikhonova M.A., Ho S.C., Akopyan A.A., Kolosova N.G., Weng J.C., Meng W.Y., Lin C.L., Amstislavskaya T.G., Ho Y.J. Neuroprotective effects of ceftriaxone treatment on cognitive and neuronal deficits in a rat modelof accelerated senescence. Behav. Brain. Res. 2017. 330: 8–16.
Wadhwa P.D., Buss C., Entringer S., Swanson J.M. Developmental origins of health and disease: brief history of the approach and current focus on epigenetic mechanisms. Sem. Reprod. Med. 2009. 27 (5): 358–368.
Weng J.C., Tikhonova M.A., Chen J.H., Shen M.S., Meng W.Y., Chang Y.T., Chene K.C., Liange K.C., Hungg C.S., Amstislavskaya T.G., Ho Y.J. Ceftriaxone prevents the neurodegeneration and decreased neurogenesis seen in a Parkinson’s disease rat model: An immunohistochemical and MRI study. Behav. Brain Res. 2016. 305: 126–139.
Wilson C.A., Vazdarjanova A., Terry A.V.Jr. Exposure to variable prenatal stress in rats: effects on anxiety-related behaviors, innate and contextual fear, and fear extinction. Behav. Brain. Res. 2013. 238: 279–288.
Yamada J., Jinno S. Aging of hippocampal neurogenesis and soy isoflavone. Oncotarget. 2016. 7: 83835–83836.
Дополнительные материалы отсутствуют.
Инструменты
Журнал высшей нервной деятельности им. И.П. Павлова


