Журнал высшей нервной деятельности им. И.П. Павлова, 2019, T. 69, № 5, стр. 601-617
ОСОБЕННОСТИ НЕЙРОННОГО ОБЕСПЕЧЕНИЯ ИНСТРУМЕНТАЛЬНОГО ПОВЕДЕНИЯ, СФОРМИРОВАННОГО ОДНО- И МНОГОЭТАПНЫМ СПОСОБАМИ
Е. А. Кузина 1, *, Ю. И. Александров 1, 2
1 Лаборатория психофизиологии им. В.Б. Швыркова,
Федеральное государственное бюджетное научное учреждение институт психологии РАН
Москва, Россия
2 Кафедра психофизиологии, Государственный академический университет гуманитарных наук
Москва, Россия
* E-mail: ehofir@mail.ru
Поступила в редакцию 27.08.2018
После доработки 27.08.2018
Принята к публикации 24.09.2018
Аннотация
В настоящей работе исследовалось, зависит ли, и если да, то как, нейрональное обеспечение поведения от того, каким числом этапов обучения представлена история его формирования. Под этапом обучения понималось формирование нового навыка, состоящего из последовательности поведенческих актов, осуществление которых приводило к достижению результата: получению пищи. У крыс (линии Лонг-Эванс), обученных инструментальному пищедобывательному навыку нажатия на педаль двумя способами, – за один или несколько этапов, регистрировали активность отдельных нейронов ретросплениальной дисгранулярной области коры. В группе крыс, у которых навык был сформирован за четыре этапа (многоэтапно), оказалось значимо больше нейронов, специализированных относительно подхода и нажатия на педаль (неизменно активирующихся в этих актах), выше средняя частота импульсации нейронов, имеющих структурированную, но не обязательно постоянную активность в выученном поведении, а также больше кластеров, объединяющих клетки с селективно повышенной активностью в одних и тех же наборах поведенческих актов. У одноэтапно обученных животных было обнаружено только два нейрона, специализированных относительно подхода и нажатия на педаль, но было больше клеток со структурированной активностью в поведении, имеющих максимальную частоту импульсации в этих актах. Таким образом, разное число этапов в истории обучения одному и тому же инструментальному навыку было связано со значимыми различиями в относительном числе и паттерне активности двух категорий нейронов РК: специализированных относительно актов выученного поведения и клеток со структурированной, но вариативной активностью.
Особенности организации конкретного поведения определяются составом и соотношением актуализирующихся в этом поведении элементов опыта (систем) разного возраста, которые формируются в онтогенезе при обучении и фиксируются в специализациях нейронов [Швырков, 1983; Александров, 1989; Александров и др., 2015]. В связи с этим было логично полагать, что поскольку системный состав поведения зависит от истории научения, внешне одинаковые формы поведения могут различаться по характеристикам нейронного обеспечения, если история их формирования различается (теоретические аргументы и некоторые эмпирические данные в поддержку указанного предположения см. [Александров и др., 2015; Горкин, Шевченко, 1995; Гаврилов, 2009; Швырков, 2006; Aleksandrov, 2006, 2008, 2015; Alexandrov et al., 2018; Svarnik et al., 2013]. Хотя в моделях инструментального поведения животных на настоящий момент имеются как данные о различиях в поведении индивидов, имеющих разную историю обучения [Александров и др., 1999; Никольская, Хоничева, 1999], так и о его сходстве [Арутюнова и др., 2014; Гаврилов, 2009; Svarnik et al., 2013], в исследованиях обучения серии последовательных задач была обнаружена корреляция между биохимическими показателями повышения метаболизма нейронов гиппокампа и ретросплениальной коры и числом сессий обучения животных [Martel et al., 2007; Rudiger et al., 2012; Snyder et al., 2012; Svarnik et al., 2013]. В экспериментах с регистрацией активности нейронов в ретросплениальной коре было показано, что при поэтапном формировании навыка нажатия на педаль у животных в дефинитивном поведении могут быть обнаружены нейроны, специфически и неизменно активные в актах, которые животные могли выучить на предшествующих этапах обучения (например, разворот от кормушки, подход к педали и т.д.) [Горкин, Шевченко, 1995; Александров и др, 2015; Alexandrov et al., 2018]. Предполагается, что пищедобывательный навык, выученный по отдельным этапам, осуществляется за счет последовательной актуализации систем, сформированных на каждом из этих этапов обучения. При обучении новому этапу-акту происходит специализация нейронов относительно вновь сформированного акта и соответственно увеличение числа специфически активных в этом поведении нейронов [Горкин, 1987]. С этим процессом увеличения можно связать и тот факт, что в передней цингулярной и латеральной энторинальной коре у тех мышей и крыс, которые продолжительное время обследовали предметы в экспериментальной клетке, может быть обнаружено больше нейронов, значимо повышающих частоту активности либо вблизи предметов, либо рядом с тем местом, где раньше находились знакомые предметы, чем у животных, которые имели менее длительный опыт взаимодействия с этими объектами [Tsao et al., 2013; Weible et al., 2012]. С другой стороны, специфическая активность клеток париетальной и префронтальной коры на разных отрезках выполнения задачи была зарегистрирована также в поведении, выученном без использования многоэтапных процедур его формирования [Chen et al., 1994; Fujisawa et al., 2008; Malagon-Vina et al., 2018]. Так, при обучении правилам поиска пищи в лабиринте более трети нейронов ретросплениальной коры (РК) у крыс селективно активировались в зависимоcти от направления пути и места подкрепления уже с первого дня обучения [Smith et al., 2012; Vedder et al., 2017], причем доля клеток РК с селективной активностью на всех этапах (отрезках пути) поведения, кроме кормушки, продолжала увеличиваться в течение последующей недели повторения [Vedder et al., 2017]. Таким образом, независимо от способа и, по-видимому, длительности обучения [Толкунов, 2007; Durstewitz et al., 2010; McKenzie et al., 2013; Smith et al., 2012; Yanike et al., 2009] в дефинитивном поведении состав специализированных нейронов определяется целью [Александров и др., 1997; Швырков, 1983; 2006; Alexandrov, 2006, 2008, 2015; Alexandrov et al., 2018] и конкретной последовательностью актов выполняемой задачи [Александров, 1982; Горкин, 1987; Горкин, Шевченко, 1995], но поскольку селекция нейронов в системы поведенческих актов при разном количестве уже сформированных систем будет проходить из разных наборов активных клеток, история обучения может быть выявлена в результате анализа особенностей паттернов специализации всех клеток указанной области мозга [Александров и др., 2015; Александров, Максимова, 2014].
Как при регистрации суммарной активности мозга во время выполнения задач [Auger et al., 2017], так и активности отдельных клеток [Горкин, Шевченко, 1995; Czajkowski et al., 2014; Miller et al., 2014; Vedder et al., 2017] было показано, что значительная часть нейронов РК, так же, как и в зрительной коре [Lütcke et al., 2013], имеет стабильные активации в дефинитивном поведении [Горкин, 1987; Горкин, Шевченко, 1995; Александров и др., 2015; Горкин и др., 2017; Miller et al., 2014; Mao et al., 2017; Vedder et al., 2017], в отличие от более вариативного состава активных в поведении клеток в префронтальной, моторной, соматосенсорной коре [Deolindo et al., 2017; Hyman et al., 2012; Lütcke et al., 2013; Mashhoori et al., 2018; Nicolelis et al., 1997], гиппокампе и ряде областей медиальной височной коры [MacDonald et al., 2011; Mankin et al., 2015], что позволяет сравнивать наборы неодновременно зарегистрированных нейронов структуры для сравнения паттернов активности клеток у животных с разной историей обучения.
Целью настоящего исследования было выяснить, зависят ли характеристики активности нейронов РК в инструментальном поведении от количества этапов обучения этому поведению, и если да, то, как и какие именно. Можно предположить, что, если активность специализированных нейронов частично отражает этапы формирования поведения, после многоэтапного обучения будет больше специализированных нейронов. В свою очередь, в силу связности структуры индивидуального опыта и учитывая, что активность нейронов отражает не только актуализацию систем, к которым они принадлежат, но и особенности их соотношения с другими системами [Горкин, Шевченко, 1995; Alexandrov et al., 1993; 2018], при многоэтапном способе обучения можно ожидать большее число вариантов активности в группах клеток разной системной принадлежности. Для проверки предположения необходимо проанализировать активность не только нейронов, специализированных относительно актов инструментального поведения, но и всех клеток, имеющих селективную активность в выученном поведении [Mao et al., 2017; Vedder et al., 2017].
МЕТОДИКА
В эксперименте участвовали взрослые крысы-самцы линии Long-Evans (9–14 мес. массой 250–350 г), которые на время обучения и эксперимента были помещены в индивидуальные клетки и находились на частичной пищевой депривации. Потеря массы за все время исследования не превышала 10–15%. Все опыты проводили в соответствии с директивой Евросоюза № 2010/63/EC от 22.10.2010 о гуманном обращении с экспериментальными животными.
В инструментальной камере, оснащенной педалями и кормушками, всех животных обучали нажимать на одну из педалей для получения кусочка сыра из кормушки, расположенной на той же стороне экспериментальной клетки, что и педаль, но в противоположном углу. Первую группу крыс (n = 4) обучали этому поведению по отдельным этапам: подход к кормушке, отход от нее, подход к педали, нажатие на педаль. Совершение каждого из этих актов подкреплялось подачей пищи в кормушке. Длительность каждой сессии (этапа) обучения составляла 20–30 мин в день, а всего обучения – 4 дня. Крыс второй группы (n = 3) обучали нажимать на педаль таким образом, что пища подавалась только после нажатия на педаль, т.е. без специального подкрепления таких “промежуточных” актов-этапов, как отход от кормушки и подход к педали. Для этого животных помещали в клетку на 30–40 мин в день, в течение которых они могли свободно обследовать экспериментальную камеру. Всех крыс этой группы обучали циклическому поведению (ЦП), состоящему из побежек от кормушки к педали (с нажатием на нее) и обратно к кормушке, на 4-й день после первого помещения в клетку. Такой способ научения происходил “одноэтапно”, потому что после появления первых циклических побежек животные достигали критерия дефинитивного (измеряемого по доле неэффективных, или проверочных циклов во время эксперимента) ЦП в течение одной сессии обучения [Арутюнова и др., 2014; Svarnik et al., 2013].
Под общим наркозом из смеси золетила и рометара у всех обученных животных в черепе над ретросплениальной дисгранулярной корой (P = 4.5–5; L = 1.1–1.2 [Paxinos, Watson, 2005] было просверлено отверстие диаметром около 2 мм, над которым фиксировали платформу для съемного микроманипулятора [Korshunov, 1995]. Эксперимент начинали через неделю после операции. Регистрацию активности отдельных нейронов проводили стеклянными микроэлектродами, заполненными изотоническим раствором NaCl с сопротивлением 2.5–7 МΩ на частоте 1 кГц. Поиск нейронов в каждой сессии регистрации проводился вручную, шаг смещения манипулятора мог составлять от 8 до 30 мкн. После окончания экспериментов проводили морфологическую реконструкцию места регистрации. Параллельно с записью нейрональной активности происходила видеозапись и запись поведенческих отметок. Более подробно процесс регистрации, параметры усиления и фильтрации сигнала, а также особенности синхронизации отметок поведения и нейронной активности были описаны ранее [Горкин и др., 2017]. Для обработки нейронной активности и поведенческих характеристик использовали программы DMain (Ю. Райгородский). Поведенческие акты выделяли по критериям, описанным в предыдущих работах [Горкин и др., 2017; Горкин, Шевченко, 1995]. Для подсчета отбирали только те записи, где животное осуществляло не менее 8–10 успешных поведенческих циклов с нажатием на педаль и побежкой к кормушке. Для каждого нейрона подсчитывали среднюю частоту активности за все время регистрации. За активацию в одном или нескольких актах принималось превышение частоты активности не менее чем в 1.5 раза над средней за все время регистрации. “Специализированными” относительно определенных систем тех или иных актов поведенческого репертуара в настоящей работе рассматривали клетки, имеющие активации во всех реализациях одного или группы актов [Александров и др., 2015; Горкин и др., 2017; Горкин, Шевченко, 1995]. Для сравнения особенностей распределения активности нейронов в двух группах крыс все клетки были отнесены к одной из трех категорий:
1) нейроны, специализированные относительно актов выученного в экспериментальной клетки поведения (“новые”, Н);
2) нейроны с активациями как в актах выученного поведения, так и вне его, связанные с определенными движениями головы и/или тела животного (налево-направо, вверх-вниз и т.п.), в какое бы поведение эти движения ни были включены (Д-нейроны);
3) клетки, не имеющие постоянных активаций в ЦП или у которых были зафиксированы акты с максимальной активацией вне ЦП (нейроны с неидентифицированной специализацией, НС) [Александров, 2015; Горкин, Шевченко, 1995].
Как было показано ранее, популяция НС-нейронов может быть подразделена на две подгруппы: клетки со структурированной (или “дифференцированной”) активностью в актах ЦП, селективно активирующиеся в тех или иных актах поведения (сНС), и нейроны с равномерной частотой активностью в поведении на протяжении сессии регистрации (рНС) [Горкин, Кузина, 2017]. сНС-клетки определяли по наличию значимых различий частоты активности в 5 актах ЦП по критерию Фридмана, р < 0.05. Для определения особенностей вовлечения нейронов РК в реализацию актов выученного поведения при разных способах обучения у всех зарегистрированных клеток, а также отдельно для каждой из выделенных категорий нейронов строились усредненные паттерны нормированных частот активности (относительно максимальной для каждого нейрона) в пяти актах ЦП [Горкин и др., 2017]. Для оценки статистической достоверности различий доли нейронов разных специализаций в двух группах животных использовали точный критерий Фишера (Fishers p и критерий χ2). Для сравнения частотных параметров активности нейронов (со средней частотой во всех актах более 0.1 спайка в секунду) и поведенческих характеристик применялся непараметрический критерий Манна–Уитни (Z) и Медианный тест (χ2); для сравнения этих переменных в последовательных актах – критерий Вилкоксона (Z). Различия считались достоверными при р < 0.05 (двусторонний критерий отклонения нулевой гипотезы). Поведение животных, обученных разными способами, анализировали, сопоставляя среднюю длительность, вариативность (стандартные отклонения относительно среднего времени) реализации актов ЦП и отношение числа проверочных посещений кормушки к результативным в каждой сессии регистрации импульсной активности нейронов, в которой были проверки пустой кормушки [Горкин и др., 2017]. Поскольку число животных в группе было мало, а у временных параметров инструментального поведения существует большой индивидуальный разброс [Martiros et al., 2018], проводилось также попарное сравнение показателей между индивидуальными животными с помощью критерия Крускала–Уоллиса (Н) с поправкой Бонферрони на множественные сравнения.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
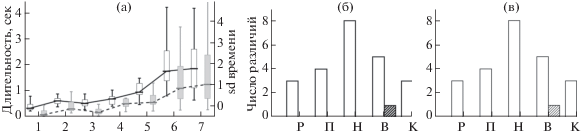
Временные характеристики реализации дефинитивного поведения. Как видно из табл. 1, при попарных сравнениях длительности и вариативности реализации разных актов ЦП между отдельными животными как внутри одной группы, так и между группами наблюдались достоверные различия (Н = 39–203, р < 0.001), которые были выражены для разных актов по-разному (χ2(6) = 3.05–10.65, р < < 0.05, коррекция Бонферрони). При этом у двух крыс (6 и 7) с многоэтапным обучением (М) почти во всех актах, кроме отхода от кормушки, данные временные параметры поведения были значимо выше, чем у животных с одноэтапным обучением (О) (Z = 2.02, р = = 0.043); меньшие значения длительности и вариативности были у всех крыс группы О в актах нажатия на педаль по сравнению с крысами 5, 6 и 7 группы М (Н = 6.8 ± 2.9, р = = 0.0008 ± 0.002) (рис. 1(а)). Сравнение количества значимых попарных различий между крысами обеих групп показало, что в группе О достоверно чаще встречались меньшие значения длительности и вариативности выполнения актов ЦП, чем у животных группы М (Z = 2.02, p = 0.043) (рис. 1(б)). Доли циклов с проверкой пустых кормушек не различались между группами (одноэтапное обучение: 0.2 ± 0.16, многоэтапное: 0.18 ± 0.2; χ2 = = 1.08, р = 0.29) и между отдельными животными (χ2(5) = 3.16, р = 0.67). У разных крыс в обеих группах была обнаружена динамика времени или вариативности выполнения некоторых актов ЦП в последовательных сессиях регистрации, но она была связана как с уменьшением, так и увеличением этих значений, иногда у одних и тех же животных (Spearman r = –0.26–0.75, p < 0.029) (табл. 1). Таким образом, разнонаправленные изменения времени актов и отсутствие значимых различий в относительном количестве проверочных (неэффективных) циклов не позволяют выделить однозначную динамику поведения, связанную с возможным продолжением обучения у крыс в одной из групп.
Таблица 1.
Длительность и вариативность времени реализации дефинитивного циклического поведения у крыс с одно- и многоэтапным обучением Table 1. Duration and variability of cyclic behavior in rats with one- and multistage training
| Показатели | Группы | Крысы | Р | П | Н | В | К | Время цикла |
|---|---|---|---|---|---|---|---|---|
| Средняя длительность актов (с) | 1 этап | 1 | 2.5 ± 0.87 | 2.45 ± 0.7 | 0.5 ± 0.3↑ | 0.88 ± 0.44 | 2.36 ± 0.8 | 5.84 ± 1.4 |
| 2 | 1.9 ± 1.4↑ | 1.5 ± 0.85 | 0.7 ± 0.26 | 1.2 ± 0.45 | 1 ± 0.35 | 4.54 ± 1.7 | ||
| 3 | 1.97 ± 1.2 | 1.86 ± 0.8 | 0.6 ± 0.2↓ | 0.43 ± 0.2↑ | 2.4 ± 0.58 | 4.35 ± 1.9 | ||
| 4 этапа | 4 | 1.56 ± 0.9 | 1.3 ± 0.74 | 0.7 ± 0.2 | 0.9 ± 0.3 | 2.73 ± 0.5 | 4.14 ± 1.1 | |
| 5 | 1 ± 0.45 | 1.9 ± 0.6 | 1 ± 0.3 | 1.2 ± 0.34 | 2.36 ± 0.5 | 5.6 ± 2.2 | ||
| 6 | 2.6 ± 1.3↑ | 2.9 ± 2↑ | 2.1 ± 0.97 | 1.4 ± 0.92 | 2.8 ± 1.5↑ | 8.4 ± 4.2↑ | ||
| 7 | 3.85 ± 1.9 | 3.44 ± 1.3 | 2 ± 1 | 1.32 ± 0.5 | 3 ± 1.8 | 9.7 ± 3 | ||
| Средняя вариативность (с) | 1 этап | 1 | 1.75 ± 1.8 | 1.3 ± 0.7↓ | 0.28 ± 0.4 | 0.38 ± 0.7 | 1.84 ± 0.8 | 2.9 ± 2.6 |
| 2 | 2 ± 2.3↑ | 0.9 ± 0.98 | 0.4 ± 0.3↓ | 0.86 ± 0.8 | 0.8 ± 0.95 | 2.7 ± 2 | ||
| 3 | 1.8 ± 2.24 | 1 ± 0.87 | 0.3 ± 0.6↓ | 0.38 ± 0.7 | 1.36 ± 0.6 | 2 ± 1.23↓ | ||
| 4 этапа | 4 | 1.82 ± 2.7 | 1.26 ± 1.6 | 0.6 ± 0.36 | 0.32 ± 0.5 | 1.34 ± 0.6 | 1.95 ± 0.8 | |
| 5 | 0.9 ± 0.6 | 1.5 ± 1.15 | 0.7 ± 0.35 | 0.85 ± 0.9 | 1.14 ± 0.6 | 2 ± 1.2 | ||
| 6 | 1.8 ± 1.5↑ | 1.8 ± 1.8↑ | 1.4 ± 0.8 | 1 ± 1.15 | 1.2 ± 0.9↑ | 3 ± 1.96 | ||
| 7 | 2.7 ± 2.13 | 2.2 ± 1.66 | 1.7 ± 1.2 | 0.8 ± 0.8↓ | 2.12 ± 1.5 | 4.33 ± 2.6 |
Примечание. ‘Р’ – отход от кормушки, ‘П’ – подход к педали, ‘Н’ – нажатие на педаль, ‘В’ – подход к кормушке, ‘К’ – кормушка. Жирным шрифтом отмечены значения, которые достоверно различаются между крысами одной группы, серым цветом – между крысами разных групп (р < 0.05). Из среднего времени цикла исключен самый вариативный кормушечный акт. ↑↓ – значимое увеличение или уменьшение указанных временных параметров в последовательных сессиях регистрации (Spearman, p < 0.05). Note. Labels of behavioral acts: ‘Р’ – departure from the feeder, ‘П’ – approach to the pedal, ‘Н’ – pressing the pedal, ‘B’ – approach to the feeder, ‘K’ – feeding. Values that significantly differ between the rats of the same group are marked in bold, and gray fill marks significant difference between rats of the different groups (p < 0.05). The most variable feeding act is excluded from the average cycle time. Symbols ↑↓ show the presence of significant increase or decrease of act’s durations in consecutive sessions (Spearman, p < 0.05).
Рис. 1.
(а) – Длительность (ось У слева) и вариативность (ось У справа) времени нажатия на педаль у крыс групп О. Ось Х – номер крысы: 1–3 – группа О, 4–7 – группа М. Медианы, квартили и минимум-максимум значений без учета выбросов. Белым цветом обозначены длительности, серым – вариативности времени акта НП. (б) – Количество достоверных (по критерию Вилкоксона) попарных различий длительности актов ЦП между крысами групп О и М. По оси абсцисс – названия актов (см. Примечание к табл. 1). Белые столбики – количество случаев, когда значения у крыс группы О были меньше, чем у крыс группы М, заштрихованные столбики – обратный вариант. (в) – Количество достоверных попарных различий вариативности длительности актов ЦП между животными обеих групп.
Fig. 1. (a) – Duration (Y axis on the left) and variability (Y axis on the right) of pedal pressing in rats of the “O” group. Axis X – rat number: 1–3 – group “O”, 4–7 – group “M”. Medians, quartiles and non-outlier range. White boxes denote the duration, gray boxes – duration’s variability. (б) – Number of significant (by Wilcoxon) pairwise differences in the duration of acts of cyclic behavior between the rats of groups “O” and “M”. The names of the acts are given on the abscissa axis (see Note to Table 1). White bars – the number of cases when the values of the rats of group “O” were significantly less than in rats of group M, the shaded bars denote the reverse situation. (в) – The number of significant pairwise differences in the variability of the behavioural acts’ duration between the animals of with one- and multistaged training.
Анализ активности нейронов. В табл. 2 приведены данные классификации всех зарегистрированных нейронов в соответствии с описанными в Методике группами. По относительному числу “новых” нейронов (специализированных относительно выученного поведения), связанных с различными движениями (Д-клетки) и не имеющих специфических активаций в исследуемом поведении (НС) между группами крыс, обученных одноэтапным (О) и многоэтапным (М) способами, не было найдено значимых различий (Fisher exact, p > 0.1). Усредненный паттерн нормированной частоты активности всех зарегистрированных нейронов в выделенных пяти актах ЦП у животных групп М и О значимо не различался (χ2(1) = 0.17–2.3, р > 0.12). Но в каждой группе соотношение между нормированными частотами в актах отличалось (рис. 2(а)): в группе М-актом, значимо отличающимся от всех остальных, было нажатие на педаль (Z = 2.7–4.3, p < 0.006), а в группе О – наклон в кормушку (Z = 2.3–3.34, p < < 0.02). Как видно на рис. 2 (а, б), где приведены паттерны частот отдельно для Н, Д и НС-нейронов, суммарный профиль активности в основном отражал особенности распределения поактовой активности наиболее многочисленной категории НС-клеток, в том числе достоверно большую долю активных нейронов в кормушке в группе М, по сравнению с крысами группы О (χ2 = 9.7, р = 0.0018).
Таблица 2.
Специализации нейронов ретросплениальной коры у крыс с разной историей обучения инструментальному навыку нажатия на педаль Table 2. Specialization of retrosplenial cortex neurons in rats with one- and multistage training procedure
| Группа нейронов | Новые | Д-нейроны | НС | Всего | |||||
|---|---|---|---|---|---|---|---|---|---|
| Группа животных | Р | П | Н | В | К | Всего | |||
| Быстрое обучение (n = 3) | 5 | 2 | 0 | 2 | 5 | 18× | 14 | 84 | 116 |
| Поэтапное обучение (n = 4) | 3 | 10 | 2 | 2 | 6 | 25× | 28 | 126 | 179 |
Примечание. Сокращенные обозначения поведенческих актов – такие же, как в табл. 1; классификация нейронов – см. Методику. × – в эту группу нейронов были включены также нейроны, имеющие специфические активации в нециклическом поведении (например, при выполнении столбиков исключительно у передней стенки клетки). Note. Labels of behavioral acts are the same as in Table 1; classification of neurons – see Methodology. × – this group of neurons also included cells that have specific activations in noncyclic behaviour (for example, when performing rears exclusively at the front wall of the cage).
Рис. 2.
Обозначения по абсциссе, как на рис. 1. (а) – Медианы и квартили нормированных частот в актах ЦП в группах одноэтапного (сплошная линия) и многоэтапного обучения (пунктирная линия). (б) – Доля Н-нейронов в трех группах актов: 1) подход и нажатие на педаль (П); 2) подход и залезание в кормушку (К); 3) жевание и разворот от кормушки (Р). Белые столбики – группа О, заштрихованные – группа М. * – р < 0.05 (Fisher exact); (в) – Частоты (Гц) Д-нейронов в пяти актах ЦП у крыс групп О и М. Горизонтальными линиями показаны средние по всем актам значения частот в каждой группе животных. (г) – То же, что (а), но нормированные частоты даны отдельно для трех категорий нейронов (см текст). * – р < 0.05 (Манн–Уитни), + – р = 0.04 (Мед. тест).
Fig. 2. Designations on the abscissa are the same, as in Fig. 1. (a) – Medians and quartiles of normalized frequencies in five behavioural acts in one-stage (solid line) and multi-stage training (dashed line). (б) – The proportion of N-neurons in three groups of acts: 1) the approach and depression of the pedal (П), 2) the approach and lowering the head into the feeder (К), 3) chewing and moving away from the feeder (Р). White bars – group “O”, shaded bars – group “M”. * – p < 0.05 (Fisher exact). (в) – The frequencies (Hz) of D-neurons in five acts in groups “O” and “M”. The horizontal lines show the overall mean frequencies in each group of animals. (г) – The same as in (a), but normalized frequencies are given separately for three categories of neurons (see text). * – p < 0.023 (Mann–Whitney), + – p = 0.04 (Median test).
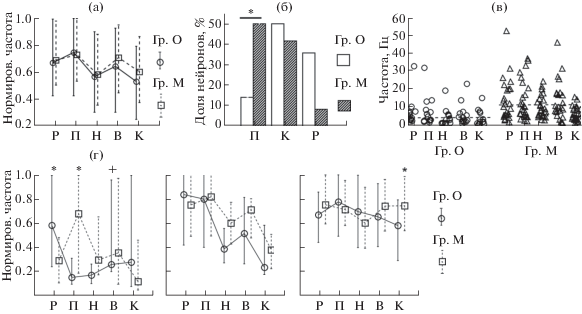
Чтобы определить, различается ли относительное количество Н-нейронов, вовлекающихся в разные акты ЦП, в зависимости от истории обучения (табл. 2), они были объединены в 3 категории: 1) подход и нажатие на педаль, 2) подход к кормушке и захват пищи из нее, 3) нахождение у кормушки и начало нового цикла движения к педали. У крыс группы М наблюдалось значимо больше активаций Н-нейронов при подходе и нажатии на педаль, чем у животных группы О (Fisher exact, p = 0.03511) (рис. 2 (б, г)). Средние частоты активности специализированных нейронов в разных актах цикла в двух группах достоверно не различались (средние частоты у крыс обеих групп: ОК = 5.56 ± 5, ПП = 5.24 ± 6, НП = 4 ± 4.6, ПК = 6.9 ± 7, К = 4.6 ± 5.5 (среднее ± sd), χ2(1) = 0.01–3.6, р > 0.12, p > 0.05), но вариативность частоты при подходе к кормушке была значимо выше в группе О (О = = 4.45 ± 2.64, М = 1.93 ± 1.66; Z = 3.14, p = = 0.0016). Поскольку длительность и вариативность актов ЦП у некоторых крыс с многоэтапным обучением были в среднем выше, чем в группе О, то различия в частотных характеристиках активности Н-нейронов могли быть также частично связаны с временными параметрами поведения, так как ранее были обнаружены как отрицательные, так и положительные корреляции частоты активности нейронов РК и задней цингулярной коры с длительностью и вариативностью выполнения актов инструментального поведения [Горкин, Кузина, 2017; Hayden et al., 2009]. Однако из большой группы попарных сравнений здесь были обнаружены только две значимых корреляции между вариативностью средней частоты в кормушке с длительностью (Spearman r = 0.46, p = 0.025) и вариативностью времени этого акта (Spearman r = 0.45, p = 0.029) при многоэтапном обучении, т.е. актами, между которыми не было значимых различий по составу и частоте активности Н-нейронов.
Средняя частота активности Д-нейронов в группе М за все время регистрации (мед(О) = = 2.9, мед(М) = 5.15; Z = –2.8, p = 0.004) и по отдельности в актах нажатия на педаль и подхода к кормушке была значимо больше, чем у одноэтапно обученных животных (Fср: М – НП = 10 ± 6.2, М – ПК = 12.7 ± 10.9, О – НП = = 4.13 ± 4.9, О – ПК=5.6 ± 6, χ2(1) = 6.5–10, р < 0.05) (рис. 2(в)). Но поскольку между средней частотой Д-клеток в этих актах и вариативностью их выполнения имелись достоверные положительные корреляции (r = = 0.32, p = 0.046), а вариативность времени тех же актов была выше в группе М (рис. 1), в сессиях записи Д-нейронов частотные различия между крысами обеих групп могли определяться в значительной степени различием во временных параметрах поведения. Несмотря на то что популяции Д-нейронов у крыс с разным числом этапов обучения состояли из разных (хотя и перекрывающихся) по частотным характеристикам совокупностей клеток, распределение их нормированной частоты активности в пяти актах ЦП значимо не различалось между группами животных (χ2(1) = 1.06 ± 1.5, р > 0.05), в отличие от распределения Н-нейронов (рис. 2(г)).
Наиболее многочисленной в обеих группах крыс была популяция НС нейронов (70% и 72%), которая не имела специфических (неизменно, во всех возникающих реализациях) активаций в ЦП и состояла из клеток со структурированной (сНС) (наличие значимых различий частоты активности в 5 актах ЦП по критерию Фридмана, р < 0.05) и равномерной (рНС) активностью в актах ЦП [Горкин, Кузина, 2017]. В выборку сНС клеток отнесены также нейроны, у которых были обнаружены максимальные активации вне актов ЦП, например, при поворотах головы в одном и том же направлении или в зависимости от местоположения животного в экспериментальной камере, т.е. клетки, описанные в других исследованиях как “нейроны поворота головы” [Chen et al., 1994; Cho, Sharp, 2001; Jacob et al., 2016]. Всего в обеих группах было найдено 7 таких нейронов. Соотношение сНС и рНС нейронов в двух группах животных не различалось (N = 56 и 36 – в группе О; 73 и 46 – в группе М, Fisher exact, p = 0.88), но средняя частота у сНС нейронов во всех актах, кроме нажатия на педаль, была выше у крыс с многоэтапным обучением (группа О – 4.33 ± 4.8, группа М – 8 ± 8.8, χ2 = 7–20, р < < 0.01). Нормированная частота активности всех НС нейронов была значимо выше в акте наклона в кормушку в группе М (χ2 = 6.9, р = = 0.008). Распределение нормированных частот активности нейронов внутри каждой группы крыс также различалось: в группе О максимальной была усредненная частота при подходе к педали, а минимальной – в кормушке (Z = 1.98–3.62, p < 0.05), а в группе М наименьший процент активности НС нейронов был в акте нажатия на педаль (Z = 1.9–3.5, p = 0.049–0.0003), и наибольшая – в кормушке (рис. 2 (г)). Оказалось, что эта разница была частично связана с разным числом клеток НС, имеющих максимальную частоту в этих актах в двух группах крыс (χ2(4) = 10.27, р = 0.036): в группе О было достоверно больше нейронов НС с максимальной частотой активности в актах нажатия на педаль (Fisher exact, p = 0.017), а у животных группы М – клеток, имеющих максимальную активность при наклоне в кормушку (Fisher exact, p = = 0.032). Такая тенденция была характерна только для выборки сНС нейронов (Fisher exact, p = 0.048 – акт нажатия на педаль в группе О, и p = 0.09 (одностор. критер.) – кормушка в группе М), но не рНС (Fisher exact, p = 0.16–0.27). Но в отличие от Н-нейронов, постоянно вовлекавшихся в акты, относительно которых они специализированы, часть сНС клеток были активны не во всех реализациях актов ЦП, в которых у них наблюдалась максимальная частота, аналогично клеткам ряда корковых областей, селективная, но при этом вариативная активность которых была зарегистрирована при выполнении разных актов инструментального поведения у крыс и обезьян [Clopath et al., 2017; Ma et al., 2016; Renart, Machens, 2014]. Так, в связи с более высокой средней частотой активности клеток в группе М (рис. 3 (а)) было значимо больше сНС нейронов со 100% вероятностью наличия хотя бы одного спайка в каждом акте поведения (Fisher exact, p < 0.01; в группе О было от 16 до 42% постоянно активных сНС нейронов в актах ЦП, в группе М – от 47 от 75%). Поскольку популяции нейронов с разной средней частотой могли иметь и различающиеся профили активности в ЦП, как было показано для высоко- и низкочастотных нейронов прелимбической и передней цингулярной коры крыс в задаче поиска пищи в лабиринте [Malagon-Vina et al., 2018], распределение нормированной активности в двух группах крыс было дополнительно сопоставлено отдельно для дНС клеток со средней частотой выше или ниже медианы (Мed = 7) в группе М. Было обнаружено, что клетки с частотой ниже 7 Гц в группе М значимо больше вовлекались в кормушечный акт, чем в группе О (χ2 = 6.7, р = 0.01, n = 46 и 47). Как видно на рисунке 3(б), в группе О у клеток с частотой больше 7 Гц была значимо выше активность при нажатии на педаль и подходе к кормушке, чем у низкочастотных нейронов (χ2 = = 6.5, р = 0.01, n = 45 и 9), а в группе М аналогичные различия были найдены для актов подхода и нажатия на педаль (χ2 = 5.2–7.6, р = = 0.02, n = 46 и 27). При добавлении рНС нейронов, т.е. суммарно для всех НС клеток, указанные различия в каждой группе сохранялись (χ2 = 5–12, р < 0.05). Таким образом, в обеих группах животных повышение уровня участия сНС клеток в актах нажатия на педаль могло происходить за счет нейронов с относительно более высокой частотой активности (хотя в группе О их было значимо меньше, чем в группе М, Fisher exact, p = 0.009; 16% – группа О, 36% – группа М), а увеличение нормированной частоты сНС нейронов в кормушечном акте у многоэтапно обученных животных происходило в результате повышенного вовлечения гетерогенных по частоте популяций клеток.
Рис. 3
(а) – Средняя частота активности всех нейронов РК в двух группах крыс. Медианы, квартили и минимум-максимум значений без учета выбросов. (б) – Профили нормированной активности у клеток с частотой выше 7 Гц (прерывистая линия) и ниже (сплошная линия) в группах О и М. Результаты представлены в виде медиан и квартилей. * – р < 0.05. (в) – Нормированные частоты активности сНС нейронов в актах ЦП. По оси ординат – номера нейронов. Клетки с максимальной средней частотой в одном и том же акте сгруппированы вместе, цифрами показана доля нейронов в каждой из пяти группировок по отношению ко всем сНС клеткам. Темным цветом обозначены нормированные частоты ≥0.85. (г) – Варианты распределения нормированной частоты ≥0.85 у сНС нейронов в актах ЦП (вертикальная ось) и относительное число клеток, имеющих данный тип активности (горизонтальная ось). Обозначения по абсциссе на (а), (б) и (в) как на рис. 1.
Fig. 3. (a) – Mean frequency of all retrosplenial cortex neurons in two groups of rats. Medians, quartiles and non-outlier range. (б) – Patterns of normalized activity in cells with a frequency above 7 Hz (dashed line) and below 7 Hz (solid line) of groups “O” and “M”. All results are presented in the form of medians and quartiles. * – p < 0.05. (в) – Normalized frequencies of sNS neurons in different behavioural acts. The ordinate shows the number of the neuron. Units with the maximum mean frequency in the same act are grouped together in blocks; the proportion of neurons (relative to all sNS units) in each of the five blocks are shown inside the framings. Dark lines indicates normalized frequencies ≥0.85. (г) – Variants of the distribution of the normalized frequency ≥0.85 for sNS neurons in acts of cyclic behavior (vertical axis) and the relative number of cells having this type of activity (horizontal axis). Designations on the abscissa in (a), (б) and (в) are the same, as in Fig. 1.
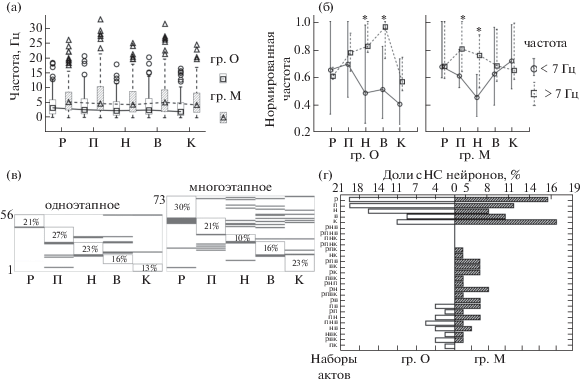
сНС клетки могли иметь повышенную частоту импульсации в разных наборах поведенческих актов в зависимости от особенностей организации их совместной активности с остальными нейронами, которые вовлекаются в ЦП. Например, у Н-нейронов РК кроликов было найдено значимое повышение частоты активности в актах, предшествующих в истории обучении тем, относительно которых эти нейроны были специализированы [Горкин, Шевченко, 1995]. Поскольку между группами крыс были обнаружены значимые различия в доле Н-нейронов, специализированных относительно педальной категории актов, можно ожидать, что число и состав сНС клеток, имеющих повышенную активность в разных актах, также будут различаться у животных с разной историей обучения. Для того чтобы определить количество возможных вариантов распределения активности (РА) сНС нейронов во всех актах ЦП при разных способах обучения, у каждого нейрона были посчитаны число и состав актов с нормированной частотой больше 0.85 (на данной выборке клеток частота активности в актах с таким индексом значимо не отличалась от максимальной, Вилкоксон, р < < 0.05) (рис. 3 (в)). В группе О 75% всех клеток имели повышенную частоту активности только в одном из актов ЦП, в отличие от животных М (54%) (Fisher exact, p = 0.026). При этом, доли сНС клеток с повышенной активностью только в одном из актов в разных актах ЦП не различались между группами (χ2(4) = = 4.85, р = 0.3). Зато у крыс группы М было в два раза больше вариантов РА у сНС нейронов (всего в обеих группах крыс было обнаружено 23 варианта РА22 с индексом >0.85, включая клетки с “одиночными” превышением частоты в акте; при способе О было 8 вариантов с превышением более чем в 1 акте, а при способе М – 17 (Fisher exact, p = 0.017) (рис. 3 (г)).
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
В двух группах крыс, обученных циклическому навыку нажатия на педаль для получения пищи из кормушки за один или четыре этапа обучения (группы с одноэтапным (О) и многоэтапным (М) обучением), сравнивали профили активности нейронов ретросплениальной коры и особенности реализации выученного навыка. Анализ скорости выполнения актов ЦП в настоящей модели выявил как значимые индивидуальные, так и межгрупповые различия во временных характеристиках отдельных актов. У крыс, обученных М-способом, достоверно чаще встречались большие значения длительности реализации актов, особенно во “второй” половине поведенческого цикла (при нажатии на педаль, подходе к кормушке и захвате пищи), чем у животных, обученных О-способом (рис. 1(б)). У двух же индивидов в группе М (крысы 6 и 7) скорость совершения всех актов ЦП оказалась существенно ниже, чем у остальных пяти крыс обеих групп. Заметим, что в других работах было отмечено сходство параметров выполнения ЦП у крыс, обученных одно- и многоэтапными способами [Гаврилов, 2009; Svarnik et al., 2013]. Полученные различия могут быть связаны с тем, что в настоящем исследовании проводился попарный анализ показателей между животными во всех сессиях регистрации, и значения индивидуальной вариативности в небольшой выборке были высокими. Возможно, увеличение времени актов у некоторых крыс группы М (например, у 6 и 7) было сопряжено с большим числом и вариативностью движений в рамках выполняемого цикла. Например, известно, что среднее время последовательностей побежек за пищей у крыс коррелировало с отклонением от оптимальной траектории перемещения между отрезками пути [Euston, McNaughton, 2006], а длительность и вариативность выполнения серий актов у обезьян и сложных движений лапой у крыс зависели от числа (или наличия) дополнительных движений у индивидуальных животных [Gholamrezaei, Whishaw, 2009; Hyman et al., 2012].
При сопоставлении одно- и многоэтапного способов обучения было обнаружено сходство процентного состава и распределения относительных частот нейронов РК, сгруппированных по критерию их специализации или вовлечения в акты ЦП. Согласующиеся результаты описаны при анализе участия нейронов разных областей коры и гиппокампа: в дефинитивном поведении структура активности клеток, установленная по относительным частотам и корреляциям в разных актах поведения, остается стабильной для данной области и определяется составом и последовательностью этих актов, т.е. содержательными характеристиками задачи [Mao et al., 2017; McKenzie et al., 2016]. Таким образом, настоящее исследование подтверждает полученные ранее данные в том, что число этапов обучения, так же, как и порядок их формирования [Горкин, Шевченко, 1995; Александров и др., 1999; Aleksandrov, 2008], не сказывались на суммарном профиле активности РК в дефинитивном поведении (включая процент специализированных относительно ЦП нейронов и среднюю частоту нормированной активности всей выборки зарегистрированных клеток), если последовательности отдельных актов в нем оставались неизменными [Александров и др., 2015]. Вместе с тем, как при сравнении особенностей частотного распределения активности клеток в каждой группе животных, так и вовлечения нейронов новых специализаций в акты ЦП, между группами О и М были найдены достоверные различия: у крыс, обученных М-способом, был больше процент нейронов, специализированных относительно подхода и нажатия на педаль, и при этом акт нажатия на педаль отличался наименьшей средней нормированной частотой активности всех нейронов РК, а у крыс группы О наименьшая доля нормированной активности всей выборки зарегистрированных нейронов была в акте наклона в кормушку. Однако в силу высокой вариативности временных характеристик ЦП у отдельных животных наблюдаемые отличия могли быть связаны не столько с разницей в истории обучения, сколько в скорости выполнения поведения. Например, в тех случаях, когда у крыс с многоэтапным обучением были выше значения длительности актов подхода и нажатия на педаль, и выше была доля нейронов, специализированных относительно этих актов. Но в обеих группах между временами актов в сессиях регистрации новых и НС нейронов не было найдено значимых различий (χ2 = 2.6–0.04, р > 0.1), которые могли бы привести к смещению оценки классификации этих нейронов. В исследовании связи количественных параметров поведения и активности нейронов было показано, что у специализированных нейронов РК в основном наблюдались отрицательные корреляции частоты активности в актах с их длительностью, в отличие от сНС нейронов [Горкин, Кузина, 2017], т.е. специфические, или фазные активации нейронов РК не были связаны с двигательными параметрами поведения. Другими авторами также не было обнаружено значимых различий при сравнении состава ансамблей нейронов ряда корковых областей и стриатума кошек в актах с коротко- и длиннолатентным периодом ожидания [Сидорина и др., 2012], между степенью выраженности фазных активаций нейронов сенсомоторной коры кроликов и двигательными параметрами инструментальных актов [Бобровников, 1989], наборами активирующихся нейронов коры и гиппокампа в ходе замены отдельных элементов поведенческого акта при неизменной совокупности движений [Александров, 1982], долей специализированных нейронов РК и временем цикла [Горкин, Шевченко, 1995; Александров и др., 1999]. Таким образом, более вероятно, что различия в относительном числе нейронов, специализированных относительно педальной группы актов, могли быть связаны со способом обучения циклическому навыку.
Между крысами двух групп, помимо разницы в распределении относительного числа нейронов, вовлекающихся в разные акты ЦП, оказалось, что в группе М средняя частота активности Д и НС нейронов была значимо выше, с чем были связаны также некоторые различия в доле относительного вовлечения этих клеток в акты ЦП. В ряде экспериментов было обнаружено, что при быстром и безошибочном выполнении задач, обычно объясняемым вниманием, частота и вариативность активности клеток коры и гиппокампа достоверно уменьшались [Clopath et al, 2017; Hayden et al., 2009; Hok et al., 2012; Muzzio et al., 2009]. В то же время в других исследованиях не наблюдалось однозначной корреляции между частотными параметрами активности клеток париетальной коры и стриатума крыс и временными особенностями поведения при навигации в лабиринте [Morcos, Harvey, 2016] и нажатии на педаль [Martiros et al., 2018]. Хотя скорость реализации ЦП у крыс в группе М не была связана с повышенной долей неэффективных циклов (относительное число циклов с проверками пустых кормушек в обеих группах животных было одинаковым), тем не менее, при обнаружении достоверных различий времени и частоты активности в одних и тех же поведенческих актах, проводился анализ корреляций частоты и временных параметров реализации актов ЦП. Оказалось, что только вариабельность частоты некоторых Д-клеток могла быть связана с вариативностью этих актов (см. “Результаты”). Как было показано в экспериментах с хронической регистрацией, средняя частота нейронов остается постоянной в течение многократных повторений “одного и того же” поведения [McMahon et al., 2014; Greenberg, Wilson, 2004], и поскольку процент сНС клеток с высокой частотой (в среднем, более 8 Гц) был значимо больше у крыс, обученных М-способом, то, возможно, входящие в эту категорию нейроны в обеих группах животных могли принадлежать популяциям, различающимся не только по функциональным, но и по морфологическим характеристикам. Было показано, что у большинства интернейронов коры частота активности во время поведения выше, чем у пирамидных клеток [Ardid et al., 2015; Frank et al., 2001; Insel, Barnes, 2014; Ison et al., 2011; Martiros et al., 2018; Malagon-Vina et al., 2018], и интернейроны в целом имеют менее селективную активность в поведении [Ison et al., 2011; Frank et al., 2001; Martiros et al., 2018, но см. Pinto, Dan, 2015]. Так, в нескольких экспериментах с регистрацией активности нейронов в двух областях РК крыс [Alexander, Nits, 2015, 2017; Smith, Mizumori, 2012; Miller et al., 2014; Vedder et al., 2017] средняя частота при обучении и реализации выученного поведения в лабиринте была 17–20 Гц, т.е. в 4–5 раз выше, чем в настоящей работе, иначе говоря, в данных исследованиях была обнаружена смещенная выборка высокочастотных нейронов, которая, по-видимому, зависела от содержания и специфики обучения экспериментальной задаче. Интересно, что в выученном поведении эти нейроны дифференцированно активировались при подходах к кормушкам [Smith, Mizumori, 2012; Miller et al., 2014] и при движениях, связанных с определенными поворотами в лабиринте [Alexander, Nits, 2015, 2017], так же, как Д-нейроны и высокочастотные сНС в обеих группах крыс.
В категорию сНС нейронов была отнесена гетерогенная совокупность клеток, имеющих неравномерные модуляции активности в последовательных актах ЦП, не связанные с движениями или скоростными параметрами поведения, как у Д-нейронов. В этом состояло основное отличие от ранее использованной классификации, в которой были объединены все клетки с неравномерной активностью в ЦП, кроме специализированных [Горкин, Кузина, 2017]. В указанной работе, в частности, было обнаружено сходство неспецифической активности специализированных нейронов и структурированной (дифференцированной) активности остальных групп клеток по соотношению доли положительных и отрицательных корреляций частоты активности в актах поведения с их длительностью. В таком случае структурированная активность Д-и Н-нейронов включает в себя также и акты со специфической активностью этих клеток, в отличие от сНС нейронов, которые могли быть специализированы относительно другого поведения [Alexandrov et al., 1993], которое животные совершали в том числе в экспериментальной камере. сНС нейроны представляли наиболее многочисленную популяцию (≈45% в каждой группе) по сравнению с остальными выделенными категориями клеток (от 11 до 30%), из-за чего их вклад в суммарный паттерн относительной частоты всей выборки зарегистрированных нейронов РК был выше. По-видимому, именно активность этих нейронов является основным источником той значимой вариативности при одновременной записи сразу множества нейронов в разных структурах, которая используется для моделирования и предсказания особенностей поведения животных [Buzsáki, 2010; Clopath et al., 2017; Deolindo et al., 2017; Ma et al., 2014, 2016; Mashhoori et al., 2018; Nicolelis et al., 1997; Vedder et al., 2017; Wirt, Hyman, 2017]. Так, несмотря на то что у одноэтапно обученных крыс вероятность повторения сходного поведенческого паттерна частот у отдельных сНС нейронов в последовательных реализациях ЦП (и соответственно вероятность их совместного воспроизведения) были значимо ниже, суммарный профиль нормированной активности, кроме кормушечного акта, не различался в двух группах (рис. 2(г)). Если верно высказанное ранее предположение о том, что зарегистрированные в процессе выполнения определенного выученного поведения НС нейроны могут быть специализированы относительно систем других поведенческих актов, которые не были или не могли быть реализованы во внешнем поведении в рамках данной экспериментальной ситуации, и наблюдаемая “неспецифическая” активность таких НС клеток связана с “уровнем” актуализации их систем в данном поведении [Alexandrov et al., 1993; Швырков, 1983], то количество актов, в которых эти нейроны достоверно больше активны, может служить показателем как числа актуализируемых в данном поведении разных систем, так и, вероятно, степени гетерогенности элементов этих систем [Швырков, 2006]. Поскольку число кластеров сНС нейронов со сходным профилем активности в ЦП оказалось больше в группе М, можно предположить, что особенности организации данной категории клеток соответствуют истории обучения данному поведению. Так, было показано, что в процессе научения каждому следующему акту или их последовательности повышается вероятность активации значительной части нейронов, активных в предыдущем поведении (не только специализированных относительно ранее выученных актов), и нейронов поискового поведения, которые при переходе к дефинитивному поведению снижают частоту активности [Александров и др., 2015; Швырков, 2006; Miller et al., 2014; Ruediger et al., 2012; Morcos et al., 2016].
При обучении М-способом появление нового правила подачи кормушки означало отмену предыдущего условия, т.е. реорганизацию всей последовательности актов, сформированной на предыдущем этапе обучения, тогда как при одноэтапном способе животные после кратковременного “ознакомления” с кормушкой могли получить пищу в кормушке только при нажатии на педаль, так что вся двигательная активность в основном концентрировалось у педали. После обучения новому навыку животные выполняют не только успешные циклы, но и периодически некоторое количество “ошибочных”, которые для удобства были объединены в категорию “проверочных циклов”. Хотя доли таких циклов не различались при разных способах обучения, большая длительность и вариативность времени актов у некоторых животных группы М могли быть связаны с особенностями актуализаций вариативного состава систем, возникших на этапах обучения ЦП. С одной стороны, у многоэтапно обученных крыс было больше Н-нейронов, специализированных относительно подхода и нажатия на педаль, актов, приобретенных на последних этапах обучения. И одновременно с этим, в паттерне нормированных частот всех клеток РК, но преимущественно сНС, наименьшая доля всей активности была при нажатии на педаль, а наибольшая – при наклоне и залезании в кормушку и отходе от нее (рис. 2 (г)). В группе О, несмотря на такое же успешное выполнение и высокую скорость нажатий, было достоверно меньше нейронов, специфически активных в педальной части цикла, в то же время доля сНС клеток в этих актах была такой же, как и в остальных актах ЦП. Поскольку поэтапное обучение построено на многократной реорганизации первичного поведения у кормушки [Александров и др., 2015; Горкин, Шевченко, 1995; Горкин и др., 2017; Svarnik et al., 2013], популяция клеток, исходно специализированных относительно прасистем этих актов, является наиболее дифференцированной (неоднородной по особенностям вовлечения в разные акты ЦП) у крыс группы М. Чем, по-видимому, может быть обусловлена и вероятность повышенной “неспецифической” [Alexandrov et al., 1993, 2018] активности в кормушке у нейронов систем других актов, связанных с кормушкой как прасистемой [Александров, Максимова, 2014; Горкин, Шевченко, 1995; Швырков, 2006], по сравнению с одноэтапно обученными животными. В свою очередь, стабильная активация нейронов РК, которые были специализированы относительно самых последних в процессе многоэтапного обучения актов подхода и нажатия на педаль, по-видимому, была сопряжена с уменьшением актуализации в этих актах прочих систем, сформованных, в том числе, на предшествующих этапах обучения [Горкин, Шевченко, 1995; Швырков, 2006]. Так как в группе О были обнаружены нейроны, специфически активные в том числе в тех актах ЦП, которым животные специально не обучались, в отличие от крыс с многоэтапным обучением, можно предположить, что специализация этих клеток происходила одновременно с формированием специализаций относительно акта подхода и нажатия на педаль, в силу обусловленной конструкцией экспериментальной клетки необходимости совершать соответствующие акты в течение одной сессии обучения. Так, в исследовании зависимости формирования новых элементов опыта от времени между последовательными этапами обучения инструментальным актам нажатия на педаль и потягивания кольца у кроликов, при коротком интервале между сессиями обучения было обнаружено меньше “общих” нейронов, специфически активных в обоих актах [Созинов и др., 2013]. Хотя в настоящей работе число Н-нейронов было недостаточно для анализа доли клеток с перекрывающимися активациями в актах ЦП, сходные закономерности наблюдались в активности сНС нейронов. Действительно, участие сНС клеток в О группе, с одной стороны, было более вариативным, а с другой, кластеров нейронов с повышенной активностью в одних и тех же актах ЦП было меньше, чем при многоэтапном обучении. Как было показано в исследовании с моделированием активности ансамблей нейронов зрительной коры, изменение весов до 75% контактов всех клеток данной сети значимо не меняло общего паттерна ее частоты и структуры связей между клетками, если даже небольшой процент клеток сохранял свою селективность в поведении [Clopath et al., 2017]; сходные результаты были получены в экспериментах с помощью хронической регистрации активности Са2+ у клеток поля СА1 [Lütcke et al., 2013; Ziv et al., 2013]. В настоящей работе вместе с небольшой долей специализированных нейронов в актах подхода и нажатия на педаль (менее 2% и 0%) при одноэтапном обучении было активно (хотя и не одновременно) достоверно больше сНС нейронов, по сравнению с группой М. И поскольку у остальных клеток (Д- и рНС) при разных способах обучения не было найдено значимых различий по относительной частоте активности в этих актах, паттерны нормированной частоты всей выборки зарегистрированных нейронов РК оказались сходными, по-видимому, за счет совместной активности различающихся ансамблей Н- и сНС нейронов в обеих группах животных.
ЗАКЛЮЧЕНИЕ
Были обнаружены достоверные различия во временных характеристиках дефинитивного поведения и особенностях активности нейронов ретросплениальной коры крыс, обученных одному и тому же инструментальному пищедобывательному навыку одно- и многоэтапным способами. Крысы с одноэтапным обучением обычно выполняли отдельные акты поведения быстрее и менее вариативно, чем многоэтапно обученные животные. У крыс с одноэтапным обучением также была меньше средняя частота импульсации нейронов со структурированной, или селективной частотой активности в выученном поведении, чем у животных с многоэтапным обучением. При этом в группе многоэтапно обученных крыс оказалось значимо больше нейронов, специализированных относительно подхода и нажатия на педаль, и клеток, имеющих повышенную частоту активности в кормушечных актах. Также при многоэтапном обучении было больше кластеров клеток с селективной активностью в одинаковых актах ЦП, в то время как у одноэтапно обученных животных низкий процент нейронов, специализированных относительно подхода и нажатия на педаль, сочетался с повышенной долей селективных клеток, имеющих максимальную активность в этих актах. Таким образом, разное количество этапов в истории обучения одному и тому же инструментальному навыку проявилось значимыми различиями в паттерне специализации и характеристиках активности двух категорий нейронов РК: специализированных относительно актов выученного поведения и клеток со структурированной, но вариативной активностью.
Исследование выполнено при поддержке Российского научного фонда (грант 14-28-00229а), Институт психологии РАН.
Список литературы
Александров Ю.И., Греченко Т.Н., Гаврилов В.В., Горкин А.Г., Шевченко Д.Г., Гринченко Ю.В., Александров И.О., Максимова Н.Е., Безденежных Б.Н., Бодунов М.В. Закономерности формирования и реализации индивидуального опыта. Журн. высш. нерв. деят. 1997. 47 (2): 243–260.
Александров И.О., Максимова Н.Е., Горкин А.Г., Шевченко Д.Г., Тихомирова И. В., Филиппова Е.В., Никитин Ю. Б. Комплексное исследование структуры индивидуального знания. Психол. Журн. 1999. 20 (1): 49–69.
Александров И.О., Максимова Н.Е. Процесс дифференциации: содержание концепта и возможности операционализации в психологических исследованиях. 2014. Дифференционно-интеграционная теория развития. Кн. 2. М.: Языки славянской культуры: Знак. С. 87–138.
Александров Ю.И., Горкин А.Г., Созинов А.А., Сварник О.Е., Кузина Е.А., Гаврилов В.В. Консолидация и реконсолидация памяти: психофизиологический анализ. Вопросы психологии. 2015. 3: 1–13.
Александров Ю.И. Постоянство состава активирующихся нейронов при изменениях параметров целенаправленного движения. Журн. высш. нерв. деят. 1982. 32 (2): 333–335.
Арутюнова К.Р., Гаврилов В.В., Александров Ю.И. Научение и поведение в отсутствие зрительного контакта со средой у крыс. Эксперим. психол. 2014. 7 (3): 31–43.
Бобровников Л.В. Вероятностно-статистические критерии оценки поведенческой специализации нервных клеток. Журн. высш. нерв. деят. 1989. 10 (2): 90–98.
Гаврилов В.В. Формирование индивидуального опыта с помощью и без помощи экспериментатора, а также при наблюдении за поведением других. Сб.: Психология человека в современном мире. Отв. ред.: А.Л. Журавлев М.И. Воловикова Л.Г. Дикая Ю.И. Александров Ю.И. М. 2009. С. 329–332.
Горкин А.Г. Поведенческая специализация нейронов коры на разных этапах обучения. ЭЭГ и нейрональная активность в психофизиологических исследованиях. М.: Наука. 1987. С. 73–80.
Горкин А.Г., Кузина Е.А., Корреляция дифференцированности нейронной активности ретросплениальной коры и параметров инструментального поведения. Нейрокомпьютеры. 2017. 8: 35–36.
Горкин А.Г., Шевченко Д.Г. Различия в активности нейронов лимбической коры кроликов при разных стратегиях обучения. Журн. высш. нервн. деят. 1995. 45 (1): 90–100.
Горкин А.Г., Кузина Е.А., Ивлиева Н.П., Соловьева О.А., Александров Ю.И. Паттерны активности нейронов ретросплениальной области коры в инструментальном пищедобывательном поведении у крыс разного возраста. Журн. высш. нервн. деят. 2017. 67 (3): 1–7.
Никольская, Хоничева Р.М. Особенности обучения крыс в условиях свободного выбора. Журн. высш. нервн. деят. 1999. 49 (3): 664–674.
Сидорина В.В., Мержанова Г.Х., Кулешова Е.П., Залешин А.В. Кооперативная деятельность нейронов зрительной, фронтальной, сенсомоторной областей коры и дорзального стриатума при реализации поведенческой программы в условиях выбора стратегии. Журн. высш. нерв. деят. 2012. 62 (2): 185–196.
Созинов А.А., Крылов А.К., Александров Ю.И. Эффект интерференции в изучении психологических структур. Эксперим. психол. 2013. 6 (1): 5–47.
Толкунов Б.Ф. Сопутствующие поведению реакции нейронов и динамика нейронной активности. Журн. высш. нервн. деят. 2007. 57 (6): 753–761.
Швырков В.Б. Системная детерминация активности нейронов в поведении. Успехи физиол. наук. 1983. 14 (1): 45–66.
Швырков В.Б. Введение в объективную психологию: Нейрональные основы психики: Избр. труды. М.: Изд-во ИП РАН. 2006. 592 с.
Alexander A.S., Nitz D.A. Retrosplenial cortex maps the conjunction of internal and external spaces. Nat. Neurosci. 2015. 18: 1143–1151.
Alexander A.S., Nitz D.A. Spatially periodic activation patterns of retrosplenial cortex encode route sub-spaces and distance traveled. Curr Biol. 2017. 27: 1551–1560.
Alexandrov Y.I., Sozinov A.A., Svarnik O.E., Gorkin A.G., Kuzina E.A., Gavrilov V.V. Neuronal Bases of Systemic Organization of Behavior. In: Cheung-Hoi Yu A., Li L. (eds) Systems Neuroscience. Advances in Neurobiology, vol 21. 2018. Springer, Cham.
Aleksandrov Yu. I. Learning and memory: traditional and systems approaches. Neuroscience and Behavioral Physiology. 2006. 36 (9): 969–985.
Aleksandrov Yu. I. How we fragment the world: the view from inside versus the view from outsideю Social Science Information. Spec.issue: Cognitive technologies. 2008. 47 (3): 419–457.
Aleksandrov Yu. I. Cognition as systemogenesys. Anticipation: Learning from the Past: The Russian/Soviet Contributions to the Science of Anticipation. Springer, (ed.). Nadin M. 2015. 25: 193–220.
Alexandrov Yu.I, Grinchenko Yu.V., Laukka S., Jarvilehto T., Maz V.N., Korpusova A.V. Effect of ethanol on hippocampal neurons depends on their behavioral specialization. Acta physiol. Scand. 1993. 149: 105–115.
Ardid S., Vinck M., Kaping D., Marquez S., Everling S., Womelsdorf T. Mapping of functionally characterized cell classes onto canonical circuit operations in primate prefrontal cortex. J Neurosci. 2015. 35: 2975–2991.
Auger S.D., Maguire E.A. Retrosplenial Cortex Indexes Stability beyond the Spatial Domain. J Neurosci. 2018. 38 (6):1472–1481.
Buzsáki G. Neural syntax: cell assemblies, synapsembles and readers. Neuron. 2010. 68 (3): 362–385.
Chen L.L., Lin L.H., Barnes C.A., McNaughton B.L. Head-direction cells in the rat posterior cortex. Exp. Brain Res. 1994. 101: 8–23.
Cho J., Sharp P.E. Head direction, place, and movement correlates for cells in the rat retrosplenial cortex. Behav. Neurosci. 2001. 115: 3–25.
Clopath C., Bonhoeffer T., Hübener M., Rose T. Variance and invariance of neuronal long-term representations. Philos. Trans. R. Soc. Lond. B Biol. Sci. 2017. 372 (1715): 20160161.
Czajkowski R., Jayaprakash B., Wiltgen B., Rogerson T., Guzman-Karlsson M.C., Barth A.L., Trachtenberg J.T., Silva A.J. Encoding and storage of spatial information in the retrosplenial cortex. Proc. Natl. Acad. Sci. USA. 2014. 111 (23): 8661–8666.
Deolindo C.S., Kunicki A.C.B., da Silva M.I., Lima B.F., Moioli R.C. Neuronal Assemblies Evidence Distributed Interactions within a Tactile Discrimination Task in Rats. Frontiers in Neural Circuits. 2017. 11: 114.
Durstewitz D., Vittoz N.M., Floresco S.B., Seamans J.K. Abrupt transitions between prefrontal neural ensemble states accompany behavioral transitions during rule learning. Neuron. 2010. 66. 438–448.
Euston D.R., McNaughton B.L. Apparent encoding of sequential context in rat medial prefrontal cortex is accounted for by behavioral variability. J. Neurosci. 2006. 26: 13143–13155.
Frank L.M., Brown E.N., Wilson M.A. A comparison of the firing properties of putative excitatory and inhibitory neurons from CA1 and the entorhinal cortex. J Neurophysiol. 2001. 86 (4): 2029–2040.
Fujisawa S., Amarasingham A., Harrison M.T., Buzsáki G. Behavior-dependent short-term assembly dynamics in the medial prefrontal cortex. Nature neuroscience. 2008. 11 (7): 823–833.
Gholamrezaei G., Whishaw I.Q. Individual differences in skilled reaching for food related to increased number of gestures: evidence for goal and habit learning of skilled reaching, Behav Neurosci. 2009. 123 (4): 863–74.
Greenberg P.A., Wilson F.A. Functional stability of dorsolateral prefrontal neurons. J. Neurophysiol. 2004. 92: 1042–1055.
Hayden B.Y., Smith D.V., Platt M.L. Electrophysiological correlates of default-mode processing in macaque posterior cingulate cortex. Proc. Natl. Acad. Sci. USA. 2009. 106 (14): 5948–5953.
Hok V., Chah E., Reilly R.B., O’Mara S.M. Hippocampal dynamics predict interindividual cognitive differences in rats. J. Neurosci. 2012. 32: 3540–3551.
Hyman J.M., Ma L., Balaguer-Ballester E., Durstewitz D., Seamans J.K. Contextual encoding by ensembles of medial prefrontal cortex neurons. Proc. Natl. Acad. Sci. USA. 2012. 109 (13): 5086–5091.
Insel N., Barnes C.A. Differential activation of fast-spiking and regular-firing neuron populations during movement and reward in the dorsal medial frontal fortex. Cerebral Cortex. 2015. 25 (9): 2631–2647. https://doi.org/10.1093/cercor/bhu062
Ison M.J., Mormann F., Cerf M., Koch C., Fried I., Quiroga R.Q. Selectivity of pyramidal cells and interneurons in the human medial temporal lobe. J. Neurophysiol. 2011. 106 (4): 1713–21.
Jacob P.Y., Casali G., Spieser L., Page H., Overington D., Jeffery K. An independent, landmark-dominated head-direction signal in dysgranular retrosplenial cortex. Nat Neurosci. 2016. 20 (2): 173–175.
Korshunov V.A. Miniature microdrive for extracellular recording of neuronal activity in freely moving animals. J. Neurosci. Meth. 1995. 57 (1): 77–80.
Lütcke H., Margolis D.J., Helmchen F. Steady or changing? Long-term monitoring of neuronal population activity. Trends Neurosci. 2013. 36: 375–384.
Ma L., Hyman J.M., Lindsay A.J., Phillips A.G., Seamans J.K. Differences in the emergent coding properties of cortical and striatal ensembles. Nature Neurosci. 2014. 17 (8): 1100–1106.
Ma L., Hyman J.M., Durstewitz D., Phillips A.G., Seamans J.K. A Quantitative Analysis of Context-Dependent Remapping of Medial Frontal Cortex Neurons and Ensembles. J. Neurosci. 2016. 36: 8258–8272.
Malagon-Vina H., Ciocchi S., Passecker J., Dorffner G., Klausberger T. Fluid network dynamics in the prefrontal cortex during multiple strategy switching. Nat Commun. 2018. 9: 309.
Mankin E.A., Diehl G.W., Sparks F.T., Leutgeb S., Leutgeb J.K. Hippocampal CA2 activity patterns change over time to a larger extent than between spatial contexts. Neuron. 2015. 85: 190–202.
Mao D., Kandler S., McNaughton B.L., Bonin V. Sparse orthogonal population representation of spatial context in the retrosplenial cortex. Nature Commun. 2017. 8: 243.
Martel G., Blanchard J., Mons N., Gastambide. F, Micheau J., Guillou J.L. Dynamic interplays between memory systems depend on practice: The hippocampus is not always the first to provide solution. Neuroscience. 2007. 150: 743–753.
Martiros N., Burgess A.A., Graybiel A.M. Inversely Active Striatal Projection Neurons and Interneurons Selectively Delimit Useful Behavioral Sequences. Curr Biol. 2018. 28 (4): 560–573.
MacDonald C.J., Lepage K.Q., Eden U.T., Eichenbaum H. Hippocampal “time cells” bridge the gap in memory for discontiguous events. Neuron. 2011. 71 (4): 737–749.
Mashhoori A., Hashemnia S., McNaughton B.L., Euston D.R., Gruber A.J. Rat anterior cingulate cortex recalls features of remote reward locations after disfavoured reinforcements. eLife. 2018. 7: e29793.
McKenzie S., Keene C.S., Farovik A., Bladon J., Place R., et al. Representation of memories in the cortical-hippocampal system: Results from the application of population similarity analyses. Neurobiol. Learn. Mem. 2016. 134: 178–91.
McMahon D.B.T., Bondar I.V., Afuwape O.A.T, Ide D.C., Leopold D.A. One month in the life of a neuron: longitudinal single-unit electrophysiology in the monkey visual system. J. Neurophysiol. 2014. 112 (7): 1748–1762.
Miller A.M.P., Vedder L.C., Law L.M., Smith D.M. Cues, context, and long-term memory: the role of the retrosplenial cortex in spatial cognition. Front. Hum. Neurosci. 2014. 8: 1441.
Morcos A.S., Harvey C.D. History-dependent variability in population dynamics during evidence accumulation in cortex. Nat. Neurosci. 2016. 19: 1672–1681.
Muzzio I.A., Levita L., Kulkarni J., Monaco J., Kentros C., Stead M., Abbott L.F., Kandel E.R. Attention enhances the retrieval and stability of visuospatial and olfactory representations in the dorsal hippocampus. PLoS Biol. 2009. 7:e1000140.
Nicolelis M.A., Fanselow E.E., Ghazanfar A.A. Hebb’s dream: the resurgence of cell assemblies. Neuron. 1997. 19, 219–221.
Paxinos G., Watson C. The Rat Brain in Stereotaxic Coordinates: Hard Cover Edition. Amsterdam: Elsevier. 2005.
Pinto L., Dan Y. Cell type-specific activity in prefrontal cortex during goal-directed behavior. Neuron. 2015. 87 (2): 437–450.
Ruediger S., Spirig D., Donato F., Caroni P. Goal-oriented searching mediated by ventral hippocampus early in trial-and-error learning. Nat. Neurosci. 2012. 15 (11): 1563–1571.
Renart A., Machens C.K. Variability in neural activity and behavior. Curr. Opin. Neurobiol. 2014. 25. 211–220.
Smith D.M., Barredo J., Mizumori S.J. Complimentary roles of the hippocampus and retrosplenial cortex in behavioral context discrimination. Hippocampus. 2012. 22: 1121–1133.
Snyder J.S., Clifford M.A., Jeurling S.I., Cameron H.A. Complementary activation of hippocampal-cortical subregions and immature neurons following chronic training in single and multiple context versions of the water maze. Behav. Brain Res. 2012. 227 (2): 330–339.
Svarnik O.E., Bulava A.I., Alexandrov Y.I. Expression of c-Fos in the rat retrosplenial cortex during instrumental re-learning of appetitive bar-pressing depends on the number of stages of previous training. Frontiers in Behavioral Neuroscience. 2013. 7:78.
Tsao A., Moser M.B., Moser E.I. Traces of experience in the lateral entorhinal cortex. Current biology: CB. 2013. 23 (5): 399–405.
Vedder L.C., Miller A.M.P., Harrison M.B., Smith D.M. Retrosplenial cortical neurons encode navigational cues, trajectories and reward locations during goal directed navigation. Cereb Cortex. 2017. 27 (7): 3713–3723.
Weible A.P., Rowland D.C., Pang R., Kentros C. Neural correlates of novel object and novel location recognition behavior in the mouse anterior cingulate cortex. J Neurophysiol. 2009. 102: 2055–2068.
Wirt R.A., Hyman J.M. Integrating Spatial Working Memory and Remote Memory: Interactions between the Medial Prefrontal Cortex and Hippocampus. Brain Sciences. 2017. 7 (4): 43.
Yanike M., Wirth S., Smith A.C., Brown E.N., Suzuki W.A. Comparison of associative learning-related signals in the macaque perirhinal cortex and hippocampus. Cereb. Cortex. 2009. 19 (5): 1064–78.
Ziv Y., Burns L.D., Cocker E.D., Hamel E.O., Ghosh K.K., Kitch L.J., Gamal A.E., Schnitzer M.J. Long-term dynamics of CA1 hippocampal place codes. Nat. Neurosci. 2013. 16 (3): 264–266.
Дополнительные материалы отсутствуют.
Инструменты
Журнал высшей нервной деятельности им. И.П. Павлова


