Журнал высшей нервной деятельности им. И.П. Павлова, 2019, T. 69, № 5, стр. 529-540
ВООБРАЖЕНИЕ ДВИЖЕНИЙ НИЖНИХ КОНЕЧНОСТЕЙ ДЛЯ УПРАВЛЕНИЯ СИСТЕМАМИ “ИНТЕРФЕЙС МОЗГ-КОМПЬЮТЕР”
Е. В. Боброва 1, *, В. В. Решетникова 1, 2, А. А. Фролов 3, 4, Ю. П. Герасименко 1
1 ФГБУН Институт физиологии РАН им. И.П. Павлова
Санкт-Петербург, Россия
2 Санкт-Петербургский государственный университет
Санкт-Петербург, Россия
3 ФГБУН Институт высшей нервной деятельности и нейрофизиологии РАН
Москва, Россия
4 Институт трансляционной медицины ГБОУ ВПО
Российского национального исследовательского медицинского университета им. Н.И. Пирогова
Москва, Россия
* E-mail: eabobrovy@gmail.com
Поступила в редакцию 04.05.2018
После доработки 17.09.2018
Принята к публикации 20.11.2018
Аннотация
Обзор посвящен проблеме использования систем “интерфейс мозг-компьютер” (ИМК), управляемых воображением движений нижних конечностей, и их применению в клинической практике. Исследований, посвященных этой теме, существенно меньше, чем исследований ИМК, управляемых воображением движений руки, что отчасти связано с методическими сложностями. В обзоре описаны различные модификации ИМК, большинство исследований направлено на восстановление функции ходьбы, меньше – на восстановление движений в голеностопном суставе. Для восстановления локомоции достаточно часто используется управление ИМК воображением ходьбы, которое приводит к перемещениям аватара в виртуальном пространстве. В ряде работ воображение движений сопровождается функциональной электрической стимуляцией, активирующей мышцы, обеспечивающие осуществление воображаемого движения, либо запуском движений механических устройств (ортезов, экзоскелетов). Наконец, описываются принципиально новые интегративные подходы, например, ИМК, управляемый воображением движений рук, сигнал от которого запускает движения ног аватара или ортезов, причем при этом осуществляется тактильная стимуляция предплечья руки в ритме шагания. Исследований по проблеме восстановления функций нижних конечностей с помощью ИМК, выполненных в России, в литературе не обнаружено.
“Интерфейс мозг-компьютер” (ИМК) – система взаимодействия между компьютером и мозгом, которая в настоящее время находит широкое применение в области нейрореабилитации [Каплан, 2016]. Благодаря ИМК люди могут не только управлять вспомогательными устройствами (ортезы, экзоскелеты), но и восстанавливать двигательные функции за счет активации пластических механизмов, направленных на изменение топологии нейронных сетей мозга [Pichiorri et al., 2011]. Есть сведения об использовании ИМК для восстановления вестибулярной функции, что необходимо для поддержания равновесия при движении [Орлов и др., 2017]. Таким образом, ИМК является многообещающим методом для создания новых стратегий постинсультной реабилитации, а также реабилитации после повреждений спинного мозга.
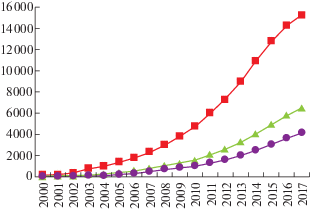
ИМК для восстановления функций нижних конечностей – сравнительно недавно развивающееся направление исследований. Большинство исследований направлено на поиск способов восстановления двигательной активности верхних конечностей с помощью ИМК [Belda-Lois et al, 2011; Frolov et al., 2017]. Сравнительный анализ источников в поисковой системе Google Scholar по ключевым словам “BCI + rehabilitation + lower limb”, то есть работ, посвященных реабилитации нижних конечностей с помощью ИМК, и по ключевым словам “BCI + rehabilitation + upper limb”, в которых рассматривается проблема нейрореабилитации верхних конечностей, показывает, что первых почти в полтора раза меньше (рис. 1). В общей сложности интерес к нейрореабилитации с помощью ИМК значительно возрос – число работ по этой теме увеличилось в 7.5 за последние 17 лет (рис. 1).
Рис. 1.
Число источников с ключевыми словами “BCI + rehabilitaion” (ИМК + реабилитация) (квадраты), “BCI + rehabilitation + upper limb” (ИМК + реабилитация + верхние конечности) (треугольники), “BCI + rehabilitation + lower limb” (ИМК + реабилитация + нижние конечности) (кружки) в поисковой системе Google Scholar в 2000–2017 гг.
Fig. 1. Quantity of search results through Google Scholar by keywords “BCI + rehabilitaion” (squares), “BCI + rehabilitation + upper limb” (triangles), “BCI + rehabilitation + lower limb” (circles) for the period 2000–2017.
ИМК в основном используется для реабилитации и улучшения качества жизни пациентов с нарушениями опорно-двигательного аппарата после инсультов или повреждений спинного мозга [Guger, 2008; Silvoni et al., 2011; Jane et al., 2015].
Инсульт является главной причиной инвалидности в США и Европе [WHO, 2008]. Обычными последствиями инсульта являются гемипарез и гемиплегия, которые приводят к дефициту движений на стороне тела, контралатеральной поврежденному полушарию. Главными клиническими симптомами при этом являются: слабость мышц, анормальный мышечный тонус, неправильная корректировка позы, снижение подвижности, недостаток координации и чувствительности. В результате инсульта 50% пациентов навсегда остаются в инвалидном кресле, 15% могут передвигаться самостоятельно, 10% могут выходить на улицу и всего 5% – подниматься по лестнице [Paolucci et al., 2008]. Таким образом, главными целями реабилитации постинсультных больных являются восстановление утраченных функций, возвращение пациентам независимости и интеграция их в социальную жизнь общества.
Повреждение спинного мозга, как правило, приводит к невозможности самостоятельно ходить и выполнять основные моторные функции, которые являются основой для самостоятельного обеспечения повседневных потребностей. Пока не существует полноценных биомедицинских решений для восстановления утерянной неврологической функции нижних конечностей у таких пациентов, и поиск решения этой проблемы является актуальной, социально-значимой задачей.
В настоящее время в большинстве случаев после повреждения спинного мозга, приводящего к потере способности самостоятельно передвигаться, используется инвалидная коляска. Однако ее длительное применение связано с уменьшением физической активности, в результате чего может возникнуть ряд заболеваний: болезни сердца, остеопороз, пролежни [Johnson et al., 1996]. Поэтому активно ищутся альтернативные методы восстановления способности передвигаться. Система ИМК может предложить решение этой проблемы в виде создания ортезов и экзоскелетов, управляемых изменением активности мозга.
ИМК для восстановления функций нижних конечностей разработаны в различных модификациях. В большинстве исследований ИМК классифицирует сигналы электрической активности мозга (ЭЭГ) при кинестетическом воображении движений; для классификации состояний мозга используется наиболее распространенный метод CSP (common spatial patterns) в различных модификациях, точность и варианты модификации которого описаны в работе Х. Башашати и соавт. (Bashashati et al., 2015). Задача воображения движений является достаточно сложной, и в последние годы возникает интерес к разработке тренировок пользователей ИМК [Боброва и др., 2017 а; 2017 б]. Варианты воображаемых движений для совершенствования и реабилитациии моторных функций весьма разнообразны [Столбков и др., 2018]. В некоторых исследованиях рассматриваются возможности применения для управления ИМК-сигналов гемодинамической активности мозга при подготовке движений нижних конечностей (метод функциональной спектроскопии в ближней инфракрасной области [Miyai et al., 2002; Mihara et al., 2007; Rea et al., 2011; 2014; Bobrov et al., 2016].
Для управления ИМК и реорганизации утраченных нейронных сетей, управляющих движениями нижних конечностей, наиболее часто служит представление пациентом локомоторных движений [Wang et al., 2010; King et al., 2013; 2014; 2015; Do et al., 2013; García-Cossio et al., 2015; Donati et al., 2016]. Для восстановления локомоции часто достаточно управления ИМК воображением ходьбы, приводящим к перемещениям аватара в виртуальном пространстве [Wang et al., 2010; King et al., 2013; 2014; 2015; Donati et al., 2016]. Такой подход, по-видимому, связан с методом, который используется при изучении областей мозга, активирующихся во время ходьбы: воображение локомоции в этом методе осуществляется одновременно с видео, демонстрирующим шагание, и испытуемый должен мысленно его имитировать [Villiger et al., 2013]. При перемещениях аватара пользователь ИМК также видит изображение процесса шагания, только этот процесс запускается в результате его собственных усилий.
Часть исследований направлена на представление движений утраченной функции одной конечности, в основном сгибания стопы [Do et al., 2011; 2012; McCrimmon et al., 2014; 2015]. В ряде работ воображение движений сопровождается функциональной электрической стимуляцией (ФЭС) активирующей мышцы, обеспечивающие осуществление воображаемого движения [Do et al., 2011; 2012; Takahashi et al., 2012; King et al., 2014; 2015; McCrimmon et al., 2014; 2015; Mrachacz-Kersting et al., 2016], либо запуском движений механических устройств (ортезов, экзоскелетов) [Do et al., 2013; Xu et al., 2014; García-Cossio et al., 2015; Donati et al., 2016]. Наконец, недавно был опробован новый подход – движения ног аватара или ортезов ИМК запускает при представлении движений рук [Donati et al., 2016], при этом осуществляется тактильная стимуляция предплечья руки в ритме шагания. Более подробную информацию о методике воображения движений в нейрореабилитации двигательных функций можно почерпнуть в недавно опубликованном обзоре Ю.К. Столбкова и соавт. [2018].
ИМК ПРИ ПРЕДСТАВЛЕНИИ ДВИЖЕНИЙ КОНЕЧНОСТЕЙ
Представление движений правой и левой ноги
Поскольку представительства правой и левой ноги в сенсомоторной коре находятся в непосредственной близости (вблизи средней линии), ответ на вопрос о разделимости состояний мозга при воображении их движений не является очевидным. Проведенное на 20 здоровых волонтерах исследование [Boord et al., 2010] дало ответ на этот вопрос. При предъявлении инструкций на экране монитора представить движение левой ноги, правой ноги или сжатие обеих кистей. Чтобы увеличить вероятность обнаружения паттернов ЭЭГ, соответствующих воображению различных движений, были изучены результаты двух экспериментальных сессий – простое представление движения ног и его представление при одновременном просмотре видео с поднятием ноги (изменение угла в тазобедренном суставе) от первого лица. Предполагалось, что это может усилить десинхронизацию мю-ритма во время воображения движения и тем самым улучшить распознавание сигналов мозга, соответствующих воображению этого движения, поскольку наблюдение за действиями облегчает и воображение движения (зеркальные нейроны), а также стандартизовать движение, которое можно вообразить по-разному. Исследование показало, что при воображении движений правой и левой ноги паттерны десинхронизации латерализованы в представительстве контралатеральной ноги. Имитация показываемых в видео движений значительно увеличивает эффект воображения движения ноги.
ИМК, основанный на кинестетическом представлении движений конечности, с добавлением функциональной электрической стимуляции (ФЭС) (рис. 2)
Рис. 2.
Блок-схема ИМК при представлении движений стопы с использованием ФЭС или ортеза.
Fig. 2. Block diagram of the BCI based on imagination of dorsiflexion with integration of FES or orthosis.
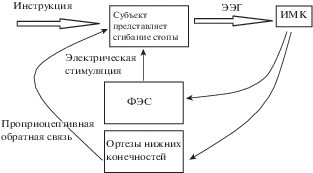
Этот подход используется преимущественно для реабилитации подвижности стопы при синдроме ее слабости. Нарушение ходьбы из-за слабости стопы – обычное последствие инсульта (“висячая стопа”), которое далеко не всегда может быть преодолено физиотерапевтическими методами, ортезы громоздки и их эффект зачастую непродолжителен. В связи с этим рассматривается возможность использования ИМК в сочетании с ФЭС, когда представление движения стопы приводит к включению электрической стимуляции мышц, поднимающих стопу, т.е. обеспечивающих тыльное сгибание (дорсифлексию). Интеграция ИМК и ФЭС систем может обеспечить устойчивое долговременное улучшение моторной функции. Предполагается, что ИМК-ФЭС система работает по принципу обучающего механизма Хебба: одновременное возбуждение моторных зон коры при представлении движения (ИМК) и структур спинного мозга, вызванное ФЭС (возбуждение альфа-мотонейронов спинного мозга и возбуждение интернейронов, вызванное афферентным потоком от сокращающейся в результате ФЭС мышцы), приводит к восстановлению возможности регуляции движения паретичной конечности моторными зонами коры. Группа исследователей из Университета Калифорнии опубликовали ряд исследований по этому вопросу [Do et al., 2011; 2012; McCrimmon et al., 2014; 2015], которые будут описаны ниже.
Развитие методики ИМК-ФЭС было начато в 2011 г. [Do et al., 2011]. Пять здоровых испытуемых осуществляли тыльное сгибание стопы, чередующееся с периодами покоя. Сигналы ЭЭГ-активности мозга классифицировали off-line и строили предсказательную модель. Далее в on-line эксперименте испытуемые сгибали одну стопу, и система ИМК-ФЭС по распознаваемой ЭЭГ-активности при сгибании этой стопы обеспечивала электрическую стимуляцию передней большеберцовой мышцы контралатеральной стопы. Таким образом, сгибание одной стопы приводило к сгибанию другой стопы в результате ФЭС. Кросс-корреляция между сгибанием первой стопы и ответом ИМК-ФЭС системы – 0.59–0.77, латентный период между этими событиями был в диапазоне 1.4–3.1 с [Do et al., 2011].
Затем эти исследователи использовали разработанную методику на 60-летнем пациенте со слабостью стопы (он мог сгибать ее только на 5°) после инсульта во внутренней капсуле мозга [Do et al., 2012]. В ходе эксперимента пациент в течение 10 мин, пока записывалась ЭЭГ, сидел перед экраном монитора, на котором показывали текстовые команды: находиться в состоянии покоя или стараться поднять стопу. Далее классификатор разделял состояние покоя и попытки поднятия стопы (98.8% точности). Затем в режиме on-line испытуемый должен был делать то же самое по команде каждые 10 с (всего 10 раз). В моменты, когда классификатор распознавал намерение пациента совершить движение, подавалась команда на неинвазивный электростимулятор и осуществлялась стимуляция малоберцового нерва, что приводило к поднятию стопы до 15°. Всего было 3 on-line-сессии, во время которых кросс-корреляция между текстовыми командами и ответом ИМК-ФЭС системы составила 0.60 [Do et al., 2012].
Сходное, но более длительное исследование, было проведено в 2014 г. на трех пациентах, страдающих хроническим инсультом [McCrimmon et al., 2014]. Каждый из них в течение недели проходил три одночасовые сессии, сходные с вышеописанными. Улучшение в сгибании стопы составило 3–8°, точность классификатора – 91–98%, кросс-корреляция – 0.44–0.66.
В следующем исследовании этих же авторов [McCrimmon et al., 2015] девять пациентов управляли основанной на ЭЭГ ИМК-ФЭС системой для сгибания стопы в 12 одночасовых сессиях в течение четырех недель. Система, используя сигналы ЭЭГ, отмечала, когда испытуемый пытался согнуть паретичную стопу, и осуществлялась стимуляция малоберцового нерва. В результате у пяти пациентов значительно улучшились скорость ходьбы и дистанция, которую они проходили за 6 мин, у троих – диапазон движений стопы, и у троих – показатели по тесту Фугл-Мейер. Ни у одного испытуемого не было ухудшения результатов по измеряемым параметрам.
Японские исследователи в 2012 г. сопоставляли два способа реабилитации движений стопы: ФЭС передней большеберцовой мышцы и та же ФЭС, но сопровождаемая намерением пациента согнуть стопу (намерение оценивали по изменениям бета-ритма, связанным с событием, электроды FCz и CPz) [Takahashi еt аl., 2012]. Пациенту давалась инструкция сгибать стопу паретичной ноги в удобном ему темпе. При достижении порогового значения бета-ритма вызывалась электрическая стимуляция. После 20 мин тренировки оценивали амплитуду движения голеностопного сустава и ЭМГ большеберцовой мышцы, они достоверно были больше при использовании ФЭС, сопровождаемой намерением пациента.
Группой исследователей из Европы (Дания, Германия, Сербия и Италия) в двойном слепом эксперименте с плацебо контролем оценивали влияние трех тренировочных сессий ИМК и электрической стимуляции малоберцового нерва на двигательную активность 22 пациентов с последствиями инсульта [Mrachacz-Kersting еt аl., 2016]. Во время повторяющихся сгибаний стопы регистрировали потенциалы коры, связанные с движением. Неинвазивная стимуляция малоберцового нерва осуществлялась либо во время пика отрицательной фазы потенциалов, связанных с движением (первая группа), или случайно (вторая группа). Только в первой (но не во второй) группе значительно улучшились вызванный моторный потенциал мышцы, показатели шкалы Фугл-Мейер, частота сгибаний ноги и скорость ходьбы на дистанции 10 м. По мнению авторов, ни один из существующих ИМК не показывал такую степень функциональных улучшений за столь короткое время.
ИМК, основанный на кинестетическом представлении движений конечности, управляющий движениями ортеза (рис. 2)
Для восстановления движений стопы после инсульта был разработан голеностопный ортез, управляемый ИМК [Xu еt аl., 2014]. Эта система детектирует потенциалы коры, связанные с движением, при воображении сгибания стопы с точностью 73 ± 10.3% и с коротким латентным периодом. Каждая такая детекция вызывала запуск ортеза, обеспечивающего пассивное сгибание стопы, расположенной на педали. Показана эффективность этой системы в индуцировании корковой нейропластичности у здоровых испытуемых после короткого тренинга (15 мин). Сразу и через 30 мин после прекращения 15-минутного движения ортеза под управлением ИМК моторные потенциалы, вызванные транскраниальной магнитной стимуляцией, достоверно увеличивались у 9 из 10 здоровых испытуемых. В контрольном эксперименте, где ортез запускался случайно, увеличения моторных потенциалов, вызванных транскраниальной магнитной стимуляцией, не было. Авторы заключают, что предлагаемая система обеспечивает быстрый и эффективный подход для индуцирования корковой пластичности с помощью ИМК и является потенциальным средством терапии для восстановления моторной функции в реабилитации после инсульта.
ИМК, ОСНОВАННЫЕ НА ВООБРАЖЕНИИ ЛОКОМОТОРНЫХ ДВИЖЕНИЙ (рис. 3)
Рис. 3.
Блок-схема ИМК при представлении локомоторных движений с использованием ФЭС, ортеза и виртуальной реальности.
Fig. 3. Block diagram of the integrated BCI-FES system.
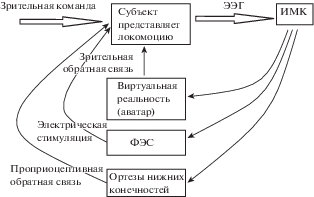
Реабилитации нижних конечностей с помощью представления ходьбы посвящена большая часть исследований. В 2007 г. Дунский и соавт. [Dunsky et al., 2007] доказали эффективность домашних тренировок по этой методике (без ИМК). В эксперименте участвовали 17 пациентов с гемипарезом, вызванным односторонним инсультом. Участники проходили 15-минутные тренинги по представлению ходьбы под контролем супервизора у себя дома 3 раза в нед в течение 6 нед. Способность к локомоции оценивалась по кинематическим и функциональным параметрам дважды до начала эксперимента, на третью и шестую недели после начала и через 3 недели после окончания. Результаты исследования показали, что скорость ходьбы увеличилась на 40% после тренировки и оставалась постоянной после третьей недели тренировок. Наблюдалось значительное увеличение длины шага, ритма ходьбы и длительности одноопорного периода пораженной нижней конечности, тогда как время двойной опоры уменьшалось. Улучшения также отмечались по шкале Тинетти.
Группа ученых из Университета Калифорнии, исследовавших использование вышеописанной системы ИМК-ФЭС для восстановления сгибаний стопы после инсульта [Do et al., 2011; 2012; McCrimmon et al., 2014; 2015], изучали также ИМК, основанный на воображении локомоторных движений. В 2010 г. ими были изучены возможности здоровых волонтеров управлять аватаром, представляя кинематические ощущения при ходьбе [Wang еt аl., 2010], в 2013 г. небольшая модификация этой методики была протестирована на пяти пациентах с пара- или тетра-плегией [King et al., 2013], а через год были опубликованы результаты тренировки пациента с параплегией, которого сначала обучали управлять аватаром, представляя его ходьбу в виртуальном пространстве, а затем добавили ФЭС, запускаемую воображением ходьбы [King et al., 2014; 2015]. Кроме того, исследователи из этой же группы, а также голландские ученые тестировали возможность использования ИМК, основанного на воображении ходьбы, для управления движениями ортеза [Do et al., 2013; García-Cossio еt аl., 2015]. Эти работы отражены в блок схеме на рис. 3 и будут подробнее описаны ниже.
ИМК, основанный на воображении локомоторных движений, управляющий движениями ортеза
Возможность использования ИМК, основанного на воображении локомоторных движений для управления движениями ортеза (рис. 2) [Do et al., 2013], тестировали на двух испытуемых: один физически здоровый, а второй – с параплегий в результате повреждения спинного мозга. Записи ЭЭГ в покое и во время воображения кинестетических ощущений при ходьбе формировали предсказательную модель, которая затем использовалась для управления ИМК. Роботизированная система ортезов для ходьбы (RoGO) управлялась испытуемыми в подвешенном состоянии над беговой дорожкой с помощью ИМК. Волонтеры выполняли пять пятиминутных онлайн-сессий, во время которых они должны были перемещаться, используя систему ИМК-RoGO. В результате было получено, что у обоих волонтеров показатель предсказательной модели составлял в среднем 86%. Кросс-корреляция между подачей инструкций к ходьбе и ходьбой с помощью ИМК-RoGO составила 0.812 ± 0.048 (p < 0.001).
В 2015 г. голландскими исследователями [García-Cossio еt аl., 2015] проведен анализ спектральной активности ЭЭГ при роботизированной ходьбе (с помощью Локомата) у десяти здоровых волонтеров и у трех пациентов с острым инсультом. Средняя точность классификации при сравнении записей при ходьбе и в состоянии покоя составила 94.5% у здоровых испытуемых и 89.9% у больных. Кроме того, была выявлена модуляция гамма-активности в области центральной борозды вблизи средней линии (отведение Cz), связанная с фазами цикла походки у здоровых добровольцев, но не у пациентов с инсультом. Эти результаты, с точки зрения авторов, демонстрируют целесообразность применения роботизированных тренажеров на базе ИМК для реабилитации ходьбы.
ИМК, основанный на воображении локомоторных движений, управляющий перемещениями аватара в виртуальной реальности
Исследование возможности использования ИМК для контроля локомоции в пространстве виртуальной реальности было проведено на трех здоровых волонтерах [Wang et al., 2010]. Они должны были управлять перемещениями аватара в пространстве виртуальной реальности, осуществляя кинестетическое представление ходьбы и покоя. Задача состояла в том, чтобы сделать 10 остановок в указанных точках виртуального пространства. Длительность пробы составляла 10 мин, всего было проведено 150 проб. Точность классификации между состоянием покоя и представлением ходьбы составила 80%, точность остановок аватара в указанных точках была достоверно выше, чем у аватара, который останавливался в случайных местах того же виртуального пространства.
Эта методика была протестирована на пяти пациентах с пара- или тетраплегией в результате повреждения спинного мозга [King et al., 2013]. Тренинги проводили раз в сутки на протяжении 5 дней. Точность классификации между состоянием покоя и представлением ходьбы составила 61–92%. Точность остановок аватара в требуемых точках была достоверно выше, чем при случайных остановках, также, как и у здоровых в вышеописанном исследовании [Wang et al., 2010]. Все пациенты, кроме одного, в первый же день достигли таких результатов, и у всех пациентов от сессии к сессии наблюдалось улучшение точности остановок аватара в требуемых точках.
ИМК, основанный на воображении локомоторных движений, управляющий перемещениями аватара в виртуальной реальности и с добавлением ФЭС
Вышеописанная методика работ [Wang еt аl., 2010] и [King et al., 2013] была расширена в [King et al., 2014; 2015]. Пациент с повреждением спинного мозга был обучен управлению аватаром, а затем ИМК был дополнен ФЭС, которая запускалась от воображения пациентом локомоции (с и без поддержки веса тела). В течение 19-недельного курса тренировок испытуемый выполнил 30 тестов ходьбы с помощью ИМК-ФЭС системы, которые показали его способность ею управлять. В результате тренинга удалось снизить поддержку веса тела при локомоции на 60% (p < 0.01).
ИМК, основанный на воображении движений рук, а затем ног, управляющий перемещениями аватара в виртуальной реальности и ортезами, с визуальной и тактильной обратной связью (рис. 4)
Рис. 4.
Блок-схема ИМК при представлении движений рук в ритме шагания с использованием виртуальной реальности, ортезов и тактильной стимуляцией руки в ритме шагания.
Fig. 4. Block diagram of the BCI based on imagination of arm movements in the rhythm of locomotion using virtual reality, orthosis and tactile arm stimulation in the rhythm of locomotion.
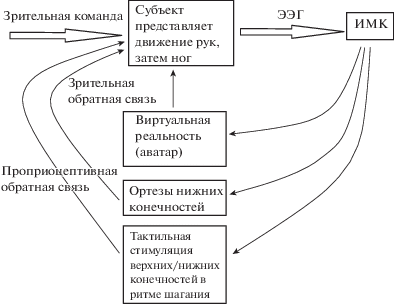
Интегральный подход с использованием ИМК, ортезов, тактильной стимуляции и виртуальной реальности использовался в 2016 г. в Бразилии [Donati et al., 2016]. Для исследования были взяты 8 человек с длительным (3–13 лет) параличом обеих нижних конечностей (параплегия) в результате травмы, с каждым из которых провели около 255 сессий в течение года. Эксперимент включал в себя использование интенсивного тренинга виртуальной реальности с визуально-тактильной обратной связью, а также хождение с помощью двух роботизированных приводов, управляемых ЭЭГ. Кроме того, был использован специально разработанный экзоскелет нижних конечностей, способный давать тактильную обратную связь испытуемому. Клинический протокол исследования получил название “Walk Again Neurorehabilitation” (WA-NR). Он включал в себя шесть компонентов:
1. Глубокое погружение в среду виртуальной реальности, при котором испытуемый в сидячем положении использовал активность своего мозга для перемещения своего аватара, получая при этом визуальную и тактильную обратную связь (запись электрической активности мозга велась с помощью 16-канального ЭЭГ);
2. То же самое, только пациент находился в вертикальном положении с помощью специального поддерживающего стола;
3. Тренировки с помощью прибора, поддерживающего вес тела, – ходьба по беговой дорожке;
4. То же самое, только движение ног в воздухе, а не по беговой дорожке;
5. Тренировки на беговой дорожке с помощью роботизированного тела, управляемого ИМК;
6. Тренировка ходьбы с помощью экзоскелета, управляемого ИМК.
Во время всех тренингов испытуемые получали тактильную обратную связь через специальный дисплей, состоящий из вибраторов различной формы с регулируемой силой вибрации. Вибрация подавалась на предплечье, когда виртуальная или роботизированная нога с той же стороны касалась земли.
Для тренировки использовали две стратегии ИМК: сначала испытуемые должны были представить движение руки для модулирования ЭЭГ активности, с помощью чего они могли подавать команды, такие как “идти” или “стоять” аватару или роботизированному телу. Когда этот метод был освоен, пациентов обучали использовать сигналы ЭЭГ для управления локомоторной активностью их индивидуального аватара или роботизированного устройства, представляя движения своих ног.
Через 12 мес. после тренировок по этой парадигме у всех восьми пациентов во многих дерматомах наблюдали значительное неврологическое улучшение в соматических ощущениях (локализация боли, приятное/грубое прикосновение и проприоцептивные ощущения). У пациентов также восстановился свободный контроль ключевых мышц нижних конечностей (по шкале измерения степени повреждения спинного мозга), что показала электромиграмма. В результате были видны заметные улучшения в их способности ходить. В итоге 50% этих пациентов повысили свой уровень в классификации степеней параплегии. Многие пациенты смогли ходить при помощи вспомогательных приборов, а некоторые – с помощью ортезов нижних конечностей (ортезы бедра-голени-лодыжки-стопы). Кроме этого, у всех пациентов было отмечено значительное повышение эмоциональной стабильности и оценки качества жизни, а также снизился уровень депрессивности и увеличилась самооценка. Улучшились состояние кожи и функция пищеварительной системы.
Неврологическое восстановление было тесно связано с восстановлением к способности представления движения нижних конечностей на уровне коры головного мозга. Авторы предполагают, что столь эффективное восстановление является результатом пластичности коры головного мозга и спинного мозга под влиянием ИМК. Измерение пластичности коры головного мозга проводили с помощью 11-канального ЭЭГ в течение года: испытуемых просили представить движение ноги и в это время измеряли активность сенсомоторных зон мозга, а также десинхронизацию мю-ритма, которая у здоровых людей появляется во время представления движения. К концу эксперимента значительно увеличилась степень десинхронизации во время представления ходьбы.
ТЕОРЕТИЧЕСКИЕ ВОЗМОЖНОСТИ РЕАБИЛИТАЦИИ НАРУШЕНИЙ ЛОКОМОЦИИ
Коллективом европейских авторов в 2012 г. [Cheron et.al., 2012] была предложена идея интегрального ИМК, включающего различные стратегии для восстановления утраченных функций нижних конечностей в зависимости от особенностей клинических требований конкретного пациента. Часть идей, изложенных в этой статье, реализована в вышеописанных исследованиях, часть – нет.
Предлагается объединение двух основных методов: первый состоит в формировании динамической рекуррентной нейронной сети, на входе которой – сигналы ЭМГ дельтовидных мышц (мышцы плеча) здоровых испытуемых при ходьбе по беговой дорожке, на выходе – кинематические характеристики движений стопы, голени и бедра, соответствующие реальным кинематическим характеристикам движений звеньев нижних конечностей этих испытуемых. Эта обученная сеть проверяется на других здоровых испытуемых с их ЭМГ и реальными движениями, а затем используется для управления ортезом у пациентов с нарушениями движений нижних конечностей. Например, у пациентов с параплегией запись ЭМГ мышц плеча даст возможность с помощью этой сети получить сигналы движений звеньев нижней конечности, позволяя экзоскелету активировать движение в тазобедренном, коленном и голеностопном суставах. Следующий шаг при работе с пациентом – использование для управления ортезом его ЭЭГ при воображении движения ног.
Эффект предлагается усилить вибротактильной (вибрация опорной поверхности стопы в фазу опоры) и визуальной стимуляцией (виртуальная реальность), которые могут усиливать ощущение ходьбы и способствовать определению подходящих компонентов параметров ЭЭГ.
Кроме того, интегральный ИМК включает второй подход – дополнение, которое развивает идеи о гибридных ИМК, использующих параллельно или последовательно сигналы ЭЭГ при воображении движений и/или при зрительном внимании и/или другие биологические сигналы (частота сердечных сокращений, направление взора) [Pfurtscheller et al., 2010]. Состоит оно в следующем: управление ортезом осуществляется не только с использованием сигнала от вышеописанной обученной динамической рекуррентной нейронной сети, но и от подсистемы, имитирующей работу генератора шагательных движений (нейрональной сети на уровне спинного мозга, которая контролирует координированные движения мышц, обеспечивающих локомоторные движения нижних конечностей) [Dimitrijevic et al., 1998, Герасименко 2002, Grillner, 2006]. Имитатор генератора шагательных движений может запускаться либо от потенциалов мозга (steady-state somatosensory evoked potentials или steady-state visual evoked potential, или classical P300), либо от вышеописанной обученной динамической рекуррентной нейронной сети (имитация влияния коры головного мозга на спинальный генератор шагательных движений).
ПОДХОДЫ К ИСПОЛЬЗОВАНИЮ МЕТОДА АНАЛИЗА ГЕМОДИНАМИЧЕСКОЙ АКТИВНОСТИ МОЗГА В УПРАВЛЕНИЯ ИМК ДЛЯ РЕАБИЛИТАЦИИ ДВИЖЕНИЙ НИЖНИХ КОНЕЧНОСТЕЙ
Большинство исследований возможностей использования ИМК для восстановления функций нижних конечностей – это исследования ИМК, управляемых сигналами электрической активности мозга (ЭЭГ). Вместе с тем в ряде работ предлагается использовать для управления ИМК сигналы гемодинамической активности в мозге при подготовке движений нижних конечностей, регистрируемые методом функциональной спектроскопии в ближней инфракрасной области (фБИК-спектроскопия). Преимущество этого метода в том, что нет необходимости в геле при наложении электродов и нет влияния проводов на сигнал, как при регистрации ЭЭГ.
Активность коры во время ходьбы анализировали этим методом у шести пациентов с гемиплегией после обширного инсульта [Miyai et al., 2002]. Пациенты ходили по беговой дорожке при частичной поддержке массы тела с помощью устройств, контролирующих размах нижних конечностей, под контролем физиотерапевтов. Улучшение в параметрах ходьбы связано с большим увеличением уровня оксигемоглобина в медиальной первичной сенсомоторной коре в непораженном полушарии по сравнению с пораженным, причем выявлена корреляция между увеличением асимметричной активации сенсомоторной коры и улучшением ходьбы.
Активность коры во время ходьбы на беговой дорожке сравнивали у 12 пациентов с атаксией без выраженного гемипареза после инфратенториального инсульта и у 11 здоровых добровольцев соответствующего возраста. У здоровых наблюдали активацию в латеральной и медиальной префронтальной коре, зависящую от фазы шагания: она была максимальна в фазе ускорения и ослаблялась в фазе опоры, у пациентов такая зависимость отсутствовала. Эти результаты показали, что устойчивая префронтальная активация может быть компенсаторным механизмам атаксической походки после инфратенториального инсульта [Mihara et.al., 2007].
Оценка активности мозга, связанной с подготовкой к движению нижних конечностей, выявила увеличение уровня оксигемоглобина в теменной коре до начала движения ноги преимущественно в контралатеральном полушарии [Rea et al., 2011]. Гемодинамические сигналы в мозге, появляющиеся при подготовке движений нижних конечностей у пациентов, перенесших инсульт, могут быть измерены и классифицированы (оценивали значения показателей фБИК-спектроскопии во время подготовки к движению правого и левого бедра у 7 пациентов с хроническим инсультом). Обнаружено, что изменение уровня общего гемоглобина в премоторной коре и в задней теменной коре различно для состояния подготовки к движению в паретичных и непаретичных конечностях [Rea et al., 2014].
Таким образом, эти исследования показывают эффективность использования фБИК-спектроскопии для выявления активности мозга во время нормального и патологического движения и для реабилитации, однако работ с использованием ИМК по сигналам гемодинамической активности для восстановления движения нижних конечностей в литературе не обнаружено.
ЗАКЛЮЧЕНИЕ
Таким образом, ИМК активно используется для реабилитации функций нижних конечностей. Большинство исследований направлено на восстановление функции ходьбы, ряд работ – на восстановление движений в голеностопном суставе. Совместно с ИМК используются роботизированные устройства, ФЭС, виртуальная реальность, тактильная стимуляция опорной поверхности. Несмотря на то что в России активно ведутся работы по использованию ИМК для реабилитации утраченных функций руки [Frolov et al., 2017], исследований по проблеме восстановления функций нижних конечностей с помощью ИМК, выполненных в России, в литературе не обнаружено.
Работа выполнена при финансовой поддержке Программы фундаментальных научных исследований государственных академий на 2013–2020 гг. (ГП-14, раздел 63), Программы ПРАН ПI.43 “Фундаментальные основы технологии физиологических адаптаций” № 0134-2018-0005. Участие А.А. Фролова поддержано грантом РНФ 16-15-00219.
Список литературы
Боброва Е.В., Фролов А.А., Решетникова В.В. Методы и подходы для оптимизации управления системой “интерфейс мозг-компьютер” здоровыми пользователями и пациентами с нарушениями движений. Журн. высш. нервн. деят. им. И.П. Павлова. 2017. 67 (4): 377–393.
Боброва Е.В., Решетникова В.В., Волкова К.В., Фролов А.А. Влияние эмоциональной устойчивости на успешность обучения управлению системой “интерфейс мозг-компьютер”. Журн высш. нервн. деят. им. И.П. Павлова. 2017. 67 (4): 485–492.
Герасименко Ю.П. Генераторы шагательных движений человека: спинальные механизмы их активации. Авиакосмическая и экологическая медицина. 2002. 36 (3): 14–24.
Каплан А.Я. Нейрофизиологические основания и практические реализации технологии мозг-машинных интерфейсов в неврологической реабилитации. Физиология человека. 2016. 42 (1): 18–127.
Орлов И.В., Столбков Ю.К., Герасименко Ю.П. Вестибулярное протезирование: концепция, подходы, результаты. Российский физиологический журнал им. И.М. Сеченова. 2017. 3: 50–65.
Столбков Ю.К., Мошонкина Т.Р., Орлов И.В., Козловская И.Б., Герасименко Ю. П. Воображаемые движения как средство совершенствования и реабилитации моторных функций. Успехи физиологических наук. 2018. 49 (2): 45–59.
Bashashati H., Ward R.K., Birch G.E., Bashashati A. Comparing different classifiers in sensory motor brain computer interfaces. PloS one. 2015. 10 (6): e0129435.
Belda-Lois J.-M., Mena-del Horno S., Bermejo-Bosch I., Moreno J.C., Pons J.L., Farina D., Iosa M., Molinari M., Tamburella F., Ramos A., Caria A., Solis-Escalante T., Brunner C., Rea M. Rehabilitation of gait after stroke: a review towards a top-down approach. J. Neuroeng. Rehabil. 2011. 8: 66.
Bobrov P.D., Isaev M.R., Korshakov A.V., Oganesyan V.V., Kerechanin J.V., Popodko A.I., Frolov A.A. Sources of electrophysiological and foci of hemodynamic brain activity most relevant for controlling a hybrid brain–computer interface based on classification of EEG patterns and near-infrared spectrography signals during motor imagery. Human Physiology. 2016. 42 (3): 241–251.
Boord P., Craig A., Tran Y., Nguyen H. Discrimination of left and right leg motor imagery for brain-computer interfaces. Med. Biol. Eng. Comput. 2010. 48: 343–350.
Cheron G., Duvinage M., De Saedeleer C., Castermans T., Bengoetxea A., Petieau M., Seetharaman K., Hoellinger T., Dan B., Dutoit T., Sylos L.F., Lacquaniti F., Ivanenko Y. From spinal central pattern generators to cortical network: integrated BCI for walking rehabilitation. Neural Plast. 2012: 375148.
Dimitrijevic M.R., Gerasimenko Y., Pinter M.M. Evidence for a spinal central pattern generator in humans. Ann. N. Y. Acad. Sci. 1998. 860: 360–376.
Do A.H., Wang P.T., King C.E., Abiri A., Nenadic Z. Brain-computer interface controlled functional electrical stimulation system for ankle movement. J. Neuroeng. Rehabil. 2011. 8: 49.
Do A.H., Wang P.T., King C.E., Chun S.N., Nenadic Z. Brain-computer interface controlled robotic gait orthosis. J. Neuroeng. Rehabil. 2013. 10: 111.
Do A.H., Wang P.T., King C.E., Schombs A., Cramer S.C., Nenadic Z. Brain-computer interface controlled functional electrical stimulation device for foot drop due to stroke. 34th Annual International Conference of the IEEE EMBS. San Diego, California, USA. 2012.
Donati A., Shokur S., Morya E., Campos D., Moioli R., Gitti C., Augusto P., Tripodi S., Pires C., Pereira G., Brasil F., Gallo S., Lin A., Takigami A., Aratanha M., Bleuler H., Cheng G., Rudolph A., Nicolelis M. Long-term training with a brain-machine interface-based gait protocol induces partial neurological recovery in paraplegic patients. Scientific Reports. 2016. 6: 30383.
Dunsky A., Dickstein R., Marcovitz E., Levy S., Deutsch J.E. Home-based motor imagery training for gait rehabilitation of people with chronic poststroke hemiparesis. Arch. Phys. Med. Rehabil. 2008. 89 (8): 1580–1588.
Frolov A.A., Mokienko O., Lyukmanov R., Biryukova E., Kotov S., Turbina L., Bushkova Y. Post-stroke rehabilitation training with a motor-imagery-based brain-computer interface (BCI)-controlled hand exoskeleton: A randomized controlled multicenter trial. Front. Neuroscie. 2017. 11: 400.
García-Cossio E., Severens M., Nienhuis B., Duysens J., Desain P., Keijsers N., Farquhar J. Decoding Sensorimotor Rhythms during Robotic-Assisted Treadmill Walking for Brain Computer Interface (BCI) Applications. PLoS ONE. 2015. 10 (12): e0137910.
Grillner S. Biological pattern generation: the cellular and computational logic of networks in motion. Neuron. 2006. 52 (5): 751–766.
Guger C. Brain computer interface. Advanced methods for the estimation of human brain activity and connectivity, applications to rehabilitation engineering. Greece, Patras. 2008.
Jane E., Aisha A., Moinuddin J.D., Anthony E., Patricia A. What would brain-computer interface users want: opinions and priorities of potential users with spinal cord injury. Arch. Physical Med. Rehabil. 2015. 96 (3): 38–45.
Johnson R.L., Brooks C.A., Whiteneck G.G. Cost of traumaticspinal cord injury in a population-based registry. Spinal Cor. 1996. 34 (8): 470–480.
King C.E., Wang P.T., Chui L.A., Do A.H., Nenadic Z. Operation of a brain-computer interface walking simulator for individuals with spinal cord injury. J. Neuroeng. Rehabil. 2013. 10: 77.
King C.E., Wang P.T., McCrimmon C.M., Chou C.C.Y., Do A.H., Nenadic Z. Brain-computer interface driven functional electrical stimulation system for overground walking in spinal cord injury participant. Conf. Proc. IEEE Eng. Med. Biol. Soc. 2014. 2014: 1238–1242.
King C.E., Wang P.T., McCrimmon C.M., Chou C.C.Y., Do A.H., Nenadic Z. The feasibility of a brain-computer interface functional electrical stimulation system for the restoration of overground walking after paraplegia. J. Neuroeng. Rehabil. 2015. 12: 80.
McCrimmon C.M., King C.E., Wang P.T., Cramer S.C., Nenadic Z., Do A.H. Brain-controlled functional electrical stimulation for lower-limb motor recovery in stroke survivors. Conf. Proc. IEEE Eng. Med. Biol. Soc. 2014. 2014: 1247–1250.
McCrimmon C.M., King C.E., Wang P.T., Cramer S.C., Nenadic Z., Do A.H. Brain-controlled functional electrical stimulation therapy for gait rehabilitation after stroke: a safety study. J. Neuroeng. Rehabil. 2015. 12: 57.
Mihara M., Miyai I., Hatakenaka M., Kubota K., Sakoda S. Sustained prefrontal activation during ataxic gait: A compensatory mechanism for ataxic stroke? Neuroimage. 2007. 37: 1338–1345.
Miyai I., Yagura H., Oda I., Konishi I., Eda H., Suzuki T., Kubota K. Premotor cortex is involved in restoration of gait in stroke. Ann. Neurol. 2002. 52: 188–194.
Mrachacz-Kersting N., Jiang N., Stevenson A.J.T., Niazi I.K., Kostic V., Pavlovic A., Radovanovic S., Djuric-Jovicic M., Agosta F., Dremstrup K., Farina D. Efficient neuroplasticity induction in chronic stroke patients by an associative brain-computer interface. J. Neurophysiol. 2016. 115 (3): 1410–1421.
Paolucci S., Bragoni M., Coiro P., De Angelis D., Fusco F., Morelli D., Venturiero V., Pratesi L. Quantification of the probability of reaching mobility independence at discharge from a rehabilitation hospital in nonwalking early ischemic stroke patients: a multivariate study. Cerebrovasc. Dis. 2008. 26 (1): 16–22.
Pfurtscheller G., Allison B.Z., Brunner C., Bauernfeind G., Solis-Escalante T., Scherer R., Zander T.O., Mueller-Putz G., Neuper C., Birbaumer N. The hybrid BCI. Front. Neurosci. 2010. 4: 30.
Pichiorri F., Fallani F.D.V., Cincotti F., Babiloni F., Molinari M., Kleih S.C., Neuper C., Kubler A., Mattia D. Sensorimotor rhythm-based brain-computer interface training: The impact on motor cortical responsiveness. J. Neural Eng. 2011. 8 (2): 025020.
Rea M., Rana M., Lugato N., Terekhin P., Gizzi L., Brötz D., Fallgatter A., Birbaumer N., Sitaram R., Caria A. Lower limb movement preparation in chronic stroke: A pilot study toward an fNIRS-BCI for gait rehabilitation. Neurorehabil. Neural Repair. 2014. 28 (6): 564–575.
Rea M., Terekhin P., Sitaram R., Ehlis A., Täglich R., Fallgater A., Birbaumer N., Caria A. An exploratory fNIRS study towards the implementation of a BCI for lower limbs movements. Quebec, Canada. 2011.
Silvoni S., Ramos-Murguialday A., Cavinato M., Volpato C., Cisotto G., Turolla A., Piccione F., Birbaumer N. Brain-computer interface in stroke: a review of progress. Clin. EEG Neurosci. 2011. 42 (4): 245–252.
Takahashi M., Takeda K., Otaka Y., Osu R., Hanakawa T., Gouko M., Ito K. Event related desynchronization-modulated functional electrical stimulation system for stroke rehabilitation: A feasibility study. J. Neuroeng. Rehabil. 2012. 9:56.
Villiger M., Estevez N., Hepp-Reymond M.-C., Kiper D., Kollias S., Eng K., Hotz-Boendermaker S.S. Enhanced activation of motor execution networks using action observation combined with imagination of lower limb movements. 2013. LoS ONE. 8 (8): e72403.
Wang P.T., King C.E., Chui L.A., Nenadic Z., Do A.H. BCI controlled walking simulator for a BCI driven FES device. RESNA Annual Conference. Las Vegas. Nevada. 2010. June 26–30.
WHO. World health statistics. WHO Press. Geneva, Switzerland. 2008.
Xu R., Jiang N., Mrachacz-Kersting N., Lin C., As G., Moreno J.C., Pons J.L., Member S., Dremstrup K., Farina D. A closed-loop brain–computer interface triggering an active ankle–foot orthosis for inducing cortical neural plasticity. IEEE transactions on biomedical engineering. 2014. 61 (7): 2092–2101.
Дополнительные материалы отсутствуют.
Инструменты
Журнал высшей нервной деятельности им. И.П. Павлова


