Журнал высшей нервной деятельности им. И.П. Павлова, 2019, T. 69, № 4, стр. 465-478
ВЛИЯНИЕ СЕЛЕКТИВНОЙ ДЕПРИВАЦИИ ТРЕТЬЕЙ СТАДИИ НОЧНОГО СНА НА ТОЛЕРАНТНОСТЬ К ГЛЮКОЗЕ. СВЯЗЬ С ИЗМЕНЕНИЯМИ АКТИВНОСТИ АВТОНОМНОЙ НЕРВНОЙ СИСТЕМЫ И СЕКРЕЦИИ КОРТИЗОЛА
Ю. В. Украинцева 1, *, А. А. Полищук 1, К. М. Левкович 1, К. А. Салтыков 1, M. Meira e Cruz 2, Д. А. Белов 3, А. Н. Нижник 3
1 Институт высшей нервной деятельности и нейрофизиологии РАН
Москва, Россия
2 Sleep Unit, Cardiovascular Center of University of Lisbon, School of Medicine
Lisbon, Portugal
3 Клиника новых медицинских технологий АрхиМед
Москва, Россия
* E-mail: ukraintseva@yandex.ru
Поступила в редакцию 24.07.2018
После доработки 31.07.2018
Принята к публикации 24.09.2018
Аннотация
В ряде работ было показано, что чувствительность тканей к инсулину регулируется во время глубокого сна и его недостаток приводит к расстройству углеводного обмена. Однако конкретные механизмы нарушения метаболизма глюкозы вследствие недостаточного или некачественного сна остаются малоизученными. Цель исследования: изучение влияния селективной депривации третьей стадии ночного сна на толерантность к глюкозе у здоровых молодых людей; оценка изменений активности автономной нервной системы (АНС) и секреции кортизола и их роли в нарушениях метаболизма глюкозы в условиях дефицита глубокого сна. Каждый из 14 добровольцев участвовал в двух экспериментах: в основном, с селективной депривацией третьей стадии сна; и в контрольном, в котором сон не нарушался. Испытуемые сдавали 5 проб слюны: в 20.00, в 01.30, в 04.00, в 07.00 и в 07.40. В пробах определялось содержание кортизола. Утром каждый испытуемый проходил пероральный глюкозотолерантный тест. Активность АНС оценивалась по показателям вариабельности RR-интервалов. Селективная депривация третьей стадии сна привела к снижению ее длительности на 54%. При этом она вызвала снижение толерантности к глюкозе: на следующее утро через 1 ч после углеводной нагрузки уровень глюкозы в крови был выше аналогичных значений в контрольных экспериментах. Ночью подавление третьей стадии сна сопровождалась увеличением соотношения спектральной мощности низкочастотного и высокочастотного компонентов вариабельности RR-интервалов, что свидетельствует об усилении симпатических влияний на сердечный ритм. Значимого влияния депривации третьей стадии на концентрацию кортизола в слюне выявлено не было. Можно заключить, что селективная депривация третьей стадии сна препятствует физиологическому ночному снижению симпатической активности. Повышенная симпатическая активация, сохраняющаяся на протяжении ночи, может являться одним из механизмов снижения толерантности к глюкозе в условиях дефицита третьей стадии сна.
Сон – это сложно организованный процесс, имеющий множество жизненно важных функций [Jessen et al., 2015]. Однако последствия плохого качества сна, например, его недостаточной глубины, фрагментации либо нарушенной архитектуры, несмотря на то, что они весьма распространены в современном обществе, остаются малоизучены.
Неоднократно было показано, что недостаточный либо фрагментированный сон негативно влияет на толерантность к глюкозе [Spiegel et al., 1999; Stamatakis, Punjabi, 2010], приводя к риску диабета второго типа [Benedict et al., 2011, 2012; Nedeltcheva, Scheer, 2014]. Также и синдром обструктивного апноэ, который, как известно, нарушает архитектуру сна, негативно влияет на обмен глюкозы и ассоциирован с риском развития диабета второго типа [Pamidi, Tasali, 2012]. Следовательно, сон играет важную роль в регуляции метаболизма углеводов.
В последние годы было показано, что к нарушению обмена глюкозы может приводить уже одно лишь подавление третьей стадии сна, без сокращения общей длительности ночного сна [Tasali et al., 2008; Herzog et al., 2013]. Наиболее глубокая третья стадия ортодоксального сна, или дельта-сон, считается самой важной для восстановления функций организма. Она сопряжена с гормональными и нейрофизиологическими процессами, которые участвуют в регуляции гомеостаза глюкозы [Nedeltcheva, Scheer, 2014]. Во время дельта-сна происходит снижение потребления мозгом глюкозы [Spiegel et al., 2004], стимуляция секреции гормона роста [Steiger et al., 1992], ингибирование кортикотропной деятельности [Born, Fehm, 1998], снижение симпатической активности и увеличение влияний блуждающего нерва [Burgess et al., 1999; Brandenberger et al., 2001; Shinar et al., 2006].
Однако конкретные механизмы, лежащие в основе нарушения глюкозотолерантности вследствие дефицита дельта-сна, остаются неясными. В качестве одного из возможных механизмов можно указать усиление активации гипоталамо-гипофизарно-адреналовой системы (ГГАС) и секреции кортизола, для которых была выявлена обратная зависимость с длительностью третьей стадии сна [Born, Fehm, 1998; Otte et al., 2005; Van Liempt et al., 2013]. Основная функция кортизола заключается в мобилизации энергетических ресурсов в условиях их нехватки, например, при стрессе или при гипогликемии [Benedict et al., 2009]. Известно, что кортизол индуцирует глюконеогенез, снижает утилизацию глюкозы в периферических тканях, тем самым способствуя развитию инсулинорезистентности и повышению глюкозы в крови [Khani, Tayek, 2001]. Поэтому учитывая роль кортизола в регуляции углеводного обмена, можно предположить, что активация ГГАС может являться одним из гормональных механизмов, с помощью которого дефицит глубокого сна приводит к изменениям в метаболизме глюкозы. Можно ожидать, что нарушение сна, действуя на организм как стрессогенный фактор, будет усиливать активацию ГГАС и повышать секрецию кортизола. Так, в одном из исследований было показано, что даже короткие эпизоды лишения сна могут привести к симпатической гиперактивности с повышением артериального давления, частоты сердечных сокращений и повышенной секрецией кортизола и норадреналина [Kuetting et al., 2018].
Помимо активации ГГАС, в качестве возможного механизма можно указать изменение баланса автономной нервной системы (АНС). В течение цикла сон-бодрствование автономная регуляция сердечного ритма закономерно меняется, в том числе она изменяется и на протяжении ночного сна и тесно связана с его глубиной [Burgess et al., 1999; Shinar et al., 2006]. Во время третьей стадии сна наблюдается выраженное преобладание парасимпатических влияний, что проявляется в виде снижения частоты сердечных сокращений (ЧСС) и артериального давления, а также увеличения вариабельности сердечного ритма [Burgess et al., 1999; Loredo et al., 2004]. Но при недостаточном либо нарушенном сне взаимосвязи между циклом сон-бодрствование и динамикой баланса АНС нарушаются [Tochikubo et al., 1996; Shinar et al. 2006], и во время сна не происходит выраженного снижения симпатической активности [Tochikubo et al., 1996]. Соответственно, можно ожидать, что подавление глубокого сна должно приводить к сдвигу автономного баланса в сторону симпатической модуляции. Поскольку чрезмерная симпатоадреналовая активация способствует развитию метаболической дисрегуляции – гипергликемии и инсулинорезистентности [Mancia et al., 2007; Grassi et al., 2009], можно предположить, что повышение симпатической активации вследствие нарушенного ночного сна может вносить свой вклад в снижение глюкозотолерантности.
Поэтому целью настоящей работы является изучение сдвигов симпатико-парасимпатического баланса и изменений секреции кортизола как возможных механизмов нарушения толерантности к глюкозе при селективной депривации третьей стадии ночного сна.
МЕТОДИКА
В исследовании приняли участие 17 мужчин в возрасте от 19 до 25 лет. При наборе участников проводили устное анкетирование с целью оценки соматического и психического здоровья, отсутствия черепно-мозговых травм, режима сна и бодрствования, продолжительности ночного сна. Критерии исключения из эксперимента были следующими: острые или хронические заболевания, прием любых медикаментов, алкогольная или наркотическая зависимость, работа со сменным графиком, отсутствие регулярного режима сна и бодрствования, расстройства сна, перелеты со сменой часовых поясов в течение последнего месяца, кровоточивость десен и заболевания полости рта.
Все участники исследования имели регулярный цикл сна-бодрствования с длительностью ночного сна около 8 ч со временем отхода ко сну 23.00–00.00 и временем подъема 07.00–08.00 соответственно в течение последних четырех недель перед экспериментом. В целях объективного контроля индивидуальных суточных ритмов активности и режима сна в течение недели до начала эксперимента испытуемые носили актиграф (фитнесс-трекер Xiaomi Mi Band 2) и вели дневник сна (необходимо было отмечать время отхода ко сну, время подъема, общую длительность сна и количество пробуждений за ночь). За сутки перед участием в эксперименте им рекомендовали воздержаться от употребления алкоголя, кофе, чая, шоколада. Перед началом опыта испытуемые были осведомлены о предмете и процедуре исследования и подтверждали свое добровольное участие подписанием Информированного согласия. По завершении каждого эксперимента они получали денежное вознаграждение (1000 руб).
Трое испытуемых были исключены из анализа по следующим причинам: у испытуемого А.Т. было выявлено расстройство сна; у испытуемого И.С. была обнаружена примесь крови в образцах слюны; испытуемый М.Н. был исключен, так как анализ данных актиграфа показал, что он не придерживался требуемого режима сна и бодрствования в течение недели перед экспериментом.
Процедура
Исследование имело ортогональный дизайн: каждый доброволец участвовал в двух экспериментах: в основном, с депривацией третьей стадии сна, и в контрольном, в котором сон не нарушался, при этом для половины испытуемых первым был основной эксперимент, для другой половины – контрольный; порядок процедур в экспериментах был идентичным и одинаковым для всех участников. О предстоящем подавлении глубокого сна испытуемые не знали, но перед каждым экспериментом они были предупреждены о том, что в течение ночи могут предъявляться звуки, на которые не нужно реагировать. Таким образом, процедура обоих экспериментов, и основного и контрольного, различалась только наличием либо отсутствием депривации третьей стадии сна и соответствовала следующей схеме (рис. 1):
Рис. 1.
Схема эксперимента.  – проба слюны, ↑ – измерение уровня глюкозы в крови. Остальные объяснения в тексте.
– проба слюны, ↑ – измерение уровня глюкозы в крови. Остальные объяснения в тексте.
Fig. 1. Study Design.  – saliva collection, ↑ – blood glucose measurement. Other explanations are in the
text.
– saliva collection, ↑ – blood glucose measurement. Other explanations are in the
text.
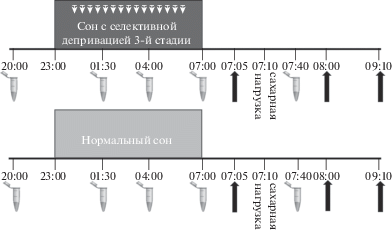
19.30 – прибытие в лабораторию, анализ данных актиграфа и дневника сна, подписание информированного согласия;
20.00 – проба слюны;
20.05 – стандартизированный ужин (мясо/рыба, гарнир, салат, компот/вода);
20.40 – тесты на функциональное состояние, сонливость и уровень бодрствования: Стэнфордская шкала сонливости (Stanford Sleepiness Scale/SSS), Визуальная шкала сонливости (Visual Sleepiness Scale/VAS), Психомоторный тест на уровень бдительности (Psychomotor vigilance test/PVT), тест на самочувствие, активность и настроение (САН);
22.30 – наложение датчиков для регистрации полисомнограммы ночного сна;
23.00 – выключение света и начало ночного сна с регистрацией полисомнограммы и ЭКГ;
01.30 – проба слюны;
04.00 – проба слюны;
07.00 – пробуждение;
07.00 – проба слюны;
07.05 – измерение уровня глюкозы в крови натощак;
07.10 – сахарная нагрузка (75 г глюкозы, растворенные в 250 мл воды);
07.15 – опросник на субъективную оценку качества сна;
07.40 – проба слюны;
08.10 – измерение уровня глюкозы в крови (через 1 ч после нагрузки);
08.30 – тесты на функциональное состояние, сонливость и уровень бодрствования: SSS, VAS, PVT, САН;
09.10 – измерение уровня глюкозы в крови (через 2 ч после нагрузки);
09.20 – завтрак.
Тесты на функциональное состояние
Вечером и утром испытуемые проходили следующие тесты на определение функционального состояния:
1) SSS [Maclean et al., 1992]. Нужно было выбрать из 7 уровней сонливости 1, который лучше всего соответствует состоянию в данный момент.
2) VAS. Содержит 2 утверждения – сонный и бодрствующий, расположенные на концах линии 100 мм. Нужно было поставить вертикальную отметку на линии между этими утверждениями в соответствии с состоянием в данный момент.
3) PVT [Dinges, Powell, 1985]. Для определения простой сенсомоторной реакции в программе PEBL Version 2.0 испытуемому на черном экране предъявляли центральный фиксационный стимул – белый крест (длительность предъявления – 400 мс), нужно было нажимать на клавишу “пробел”клавиатуры при появлении в центре экрана красного круга (длительность предъявления – 300 мс) в одном и том же месте через нефиксированные промежутки времени (от 2 до 9 сек). Стимул горел на экране до момента нажатия испытуемым на клавишу. Тест длился примерно 10 мин и состоял из 85 презентаций целевого стимула. Оценивали ложные тревоги – нажатие на клавишу быстрее 150 мс, пропуски – нажатие с задержкой, превышающей 500 мс, и время реакции.
4) Опросник САН состоит из 14 шкал, описывающих субъективные оценки уровней самочувствия, активности и настроения.
Утром просили заполнить опросник на субъективную оценку качества сна. Нужно было оценить в баллах от 0 до 10 глубину и качество сна, а также указать количество пробуждений прошедшей ночью.
Регистрация полисомнограммы и ЭКГ
Испытуемые спали в специально оборудованной для сна комнате. Для записи 19 каналов электроэнцефалограммы (по международной системе 10-20), электрокардиограммы (ЭКГ), электромиограммы и двух каналов окулограммы использовали энцефалограф Энцефалан-EEGR-19/26 (фирма “Медиком”, Таганрог, Россия) с частотой дискретизации 250 Гц. ЭКГ регистрировали во втором отведении. Регистрирующие электроды устанавливались с помощью электродного геля “Униагель”фирмы “Гельтек”(Россия).
Депривация третьей стадии сна
Во время сессии с селективной депривацией полисомнограмму анализировали в режиме “онлайн”и подавляли третью стадию по методике, описанной Герцог и соавт. [Herzog et al., 2013] с некоторыми модификациями. Когда испытуемые достигали третьей стадии сна, то есть, в соответствии со стандартными критериями [Rechtschaffen, Kales, 1968], когда в записи регистрировались 6 или более дельта-волн с амплитудой около 75 мВ и частотой, меньшей 2 Гц, в течение 30-секундной эпохи анализа, предъявляли стандартизованный акустический тон с частотой 532 Гц, с громкостью 35 дБ. При необходимости интенсивность звука увеличивали до 90 дБ. Для предъявления звуков использовали сценарий, написанный в программе E-Prime (E_Prime 1.2, Psychology Software Tools, Pittsburgh, PA, USA). Звуки подавали через 2 колонки, расположенные на расстоянии около 50 см от головы участника. Для акустической стимуляции были выбраны следующие критерии: подачу звуков прекращали при появлении признаков уменьшения глубины сна, таких как К-комплексы, альфа-волны или уменьшение дельта-индекса. При депривации старались избежать полного пробуждения испытуемого.
Экспресс-анализ крови на содержание глюкозы и проведение теста на толерантность к глюкозе
В каждом эксперименте утром проводили пероральный глюкозотолерантный тест (ГТТ). После измерения у испытуемого уровня глюкозы в крови натощак в течение 5 мин предлагали выпить стакан теплой воды, в котором растворена глюкоза (75 г на 250 мл воды). Далее через 1 ч и через 2 ч проводили измерения уровня глюкозы. Уровень глюкозы в крови оценивали с помощью глюкометра Free Style Precision Neo (Abbott Diabetes Care, Испания), который позволяет проводить измерения в капиллярной крови и таким образом является малоинвазивным. Для повышения точности каждое измерение проводили дважды, после чего данные усредняли. Глюкометр Free Style Precision Neo был выбран как один из наиболее точных систем для оценки уровня глюкозы в капиллярной крови [Baumstark et al., 2018].
Использование глюкометров имеет некоторые ограничения, связанные с тем, что чувствительность этого метода не позволяет детектировать незначительные колебания сахара, вследствие чего могут возникать ошибки. Но данные литературы свидетельствуют о том, что в целом значения глюкометра вполне сопоставимы с результатами анализа венозной крови и их использование допустимо при проведении глюкозотолерантного теста [Boyd et al., 2005; Yang et al., 2012].
Пробы слюны и анализ кортизола
В каждом эксперименте проводили взятие проб слюны, поскольку анализ содержания кортизола в слюне позволяет отслеживать колебания его секреции [Ghiciuc et al., 2011]. Слюну собирали в пробирки SaliCaps, взятие одной пробы занимало в среднем 2 мин. Для сбора ночных проб испытуемых осторожно будили, слюна собиралась при выключенном свете. Длительность пробуждения для взятия ночной пробы составляла в среднем 5 мин. Пробы замораживали и хранили при –60°С.
Далее пробы анализировали методом тандемной хромато-масс-спектрометрии (LC-MS/MS). Обнаружение и количественное определение кортизола проводили на тандемном масс-спектрометре AB SCIEX QTRAP 6500 (AB SCIEX, Concord, Canada) с использованием системы Waters® ACQUITY UPLC® H-Class для хроматографического разделения. Анализ уровня гормонов проводили в лаборатории “Клиники новых медицинских технологий АрхиМед”.
Обработка результатов
Полисомнограммы независимо друг от друга анализировали два эксперта (П.А.А., У.Ю.В.) в программе LEONARDO. Запись разбивали на 30-секундные эпохи. Каждую эпоху относили либо к бодрствованию, либо к одной из стадий ортодоксального сна (стадия 1, стадия 2, стадия 3), либо к парадоксальному сну в соответствии со стандартными критериями [Rechtschaffen, Kales, 1968] и с учетом поправок Американской академии медицины сна [Iber et al., 2007]. При анализе полисомнограммы вычисляли латентный период засыпания, общую длительность сна, длительность пробуждений, длительность периода сна, эффективность сна. Длительность периода сна измеряли от момента засыпания до последнего пробуждения, включая длительность ночных пробуждений, если они были. Эффективность сна рассчитывали как отношение общей длительности сна к длительности периода сна, выраженное в процентах.
По ЭКГ анализировали показатели вариабельности сердечного ритма вечером перед отходом ко сну, во время третьей стадии сна в первых двух циклах сна и утром после пробуждения. Первые два цикла сна были выбраны, поскольку в них у всех испытуемых регистрировалась третья стадия сна. C помощью программы HRVanalysis [Pichot et al., 2016] вычисляли следующие показатели: ЧСС, среднее значение RR-интервалов и их стандартное отклонение, спектральная мощность модуляции сердечного ритма в высоком – ВЧ (0.15–0.40 Гц) и низком – НЧ (0.04–0.15 Гц) частотных диапазонах, а также их соотношение НЧ/ВЧ.
Статистический анализ результатов выполняли с использованием программного обеспечения Statistica 10 (Stat Soft. Inc., Tulsa, USA). Соответствие полученных данных нормальному распределению проверяли по критерию Шапиро-Уилка. Для приведения к нормальному распределению использовали логарифмирование. Для сравнения показателей архитектуры и субъективных оценок сна в экспериментах с селективной депривацией и в контрольных экспериментах проводили парные t-тесты. Для анализа динамики уровней глюкозы и кортизола, а также вариативности сердечного ритма использовали дисперсионный анализ ANOVA для повторных измерений с апостериорным тестом Ньюмана-Койлса.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
Анализ архитектуры сна
Анализ архитектуры ночного сна показал, что существует статистически значимая разница в длительности первой, второй и третьей стадий сна между экспериментами с селективной депривацией третьей стадии и контрольными экспериментами, где сон не нарушался (табл. 1). Как и ожидалось в соответствии с экспериментальным протоколом, подавление третьей стадии сна привело к ее фрагментации и значимо (p < 0.001) сократило время, проведенное в ней. Общая длительность этой стадии уменьшилась на 56.53 мин, что составляло 54% от ее длительности в контрольном эксперименте (рис. 2). Помимо этого, подавление дельта-сна привело к увеличению продолжительности первой стадии на 14.18 мин (p = 0.002) и второй стадии на 25.46 мин (p = 0.036). Примечательно, что селективная депривация дельта-сна не оказала статистически значимого влияния на общее время сна и длительность пробуждений во сне, однако она на уровне тенденции (p = = 0.062) снизила эффективность сна. При анализе субъективных оценок глубины сна, количества пробуждений и качества сна значимые различия были выявлены только для субъективных оценок качества сна (р = 0.011): в соответствии с самоотчетом испытуемых оно было ниже в экспериментах с селективной депривацией третьей стадии сна (табл. 1).
Таблица 1.
Показатели архитектуры и субъективных оценок сна в контрольных экспериментах и в экспериментах с селективной депривацией 3 стадии сна Table 1. Mean values of polysomnographic data and self-reported scores of sleep quality in control sessions and in sessions with SWS suppressio
| Нормальный сон | Сон с депривацией 3 стадии | Р | |
|---|---|---|---|
| Архитектура сна | |||
| Общая длительность сна | 424.14 (10.00) | 404.79 (12.63) | 0.100 |
| Длительность периода сна | 463.86 (5.53) | 454.54 (6.66) | 0.298 |
| Длительность пробуждений | 39.39 (7.26) | 48.79 (7.46) | 0.101 |
| Эффективность сна, % | 91.38 (1.58) | 88.86 (1.86) | 0.062 |
| Латентность засыпания | 16.75 (2.67) | 22.46 (6.16) | 0.359 |
| Латентность третьей стадии | 10.75 (0.93) | 11.46 (2.12) | 0.767 |
| Латентность БДГ-сна | 87.64 (9.36) | 107.11 (14.38) | 0.240 |
| Длительность первой стадии | 15.39 (1.92) | 29.57 (4.09) | 0.002 |
| Длительность второй стадии | 205.86 (8.82) | 231.32 (9.10) | 0.036 |
| Длительность третьей стадии | 104.71 (6.62) | 48.18 (5.16) | <0.001 |
| Длительность БДГ-сна | 92.29 (6.59) | 87.00 (9.03) | 0.393 |
| Субъективные оценки сна | |||
| Глубина сна | 7.54 (0.48) | 6.57 (0.52) | 0.287 |
| Количество пробуждений | 2.35 (0.38) | 3.50 (0.68) | 0.362 |
| Качество сна | 8.00 (0.30) | 6.00 (0.53) | 0.003 |
Примечание: В таблице представлены средние значения показателей и стандартная ошибка среднего (в скобках). Все показатели архитектуры сна, кроме эффективности, представлены в мин, субъективные оценки сна – в баллах. Статистическая оценка значимости различий между контрольными экспериментами и экспериментами с селективной депривацией 3 стадии получена с помощью парного t-теста. Значимые различия выделены жирным шрифтом. Note: Data are mean values and standard error of mean (in brackets). All polysomnographic indices, except efficiency, are shown in minutes, self-reported scores of sleep quality – in marks. P-values are derived from a paired Student’s t-test. Significant differences are highlighted in bold.
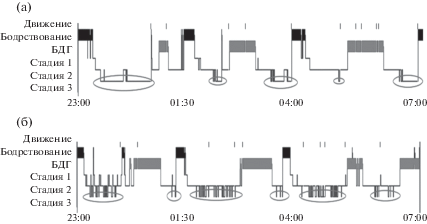
Рис. 2.
Гипнограммы ночного сна испытуемого Е.Г.: (a) – в контрольном эксперименте; (б) – в эксперименте с депривацией 3 стадии сна (обведены участки гипнограмм, содержащие 3 стадию сна). БДГ – сон с быстрыми движениями глаз.
Fig. 2. Hypnograms of night sleep of participant E.G.: (a) – in control session; (б) – in session with SWS suppression (the areas of hypnograms, which contain SWS, are outlined). БДГ – rapid-eye movement sleep.
Результаты анализа уровня глюкозы в крови после углеводной нагрузки
Анализ индивидуальной динамики уровня глюкозы в крови показал у большинства испытуемых (у 12 человек) повышенную концентрацию глюкозы после углеводной нагрузки в эксперименте с депривацией третьей стадии сна (рис. 3 (а)). Однако у двух испытуемых (А.Я. и М.Ш.) были выявлены парадоксальные реакции на ГТТ в эксперименте с депривацией: и через 1, и через 2 ч после сахарной нагрузки их уровень глюкозы оставался таким же низким, как при пробуждении. При этом в контрольном эксперименте в ответ на углеводную нагрузку он повышался, как и у других испытуемых. Мы предположили, что такая реакция на ГТТ в экспериментах с депривацией может свидетельствовать о том, что подавление глубокого сна вызывает у них противоположные сдвиги углеводного обмена, приводящие не к снижению, а к повышению глюкозотолерантности. Поэтому данные этих двух испытуемых анализировались отдельно. Анализ данных остальных 12 человек показал, что уровень глюкозы в крови, измеренный натощак сразу после пробуждения, не различался значимо в контрольном эксперименте и в эксперименте с депривацией третьей стадии сна. Но концентрация глюкозы, измеренная через 1 ч после углеводной нагрузки, была достоверно повышена в эксперименте с депривацией (p = 0.001). Через 2 ч после нагрузки уровень глюкозы не отличался значимо от контрольного (рис. 3 (б)).
Рис. 3.
Уровень глюкозы в крови утром после пробуждения натощак, через 1 ч и через 2 ч после сахарной нагрузки: (a) – индивидуальные значения в эксперименте с селективной депривацией 3 стадии, черные сплошные линии – кривые испытуемых М.Ш. и А.Я.; (б) – усредненные значения в эксперименте с депривацией 3 стадии сна (сплошная линия) и в контрольном эксперименте (прерывистая линия). На графике указан 95% доверительный интервал.
Fig. 3. Blood glucose level: in fasting state, in 1 hour and 2 hours after glucose intake: (a) – individual levels in session with SWS suppression, black firm lines – curves of participants M.Sh. and A.Ya.; (б) – mean in the session with SWS suppression (full line) and in the control session (broken line). 95% confidence interval is shown on the graph.
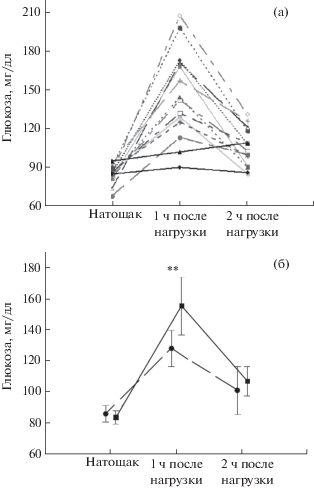
Показатели вариативности сердечного ритма, тестов на функциональное состояние и концентрация кортизола в пробах слюны у А.Я. и М.Ш. не выделялись на фоне обще- групповых, и поэтому они анализировались вместе с данными других испытуемых.
Результаты анализа тестов на функциональное состояние
Селективная депривация третьей стадии сна не оказала значимого влияния на бдительность и сонливость по данным тестов SSS, VAS и PVT. Она также не повлияла на субъективные оценки самочувствия, активности и настроения испытуемых.
Результаты анализа сердечного ритма
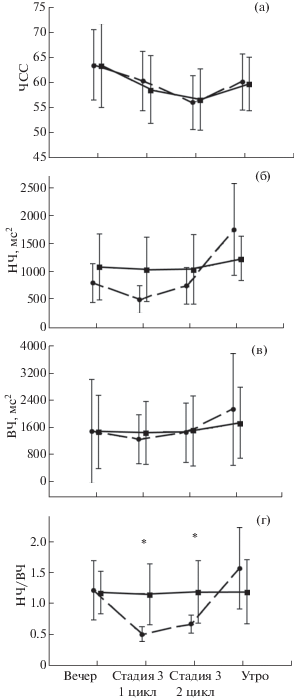
Анализ ЧСС и стандартного отклонения RR-интервалов в вечерних, ночных и утренних записях не выявил значимых различий между контрольным экспериментом и экспериментом с депривацией третьей стадии сна (рис. 4 (а)). Но анализ спектров кардиоинтервалограмм выявил в экспериментах с депривацией достоверно повышенное относительно контроля соотношение НЧ/ВЧ в первом (р = 0.016) и втором (р = 0.049) циклах сна (рис. 4 (г)). Динамика значений НЧ (рис. 4 (б)) и ВЧ (рис. 4 (в)) свидетельствует о том, что высокие значения показателя НЧ/ВЧ на фоне депривации третьей стадии обусловлены прежде всего вкладом низкочастотной составляющей вариабельности сердечного ритма. Ни в вечерних, ни в утренних записях соотношение НЧ/ВЧ не различалось значимо в двух типах экспериментов.
Рис. 4.
Показатели вариабельности RR-интервалов в эксперименте с депривацией 3 стадии сна (сплошная линия) и в контрольном эксперименте (прерывистая линия): вечером перед засыпанием, в течение 3 стадии 1 цикла сна, в течение 3 стадии 2 цикла сна и утром сразу после пробуждения. (a) – частота сердечных сокращений (ЧСС); (б) – спектральная мощность низких частот кардиоинтервалограммы (НЧ); (в) – спектральная мощность высоких частот кардиоинтервалограммы (ВЧ); (г) – соотношение спектральной мощности низких частот и высоких частот кардиоинтервалограммы (НЧ/ВЧ). На графике указан 95% доверительный интервал.
Fig. 4. The levels of variability of RR-intervals in the session with SWS suppression (full line) and in control one (broken line): in the evening before falling asleep, during SWS in the first sleep cycle, during SWS in the second sleep cycle, and in the morning immediately after awaking. (a) – heart rate (ЧСС); (б) – spectral power of low frequencies of RR-variability (НЧ); (в) – spectral power of high frequencies (ВЧ); (г) – ratio of spectral power of low frequencies and high frequencies (НЧ/ВЧ). 95% confidence interval is shown on the graph.
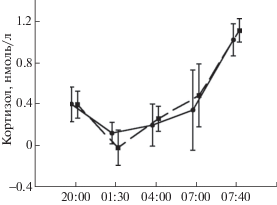
Данные анализа концентрации кортизола
Анализ содержания кортизола в вечерней, в ночных и в утренних пробах слюны не выявил значимых различий между двумя типами экспериментов (рис. 5).
Рис. 5.
Log-трансформированные значения концентрации кортизола в пробах слюны в эксперименте с депривацией 3 стадии сна (сплошная линия) и в контрольном эксперименте (прерывистая линия). На оси абсцисс – время сбора слюны. На графике указан 95% доверительный интервал.
Pic. 5. Log-transformed data of concentration of cortisol in saliva tests in the session with SWS suppression (full line) and in control one (broken line). The x-axis indicates time of saliva collection. 95% confidence interval is shown on the graph.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Анализ архитектуры ночного сна показал, что селективная депривация третьей стадии привела к уменьшению ее длительности на 56.53 мин, что составило 54% от длительности дельта-сна в контрольном эксперименте. При этом подавление глубокого сна не повлияло значимо на общее время сна и длительность ночных пробуждений, однако у большинства испытуемых оно привело к снижению глюкозотолерантности на следующее утро: после ночи с селективной депривацией дельта-сна через 1 ч после сахарной нагрузки наблюдалось значимое повышение уровня глюкозы в крови. Наши данные согласуются с результатами более ранних работ, в которых было обнаружено, что у здоровых людей к нарушению обмена глюкозы может приводить уже одно лишь подавление дельта-сна, без сокращения общей длительности ночного сна [Tasali et al., 2008; Stamatakis, Punjabi, 2010; Herzog et al., 2013].
В работе Herzog и соавт. [Herzog et al., 2013] было показано, что снижение глюкозотолерантности после подавления глубокого сна происходит на фоне повышенной секреции инсулина и вызвано инсулинорезистентностью. Однако до сих пор неясно, какие именно процессы обусловливают снижение чувствительности тканей к инсулину в условиях недостатка глубокого сна. Наши результаты позволяют уточнить некоторые из них. В частности, анализ сердечного ритма показал, что селективная депривация третьей стадии сна сопровождалась увеличением соотношения спектральной мощности низкочастотного и высокочастотного компонентов кардиоинтервалограммы НЧ/ВЧ. Вариативность сердечного ритма отражает активность АНС, высокочастотный компонент (от 0.15 до 0.04 Гц) представляет собой частоту дыхания и подчиняется влияниям парасимпатического отдела АНС. Низкочастотный отражает входы от обоих отделов АНС. Поэтому соотношение НЧ/ВЧ является часто используемым показателем симпатической модуляции [Pichot et al., 2016]. Таким образом, хотя ЧСС на анализировавшихся эпохах анализа не изменилась значимо, и в первом и во втором циклах сна на фоне подавления третьей стадии происходило увеличение показателя НЧ/ВЧ, что свидетельствовало об усилении активации симпатоадреналовой системы в ответ на нарушение сна. Наши результаты аналогичны данным работ, в которых было показано, что как недостаточный [Tochikubo et al., 1996; Lusardi et al., 1999], так и нарушенный [Carlson et al., 1993; Shinar et al. 2006] сон сопровождается увеличением активности симпатической нервной системы. В частности, сокращение ночного сна до 4 ч приводило к увеличению симпатической и снижению парасимпатической автономной регуляции, что проявлялось в повышении низкочастотных компонентов вариабельности сердечного ритма, росте артериального давления и увеличении концентрации норадреналина в моче [Tochikubo et al., 1996; Lusardi et al., 1999]. Аналогичные сдвиги автономного баланса наблюдаются и при синдроме обструктивного апноэ сна (СОАС) [Carlson et al., 1993; Shinar et al. 2006]. СОАС – это расстройство сна, характеризующееся многократными остановками дыхания во сне вследствие повторяющейся обструкции верхних дыхательных путей. За каждой остановкой дыхания следуют кратковременные пробуждения или переход в поверхностную стадию сна с повышением тонуса мышц и восстановлением проходимости глотки. Такая фрагментация сна приводит к нарушению его архитектуры, прежде всего к значительному снижению длительности третьей стадии сна [Redline et al., 2004; Yee et al., 2007]. Таким образом, уменьшение продолжительности глубокого сна препятствует физиологическому ночному снижению симпатической активности. Причем повышенная симпатическая активация может сохраняться и после пробуждения, приводя к устойчивому повышению артериального давления и ЧСС в дневное время [Tochikubo et al., 1996; Lusardi et al., 1999; Van Leeuwen et al., 2017].
С другой стороны, хорошо известно, что симпатоадреналовая система регулирует чувствительность скелетных мышц к инсулину. Это достигается путем изменения регионального кровотока [Egan, 1991], а также с помощью усиления липолиза, повышая циркуляцию в крови свободных жирных кислот, которые ингибируют транспорт глюкозы внутрь клетки [Kahn, Flier, 2000; Esler et al., 2006]. Поэтому различные компоненты метаболического синдрома ассоциированы с прямыми и непрямыми маркерами симпатической гиперактивности [Mancia et al., 2007]. Показано также, что при симпатической денервации инсулин-чувствительных тканей наблюдаются нормализация метаболизма глюкозы и повышение чувствительности к инсулину [Mahfoud et al., 2011]. В нашем исследовании анализ утренних значений вариативности сердечного ритма не выявил различий между двумя типами экспериментов. Но мы полагаем, что повышенная симпатическая активация в течение как минимум двух циклов ночного сна, во время подавления третьей стадии, способна влиять на процессы углеводного обмена и вносить свой вклад в снижение глюкозотолерантности.
Данные анализа ночных и утренних проб слюны свидетельствуют о том, что селективная депривация дельта-сна в течение одной ночи не приводит к повышению концентрации кортизола. Кортизол, гормон ГГАС, часто используется как маркер стресса, поэтому можно заключить, что подавление дельта-сна не являлось стрессором для участников исследования. Можно также сделать вывод, что снижение толерантности к глюкозе в экспериментах с депривацией не было связано с инсулинорезистентностью, вызываемой увеличенной секрецией кортизола.
Следует отметить, что, несмотря на значительное снижение длительности третьей стадии, селективная депривация не привела к существенным нарушениям архитектуры сна. Общая продолжительность сна и длительность ночных пробуждений на групповом уровне остались неизменными, и была найдена лишь тенденция к снижению эффективности сна. Также и значимых различий в уровне сонливости и бдительности между двумя типами экспериментов выявлено не было. Это говорит о том, что по сравнению с частичным или полным лишением ночного сна, селективное подавление третьей стадии не оказывает выраженного негативного влияния на функциональное состояние. Кроме того, несмотря на более низкую субъективную оценку качества сна в экспериментах с депривацией, субъективные оценки его глубины и количества пробуждений остались сопоставимыми с контрольными значениями. То есть в экспериментах с депривацией испытуемые в целом были удовлетворены своим сном, несмотря на то, что продолжительность третьей стадии уменьшилась более чем наполовину. Следовательно, депривация не сопровождалась выраженным физическим либо психологическим дискомфортом, который мог бы повлиять на результаты исследования.
Интересно, что у двух испытуемых были выявлены парадоксальные реакции на ГТТ в эксперименте с депривацией: и через 1 и через 2 ч после сахарной нагрузки их уровень глюкозы оставался таким же низким, как и измеренный натощак. Такая реакция на ГТТ свидетельствует о том, что подавление третьей стадии сна вызывает у них иные сдвиги углеводного обмена, приводящие не к снижению, а к повышению глюкозотолерантности. Нам не удалось найти в литературе описания подобного эффекта нарушений сна на глюкозотолерантность. Возможно, сочетание индивидуальных особенностей углеводного обмена и дефицита глубокого сна могли спровоцировать возникновение реактивной гиперчувствительности к инсулину [Guiducci, et al., 2014].
Существуют ограничения в интерпретации результатов нашего исследования. А именно, следует учитывать тот факт, что подавление третьей стадии, помимо влияния на общее время глубокой и поверхностных стадий, оказывает также более тонкое воздействие на архитектуру сна, изменяя длительности его отдельных циклов. В некоторых случаях можно наблюдать укорочение циклов (как в случае Е.Г., чья гипнограмма приведена на рис. 2), в других – их удлинение. Эти сдвиги могли в некоторой степени влиять на значения индексов автономной активности, поскольку анализ кардиоинтервалограмм, который проводился во время третьей стадии, приходился на разное астрономическое время, что означало различное действие циркадианного фактора. С другой стороны, пробуждение испытуемых для измерения кортизола в слюне, проводившееся в одно и то же астрономическое время, приходилось в разных экспериментах на разные стадии сна, что в свою очередь могло оказывать влияние на уровень этого гормона.
ЗАКЛЮЧЕНИЕ
Наши результаты позволяют заключить, что сокращение третьей стадии сна на 54% оказывает выраженный эффект на углеводный обмен. У 12 участников эксперимента она привела к снижению глюкозотолерантности, у двух человек наблюдалось ее повышение, что обусловлено, по-видимому, индивидуальными особенностями углеводного обмена испытуемых. Помимо этого, ночью на фоне подавления третьей стадии были выявлены повышенные симпатические влияния на сердечный ритм. Можно заключить, что нарушение глубокого сна препятствует физиологическому ночному снижению симпатической активности. Учитывая роль симпатоадреналовой системы в регуляции углеводного обмена, можно предположить, что устойчивое повышение симпатической активации, сохраняющееся на протяжении ночи, может являться одним из механизмов снижения толерантности к глюкозе в условиях дефицита третьей стадии сна.
Исследование проводилось при поддержке фонда РФФИ, проект № 18-013-01187 А, и при поддержке Российской Академии Наук.
Список литературы
Baumstark A., Jendrike N., Pleus S., Liebing C., Beer A., Flacke F., Haug C., Freckmann G. Evaluation of Four Blood Glucose Monitoring Systems for Self-Testing with Built-in Insulin Dose Advisor Based on ISO 15197:2013: System Accuracy and Hematocrit Influence. Diabetes Technol. Ther. 2018. 20 (4): 303–313.
Benedict C., Brooks S.J., O’Daly O.G., Almen M.S., Morell A., Aberg K., Gingnell M., Schultes B., Hallschmid M., Broman, J.E., Larsson E.M., Schioth H.B. Acute sleep deprivation enhances the brain’s response to hedonic food stimuli: an fMRI study. J. Clin. Endocrinol. Metab. 2012. 97: 443–447.
Benedict C., Hallschmid M., Lassen A., Mahnke C., Schultes B., Schioth H.B., Born J., Lange T. Acute sleep deprivation reduces energy expenditure in healthy men. Am. J. Clin. Nutr. 2011. 93: 1229–1236.
Benedict C., Kern W., Schmid S.M., Schultes B., Born J., Hallschmid M. Early morning rise in hypothalamic–pituitary–adrenal activity: a role for maintaining the brain’s energy balance. Psychoneuroendocrinology. 2009. 34 (3): 455–462.
Born J., Fehm H.L. Hypothalamus-pituitary-adrenal activity during human sleep: a coordinating role for the limbic hippocampal system. Exp. Clin. Endocrinol. Diabetes. 1998. 106: 153–163.
Boyd R., Leigh B., Stuart P. Capillary versus venous bedside blood glucose estimations. Emerg. Med. J. 2005. 22 (3): 177–179.
Brandenberger G., Ehrhart J., Piquard F., Simon C. Inverse coupling between ultradian oscillations in delta wave activity and heart rate variability during sleep. Clin. Neurophysiol. 2001. 112: 992–996.
Burgess H.J., Trinder J., Kim Y. Cardiac autonomic nervous system activity during presleep wakefulness and stage 2 NREM sleep. J. Sleep. Res. 1999. 8: 113–122.
Carlson J.T., Hedner J., Elam M., Ejnell H., Sellgren J., Wallin B.G. Augmented resting sympathetic activity in awake patients with obstructive sleep apnea. Chest. 1993. 103 (6): 1763–1768.
Dinges D.I., Powell J.W. Microcomputer analysis of performance on a portable, simple visual RT task sustained operations. Behavioral Research Methods, Instrumentation, and Computers. 1985. 17: 652–655.
Egan B.M. Neurohumoral, hemodynamic and microvascular changes as mechanisms of insulin resistance in hypertension: a provocative but partial picture. Int J Obes. 1991. 15: 133–139.
Esler M., Straznicky N., Eikelis N., Masuo K., Lambert G., Lambert E. Mechanisms of sympathetic activation in obesity-related hypertension. Hypertension. 2006. 48: 787–796.
Ghiciuc C.M., Cozma-Dima C.L., Pasquali V., Renzi P., Simeoni S., Lupusoru C.E., Patacchioli F.R. Awakening responses and diurnal fluctuations of salivary cortisol, DHEA-S and alpha-amylase in healthy male subjects. Neuroendocrinol. Lett. 2011. 32: 475–480.
Grassi G., Seravalle G., Quarti-Trevano F., Dell’Oro R., Bombelli M., Mancia G. Metabolic syndrome and cardiometabolic risk: an update. Blood Press. 2009. 18: 7–16.
Guiducci L., Iervasi G., Quinones-Galvan A. On the paradox insulin resistance/insulin hypersensitivity and obesity: two tales of the same history. Expert Review of Cardiovascular Therapy. 2014. 12 (6): 637–642.
Herzog N., Jauch-Chara K., Hyzy F., Richtera A., Friedrich A., Benedict C., Oltmanns K.M. Selective slow wave sleep but not rapid eye movement sleep suppression impairs morning glucose tolerance in healthy men. Psychoneuroendocrinology. 2013. 38: 2075–2082.
Iber C., Ancoli-Israel S., Chesson A.L., Quan S.F. The AASM Manual for the Scoring of Sleep and Associated Events: Rules, Terminology and Technical Specifications. Westchester: American Academy of Sleep Medicine, 2007.
Jessen N.A., Munk A.S., Lundgaard I., Nedergaard M. The Glymphatic System: A Beginner’s Guide. Neurochem Res. 2015. 40(12): 2583–2599.
Kahn B.B., Flier J.S. Obesity and insulin resistance. J Clin Invest. 2000. 106: 473–481.
Khani S., Tayek J.A. Cortisol increases gluconeogenesis in humans: its role in the metabolic syndrome. Clin. Sci. 2001. 101 (6): 739–747.
Kuetting D.L.R., Feisst A., Sprinkart A.M., Homsi R., Luetkens J., Thomas D., Schild H.H., Dabir D. Effects of a 24-hr-shift-related short-term sleep deprivation on cardiac function: A cardiac magnetic resonance-based study. J. Sleep Res. 2018. e12665.
Loredo J.S., Nelesen R., Ancoli-Israel S., Dimsdale J.E. Sleep quality and blood pressure dipping in normal adults. Sleep. 2004. 27: 1097–1103.
Lusardi P., Zoppi A., Preti P., Pesce R.M., Piazza E., Fogari R. Effects of insufficient sleep on blood pressure in hypertensive patients: a 24-h study. Am. J. Hypertens. 1999. 12: 63–68.
Maclean A.W., Fekken G.C., Saskin P., Knowles J.B. Psychometric evaluation of the Stanford Sleepiness Scale. Journal of Sleep Research. 1992. 1 (1): 35–39.
Mahfoud F., Schlaich M., Kindermann I., Ukena C., Cremers B., Brandt M.C., Hoppe U.C., Vonend O., Rump L.C., Sobotka P.A., Krum H., Esler M., Böhm M. Effect of renal sympathetic denervation on glucose metabolism in patients with resistant hypertension: a pilot study. Circulation. 2011. 123: 1940–1946.
Mancia G., Bousquet P., Elghozi J.L., Esler M., Grassi G., Julius S., Reid J., Van Zwieten P.A. The sympathetic nervous system and the metabolic syndrome. J Hypertens. 2007. 25: 909–920.
Nedeltcheva A.V., Scheer F.A. Metabolic effects of sleep disruption, links to obesity and diabetes. Curr Opin Endocrinol Diabetes Obes. 2014. 21 (4): 293–298.
Otte C., Lenoci M., Metzler T., Yehuda R., Marmar C.R., Neylan T.C. Hypothalamic-pituitary-adrenal axis activity and sleep in posttraumatic stress disorder. Neuropsychopharmacology. 2005. 30: 1173–1180.
Pamidi S., Tasali E. Obstructive Sleep Apnea and Type 2 Diabetes: Is There a Link? Frontiers in Neurology. 2012. 3: 126.
Pichot V., Roche F., Celle S., Barthélémy J.C., Chouchou F. HRVanalysis: A Free Software for Analyzing Cardiac Autonomic Activity. Front. Physiol. 2016. 7: 557.
Rechtschaffen A., Kales A. A Manual of Standardized Terminology, Techniques, and Scoring System for Sleep Stages of Human Subjects. Washington DC: Washington Public Health Service, US Government Printing Office, 1968.
Redline S., Kirchner H.L., Quan S.F., Gottlieb D.J., Kapur V., Newman A. The effects of age, sex, ethnicity, and sleep-disordered breathing on sleep architecture. Arch Intern Med. 2004. 164 (4): 406–418.
Shinar Z., Akselrod S., Dagan Y., Baharav A. Autonomic changes during wake–sleep transition: a heart rate variability based approach. Auton. Neurosci. 2006. 130: 17–27.
Spiegel K., Leproult R., L’hermite-Balériaux M., Copinschi G., Penev P.D., Van Cauter E. Leptin levels are dependent on sleep duration: relationships with sympathovagal balance, carbohydrate regulation, cortisol, and thyrotropin. J. Clin. Endocrinol. Metab. 2004. 89 (11): 5762–5771.
Spiegel K., Leproult R., Van Cauter E. Impact of sleep debt on metabolic and endocrine function. Lancet. 1999. 354 (9188): 1435–1439.
Stamatakis K.A., Punjabi N.M. Effects of sleep fragmentation on glucose metabolism in normal subjects. Chest. 2010. 137: 95–101.
Steiger A., Guldner J., Hemmeter U., Rothe B., Wiedemann K., Holsboer F. Effects of growth hormone-releasing hormone and somatostatin on sleep EEG and nocturnal hormone secretion in male controls. Neuroendocrinology. 1992. 56: 566–573.
Tasali E., Leproult R., Ehrmann D.A., Van Cauter E. Slow-wave sleep and the risk of type 2 diabetes in humans. Proceedings of the National Academy of Sciences. 2008. 105 (3): 1044–1049.
Tochikubo O., Ikeda A., Miyajima E., Ishii M. Effects of insufficient sleep on blood pressure monitored by a new multibiomedical recorder. Hypertension. 1996. 27: 1318–1324.
Van Leeuwen W.M.A., Sallinen M., Virkkala J., Lindholm H., Hirvonen A., Hublin C., Porkka-Heiskanen T., Härmä M. Physiological and autonomic stress responses after prolonged sleep restriction and subsequent recovery sleep in healthy young men. Sleep Biol. Rhythms. 2017. 16 (1): 45–54.
Van Liempt S., Arends J., Cluitmans P.J., Westenberg H.G., Kahn R.S., Vermetten E. Sympathetic activity and hypothalamo-pituitary-adrenal axis activity during sleep in post-traumatic stress disorder: a study assessing polysomnography with simultaneous blood sampling. Psychoneuroendocrinology. 2013. 38 (1): 155–165.
Yang C., Chang C., Lin J. A Comparison between Venous and Finger-Prick Blood Sampling on Values of Blood Glucose. International Proceedings of Chemical, Biological & Environmental. 2012. 39: 206–210.
Yee B.J., Phillips C.L., Banerjee D., Caterson I., Hedner J.A., Grunstein R.R. The effect of sibutramine-assisted weight loss in men with obstructive sleep apnoea. Int J Obes (Lond). 2007. 31: 161–168.
Дополнительные материалы отсутствуют.
Инструменты
Журнал высшей нервной деятельности им. И.П. Павлова


