Журнал высшей нервной деятельности им. И.П. Павлова, 2019, T. 69, № 4, стр. 479-492
АКТИВНОСТЬ НЕЙРОНОВ БАЗАЛЬНОГО КРУПНОКЛЕТОЧНОГО ЯДРА ПЕРЕДНЕГО МОЗГА КРЫСЫ ПРЕДСКАЗЫВАЕТ РЕЗУЛЬТАТ ПИЩЕДОБЫВАТЕЛЬНОГО ДВИЖЕНИЯ
Д. А. Ивлиев 1, *, Н. Ю. Ивлиева 1
1 Федеральное государственное бюджетное учреждение науки
Институт высшей нервной деятельности и нейрофизиологии РАН
Москва, Россия
* E-mail: ida1965@mail.ru
Поступила в редакцию 21.03.2018
После доработки 11.07.2018
Принята к публикации 24.09.2018
Аннотация
Известно, что в результате научения происходит увеличение частоты разряда нейронов в основании переднего мозга на стимулы, регулярно предшествующие вознаграждению. В условиях двигательного научения регулярно предшествуют вознаграждению те стимулы, которые сопутствуют движению, или, в случае сложного движения, его критичной стадии. Именно эти стимулы могут быть связаны с отмеченными выше изменениями поведения нейронов. С целью проверки выдвинутого предположения в области базального ядра мозга крысы была зарегистрирована активность нейронов при выполнении свободноподвижным животным пищедобывательного движения. Показана группа нейронов, фазически активирующихся во время критической фазы пищедобывательного движения. Эта модуляция активности не наблюдалась при неудачном выполнении движения и, таким образом, предсказывала успешность выполнения движения. Обсуждается возможность кодирования клетками базального ядра поведенческой значимости стимулов, сопутствующих движению.
Одним из свойств объектов окружающего мира, ориентируясь на которые животное организует свое адаптивное поведение, является их значимость для текущего поведения. Wolfram Schultz [Schultz, 2013] так определяет это свойство (стp. 233): “Salience refers to the capacity of stimuli to elicit arousal, alert and attention which enhance neuronal processing and behavioural reactions”. Выделяют три типа значимости: физическую, обусловленную физическими свойствами стимулов, новизны и мотивационную, характеризующуюся своей связью с вознаграждением/наказанием [Schultz, 2013]. Мотивационная значимость имеет условный характер, т.е. становится характеристикой стимулов в процессе научения [Toates, 1986]. По мере тренированности животные научаются предсказывать появление вознаграждения/наказания по предшествующим стимулам, а сами стимулы приобретают еще и предсказательную силу [Schultz et al., 1997; Tindell et al., 2004]. Некоторые авторы, отмечая, что условные стимулы несут в себе и предсказывающую информацию, и мотивационную значимость, на основании близости стимулов по времени к вознаграждению придают этим характеристикам разный вес при определении влияния стимулов на поведение животных [Schultz, 2013; Smith et al., 2011].
Одной из структур, нейронам которой приписывают кодирование мотивационной значимости стимулов и оценку вероятности будущего вознаграждения/наказания, является базальный передний мозг (basal forebrain, BF). В этом контексте чаще всего речь идет о двух его перекрывающихся областях – вентральном паллидуме (VP) и базальном крупноклеточном ядре (NBM) [см. ссылки в обзорах Lin et al., 2015; Raver, Lin, 2015; Root et al., 2015]. И хотя поведенческая значимость стимулов и их предсказательная сила отражаются в модуляции активности нейронов различных структур мозга: вентрального стриатума, дорзального паллидума, передней цингулярной коры, черной субстанции, голубого пятна и дорзальных ядер шва [Bouret et al., 2012; Bouret, Richmond, 2015; Inaba et al., 2013; Schechtman et al., 2016; Shidara et al., 1998; Toda et al., 2012], область VP/NBM, учитывая ее афферентные и эфферентные связи, имеет преимущество как кандидат на роль организатора поведения на основе определения значимости стимулов. С одной стороны, она связана со структурами, принимающими участие в контроле над мотивационной и эмоциональной составляющей поведения: прилежащим ядром, амигдалой, гипоталамусом и вентральной областью покрышки [Gielow, Zaborszky, 2017; Heimer et al., 1991; Mogenson et al., 1980; Nelson, Mooney, 2016; Semba et al., 1988]. Так же эта область получает проекции от модулирующих структур среднего мозга: дорзальных ядер шва, голубого пятна [Gasbarri et al., 1999; Nelson, Mooney, 2016; Semba et al., 1988]. С другой стороны, она имеет связи с двигательными структурами мозга – дорзальной и вентральной стриатопаллидальными системами, сенсомоторной корой, двигательными ядрами среднего мозга [Gielow, Zaborszky, 2017; Root et al., 2015; Semba et al., 1988], что может служить основанием для ее вовлечения в организацию движений. Наиболее существенно то, что BF (особенно NBM) дает обширные проекции во все области neocortex [Lehmann, 1980; Luiten et al., 1987; Mesulam et al., 1983; Nelson, Mooney, 2016]. Причем есть основания полагать, что эти проекции имеют сегрегированный характер и отражают не только паттерн анатомических кортико-кортикальных связей [Zaborszky et al., 2015], но и функциональных связей [Gielow, Zaborszky, 2017; Nelson, Mooney, 2016]. Есть свидетельства того, что в BF разные популяции нейронов имеют максимальную модуляцию активности в определенные, но разные фазы поведенческого акта [Tingley et al., 2014]. Все это взятое вместе позволяет предположить, что проекционные клетки этой области могут влиять на “процессинг” во всех корковых первичных анализаторах (включая двигательный), функционально связанных во время определенной стадии поведения. Учитывая униформные и быстрые реактивные свойства нейронов BF, их влияние на кору может быть синхронизировано с моментом действия значимых стимулов, какую бы модальность и валентность они не имели [Hangya et al., 2015; Lin et al., 2015].
Нейронные корреляты значимости стимулов продемонстрированы, главным образом, в работах, использующих методику классического (Павловского) научения. В них нейроны BF, изменяющие активность при предъявлении вознаграждения [Tindell et al., 2004] или наказания [Maho et al., 1995; Whalen et al., 1994], после научения проявляли модуляцию и на предшествующие условные стимулы. Даже там, где дизайн эксперимента предполагал наличие двигательных методик, показана связь активности нейронов BF со значимостью только лишь условных стимулов, предшествующих двигательному ответу. Но в одних из этих работ двигательным ответом были консумматорные движения (лизания) [Hangya et al., 2015; Lin, Nicolelis, 2008], которые, как и нейронную активность, связанную с ними, трудно интерпретировать и анализировать в парадигме инструментального научения. В других же создавалась ситуация вероятностного вознаграждения, при которой достижение конечной цели определяется не только способностью животного совершить некоторое действие, но и случайной подачей стимула [Avila, Lin, 2014a; 2014b]. Очевидно, что подобная процедура понижала значимость самих двигательных реакций. Однако в парадигме инструментального научения достижение результата поведения (пища или отмена тока) зависит от выполнения выучиваемого движения [Конорски, 1970; Balleine et al., 2009]. Следовательно, одна из наиболее значимых стимуляций должна быть связана с таким движением.
Есть небольшое число работ, в которых исследуется связь модуляции активности нейронов BF и осуществления выученных целенаправленных манипуляторных движений. В них показана возможность вовлечения нейронов NBM в процесс принятия решения о совершении/не совершении контекст-зависимой реакции [Richardson, DeLong, 1990]. Нами ранее было показано, что изменение активности группы нейронов NBM, сопутствующее сложному пищедобывательному движению передней конечности, связано с его успешностью. Было предположено, что эта модуляция активности происходит во время фазы движения, наиболее значимой для его успешного завершения [Ивлиев, Ивлиева, 2005].
Целью настоящей работы было проверить сделанное нами ранее предположение и выяснить, может ли изменение активности нейронов NBM происходить во время критической фазы сложного двигательного акта и предсказывать его результат.
МЕТОДИКА
Правила работы с животными и протоколы эксперимента утверждены Этической комиссией Института высшей нервной деятельности и нейрофизиологии РАН. Эксперимент был проведен на взрослых самцах крыс линии Вистар (n = 5) массой 350–450 г на начало эксперимента. До начала эксперимента крыс приручали к рукам и экспериментальной камере по 15 мин 2–3 дня.
Хорошо известно, что при доставании удаленной пищи у крыс наблюдается индивидуальная латерализация в использовании передних конечностей. Этот феномен был получен при использовании различных вариантов методики для выработки пищедобывательного навыка у крыс [Peterson, 1934; Castro, 1972; Bracha et al., 1990; Whishaw, Pellis, 1990; Ballermann et al., 2001; Buitrago et al., 2004]. Для того, чтобы избежать влияния на интерпретацию данных двигательного предпочтения, которое может измениться по ходу опыта, эксперимент был выполнен в два этапа. На первом этапе проводили предварительную тренировку животного, на втором в усложненных условиях модифицировали полученный навык. Известно, что после такой предварительной тренировки животные не меняют используемую лапу во время последующей процедуры модификации пищедобывательного навыка [Ивлиев, 2002]. В начале каждого этапа крыс подвергали пищевой депривации в течение двух суток. В остальное время эксперимента вне опытов у животных поддерживали 80% от исходной массы тела при свободном доступе к воде.
Экспериментальная камера
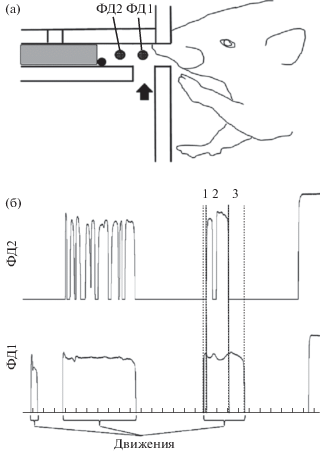
Экспериментальная камера представляла собой прозрачный ящик (200×300×300 мм) из оргстекла. На передней стенке камеры с внешней стороны на высоте 50 мм от пола располагалась горизонтальная прямоугольная кормушка (26 × 26 × 65 мм), которая через внутреннее квадратное отверстие в поперечнике (12 × 12 мм) сообщалась с камерой. В боковых стенках кормушки по центру на расстоянии 5 и 15 мм от внешней стенки камеры размещались два инфракрасных фотодатчика, ФД1 и ФД2 соответственно (рис. 1(а)). Датчики использовались для определения положения лапы внутри кормушки и конца пробы. Кормушка была снабжена поршнем для подачи пищи экспериментатором. В конце пробы поршень вручную задвигался, что служило отметкой конца пробы.
Рис. 1.
(а) Вид кормушки в боковом разрезе. Показаны: пищевая гранула, поршень (заштриховано), расположение фотодатчиков ФД1 и ФД2, открываемое отверстие при модификации навыка (стрелка). (б) структура пищедобывательных движений. Отклонение линий вверх – перекрытие лапой соответствующего ФД. Последние отклонения – отметка завершения пробы. Цифрами и пунктиром обозначены выделенные для обработки периоды последнего движения: 1 – протягивание лапы, 2 – период скребков, 3 – вынимание лапы. Отметка времени 100 мс.
Fig. 1. (a) Feeder in the side view. The food pellet, piston (shaded), the location of photosensors FD1 and FD2, the opening for movement modification (arrow) are shown. (б) Structure of reaching for food movements. Deviation of the lines upwards is detection of the forepaw on the corresponding FD. The last deviation is the end of the run. The digits and dashed lines indicate the periods of the last movement selected for processing: 1 – forepaw extension, 2 – the period of the scratches, 3 – forepaw flexion. Time stamp 100 ms.
Предварительная тренировка
Целью предварительной тренировки было определение у крысы предпочитаемой ею передней лапы для извлечения из кормушки пищевых гранул (Dustless Precision Pellets®, Bio-Serv®, вес 45 мг). Тренировку проводили по 30 мин каждый день, регистрация двигательной и нейронной активности при этом не велась. После того как крысу помещали в камеру, ей предъявляли пищу у края кормушки. После каждого вынимания пищи крысой любым способом (передними лапами или языком) пища отодвигалась в глубь кормушки по 5 мм до достижения 20–25 мм от края кормушки, откуда крыса могла достать пищу только передними лапами. Это положение не изменялось до конца эксперимента. После извлечения 10 гранул с указанного расстояния тренировка заканчивалась, на что уходило от 2 до 6 дней. Крыс, которые вынули пищу одной и той же лапой, брали на операцию.
Модификация пищедобывательного навыка
По истечении послеоперационного восстановительного периода (1 нед) у животных модифицировали пищедобывательный навык, приобретенный ими на стадии предварительной тренировки. Процедуру проводили с регистрацией пищедобывательных движений и нейронной активности. Опыты проходили по следующей схеме. После введения электрода и получения устойчивой картины нейронной активности крысы выполняли 25 проб по извлечению пищи. Пищедобывательные движения за этот период считались контрольными (контроль). Затем снизу кормушки открывали отверстие длиной 10 мм (рис. 1(а)), для того чтобы крысы были вынуждены захватить пищу более дистально внутри кормушки и не смогли бы достать плохо схваченные гранулы. В этом и заключалась модификация навыка, т.к. такой дистальный захват пищи не был необходимым условием на стадии предварительной тренировки, и животные могли окончательно захватывать пищу у края кормушки. Крысы выполняли 50 проб по извлечению пищи. Далее отверстие закрывали, меняли положение микроэлектрода, и процедура повторялась (25 контрольных проб и 50 проб с отверстием). Опыт прекращали при насыщении животного. Таким образом удавалось выполнить от 1 до 3 регистраций в день. Тренировку заканчивали, когда доля успешных проб за опыт выходила на асимптотический уровень и держалась на протяжении трех последовательных дней.
Под пробой здесь понимаются все пищедобывательные движения лапой от момента подачи пищи до ее доставания или падения пищи в отверстие. Успешными считались проба и соответствующие движения (успех), когда животное вынимало пищу и отправляло ее в рот. Неудачными считались проба и движения (неудача), во время которых пища выпадала в отверстие в кормушке. Те случаи, когда крыса вынимала пищу, но не обращая на нее внимания, отбрасывала, или когда вынимая пустую лапу, подносила ее ко рту, принимались за ошибочные (ошибка).
Хирургическая процедура
Для уменьшения кровопотери за 20 мин до операции животному внутримышечно вводили этамзилат в дозе 8 мг/кг. Операцию проводили под анестезией хлоралгидратом (Panreac Quimica S.L.U.) 350 мг/кг, внутрибрюшинное введение. При необходимости для поддержания наркоза использовали 0.5 дозы анестетика. Местное обезболивание осуществляли подкожной инъекцией 0.5% р-ра новокаина. В начале операции внутримышечно вводили антибиотик (Байтрил® 2.5%, ЗАО “Байер”, Россия) 5 мг/кг. При помощи термоножа проводили скальпирование черепа и удаляли мягкие ткани, затем обрабатывали череп перекисью водорода. Над контралатеральной к предпочитаемой лапе (см. выше) областью BF (от Bregma AP = –1.3 мм, ML = ±3 мм) [Paxinos, Watson, 1998] бормашиной, закрепленной в стереотаксическом аппарате, в черепе делали отверстие диаметром 2 мм. Трепанационное отверстие замазывали смесью воска и вазелинового масла в соотношении 7:3. Над отверстием размещали пластиковую опору для микроэлектродного манипулятора. Опору и два винта из нержавеющей стали ∅1.6 мм, один в теменной кости, другой в носовой, заливали акриловой пластмассой. Один из винтов служил в качестве заземляющего электрода. Рану обрабатывали стрептоцидом и зашивали.
Регистрация нейронной и пищедобывательной активности
Экстраклеточную спайковую активность нейронов смежных областей BF (от Bregma AP = –0.8 – –1.8 мм, ML = ±2.5–3.5 мм, DV = = –6 – –8 мм) [Paxinos, Watson, 1998] регистрировали вольфрамовым микроэлектродом в лаковой изоляции (Do = 100 мкм, диаметр кончика <10 мкм). Сопротивление электродов: 1–4 Мом (при 1 кГц). Позиционирование кончиков электродов проводили при помощи микроманипулятора. Каждое новое положение кончика электрода вдоль трека отличалось от предыдущего не менее, чем на 100 мкм. Сигналы фильтровались (300–3000 Гц) и усиливались при помощи усилителя DL302N (НейроБиоЛаб, Россия), затем через многофункциональную плату NI PCI – 6251 (National Instruments Corp., USA) сохранялись на компьютере Pentium – 4, (3 ГГц). Частота дискретизации вводимых сигналов составляла 50 кГц.
Движения лапы в кормушке регистрировали двумя фотодатчиками (рис. 1(а)). Иногда крыса, просовывая морду в кормушку, частично перекрывала ближайший фотодатчик, при этом величина входного сигнала не превышала 10% от максимального значения. Эта величина входного сигнала была принята для определения начала и конца перекрытия фотодатчиков лапой. Сигналы от фотодатчиков усиливались и вводились в компьютер так же, как и сигналы нейронной активности. Ввод данных в компьютер осуществляли с помощью программы, написанной в лаборатории на языке LabView (National Instruments Corp., USA). Успешность движения в конце пробы фиксировалась экспериментатором в протоколе опытов.
Двигательная активность
Известно, что у крысы пищедобывательные движения лапой в трубке-кормушке не являются унитарными, зачастую крыса совершает несколько движений, не вынимая лапу из кормушки [Bracha et al., 1990; Сташкевич, Ивлиев, 2013]. Учитывая ограничения используемого нами способа регистрации движений лапы внутри кормушки, за пищедобывательное движение мы принимали всю совокупность движений лапой, совершаемых на протяжении времени перекрытия ею ФД1. Перемещения лапы вне кормушки не регистрировались. Фрагмент записи, отражающий структуру пробы и пищедобывательных движений, приведен на рис. 1(б). Очевидно, что наиболее значимые для успешной реализации задачи события происходят во время последнего движения в пробе, которое влечет за собой успех или неудачу. Поэтому именно это движение и было выбрано для обработки. Мы выделили в последнем движении три условных временных интервала (рис. 1(б)): протягивание лапы – время от начала перекрытия лапой датчика ФД1 до начала первого перекрытия датчика ФД2; вынимание лапы – время от конца последнего перекрытия лапой ФД2 до конца перекрытия ФД1; период скребков – время от окончания протягивания лапы до начала ее вынимания, в течение которого крыса совершала различные манипуляторные движения, скребки и захват пищевых гранул. Выделенные интервалы дали нам 4 поведенческих маркера, обозначенные на рис. 1(б) пунктиром: начало протягивания лапы, начало периода скребков (конец протягивания лапы), начало вынимания лапы (конец периода скребков) и конец движения. Эти поведенческие события использовались для построения гистограмм нейронной активности. Движения во время неудачи, у которых интервал вынимания лапы был меньше, чем минимальный аналогичный интервал при успехе, не учитывались. Тем самым мы уменьшали вероятность учета неудачных движений со случайным падением гранул без попытки их захватить.
Определение типа модуляции для каждого нейрона
Экстраклеточные активности отдельных клеток разделяли в программе Spike2 (CED, UK) по форме спайка. Также спайки считались принадлежащими одному нейрону, если показывали четкий рефрактерный период (>1 мс) на гистограмме межимпульсных интервалов.
Для определения модуляции нейронной активности в контрольных, успешных и неуспешных пробах анализировались спайковые разряды во время последних пищедобывательных движений. Регистрации при ошибках не обрабатывались. PETHs (perievent time histograms) (ширина бина 20 мс, эпоха анализа ± 500 мс), выровненные относительно поведенческих маркеров (см. выше), усреднялись отдельно для контрольных, успешных и неудачных проб для каждого нейрона. На основании этих усредненных PETHs определяли наличие модуляции активности, используя метод нахождения изменений во временной последовательности данных (Change-Point Analysis, СРА) [Taylor, 2000]. Для этого в лаборатории была написана программа с помощью пакета LabView 12 (National Instruments Corp., USA). Процедуру bootstrap применяли 10 000 раз. Наличие модуляции клеточной активности принимали на уровне значимости α = 0.05. Повторение процедуры СРА на той же самой PETH позволяло определить не только начало модуляции, но и ее длительность [Taylor, 2000]. Интервал времени до модуляции принимался за условный фоновый период. За найденные периоды фоновой активности и модуляции рассчитывали среднее значение бина в каждой из проб для каждого нейрона. По полученным значениям усредненных бинов успешные пробы сравнивали с контрольными и неудачными для каждого нейрона. На основании результатов этого сравнения нейроны были сгруппированы по типам модуляции клеточной активности и времени ее появления.
Анализ популяционной активности
Для каждого из типов модуляции было по три сравниваемые группы нейронов (контроль, успех, неудача). Для каждого нейрона в этих группах на основании усредненной PETH была получена нормализованная (Z-scored) гистограмма. Ее бины за период модуляции, определенный для конкретного нейрона, усредняли и получали нормализованное значение бина для этого периода. Усредняя эти бины, получали значение популяционной нормализованной модуляции для каждой группы клеток. Популяционная модуляция сравнивалась между контрольными, успешными и неуспешными движениями. Общий вид популяционной активности клеток каждой группы получался построением усредненных PETH и Z-scored гистограмм всех клеток в группе.
Статистический анализ данных
Все данные проверяли на нормальность распределения по тестам Lilliefors и Shapiro-Wilk. Однородность выборочных дисперсий проверяли Levene-тестом. Если данные соответствовали всем выбранным критериям при р ≤ 0.05, то для каждого типа модуляции группу “успех” сравнивали с группами “контроль” и “неудача” с использованием ANOVA и Dunnett-теста для post-hoc анализа. В противном случае для межгрупповых сравнений использовали Kruskal-Wallis ANOVA и Dunn-Sidak тест для множественных сравнений. Статистическую достоверность различий принимали при р ≤ 0.05. Статистические сравнения проводили с использованием программы STATISTICA 6 (StatSoft, Inc., USA) и процедур kruskalwallis и multcompare в MATLAB R2008a (The MathWorks, Inc., USA).
Морфологический контроль
После опытов под хлоралгидратным наркозом у животного метили верхнюю и нижнюю границы области регистрации, пропуская анодный ток (100 мкА, 2 с) через регистрирующий электрод. После этого стандартно фиксировали мозг, изготавливали срезы толщиной 40 мкм на микротоме и окрашивали по Нисслю.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЙ
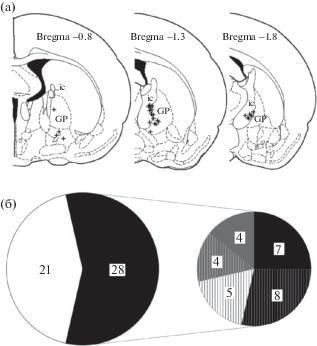
Из 49 нейронов, взятых в обработку, 28 клеток (57%) показали изменение активности за время регистрации. В среднем модуляция активности состояла в увеличении частоты разряда от 20–40 Hz за предшествующий период до 50–80 Hz. В основном эти нейроны были зарегистрированы в области, лежащей на границе между внутренней капсулой и бледным шаром (рис. 2 (а)), и таким образом принадлежали NBM [Lehmann et al., 1980; Luiten et al., 1987]. Эти 28 клеток были сгруппированы по типу модуляции клеточной активности и времени ее появления. У 15 из них (рис. 2(б) на выноске черным) наблюдалось различное изменение активности во время успешных и неудачных движений (у 14 клеток при вынимании лапы (группа 1), у 1 – при протягивании). Другие 8 из 28 нейронов (группа 2) (рис. 2 (б) на выноске серым) показали дифференциальную модуляцию только после движений. 17 нейронов показали значимое изменение активности, которое не различалось при успехе и неудаче (рис. 2 (б) на выноске заштриховано). Из них 8 клеток принадлежали группе 1, 4 клетки – группе 2, 5 клеток показали только недифференциальную модуляцию (рис. 2 (б) на выноске белым). Недифференциальная модуляция наблюдалась только во время движения. Эта модуляция варьировала от нейрона к нейрону как по времени появления (у 14 при протягивании лапы, у 3 – при вынимании), так и по своей направленности (активация или торможение), поэтому для дальнейшей обработки были взяты десять клеток (группа 3) с наиболее часто встречаемым паттерном для такой модуляции (увеличение активности при протягивании лапы). Соотношение клеток с различными видами модуляции активности представлено на рис. 2 (б).
Рис. 2.
(а) Распределение нейронов, показавших модуляцию активности на реконструкциях поперечных срезов мозга. Знаком + отмечены места регистрации нейронов. Координаты срезов даны согласно атласу [Paxinos, Watson 1998]. ic – внутренняя капсула, GP – бледный шар. (б) Соотношение клеток, показавших модуляцию активности. Слева: белая область – нейроны без изменения активности; черная – нейроны с модуляцией, среди них (на выноске справа): черным – нейроны с дифференциальной модуляцией во время движения, серым – нейроны с дифференциальной модуляцией только после движения, белым – нейроны только с недифференциальной модуляцией во время движения. Заштриховано – нейроны с недифференциальной модуляцией. Цифрами показано количество клеток.
Fig. 2. (a) The distribution of neurons that showed modulation of activity on reconstructions of coronal sections of the brain. + is marked place of registration of neurons. The coordinates of the slices are given according to the atlas [Paxinos, Watson 1998]. ic – capsula interna, GP – globus pallidus. (б) Fraction of cells that showed modulation of activity. White area on left – unresponsive neurons; black – neurons which showed modulation of activity, among them (insertion on right): black – neurons with differential modulation during movement, gray – neurons with differential modulation after the movement, shaded – neurons with non-differential modulation, white – neurons with only non-differential modulation during movement. Numbers indicate the number of cells.
Влияние успешности движения на активность нейронов
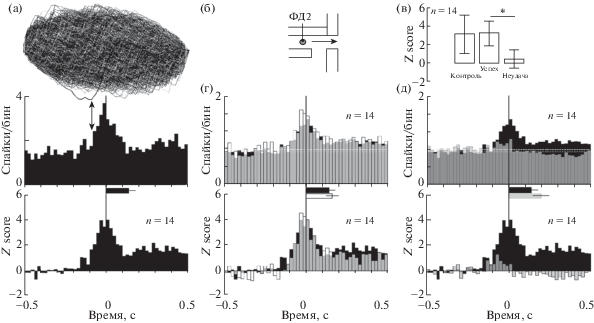
Анализ динамики нейронной активности на протяжении трех выделенных двигательных интервалов показал, что у клеток группы 1 при успешном движении происходило значимое и кратковременное (около 200 мс) увеличение частоты разряда (CPA, α = 0.05). Эта модуляция начиналась за 80–100 мс перед выниманием лапы и заканчивалась до завершения движения. Сразу после движения, не доходя до фонового уровня, быстрая модуляция переходила в тоническую активационную фазу (рис. 3 (а), (д)). При неудачных попытках быстрая активационная модуляция либо отсутствовала, либо была достоверно ниже, чем при успешных движениях (рис. 3 (в)). При этом после движения наблюдалось незначительное снижение активности (рис. 3 (д)).
Рис. 3.
Дифференциальная модуляция активности во время пищедобывательного движения. (а) Изменение нейронной активности с началом вынимания лапы при успешном пищедобывательном движении (в середине пример для отдельно взятого нейрона, снизу – популяционная (Z-scored) активность). Сверху результат анализа CPA для приведенного нейрона. Достоверное изменение активности отмечено стрелкой. Следующий за этим моментом бин на гистограмме ниже является началом модуляции, интервал времени до этой точки является фоновым периодом. Пунктир – уровень фоновой активности. Горизонтальный столбик – средняя длительность вынимания лапы. (б) Изменение уровня сигнала от показанного фотодатчика считалось событием, относительно которого выравнивались гистограммы на рисунке. Стрелка – направление движения лапы. (в) Межгрупповое сравнение нормализованных значений модуляции, представленной как усредненный бин за период модуляции. (г) Популяционная активность при вынимании лапы в группе “успех” (черные гистограммы) и “контроль” (белые гистограммы) (сверху частота разряда, снизу Z score). (д) Популяционная активность при вынимании лапы в группе “успех” (черные гистограммы) и “неудача” (серые гистограммы) (сверху частота разряда, снизу Z score). На всем рисунке: гистограммы и CUSUM-кривые выровнены относительно начала вынимания лапы (вертикальные линии). Горизонтальные столбики соответствующего цвета – средняя длительность вынимания лапы. Пунктир – уровни фоновой активности. Разбросы даны в виде 95% доверительного интервала. * – р ≤ 0.05 (post hoc Dunnet-тест). Здесь и далее ширина бина 20 мс.
Fig. 3. Differential modulation of activity during the reaching for food movements. (a) Neurons are excited at the beginning of the forearm flexion during successful movement (middle: example modulation for a single neuron; bottom: Z-scored population modulation). Top – CPA analysis for PETH below. Change point in neuron activity is indicated by double-head arrow. First of bins on the PETH below following this point is considered as the beginning of the modulation; the time interval before this point is considered as background period. Horizontal bar: average duration of the forepaw flexion. (б) Change of the value from photosensor depicted was considered as event for PETHs alignment. Arrow – direction of forearm movement. (в) Between groups comparison of Z-scored modulation represented as average bin of the modulation period. (г) Population activity during forepaw flexion in the groups “success” (black histograms) and “control” (white histograms) (top: firing rate, bottom: Z-score). (д) Population activity during forepaw flexion in the groups “success” (black histograms) and “failure” (grey histograms) (top: firing rate, bottom: Z-score). In the whole figure: PETHs and CUSUM-curves are aligned to the beginning of the forepaw flexion (vertical lines). Horizontal bars of the corresponding color – the average duration of the forepaw flexion. Dashed lines: average baseline firing. Values are mean ±95% confidence interval. * – p ≤ 0.05 (post hoc Dunnet test). Hereinafter, the bin width is 20 ms.
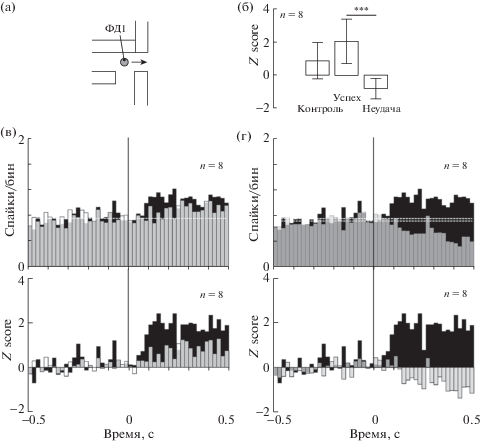
Клетки группы 2 показали значимое (CPA, α = 0.05) тоническое изменение активности после того, как крыса доставала пищу из кормушки. Эта модуляция достоверно различалась при успехе и неудаче (рис. 4 (б)) и имела разнонаправленный характер: после успешных движений наблюдался рост активности, а в случае неудачи в этот период следовало торможение активности (рис. 4 (г)).
Рис. 4.
Дифференциальная модуляция активности после пищедобывательного движения. (а) Обозначение как на рис. 3(б). (б) Межгрупповое сравнение нормализованных значений модуляции, представленной как усредненный бин. (в) Популяционная активность нейронов в группе “успех” (черные гистограммы) и “контроль” (белые гистограммы) (сверху частота разряда, снизу Z score). (г) Популяционная активность в группе “успех” (черные гистограммы) и “неудача” (серые гистограммы) (сверху частота разряда, снизу Z score). На всем рисунке гистограммы выровнены относительно конца вынимания лапы (вертикальные линии). *** – p ≤ 0.001 (post hoc Dunnet-тест). Остальные обозначения как на рис. 3.
Fig. 4. Differential modulation of activity after food retrieval. (a) The notation as in Fig. 3 (б). (б) Between groups comparison of Z-scored modulation represented as average bin of the modulation period. (в) Population activity in the groups “success” (black histograms) and “control” (white histograms) (top: firing rate, bottom: Z-score). (г) Population activity in the groups “success” (black histograms) and “failure” (grey histograms) (top: firing rate, bottom: Z-score). In the whole figure, PETHs are aligned to the end of the forepaw flexion (vertical lines). *** – p ≤ 0.001 (post hoc Dunnet test). The rest notation as in Fig. 3.
Модуляция активности нейронов, объединенных в группе 3, представляла собой достоверное (CPA, α = 0.05) увеличение частоты импульсации за 20–40 мс до начала регистрации присутствия лапы в кормушке (рис. 5 (г)), заканчивающееся через 120–140 мс в периоде скребков. Эта модуляция активности наблюдалась как при успешных, так и при неудачных движениях и не различалась по величине в этих группах (рис. 5 (б)).
Рис. 5.
Недифференциальная модуляция активности во время пищедобывательного движения. На рисунке показан наиболее часто встречаемый случай динамики нейронной активности. (а) обозначение как на рис. 3(б). (б) Межгрупповое сравнение нормализованных значений модуляции, представленной как усредненный бин. (в) Популяционная активность нейронов (частота разряда) во время вытягивания лапы в группе “успех” (черные гистограммы) и “контроль” (белые гистограммы). (г) Популяционная активность во время вытягивания лапы в группе “успех” (черные гистограммы) и “неудача” (серые гистограммы). На всем рисунке гистограммы выровнены относительно начала протягивания лапы (вертикальные линии). Остальные обозначения как на рис. 3.
Fig. 5. Non-differential modulation of activity during reaching for food movement. The figure shows the most common case of dynamics of neural activity. (a) The notation as in Fig. 3(б). (б) Between groups comparison of Z-scored modulation represented as average bin of the modulation period. (в) Population activity (firing rate) during forepaw extension in the groups “success” (black histograms) and “control” (white histograms). (г) Population activity (firing rate) during forepaw extension in the groups “success” (black histograms) and “failure” (grey histograms). In the whole figure, the histograms are aligned with the beginning of forepaw extension (vertical lines). The rest of the notation as in Fig. 3.
Влияние модификации пищедобывательного навыка на активность нейронов
Усложнение доставания пищевых гранул не повлияло на характер изменения активности клеток NBM. Так, у нейронов группы 1 модуляция клеточной активности при контрольных движениях не отличалась от изменения активности при успешных движениях и так же наблюдалась перед началом вынимания лапы с пищей (рис. 3 (в), (г)). У нейронов группы 2 модуляция активности в контроле так же, как и в случае успешных движений, начиналась после завершения движения (рис. 4 (в)), хотя и была менее выражена. При этом сравнение модуляций в группах “контроль” и “успех” не выявило достоверных отличий (рис. 4 (б)). Модификация навыка существенно не повлияла и на недифференциальную модуляцию в группе 3. При контрольных движениях также наблюдался рост активности перед началом регистрации лапы в кормушке (рис. 5 (в)), при этом динамика активности не имела выраженный фазический характер, как при успешных движениях. Сравнение нейронных активностей в этих группах не выявило достоверных отличий (рис. 5 (б)).
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Известно, что в результате научения происходит увеличение ответа нейронов BF на стимулы, регулярно предшествующие вознаграждению, и/или увеличение количества клеток, реагирующих на эти стимулы [Smith et al., 2011; Tindell et al., 2004]. Очевидно, что в условиях двигательного научения регулярно предшествуют вознаграждению те стимулы, которые сопутствуют движению, или в случае сложного движения – его критичной стадии (стадии наиболее важной для его выполнения). Именно эти стимулы могут быть связаны с отмеченными выше изменениями поведения нейронов NBM. С целью проверки выдвинутого предположения была зарегистрирована активность нейронов из области NBM мозга крысы при выполнении свободноподвижным животным пищедобывательного движения. Выполнение этого движения для крысы было затруднено наличием отверстия снизу трубки-кормушки, что вынуждало животное для получения вознаграждения захватывать пищевые гранулы более дистально. Таким образом, необходимость заранее схватить пищу и преодолеть препятствие было одним из последних событий, непосредственно предшествующих получению вознаграждения, и определяло наиболее критическую фазу пищедобывательного движения.
Было обнаружено, что наиболее представительная модуляция нейронной активности в период регистрации состояла в кратковременном (не более 200 мс) увеличении частоты разряда клеток в течение обозначенной выше фазы движения. Пиковое значение активности нейронов приходится на начало вынимания конечности как раз перед преодолением лапой препятствия (рис. 3 (б)). Вероятно, что к этому моменту крыса почти схватила пищевую гранулу, что подтверждается видеоматериалами, полученными при регистрации подобного поведения в другом эксперименте [Сташкевич, Ивлиев, 2013]. Таким образом, увеличение частоты разряда нейронов сопутствовало формированию захвата пищевой гранулы. Учитывая, что модуляции активности не было при неудачных движениях, т.е. при слабом схватывании, когда гранула падала в отверстие, можно предположить, что эта модуляция отражает участие нейронов NBM в выполнении движения схватывания per se. Мы считаем, что в данном случае это не так по следующим причинам: во-первых, показано, что активность нейронов NBM не связана с выполнением различных движений как таковых [Richardson, DeLong, 1990] (но см. [Avila, Lin, 2014b]); во-вторых, у некоторых нейронов, показавших дифференциальную модуляцию во время схватывания пищи, обнаруживалась схожая по величине и длительности, но недифференциальная модуляция при протягивании лапы (ср. рис. 3 (д) и рис. 5 (г)), т.е. схожее изменение активности происходило при не схожих движениях (экстензия vs флексия); в-третьих, эта модуляция заканчивается до завершения движения (рис. 3 (д)), когда животное все еще продолжает сжимать гранулу, что требует активности нейронов, обеспечивающих сжатие кисти.
Каким же может быть функциональное значение увеличения активности нейронов NBM, наблюдаемое в данном эксперименте во время критичной фазы движения? Считается, что быстрый (доли секунды) разряд нейронов, зарегистрированных в тех же областях, что и в нашей работе, и имеющих схожие частотные характеристики нейронной активности, отражает кодирование нейронами поведенческой значимости стимулов, предшествующих вознаграждению [Avila, Lin, 2014a; 2014b; Lin, Nicolelis, 2008; Raver, Lin 2015; Smith et al., 2011; Tindell et al., 2004]. Последствия модуляции проявляются в более быстром и точном выборе поведенческого ответа (принятии решения), при этом увеличение активности нейронов NBM способствует выполнению двигательного ответа [Avila, Lin, 2014a; Raver, Lin, 2015; Richardson, DeLong, 1990], а резкое уменьшение – прерыванию уже начатого движения [Mayse et al., 2015]. Предполагается, что улучшение поведения происходит в результате улучшения процессинга в кортикальных клетках-мишенях. К сожалению, в работах, исследующих кодирование значимости стимулов нейронами различных структур и использующих двигательные методики, мало внимания уделяется самому движению и той значимости, которое оно имеет для успешной реализации целенаправленного поведения. Согласно информационной теории, более ранний условный стимул (более отдаленный от вознаграждения) имеет наибольшую предсказательную силу о вознаграждении [Smith et al., 2011]. И если с этим утверждением еще можно согласиться в ситуации классического Павловского обусловливания, где вся последующая стимуляция и вознаграждение/наказание в результате предшествующих сочетаний в большой степени предопределены (низкая неопределенность), то в условиях двигательного научения наибольшая предсказательная сила должна быть у стимулов, сопутствующих движению (т.е. у более поздних, близких к вознаграждению/наказанию). И чем сложнее двигательный ответ, тем в большей степени от него зависит вероятность достижения цели. Нам представляется очевидным, что никакая предшествующая движению внешняя стимуляция не может предсказывать результат достаточно надежно (высокая неопределенность), пока не выработается автоматизированный двигательный навык (т.н. привычка, habit), который во многом похож на “врожденные” безусловно-рефлекторные движения (консуматорные, чесания, грумминг). Но такое движение приобретается в результате перетренировки и, как правило, не является целью процедуры инструментализации – она ограничивается выработкой высокоэффективного, но не автоматизированного навыка (skill).
Учитывая вышесказанное, можно предположить, что модуляция активности нейронов NBM в нашей работе представляет собой такой сигнал значимости стимуляции, сопровождающей успешное движение, а именно: тактильной от вентральной поверхности кисти и проприоцептивной от мышц – сгибателей пальцев. И здесь встает важный и трудный для интерпретации данных вопрос: эта модуляция является следствием или причиной успешности двигательной реакции? И в том, и в другом случае модуляция активности нейронов NBM может интерпретироваться как сигнал, кодирующий поведенческую значимость стимулов. Но в первом случае самое важное и значимое событие произошло (например, захват пищи), и все последующие события менее существенны для успешного завершения задачи. Во втором же случае только лишь создались условия для успешного захвата пищи (например, необходимый контакт с пищей и степень сжатия кисти), и модуляция активности нейронов NBM здесь приводит к улучшению процессинга в областях-мишенях для этих клеток (например, в сенсомоторной коре), что выражается как увеличение направленного внимания на успешное завершение движения. Для ответа на этот вопрос необходимы дальнейшие исследования с более подробной регистрацией поведения.
Остается открытым вопрос о медиаторной природе зарегистрированных нейронов. Функцию кодирования поведенческой значимости стимулов и связанными с ней повышение внимания и улучшения процессинга в коре приписывают как холинергическим [Hangya et al., 2015; Nelson, Mooney, 2016], так и ГАМК-ергическим [Avila, Lin, 2014а; 2014b; Lin, Nicolelis, 2008] кортикопетальным нейронам NBM, которыми богата эта область. К тому же показана сотрансмиссия в терминалях проекционных холинергических нейронов BF ацетилхолина и ГАМК [Saunders et al., 2015а; Saunders et al., 2015b].
В контрольных условиях (без отверстия в кормушке) оказалось, что нейроны проявляют точно такую же модуляцию активности, как и во время усложнения движения. Таким образом, усложнение пищедобывательного движения не повлияло на характер изменения клеточной активности. Во время вынимания пищи это, возможно, объясняется тем, что для каждой крысы было зарегистрировано несколько клеток на разных стадиях тренированности, и поэтому нейронные записи в контрольных условиях были получены, когда животное уже имело опыт модификации навыка (кроме первых зарегистрированных нейронов для каждого животного). Для модуляции, проявляемой в начале движения, это может объясняться одинаковой для двух ситуаций значимостью некоторых событий во время экстензии лапы (например, прицельное вытягивание лапы на определенное расстояние). Та же причина может быть и для недифференциальной модуляции в начале движения.
Тоническая дифференциальная модуляция, проявляемая после движения, и модуляция в группе “контроль” в это же время для клеток группы 2, возможно, отражает реакцию непосредственно на вынутую и поедаемую пищу. Это хорошо известная и показанная во многих работах реакция нейронов BF на пищевое вознаграждение, которая наблюдалась и до, и после процедуры обучения.
Наша работа также не противоречит данным, согласно которым в области VP и NBM существуют как нейроны, реагирующие на определенное событие по ходу эксперимента, так и способные изменять свою активность в ответ на несколько (но также определенных) событий [Richardson, DeLong, 1990; Smith et al., 2011; Tingley et al., 2014].
ЗАКЛЮЧЕНИЕ
В области NBM мозга крысы была показана группа нейронов, фазически активирующихся во время критической фазы пищедобывательного движения. Эта модуляция активности не наблюдалась при неудачном выполнении движения и, таким образом, предсказывала успешность выполнения движения. Высказано предположение, что данная модуляция отражает кодирование клетками NBM поведенческой значимости стимулов, сопутствующих движению.
Список литературы
Ивлиев Д.А. Особенности формирования новой двигательной координации при пищедобывательных движениях у крыс. Журн. высш. нерв. деят. 2002. 52 (5): 629–633.
Ивлиев Д.А., Ивлиева Н.Ю. Модуляция нейронной активности в области базального переднего мозга крысы, связанная с эффективностью пищедобывательных движений. Журн. высш. нерв. деят. 2005. 55 (5): 684–692 (переведена: Ivliev D.A., Ivlieva N.Y. Modulation of neuron activity in the basal forebrain of the rat related to the outcome of food-procuring movements. Neurosci. Behav.Physiol. 2006. 36 (8): 889–896. ).https://doi.org/10.1007/s11055-006-0103-z
Конорски Ю. Интегративная деятельность мозга. М.: Мир, 1970. 412 с. (английский вариант: Konorski J. Integrative activity of the brain: an interdisciplinary approach. Chicago, IL: University of Chicago Press, 1967. 1–531 pp.).
Сташкевич И.С., Ивлиев Д.А. Использование метода высокоскоростной видеорегистрации в исследовании пищедобывательных движений у крыс. Журн. высш. нерв. деят. 2013. 63 (5): 597–605. https://doi.org/10.7868/S0044467713050092
Avila I., Lin S-C. Motivational salience signal in the basal forebrain is coupled with faster and more precise decision speed. PLoS Biol. 2014a. 12 (3): e1001811. https://doi.org/10.1371/journal.pbio.1001811
Avila I., Lin S-C. Distinct neuronal populations in the basal forebrain encode motivational salience and movement. Front. Behav. Neurosci. 2014b. 8: 421. https://doi.org/10.3389/fnbeh.2014.00421
Balleine B.W., Liljeholm M., Ostlund S.B. The integrative function of the basal ganglia in instrumental conditioning. Behav. Brain Res. 2009. 199 (1): 43–52. https://doi.org/10.1016/j.bbr.2008.10.034
Ballermann M., Metz G.A.S., McKenna J.E., Klassen F., Whishaw I.Q. The pasta matrix reaching task: a simple test for measuring skilled reaching distance, direction, and dexterity in rats. J. Neurosci. Methods. 2001. 106 (1): 39–45.
Bouret S., Ravel S., Richmond B.J. Complementary neural correlates of motivation in dopaminergic and noradrenergic neurons of monkeys. Front. Behav. Neurosci. 2012. 6: 402. https://doi.org/10.3389/fnbeh.2012.00040
Bouret S., Richmond B.J. Sensitivity of locus ceruleus neurons to reward value for goal-directed actions. J. Neurosci. 2015. 35 (9): 4005–4014. https://doi.org/10.1523/JNEUROSCI.4553-14.2015
Bracha V., Zhuravin I.A., Bures J. The reaching reaction in the rat: a part of the digging pattern? Behav. Brain Res. 1990. 36 (1–2): 53–64. https://doi.org/10.1016/0166-4328(90)90159-C
Buitrago M.M., Ringer T., Schulz J.B., Dichgans J., Luft A.R. Characterization of motor skill and instrumental learning time scales in a skilled reaching task in rat. Behav. Brain Res. 2004. 155 (2): 249–256. https://doi.org/10.1016/j.bbr.2004.04.025
Castro A.J. The effects of cortical ablations on digital usage in the rat. Brain Res. 1972. 37 (2): 173–185.
Gasbarri A., Sulli A., Pacitti C., McGaugh J.L. Serotonergic input to cholinergic neurons in the substantia innominata and nucleus basalis magnocellularis in the rat. Neuroscience. 1999. 91 (3): 1129–1142.
Gielow M.R., Zaborszky L. The input-output relationship of the cholinergic basal forebrain. Cell Reports. 2017. 18: 1817–1830. https://doi.org/10.1016/j.celrep.2017.01.060
Hangya B., Ranade S.P., Lorenc M., Kepecs A. Central cholinergic neurons are rapidly recruited by reinforcement feedback. Cell. 2015. 162 (5): 1155–1168. https://doi.org/10.1016/j.cell.2015.07.057
Heimer L., Zahm D.S, Churchill L., Kalivas P.W., Wohltmann C. Specificity in the projection patterns of accumbal core and shell in the rat. Neuroscience. 1991. 41 (1): 89–125.
Inaba K., Mizuhiki T., Setogawa T., Toda K., Richmond B.J., Shidara M. Neurons in monkey dorsal raphe nucleus code beginning and progress of step-by-step schedule, reward expectation, and amount of reward outcome in the reward schedule task. J. Neurosci. 2013. 33 (8): 3477–3491. https://doi.org/10.1523/JNEUROSCI.4388-12.2013
Lehmann J., Nagy J.I., Atmadja S., Fibiger H.C. The nucleus basalis magnocellularis: the origin of a cholinergic projection to the neocortex of the rat. Neuroscience. 1980. 5 (7): 1161–1174.
Lin S-C., Nicolelis M.A.L. Neuronal ensemble bursting in the basal forebrain encodes salience irrespective of valence. Neuron. 2008. 59: 138–149. https://doi.org/10.1016/j.neuron.2008.04.031
Lin S-C., Brown R.E., Hussain Shuler M.G., Petersen C.C.H., Kepecs A. Optogenetic dissection of the basal forebrain neuromodulatory control of cortical activation, plasticity, and cognition. J. Neurosci. 2015. 35 (41): 13896–13903. https://doi.org/10.1523/JNEUROSCI.2590-15.2015
Luiten P.G., Gaykema R.P., Traber J., Spencer D.G. Jr. Cortical projection patterns of magnocellular basal nucleus subdivisions as revealed by anterogradely transported Phaseolus vulgaris leucoagglutinin. Brain Res. 1987. 413 (2): 229–250.
Maho C., Hars B., Edeline J.-V., Hennevin E. Conditioned changes in the basal forebrain: relations with learning-induced cortical plasticity. Psychobiology. 1995. 23 (1): 10–25. https://doi.org/10.3758/BF03327054
Mayse J.D., Nelson G.M., Avila I., Gallagher M., Lin S-C. Basal forebrain neuronal inhibition enables rapid behavioral stopping. Nat. Neurosci. 2015. 18 (10): 1501–1508. https://doi.org/10.1038/nn.4110
Mesulam M.M., Mufson E.J., Wainer B.H., Levey A.I. Central cholinergic pathways in the rat: an overview based on an alternative nomenclature (Ch1-Ch6). Neuroscience. 1983. 10 (4): 1185–1201.
Mogenson G.J., Jones D.L., Yim C.Y. From motivation to action: functional interface between the limbic system and the motor system. Prog. Neurobiol. 1980. 14 (2–3): 69–97.
Nelson A., Mooney R. The basal forebrain and motor cortex provide convergent yet distinct movement-related inputs to the auditory cortex. Neuron. 2016. 90: 1–14. https://doi.org/10.1016/j.neuron.2016.03.031
Paxinos G., Watson C. The rat brain in stereotaxic coordinates. San Diego: Acad. Press, 1998. 1–474 pp.
Peterson G.M. Mechanisms of handedness in the rat. J. Comp. Psychol. Monogr. 1934. 5: 1–67.
Raver S.M., Lin S.-C. Basal forebrain motivational salience signal enhances cortical processing and decision speed. Front. Behav. Neurosci. 2015. 9: 277. https://doi.org/10.3389/fnbeh.2015.00277
Richardson R.T., DeLong M.R. Context-dependent responses of primate nucleus basalis neurons in a go/no-go task. J. Neurosci. 1990. 10 (8): 2528–2540.
Root D.H., Melendez R.I., ZaborszkyL., Napier T.C. The ventral pallidum: Subregion-specific functional anatomy and roles in motivated behaviors. Prog. Neurobiol. 2015. 130: 29–70. https://doi.org/10.1016/j.pneurobio.2015.03.005
Saunders A., Granger A.J., Sabatini B.L. Corelease of acetylcholine and GABA from cholinergic forebrain neurons. eLife. 2015a. 4: e06412. https://doi.org/10.7554/eLife.06412
Saunders A., Oldenburg I.A., Berezovskii V.K., Johnson C.A., Kingery N.D., Elliott H.L., Xie T., Gerfen C.A., Sabatini B.L. A direct GABAergic output from the basal ganglia to frontal cortex. Nature. 2015b. 521 (7550): 85–89. https://doi.org/10.1038/nature14179
Schechtman E., Noblejas M.I., Mizrahi A.D., Dauber O., Bergman H. Pallidal spiking activity reflects learning dynamics and predicts performance. Proc. Natl. Acad. Sci. USA. 2016. 113 (41): E6281–E6289. https://doi.org/10.1073/pnas.1612392113
Schultz W., Dayan P., Montague P.R. A neural substrate of prediction and reward. Science. 1997. 275: 1593–1599.
Schultz W. Updating dopamine reward signals. Curr. Opin. Neurobiol. 2013. 23 (2): 229–238. https://doi.org/10.1016/j.conb.2012.11.012
Semba K., Reiner P.B., McGeer E.G., Fibiger H.C. Brainstem afferents to the magnocellular basal forebrain studied by axonal transport, immunohistochemistry, and electrophysiology in the rat. J Comp Neurol. 1988. 267 (3): 433-453. https://doi.org/10.1002/cne.902670311
Shidara M., Aigner T.G., Richmond B.J. Neuronal signals in the monkey ventral striatum related to progress through a predictable series of trials. J. Neurosci. 1998. 18 (7): 2613–2625.
Smith K.S., Berridge K.C., Aldridge J.W. Disentangling pleasure from incentive salience and learning signals in brain reward circuitry. Proc. Natl. Acad. Sci. USA. 2011. 108 (27): E255–264. https://doi.org/10.1073/pnas.1101920108
Taylor W.A. Change-point analysis: a powerful new tool for detecting changes. Web: http://www.variation.com/cpa/tech/changepoint.html 2000.
Tindell A.J., Berridge K.C., Aldridge J.W. Ventral pallidal representation of pavlovian cues and reward: population and rate codes. J. Neurosci. 2004. 24 (5): 1058–1069. https://doi.org/10.1523/JNEUROSCI.1437-03.2004
Tingley D., Alexander A.S., Kolbu S., de Sa V.R., Chiba A.A., Nitz D.A. Task-phase-specific dynamics of basal forebrain neuronal ensembles. Front. Syst. Neurosci. 2014. 8: 174. https://doi.org/10.3389/fnsys.2014.00174
Toates F. Motivational Systems. Cambridge: Cambridge University Press, 1986. 1–186 pp.
Toda K., Sugase-Miyamoto Y., Mizuhiki T., Inaba K., Richmond B.J., Shidara M. Differential encoding of factors influencing predicted reward value in monkey rostral anterior cingulate cortex. PLoS One. 2012. 7 (1): e30190. https://doi.org/10.1371/journal.pone.0030190
Whalen P.J., Kapp B.S., Pascoe J.P. Neuronal activity within the nucleus basalis and conditioned neocortical electroencephalographic activation. J. Neurosci. 1994. 14 (3 Pt 2): 1623–1633.
Whishaw I.Q., Pellis S.M. The structure of skilled forelimb reaching in the rat: a proximally driven movement with a single distal rotary component. Behav. Brain Res. 1990. 41 (1): 49–59.
Zaborszky L., Csordas A., Mosca K., Kim J., Gielow M.R., Vadasz C., Nadasdy Z. Neurons in the basal forebrain project to the cortex in a complex topographic organization that reflects corticocortical connectivity patterns: an experimental study based on retrograde tracing and 3D reconstruction. Cereb. Cortex. 2015. 25 (1): 118–137. https://doi.org/10.1093/cercor/bht210
Дополнительные материалы отсутствуют.
Инструменты
Журнал высшей нервной деятельности им. И.П. Павлова


