Журнал высшей нервной деятельности им. И.П. Павлова, 2019, T. 69, № 4, стр. 514-521
DICKKOPF-1 И NORRIN ПОДАВЛЯЮТ ДОЛГОВРЕМЕННУЮ ПОТЕНЦИАЦИЮ IN VIVO В ГИППОКАМПЕ КРЫС
О. Я. Иванова 1, *, Ю. В. Добрякова 1, В. А. Маркевич 1
1 Институт высшей нервной деятельности и нейрофизиологии РАН
Москва, Россия
* E-mail: gurskaya@physics.msu.ru
Поступила в редакцию 17.04.2018
После доработки 13.07.2018
Принята к публикации 24.09.2018
Аннотация
Сигнальный путь Wnt играет существенную роль в регуляции синаптической пластичности. Ранее мы показали, что хроническое подавление каскада Wnt вызывает нарушение долговременной потенциации (ДП) in vivo, в то время как хроническая оверэкрессия белка Wnt3 сопровождается кратковременным увеличением амплитуды ДП. Целью настоящей работы было изучение влияния различных доз ингибитора сигнального пути Wnt Dickkopf-1 (Dkk1) и активатора сигнального пути Wnt Norrin на ДП in vivo. Внутрижелудочковое введение как Dkk1, так и Norrin вызвало подавление ДП in vivo. При этом, как и в случае хронического подавления каскада Wnt, оба эффекта сопровождались снижением коэффициента парной фасилитации до тетанизации, свидетельствующим о вовлеченности пресинаптического аппарата в индукцию ДП. Эти результаты дают основания предположить, что в основе влияния различных модуляторов сигнального пути Wnt на синаптическую пластичность лежат общие пресинаптические перестройки.
ВВЕДЕНИЕ
Сигнальный путь Wnt является активным участником разнообразных биологических процессов как в период созревания, так и у взрослых особей [Nüsslein-Volhard, Wieschaus 1980; McMahon, Moon, 1989; Jessberger et al., 2009]. Согласно современным представлениям, каскад Wnt контролирует клеточную дифференцировку, миграцию нейронов, а также играет важную роль в модуляции работы зрелых синапсов [Маркевич и др., 2012; Oliva et al., 2013; Гурская и др., 2015] и регуляции нейрогенеза [Lie et al., 2005; Jessberger et al., 2009; Аниол и др., 2016]. На уровне целого мозга было исследовано участие каскада Wnt в процессах обучения и формирования памяти: было показано, что его подавление нарушает процессы распознавания объектов и пространственную память [Maguschak, Ressler, 2008; Jessberger et al., 2009; Fortress et al., 2013].
Роль сигнального пути Wnt в реализации синаптической пластичности ранее была объектом активного изучения на модели долговременной потенциации (ДП) in vitro в срезах гиппокампа. Было продемонстрировано, что фармакологические активаторы каскада увеличивают ДП и восстанавливают ее при предварительном нарушении, вызванном β-амилоидом, в то время как ингибирование сигнального пути вызывает противоположные эффекты [Chen et al., 2006; Cerpa et al., 2011; Vargas et al., 2014; 2015]. В проведенных ранее исследованиях мы показали, что хроническое подавление канонического каскада Wnt методом лентивирусной трансдукции приводит к нарушению параметров синаптической пластичности в модели ДП in vivo, а хроническое усиление сигнального пути Wnt обеспечивает улучшение условий для возникновения долговременной потенциации in vivo [Ivanova et al., 2017]. Настоящее исследование посвящено изучению действия ингибитора сигнального пути Wnt Dickkopf-1 (Dkk1) и активатора сигнального пути Wnt Norrin на ДП in vivo с целью сравнить результаты их кратковременного воздействия с полученными ранее эффектами долговременной модуляции каскада Wnt лентивирусами.
МЕТОДИКА
Животные
Исследование влияния сигнального пути Wnt на синаптическую пластичность проводили на половозрелых самцах крыс Вистар массой 250–350 г, полученных из питомника лабораторных животных “Пущино” (Московская обл.). Общее число использованных в эксперименте животных составило 38 особей. Животных содержали в стандартных условиях вивария при 21 ± 1°С с 12-часовым циклом сна/бодрствования и свободным доступом к пище и воде. Все эксперименты выполнены в соответствии с требованиями этической комиссии Института высшей нервной деятельности и нейрофизиологии РАН.
Электрофизиологическое исследование на наркотизированных животных in vivo
Нейрофизиологические исследования проводили в условиях острого опыта. Наркотизированным уретаном (1.75 г/кг, в/б) животным для стимуляции и регистрации вызванных ответов стереотаксически унилатерально вживляли биполярные электроды, скрученные из нихромовой проволоки в заводской изоляции диаметром 80 мкм, по следующим координатам: коллатерали Шаффера –3.0 a/p, –3.0 m/l, 3.0–3.4 d/v от брегмы; поле СА1 гиппокампа –2.7 a/p, –1.5 m/l, 2.2–2.8 d/v от брегмы [Paxinos, Watson, 2005]. Электроды фиксировали на черепе с помощью быстро полимеризующегося стоматологического пластика “Протакрил М”.
Электрофизиологическое исследование in vivo осуществляли сразу после вживления электродов на животных, находящихся в состоянии наркотического сна. Коллатерали Шаффера стимулировали прямоугольными импульсами тока длительностью 50–100 мкс. Эффективность синаптической передачи оценивали по изменению амплитудно-временных характеристик фокальных возбуждающих постсинаптических потенциалов (фВПСП) в поле СА1 (парная стимуляция: межстимульный интервал 30 мс, интервал между парами стимулов 20 с, интенсивность стимуляции 100–400 мкА). Интенсивность стимуляции подбирали так, чтобы амплитуда фВПСП на первый в паре стимул достигала 40–50% от максимальной.
В качестве агента, подавляющего каскад Wnt, использовали Dkk-1 (R&D Systems, США) в дозах 200 нг/мкл (n = 9) или 400 нг/мкл (n = = 7), а для активации каскада применяли Wnt Norrin (R&D Systems, США) в дозах 125 нг/мкл (n = 5) или 250 нг/ мкл (n = 5). Препарат либо физиологический раствор (контрольная группа, n = 12) вводили унитерально в правый желудочек головного мозга крысы в объеме 2 мкл по координатам: –0.8 a/p, 1.5 m/l, 4.0 d/v от брегмы [Paxinos, Watson, 2005].
После стабилизации ответов записывали базовую активность (60 мин). Для индукции долговременной потенциации использовали высокочастотную тетанизацию: 5 групп с промежутком 30 с по 4 пачки, в каждой 5 стимулов с частотой 100 Гц, интервал между пачками 200 мс. После тетанизации запись вели еще 180 мин.
Для каждого животного среднее значение амплитуды фВПСП до тетанизации принимали за 100%, и далее значения фВПСП после тетанизации считали относительно него. Все данные представлены в виде среднего значения ± SEM (стандартная ошибка среднего). Для статистического анализа использовали программное обеспечение Statistica 10 (StatSoft, США). Для оценки достоверности изменений применяли двухфакторный дисперсионный анализ (ANOVA) с повторными измерениями – метод с одним межгрупповым (введение вируса) и одним внутригрупповым (повторные изменения в ходе тестирования) факторами. Внутригрупповое сравнение оценивали апостериорным методом наименьших значимых различий Фишера (Fisher’s LSD post hoc test). Различия считали значимыми при p < 0.05. Изменения амплитуды долговременной потенциации в 20, 60 и 180 минут анализировали с помощью t-критерия Стьюдента.
Коэффициент парной фасилитации определяли как отношение второго вызванного фВПСП к первому. Значимость изменений усредненного по времени исходного коэффициента парной фасилитации (до тетанизации) определяли с помощью непараметрического критерия Манна–Уитни.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
Dkk1 подавляет долговременную потенциацию in vivo
В первой серии экспериментов было из-учено влияние разных доз ингибитора сигнального пути Wnt Dkk1 на ДП in vivo: группы Dkk1 200 (200 нг/мкл, т.е. 400 нг/животное) и Dkk 400 (400 нг/мкл, т.е. 800 нг/животное). В группе Dkk 200 после высокочастотной тетанизации выявлено значительное долговременное снижение амплитуды фВПСП относительно контроля на протяжении всего времени записи (180 мин) (ANOVA F(1, 13) = = 6.07, p < 0.05; рис. 1(а)). Более детальный анализ с использованием метода наименьших значимых различий подтвердил статистически достоверные отличия на протяжении всего периода регистрации между значениями в каждой временной точке после тетанизации (рис. 1(а)). При этом в группе Dkk1 400 амплитуда ДП была лишь незначительно снижена относительно контроля (ANOVA F(1, 11) = 1.03, p = 0.3; рис. 1(а)).
Рис. 1.
Долговременная потенциация (ДП) in vivo в поле CA1 гиппокампа при стимуляции коллатералей Шаффера в группах животных, получавших разные дозы (в нг/мкл): Dkk1 ((а), Dkk1 200 и Dkk1 400) и Norrin ((б), Norrin 125 и Norrin 250). Представлена динамика изменения амплитуд фВПСП в течение 60 мин до и 180 мин после высокочастотной тетанизации. Изменения показаны по отношению к базовому уровню показателей до тетанизации, принятому за 100% для каждой группы животных; для каждого момента времени представлена усредненная амплитуда фВПСП ± стандартная ошибка среднего. Достоверные отличия значений в экспериментальных группах от контроля при p < 0.05 отмечены * (Дисперсионный анализ с повторными измерениями и апостериорный анализ методом наименьших значимых различий).
Fig. 1. Long-term potentiation (LTP) in vivo in the Schaffer collateral-CA1 synapses in the groups of animals received different doses (in ng/µL) of Dkk1 ((а), Dkk1 200 and Dkk1 400) or Norrin ((б), Norrin 125 and Norrin 250). It is shown the time course of normalized fEPSP amplitudes during 60 min before (baseline) and 180 min after high frequency stimulation. Each point represents the mean ± SEM percentage from baseline. * p < 0.05 (mixed design ANOVA followed by Fisher’s LSD post hoc test).
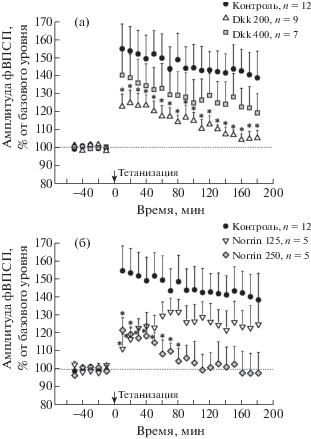
Таким образом, меньшая доза Dkk1 вызывала наиболее выраженное подавление ДП in vivo. Динамика изменений ДП при обеих дозах была сходной, хотя изменения при большей дозе Dkk1 были менее выражены.
Norrin подавляет долговременную потенциацию in vivo
Во второй серии экспериментов исследовали влияние разных доз активатора сигнального пути Wnt Norrin на ДП in vivo: группы Norrin 125 (125 нг/мкл, т.е. 250 нг/крысу) и Norrin 250 (250 нг/мкл, т.е. 500 нг/крысу). При введении животным Norrin в дозе 125 нг/мкл значимое снижение амплитуды ДП относительно контроля было выявлено лишь в первые 20 мин после тетанизации с последующим восстановлением до контрольного уровня, (ANOVA F(1, 10) = 2.00, p = 0.2; рис. 1(б)). Большая доза активатора сигнального пути Wnt (группа Norrin 250) вызвала значительное снижение амплитуды ДП на протяжении всего времени записи (ANOVA F(1, 10) = = 5.00, p < 0.05; рис. 1(б)). Однако апостериорный анализ методом наименьших значимых различий выявил статистически достоверные изменения лишь в первые 80 мин после тетанизации, а на протяжении остального времени записи значимость различий оставалась на уровне p < 0.1.
Таким образом, активатор сигнального пути Wnt Norrin, так же, как и ингибитор сигнального пути Wnt Dkk1, вызывал подавление ДП in vivo. Но в отличие от эффектов Dkk1, в случае Norrin наблюдалась прямая дозозависимость эффектов: меньшая доза вызывала кратковременное снижение амплитуды ДП, которая восстанавливалась со временем; большая же доза вызывала долговременное значимое снижение амплитуды ДП.
Dkk1 и Norrin: воздействие на пресинаптический аппарат
Для оценки вклада пресинаптического аппарата в реализацию наблюдаемых эффектов анализировали динамику изменения коэффициента парной фасилитации в поле СА1 гиппокампа при парной стимуляции до и после тетанизации.
Дисперсионный анализ значений коэффициента парной фасилитации после тетанизации не выявил достоверных отличий от контрольной группы ни в группах Dkk 200 и Dkk 400 (рис. 2(а)), ни в группах Norrin 125 и Norrin 250 (рис. 2(в)). В то же время значения коэффициента парной фасилитации до тетанизации (исходный коэффициент парной фасилитации) были снижены относительно контроля в группе Dkk 200, причем достоверность различий составила p = 0.05 (ANOVA F(1, 16) = 4.47; рис. 2(а)), а апостериорный анализ методом наименьших значимых различий выявил статистически значимые изменения в трех из пяти временных точек. В группе Norrin 250 также наблюдалась тенденция к снижению значений исходного коэффициента парной фасилитации относительно контроля (ANOVA F(1, 12) = 2.90, p = = 0.1; рис. 2 (в)). Усредненные значения исходного коэффициента парной фасилитации составили 1.36 ± 0.12 в группе Dkk 200, 1.54 ± 0.12 в группе Dkk 400 (рис. 2 (б)); 1.54 ± 0.19 в группе Norrin 125, 1.34 ± 0.21 в группе Norrin 250 (рис. 2 (г)); 1.71 ± 0.12 в контрольной группе, (рис. 2 (б, г)). Однако достоверное отличие от контроля также наблюдалось лишь в группе Dkk 200 (p < 0.05), а в группе Norrin 250 значимость различий была на уровне p = 0.1.
Рис. 2.
(а, в) – динамика изменения коэффициента парной фасилитации (коэффициента ПФ) в поле СА1 гиппокампа в течение 60 мин до и 180 мин после высокочастотной тетанизации в группах животных, получавших разные дозы (в нг/мкл): Dkk1 ((а), Dkk1 200 и Dkk1 400) и Norrin ((в), Norrin 125 и Norrin 250). (б, г) – усредненные значения коэффициента парной фасилитации до (“базовый уровень”) и после индукции ДП in vivo (“ДП”) поле СА1 гиппокампа при стимуляции коллатералей Шаффера. Достоверные отличия значений в экспериментальных группах от контроля при p < 0.05 отмечены * (непараметрический критерий Манна–Уитни).
Fig. 2. Paired pulse facilitation (PPF) ratio in the Schaffer collateral-CA1 synapses in the groups of animals received different doses (in ng/µL) of Dkk1 ((а, б) Dkk1 200 and Dkk1 400) or Norrin ((в, г) Norrin 125 and Norrin 250). (а, в) The time course of normalized PPF ratio for 60 min before (baseline) and 180 min after high frequency stimulation. Each point represents the mean ± SEM. * – p < 0.05 (mixed design ANOVA followed by Fisher’s LSD post hoc test) (б, г) The average PPF ratio in the baseline (“базовый уровень”) and after high frequency stimulation (“ДП”). * – p < 0.05 (Mann–Whitney U test).
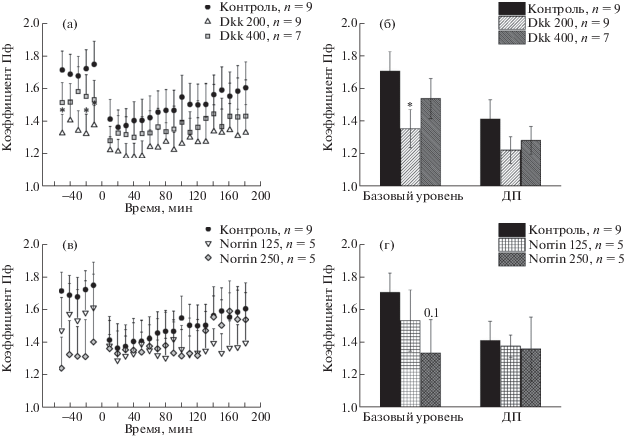
Оценивая участие пресинаптического аппарата в наблюдаемых нарушениях синаптической пластичности, интересно сравнить значения исходного коэффициента парной фасилитации (при записи базового уровня) и коэффициента парной фасилитации после индукции ДП (рис. 2 (б, г)). В контрольной группе наблюдалась тенденция к снижению значений коэффициента парной фасилитации после тетанизации (1.41 ± 0.12) относительно его значения до тетанизации (1.71 ± 0.12, p = 0.1). Схожая тенденция обнаружилась и при сравнении значений до и после тетанизации в группе Dkk 400 (1.54 ± 0.12 и 1.28 ± 0.09 соответственно, p = 0.1). В остальных группах отличий не наблюдалось даже на уровне тенденций (p > 0.1).
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Семейство белков Dkk состоит из четырех гликопротеинов длиной в 255–350 аминокислот и играет важную роль как в эмбриональном развитии, так и в функционировании взрослого мозга, а также в патогенезе ряда заболеваний, в том числе рака и болезни Альгеймера [Niehrs, 2006]. Белок Dkk1, связываясь с корецептором LRP5/6, мешает взаимодействию лигандов Wnt с рецепторами Fzd и тем самым блокирует канонический сигнальный путь Wnt [Semenov et al., 2001]. Интересно, что гибридные белки, объединяющие Dkk1 и Fzd5, являются потенциальными активаторами сигнального пути Wnt [Holmen et al., 2005]. Белок Dkk2 также может не только ингибировать, но и активировать каскад Wnt/β-катенин, взаимодействуя с Fzd8 [Wu et al., 2000] либо с Lrp6 [Brott, Sokol, 2002]. При низких уровнях Lrp5/6 Dkk2 выступает как ингибитор, конкурируя с лигандами Wnt, в то время как при высоких уровнях сигнализация Dkk2-Lrp5/6 сверхкомпенсирует отсутствие взаимодействия Wnt-Fz-Lrp5/6 и активирует сигнальный путь Wnt/β-катенин [Niehrs, 2006]. Dkk1 и Dkk2 могут действовать скоординированно для успешной модуляции канонического каскада Wnt [Wu et al., 2000].
Недавние исследования продемонстрировали участие Dkk1 в процессах обучения и формирования памяти: внутригиппокампальное введение Dkk1 препятствовало узнаванию знакомого объекта [Fortress et al., 2013), а стереотаксические инъекции антагониста Wnt Dkk1 в базолатеральную область миндалины выявили нарушение консолидации памяти без изменений кратковременной памяти [Maguschak, Ressler, 2011]. Влияние Dkk1 на синаптическую пластичность было показано на модели in vitro переживающих срезов гиппокампа транcгенных мышей с управляемой экспрессией Dkk1 в гиппокампе: обратимое усиление долговременной депрессии и подавление долговременной потенциации в течение часа записи после индукции [Marzo et al., 2016]. Последнее подтвердилось результатами настоящей работы, причем большее время регистрации (3 ч) позволило сравнить кратковременное влияние Dkk1 с эффектом хронического подавления канонического каскада Wnt, полученным ранее [Ivanova et al., 2017]. Внутрижелудочковое введение Dkk1 в дозе 400 нг/животное повлекло за собой долговременное подавление ДП in vivo в отличие от лентивирусного ингибирования сигнального пути Wnt, при котором через 3 ч различия становились незначимыми, то есть были затронуты только индукция и экспрессия ранней фазы ДП in vivo с возможностью ее восстановления. Интересно, что изменения ДП при большей дозе Dkk1 были менее выражены, чем при меньшей дозе. Подобный эффект может отражать перенасыщение рецепторов и запуск компенсаторных механизмов, однако этот вопрос требует более подробного изучения.
В предыдущих исследованиях с помощью лентивирусных конструкций мы изучали влияние на синаптическую пластичность не только хронического подавления канонического сигнального пути Wnt, но хронической оверэкспрессии белка Wnt3. Полученный эффект – усиление ДП in vivo – затронул лишь раннюю фазу ДП, что, как и в случае хронического подавления, отличалось от эффекта кратковременного воздействия активатора сигнального пути Wnt WASP, полученного Vargas и соавт. [Vargas et al, 2014]. Для того, чтобы сравнить разные подходы к усилению активации канонического каскада Wnt, мы использовали белок Norrin, богатый цистеином фактор роста, который, несмотря на структурное отличие от белков Wnt, может связываться с рецептором Fzd4 и корецептором LRP5/6, тем самым активируя канонический сигнальный путь Wnt [Xu et al., 2004; Seitz et al., 2010; Ke et al., 2013]. Мутации в гене NDP (Norrie disease protein) или генах рецепторов FZ4, LRP5 и TSPAN-12 приводят к витреоретинальным заболеваниям, таким, как болезнь Норри, семейная экссудативная витреоретинопатия и болезнь Коатса [Chang et al., 2015], а белок Norrin, помимо влияния на развитие сосудов сетчатки, обладает нейропротекторными свойствами [Seitz et al., 2010, Leopold et al., 2017]. Неожиданно эффект действия Norrin на ДП in vivo оказался противоположным эффекту действия лентивирусной конструкции, оверэкспрессирующей Wnt3, который мы наблюдали ранее. Внутрижелудочковое введение Norrin в дозах 250 нг/животное или 500 нг/животное вызвало дозозависимое снижение амплитуды ДП, сравнимое с эффектами ингибирования канонического сигнального пути Wnt [Marzo et al., 2016; Ivanova et al., 2017]. Механизмы, лежащие в основе противоположных эффектов разных способов усиления активации канонического каскада Wnt, активатором Norrin и посредством долговременного увеличения экспрессии Wnt3, пока не изучены и являются перспективной темой для дальнейшего исследования.
С целью детального изучения механизмов полученных эффектов мы анализировали коэффициент парной фасилитации как показатель работы пресинаптического аппарата. Пресинаптические перестройки связывают с изменением количества зон выброса медиатора либо вероятности выброса в каждой активной зоне [Voronin, 1993], что чрезвычайно важно для возникновения и поддержания ранней фазы ДП [Schulz et al., 1994; Kleschevnikov et al., 1997]. Снижение исходного коэффициента парной фасилитации в группах, продемонстрировавших значительное подавление ДП in vivo (группа, получавшая меньшую дозу Dkk1, и группа, получавшая большую дозу Norrin), как и в случае лентивирусного хронического подавления канонического сигнального пути Wnt, свидетельствует о нарушении работы пресинаптического аппарата. Отсутствие различий между коэффициентами парной фасилитации до и после индукции ДП in vivo свидетельствует о меньшей вовлеченности пресинаптических механизмов в ее индукцию в обеих группах, получавших Norrin, и в группе, получавшей меньшую дозу Dkk1, что и могло привести к значительному снижению амплитуды ранней фазы ДП в этих группах.
ЗАКЛЮЧЕНИЕ
В настоящей работе мы продемонстрировали влияние ингибитора сигнального пути Wnt Dkk1 и активатора сигнального пути Wnt Norrin на синаптическую пластичность в модели ДП in vivo. Как и в случае хронического подавления каскада Wnt/β-катенина, и Dkk1, и Norrin снижали амплитуду ДП. Однако меньшая доза Dkk1 вызывала долговременное значительное подавление ДП (в течение всего времени записи), а эффект применения большей дозы имел сходную динамику, но был статистически недостоверен. Меньшая доза Norrin значительно снижала амплитуду лишь в первые ДП 20 мин записи, а большая доза Norrin подавляла ДП in vivo в течение 80 мин. Снижение исходного коэффициента парной фасилитации, сопровождающее эффекты достоверного подавления ДП in vivo, позволяет предположить, что в основе наблюдаемого нарушения синаптической пластичности лежит повреждение пресинаптических функций. Сходство влияния ингибитора и активатора сигнального пути Wnt/β-катенина на ДП in vivo и пресинаптический аппарат вызывает ряд вопросов о механизмах их действия и нуждается в дальнейшем изучении.
Работа поддержана программой фундаментальных исследований президиума РАН “Механизмы интеграции молекулярных систем при реализации физиологических функций. Интеграция регуляторных влияний в обеспечении функций организма”.
Список литературы
Аниол В.А., Тишкина А.О., Гуляева Н.В. Нейрогенез и нейровоспаление: роль белков семейства Wnt. Нейрохимия. 2016. 33 (1): 5–11.
Гурская О.Я., Добрякова Ю.В., Маркевич В.А. Роль сигнального пути Wnt в регуляции работы мозга. Журн. высш. нерв. деят. 2015. 65 (4): 387–399.
Маркевич В.А., Саложин С.В., Гуляева Н.В. Участие сигнального пути WNT в пластичности гиппокампа. Росс. Физиол. Журн. им. И.М. Сеченова. 2012. 98 (12): 1460–1470.
Brott B.K., Sokol S.Y. Regulation of Wnt/LRP signaling by distinct domains of Dickkopf proteins. Mol Cell Biol. 2002. 22 (17): 6100–10.
Cerpa W., Gambrill A., Inestrosa N.C., Barria A. Regulation of NMDA-receptor synaptic transmission by Wnt signaling. J Neurosci. 2011. 31: 9466–9471.
Chang T.-H., Hsieh F.-L., Zebisch M., Harlos K., Elegheert J., Jones E.Y. Structure and functional properties of Norrin mimic Wnt for signalling with Frizzled4, Lrp5/6, and proteoglycan. Kuriyan J, ed. eLife. 2015. 4: e06554.
Chen J., Park C.S., Tang S.J. Activity-dependent synaptic Wnt release regulates hippocampal long term potentiation. J Biol Chem. 2006. 281: 11910–11916.
Fortress A.M., Schram S.L., Tuscher J.J., Frick K.M. Canonical Wnt signaling is necessary for object recognition memory consolidation. J Neurosci. 2013. 33: 12619–12626.
Holmen S.L., Robertson S.A., Zylstra C.R., Williams B.O. Wnt-independent activation of beta-catenin mediated by a Dkk1-Fz5 fusion protein. Biochem Biophys Res Commun. 2005. 328: 533–539.
Ivanova O.Y., Dobryakova Y.V., Salozhin S.V., Aniol V.A., Onufriev M.V., Gulyaeva N.V., Markevich V.A. Lentiviral Modulation of Wnt/β-Catenin Signaling Affects In Vivo LTP. Cell Mol Neurobiol. 2017. 37 (7): 1227–1241.
Jessberger S., Clark R.E., Broadbent N.J., Clemenson G.D. Jr., Consiglio A., Lie D.C., Squire L.R., Gage F.H. Dentate gyrus-specific knockdown of adult neurogenesis impairs spatial and object recognition memory in adult rats. Learn Mem. 2009. 16 (2): 147–54.
Ke J., Harikumar K.G., Erice C., Chen C., Gu X., Wang L., Parker N., Cheng Z., Xu W., Williams B.O., Melcher K., Miller L.J., Xu H.E. Structure and function of Norrin in assembly and activation of a Frizzled 4-Lrp5/6 complex. Genes Dev. 2013. 27(21): 2305–19.
Kleschevnikov A.M., Sokolov M.V., Kuhnt U., Dawe G.S., Stephenson J.D., Voronin L.L. Changes in paired-pulse facilitation correlate with induction of long-term potentiation in area CA1 of rat hippocampal slices. Neuroscience. 1997. 76: 829–43.
Leopold S.A., Zeilbeck L.F., Weber G., Seitz R., Bösl M.R., Jägle H., Fuchshofer R., Tamm E.R., Ohlmann A. Norrin protects optic nerve axons from degeneration in a mouse model of glaucoma. Sci Rep. 2017. 7 (1): 14274.
Lie D.C., Colamarino S.A., Song H.J., Désiré L., Mira H., Consiglio A., Lein E.S., Jessberger S., Lansford H., Dearie A.R., Gage F.H. Wnt signalling regulates adult hippocampal neurogenesis. Nature. 2005. 437 (7063): 1370–5.
Maguschak K.A., Ressler K.J. Beta-catenin is required for memory consolidation. Nat Neurosci. 2008. 11: 1319–1326.
Maguschak K.A., Ressler K.J. Wnt signaling in amygdala-dependent learning and memory. J Neurosci. 2011. 31: 13057–13067.
Marzo A., Galli S., Lopes D., McLeod F., Podpolny M., Segovia-Roldan M., Ciani L., Purro S., Cacucci F., Gibb A., Salinas P.C. Reversal of Synapse Degeneration by Restoring Wnt Signaling in the Adult Hippocampus. Curr Biol. 2016. 26 (19): 2551–2561.
McMahon A.P., Moon R.T. Ectopic expression of the protooncogene int-1 in Xenopus embryos leads to duplication of the embryonic axis. Cell. 1989. 58: 1075–1084.
Niehrs C. Function and biological roles of the Dickkopf family of Wnt modulators. Oncogene. 2006. 25 (57): 7469–81.
Nüsslein-Volhard C., Wieschaus E. Mutations affecting segment number and polarity in Drosophila. Nature. 1980. 287: 795–801.
Oliva C.A., Vargas J.Y., Inestrosa N.C. Wnts in adult brain: from synaptic plasticity to cognitive deficiencies. Front Cell Neurosci. 2013. 7: 224.
Paxinos G., Watson C. The Rat Brain in Stereotaxic Coordinates. Elsevier: Academic Press, 2005. ISBN: 0-12-088472-0.
Schulz P.E., Cook E.P., Johnston D. Changes in paired-pulse facilitation suggest presynaptic involvement in long-term potentiation. J Neurosci. 1994. 14: 5325–37.
Seitz R., Hackl S., Seibuchner T., Tamm E.R., Ohlmann A. Norrin mediates neuroprotective effects on retinal ganglion cells via activation of the Wnt/beta-catenin signaling pathway and the induction of neuroprotective growth factors in Muller cells. J Neurosci. 2010. 30 (17): 5998–6010.
Semënov M.V., Tamai K., Brott B.K., Kühl M., Sokol S., He X. Head inducer Dickkopf-1 is a ligand for Wnt coreceptor LRP6. Curr Biol. 2001. 11 (12): 951–61.
Vargas J.Y., Ahumada J., Arrázola M.S., Fuenzalida M., Inestrosa N.C. WASP-1, a canonical Wnt signaling potentiator, rescues hippocampal synaptic impairments induced by Aβ oligomers. Exp Neurol. 2015. 264: 14–25.
Vargas J.Y., Fuenzalida M., Inestrosa N.C. In vivo activation of Wnt signaling pathway enhances cognitive function of adult mice and reverses cognitive deficits in an Alzheimer’s disease model. J Neurosci. 2014. 34(6): 2191–2202.
Voronin L.L. Synaptic modifications and memory. An electrophysiological analysis. Springer-Verlang, Berlin Heidelberg. 1993.
Wu W., Glinka A., Delius H., Niehrs C. Mutual antagonism between dickkopf1 and dickkopf2 regulates Wnt/beta-catenin signalling. Curr Biol. 2000. 10 (24): 1611–4.
Xu Q., Wang Y., Dabdoub A., Smallwood P.M., Williams J., Woods C., Kelley M.W., Jiang L., Tasman W., Zhang K., Nathans J. Vascular development in the retina and inner ear: control by Norrin and Frizzled-4, a high-affinity ligand-receptor pair. Cell. 2004. 116 (6): 883–95.
Дополнительные материалы отсутствуют.
Инструменты
Журнал высшей нервной деятельности им. И.П. Павлова


