Журнал высшей нервной деятельности им. И.П. Павлова, 2019, T. 69, № 3, стр. 343-353
ТОРМОЖЕНИЕ ОБРАТНОГО ЗАХВАТА СЕРОТОНИНА В МЕДИАЛЬНОЙ ПРЕФРОНТАЛЬНОЙ КОРЕ ВО ВРЕМЯ ВЫРАБОТКИ УСЛОВНОРЕФЛЕКТОРНОЙ РЕАКЦИИ СТРАХА СПОСОБСТВУЕТ ФОРМИРОВАНИЮ ГЕНЕРАЛИЗОВАННОГО СТРАХА
Н. Б. Саульская 1, *, О. Э. Марчук 1
1 Федеральное государственное бюджетное учреждение науки
Институт физиологии им. И.П. Павлова Российской академии наук
Санкт-Петербург, Россия
* E-mail: nbsinfran@yandex.ru
Поступила в редакцию 27.02.2018
После доработки 16.03.2018
Принята к публикации 14.05.2018
Аннотация
На крысах линии Спрег-Доули методом внутримозгового микродиализа показано, что выработка условнорефлекторной реакции страха (сочетание условного звукового сигнала CS+ и неизбегаемого электрокожного раздражения) сопровождается подъемом уровня внеклеточного серотонина в медиальной префронтальной коре. Введение селективного ингибитора транспортеров серотонина флуоксетина (1 мкМ) в медиальную префронтальную кору во время выработки условнорефлекторной реакции страха, во-первых, увеличивало наблюдаемый в ходе этого теста подъем уровня внеклеточного серотонина в указанной области. Во-вторых, такое введение усиливало через сутки замирание животных (показатель страха) на дифференцировочный сигнал CS–, не ассоциируемый с болевым раздражением (тест на генерализацию страха), но не оказывало влияния на замирание тех же животных на условный сигнал CS+, ранее сочетавшийся с болевым раздражением (тест на проявление реакции страха). Полученные данные впервые свидетельствуют, что стимуляция серотонинергической системы медиальной префронтальной коры во время выработки условнорефлекторной реакции страха способствует последующей генерализации этой условнорефлекторной реакции, не влияя на ее формирование.
Медиальная префронтальная кора (мПК) вовлечена в регуляцию ряда важных физиологических процессов, обеспечивающих целостный ответ организма. Это внимание, рабочая память, оценка и выбор приоритетности, торможение нерелевантных поведенческих программ и проявлений импульсивности, контроль висцеральных функций и эмоциональных реакций [Кулешова и др., 2008; Arnsten et al., 2015]. Нарушения нормального функционирования мПК выявлены при некоторых формах психопатологии, в частности, при посттравматических [Pitman et al., 2012] и тревожно-депрессивных стрессовых расстройствах [Cha et al., 2014]. Одной из центральных характеристик таких расстройств является стойкая генерализация страха, выражающаяся в проявлениях страха на безопасные стимулы [Greenberg et al., 2013; Jovanovic et al., 2012; Kaczkurkin et al., 2017]. Исследования последних лет продемонстрировали, что мПК может вовлекаться в контроль генерализации страха в норме [Xu, Sudhof, 2013; Zelikowsky et al., 2013] и возможно опосредует нарушение такого контроля при патологии [Cha et al., 2014]. В частности, с использованием условнорефлекторной реакции страха (УРС – модель страха) показано, что инактивация мПК приводит к усилению замирания (показатель страха у грызунов) на обстановочные сигналы, не ассоциируемые с болевым раздражением, при неизменности замирания на ранее сочетавшиеся с болевым раздражением звуковой и обстановочный стимулы [Xu et al., 2012; Xu, Sudhof, 2013]. Исследования нейрохимических механизмов этого феномена выявили важную роль NMDA рецепторов [Vieira et al., 2015] и транскрипционного фактора CREB [Vieira et al., 2014] в мПК в формировании дифференцировочной памяти, улучшающей точность УРС, а мы недавно продемонстрировали участие нитрергической системы мПК в сдерживании генерализации этой условнорефлекторной реакции [Саульская, Судоргина, 2015]. Однако вклад других нейромедиаторных систем мПК, в частности, ее серотонинергической системы в контроль генерализации страха ранее не изучали. Вместе с тем серотонин оказывает значительное влияние на функционирование мПК, действуя на нейронную возбудимость, импульсную активность и пластичность нейронов этой области коры [Puig et al., 2005; Meunier et al., 2013].
Цель настоящего исследования заключалась в изучении участия серотонинергической системы мПК в генерализации страха, вызываемого выработкой УРС. Для этого методом прижизненного внутримозгового микродиализа было исследовано влияние введений в мПК во время выработки УРС селективного ингибитора транспортеров серотонина флуоксетина на выброс серотонина в мПК в ходе этого теста, а также на формирование УРС и на последующую генерализацию этой условнорефлекторной реакции. Таких сведений в литературе нет.
МЕТОДИКА
Работа проведена на самцах крыс линии Спрег-Доули массой 260–350 г из биоколлекции “Коллекция лабораторных млекопитающих разной таксономической принадлежности” Института физиологии им. И.П. Павлова РАН, поддержанной программой биоресурсных коллекций ФАНО России. Эксперименты выполняли в соответствии с международными нормами гуманного обращения с экспериментальными животными (директива Евросоюза № 86/609/EEC).
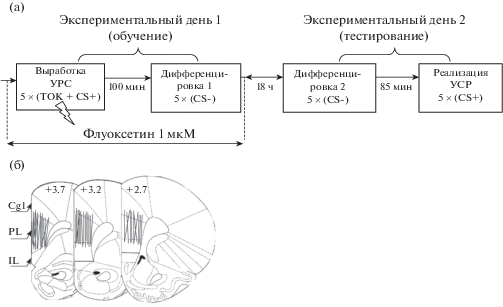
Крысам под наркозом (рометар, 1.4 мкг/100 г массы и золетил, 5 мг/100 г массы, внутримышечно) унилатерально имплантировали концентрические диализные канюли в мПК, как ранее описано [Саульская, Судоргина, 2015]. На следующий день (экспериментальный день 1 – этап обучения) каждую крысу помещали в дневную домашнюю клетку и начинали диализную перфузию мПК искусственной спинномозговой жидкостью (ИСМЖ) [Saulskaya, Fofonova, 2006] со скоростью 1 мкл/мин. Использовали диализный насос SP-300 (“Next Advance”, США). После стабилизационного периода (1.5 ч) собирали 5 порций диализата (по 15 мин каждая), после чего животных делили на три группы: две экспериментальных и одну контрольную. Схема экспериментов приведена на рис. 1(а). У животных экспериментальной группы 1 (n = 14) вырабатывали УРС: каждую крысу помещали в условнорефлекторную камеру с решетчатым покрытием пола (30 × 30 × 35 см) на 5 мин и предъявляли условный сигнал (CS+) – непрерывный тон (1000 Гц, 51 дБ, 5 раз по 10 с, интервал 1 мин), который сочетали на последней секунде звучания с электрокожным раздражением лап (1.5 мА, 1 с). После этого, не прерывая сбора диализата, животное возвращали в дневную домашнюю клетку. Спустя 100 мин проводили дифференцировочную сессию 1, целью которой было познакомить животное с безопасными сигналами: крысу помещали на 5 мин в дифференцировочную камеру (30 × 30 × 35 см, белый пол, белые стены), где предъявляли дифференцировочный сигнал (CS-) – прерывистый тон (1000 Гц, 51 дБ, 0.06 с – звук, 0.06 с – пауза; 5 раз по 10 с, интервал 1 мин), но без болевого раздражения. Через 5 мин крысу возвращали в дневную домашнюю клетку на 70 мин, после чего эксперимент завершали. На этом этап обучения заканчивался. С животными контрольной группы (n = 7) в первый день экспериментов проводили такие же процедуры, но без электрокожного раздражения. Животным экспериментальной группы 2 (n = 8) после сбора фоновых порций диализата в ИСМЖ для перфузии мПК добавляли селективный ингибитор транспортеров серотонина флуоксетин (1 мкМ, “Sigma”, США) и собирали еще 4 порции диализата (по 15 мин). Затем у животных экспериментальной группы 2 вырабатывали УРС и спустя 100 мин следовала дифференцировочная сессия 1, как описано для экспериментальной группы 1. Через 70 мин префузионную жидкость, содержащую флуоксетин, заменяли на ИСМЖ и в течение 30 мин проводили дополнительную перфузию для устранения флуоксетина из канюли и тканей мозга. После этого эксперимент завершали. Диализат собирали каждые 15 мин в течение всего эксперимента.
Рис. 1.
(а) схема эксперимента; (б) положение диализных участков канюль в медиальной префронтальной коре. Цифры – расстояние (мм) от брегмы [Paxinos, Watson. 1997]. Cg1 – цингулярная кора, поле 1. PL – прелимбическая кора. IL – инфралимбическая кора.
Fig. 1. (а) experimental design; (б) microdialysis probe placement in the medial prefrontal cortex. Numbers indicate distance (mm) from bregma [Paxinos, Watson. 1997]. Cg1 – cingulate cortex, area 1. PL – prelimbic cortex. IL – infralimbic cortex.
На следующий день (экспериментальный день 2 – этап тестирования) каждое животное помещали на 5 мин в крестообразный лабиринт (открытые рукава – 50 × 14 см; закрытые рукава – 50 × 14 × 40 см; центральная платформа – 14 × 14 см) для определения индекса тревожности (длительность пребывания в открытых рукавах лабиринта в % к длительности теста) и уровня исследовательской активности (пересечения секторов закрытых рукавов лабиринта). Затем животных подключали к диализному насосу, подающему ИСМЖ, и после стабилизационного периода (1 ч) собирали 5 порций диализата (по 15 мин) для определения фонового уровня внеклеточного серотонина в мПК у животных, подвергавшихся (экспериментальная группа 2) и не подвергавшихся (экспериментальная группа 1 и контрольная группа) введениям флуоксетина накануне. Далее с животными экспериментальных групп 1 и 2 сначала проводили дифференцировочную сессию 2 (тест на генерализацию УРС) также, как дифференцировочную сессию 1, а через 85 мин после нее проводили реализацию УРС (тест на выработанность УРС) – животное помещали в условнорефлекторную камеру на 5 мин, где ему предъявляли условный сигнал (CS+) (5 раз по 10 с, интервал 1 мин), но без электрокожного раздражения. Затем животное возвращали в дневную домашнюю клетку и эксперимент завершали. С животными контрольной группы во второй день экспериментов проводили такие же процедуры, что и с крысами экспериментальных групп. Во время поведенческих тестов регистрировали время замирания (с) на условный (СS+) или дифференцировочный (CS–) сигналы – параметр, отражающий степень выработанности УРС и степень генерализации УРС соответственно. Во время тестов осуществляли видеорегистрацию поведения на персональном компьютере с помощью веб-камеры (“Logiteс”, Китай).
На отдельной группе животных (n = 12) c имплантированными в мПК диализными канюлями исследовали эффекты введения в мПК флуоксетина на чувствительность к электрокожному раздражению. В этих экспериментах половине животных в течение 1 ч вводили 1 мкМ флуоксетина в мПК, добавляя этот препарат в перфузионную жидкость. Второй половине крыс состав перфузионной жидкости не меняли. После этого каждую крысу помещали в камеру с решетчатым покрытием пола и определяли пороги чувствительности к току (мкА) по появлению реакции при увеличении силы тока и по исчезновению этой реакции при снижении силы тока. Чувствительность каждого животного рассчитывали как среднее этих двух величин. Применяли источник питания (Б5. 120/0.75, “Акип”, Россия) с функцией постоянства тока.
Уровень серотонина в диализате мПК определяли методом высокоэффективной жидкостной хроматографии с электрохимической детекцией. Использовали хроматографическую систему (Shimadzu, Германия), описанную ранее [Saulskaya, Fofonova, 2006], но с хроматографической колонкой Kinetex, “Phenomenex”, США (150 × 2.1 мм, 2.6 мкм C18). Напряжение на рабочем электроде составляло +0.61 В. Подвижная фаза содержала: 0.1 M NaH2PO4 · 2H2O; 2 мМ KCl; 0.5 мМ ЭДТА; 0.26 мМ октилсульфоната натрия; 11% карбинола; pН 5. Поток – 0.135 мл/мин при давлении около 170 бар. Регистрацию и обработку хроматограмм осуществляли в режиме реального времени (МультиХром 1.72, Амперсенд, Россия). Содержание серотонина в каждой диализной пробе выражали в нМ/л, а затем – в процентах по отношению к собственному среднему фону. В конце экспериментов осуществляли морфологический контроль попаданий. В обработку были включены крысы с локализацией канюль в мПК (рис. 1(б); преимущественно прелимбическая кора).
Статистическую обработку проводили с использованием пакета SigmaStat (3.5). Сравнение изменений уровня внеклеточного серотонина относительно фона осуществляли методом однофакторного дисперсионного анализа (фактор – время; F-критерий). За ним следовало сравнение изменений в отдельных временны́х точках относительно фона по t-критерию Стьюдента. Межгрупповое сравнение и сравнение между разными тестами проводили методом двухфакторного дисперсионного анализа (первый фактор – группа или тест, второй фактор – время, F-критерий) с дальнейшим сравнением групп в конкретных временны́х точках по t-критерию Стьюдента. Сравнение параметров поведения осуществляли с помощью критерия Манна–Уитни.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЙ
Фоновый уровень серотонина в диализате мПК составлял в этих экспериментах 0.20 ± ± 0.01 нМ (n = 29), что близко к данным других исследователей [Mork et al., 2017; Yoshitake et al., 2014].
Выработка УРС (сочетание CS+ с неизбегаемым болевым раздражением) у животных экспериментальной группы 1 сопровождалась подъемом уровня внеклеточного серотонина в мПК относительно собственного фонового уровня перед тестом (рис. 2; F(9,117) = = 6.4, p < 0.001). Такой подъем отсутствовал у животных контрольной группы в ходе контрольного теста в выработке (рис. 2; F(9,54) = = 1.8, p = 0.08). Межгрупповое сравнение показало, что изменения уровня серотонина в мПК в ходе выработки УРС у животных экспериментальной группы 1 были достоверно выше, чем этот показатель у крыс контрольной группы (F(9,190) = 3.4, p < 0.001).
Рис. 2.
Изменения уровня внеклеточного серотонина в мПК в ходе выработки УРС и дифференцировочной сессии 1 (Выработка УРС) и во время контрольных тестов (Контроль). По оси абсцисс – время, мин; по оси ординат – уровень серотонина, % к фону; разброс на графиках – ошибка среднего; черные стрелки – начало тестов; * – p < 0.01; ** – p < 0.001 – при сравнении с собственным фоном (t-критерий); + – p < 0.05; ++ – p < 0.01 – при межгрупповом сравнении (t-критерий).
Fig. 2. Changes in extracellular serotonin levels in the medial prefrontal cortex during an acquisition of a conditioned fear response and a differentiation session 1 (Выработка УРС) and during control tests (Контроль). The axis x – time, min; the axis y – serotonin level, % of baseline. The deviation in the curves is a standard error of measurements. Black arrows – the beginning of the tests. * – p < 0.01; ** – p < 0.001 – compared with basal levels (Student t-test); + – p < 0.05; ++ – p < 0.01 – intergroup comparison (Student t-test).
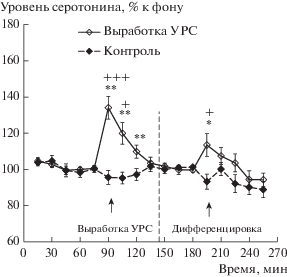
Предъявление животным экспериментальной группы 1 дифференцировочного сигнала CS- без болевого раздражения во время дифференцировочной сессии 1 вызывало небольшой рост уровня внеклеточного серотонина в мПК относительно фона перед тестом (рис. 2; F(7,91) = 3.2, p = 0.005). Но такой рост не отличался статистически значимо от уровня серотонина в мПК животных контрольной группы в ходе контрольного теста к дифференцировке 1 (рис. 2; F(7,152) = 1.4, p = = 0.22). Этот контрольный тест не сопровождался изменениями уровня серотонина в мПК (рис. 2; F(7,42) = 2.2, p = 0.06).
Введение в мПК крысам экспериментальной группы 2 селективного ингибитора транспортеров серотонина флуоксетина (1 мкМ) увеличивало уровень внеклеточного серотонина в этой области до 165 ± 8% относительно фона перед введением (рис. 3; F(8, 56) = 24.7, p < 0.001), что свидетельствует о мягкой стимуляции серотонинреактивной системы мПК данной дозой флуоксетина. Такое ведение также увеличивало подъем уровня внеклеточного серотонина в мПК, вызываемый выработкой УРС (рис. 3). А именно выработка УРС, проводимая на фоне введения флуоксетина, сопровождалась подъемом уровня внеклеточного серотонина в мПК (максимум 227 ± 8%) относительно собственного фона перед введением (F(13, 91) = 37.5, p < 0.001). Этот подъем был, кроме того, достоверен относительно уровня внеклеточного серотонина перед данным поведенческим тестом (увеличенного введением флуоксетина) (F(6, 42) = = 11.7, p < 0.001), а также по данным двухфакторного дисперсионного анализа относительно изменений уровня внеклеточного серотонина в мПК в ходе выработки УРС у животных экспериментальной группы 1, не подвергавшихся введению флуоксетина (рис. 3; максимум 134 ± 6%; F(9, 200) = 10.2, p < 0.001).
Рис. 3.
Изменения уровня внеклеточного серотонина в мПК в ходе выработки УРС и дифференцировочной сессии 1 у животных с введением в мПК 1 мкМ флуоксетина (Флуоксетин + + Выработка УРС) и у крыс без введения этого препарата (Выработка УРС). * – p < 0.01; ** – p < < 0.001 – при сравнении с фоном (t-критерий); + – p < 0.001 при межгрупповом сравнении (t-критерий); # – p < 0.05; ## – p < 0.01; ### – p < < 0.001– при сравнении с уровнем серотонина перед тестом (t-критерий). Белая стрелка – начало введения флуоксетина. Горизонтальная линия – период введения флуоксетина. Остальные обозначения как на рис. 2.
Fig. 3. Changes in extracellular serotonin levels in the medial prefrontal cortex during the acquisition of the conditioned fear response and the differentiation session 1 in rats with (Флуоксетин + Выработка УРС) and without (Выработка УРС) fluoxetine infusions (1 µM) into this brain area. * – p < 0.01; ** – p < 0.001 – compared with basal level (Student t-test); + – p < 0.001 – intergroup comparison (Student t-test); # – p < 0.05; ## – p < 0.01; ### – p < < 0.001– compared with serotonin levels before the test (Student t-test). The white arrow – the beginning of the fluoxetine infusions. The horizontal bar – the period of the fluoxetine infusions. Other notations are the same as in fig. 2.
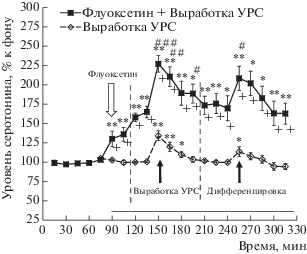
Введение 1 мкМ флуоксетина в мПК животных экспериментальной группы 2 увеличивало подъем уровня внеклеточного серотонина в этой области во время дифференцировочной сессии 1 со 114 ± 6% (максимальный подъем у животных экспериментальной группы 1 без введения препарата) до 209 ± ± 16% (максимум у крыс экспериментальной группы 2, подвергавшихся введению флуоксетина) (рис. 3; F(9, 200) = 10.2, p < 0.001). Такой подъем, наблюдаемый на фоне введения флуоксетина, был достоверен относительно уровня серотонина перед поведенческим тестом (увеличенным введением флуоксетина) (F(7,49) = 2.5, p = 0.03), а также относительно фонового уровня внеклеточного серотонина в мПК перед введением препарата (F(13, 91) = = 15.9, p < 0.001).
Введение флуоксетина в мПК крыс экспериментальной группы 2 во время выработки УРС и дифференцировочной сессии 1 (этап обучения) не оказывало влияния на фоновый уровень внеклеточного серотонина в этой области коры через сутки на этапе тестирования (0.18 ± 0.01 нМ – у крыс экспериментальной группы 1; 0.18 ± 0.02 нМ – у крыс экспериментальной группы 2; t = 0.07, p = 0.94).
Тестирование животных на проявление реакции страха через сутки после выработки УРС показало, что крысы экспериментальной группы 1 характеризуются значительным замиранием на условный сигнал CS+ (показатель выработанности УРС) во время реализации УРС (таблица 1) и меньшим замиранием на дифференцировочный сигнал CS– (показатель генерализации УРС) во время дифференцировочной сессии 2 (p < 0.001), что свидетельствует о дискриминации этими животными потенциально опасных и безопасных звуковых стимулов. Замирание этих животных на CS+ и CS– было выше, чем уровень неподвижности крыс контрольной группы во время соответствующих контрольных тестов (таблица 1; p = 0.002 для CS+ и p = = 0.014 для CS-).
Таблица 1.
Замирание (с) на дифференцировочный (CS–) и условный (CS+) сигналы во время тестирования на проявления реакции страха крыс, подвергавшихся (Экспериментальная группа 2) и не подвергавшихся (Экспериментальная группа 1) введению 1 мкМ флуоксетина в мПК во время выработки УРС; уровень неподвижности крыс контрольной группы (Контрольная группа) Table 1. Time spent freezing (s) to the differential cue (CS–) and to the conditioned cue (CS+) during the test phase of fear conditioning in rats, undergone (Экспериментальная группа 2) and not undergone (Экспериментальная группа 1) the fluoxetine infusions (1 μM) into the medial prefrontal cortex during the training phase; time spent immobility in control rats (Контрольная группа)
| Группы | Экспериментальная группа 1 | Экспериментальная группа 2 | Контрольная группа |
|---|---|---|---|
| CS– | 26 ± 3 * ++ # | 36 ± 2 + ### | 12 ± 5 |
| CS+ | 40 ± 2 ## | 43 ± 2 ### | 19 ± 2 |
| Число крыс | 14 | 8 | 7 |
Примечания. * p < 0.05 – при сравнении с экспериментальной группой 2 (критерий Манна–Уитни); + – p < 0.05, ++ – p < 0.001 – при сравнении с замиранием на CS+ (критерий Манна–Уитни); # – p < 0.05, ## – p < 0.01, ### – p < 0.001 – при сравнении с контрольной группой (критерий Манна–Уитни). Notes. * p < 0.05 – compared with the experimental group 2 (Mann–Whitney test); + – p < 0.05, ++ – p < 0.001 – compared with freezing to CS+ (Mann–Whitney test); # – p < 0.05, ## – p < 0.01, ### – p < 0.001 – compared with the control group (Mann–Whitney test).
Введение флуоксетина (1 мкМ) в мПК во время выработки УРС и дифференцировочной сессии 1 (этап обучения) животным экспериментальной группы 2 приводило через сутки после обучения (этап тестирования) к увеличению длительности замирания на дифференцировочный сигнал (CS–), не ассоциируемый с болевым раздражением, по сравнению с этим показателем крыс экспериментальной группы 1, не подвергавшихся введениям флуоксетина (таблица; p = 0.03), но не влияло на замирание этих же животных на условный сигнал (CS+), ранее сочетавшийся с болевым раздражением (таблица; p = 0.36).
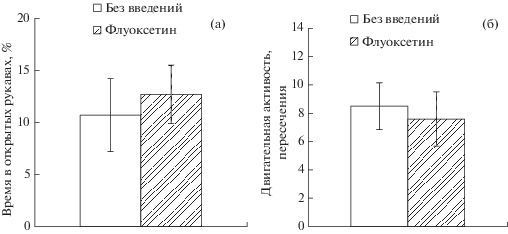
Введение 1 мкМ флуоксетина в мПК во время выработки УРС не оказывало влияния через сутки после введения на уровень тревожности животных в крестообразном лабиринте (время в открытых рукавах) (рис. 4 (а); p = 0.45 и на двигательную активность (пересечения) (рис. 4 (б); p = 0.35) в ходе этого теста.
Рис. 4.
(а) время пребывания (% к длительности теста) в открытых рукавах крестообразного лабиринта и (б) горизонтальная двигательная активность (пересечения) в закрытых рукавах крестообразного лабиринта животных, подвергавшихся (Флуоксетин) и не подвергавшихся (Без введений) введению 1 мкМ флуоксетина в мПК за сутки до теста.
Fig. 4. (а) time spent in the plus maze open arms (% of the test duration) and (б) ambulation in the plus maze closed arms (crossing lines) in rats, undergone (Флуоксетин) and not undergone (Без введений) the fluoxetine infusions (1 μM) into the medial prefrontal cortex a day before the test.
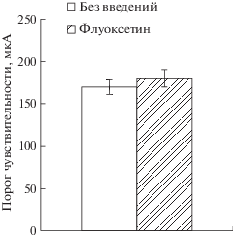
Введение 1 мкМ флуоксетина в мПК не изменяло порог чувствительности к току при тестировании через 1 час после начала введения, что соответствует по времени началу выработки УРС у животных экспериментальной группы 2, подвергавшихся введению флуоксетина (рис. 5; p = 0.6).
Рис. 5.
Порог чувствительности к электрическому току (мкМ) животных с введениями (Флуоксетин) и без введений (Без введений) 1 мкМ флуоксетина в мПК.
Fig. 5. The threshold of the electrical current sensitivity (μA) of animals with (Флуоксетин) and without (Без введений) the fluoxetine infusions (1 μM) into the medial prefrontal cortex.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
В последние два десятилетия достигнут значительный прогресс в понимании нейрофизиологических механизмов формирования, проявлений и угасания страха. Центральную роль в этих процессах отводят трем взаимодействующим структурам – амигдале, гиппокампальной формации и мПК, коллективно образующим высшее звено внутримозговой системы страха [см. Orsini, Maren, 2012]. В этой системе мПК занимает важное место, обеспечивая поддержание состояния страха (прелимбический отдел мПК) и его угашение (инфралимбический отдел мПК) [Burgos-Robles et al., 2009; Sortes-Bayon, Quirk, 2010]. Исследования последних лет, выполненные на грызунах с использованием УРС (модель страха), показали, что мПК (прелимбический и инфралимбический отделы), кроме того, участвует в тормозном контроле генерализации УРС [Xu et al., 2012; Xu, Sudhof, 2013; Zelikowsky et al., 2013], причем такое участие происходит при взаимодействии с амигдалой и гиппокампальной формацией [Rozeske et al., 2015].
Значительное влияние на функционирование структур системы страха оказывают серотонинергические сигналы из ядер шва [см. Bauer, 2015]. Продемонстрирована важность серотонинергической нейротрансмиссии в мПК, амигдале, гиппокампальной формации и в самих ядрах шва для регуляции проявлений страха при реализации УРС [Almada et al., 2009; Almada et al., 2015; Ferreira, Nobre, 2014; Leon et al., 2017], а также вклад серотонин-зависимых процессов в латеральной амигдале в формировании этой условнорефлекторной реакции [см. Bocchio et al., 2016]. Вместе с тем сведения о роли серотонинергических механизмов ЦНС в генералиазции УРС ограничены. Нам встретилась всего одна работа, в которой показано, что мыши, нокаутные по гену 5HT1А рецепторов серотонина, демонстрируют усиление выработки и генерализации УРС на обстановочные стимулы (рост замирания на условный и на дифференцировочный обстановочные сигналы) [Klemenhagen et al., 2006]. Эти данные свидетельствуют, что серотонинергическая система мозга в целом участвует в контроле генерализации УРС, хотя такое участие видимо не селективно. Результаты настоящего исследования впервые демонстрируют, что серотонинергическая система мПК может вносить вклад в этот процесс, усиливая генерализацию формирующегося страха. В пользу этого говорят данные, что стимуляция серотонинергической нейротрансмиссии в мПК введениями в эту область во время выработки УРС флуоксетина, блокирующего обратный захват серотонина, приводит впоследствии к усилению проявлений страха (замирание) на безопасный дифференцировочный сигнал (СS–), но не влияет на замирание этих же животных на потенциально опасный условный сигнал (CS+). Такая селективность действия флуоксетина по отношению к проявлениям страха на дифференцировочные раздражители у одних и тех же животных является надежным контролем, демонстрирующим, что эффекты препарата не могут быть связаны с изменением способности животных замирать при появлении признаков опасности, а также с другими факторами, способными недискриминативно отражаться на уровне замирания. В подтверждение этого проведенные нами тесты показывают, что введение флуоксетина в мПК не сказывается на чувствительности к току, а также на подвижности и тревожности животных на соответствующих этапах экспериментов. Все это вместе позволяет сделать вывод, что обнаруженные эффекты флуоксетина, по всей видимости, связаны с его действием на генерализацию УРС.
Маловероятно, что отсутствие влияния флуоксетина на выработку УРС, проявляющееся в неизменности замирания на CS+ через сутки после обучения, связано с предельным уровнем выработанности УРС, поскольку ранее, используя такую же процедуру выработки УРС, мы показали [Саульская и др., 2008], что при использовании большего числа сочетаний CS+ с болевым раздражением во время выработки (10 вместо 5), замирание животных на СS+ во время реализации УРС увеличивается до 93 ± 2% (по сравнению с 80 ± 4% в настоящей работе). При этом замирание на CS+ у отдельных животных могло достигать 98%.
Согласно данным литературы, полученным методами инактивации и разрушений, мПК в целом сдерживает генерализацию УРС [Xu et al., 2012; Xu, Sudhof, 2013; Zelikowsky et al., 2013; Rozeske et al., 2015]. А наши недавние исследования показали, что такое сдерживающее влияние мПК на генерализацию осуществляется при участии нитрергической системы этой области коры [Саульская, Судоргина, 2015]. Результаты настоящего исследования демонстрируют, что мПК может оказывать противоположные по направленности влияния, управляемые серотонинергическим входом, усиливающие генерализацию страха. Все это позволяет заключить, что мПК располагает нейрохимическими механизмами, способными двунаправленно влиять на генерализацию страха на этапе его формирования, что обеспечивает гибкий баланс генерализации и специализации страха.
Важный вопрос – какую информацию передают серотонинергические сигналы, приходящие в мПК во время выработки УРС и стимулирующие генерализацию этой условнорефлекторной реакции? Есть данные, что такие сигналы, приходящие из ядер шва, могут отражать неконтролируемость стресса [Maswood et al., 1998; Bland et al., 2003; Amat et al., 2005] (в случае выработки УРС – это неизбегаемость болевого раздражения), что делает ситуацию более аверсивной для животных. Предполагают, что запускаемый неконтролируемым стрессом выброс серотонина в мПК приводит к ослаблению тормозного влияния этой области на серотонинергические нейроны ядер шва [Puglisi-Allegra, Andolina, 2015], и это инициирует смену стратегии преодоления стресса с активной на пассивную (замирание вместо избегания) [Amat et al., 2005]. Такая перестройка поведения является оправданной в ситуации неизбегаемости наказания и, как думают [Puglisi-Allegra, Andolina, 2015], связана с усилением серотонинергических влияний ядер шва (контролируемых мПК) на амигдалу. Результаты работы позволяют предполагать, что еще одним последствием неконтролируемого стресса, опосредуемым системой “ядра шва – мПК”, является серотонин-зависимое усиление генерализации страха, отражающее, на наш взгляд, торможение стрессом одной из центральных функций мПК – сдерживающего влияния на нецелесообразные поведенческие или эмоциональные ответы [Arnsten et al., 2015].
В целом полученные данные об участии серотонинергической нейротрансмиссии в мПК в формировании генерализованного страха вносят вклад в понимание нейрохимических процессов, лежащих в основе генерализации страха в норме, и могут быть полезны при разработке подходов коррекции генерализованного страха при патологии.
ВЫВОДЫ
1. Выработка условнорефлекторной реакции страха (сочетание звукового условного сигнала и неизбегаемого болевого раздражения) сопровождается выбросом серотонина в медиальной префронтальной коре, что свидетельствует об активации ее серотонинергического входа.
2. Введение в медиальную префронтальную кору во время выработки условнорефлекторной реакции страха ингибитора транспортеров серотонина флуоксетина (1 мкМ), во-первых, увеличивает выброс серотонина в ходе этого теста, во-вторых, усиливает через сутки замирание животных (показатель страха) на дифференцировочный звуковой сигнал, не ассоциируемый с болевым раздражением, но не изменяет замирание этих же животных на потенциально опасный условный звуковой сигнал.
3. Полученные данные впервые свидетельствуют, что активация серотонинергического входа медиальной префронтальной коры во время выработки условнорефлекторной реакции страха (модель формирования страха) способствует генерализации этой условнорефлекторной реакции, не влияя на ее формирование.
Работа выполнена при финансовой поддержке Российского фонда фундаментальных исследований (проект № 16-04-00449).
Список литературы
Кулешова Е.П., Залешин А.В., Долбакян Э.Е., Григорьян Г.А., Мержанова Г.Х. Кооперативная деятельность нейронов прилежащего ядра (n. accumbens) и фронтальной коры у кошек, обученных выбору разных по ценности подкреплений. Журн. высш. нервн. деят. 2008. 58 (4): 449–457.
Саульская Н.Б., Судоргина П.В. Активность нитрергической системы медиальной префронтальной коры крыс с высокой и низкой генерализацией условнорефлекторной реакции страха. Журн. высш. нервн. деят. 2015. 65 (3): 372–381.
Саульская Н.Б., Фофонова Н.В., Судоргина П.В. Влияние блокады D2-рецепторов дофамина на уровень внеклеточного цитруллина в прилежащем ядре в ходе реализации условнорефлекторной реакции страха. Журн. высш. нервн. деят. 2008. 58 (4): 465–474.
Almada R.C., Borelli K.G., Albrechet-Souza L., Bran-dao M.L. Serotonergic mechanisms of the median raphe nucleus-dorsal hippocampus in conditioned fear: output circuit involves the prefrontal cortex and amygdala. Behav. Brain Res. 2009. 203 (2): 279–287.
Almada R.C., Coimbra N.C., Brandao M.L. Medial prefrontal cortex serotonergic and GABAergic mechanisms modulate the expression of contextual fear: intratelencephalic pathways and differential involvement of cortical subregions. Neurosci. 2015. 284 (11): 988–997.
Amat J., Baratta M.V., Paul E., Bland S.T., Watkins L.R., Maier S.F. Medial prefrontal cortex determines how stressor controllability affects behavior and dorsal raphe nucleus. Nature Neuroscience. 2005. 8 (3): 365–371.
Arnsten A.F., Raskind M.A., Taylor F.B., Connor D.F. The effects of stress exposure on prefrontal cortex: translating basic research into successful treatments for post-traumatic stress disorder. Neurobiology of Stress. 2015. 1: 89–99.
Bauer E.P. Serotonin in fear conditioning processes. Beh. Brain. Res. 2015. 277: 68–77.
Bland S.T., Hargrave D., Pepin J.L., Amat J., Watkins L.R., Maier S.F. Stressor controllability modulates stress-induced dopamine and serotonin efflux and morphine-induced serotonin efflux in the medial prefrontal cortex. Neuropsychopharnacology. 2003. 28 (9): 1589–1596.
Bocchio M., McHugh S.P., Bennerman D.M., Sharp T., Capogna M. Serotonin, amygdala and fear: assembling the puzzle. Frontiers in Neural Circuits. 2016. 10 (24): 1–15.
Burgos-Robles A., Vidal-Gonzales I., Quirk G.J. Sustained conditioned response in prelimbic prefrontal neurons are correlated with fear expression and extinction failure. J. Neurosciense. 2009. 29 (26): 8474–8482.
Cha J., Greenberg T., Carlson J.M., Dedora D.J., Hajcak G., Mujica-Parodi L.R. Circuit-wide structural and functional measures predict ventromedial prefrontal cortex fear generalization: implications for generalized anxiety disorder. J. Neurosci. 2014. 34 (11): 4043–4053.
Ferreira R., NobreM.J. Conditioned fear in low- and high- anxious rats is differentially regulated by cortical subcortical and midbrain 5-HT (1A) receptors. Neurosci. 2014. 268: 159–168.
Greenberg T., Carlson J.M., Cha J., Hajcak G., Mujica-Parodi L.R. Ventromedial prefrontal cortex reactivity is altered in generalized anxiety disorder during fear generalization. Depress. Anxiet. 2013. 30 (3): 242–250.
Jovanovic T., Kazama A., Bachevalier J., Davis M. Impaired safety signal learning may be a biomarker of PTSD. Neuropharmacology. 2012. 62 (2): 695–704.
Kaczkurkin A.N., Burton P.C., Chazin S.M., Manbeck A.B., Espenses-Sturges T., Cooper S.E., Sponheim S.R., Lissek S. Neural substrates of overgeneralized conditioned fear in PTSD. Am. J. Psychiatry. 2017. 174 (2): 125–134.
Klemenhagen K.C., Gordon J.A., David D.J., Hen R., Gross C.T. Increased fear response to contextual cues in mice lacking the 5-HT1A receptor. Neuropsychopharmacology. 2006. 31 (1): 101–111.
Leon L.A., Castro-Gomes V., Zarate-Guerrero S., Corredor K., Cruz A.P.M., Blandao M.L., Cardenas F.P., Landeira-Fernandez J. Behavioral effects of systemic, infralimbic and prelimbic injections of a serotonin 5-HT2A antagonist in Carioca high- and low-conditioned freezing rats. Frontiers in Behavioral Neuroscience. 2017. 11 (117): 1–13.
Maswood S., Barter J.E., Watkins L.R., Maier S.F. Exposure to inescapable but not escapable shock increases extracellular levels of 5-HT in the dorsal raphe nucleus of the rat. Brain Res. 1998. 783 (1): 115–20.
Meunier C.N., Amar M, Lanfumey L., Hamon M., Fossier P. 5-HT (1A) receptors direct the orientation of plasticity in layer 5 pyramidal neurons of the mouse prefrontal cortex. Neuropharmacology. 2013. 71: 37–45.
Mork A., Russel R.V., de Jong I.E.M., Smagin G. Effects of the 5-HT6 receptor antagonist idalopiridine on extracellular levels of monoamines, glutamate and acetylcholine in the rat medial prefrontal cortex. Europ. J. Pharmacol. 2017. 799: 1–6.
Orsini C.A., Maren S. Neural and cellular mechanisms of fear and extinction memory formation. Neurosci. Biobehav. Rev. 2012. 36 (2): 1773–1802.
Paxinos G., Watson C. The rat brain in stereotaxic coordinates. Compact third edition. San Diego, London, Boston, New York, Sydney, Tokyo, Toronto: Academic Press. 1997.
Pitman R.K., Rasmusson A.M., Koenen K.C., Shin L.M., Orr S.P., Gilbertson M.W., Milad M.R., Liberzon I. Biological studies of post-traumatic stress disorder. Nature Rev. Neurosci. 2012. 13 (11): 769–787.
Puig M.V., Artigas F., Celada P. Modulation of the activity of pyramidal neurons in rat prefrontal cortex by raphe stimulation in vivo: Involvement of serotonin and GABA. Cerebral Cortex. 2005. 15 (1): 1–14.
Puglisi-Allegra S., Andolina D. Serotonin and stress coping. Behavioral Brain Research. 2015. 277: 58–67.
Rozeske R.R., Valerio S., Chaudun F., Herry C. Prefrontal neuronal circuits of contextual fear conditioning. Genes Brain Behav. 2015. 14 (1): 22–36.
Saulskaya N.B., Fofonova N.V. Effects of N-Methyl-D-aspartate on extracellular citrulline level in the rat nucleus accumbens. Neurosci. Lett. 2006. 407 (1): 91–95.
Sortes-Bayon F., Quirt G.J. Prefrontal control of fear: more than just extinction. Curr. Opin. Neurobiol. 2010. 20 (2): 231–235.
Vieira P.A., Corches A., Lovelace J.W., Westbrook K.B., Mendoza M., Korzus E. Prefrontal NMDA receptors expressed in excitatory neurons control fear discrimination and fear extinction. Neurobiol. Learn. Mem. 2015. 119:52–62.
Vieira P.A., Lovelace J.W., Corches A., Rashid A.J., Josselyn S.A., Korzus E. Prefrontal consolidation supports the attainment of fear memory accuracy. Learn. Mem. 2014. 21: 394–405.
Xu W., Morishita W., Buckmaster P.S., Pang Z.P., Malenka R.C., Sudhof T.C. Distinct neuronal coding schemes in memory revealed by selective erasure of fast synaptic transmission. Neuron. 2012. 73 (5): 990–1001.
Xu W., Sudhof T.C. A neural circuit for memory specificity and generalization. Science. 2013. 339 (6125): 1290–1295.
Yoshitake S., Kuteeva E., Hokfelt T., Mennicken F., Theodorson E., Yamaguchi M., Kehr J., Yoshitake T. Correlation between the effects of local and intracerebroventricular infusions of the galanin on 5-HT release studied by microdialysis, and distribution of galanin and galanin receptors in prefrontal cortex, ventral hippocampus, amygdala, hypothalamus, and striatum of awake rats. Synapse. 2014. 68 (5): 179–193.
Zelikowsky M., Bissiere S., Hast T.A., Bennett R.Z., Abdipranoto A., Vissel B., Fanselow M.S. Prefrontal microcircuit underlies contextual learning after hippocampal loss. Proc. Natl. Acad. Sci. USA. 2013. 110 (24): 9938–9943.
Дополнительные материалы отсутствуют.
Инструменты
Журнал высшей нервной деятельности им. И.П. Павлова


