Журнал высшей нервной деятельности им. И.П. Павлова, 2019, T. 69, № 2, стр. 133-149
ИЗМЕНЕНИЕ ФУНКЦИОНАЛЬНОЙ АКТИВНОСТИ ПЕРЕДНЕЙ ПОЯСНОЙ КОРЫ ПРИ ОБСЕССИВНО-КОМПУЛЬСИВНОМ РАССТРОЙСТВЕ: ОБЗОР ФУНКЦИОНАЛЬНЫХ ТОМОГРАФИЧЕСКИХ ИССЛЕДОВАНИЙ
Р. С. Машарипов 1, Н. С. Медведева 1, А. Д. Коротков 1, *, М. В. Киреев 1, 2, С. В. Медведев 1
1 ФГБУН Институт мозга человека им. Н.П. Бехтеревой РАН
Санкт-Петербург, Россия
2 ФГБОУ ВО Санкт-Петербургский государственный университет
Санкт-Петербург, Россия
* E-mail: korotkov@ihb.spb.ru
Поступила в редакцию 27.10.2017
После доработки 19.04.2018
Принята к публикации 14.05.2018
Аннотация
Настоящая работа посвящена анализу представленных в литературе данных о патологических изменениях активности передней поясной коры при развитии обсессивно-компульсивного расстройства. Сделано предположение о том, что уровень активности передней поясной коры может изменяться в зависимости от продолжительности заболевания. При этом изменение уровня активности в покое и при вовлечении в деятельность может иметь разный характер.
ВВЕДЕНИЕ
Обсессивно-компульсивное расстройство (ОКР) – широко распространенное малокурабельное психическое заболевание, характеризующееся навязчивыми мыслями (обсессиями) и стереотипными действиями (компульсиями), совершаемыми для подавления тревоги. Распространенность в разных странах примерно равна и составляет 2.5% [Abramovich et al., 2015; Maia et al., 2008]. По этому показателю ОКР находится на четвертом месте среди других психических заболеваний [Aouizerate et al., 2004].
Несмотря на то что когнитивно-поведенческая терапия (КПТ) и фармакотерапия помогают пациентам с относительно легкой формой ОКР, у большинства пациентов эти виды терапии не приводят к ремиссии, а у пациентов с тяжелой длительной формой ОКР не вызывают улучшения симптоматики. Например, в исследовании 144 пациентов с ОКР частичная ремиссия после неинвазивной терапии составила 11–20%, а полная ремиссия 17–28%; в 35% случаев она приводила только к улучшению симптомов, и в 17% случаев такая терапия не только не приводила к ремиссии, но и не вызывала улучшения симптоматики [Skoog, Skoog, 1999]. В другом исследовании с 214 испытуемыми, проходившими КПТ и/или фармакотерапию, вероятность полной ремиссии и частичной ремиссии в течение двух лет наблюдения составила 6% и 24% соответственно [Eisen et al., 2010]. До 60% пациентов неудовлетворительно реагируют на фармакотерапию [Pallanti, Quercioli, 2006].
Известно, что эффективным способом коррекции симптоматики у пациентов с тяжелой формой ОКР, резистентных к КПТ и фармакотерапии, является нейрохирургическое вмешательство, при этом одной из наиболее часто выбираемых мишеней является передняя поясная кора [Brown et al., 2016]. Согласно результатам четырех клинических исследований [Jenike et al., 1991; Doughbery et al., 2002; Jung et al., 2006; Sheth et al., 2013], в которых было проведено обследование в сумме 124 пациентов, лечебный эффект цингулотомии наблюдался примерно от 37% до 47% случаев.
В настоящий момент механизмы развития ОКР, а также причины высокой резистентности заболевания к консервативному лечению, остаются не до конца исследованными, что препятствует разработке новых эффективных методов терапии и затрудняет поиск нейромаркеров, необходимых для ранней диагностики ОКР [см., например, Weygandt et al., 2012; Кропотов и др., 2013; Remijnse et al., 2013; Евдокимов и др., 2014; Zielinska et al., 2016; Kropotov, 2016; Bandelow et al., 2016].
Для изучения мозговых механизмов развития ОКР было проведено множество структурных и функциональных нейровизуализационных исследований, при этом среди томографических методов, позволяющих наблюдать за физиологическими процессами во всем объеме головного мозга, использовались методы однофотонной эмиссионной компьютерной томографии (ОФЭКТ), позитронно-эмиссионной томографии (ПЭТ) и функциональной магнитно-резонансной томографии (фМРТ).
Принимая во внимание высокую эффективность цингулотомии при тяжелых формах ОКР, имеет смысл подробнее рассмотреть роль передней поясной коры (ППК) в развитии ОКР. Показано, что ППК вовлечена в обеспечение различных когнитивных процессов, включая внимание [Bush et al., 2000; Wager, Smith, 2003], мотивацию и реакцию на вознаграждение [Bush et al., 2002], принятие решений [Huey et al., 2008], планирование действий [Ruby et al., 2002], инициацию и контроль выполнения моторных программ [Rauch, Jenike, 1993; Perani et al., 1995; Wiese et. al., 2004]. Но прежде всего уровень активности ППК повышается в ситуации конфликтного выбора, высокой вероятности совершения ошибки и непосредственно при совершении ошибки. Это было показано во множестве электрофизиологических и функциональных томографических исследований [см., например, Bechtereva et al., 2005; Yeung, 2013]. Таким образом, к ключевым функциям ППК можно отнести детекцию ошибок, мониторинг конфликтов и управление действиями.
Большая часть работ, посвященных ОКР, была направлена на изучение нарушения механизмов мониторинга конфликтов, детекции ошибок, подавления действий и переключения внимания в конфликтных условиях [Stern, Taylor, 2014]. Проведение исследований в этом направлении связано с предположением, что характерное для пациентов с ОКР субъективное ощущение “что-то не так” вызвано нарушением механизма оптимизации деятельности: детекции ошибок и мониторинга конфликтов [Бехтерева, 1971; Pitman, 1987]. В отечественной литературе предположение впервые было сформулировано Н.П. Бехтеревой, описавшей нарушение этого механизма при навязчивых состояниях следующим образом: “постоянная, не детерминированная ошибкой, первичная по отношению к какому-то действию активность структуры, играющей обычно роль “детектора ошибок”, все время сигнализирует о рассогласовании осуществляемого действия … с планом, независимо от правильности или ошибочности действия” [Бехтерева, 1971]. Навязчивое повторение действий при этом может представлять собой попытку устранить мнимую ошибку и подавить тревогу.
С целью выяснения роли ППК при формировании ОКР проведен анализ данных литературы, полученных с применением методов функциональной томографии. Рассматривались исследования, в которых было обнаружено изменение функциональной активности ППК у пациентов в состоянии оперативного покоя11 по сравнению с нормой, при провокации обсессивно-компульсивных симптомов и при выполнении деятельности в конфликтных условиях, а также выявившие изменение уровня активности ППК до и после терапии.
ПЭТ И ОФЭКТ В СОСТОЯНИИ ОПЕРАТИВНОГО ПОКОЯ
Оценка уровня нейрональной активности в состоянии оперативного покоя обычно проводится при помощи измерения локального мозгового кровотока (лМК) методом ОФЭКТ с использованием гексаметилпропилен-аминоксима, меченным технецием-99m или при помощи измерения скорости метаболизма глюкозы методом ПЭТ с фтор-18 дезоксиглюкозой (18ФДГ-ПЭТ). Данные, касающиеся функциональной активности ППК в состоянии оперативного покоя у пациентов с ОКР, крайне противоречивы: повышение и понижение сообщаются примерно в равном количестве работ. Среди 32 известных нам исследований, в которых напрямую сравнивался уровень активности структур мозга в состоянии оперативного покоя у пациентов с ОКР по сравнению с нормой, в 11 работах значимые различия были обнаружены в области ППК. В шести исследованиях было обнаружена гиперактивность ППК [Swedo et al., 1989; Perani et al., 1995; Zuo et al., 2013; Chang et al., 2003; Wen et al., 2013 и Diler et al., 2004], а в пяти – гипоактивность [Busatto et al., 2000; van Laere et al., 2006; Jeune et al., 2010; Киреев и др., 2011а; Millet et al., 2013].
Напротив, исследования, в которых было обнаружено изменение уровня активности ППК после курса терапии, отличаются своей повторяемостью. В целом авторы исследований связывают лечебный эффект той или иной терапии с изменением активности структур мозга, в частности, со снижением уровня активности ППК в состоянии оперативного покоя до нормальных значений. В результате анализа литературы было обнаружено 22 работы, в которых исследовалось изменение уровня активности структур мозга после определенной формы терапии: фармакотерапии [Hoehn-Saric et al., 1991; Rubin et al., 1995; Hoehn-Saric et al., 2001; Carey et al., 2004; Diler et al., 2004; Ho Pian et al., 2005; Castilo et al., 2005; Benkelfat et al., 1990; Baxter et al., 1992; Swedo et al., 1992; Perani et al., 1995; Saxena et al., 1999, 2002; Hansen et al., 2002; Kang et al., 2003; Buchsbaum et al., 2006; Apostolova et al., 2010], хирургической операции [Chang et al., 2003; Zuo et al., 2013] и когнитивно-поведенческой терапии [Baxter et al., 1992; Schwartz et al., 1996; Apostolova et al., 2010]. Снижение уровня активности ППК после фармакотерапии было обнаружено в шести работах [Hoehn-Saric et al., 1991; Baxter et al., 1992; Perani et al., 1995; Hoehn-Saric et al., 2001; Carey et al., 2004; Diler et al., 2004], а повышение только в одной [Buchsbaum et al., 2006]. Отличие результатов этой работы от предыдущих можно объяснить тем, что исследовались пациенты, резистентные к наиболее часто применяемым препаратам (селективные ингибиторы обратного захвата серотонина), с относительно большой длительностью заболевания (21.0 ± 11.8 лет), при этом примерно у половины пациентов применение атипичного нейролептика рисперидона оказало лечебный эффект.
Как нам известно, среди отечественных работ, посвященных изучению ОКР, метод 18ФДГ-ПЭТ использовался в работе Абриталина и др. [2010] [также см. Stanzhevsky et al., 2007; Поздняков и др., 2008; Корзенев и др., 2008]. Важно отметить, что в этой работе не использовалось прямое межгрупповое статистическое сравнение. У части пациентов с резистентной формой ОКР до терапии был обнаружен гиперметаболизм глюкозы в ППК, а после терапии, включающей фармакотерапию и стереотаксическое воздействие [см. также Корзенев и др., 2004], был обнаружен гипометаболизм глюкозы в ППК.
Полный перечень изменений активности мозга в состоянии покоя у пациентов с ОКР по сравнению с нормой, а также изменений уровня активности мозга после терапии по сравнению с долечебным уровнем, сообщаемый в литературе, представлен в табл. 1.
Таблица 1.
Количество статей, в которых сообщаются значимые изменения метаболизма глюкозы (ПЭТ) или мозгового кровотока (ОФЭКТ) у больных ОКР по сравнению с нормой, а также изменения активности мозга после терапии. Одна статья может присутствовать в нескольких строках и столбцах. ПФК – префронтальная кора, ДЛ – дорзолатеральная, ВЛ – вентролатеральная, ВМ – вентромедиальная, ДМ – дорзомедиальная. ОФК – орбитофронтальная кора Table 1. The number of articles in which significant differences were found comparing glucose metabolism (for PET) or cerebral flow (for SPECT) and comparing brain activity before and after therapy. The same article may be present in several rows and columns of the table. PFC – prefrontal cortex, DL – dorsolateral, VL – ventrolateral, VM – ventromedial, DM – dorsomedial, OFC – orbitofrontal cortex
| Область мозга | ПЭТ | ОФЭКТ | До vs После терапии (ПЭТ) | До vs После терапии (ОФЭКТ) |
|---|---|---|---|---|
| Префронтальная кора: | 7↑/2↓ | 8↑/4↓ | 1↑/7↓ | |
| 1) ОФК | 5↑ | 3↑/5↓ | – | |
| 2) ДЛПФК | 1↑/2↓ | – | – | |
| 3) ВЛПФК | 3↑ | – | – | |
| 3) ВМПФК | 1↑ | – | – | |
| 4) ДМПФК | 1↓ | – | – | |
| Передняя поясная кора | 3↑/4↓ | 3↑/1↓ | 1↑/2↓ | 5↓ |
| Хвостатое ядро | 4↑ | 2↑/5↓ | 2↑/5↓ | |
| Островок | 1↑/2↓ | – | 1↓ | |
| Таламус | 3↑ | 3↑/1↓ | 1↑/4↓ | |
| Теменная кора | 3↓ | 1↑/2↓ | 1↑ | |
| Височная кора | – | 1↑/2↓ | – | |
| Затылочная кора | – | 1↑/2↓ | – | |
| Задняя поясная кора | 1↑/2↓ | 1↓ | 1↓ | |
| Скорлупа | 2↑ | 1↑/1↓ | – | |
| Моторная/премоторная кора | 1↓ | – | 1↑ | |
| Прецентральная извилина | 1↓ | 1↑/2↓ | 1↑ | |
| Постцентральная извилина | – | 1↑/1↓ | 1↑ | |
| Гиппокампальная извилина | 1↓ | – | 1↓ | |
| Клин | 1↓ | – | – | |
| Язычная извилина | 1↓ | – | 1↑ | |
| Прилежащее ядро | 1↑ | – | – | |
| Бледный шар | 1↑ | 1↑ | 1↑/1↓ | |
| Мозжечок | – | 2↑/1↓ | 1↓ |
ИССЛЕДОВАНИЯ С ПРОВОКАЦИЕЙ СИМПТОМОВ
В фМРТ и ПЭТ исследованиях (с использованием радиофармпрепаратов C15O2 или H$_{2}^{{15}}$O) с провокацией обсессивно-компульсивных симптомов подбирают нейтральные и провоцирующие предъявления. Обычно используются стандартизированные предъявления: изображения загрязненных помещений или предметов, шприцов, денег (для пациентов со страхом загрязнения и заражения), электрических приборов, газовой плиты, кошелька, открытой двери (для пациентов, страдающих от навязчивых перепроверок), пустые бутылки, старые вещи, газеты, игрушки, мусорные ведра (для пациентов, страдающих от навязчивого собирательства вещей), а также определенные тексты или речи, описывающие ситуации, провоцирующие обсессивно-компульсивную симптоматику, и т.д. В некоторых исследованиях использовались индивидуализированные предъявления: фотографии, сделанные больными ОКР, вызывающие у них обсессии и компульсии.
Среди семи известных нам ПЭТ исследований с провокацией симптомов только в одном у пациентов с ОКР было обнаружено повышение активности ППК по сравнению с состоянием покоя [Rauch et al., 1994]. Из 12-ти рассмотренных нами фМРТ исследований с провокацией симптомов повышение активности ППК в ответ на провоцирующие предъявления обнаружено в шести работах [Breiter et al., 1996; Adler et al., 2000; Mataix-Cols et al., 2004; An et al., 2009; Morgieve et al., 2014; Pedapati et al., 2015]. Однако следует отметить, что в двух из этих работ повышение активности ППК обнаружено также и в норме [Mataix-Cols et al., 2004; An et al., 2009], что может говорить о неспецифичности этой реакции ППК к патологическому состоянию. В таком случае следует ориентироваться на результаты прямого межгруппового сравнения, которые, как нам известно, сообщаются в девяти работах. Среди них в четырех работах обнаружено повышение или понижение активности ППК у пациентов по сравнению с нормой в зависимости от типа провоцирующего стимула и от типа ОКР. У пациентов преимущественно c навязчивым страхом загрязнения обнаружено снижение уровня активности ППК [Agarwal et al., 2013]. Напротив, у пациентов с симптомами навязчивого накопления вещей по сравнению с пациентами без указанной симптоматики и здоровыми испытуемыми обнаружено повышение нейрональной активности в вентромедиальной префронтальной коре, включая часть ППК [An et al., 2009]. В смешанной группе пациентов повышение уровня активности ППК по сравнению с нормой наблюдалось только при предъявлении стимулов с загрязнением и стимулов, вызывающих навязчивую перепроверку действий [Mataix-Cols et al., 2004]. Однако в работе Murayama et al. [2013] у пациентов с симптомами навязчивой перепроверки действий обнаружено понижение активности ППК. Авторы объясняют полученный результат повышением активности ППК в контрольном условии (проговаривание нейтральных слов про себя). Полный перечень результатов фМРТ исследований с провокацией обсессивно-компульсивных симптомов представлен в табл. 2. Стоит также отметить, что в мета-анализе Rotge et al. [2008] исследований с провокацией симптомов, в котором рассматривалось четыре ПЭТ и четыре фМРТ исследования, у пациентов было обнаружено повышение уровня нейрональной активности в корковых и подкорковых областях, в том числе и в ППК.
Таблица 2.
Количество статей, в которых сообщаются изменения (внутригрупповые и межгрупповые) уровня активности структур мозга у больных и здоровых испытуемых при предъявлении провоцирующих стимулов, обнаруженные в фМРТ-исследованиях. Одна статья может присутствовать в нескольких строках и столбцах. ПФК – префронтальная кора, ДЛ – дорзолатеральная, ВЛ – вентролатеральная, ВМ – вентромедиальная, ДМ – дорзомедиальная. ОФК – орбитофронтальная кора Table 2. The number of articles using fMRI symptom provocation design in which significant differences (both within-subject and between-subject) in brain activity were found in OCD patients and healthy controls. The same article may be present in several rows and columns of the table. PFC – prefrontal cortex, DL – dorsolateral, VL – ventrolateral, VM – ventromedial, DM – dorsomedial, OFC – orbitofrontal cortex
| Область мозга | Норма | ОКР | ОКР vs Норма | До vs После терапии |
|---|---|---|---|---|
| Префронтальная кора | 3↑ | 10↑ | 6↑/3↓ | 4↓ |
| 1) ОФК | 3↑ | 9↑ | 4↑/3↓ | 2↓ |
| 2) ДЛПФК | 3↑ | 7↑ | 2↑/1↓ | 2↓ |
| 3) ВЛПФК | 2↑ | 5↑ | 3↑ | 1↓ |
| 3) ВМПФК | 2↑ | 2↑ | 2↑/1↓ | – |
| 4) ДМПФК | 1↑ | 3↑ | – | – |
| Височная кора | 3↑ | 9↑ | 1↑ | 1↓ |
| Теменная кора | 2↑ | 6↑ | 2↑/1↓ | 1↓ |
| Хвостатое ядро | 2↑ | 6↑ | 5↑/2↓ | 1↓ |
| Инсула | 2↑ | 6↑ | 1↑/1↓ | 1↓ |
| Передняя поясная кора | 2↑ | 5↑ | 2↑/2↓ | 3↓ |
| Мозжечок | 2↑ | 5↑ | 1↑ | 1↓ |
| Таламус | 2↑ | 3↑ | 2↑ | 1↓ |
| Прецентральная извилина | 2↑ | 3↑ | – | – |
| Постцентральная извилина | – | 3↑ | – | – |
| Амигдала | 1↑ | 3↑ | – | – |
| Зрительная кора | 2↑ | 2↑ | – | – |
| Скорлупа | 1↑ | 2↑ | 1↑ | 1↓ |
| Парагиппокампальная извилина | 1↑ | 2↑ | – | – |
| Гиппокампальная извилина | – | 2↑ | – | – |
| Предклинье | – | 2↑ | 1↓ | – |
| Клин | – | 1↑ | – | – |
| Бледный шар | – | 1↑ | 2↑ | – |
| Чечевицеобразное ядро | – | 1↑ | – | – |
| Субталамические ядра | – | 1↑ | – | – |
| Прилежащее ядро | – | 1↑ | 2↑ | 1↓ |
| Дополнительная моторная кора | – | – | 1↑ | 1↓ |
| Затылочная кора | – | 1↑ | 1↑ | 1↓ |
| Задняя поясная кора | – | – | 1↑ | – |
Кроме этого, среди пяти работ, в которых сравнивалась активность мозга при провокации симптомов до и после когнитивно-поведенческой терапии [Baioui et al., 2013; Schiepek et al., 2013; Morgieve et al., 2014; в Nakao et al., 2005a, часть испытуемых также проходили фармакотерапию] снижение уровня активности в ППК обнаружено в трех работах [Nakao et al., 2005a; Schiepek et al., 2013; Morgieve et al., 2014]. Авторы этих работ предполагают, что снижение уровня активности ППК при провокации обсессивно-компульсивных симптомов сопровождается улучшением симптоматики.
ИССЛЕДОВАНИЯ С ВЫПОЛНЕНИЕМ И ПОДАВЛЕНИЕМ ДЕЙСТВИЙ В КОНФЛИКТНЫХ УСЛОВИЯХ
Для создания конфликтных условий или условий т.н. когнитивного конфликта, требующих активного вовлечения механизмов детекции ошибок, мониторинга конфликтов и подавления действий, использовались: тест “GO-NOGO” [Page et al., 2009; Maltby et al., 2005; Roth et al., 2007; Tolin et al., 2014] и его модификации [Berlin et al., 2015; Morein-Zamir et al., 2016], Стоп-тест [Woolley et al., 2008; Rubia et al., 2010; De Wit et al., 2012; Kang et al., 2012], Струп тест [Nakao et al., 2005a, 2005b; van den Heuvel et al., 2005; Nabeyama et al., 2008; Nakao et al., 2009; Schlosser et al., 2010], моторный Струп тест или т.н. тест Саймона [Woolley et al., 2008; Page et al., 2009; Rubia et al., 2011; Marsh et al., 2014], Фланкерный тест [Fitzgerald et al., 2005; Huyser et al., 2011; Grutzmann et al., 2014] и его модификация [Stern et al., 2011], задание с интерференцией множества источников (англ. “Multiple Source Interference Task – MSIT”) [Yucel et al., 2007; Fitzgerald et al., 2010, 2013], модификация задания с непрерывным выполнением (англ. “Сontinuous Performance Task – CPT”, имеющая градацию уровней когнитивного конфликта, англ. “AX-CPT”) [Ursu et al., 2003; Ursu, Carter, 2009]. Для всех этих исследований характерно сравнение уровня активности структур мозга при правильном выполнении конгруэнтных (в которых нет конфликта между действиями) и инконгруэнтных проб (в которых возникает конфликт), а также при совершении ошибок в разных пробах (при неспособности подавить действие или при выполнении действия, когда его необходимо подавить). В сводной табл. 3 перечислены изменения нейрональной активности, обнаруженные при сравнении инконгруэнтных и конгруэнтных проб. Во-первых, рассматривались инконгруэнтные и конгруэнтные пробы в Фланкерном тесте, Струп тесте, тесте Саймона, тестах “MSIT” и “AX-CPT”. Во-вторых, “GO” пробы считались соответствующими конгруэнтным пробам (в “GONOGO” тесте и Стоп-тесте), а “NOGO” и Стоп-пробы считались соответствующими ингонкруэнтным пробам. В сумме нами было обнаружено 29 фМРТ-исследований, в которых использовались перечисленные экспериментальные задания. Среди них в 23 работах сообщаются результаты прямого межгруппового сравнения.
Таблица 3.
Количество статей, в которых сообщаются изменения (внутригрупповые и межгрупповые) нейрональной активности при сравнении инконгруэнтных и конгруэнтных проб. Одна статья может присутствовать в нескольких строках и столбцах Table 3. The number of articles in which significant differences (both within-subject and between-subject) in neural activity were found comparing incongruent and congruent trials. The same article may be present in several rows and columns of the table
| Область мозга | Норма | ОКР | ОКР vs Норма |
|---|---|---|---|
| Префронтальная кора | 17↑/2↓ | 17↑/1↓ | 7↑/7↓ |
| Передняя поясная кора | 14↑ | 9↑ | 4↑/7↓ |
| Теменная кора | 11↑ | 11↑ | 1↑/6↓ |
| Моторная/премоторная кора | 9↑ | 9↑ | 5↑/1↓ |
| Затылочная кора | 9↑ | 8↑ | 2↑/2↓ |
| Височная кора | 7↑ | 7↑ | 1↑/6↓ |
| Мозжечок | 7↑ | 7↑ | 3↑/4↓ |
| Инсула | 7↑ | 6↑ | 2↑/2↓ |
| Хвостатое ядро | 6↑ | 5↑ | 4↑/4↓ |
| Таламус | 4↑ | 3↑ | 1↑/1↓ |
| Предклинье | 3↑/1↓ | 2↑ | 1↑/1↓ |
| Веретенообразная извилина | 4↑ | 2↑ | 3↓ |
| Скорлупа | 3↑ | 2↑ | 2↑/2↓ |
| Прецентральная извилина | 1↑ | 4↑ | 4↑/2↓ |
| Задняя поясная кора | 1↑/1↓ | 1↑ | 3↑ |
| Крючок | 2↑ | 1↑ | 1↑ |
| Постцентральная извилина | 1↑ | 2↑ | 1↓ |
| Гиппокампальная извилина | 1↑ | 2↑ | 1↑/1↓ |
| Клин | 1↑ | 1↑ | – |
| Бледный шар | – | 1↑ | – |
| Парагиппокампальная извилина | – | 1↑ | 1↑ |
Результаты межгруппового сравнения активности мозга в условиях когнитивного конфликта довольно противоречивы. В семи работах обнаружено снижение уровня активности у пациентов по сравнению с нормой [Nakao et al., 2005b; Yucel et al., 2007; Nabeyama et al., 2008; Page et al., 2009; Rubia et al., 2010; 2011; Kang et al., 2012], а в четырех работах – повышение [Maltby et al., 2005; Ursu, Carter, 2009; Fitzgerald et al., 2010; Schlosser et al., 2010]. Кроме этого, в одной работе после успешного курса фармакотерапии и КПТ у пациентов было обнаружено снижение уровня активности ППК по сравнению с долечебным уровнем.
В десяти известных нам работах описывались изменения нейрональной активности, обнаруженные при сравнении проб с совершением ошибки и проб с правильным выполнением деятельности (полный перечень результатов см. в сводной табл. 4). Чаще всего при совершении ошибки регистрируется изменение уровня активности ППК у пациентов по сравнению с нормой: в пяти работах повышение активности [Ursu et al., 2003; Maltby et al., 2005; Fitzgerald et al., 2005; Huyser et al., 2011; Grutzman et al., 2014] и в одной понижение [Woolley et al., 2008; те же данные в Rubia et al., 2010].
Таблица 4.
Количество статей, в которых сообщаются изменения (внутригрупповые и межгрупповые) нейрональной активности при совершении ошибки. Одна статья может присутствовать в нескольких строках и столбцах Table 4. The number of articles in which significant differences (both within-subject and between-subject) in neural activity were found when mistakes are made. The same article may be present in several rows and columns of the table
| Область мозга | Норма | ОКР | ОКР > Норма |
|---|---|---|---|
| Передняя поясная кора | 9↑ | 8↑ | 5↑/1↓ |
| Префронтальная кора | 8↑/1↓ | 8↑/1↓ | 2↑/3↓ |
| Инсула | 6↑ | 6↑ | 1↑ |
| Моторная/премоторная кора | 5↑ | 6↑ | – |
| Височная кора | 5↑ | 4↑ | 1↓ |
| Теменная кора | 5↑ | 4↑ | – |
| Затылочная кора | 1↑ | 3↑ | 1↓ |
| Задняя поясная кора | – | 3↑ | 1↑ |
| Таламус | 2↑ | 1↑ | 1↓ |
| Предклинье | 2↑ | 1↑ | – |
| Прецентральная извилина | 2↑ | 1↑ | – |
| Мозжечок | – | 2↑ | 1↓ |
| Хвостатое ядро | 2↑ | – | 1↓ |
| Веретенообразная извилина | 1↑ | 1↑ | 1↓ |
| Скорлупа | 1↓ | 1↓ | 1↓ |
| Гиппокампальная извилина | – | 1↑ | 1↓ |
| Клин | 1↑ | – | – |
| Бледный шар | – | – | 1↓ |
| Амигдала | – | – | 1↑ |
Здесь также необходимо упомянуть результаты нескольких мета-анализов, касающиеся уровня активности ППК. В работе Menzies и др. [2008] анализировалось 15 фМРТ-исследований с разными экспериментальными заданиями, включая провокацию симптомов и создание условий когнитивного конфликта. Статистически значимые различия независимо от направления эффекта обнаружены в ряде структур, в том числе и в ППК. В мета-анализе Eng и др. [2015] определялись общие изменения среди фМРТ-исследований с разными видами экспериментальных заданий. Чрезмерная активность ППК была обнаружена при выполнении деятельности в условиях когнитивного конфликта (для мета-анализа использовалось семь работ), а снижение ее активности наблюдается при необходимости быстро переключиться с одного вида деятельности на другой (пять работ). В мета-анализе 18 фМРТ-исследований [Norman et al., 2016] в пробах с подавлением действий и/или в инконгруэнтных пробах у взрослых пациентов с ОКР также было обнаружено понижение уровня активности ППК. В противоположность этому результату в мета-анализе восьми фМРТ-исследований подростков с ОКР [Brem et al., 2012] было обнаружено повышение уровня активности ППК по сравнению с нормой.
В целом анализ данных функциональных томографических исследований, касающихся уровня активности ППК, показал следующее (см. табл. 5):
Таблица 5.
Количество статей, в которых при межгрупповом статистическом сравнении, а также при сравнении активности мозга до и после терапии были обнаружены значимые различия в передней поясной коре (ППК) Table 5. The number of articles in which significant differences in brain activity were found in the anterior cingulate cortex (ACC) using between-group comparison and comparing brain activity before and after therapy
| ОКР vs Норма | До vs После терапии | |
|---|---|---|
| Уровень активности ППК в покое (ПЭТ, ОФЭКТ) | 6 ↑/5↓ | 1 ↑/7↓ |
| Провокация симптомов (фМРТ) | 2↑/2↓ | 3↓ |
| Инконгруэнтные пробы, Подавление действий (фМРТ) | 4↑/7↓ | 1↓ |
| Совершение ошибок (фМРТ) | 5↑/1↓ | – |
1. В состоянии оперативного покоя наблюдаются разнонаправленные изменения уровня активности в ППК по сравнению с нормой (повышение в шести работах и понижение в пяти работах).
2. Улучшение состояния пациентов после КПТ и/или фармакотерапии, как правило, сопровождается снижением уровня активности ППК.
3. В исследованиях с провокацией обсессивно-компульсивных симптомов в половине работ наблюдается повышение активности ППК, и в другой половине, соответственно, снижение. После КПТ сообщается снижение уровня активности ППК.
4. В условиях когнитивного конфликта (в инконгруэнтных пробах) межгрупповое сравнение дает противоречивые результаты. В четырех работах обнаружено повышение уровня активности ППК у пациентов по сравнению с нормой, а в семи работах – понижение.
5. При совершении ошибки межгрупповое сравнение выявило повышение уровня активности ППК у пациентов по сравнению с нормой в пяти работах, а снижение только в одной.
СВЯЗЬ МЕЖДУ УРОВНЕМ ЛОКАЛЬНОЙ АКТИВНОСТИ ППК И ДЛИТЕЛЬНОСТЬЮ ОКР
Анализ литературы указывает на противоречивость данных функциональной томографии о характере изменений активности ППК при ОКР. Исследования, в которых использовались магнитно-резонансная спектроскопия, МР-морфометрия, диффузионная МРТ также характеризуются противоречивостью данных относительно изменений функционального состояния ППК и других структур мозга при ОКР [см. обзорные работы Del Casale et al., 2011; Eng et al., 2015; Menzies et al., 2008; Киреев и др., 2013; Rotge et al., 2010; Piras et al., 2013; Nakao et al., 2014; Koch et al., 2014; Chen et al., 2013; Naaijen et al., 2015; Saxena, Rauch, 2000]. Разнородность результатов нейровизуализационных исследований обусловливает существование множества гипотез относительно этиологии ОКР. В настоящий момент нет общепризнанного взгляда на мозговые механизмы развития ОКР. Многие исследователи придерживаются гипотезы об изменении активности в кортико-стриато-таламических сетях. Но наиболее перспективными, на наш взгляд, являются представления о нарушении работы мозгового механизма детекции ошибок как основе формирования ОКР и его устойчивости к фармакотерапии. Согласно этим представлениям, при нарушении базового мозгового механизма “детектор ошибок” становится “детерминатором ошибок” [Бехтерева 1971; Медведев и др., 2003]. Предположительный механизм работы “детектора ошибок” заключается в сравнении поступающей информации с внутренней информацией, хранящейся в релевантной матрице памяти (краткосрочной и долгосрочной), в регистрации ошибки или рассогласования (отклонения от матрицы) и передаче управляющих сигналов о наличии ошибки другим структурам исполнительного контроля (например, префронтальной коре и стриатуму) для коррекции действий и для устранения ошибки. В норме механизм детекции ошибок обеспечивает оптимизацию и автоматизированность выполнения действий. При нарушении этого механизма происходит ложная регистрация ошибки. Структуры, выполняющие функцию “детектора ошибок”, посылают ложные сигналы о наличии отклонений в префронтальную кору, что приводит к навязчивым мыслям (обсессиям), и в стриатум, что приводит к выполнению моторных/поведенческих программ, необходимых для устранения ошибки (ритуализированные стереотипные действия, т.н. компульсии). В первом случае механизм детекции ошибок стабилизирует нормальное состояние, во втором случае он стабилизирует патологическое состояние, препятствуя воздействию когнитивно-поведенческой терапии и фармакотерапии, чем объясняется высокая резистентность пациентов к лечению при ОКР. Как уже было замечено ранее, ключевым звеном нейроанатомической системы, участвующей в обеспечении этого механизма, является ППК [Dehaene et al., 1994; Carter et al., 1998, 1999; Botvinick et al., 1999, 2001, 2004; van Veen et al., 2001; Bechtereva et al., 2005; Киреев и др., 2011б], что позволяет объяснить высокую эффективность цингулотомии при ОКР: разрушаются структуры ППК, которая уже не может полноценно выполнять свои функции [Медведев и др., 2003].
Ранее, в проведенной в Институте мозга человека им. Н.П. Бехтеревой работе, у больных с тяжелым фармакорезистентным длительным ОКР был обнаружен гипометаболизм в ППК [Киреев и др., 2011а]. Как показывает анализ данных литературы, результаты оценки изменений активности ППК при ОКР противоречивы (см. табл. 5). Для того чтобы объяснить разноречивость, нами было предположено, что функциональная активность ППК может быть связана с длительностью заболевания. В литературе мало данных по пациентам с ОКР с большой длительностью и проведено мало исследований, изучавших изменения функциональной активности структур мозга в течении болезни. Дебют заболевания не сообщается примерно в половине исследований [Abramovich et al., 2015]. Пренебрежение этими данными может приводить к неправильной интерпретации полученных результатов. Некоторые исследователи считают, что существуют нейрофизиологические различия между пациентами с ранней и поздней манифестацией заболевания [Roth et al., 2005; Hwang et al., 2007], исходя из этого, предлагается разделение ОКР на два подтипа с ранним и поздним дебютом. Но такое разделение не позволяет объяснить противоречивость нейровизуализационных данных, так как, например, повышение активности ППК сообщается не только у пациентов с ранним дебютом [Swedo et al., 1989; Zuo et al., 2013], но и с относительно поздним дебютом [Perani et al., 1995]. Объяснение противоречивости данных следует попытаться объяснить не только ранним или поздним дебютом заболевания, но и самой длительностью заболевания. Игнорирование дебюта заболевания также приводит и к игнорированию длительности заболевания.
Обращаясь к данным литературы, нам удалось обнаружить только две работы, в которых целенаправленно исследовалось влияние длительности заболевания на уровень активности ППК. Во-первых, в ОФЭКТ исследовании Busatto et. al. [2001] у больных с ранней манифестацией заболевания было обнаружено понижение мозгового кровотока в покое в ряде областей мозга, включая левую переднюю поясную кору (ПБ 32), по сравнению с нормой и пациентами с поздней манифестацией. Авторы подчеркивают, что наблюдаемый эффект связан именно с ранним или поздним дебютом заболевания. По нашему мнению, он также может быть объяснен продолжительностью заболевания. Средний возраст исследуемых был примерно одинаков и составлял 31.2 лет и 33.1 лет, средний возраст дебюта – 7.7 лет и 22.8 лет соответственно. Отсюда длительность заболевания для двух групп отличалась примерно в два раза. С этой точки зрения можно предположить, что в процессе патологических функциональных перестроек мозга со временем скорость кровотока в ППК в состоянии оперативного покоя постепенно падает по сравнению с нормой. Также в пользу этого говорит обнаруженная в исследовании значимая негативная корреляция между лМК в правой ППК и длительностью заболевания. Во-вторых, в работе Huyser и др. [2011] было показано, что активность в ППК при совершении ошибок увеличивается с возрастом подростков с ОКР (возраст от 9 до 19 лет).
Далее, исходя из выдвинутого предположения, внимание было обращено на характеристики выборок пациентов в анализируемых функциональных томографических исследованиях, а именно, на возраст, дебют и длительность заболевания. В трех ПЭТ-исследованиях, в которых обнаружили гиперметаболизм глюкозы, длительность заболевания в среднем составляла 7.5 лет [Perani et al., 1995], 8.6 лет [Zuo et al., 2013] и 18.7 лет [Swedo et al., 1989]. Среди исследований, в которых был выявлен гипометаболизм глюкозы, средняя длительность заболевания сообщается в двух исследованиях: 23.2 года [van Laere et al., 2006] и 30.8 лет [Jeune et al., 2010]. Кроме этого, в исследовании Киреев и др. [2011а] сообщается, что исследовались пациенты с тяжелым резистентным длительным ОКР. Также нами было замечено, что в исследованиях с выраженным гиперметаболизмом возраст пациентов варьировался от 22 до 27.8 лет, а в трех других исследованиях от 31 до 44 лет (см. схему на рис. 1). В ОФЭКТ исследовании, в котором было установлено понижение лМК в ППК [Busatto et al., 2000], исследовались пациенты с большой длительностью заболевания – 16.9 лет. В других ОФЭКТ-исследованиях, определивших повышение лМК в ППК, длительность составляла 6.3 лет [Chang et al., 2003] и 2.33 года [Wen et al., 2013], а в работе Diler et al. [2004] длительность заболевания не сообщается, но известно, что исследовались дети со средним возрастом 13.17 лет. Исходя из этого можно предположить, что на начальных этапах развития ОКР в состоянии оперативного покоя имеет место гиперактивность ППК, которая затем сменяется гипоактивностью, возможно из-за истощения нервной ткани и перераспределения функций “детектора ошибок” между другими интактными областями мозга, поэтому лечебное повреждение ППК при цингулотомии не только эффективно при тяжелых резистентных формах ОКР, но и практически не приводит к когнитивным нарушениям.
Рис. 1.
Схема ПЭТ исследований, в которых сообщаются значимые изменения метаболизма глюкозы в ППК при прямом межгрупповом сравнении. Слева указан дебют заболевания, справа возраст пациентов. В квадратах указано направление эффекта и примерная длительность заболевания.
Fig. 1. Schematic diagram of PET studies reported significant between-group differences in glucose metabolism in the anterior cingulate cortex (ACC). The disease onset is indicated on the left side. The age of patients is indicated on the right side. The direction of an effect and approximate duration of the disease are presented in the boxes.
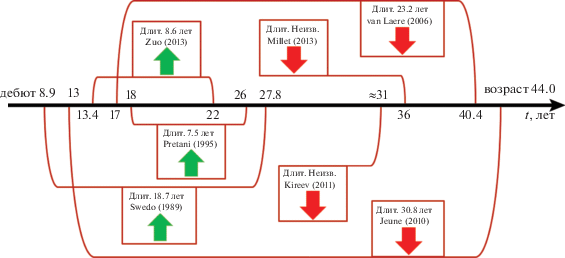
Также можно отметить, что в единственном известном нам фМРТ-исследовании [Wooley et al., 2008] (в статье Rubia et al., [2010] сообщаются те же результаты), показавшем снижение уровня функциональной активности в ППК по сравнению с нормой при совершении ошибок, исследовали подростков (средний возраст 14.3), в отличие от других работ, в которых было обнаружено повышение активности (средний возраст в этих исследованиях от 32 до 39 лет, длительность заболевания не сообщается ни в одном из них) [Maltby et al., 2005; Fitzgerald et al., 2005; Ursu et al., 2003; Huyser et al., 2011; Grutzman et al., 2014]. Возможно, с течением болезни активность ППК при вовлечении в деятельность и/или при совершении ошибки, наоборот, возрастает с увеличением длительности заболевания.
ЗАКЛЮЧЕНИЕ
Настоящий обзор позволяет нам сформулировать гипотезу о том, что функциональная активность ППК изменяется в процессе развития ОКР. В состоянии оперативного покоя у пациентов гиперактивность ППК сменяется гипоактивностью с увеличением длительности заболевания. А при реализации деятельности в условиях когнитивного конфликта и при совершении ошибок имеет место обратный процесс: повышение уровня активности ППК с увеличением длительности заболевания. В дальнейшем для экспериментальной проверки этой гипотезы требуется проведение сочетанного ПЭТ-фМРТ исследования на одной выборке пациентов.
Список литературы
Абриталин Е.Ю., Корзенев А.В., Станжевский А.А., Шамрей В.К., Труфанов Г.Е., Тютин Л.А., Поздняков А.В., Костеников Н.А., Тарумов Д.А., Бойков И.В. Применение методов функциональной нейровизуализации у больных с резистентными формами тревожнообсессивных и депрессивных расстройств. Мед. Виз. 2010. 5: 83–89.
Бехтерева Н.П. Нейрофизиологические аспекты психической деятельности человека. М.; Л.: Медицина. 1971. 120 с.
Евдокимов С.А., Пронина М.В., Полякова Г.Ю., Пономарев В.А., Поляков Ю.И., Кропотов Ю.Д. Анализ независимых компонент вызванных потенциалов пациентов с установленными диагнозами шизофрения, обсессивно-компульсивное и депрессивное расстройство. Журн. высш. нерв. деят. им. И.П. Павлова. 2014. 64 (5): 500–509.
Киреев М.В., Коротков А.Д., Поляков Ю.И., Аничков А.Д., Медведев С.В. ПЭТ-исследование функционального состояния мозга при навязчивых состояниях. Профил. и клин. мед. 2011а. 3 (40): 245–248.
Киреев М.В., Коротков А.Д., Поляков Ю.И., Аничков А.Д., Медведев С.В. Мозговой механизм детекции ошибок – ПЭТ-исследование. Росс. физиол. журнал им. И.М. Сеченова. 2011б. 97 (10): 1060–1065.
Киреев М.В., Медведева Н.С., Коротков А.Д., Поляков Ю.И., Аничков А.Д., Медведев С.В. Патология передней поясной извилины при обсессивно-компульсивных расстройствах. Физиол. чел. 2013. 39 (1): 54–57.
Корзенев А.В., Гайдар Б.В., Незнанов Н.Г., Шамрей В.К., Вовин Р.Я., Скоромец Т.А., Парфенов В.Е., Шустин В.А., Тютин Л.А., Станжевский А.А., Абриталин Е.Ю. О возможности преодоления терапевтической резистентности малокурабельных тревожно-обсессивных расстройств с использованием методов функциональной стереотаксической нейрохирургии. Психиатрия. 2004. 5 (11): 14–25.
Корзенев А.В., Станжевский А.А., Тютин Л.А., Поздняков А.В., Шамрей В.К., Костеников Н.А., Труфанов Г.Е., Фокин В.А., Абриталин Е.Ю. Функциональная нейровизуализация в диагностике и контроле лечения тревожно-обсессивных расстройств. Мед. Радилог. Рад. Без. 2008. 53 (5): 48–56.
Кропотов Ю.Д., Пронина М.В., Поляков Ю.И., Пономарев В.А. Функциональные биомаркеры в диагностике психических заболеваний: Когнитивные вызванные потенциалы. Физ. чел. 2013. 39 (1): 14–25.
Медведев С.В., Аничков А.Д., Поляков Ю.И. Физиологические механизмы эффективности стереотаксической билатеральной цингулотомии в лечении устойчивой психической зависимости при наркомании. Физ. чел. 2003. 29 (4): 117–123.
Поздняков А.В., Тютин Л.А., Станжевский А.А., Корзенев А.В., Костеников Н.А., Шамрей В.К., Абриталин Е.Ю. Применение позитронной эмиссионной томографии с 18F-ФДГ в диагностике и оценке эффективности лечения резистентных форм тревожно-обсессивных расстройств. Вест. Рент. Рад. 2008. 1: 24–29.
Ухтомский А.А. Физиологический покой и лабильность как биологические факторы. Ученые записки ЛГУ. 1937. 3 (17): 213–226.
Abramovitch A., Mittelman A., Tankersley A.P., Abramowitz J.S., Schweiger A. Neuropsychological investigations in obsessive-compulsive disorder: A systematic review of methodological challenges. Psych. Res. 2015. 228 (1): 112–120.
Adler C.M., McDonough-Ryan P., Sax K.W., Holland S.K., Arndt S., Stralowski S.M. fMRI of neuronal activation with symptom provocation in unmedicated patients with obsessive-compulsive disorder. J. Psychiatr. Res. 2000. 34: 317–324.
Agarwal S.M., Jose D., Baruah U., Shivakumar V., Kalmady S.V., Venkatasubramanian G., Mataix-Cols D., Reddy Y.C.J. Neurohemodynamic correlates of washing symptoms in obsessive-compulsive disorder: A pilot fMRI study using symptom provocation paradigm. Indian J. Psychol. Med. 2013. 35 (1): 67–74.
An S.K., Mataix-Cols D., Lawrence N.S., Wooderson S., Giampietro V., Speckens A., Brammer M.J., Phillips M.L. To discard or not to discard: The neural basis of hoarding symptoms in obsessive-compulsive disorder. Mol. Psych. 2009. 14 (3): 318–331.
Aouizerate B., Guehl D., Cuny E., Rougier A., Bioulac B., Tignol J., Burbaud P. Pathophysiology of obsessive-compulsive disorder: A necessary link between phenomenology, neuropsychology, imagery and physiology. Prog. Neurobiol. 2004. 72 (3): 195–221.
Apostolova I., Block S., Buchert R., Osen B., Conradi M., Tabrizian S., Gensichen S., Schroder-Hartwig K., Fricke S., Rufer M., Weiss A., Hand I., Clausen M., Obrocki J. Effects of behavioral therapy or pharmacotherapy on brain glucose metabolism in subjects with obsessive-compulsive disorder as assessed by brain FDG-PET. Psych. Res. Neuroimaging. 2010. 184: 105–116.
Baioui A., Pilgramm J., Kagerer S., Walter B., Vaitl D., Stark R. Neural correlates of symptom reduction after CBT in obsessive-compulsive washers – An fMRI symptom provocation study. J. Obsessive-Compulsive and Rel. Dis. 2013. 2 (3): 322–330.
Bandelow B., Baldwin D., Abelli M., Altamura C., Dell’Osso B., Domschke K., Fineberg N.A., Grünblatt E., Jarema M., Maron E., Nutt D., Pini S., Vaghi M.M., Wichniak A., Zai G., Riederer P. Biological markers for anxiety disorders, OCD and PTSD – a consensus statement. Part I: Neuroimaging and genetics. World J. Biol. Psy. 2016. 17 (5): 321–365.
Baxter L.R., Schwartz J.M., Bergman K.S., Szuba M.P., Guze B.H., Mazziotta J.C., Alazraki A., Selin C.E., Ferng H.K., Munford P., Phelps M.E. Caudate glucose metabolic rate changes with both drug and behavior therapy for obsessive-compulsive disorder. Arch. Gen. Psych. 1992. 49: 681–689.
Bechtereva N.P., Shemyakina N.V., Starchenko M.G., Danko S.G., Medvedev S.V. Error detectors mechanisms of the brain: background and prospects. Intern. J. Psychophysiology. 2005. 58 (2-3): 227–234.
Benkelfat C., Nordahl T.E., Semple W.E., King A.C. Local cerebral glucose metabolic rates in obsessive-compulsive disorder. Patients treated with clomipramine. Arch. Gen. Psych. 1990. 47: 840–848.
Berlin H.A., Schulz K.P., Zhang S., Turetzky R., Rosenthal D., Goodman W. Neural correlates of emotional response inhibition in obsessive-compulsive disorder: A preliminary study. Psych. Res. 2015. 234 (2): 259–264.
Botvinick M.M., Nystrom L.E., Fissell K., Carter C.S., Cohen J.D. Conflict monitoring versus selection-for-action in anterior cingulate cortex. Nature. 1999. 402 (6758): 179–181.
Botvinick M.M., Braver T.S., Barch D.M., Carter C.S., Cohen J.D. Conflict monitoring and cognitive control. Psychol. Rev. 2001. 108 (3): 624–652.
Botvinick M.M., Cohen J.D., Carter C.S. Conflict monitoring and anterior cingulate cortex: An update. Trends. Cogn. Sci. 2004. 8 (12): 539–546.
Breiter H.C., Rauch S.L., Kwong K.K., Baker J.R., Weisskoff R.M., Kennedy D.N., Kendrick A.D., Davis T.L., Jiang A., Cohen M.S., Stern C.E., Belliveau J.W., Baer L., O’Sullivan R.L., Savage C.R., Jenike M.A., Rosen B.R. Functional magnetic resonance imaging of symptom provocation in obsessive-compulsive disorder. Arch. Gen. Psych. 1996. 53: 595–606.
Brem S., Hauser T.U., Iannaccone R., Brandeis D., Drechsler R., Walitza S. Neuroimaging of cognitive brain function in paediatric obsessive-compulsive disorder: A review of literature and preliminary meta-analysis. J. Neural. Transm. 2012. 119 (11): 1425–1448.
Brown L.T., Mikell C.B., Youngerman B.E., Zhang Y., McKhann G.M., Sheth S.A. Dorsal anterior cingulotomy and anterior capsulotomy for severe, refractory obsessive-compulsive disorder: a systematic review of observational studies. J. Neurosurg. 2016. 124: 77–89.
Buchsbaum M.S., Hollander E., Pallanti S., Rossi N.B., Platholi J., Newmark R., Bloom R., Sood E. Positron emission tomography imaging of risperidone augmentation in serotonin reuptake inhibitor-refractory patients. Neuropsychobiol. 2006. 53 (3): 157–168.
Busatto G.F., Zamignani D.R., Buchpiguel C.A., Garrido G.E., Glabus M.F., Rocha E.T., Maia A.F., Rosario-Campos M.C., Campi Castro C., Furuie S.S., Gutierrez M.A., McGuire P.K., Miguel E.C. A voxel-based investigation of regional cerebral blood flow abnormalities in obsessive-compulsive disorder using single photon emission computed tomography (SPECT). Psychiatry Res. 2000. 99 (1): 15–27.
Busatto G.F., Buchpiguel C.A., Zamignani D.R., Garrido G.E., Glabus M.F., Rosario-Campos M.C., Castro C.C., Maia A., Rocha E.T., McGuire P.K., Miguel E.C. Regional cerebral blood flow abnormalities in early-onset obsessive-compulsive disorder: An exploratory SPECT study. J. Am. Acad. Child. Adolesc. Psychiatry. 2001. 40 (3): 347–54.
Bush G., Luu P., Posner M.I. Cognitive and emotional influences in anterior cingulate cortex. Trends Cog. Sci. 2000. 4 (6): 215–222.
Bush G., Vogt B.A., Holmes J., Dale A.M., Greve D., Jenike M.A., Rosen B.R. Dorsal anterior cingulate cortex: A role in reward-based decision making. Proc. Natl. Acad. Sci. 2002. 99 (1): 523–528.
Carey P.D., Warwick J., Niehaus J.H., Linden G., Heerden B.B., Harvey B.H., Seedat S., Stein D.J. Single photon emission computed tomography (SPECT) of anxiety disorders before and after treatment with citalopram. BMC Psychiatry. 2004. 4: 30.
Carter C.S., Braver T.S., Barch D.M., Botvinick M.M., Noll D., Cohen J.D. Anterior cingulate cortex, error detection, and the online monitoring of performance. Science. 1998. 280 (5364): 747–749.
Carter C.S., Botvinick M.M., Cohen J.D. The contribution of the anterior cingulate cortex to executive processes in cognition. Rev. Neurosci. 1999. 10 (1): 49–57.
Castilo A.R.G.L., Buchpiguel C.A., Ataujo L.A.S.B., Castillo J.C.R., Asbahr F.R., A.K. Maia, Oliveira Latorre M.R.D. Brain SPECT imaging in children and adolescents with obsessive-compulsive disorder. J. Neural. Transm. 2005. 112: 1115–1129.
Chang J.W., Kim C.H., Lee J.D., Chung S.S. Single photon emission computed tomography imaging in obsessive-compulsive disorder and for stereotactic bilateral anterior cingulotomy. Neurosurg. Clin. N. Am. 2003. 14: 237–250.
Chen J., Silk T., Seal M., Dally K., Vance A. Widespread decreased grey and white matter in paediatric obsessive-compulsive disorder (OCD): A voxel-based morphometric MRI study. Psych. Res. 2013. 213 (1): 11–17.
De Wit S.J., de Vries F.E., van der Werf Y.D., Cath D.C., Heslenfeld D.J., Veltman E.M., van Balkom A.J., Veltman D.J., van den Heuvel O.A. Presupplementary motor area hyperactivity during response inhibition: A candidate endophenotype of obsessive-compulsive disorder. Am. J. Psych. 2012. 169 (10): 1100–1108.
Dehaene S., Posner M.I., Tucker D.M. Localization of a neural system for error detection and compensation. Psy. Sci. 1994. 5 (5): 303–305.
Del Casale A., Kotzalidis G.D, Rapinesi C., Serata D., Ambrosi E., Simonetti A., Pompili M., Ferracuti S., Tatarelli R., Girardi P. Functional neuroimaging in obsessive-compulsive disorder. Neuropsychobiol. 2011. 64 (2): 61–85.
Diler R.S., Kibar M., Avci A. Pharmacotherapy and regional cerebral blood flow in children with obsessive-compulsive disorder. Yonsei Med. J. 2004. 45 (1): 90–99.
Dougherty D.D., Baer L., Cosgrove G.R., Cassem E.H., Price B.H., Nierenberg A.A., Jenike M.A., Rauch S.L. Prospective long-term follow-up of 44 patients who received cingulotomy for treatment-refractory obsessive-compulsive disorder. Am. J. Psych. 2002. 159 (2): 269–75.
Eisen J.L., Pinto A., Mancebo M.C. Dyck I.R., Orlando M.E., Rasmussen S.A. A 2-year prospective follow-up study of the course of obsessive-compulsive disorder. J. Clin. Psychiat. 2010. 71 (8): 1033–9.
Eng G.K., Sim K., Chen S.H. Meta-analytic investigations of structural grey matter, executive domain-related functional activations, and white matter diffusivity in obsessive compulsive disorder: An integrative review. Neurosci. Biobehav. Rev. 2015. 52: 233–257.
Fitzgerald K.D., Welsh R.C., Gehring W.J., Abelson J.L., Himle J.A., Liberzon I., Taylor S.F. Error-related hyperactivity of the anterior cingulate cortex in obsessive-compulsive disorder. Biol. Psychiatry. 2005. 57 (3): 287–294.
Fitzgerald K.D., Stern E.R., Angstadt M., Nicholson-Muth K.C., Maynor M.R., Welsh R.C., Hanna G.L., Taylor S.F. Altered function and connectivity of the medial frontal cortex in pediatric obsessive-compulsive disorder. Biol. Psych. 2010. 68 (11): 1039–1047.
Fitzgerald K.D., Liu Y., Stern E.R., Welsh R.C., Hanna G.L., Monk C.S., Phan K.L., Taylor S.F. Reduced error-related activation of dorsolateral prefrontal cortex across pediatric anxiety disorders. J. Am. Acad. Child Adolesc. Psychiatry. 2013. 52 (11): 1183–1191.
Grutzmann R., Endrass T., Kaufmann C., Allen E., Eichele T., Kathmann N. Presupplementary Motor Area Contributes to Altered Error Monitoring in Obsessive-Compulsive Disorder. Biol. Psychiatry. 2014. 80 (7): 562–571.
Hansen E.S., Hasselblalch S., Law I., Bowlig T.G. The caudate nucleus in obsessive-compulsive disorder. Reduced metabolism following treatment with paroxetine: A PET study. Int. J. Neuropsychologicol. 2002. 5(1): 1–10.
Ho Pian K.L., Megen H.J.G.M., Ramsey N.F., Mandl R., Rijk P.P., Wynne H.J., Westenberg H.G.M. Decreased thalamic blood flow in obsessive-compulsive disorder patients responding to fluvoxamine. Psy. Res. Neuroimaging. 2005. 138: 89–97.
Hoehn-Saric R., Pearlson G.D., Harris G.J., Machlin S.R., Camargo E.E. Effects of fluoxetine on regional cerebral blood flow in obsessive-compulsive patients. Am. J. Psychiatry. 1991. 148 (9): 1243–1245.
Hoehn-Saric R., Schlaepfer T.E., Greenberg B.D., McLeod D.R., Pearlson G.D., Wong S.H. Cerebral blood flow in obsessive-compulsive patients with major depression: Effect of treatment with sertraline or desipramine on treatment responders and non-responders. Psychiatry Res. 2001. 108 (2): 89–100.
Huey E.D., Zahn R., Krueger F., Moll J., Kapogiannis D., Wassermann E.M., Grafman J. A psychological and neuroanatomical model of obsessive-compulsive disorder. J. Neuropsychiatry Clin. Neurosci. 2008. 20 (4): 390–408.
Huyser C., Veltman D.J., Wolters L.H., de Haan E., Boer F. Developmental aspects of error and high-conflict-related brain activity in pediatric obsessive-compulsive disorder: A fMRI study with a Flanker task before and after CBT. J. Child. Psychol. Psychiatry. 2011. 52 (12): 1251–1260.
Hwang S.H., Kwon J.S., Shin Y.W., Lee K.J., Kim Y.Y., Kim M.S. Neuropsychological profiles of patients with obsessive-compulsive disorder: early onset versus late onset. J. Int. Neuropsychol. Soc. 2007. 13 (1): 30–37.
Jenike M., Baer L., Ballantine H.T., Martuza R.L., Tynes S., Giriunas I., Buttolph M.L., Cassem N.H. Cingulotomy for refractory obsessive-compulsive disorder: A long-term follow-up of 33 patients. Archives of general psychiatry. 1991. 48: 548–555.
Jeune F., Verin M., N’Diaye K., Drapier D., Leray E., Du Mantcel S.T., Baup N., Pelissolo A., Polosan M., Mallet L., Yelnik J., Devaux B., Fontaine D., Chereau I., Bourguignon A., Peron J., Sauleau P., Raoul S., Garin E., Krebs M.O., Jaafari N., Millet B. Decrease of prefrontal metabolism after subthalamic stimulation in obsessive-compulsive disorder: A positron-emission tomography study. Biol. Psych. 2010. 68: 1016–1022.
Jung H.H., Kim C.H., Chang J.H., Park Y.G., Chung S.S., Chang J.W. Bilateral anterior cingulotomy for refractory obsessive-compulsive disorder: Long-term follow-up results. Stereotact. Funct. Neurosurg. 2006. 84: 184–189.
Kang D.H., Kwon J.S., Kim J.J., Youn T., Park H.J., Kim M.S., Lee D.S., Lee M.C. Brain glucose metabolic changes associated with neuropsychological improvements after 4 months of treatment in patients with obsessive-compulsive disorder. Acta. Psychiatr. Scand. 2003. 107: 291–297.
Kang D.H., Jang J.H., Han J.Y., Kim J.H., Jung W.H., Choi J.S., Choi C.H., Kwon J.S. Neural correlates of altered response inhibition and dysfunctional connectivity at rest in obsessive-compulsive disorder. Prog. Neuropsychopharmacol. Biol. Psychiatry. 2012. 40: 340–346.
Koch K., Reeses T.J., Rus O.G., Zimmer C., Zaudig M. Diffusion tensor imaging (DTI) studies in patients with obsessive-compulsive disorder (OCD): A review. J. Psych. Res. 2014. 54: 26–35.
Kropotov J.D. Functional neuromarkers for psychiatry: Applications for diagnosis and treatment. Academic Press. 2016. P. 498.
Maia T.V., Cooney R.E., Peterson B.S. The neural bases of obsessive-compulsive disorder in children and adults. Dev. and Psych. 2008. 20 (4): 1251–1283.
Maltby N., Tolin D.F., Worhunsky P., O’Keefe T.M., Kiehl K.A. Dysfunctional action monitoring hyperactivates frontal-striatal circuits in obsessive-compulsive disorder: An event-related fMRI study. NeuroImage. 2005. 24 (2): 495–503.
Marsh R., Horga G., Parashar N., Wang Z., Peterson B.S., Simpson H.B. Altered activation in frontostriatal circuits during sequential processing of conflict in unmedicated adults with obsessive-compulsive disorder. Biol. Psych. 2014. 75 (8): 615–622.
Mataix-Cols D., Wooderson S., Lawrence N., Brammer M.J., Speckens A., Phillips M.L. Distinct neural correlates of washing, checking, and hoarding symptom dimensions in obsessive-compulsive disorder. Arch. Gen. Psych. 2004. 61 (6): 564–576.
Menzies L., Samuel R.C., Laird A.R., Thelen S.M., Sahakian B.J., Bullmore E.T. Integrating evidence from neuroimaging and neuropsychological studies of obsessive-compulsive disorder: The orbitofronto-striatal model revisited. Neurosci. Biobehav. Rev. 2008. 32 (3): 525–549.
Millet B., Dondaine T., Reymann J.M., Bourguignon A., Naudet F., Jaafari N., Drapier D., Turmel V., Mesbah H., Verin M., Jeune F. Obsessive compulsive-disorder networks: Positron emission tomography and neuropsychology provide new insights. PLoS One. 2013. 8 (1): e53241.
Morein-Zamir S., Voon V., Dodds C.M., Sule A., van Niekerk J., Sahakian B.J., Robbins T.W. Divergent subcortical activity for distinct executive functions: Stopping and shifting in obsessive-compulsive disorder. Psychol. Med. 2016. 46 (4): 829–840.
Morgieve M., N’Diaye K., Haynes W.I., Granger B., Clair A.H., Pelissolo A., Mallet L. Dynamics of psychotherapy-related cerebral haemodynamic changes in obsessive-compulsive disorder using a personalized exposure task in functional magnetic resonance imaging. Psychol. Med. 2014. 44 (7): 1461–1473.
Murayama K., Nakao T., Sanematsu H., Okada K., Yoshiura T., Tomita M., Masuda Y., Isomura K., Nakagawa A., Kanba S. Differential neural network of checking versus washing symptoms in obsessive-compulsive disorder. Prog. Neuropsychopharmacol. Biol. Psych. 2013. 40: 160–166.
Naaijen J., Lythgoe D.J., Amiri H., Buitelaar J.K., Glennon J.C. Fronto-striatal glutamatergic compounds in compulsive and impulsive syndromes: A review of magnetic resonance spectroscopy studies. Neurosci. Biobehav. Rev. 2015. 52: 74–88.
Nabeyama M., Nakagawa A., Yoshiura T., Nakao T., Nakatani E., Togao O., Yoshizato C., Yoshioka K., Tomita M., Kanba S. Functional MRI study of brain activation alterations in patients with obsessive-compulsive disorder after symptom improvement. Psych. Res. 2008. 163 (3): 236–247.
Nakao T., Nakagawa A., Yoshiura T., Nakatani E., Nabeyama M., Yoshizato C., Kudoh A., Tada K., Yoshioka K., Kawamoto M., Togao O., Kanba S. Brain activation of patients with obsessive-compulsive disorder during neuropsychological and symptom provocation tasks before and after symptom improvement: a functional magnetic resonance imaging study. Biol. Psych. 2005a. 57 (8): 901–910.
Nakao T., Nakagawa A., Yoshiura T., Nakatani E., Nabeyama M., Yoshizato C., Kudoh A., Tada K., Yoshioka K., Kawamoto M. A functional MRI comparison of patients with obsessive-compulsive disorder and normal controls during a Chinese character Stroop task. Psych. Res. 2005b. 139 (2): 101–114.
Nakao T., Nakagawa A., Yoshiura T., Nakatani E., Nabeyama M., Sanematsu H., Togao O., Yoshioka K., Tomita M., Kuroki T., Kanba S. Duration effect of obsessive-compulsive disorder on cognitive function: A functional MRI study. Depress. Anxiety. 2009. 26 (9): 814–823.
Nakao T., Okada K., Kanba S. Neurobiological model of obsessive-compulsive disorder: Evidence from recent neuropsychological and neuroimaging findings. Psych. Clin. Neurosci. 2014. 68 (8): 587–605.
Norman L.J., Carlisi C.O., Christakou A., Cubillo A., Murphy C.M., Chantiluke K., Simmons A., Giampietro V., Brammer M., Mataix-Cols D., Rubia K. Shared and disorder-specific task-positive and default mode network dysfunctions during sustained attention in paediatric Attention-Deficit/Hyperactivity Disorder and obsessive/compulsive disorder. Neuroimage Clin. 2017. 15: 181–193.
Page L., Rubia K., Deeley Q., Daly E., Toal F., Mataix-Cols D., Giampietro V., Schmitz N., Murphy D.G. A functional magnetic resonance imaging study of inhibitory control in obsessive-compulsive disorder. Psych. Res. 2009. 174 (3): 202–209.
Pallanti S., Quercioli L. Treatment-refractory obsessive-compulsive disorder: methodological issues, operational definitions and therapeutic lines. Prog. Neuropsychopharmacol. Biol. Psychiatry. 2006. 30 (3): 400–12.
Pedapati E., Di Francesco M., Wu S., Giovanetti C., Nash T., Mantovani A., Ammerman R., Harris E. Neural correlates associated with symptom provocation in pediatric obsessive-compulsive disorder after a single session of sham-controlled repetitive transcranial magnetic stimulation. Psych.Res. 2015. 233 (3): 466–473.
Perani D., Colombo C., Bressi S., Bonfanti A., Grassi F., Scarone S., Bellodi L., Smeraldi E., Fazio F. [18F]-FDG PET study in obsessive-compulsive disorder. A clinical/metabolic correlation study after treatment. Br. J. Psych. 1995. 166: 244–250.
Piras F., Piras F., Chiapponi C., Girardi P., Caltagirone C., Spalletta G. Widespread structural brain changes in OCD: A systematic review of voxel-based morphometry studies. Cortex. 2013. 62: 89–108.
Pitman R.K. A cybernetic model of obsessive-compulsive psychopathology. Compr. Psychiatry. 1987. 28 (4): 334–343.
Rauch S.L., Jenike M.A. Neurobiological models of obsessive-compulsive disorder. Psychosomatics. 1993. 31 (1): 20–32.
Rauch S.L., Jenike M.A., Alpert N.M., Baer L., Breiter H.C.R., Savage C.R., Fischman A.J. Regional cerebral blood flow measured during symptom provocation in obsessive-compulsive disorder using oxygen 15-labeled carbon dioxide and positron emission tomography. Arch. Gen. Psych. 1994. 51: 62–70.
Remijnse P.L., van den Heuvel O.A., Nielen M.A., Vriend C., Hendriks G.J., Hoogendijk J.G., Uylings B.M., Veltman D.J. Cognitive inflexibility in obsessive-compulsive disorder and major depression is associated with distinct neural correlates. PLoS One. 2013. 8 (4): e59600. doi: 10.1371/journal.pone.0059600.
Rotge J.Y., Guehl D., Dilharreguy B., Cuny E., Tignol J., Bioulac B., Allard M., Burbaud P., Aouizerate B. Provocation of obsessive-compulsive symptoms: A quantitative voxel-based meta-analysis of functional neuroimaging studies. J. Psychiatry. Neurosci. 2008. 33 (5): 405–412.
Rotge J.Y., Langbour N., Guehl D., Bioulac B., Jaafari N., Allard M., Aouizerate B., Burbaud P. Gray matter alterations in obsessive–compulsive disorder: An anatomic likelihood estimation meta-analysis. Neuropsychopharmacol. 2010. 35 (3): 686–691.
Roth R.M., Milpovan D., Baribeau J., O’Connor K. Neuropsychological functioning in early- and late-onset obsessive-compulsive disorder. J. Neuropsychiatry. Clin. Neurosci. 2005. 17 (2): 208–13.
Roth R.M., Saykin A.J., Flashman L., Pixley H.S., West J.D., Mamourian A.C. Event-related functional magnetic resonance imaging of response inhibition in obsessive-compulsive disorder. Biol. Psychiatry. 2007. 62 (8): 901–909.
Rubia K., Cubillo A., Smith A.B., Woolley J., Heyman I., Brammer M.J. Disorder-specific dysfunction in right inferior prefrontal cortex during two inhibition tasks in boys with attention-deficit hyperactivity disorder compared to boys with obsessive-compulsive disorder. Hum. Brain Mapp. 2010. 31 (2): 287–299.
Rubia K., Cubillo A., Woolley J., Brammer M.J., Smith A. Disorder-specific dysfunctions in patients with attention-deficit/hyperactivity disorder compared to patients with obsessive-compulsive disorder during interference inhibition and attention allocation. Hum. Brain Mapp. 2011. 32 (4): 601–611.
Rubin R.T., Ananth J., Villanueva-Meyer J., Trajmar P.G., Mena I. Regional 133Xenon cerebral blood flow and cerebral 99mTc-HMPAO uptake in patients with obsessive-compulsive disorder before and during treatment. Biol. Psychiatry. 1995. 38: 429–437.
Ruby P., Sirigu A., Decety J. Distinct areas in parietal cortex involved in long-term and short-term action planning: A PET investigation. Cortex. 2002. 38 (3): 321–339.
Saxena S., Brody A.L., Maidment K.M. Dunkin J.J., Colgan M., Alborzian S., Phelps M.E., Baxter L.R. Localized orbitofrontal and subcortical metabolic changes and predictors of response to paroxetine treatment in obsessive-compulsive disorder. Neuropsychopharm. 1999. 21: 683–693.
Saxena S., Rauch S.L. Functional neuroimaging and the neuroanatomy of obsessive-compulsive disorder. Psych. Clin. North. Am. 2000. 23 (3): 563–586.
Saxena S., Brody A.L., Ho M.L., Albozian S., Maidment K.M., Zohrabi N., Ho M.K., Huang S.C., Wu H.M., Baxter L.R. Differential cerebral metabolic changes with paroxetine treatment of obsessive-compulsive disorder vs major depression. Arch. Gen. Psych. 2002. 59: 250–261.
Schiepek G., Tominschek I., Heinzel S., Aigner M., Dold M., Unger A., Lenz G., Windischberger C., Moser E., Plöderl M., Lutz J., Meindl T., Zaudig M., Pogarell O., Karch S. Discontinuous patterns of brain activation in the psychotherapy process of obsessive-compulsive disorder: converging results from repeated fMRI and daily self-reports. PLoS One. 2013. 8 (8): e71863.
Schlosser R.G., Wagner G., Schachtzabel C., Peikert G., Koch K., Reichenbach J.R., Sauer H. Fronto-cingulate effective connectivity in obsessive-compulsive disorder: A study with fMRI and dynamic causal modeling. Hum. Brain Mapp. 2010. 31 (12): 1834–1850.
Schwartz J.M., Stoessel P.W., Baxter L.R., Martin K.M., Phelps M.E. Systematic changes in cerebral glucose metabolic rate after successful behavior modification treatment of obsessive–compulsive disorder. Arch. Gen. Psych. 1996. 53: 109–113.
Sheth A.S., Neal J., Tangherlini F., Mian M.K., Gentil A., Cosgrove G.R., Eskandar E.N., Dougherty D.D. Limbic system surgery for treatment-refractory obsessive-compulsive disorder: A prospective long-term follow-up of 64 patients. 2013. 118: 491–497.
Skoog G., Skoog I. A 40-year follow-up of patients with obsessive-compulsive disorder. Arch. Gen. Psychiatry. 1999. 56: 121–127.
Stanzhevsky A.A., Tyutin L.A., Korzenev A.V., Pozdnyakov A.V., Kostenikov N.A., Shalek R.A. PET with 18FDG and +HMRS in diagnosis and evaluation of malignant anxiety obsessive disorders. Eur. Radiol. 2007. 17 (1): 230.
Stern E.R., Welsh R.C., Fitzgerald K.D., Gehring W.J., Lister J.J., Himle J.A., Abelson J.L., Taylor S.F. Hyperactive error responses and altered connectivity in ventromedial and frontoinsular cortices in obsessive-compulsive disorder. Biol. Psychiatry. 2011. 69 (6): 583–591.
Stern E.R., Taylor S.F. Cognitive neuroscience of obsessive-compulsive disorder. Psychiatr. Clin. North. Am. 2014. 37 (3): 337–352.
Swedo S.E., Schapiro M.B., Grady C.L., Cheslow D.L., Leonard H.L., Kumar A., Friedland R., Rapoport S.I., Rapoport J.L. Cerebral glucose metabolism in childhood-onset obsessive-compulsive disorder. Arch. Gen. Psych. 1989. 46: 518–523.
Swedo S.E., Pietrini P., Leonard H.L., Schapiro M.B., Rettew D.C., Goldberger E.L., Rapoport S.I., Rapoport J.L., Grady C.L. Cerebral glucose metabolism in childhood-onset obsessive-compulsive disorder. Revisualization during pharmacotherapy. Arch. Gen. Psych. 1992. 49: 690–694.
Tolin D.F., Witt S.T., Stevens M.C. Hoarding disorder and obsessive-compulsive disorder show different patterns of neural activity during response inhibition. Psych. Res. 2014. 221 (2): 142–148.
Ursu S., Stenger V.A., Shear M.K., Jones M.R., Carter C.S. Overactive action monitoring in obsessive-compulsive disorder: evidence from functional magnetic resonance imaging. Psychol. Sci. 2003. 14 (4): 347–353.
Ursu S., Carter C.S. An initial investigation of the orbitofrontal cortex hyperactivity in obsessive-compulsive disorder: Exaggerated representations of anticipated aversive events? Neuropsychologia. 2009. 47 (10): 2145–2148.
van den Heuvel O.A., Veltman D.J., Groenewegen H.J., Witter M.P., Merkelbach J., Cath D.C., van Balkom A.J., van Oppen P., van Dyck R. Disorder-specific neuroanatomical correlates of attentional bias in obsessive-compulsive disorder, panic disorder, and hypochondriasis. Arch. Gen. Psych. 2005. 62 (8): 922–933.
van Laere K., Nuttin B., Gabriels L., Dupont P., Rasmussen S., Greenberg B.D., Cosyns P. Metabolic imaging of anterior capsular stimulation in refractory obsessive-compulsive disorder: A key role for the subgenual anterior cingulate and ventral striatum. J. Nucl. Med. 2006. 47: 740–747.
van Veen V., Cohen J.D., Botvinick M.M., Stenger V.A., Carter C.S. Anterior cingulate cortex, conflict monitoring, and levels of processing. Neuroimage. 2001 14 (6): 1302–1308.
Wager T.D., Smith E.E. Neuroimaging studies of working memory: A meta-analysis. Cogn. Affect. Behav. Neurosci. 2003. 3 (4): 255–574.
Wen S.L., Cheng M.H., Cheng M.F., Yue J.H., Wang H. Pharmacotherapy response and regional cerebral blood flow characteristics in patients with obsessive-compulsive disorder. Behav. Brain Funct. 2013. 9: 31.
Weygandt M., Blecker C.R., Schafer A., Hackmack K., Haynes J.D., Vaitl D., Starl R., Schienle A. fMRI pattern recognition in obsessive–compulsive disorder. Neuroimage. 2012. 60: 1186–1193.
Wiese H., Stude P., Nebel K., de Greiff A., Forsting M., Diener H.C., Keidel M. Movement preparation in self-initiated versus externally triggered movements: an event-related fMRI-study. Neurosci. Lett. 2004. 371 (2-3): 220–225.
Woolley J., Heyman I., Brammer M., Frampton I., McGuire P.K., Rubia K. Brain activation in paediatric obsessive-compulsive disorder during tasks of inhibitory control. Br. J. Psych. 2008. 192 (1): 25–31.
Yeung N. Conflict monitoring and cognitive control. In Ochsner K.N., Kosslyn S. (Eds.). The Oxford Handbook of Cognitive Neuroscience: Volume 2: The Cutting Edges. Oxford University Press. 2013. P. 275–299.
Yucel M., Harrison B.J., Wood S.J., Fornito A., Wellard R.M., Pujol J., Clarke K., Phillips M.L., Kyrios M., Velakoulis D., Pantelis C. Functional and biochemical alterations of the medial frontal cortex in obsessive-compulsive disorder // Arch. Gen. Psych. 2007. 64 (8): 946–955.
Zielińska J., Góral-Półrola J., Półrola P., Łuckoś M., Kropotov J.D., Pachalska M. Hyper-frontality in an OCD patient – evidence from event-related potentials in a cued GO/NOGO task. Ann. Agric. Environ. Med. 2016. 23 (2): 276–279.
Zuo C., Ma Y., Sun B., Peng S., Zhang H., Eidelberg D., Guan Y. Metabolic imaging of bilateral anterior capsulotomy in refractory obsessive-compulsive disorder: An FDG PET study. J. Cereb. Blood Flow Metab. 2013. 33 (6): 880–887.
Дополнительные материалы отсутствуют.
Инструменты
Журнал высшей нервной деятельности им. И.П. Павлова


