Журнал высшей нервной деятельности им. И.П. Павлова, 2019, T. 69, № 2, стр. 150-163
ГРУППОВОЙ И ИНДИВИДУАЛЬНЫЙ фМРТ-АНАЛИЗ ОСНОВНЫХ СЕТЕЙ ПОКОЯ ЗДОРОВЫХ ИСПЫТУЕМЫХ
А. А. Гаврон 1, 2, Yacila Isabela Deza Araujo 4, Е. В. Шарова 1, *, А. С. Смирнов 3, Г. Г. Князев 5, М. В. Челяпина 1, Л. М. Фадеева 3, А. А. Абдулаев 1, 2, М. А. Куликов 1, Л. А. Жаворонкова 1, Г. Н. Болдырева 1, В. М. Верхлютов 1, И. Н. Пронин 3
1 ФГБУН Институт высшей нервной деятельности и нейрофизиологии РАН
Москва, Россия
2 Национальный исследовательский ядерный университет “МИФИ”
Москва, Россия
3 ФГАУ “Национальный научно-практический центр нейрохирургии им. акад. Н.Н. Бурденко” Минздрава России
Москва, Россия
4 Отделение психиатрии и центр нейровизуализации, Технический университет Дрездена
Дрезден, Германия
5 Научно-исследовательский институт физиологии и фундаментальной медицины
Новосибирск, Россия
* E-mail: esharova@nsi.ru
Поступила в редакцию 21.09.2017
После доработки 25.01.2018
Принята к публикации 05.03.2018
Аннотация
Анализ фМРТ в состоянии покоя (RS) представляется адекватным методическим подходом к исследованию базового уровня функциональной активности мозга человека в норме и патологии. Недостаточная представленность этого направления в России отчасти обусловлена малым числом отечественных публикаций с описанием приемов обработки данных. В работе приводится алгоритм анализа фМРТ-сигналов RS на основе метода независимых компонент (ICA), реализованный в программном обеспечении FSL и использованный для изучения типичных функциональных сетей покоя (RSN) в норме. Усреднение данных по группам наблюдений, правомерное в исследованиях здоровых людей, зачастую оказывается неприменимым к разным формам церебральной патологии, характеризующейся значительно большей вариативностью гемодинамики. В связи с этим у 17 исследованных здоровых испытуемых проводили сравнительную оценку топографии и ряда количественных показателей типичных RSN, выделенных при групповом и индивидуальном анализе фМРТ-сигналов. Эти сети были сопоставимы с RSN, описанными в литературе в качестве основных, а также воспроизводимыми при групповом и индивидуальном анализе, что подтверждает корректность, надежность и эффективность используемого алгоритма. При индивидуальном анализе RSN выявлена их вариативность, сопряженная с рядом психофизиологических особенностей здоровых испытуемых (пол, профиль моторной асимметрии, паттерн ЭЭГ), объясняющая отчасти разную степень соответствия шаблонам групповых сетей. Результаты индивидуального фМРТ- и ЭЭГ-сопоставления указывают на перспективность анализа топографии источников отдельных ритмов в качестве ЭЭГ-маркеров RSN. Наименее вариативные в норме количественные фМРТ-характеристики сетей покоя (такие как максимальная интенсивность активации сети, средняя частота активной зоны спектра, частота доминирующего пика) могут иметь преимущественную диагностическую ценность для исследований RSN в патологии.
Функциональная магнитно-резонансная томография (фМРТ) в качестве одного из современных неинвазивных методов нейровизуализации традиционно используется для изучения структурно-функциональной организации разных видов церебральной деятельности. Она позволяет на основе анализа изменений оксигенации крови в активируемых при работе участках головного мозга (по сравнению с состоянием покоя) определять функциональную нейроанатомию моторных, сенсорных и когнитивных функций мозга человека в норме и при патологии [Smith et al., 2009]. В литературе реактивное увеличение локального кровенаполнения мозговой ткани (+BOLD-эффект) рассматривают как маркер нейрональной активности, а метод фМРТ – как оптимальный инструмент пространственного картирования активируемых нейронных ансамблей [Штарк и др., 2012].
В последние годы метод фМРТ стал использоваться для исследования нейродинамики состояния покоя или, иначе говоря, спокойного бодрствования (resting state, RS). В покое также происходят колебания уровня оксигенации крови (BOLD-сигнала) с частотой < 0.1 Гц, отражающие базовую нейрональную активность головного мозга, которая позволяет поддерживать определенный уровень активации функциональных сетей головного мозга, отвечающих за интеграцию сигналов как от внутренних органов, так и от внешней среды [Van Dijk et al., 2010]. Причем эта активность является наиболее метаболически затратным компонентом нервной деятельности, потребляющим около 80% энергии мозга [Raichle, Mintun, 2006]. Подсчитано, что дополнительное потребление энергии на выполняемые задания, включая когнитивные функции, составляет относительно малую долю энергетического баланса головного мозга – менее 5% [Raichle, 2010]. Поэтому при комплексной оценке функций мозга анализ спонтанной активности не менее важен, чем оценка стимул-зависимой.
Выделение совокупности мозговых областей, различающихся по своей активности в покое, основано на определении регионов (пространственных кластеров) с независимо ведущей себя гемодинамикой в течение всех набранных временных серий во время исследования [Smith et al., 2009], по синхронному изменению уровня фМРТ-сигнала для ограниченного объема или объемов серого вещества [Allen et al., 2002].
К числу пионерских работ по выявлению нейронных сетей покоя (resting state network, RSN) относятся фМРТ-данные B. Biswal и др. [Biswal et al., 1995] об автономной синхронности изменений интенсивности гемодинамических сигналов отдельных участков мозга в состоянии спокойного бодрствования, а также ПЭТ-исследование С.В. Медведева и др. [1996] об избирательном повышении уровня функциональной активности ряда корковых и подкорковых образований в покое. Начиная с публикации Friston et al. [1993], к числу пространственно-временных характеристик деятельности нейронных сетей стали относить функциональную связанность (functional connectivity, FC) между областями внутри сети и между сетями. Высокая скоррелированность во времени межрегиональных BOLD-сигналов расценивается в качестве основы формирования функциональных нейронных сетей [Мартынова и др., 2016] или “коннектом”.
С тех пор разными авторами, на основании различных методических приемов было выделено и описано значительное количество совокупно активированных в покое церебральных структур или функциональных сетей, ряд которых демонстрирует высокую воспроизводимость в различных выборках здоровых испытуемых [Cordes et al., 2000; Gusnard et al., 2001; Beckmann et al., 2005; Biswal et al., 2010; Rosazza, Minati, 2011; Катаева и др., 2013]. Это свидетельствует о сходстве внутренней функциональной архитектуры головного мозга человека в норме [Corbetta, Shulman, 2002].
В литературе в качестве наиболее характерных для здоровых людей рассматриваются от 7 до 15 RSN [Biswal et al., 2010; Corbetta, Shulman, 2002; Greicius et al, 2003; Allen et al., 2011; Мартынова и др., 2016]. К ним относятся Default Mode Network или DMN: сеть, cвязываемая с уровнем бодрствования и внимания [Greicius et al, 2003; Allen et al., 2011]; сенсомоторная сеть, предположительно содействующая выполнению активных движений; зрительная сеть (могут выявляться до трех модификаций); сеть управляющих функций (Executive control), включающая лобные зоны, связанные с реализацией управляющих функций мозга; две латерализованные фронто-париетальные сети; слуховая (височная) сеть, соотносимая с зонами чтения; височно-теменнная – с обработкой лингвистической информации (рис. 1(а), 2(а)). При том, что области мозга в пределах каждой сети анатомически разобщены, они являются функционально связанными, демонстрируя высокий уровень корреляции активности BOLD-сигнала [Cordes et al., 2000; Lowe et al., 2002]. Было установлено, что качество функционирования ряда RSN (т.е. наличие активации структурных компонентов сети и ее степень, оцениваемая по ряду количественных показателей) напрямую коррелирует с успешностью реализации определенных когнитивных функций [Rocca et al., 2010].
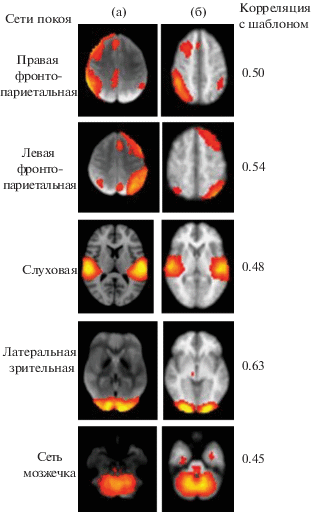
Рис. 1.
Отображение 5 основных сетей RS группы нормы в сопоставлении с соответствующими эталонными сетями. (а) – эталонные сети RS из публикации Smith et al., 2009. (б) – сети RS исследованной группы здоровых испытуемых (N = 15). Слева от рисунка – обозначение сети, справа – коэффициент ее сходства с шаблоном из публикации Smith et al., 2009 .
Fig. 1. The mapping of the 5 main RS networks of the norm group in comparison with the corresponding reference networks. (а) – reference RS networks from the publication Smith et al., 2009. (б) – network RS of the examined group of healthy subjects (N = 15). To the left of the figure is the network designation, to the right is the coefficient of its similarity to the template Smith et al., 2009.
Важно подчеркнуть, что фМРТ-исследование состояния покоя не требует участия испытуемого (пациента), поэтому может быть единственным возможным способом функциональной нейровизуализации для больных с ограниченными когнитивными или двигательными возможностями, а также угнетением сознания. Выявленные в ряде работ специфические нарушения некоторых сетей RS при болезни Альцгеймера, рассеянном склерозе [Bonavita et al., 2011; Pan Wang et al., 2015], боковом амиотрофическом склерозе [Tedeschi et al., 2012] и при длительном угнетении сознания разной нозологии [Vanhaudenhuyse et al., 2010] свидетельствуют о значительных клинических возможностях данного направления исследований. В России оно занимает скорее стартовую позицию [Верхлютов и др., 2014; Вalaev et al., 2014; Ushakov et al., 2016 ].
Cледует отметить, что приемы исследования фМРТ–сетей RS довольно сложны и связаны с привлечением математических моделей. Единый алгоритм их выявления и анализа до сих пор отсутствует как за рубежом, так и в России. К числу наиболее распространенных приемов относятся 1) определение области интереса (ROI) и вычисление FC сигнала группы вокселов этого региона с другими вокселами мозга [Golestani, Goodyear, 2011], а также 2) анализ независимых компонент (ICA) [Hyvärinen, Oja, 2000]. Последний основан на статистической технике, позволяющей линейно преобразовать исходные данные в новые компоненты, которые будут являться по отношению друг к другу максимально независимыми статистически [Hyvärinen, Oja, 2000; Calhoun et al., 2008]. В случае фМРТ возможно определение временных и пространственных независимых компонент, но пространственный ICA проводится наиболее часто [Schöpf et al., 2010]. Определение FC основывается на оценке согласованности (корреляции, когерентности) гемодинамических сигналов, их фазовых соотношений, кластеризации и теории графов [Calhoun et al., 2004; Bonhomme et al., 2016].
При анализе сетей RS для получения наиболее достоверных результатов проводится усреднение данных по группам наблюдений. В то время как последнее условие правомерно в исследованиях здоровых людей для определения базовых нормативных стандартов RS [Allen et al., 2011], оно зачастую оказывается неприменимым к разным формам церебральной патологии, характеризующейся значительно большей вариативностью гемодинамики [Lee et al., 2013]. В этой ситуации информативным представляется индивидуальное исследование сетей покоя, которое может способствовать решению таких клинических задач, как оценка степени двигательного или речевого дефекта, глубины угнетения сознания пациентов при невозможности контакта с ними, а также направленности восстановления и эффективности проводимого лечения.
Обоснование важности анализа индивидуальных фМРТ сетей RS и в норме, а также его примеры приводятся в работе [Wang et al., 2015]. Ранее нами был апробирован алгоритм выявления сетей RS посредством ICA-анализа на базе программного обеспечения FSL (FMRIB Software Library) [Гаврон и др., 2014] и показана эффективность его применения для исследования индивидуальных сетей RS у здоровых испытуемых. Для проверки корректности используемого подхода, а также для определения более надежных нормативных сетевых характеристик в настоящей работе была проведена сравнительная оценка топографии и ряда количественных показателей типичных нейронных сетей RS у здоровых людей, выделенных при групповом и индивидуальном анализе фМРТ-сигналов.
Задачи:
1) На основе алгоритма ICA-анализа на базе программного обеспечения FSL провести групповой и индивидуальный анализ данных фМРТ в состоянии покоя у здоровых испытуемых; сопоставить топографию основных групповых и индивидуальных сетей RS c описанными в литературе.
2) Сравнить количественные показатели функциональной активности отдельных RSN здоровых людей, полученных при групповом и индивидуальном фМРТ-анализе.
3) Оценить возможности индивидуальных исследований RSN в норме на примерах сопоставления их количественных показателей с рядом психофизиологических особенностей испытуемых: пол, профиль моторной межполушарной асимметрии, специфика паттерна ЭЭГ и топография независимых источников ее отдельных ритмов.
4) На основе полученных данных рассмотреть возможную перспективность используемых показателей RSN для исследований пациентов с церебральной патологией.
МЕТОДИКА
фМРТ-исследование в состоянии покоя выполнено у 17 здоровых добровольцев: 12 мужчин и 5 женщин в возрасте 24–29 лет.
Исследования выполнялись в соответствии с принципами Хельсинкской декларации, после получения информированного согласия на участие у каждого испытуемого и одобрения этическим комитетом ИВНД и НФ РАН.
фМРТ проводили в Отделении рентгеновских и радиоизотопных методов диагностики ФГАУ “Национальный научно-практический центр нейрохирургии им. акад. Н.Н. Бурденко” МЗ РФ на магнитно-резонансном томографе General Electric Signa HDxt (США) с напряженностью магнитного поля 3.0 Тл и скоростью нарастания поля 135 мТл/м. Длительность фМРТ-регистрации в состоянии покоя с закрытыми глазами составляла 10 мин 12 с или, с учетом дополнительной гомогенизации поля в области интереса, 12 мин.
Для получения структурных данных (в объеме всего мозга) использовалась импульсная последовательность 3D FSPGR (BRAVO). TR = 8.8 мс, TE = 3.5 мс, толщина среза = 1 мм, FOV = 250 мм, матрица изображения 256 × × 256, размер воксела 0.97 × 0.97 × 1.0 мм. Для получения функциональных данных использовалась Эхопланарная последовательность Спиновое ЭХО (BOLD T2). TR = 2000 мс, TE = 30 мс, толщина среза = 3 мм, FOV 250 мм, матрица изображения 128 × 128, размер воксела 1.95 × 1.95 × 3 мм. В каждой временной серии было получено 300 наборов функциональных объемов, каждый из которых содержит 24–40 аксиальных срезов, захватывающих весь головной мозг. Время сканирования одного функционального объема – 2 с. (Измерения первых 6 функциональных объемов в обработке не использовались.) Общее число срезов в функциональной серии составляло 7000–12 000.
Во время регистрации проводился первичный контроль качества получаемых гемодинамических сигналов, автоматическая коррекция уровня шума, а также оценка качества блоковых записей по присутствию двигательных артефактов (отличное, хорошее, плохое). В последнем случае сканирование прерывается, и исследование начинают снова.
Выходные данные экспериментов записывали в формате DICOM с последующей конвертацией в NIFTI и обработкой в программном обеспечении FMRIB Software Library (FSL) [Hyvärinen, Oja, 2000], которое находится в свободном доступе (http://fsl.fmrib.ox.ac.uk/fsl/fslwiki/).
В процессе обработки проводили удаление артефактов, связанных с низкочастотным шумом и коррекцию артефактов движения, а также преобразование функциональных данных в стандартное пространство (анатомическая структура головного мозга) – c помощью инструментов BET Brain Extraction, MCFLIRT и в разделе Pre-stats инструмента MELODIC ICA программного обеспечения FSL.
После этого посредством инструмента MELODIC проводили ICA-анализ фМРТ RS. Полученные покомпонентные данные накладывались на эталонное (при групповом анализе) или индивидуальные изображения мозга в аксиальной, фронтальной и сагиттальной плоскостях.
При индивидуальном анализе RS у каждого испытуемого по умолчанию выделялось некоторое количество групп вокселов (крупномасштабных сетей), имеющих статистически независимые показатели динамики BOLD-сигнала. Порог значимости для выделения независимых компонентов р ≤ 0.01. Поправка на множественность сравнений производилась автоматически при снижении значения р ниже уровня 0.05. Визуализация выделенных сетей в объемном изображении мозга каждого испытуемого и корректировка полученных результатов осуществлялись в инструменте fslview.
Два независимых эксперта (А.С. и М.Ч.) проводили оценку топографии каждого компонента и дифференцировку “артефактных” и истинных нейрональных компонент.
При групповом анализе RS, выполненном по данным исследований 15 здоровых испытуемых, предварительная обработка DICOM-файлов осуществлялась с помощью программного обеспечения SPM (Statistical Parametric Mapping), работающим в среде Matlab. Она включала следующие этапы: 1) конвертация DICOM-файлов в nifti-формат; 2) коррекция срезов по времени; 3) выравнивание и корегистрация; 4) нормализация, при которой отфильтрованные функциональные данные преобразуются в стандартное пространство; 5) сглаживание. Затем применяли метод multi-session temporal concatenation – 2D-анализ независимых компонент последовательно соединенных исходных фМРТ-данных. Перед применением описываемого метода проводилось изменение формы nifti-файлов. Анализ ICA, реализованный на базе программного обеспечения FSL, был дополнен программой SPM (Matlab) и использованием языка программирования Python. Число выделяемых сетей ограничивали на уровне 60. После применения поправки на множественность сравнений и независимой экспертной оценки основных сетей их идентификацию уточняли посредством пространственного кросскорреляционного анализа, реализованного в инструменте fslcc, с использованием шаблонов Smith et al. [2009].
Верификацию активированных в каждой сети структур мозга как при индивидуальном, так и при групповом анализе проводили с помощью программного пакета AAL (Аnatomical Automatic Labeling). Для количественной оценки активности основных сетей использовали такие интегральные показатели, как число вокселов, их объем (см3) и максимальная интенсивность. Они рассчитывались автоматически с помощью набора консольных команд FSL: ряда утилит командной строки FSLUTILS (а именно fslstats). Эти показатели, во-первых, рекомендованы разработчиками FSL, а во-вторых, эффективно использовались для оценки нарушений сетей RS при патологии [Dumas et al., 2013; Widjaja et al., 2013]. Следует отметить, что интенсивность относится к числу статистических показателей активности сети. Он соответствует величине F-критерия Фишера. Единица измерения интенсивности – безразмерная величина, устанавливаемая программно. Величина F отображается в соответствии с градуальной цветовой или черно-белой шкалой, где яркость или цвет соответствует значению F-критерия: мах-интенсивность – максимальному, минимальное значение – для значения F-критерия, соответствующего р = 0.01. Значения F для р > минимального уровня значимости не отображаются при совмещении анатомических и функциональных 3D данных.
Наряду с пространственными характеристиками оценивали и индивидуальные частотные показатели гемодинамики отдельной сети (среднюю частоту активной зоны и частоту доминирующего пика спектра мощности) – c привлечением авторского программного обеспечения, реализованного в среде MatLab.
В день фМРТ-исследования у каждого испытуемого определяли профиль моторной межполушарной асимметрии по опроснику Аннет [Бизюк, 2005], согласно которому десять испытуемых были правшами (8 мужчин, 2 женщины), шесть – левшами (пять мужчин и одна женщина), еще одна женщина – амбидекстром.
Наряду с этим у всех испытуемых регистрировали электроэнцефалограмму (ЭЭГ): монополярно, от симметричных затылочных, теменных, центральных, лобных и височных областей обоих полушарий, в состоянии спокойного бодрствования с закрытыми глазами, с полосой пропускания 0.5–37 Гц. Проводили визуальный анализ паттерна с учетом степени и регулярности выраженности основного (альфа) ритма, особенностей его пространственной организации, а также усиление, наряду с альфа, других видов активности (в частности, тета и бета). Основываясь на опыте исследований по клинической электроэнцефалографии [Клиническая электроэнцефалография (под ред. В.С. Русинова), 1973; Болдырева и др., 2000], ранжировали особенности рисунка фоновой ЭЭГ каждого испытуемого по выраженности в ней влияний неспецифических систем мозга разного уровня. Согласно такой оценке, было выделено 4 типа ЭЭГ: 1 – регулярный альфа-ритм с выраженными зональными различиями – сбалансированные корково-подкорковые отношения; 2 – регулярный альфа-ритм с тета-колебаниями в центрально-лобных отделах – нерезкое усиление влияний на кору со стороны диэнцефальных образований мозга; 3 – перераспределение альфа на передние отделы, билатеральные заостренные вспышки – выраженные признаки раздражения срединно-диэнцефальных образований; 4 – нерегулярный альфа-ритм, нерезкое снижение амплитуды биопотенциалов, наличие диффузных ирритативных знаков, десинхронизация – усиление влияний неспецифической активирующей системы орального ствола.
У 12 испытуемых на основе коэффициента ранговой корреляции Спирмена оценивали сопряженность между характеристиками индивидуальных фМРТ сетей RS, гендерной принадлежности, моторной асимметрии и ЭЭГ. Для сравнения показателей нескольких зон применяли однофакторный дисперсионный анализ с последующим привлечением post-hoc критерия Ньюмена-Келлса. Расчеты проводили на базе пакета статистических программ Statistica Release 7.
Кроме того, у 1 испытуемого-правши проводили обработку ЭЭГ методом пространственного ICA в модификации Г.Г. Князева [Knyazev et al., 2011] в программе GIFT. Анализировали топографию источников ЭЭГ-активности по каждому из основных диапазонов физиологических ритмов: дельта (1–4 Гц), тета (4–8 Гц), альфа (8–12 Гц) и бета (12–30 Гц). Сопоставляли соответствие топографии фМРТ сетей DMN, Sensorimotor и Executive control c локализацией эквивалентных источников разных составляющих ЭЭГ активности: качественно и на основе расчета пространственных корреляций.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
На основе освоенного алгоритма ICA-анализа фМРТ RS, будь то групповые или индивидуальные данные, выделялось порядка 60 независимых компонент, после экспертной оценки которых с дифференцировкой “артефактных” и истинных нейрональных сетей определялись 23–25 значимых RSN. Их сопоставляли с описанными в литературе [Smith et al., 2009; Cordes et al., 2000; Rosazza, Minati, 2011] и идентифицировали до 15 основных, сходных по топографии с “эталонными”.
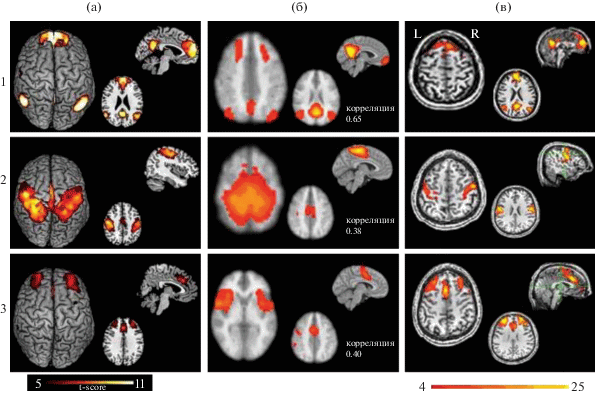
При групповом анализе RS к числу основных сетей были отнесены 13 (рис. 1 (б) и 2 (б)), демонстрирующих наибольшее сходство с эталонными, что подтверждалось высокими (от 0.4 до 1) коэффициентами корреляции с шаблонами [Smith et al., 2009] (рис. 1(а), 2(а)). При этом некоторые RSN проявлялись в нескольких модификациях (как например, визуальная – в форме латеральной, медиальной и полюсно-затылочной, а также передняя и задняя сети ДМН), либо в виде нескольких “дублеров”. Наибольшей корреляцией с эталонными сетями характеризовались сети DMN (1.0 для DMN anterior; 0.65 для DMN posterior – показано на рис. 2(б), 1), а также латеральная визуальная и фронто-париетальные, представленные на рис. 1. Меньшей, порядка 0.38–0.40, была сопряженность с шаблоном сенсомоторной сети и когнитивного контроля (рис. 2(б), 2,3).
Рис. 2.
Отображение трех сетей покоя, выявляемых при групповом и индивидуальном анализе здоровых испытуемых, в сопоставлении с эталонными. 1 – сеть DMN, 2 – сенсомоторная, 3 – сеть управляющих функций. (а) – образцы трех указанных сетей по Rosazza, C., Minati, L., 2011. (б) – сети, полученные усреднением фМРТ RS по группе здоровых испытуемых (N = 15); цифрами показана корреляция c шаблоном Smith et al., 2009. (в) – примеры индивидуальных сетей: 1 (в) – исп. Е-вой, 2 (в) и 3 (в) – исп. Б-ва.
Fig. 2. The mapping of three resting networks, revealed in the group and individual analysis of healthy subjects, compared with the reference ones. 1 – DMN network, 2 – sensorimotor network, 3 – executive control network. (а) – samples of the three specified networks by Rosazza, C., Minati, L., 2011. (б) – networks obtained by averaging fMRT RS in a group of healthy subjects (N = 15); figures show the correlation with the template Smith et al., 2009. (в) – examples of individual networks: 1 (в) – ex. Е-va, 2 (в) and 3 (в) – ex. B-va.
Для основных сетей были рассчитаны интегральные количественные показатели: объем активации, максимальная интенсивность, частота доминирующего пика и средняя частота активной зоны спектра.
Большинство RSN, выявленных при индивидуальном анализе данных фМРТ, также обнаруживали значительное топографическое сходство и с описанными в литературе эталонными, и с групповыми сетями (рис. 2 (в)). Это касается также ряда количественных показателей, полученных путем усреднения индивидуальных данных по группе наблюдений.
На рис. 3 (а) отображена диаграмма представленности 8 основных нейронных сетей по результатам индивидуального анализа RS в выборке наблюдений из 12 человек. Наиболее часто (100% наблюдений) выделялись сети DMN и слуховая № 7. Активизация последней может быть обусловлена шумом, сопровождающим фМРТ-исследование и достигавшим во время эксперимента уровня 90–100 Дб. Несколько реже (83% наблюдений) определялись латерализованные фронто-париетальные сети (№ 5 и 6). Представленность других сетей была менее стабильной (от 67% до 50% наблюдений). Сеть контроля, в частности, была выявлена в 58% случаев.
Рис. 3.
Анализ выраженности типичных сетей RS в группе здоровых испытуемых. Диаграммы представленности 8 сетей RS (а) – во всей выборке наблюдений (N = 12); (б) – раздельно у мужчин (более темные столбики, М) и женщин (Ж); (в) – у правшей и левшей. По оси Х – номер сети RS: 1 – DMN, 2 – сенсомоторная; 3 – медиальная зрительная; 4 – сеть контроля; 5, 6 – латерализованные фронтопариетальные; 7 – слуховая; 8 – височно-теменнная. По оси Y – процент встречаемости сети в группе.
Fig. 3. Analysis of the typical RS networks severity in the healthy group. Diagrams of representation of 8 RS networks (а) – in the whole sample of observations (N = 12); (б) – separately for men (darker bars, M) and women (Ж); (в) – in right-handed and left-handed people. On the X axis – the RS network number: 1 – DMN, 2 – sensorimotor; 3 – medial visual; 4 – control network; 5, 6 – lateralized frontoparietal; 7 – auditory; 8 – temporo-parietal. The Y-axis represents the percentage of the network in the group.
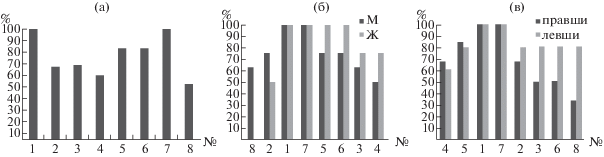
Отмечена неидентичность встречаемости основных сетей RS у мужчин и женщин (рис. 3 (б)), а также у правшей и левшей (рис. 3 (в)). Более стабильно основные сети идентифицировались у женщин по сравнению с мужчинами, хотя статистически различия были незначимы. Для мужчин же более характерным было наличие сетей № 2 (сенсомоторной) и особенно № 8 (височно-теменной), которая у женщин вообще не определялась. Для последней гендерные различия были приближены к достоверным (p < 0.08 по точному критерию Фишера). Что касается фактора функциональной моторной асимметрии (рис. 3, III), то для четырех сетей обнаружена большая стабильность их проявления у левшей по сравнению с правшами. Это относится, в частности, к правой фронто-париетальный сети № 6: 80% встречаемости у левшей, 50% – у правшей.
На примере сети DMN было проанализировано распределение индивидуальных интегральных количественных характеристик – объема (см3) активированных вокселов (рис. 4 (I)) и максимальной интенсивности (рис. 4 (II)) – в зависимости от пола испытуемых, профиля функциональной моторной асимметрии, а также типа ЭЭГ. Оказалось, что параметр “объем активации” в выборке наблюдений достаточно вариативен: при среднем значении 77.9 ± 11.8 см3 его разброс по испытуемым составляет от +35% до –43%. При отсутствии статистически значимых гендерных различий этого показателя вследствие его значительных внутригрупповых разбросов (рис. 4 I (а)), корреляции с особенностями ЭЭГ (рис. 4 I (в)), отмечена сопряженность объема активации сети DMN с моторной функциональной асимметрией испытуемых. На рис. 4 I (б) видно, что большие его значения присущи левшам обоего пола по сравнению с правшами (p = 0.047 по критерию Стьюдента).
Рис. 4.
Сопоставление количественных показателей сети DMN с индивидуальными особенностями испытуемых. Гистограммы распределения объема (I) и интенсивности (II) активации сети DMN (а) – по полу испытуемых; (б) – по профилю МПА (в) – по типу ЭЭГ. На (а) темные столбики – мужчины, светлые – женщины. На (б) темные столбики – правши, светлые – левши. По оси У на I – объем активации сети DMN в см3, на II – максимальная интенсивность активации этой сети. По оси Х на (в) – ранг ЭЭГ: 1 – регулярный альфа-ритм с выраженными зональными различиями – сбалансированные корково-подкорковые отношения; 2 – регулярный альфа-ритм с тета-колебаниями в центрально-лобных отделах – нерезкое усиление влияний в коре со стороны диэнцефальных образований мозга; 3 – регулярный альфа-ритм с усиленными признаками раздражения срединно-диэнцефальных образований (перераспределение альфа на передние отделы, билатеральные заостренные вспышки); 4 – нерегулярный альфа-ритм, нерезкое снижение амплитуды биопотенциалов и усиление диффузных ирритативных знаков, десинхронизация – усиление влияний неспецифической активирующей системы орального ствола.
Fig. 4. Comparison of the DMN network quantitative indicators with the individual characteristics of the subjects. Distribution histograms of the volume (I) and the activation intensity (II) DMN network (а) – by sex of the subjects; (б) – by the profile of interhemispheric asymmetry (в) – by type of EEG. At (а) the dark bars are men, the light ones are women. On (б) the dark bars are right handed, light columns are left-handed. On the Y-axis, I denotes the DMN network activation volume in cm3, on II – the maximum activation intensity of this network. On the X-axis, in diagrams (в) – EEG rank: 1 – regular alpha rhythm with pronounced zonal differences – balanced cortical-subcortical relationships; 2 – regular alpha rhythm with theta-oscillations in the central frontal areas – an unsharpening amplification of the effects in the cortex from the side of the diencephalic structures of the brain; 3 – regular alpha rhythm with enhanced signs of irritation of mid-diencephalic formations (redistribution of alpha to anterior divisions, bilateral sharp points); 4 – irregular alpha-rhythm, an uneven decrease in the amplitude of biopotentials and an increase in diffuse irrational signs, desynchronization – intensification of the nonspecific brainstem activating system effects.
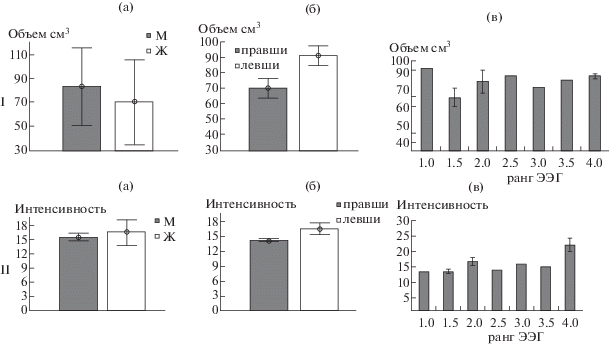
Параметр “интенсивность активации сети DMN” в целом был более стабилен в группе наблюдений (рис. 4 II). Он имеет близкие значения (15.3 ± 1.6) у большинства (11 из 12) испытуемых при его индивидуальной вариативности в пределах от +25% до –15% (в среднем 10.3%). (Исключение составил испытуемый – амбидекстр с интенсивностью сигнала 25.3). При отсутствии достоверных статистических различий этого показателя между мужчинами и женщинами (рис. 4 II (а), правшами и левшами (4 II (б)), выявлено наличие положительной статистически значимой монотонной связи между интенсивностью сети DMN и рангом ЭЭГ испытуемых (рис. 4 II (в)): согласно ранговому критерию корреляции Спирмена R(s) = 0.69, p = 0.02. Т.е. имеет место почти линейное нарастание интенсивности активации сети DMN по мере повышения ранга ЭЭГ, т.е. усиления в ее рисунке признаков раздражения срединных образований мозга, в особенности со стороны орального ствола, отражая активирующие влияния со стороны верхнестволовой ретикулярной формации.
Наряду со структурно-топографическим анализом исследовали также частотные характеристики гемодинамических спектров отдельных сетей: среднюю частоту активной зоны и частоту доминирующего пика. При групповом и индивидуальном измерениях этих показателей порядок характеристик был одинаковым. Вместе с тем сравнение их индивидуальных значений по основным сетям RS показало, что “частота доминирующего пика” у здоровых людей весьма вариативна: колебания ее значений для одной сети в группе нормы могли достигать 70%. В то же время средняя частота активной зоны оказалась более стабильным параметром в группе наблюдений: разброс значений для одной сети колебался от 7% (DMN) до 25%.
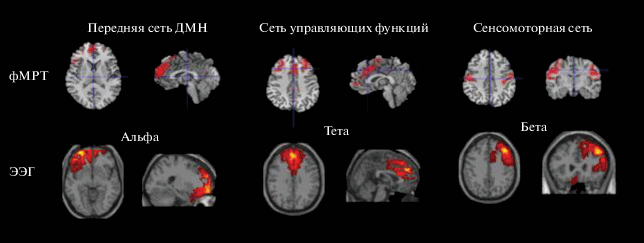
Пилотные фМРТ – ЭЭГ сопоставления показателей состояния покоя, проведенные у здорового испытуемого – правши Б-ва, выявили хотя и низкие (порядка 0.15–0.23), но значимые корреляции сетевых гемодинамических сигналов DMN, Sensorimotor, Executive control и ЭЭГ-активности всех анализируемых частотных диапазонов. Вместе с тем было отмечено избирательное сходство топографии каждой из трех рассматриваемых сетей фМРТ по отношению к локализации источников отдельных ритмов ЭЭГ (рис. 5): DMN – с альфа (причем в форме двух независимых источников: лобного и затылочного), а также дельта и бета (лобные источники); Sensorimotor – с источниками бета-активности; Еxecutive control – альфа- и тета-активности.
Рис. 5.
Сопоставление топографии сетей покоя фМРТ и локализации источников отдельных ритмов ЭЭГ у здорового испытуемого.
Fig. 5. Comparison of the fMRI resting networks topography and localization of the EEG rhythms sources in a healthy subject.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
В настоящей работе представлены результаты ICA, реализованного на базе программного обеспечения FSL для выявления в сигналах фМРТ-нейрональных сетей мозга, активированных в состоянии покоя у здоровых людей. Выделенные при этом RSN были сходными между собой по топографии в индивидуальных наблюдениях, а также общими для группы испытуемых. Основные сети покоя соответствовали также RSN, описанным другими исследователями [Smith et al., 2009; Cordes et al., 2000; Rosazza, Minati, 2011] и значимо коррелировали с шаблонами [Smith et al., 2009]. Это подтверждает корректность, надежность и эффективность используемого алгоритма.
Был апробирован ряд количественных характеристик активности сетей RS. К ним относятся частотные: достаточно известная частота доминирующего пика, а также средняя частота активной зоны. Менее распространены такие параметры, как интегральный объем активации и интенсивность сети. Было выявлено, что ряд использованных количественных показателей, полученных при индивидуальном и групповом анализе RSN у здоровых людей, сходны. При этом отмечена разная степень индивидуальной вариативности этих характеристик. Например, объем сети DMN, наименее стабильный в группе наблюдений, сопряжен с такой психофизиологической характеристикой, как профиль моторной функциональной асимметрии, а также зависит от вида проводимого анализа. В то же время интенсивность активации сети, почти независимая от вида анализа, характеризуется меньшим разбросом индивидуальных значений, т.е. более стабильна, и коррелирует с состоянием срединных (регуляторных) образований мозга, которое подвержено существенным изменениям при разных формах церебральной патологии. Из частотных показателей большей стабильностью в норме характеризуется средняя частота активной зоны спектра.
Менее вариативные в норме характеристики RSN могут, по нашему мнению, иметь преимущественную диагностическую ценность для исследований сетей покоя в патологии. Это предположение подтверждается результатами наших пилотных фМРТ-исследований RS у пациентов с тяжелой черепно-мозговой травмой: угнетение сознания у них сопровождалось редукцией корковых составляющих сети DMN, а также резким снижением интенсивности ее активации и частотных показателей [Gavron et al., 2015]. Конечно же, требуется уточнение информативности использованных количественных характеристик RSN на большей выборке здоровых испытуемых. Однако полученные уже в этой работе данные свидетельствуют о перспективности использования рассматриваемых показателей фМРТ-сетей покоя для экспресс-диагностики или экспертной оценки активности головного мозга при патологии в сравнении с их нормативными значениями в качестве опорных.
Выявленная в работе вариативность индивидуальных сетей покоя в норме согласуется с отмечавшейся нами ранее вариативностью фМРТ-ответов здоровых испытуемых при разных видах деятельности, cопряженной с рядом их индивидуальных характеристик [Шарова и др., 2015]. Вариативностью RSN, как, например, сети контроля, может объясняться неодинаковая степень корреляции с шаблоном усредненных сетей по группе наблюдений. Пытаясь выявить факторы, обусловливающие эту вариативность, мы показали в целом более стабильное выделение основных RSN у женщин по сравнению с мужчинами. Косвенным образом это согласуется с результатами мегааналитического исследования 603 здоровых испытуемых: присущая женщинам в целом большая интенсивность (а значит и выделяемость) сетей покоя по сравнению с мужчинами [Lowe et al., 2002]. В то же время у мужчин лучше выделялись сенсомоторная и височно-теменная сети. Эти данные служат еще одним подтверждением отмечаемых в литературе выраженных гендерных различий функционирования ассоциативных теменных корковых областей у человека [Славуцкая и др., 2012]. Данные, касающиеся особенностей сети DMN у правшей и левшей (большие значения объема ее активации присущи левшам обоего пола по сравнению с правшами), согласуются с устоявшимися уже в разных нейронауках представлениями о более диффузной организации церебральных функций у левшей по сравнению с правшами [Брагина, Доброхотова, 1981; Жаворонкова, 2009; Pool et al., 2015].
Представленные результаты работы свидетельствуют, по нашему мнению, о правомерности анализа сетей покоя и их показателей не только по группам наблюдений, но и индивидуально. В первую очередь это, конечно же, касается исследований при патологии. Вместе с тем и у здоровых людей такой подход способствует, во-первых, объяснению некоторых результатов группового анализа, во-вторых, предварительному выбору групп сравнения, в-третьих, выявлению “точек исследовательского роста”. В этой связи представленные нами результаты индивидуального фМРТ- и ЭЭГ-сопоставления указывают на перспективность исследований с использованием в качестве одного из ЭЭГ-маркеров сетей покоя топографии источников отдельных ритмов [Knyazev et al., 2011; Babiloni et al., 2016].
ВЫВОДЫ
1) Посредством анализа независимых компонент (ICA) на базе программного обеспечения FSL (FMRIB Software Library) у здоровых людей выделены RNS, сопоставимые с данными литературы, воспроизводимые при групповом и индивидуальном анализе, что подтверждает корректность и возможности проведения последнего в норме и патологии.
2) При индивидуальном анализе RNS выявлена вариативность ответов, сопряженная с рядом психофизиологических особенностей здоровых испытуемых (пол, профиль моторной асимметрии, паттерн ЭЭГ), объясняющая отчасти разную степень соответствия шаблонам групповых сетей.
3) Менее вариативные в норме количественные характеристики RSN (как, например, максимальная интенсивность активации сети, средняя частота активной зоны спектра, частота доминирующего пика) могут иметь преимущественную диагностическую ценность для исследований сетей покоя в патологии.
Работа выполнена при поддержке Гранта РГНФ № 15-36-01038 и РФФИ № 18-013-00355.
Список литературы
Бизюк А.П. Компендиум методов нейропсихологического исследования. СПб.: Речь, 2005. 400 с.
Болдырева Г.Н., Шарова Е.В., Добронравова И.С. Роль регуляторных структур в формировании ЭЭГ человека. Физиология человека. 2000. 5: 19–34.
Брагина Н.Н., Доброхотова Т.А. Функциональные асимметрии человека. М: Медицина, 1981. 240 с.
Верхлютов В.М., Соколов П.А., Ушаков В.Л., Стрелец В.Б. Модификация и динамика сетей состояния покоя при просмотре и воображении видеосюжетов. Тезисы докладов Шестой международной конференции по когнитивной науке. Калининград. 23–27 июня 2014: 209–210.
Гаврон А.А., Шарова Е.В., Смирнов А.С., Абдулаев А.С., Фадеева Л.М., Челяпина М.В., Верхлютов В.М. Применение алгоритма независимых компонент для анализа фМРТ в состоянии оперативного покоя человека (resting state) в норме и патологии. Тезисы докладов VI Троицкой конференции “Медицинская физика и инновации в медицине”. Троицк–Москва. Июнь 2014: 22–24.
Жаворонкова Л.А. Правши-левши. Межполушарная асимметрия биопотенциалов мозга человека. Краснодар: Экоинвест, 2009. 239 с.
Катаева Г.В., Коротков А.Д., Киреев М.В., Медведев С.В. Факторная структура значений регионарного мозгового кровотока и скорости метаболизма глюкозы как инструмент исследования дефолтной моды мозга. Физиология человека. 2013. 39 (1): 60–66.
Клиническая электроэнцефалография (под ред. В.С. Русинова). М.: Медицина. 1973. 340 с.
Мартынова О.В., Сушинская-Тетерева А.О., Балаев В.В., Иваницкий А.М. Корреляция функциональной связанности областей мозга, активных в состоянии покоя, с поведенческими и психологическими показателями. Журнал высшей нервной деятельности. 2016. 66 (5): 541–555.
Медведев С.В., Пахомов С.В., Рудас М.С., Алхо М., Терваниеми К., Рейникайнен Р., Наатанен А. О выборе состояния спокойного бодрствования как референтного при психологических пробах. Физиология человека. 1996. 22 (1): 5–15.
Славуцкая А.В., Герасименко Н.Ю., Михайлова Е.С. Распознавание пространственно преобразованных фигур мужчинами и женщинами: анализ поведения и вызванных. Физиология человека. 2012. 38 (3): 18–29.
Шарова Е.В., Шендяпина М.В., Болдырева Г.Н., Давыдова Н.Ю., Мигалев А.С., Челяпина М.В., Куликов М.А., Жаворонкова Л.А., Ениколопова Е.В., Фадеева Л.М., Корниенко В.Н. Анализ индивидуальной вариативности фМРТ ответов здоровых испытуемых при открывании глаз, двигательных и речевых нагрузках. Физиология человека. 2015. Т. 41. № 1. С. 5–16.
Штарк М.Б., Коростышевская А.М., Резакова М.В., Савелов А.А. Функциональная магнитно-резонансная томография и нейронауки. Успехи физиологических наук. 2012. 43 (1): 3–29.
Allen E.A., Erhardt E.B., Damaraju E., Gruner W., Segall J.M., Silva R.F., Havlicek M., Rachakonda S., Fries J., Kalyanam R., Michael A.M., Caprihan A., Turner J.A.,Eichele T., Adelsheim S., Bryan A.D., Bustillo J., Clark V.P., Feldstein Ewing S.W., Filbey F., Ford C.C., Hutchison K., Jung R.E., Kiehl K.A., Kodituwakku P., Komesu Y.M., Mayer A.R., Pearlson G.D., Phillips J.P., Sadek J.R., Stevens M., Teuscher U., Thoma R.J., Calhoun V.D. A baseline for the multivariate comparison of resting-state networks. Frontiers in Systems Neuroscience. 2011. (5): 1–19.
Babiloni C., Del Percio C., Caroli A., Salvatore E., Nicolai E., Marzano N., Lizio R., Cavedo E., Landau S., Chen K., Jagust W., Reiman E., Tedeschi G., Montella P., De Stefano M., Gesualdo L., Frisoni G.B., Soricelli A. Cortical sources of resting state EEG rhythms are related to brain hypometabolism in subjects with Alzheimer’s disease: an EEG-PET study. Neurobiology of Aging. 2016. 48: 122–134.
Balaev V., Petrushevsky A., Martynova O. Functional connectivity in chronic stroke compared with normal aging changes. Materials of the CCCP Workshop. National Research University Higher School of Economics. Moscow, Russia. December 2014. P. 12.
Beckmann C.F., DeLuca M., Devlin J.T., Smith S.M. Investigations into resting-state connectivity using independent component analysis. Philos Trans R Soc Lond B Biol Sci. 2005. 360: 1001–1013.
Biswal B., Yetkin F.Z., Haughton V.M., Hyde J.S. Functional connectivity in the motor cortex of resting human brain using echo-planar MRI. Magn Reson Med. 1995. 34: 537–541.
Biswal B.B., Mennes M., Zuo, X.N., Gohel S., Kelly C., Smith S.M. et al. Toward discovery science of human brain function. Proc. Natl. Acad. Sci. USA. 2010. 107: 4734–4739.
Bonavita S., Gallo A., Sacco R., Corte M.D., Bisecco A., Docimo R., Lavorgna L., Corbo D., Costanzo A.D., Tortora F., Cirillo M., Esposito F., Tedeschi G. Distributed changes in default-mode resting-state connectivity in multiple sclerosis. Mult Scler. 2011. 17: 411–422.
Bonhomme V., Vanhaudenhuyse A., Demertzi A., Bruno M.-A., Jaquet O., Bahri M.A., Plenevaux A., Boly M., Boveroux P., Soddu A., Brichant J.F., Maquet P., Laureys S. Resting-state Network-specific Breakdown of Functional Connectivity during Ketamine Alteration of Consciousness in Volunteers. Anesthesiology. 2016. 125 (5): 873–888.
Calhoun V.D., Adali T., Pekar J.J. A method for comparing group fMRI data using independent component analysis: Application to visual, motor and visuomotor tasks. Magn. Reson. Imaging. 2004. 2004. 22: 1181–1191.
Calhoun V.D., Kiehl K.A., Pearlson G.D. Modulation of temporally coherent brain networks estimated using ICA at rest and during cognitive tasks. Hum Brain Mapp. 2008. 29: 828–838.
Corbetta M., Shulman G.L. Control of goal-directed and stimulus-driven attention in the brain. Nat Rev Neurosci. 2002. 3: 201–215.
Cordes D., Haughton V.M., Arfanakis K., Wendt G.J., Turski P.A., Moritz C.H., Quigley M.A., Meyerand M.E. Mapping functionally related regions of brain with functional connectivity MR imaging. Am J Neuroradiol. 2000. 21: 1636–1644.
Dumas E.M., van den Bogaard Simon J.A., Hart E.P., Soeter R.P., van Buchem M.A., van der Grond J., Rombouts S.A.R.B., Roos R.A.C. Reduced functional brain connectivity prior to and after disease onset in Huntington’s. Neuroimage: Clinical. 2013. 2. P. 377–384. http://dx.doi.org/10.1016/j.nicl.2013.03.001.
Friston K.J., Frith C.D., Liddle P.F., Frackowiak R.S. Functional connectivity: the principal- component analysis of large (PET) data sets. J.Cereb. Blood Flow Metab. 1993. 13 (1): 5–14.
Gavron A.A., Sharova E.V., Abdulaev A.A., Smirnov A.S., Fadeeva L.M., Chelyapina M.V., Zaytsev O.S., Verkhlyutov V.M., Pronin I.N. Our experience of the comparative fmri resting state (RS) analysis in normal subjects and patients with severe traumatic brain injury (TBI) according the algorithm of independent components analysis (ICA). Book of abstracts of the 15-th European Congress on Clinical Neurophysiology. Brno. Czech Republic. Sept-oct 2015: 213.
Golestani A.M., Goodyear B.G. Regions of interest for resting-state fMRI analysis determined by inter-voxel cross-correlation. Neuroimage. 2011. 56 (1): 246–251.
Greicius M.D., Krasnow B., Reiss A.L., Menon V. Functional connectivity in the resting brain: A network analysis of the default mode hypothesis. PNAS. 2003. 100 (1): 253–258.
Gusnard D.A., Akbudak E., Shulman G.L., Raichle M.E. Medial prefrontal cortex and self-referential mental activity: Relation to a default mode of brain function. Proc Natl Acad Sci U S A. 2001. 98 (7): 4259–4264.
Hyvärinen A., Oja E. Independent component analysis: algorithms and applications. Neural Netw. 2000. 13 (4–5): 411–430.
Jenkinson M., Beckmann C.F., Behrens T.E., Woolrich M.W., Smith S.M. FSL. NeuroImage. 2012. 62: 782–790.
Knyazev G.G., Slobodskoj-Plusnin J.Y., Bocharov A.V., Pylkova L.V. The default mode network and EEG alpha oscillations: An independent component analysis. Brain Research . 2011.1402: 67–79.
Lee M.H., Smyser C.D., Shimony J.S. Resting-State fMRI: A Review of Methods and Clinical Applications. AJNR Am J Neuroradiol. Oct. 2013. 34: 1866–72.
Lowe M.J., Phillips M.D., Lurito J.T., Mattson D., Dzemidzic M., Mathews V.P. Multiple sclerosis: low-frequency temporal blood oxygen level-dependent fluctuations indicate reduced functional connectivity initial results. Radiol. 2002. 224: 184–192.
Pan Wang, Bo Zhou, Hongxiang Yao, Yafeng Zhan, Zengqiang Zhang, Yue Cui, Kaibin Xu, Jianhua Ma, Luning Wang, Ningyu An, Xi Zhang, Yong Liu, Tianzi Jiang. Aberrant intra- and inter-network connectivity architectures in Alzheimer’s disease and mild cognitive impairment. Scientific Reports. 2015. 5. 14824: 1–12. doi 10.1038/srep14824.
Pool E.M., Rehme A.K., Eickhoff S.B., Fink G.R., Grefkes C. Functional resting-state connectivity of the human motor network: Differences between right- and left-handers. NeuroImage. 2015. 109: 298–306.
Raichle M.E., Mintun M.A. Brain work and brain imaging. Annu Rev Neurosci. 2006. 29: 449–476.
Raichle M.E. Two views of brain function. Trends Cogn Sci. 2010; 14: 180–190.
Rocca M.A., Valsasina P., Absinta M., Riccitelli G., Rodegher M.E., Misci P., Rossi P., Falini A., Comi G., Filippi M. Default-mode network dysfunction and cognitive impairment in progressive MS. Neurol. 2010. 74: 1252–1259.
Rosazza C., Minati L. Resting-state brain networks: literature review and clinical applications. Neurol Sci. 2011. 32 (5): 773–785.
Smith S.M., Fox P.T., Miller K.L., Glahn D.C., Fox P.M., Mackay C.E., Filippini N., Watkins K.E., Toro R., Laird A.R., Beckmann C.F. Correspondence of the brain’s functional architecture during activation and rest. Proc. Natl. Acad. Sci. U.S.A. 2009. 106: 13040–13045.
Schöpf V., Windischberger C., Kasess C.H., Lanzenberger R., Moser E. Group ICA of resting-state data: a comparison.MAGMA. 2010. 23 (5–6): 317–325.
Tedeschi G., Trojsi F., Tessitore A., Corbo D., Sagnelli A., Paccone A., D’Ambrosio A., Piccirillo G., Cirillo M., Cirillo S., Monsurrò M.R., Esposito F. Interaction between aging and neurodegeneration in amyotrophic lateral sclerosis. Neurobiol Aging. 2012. 33: 886–898.
Ushakov V.L., Sharaev M.G., Kartashov S.I., Zavyalova V.V., Verkhlyutov V.M., Velichkovsky B.M. Dynamic Causal Modeling of Hippocampal Links within the Human Default Mode Network: Lateralization and Computational Stability of Effective Connections. Front. Hum. Neurosci. 2016. 10:528. doi 10.3389/fnhum.2016.00528
Van Dijk K.R., Hedden T., Venkataraman A., Evans K.C., Lazar S.W., Buckner R.L. Intrinsic functional connectivity as a tool for human connectomics: theory, properties, and optimization. J Neurophysiol. 2010. 103: 297–321.
Vanhaudenhuyse A., Noirhomme Q., Tshibanda L.J.-F., Bruno M.-A., Boveroux P., Schnakers C., Soddu A., Perlbarg V., Ledoux D., Jean-François Brichant, Moonen G., Michael D., Greiciu M.D., Laureys S., Boly M. Default network connectivity reflects the level of consciousness in non-communicative brain-damaged patients. Brain (A Journal of Neurology). 2010. 133 (1): 161–171.
Wang D., Buckner R.L., Fox M.D., Holt D.J., Holmes A.J., Stoecklein S., Langs G., Pan R., Qian T., Li K., Baker J.T., Stufflebeam S.M., Wang K., Wang X., Hong Bo, Liu H. Parcellating cortical functional networks in individuals. Nature Neurosciense. 2015. 18 (12): 1853–1860.
Widjaja E., Zamyadi M., Raybaud C., Snead O.C., Smith M.L. Impaired Default Mode Network on Resting-State fMRI in Children with Medically Refractory Epilepsy. AJNR Am J Neuroradiol. Mar 2013. 34: 552–57.
Дополнительные материалы отсутствуют.
Инструменты
Журнал высшей нервной деятельности им. И.П. Павлова


