Журнал высшей нервной деятельности им. И.П. Павлова, 2019, T. 69, № 2, стр. 248-255
Влияние однократного введения агониста и антагониста рецепторов эндоканнабиноидной системы на развитие поведенческих нарушений после эпилептического статуса
М. А. Борисова 1, 2, Е. М. Сулейманова 1, *
1 ФГБУН Институт высшей нервной деятельности и нейрофизиологии РАН
Москва, Россия
2 ФГБОУ ВО “Московский государственный университет им. М.В.Ломоносова”
Москва, Россия
* E-mail: e.m.suleymanova@gmail.com
Поступила в редакцию 18.12.2017
После доработки 23.07.2018
Принята к публикации 24.09.2018
Аннотация
Эпилептический статус (ЭС) является опасным состоянием, вызывающим ряд патологических последствий, среди которых высокая смертность, развитие височной эпилепсии, ухудшение памяти, нейродегенерация в различных областях мозга, эмоциональные и поведенческие нарушения. Недавно открытое свойство эндоканнабиноидов ограничивать синаптическую передачу делает ее потенциально мощным агентом снижения эксайтотоксичности во время эпилептического статуса, а значит, и предотвращения нарушений, вызываемых ею. В настоящей работе мы исследовали эффекты однократного введения агониста и антагониста эндоканнабиноидных рецепторов на развитие тревожных и депрессивных расстройств у крыс в хронический период после литий-пилокарпинового эпилептического статуса. Было показано, что активация эндоканнабиноидной системы в ранний период после ЭС частично ослабляет поведенческие нарушения, в то время как блокада эндоканнабиноидных рецепторов, напротив, усугубляет их.
ВВЕДЕНИЕ
Эпилептический статус (ЭC) – это состояние, которое характеризуется длительной судорожной активностью или частыми повторяющимися припадками без полного восстановления сознания в течение 30 мин и более [DeLorenzo et al., 1999]. Риски, связанные с возникновением ЭС, чрезвычайно разнообразны. В первую очередь, это высокая смертность, возникающая приблизительно в 20 процентах случаев [Dham et al, 2014]. По данным разных отчетов, смертность после ЭС может колебаться от 7.6 до 39% [Leitinger et al., 2015]. Длительные судороги при ЭС приводят к гибели нейронов и реактивному глиозу в гиппокампе, миндалине, дорсомедиальном ядре таламуса, слое клеток Пуркинье мозжечка, повреждениям пириформной и энторинальной коры [Fujikawa et al., 2000], также могут привести к реорганизации нейронных сетей и спрутингу аксонов, который, в свою очередь, ведет к формированию аномальных возвратных возбуждающих связей с пирамидными клетками поля CA3 гиппокампа через разрастание мшистых волокон гранулярных клеток зубчатой фасции [Cronin, Dudek, 1988]. Таким образом, ЭС запускает каскад патологических процессов, который может привести к эпилептогенезу: показано, что ЭС является фактором, повышающим риск развития височной эпилепсии [Gorter et al., 2015].
Нейродегенеративные изменения, реорганизация нейронных связей, происходящие после ЭС и во время эпилептогенеза, могут приводить к функциональным расстройствам ЦНС. В клинике показано, что у пациентов с височной эпилепсией часто диагностируются депрессивные расстройства [Fiest et al., 2013]. Также среди пациентов с эпилепсией чаще, чем в общей популяции, встречаются люди, страдающие от тревожных расстройств, включая социофобию, специфические фобии, паническое расстройство, генерализованное тревожное расстройство и др. [Brandt, Mula, 2016]. Различные формы эмоциональных расстройств значительно ухудшают качество жизни пациента, а также сами, в свою очередь, могут усугубить течение других заболеваний [Казимирова и др., 2017]. Помимо тревожных расстройств, хроническая височная эпилепсия часто сопровождается синдромом дефицита внимания [Bocquillon et al, 2009], нарушениями процессов обучения и различными нарушения памяти [Holmes, 2015].
Эндоканнабиноидная система мозга представляет большой интерес для исследований в области эпилепсии. Рецепторы эндоканнабиноидной системы 1 типа СВ1 (endocannabinoid receptors) при взаимодействии с агонистами тормозят выделение медиатора в синаптическую щель, таким образом регулируя возбудимость нейронов [Friedman, Devinsky, 2015]. В недавнем исследовании было показано, что мыши, нокаутные по генам рецепторов эндоканнабиноидной системы 1 и 2 типа СВ1- и СВ2, в 80% случаев демонстрировали эпилептические приступы, в то время как у нокаутов только по СВ1-рецепторам был выявлен сниженный порог возникновения судорог в каинатной модели височной эпилепсии [Rowley et al., 2017]. Также было показано, что предварительное введение агониста эндоканнабиноидных рецепторов WIN 55,212-2 способно подавлять развитие судорожной активности на модели ЭС у морских свинок [Шубина, Кичигина, 2011]. Помимо влияния на выделение медиатора, известно, что активация эндоканнабиноидных рецепторов может иметь противовоспалительный эффект. За это ответственны СВ2-рецепторы, которые расположены преимущественно на мембранах иммунных клеток: Т- и B-лимфоцитов и макрофагов на периферии и микроглиальных клетках в ЦНС [Maresz et al., 2005].
Хорошо известно, что нейродегенеративные процессы и реорганизация связей в гиппокампе приводят к поведенческим расстройствам в экспериментальных моделях [Gröticke et al., 2007; Maia et al., 2014; Tchekalarova et al., 2017]. Одной из таких моделей является литий-пилокарпиновая модель ЭС у крыс с последующим эпилептогенезом и развитием спонтанных судорог в хронический период. Она достаточно хорошо воспроизводит особенности височной эпилепсии и гиппокампального склероза у человека. Задачей нашей работы явилось изучение влияния однократного введения агониста и антагониста рецепторов эндоканнабиноидов на развитие поведенческих нарушений в хронический период после ЭС.
МЕТОДИКА
Работа была проведена на взрослых самцах крыс линии Wistar (n = 92) (вес на начало эксперимента 175–250 г). Все работы с экспериментальными животными проводились в соответствии с международными правилами содержания и обращения с животными (Директива от 22 сентября 2010 г. – 2010/63/EU).
Крысам внутрибрюшинно вводили хлорид лития (Lithium Chloride, Acros Organics, США) в физиологическом растворе за 24 ч до эксперимента из расчета 127 мг/кг (3 ммоль/кг). Для инициации судорог делали внутрибрюшинную инъекцию гидрохлорида пилокарпина (Pilocarpine hydrochloride, Sigma, США), растворенного в физрастворе, из расчета 28 мг/кг. Для наблюдения развития ЭС в течение 1.5 ч крыс помещали в плексигласовые боксы с прозрачными стенками и регистрировали на видео при помощи цифровой видеокамеры. Крысам группы Контроль вместо инъекции пилокарпина вводили физиологический раствор. Тяжесть судорог оценивали по шкале Racine [Racine, 1972]. Отмечали время начала судорожной активности, началом ЭС считали появление 3–4 стадии. После полутора часов ЭС судороги купировали пентобарбиталом (Nembutal, Ceva Sante Animale, Франция, 25 мг/кг внутрибрюшинно). Через четыре часа после купирования ЭС группе крыс WIN производили внутрибрюшинную инъекцию агониста CB1- и СВ2-рецепторов WIN-55,212-2 в дозе 5 мг/кг (WIN-55,212-2, Sigma, США) в растворе 5% диметилсульфоксида (ДМСО) и 1% твин-80 (Tween-80, Sigma, США), а группе крыс AM251 – внутрибрюшинную инъекцию антагониста СВ1-рецепторов АМ251 в дозе 3 мг/кг (AM251, Abcam, США) в растворе 5% ДМСО и 1% твин-80. Еще одной группе крыс вводили растворитель (ДМСО) в эквивалентном объеме. Через 4 мес. проводили батарею поведенческих тестов: тест на вкусовое предпочтение, тест “приподнятый крестообразный лабиринт” (ПКЛ), тест “открытое поле” (ОП).
Тест на вкусовое предпочтение
При проведении теста на вкусовое предпочтение крыс помещали в индивидуальные боксы с двумя одинаковыми поилками. Корм был доступен без ограничений. В первый день (претест) в поилки наливали по 100 мл водопроводной воды, через 24 ч замечали объем выпитой воды. Во второй день в одной из поилок воду заменяли на 1% раствор сахарозы, через 24 ч измеряли объем выпитой жидкости. Для исключения предпочтения стороны поилки меняли местами и снова измеряли объем выпитого через 24 ч.
Тесты “приподнятый крестообразный лабиринт” и “открытое поле”
Тест “приподнятый крестообразный лабиринт” (ПКЛ) проводили в аппарате 110 × 110 см с двумя открытыми и двумя закрытыми рукавами, соединенными центральной зоной. Высота стенок закрытых рукавов составляла 40 см, ширина рукавов – 11 см. Лабиринт находился на высоте 50 см над полом. Крыс помещали в центральную зону установки головой в сторону одного из открытых рукавов. Длительность теста составляла 5 мин.
Тест “открытое поле” (ОП) проводили в круглой арене диаметром 100 см с черными стенками высотой 30 см. Крыс помещали в центр арены, длительность теста составляла 5 мин.
Аппараты тщательно очищали после каждого животного.
Тесты ПКЛ и ОП проводили в разные дни (с интервалом в 24 ч).
Поведение фиксировалось и обрабатывалось с помощью трекинговой видеосистемы Noldus Ethovision.
Статистическая обработка данных
Статистическая обработка осуществлялась программами Statistica 7.0 и GraphPad Prism 6. Данные проверяли на нормальность визуально по гистограммам распределения и с применением теста Колмогорова–Смирнова. Достоверность различий между контрольной и экспериментальной группами проводили с применением дисперсионного анализа ANOVA и Tukey post hoc. Достоверность различий в долях животных с ангедонией оценивали с помощью точного критерия Фишера. Различия считали значимыми при p < 0.05.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЙ
Тест на вкусовое предпочтение
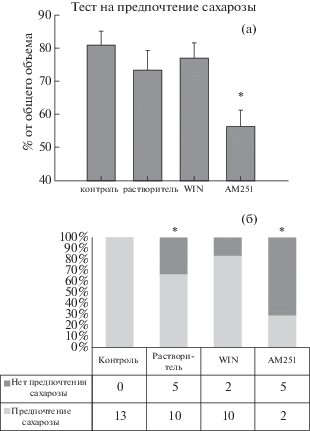
Тест на вкусовое предпочтение был проведен на 13 контрольных крысах, 15 крысах, получивших растворитель, 12 крысах, получивших WIN, и 7 крысах, получивших AM251. Все контрольные крысы демонстрировали преимущественное потребление сахарозы (более 60% от общего объема потребленной жидкости). Доля потребления раствора сахарозы от общего объема выпитой жидкости составила 80.83 ± 4.24% в контрольной группе, 73.27 ± 6.0% в группе, получившей растворитель, 76.95 ± 4.56% у крыс, получивших WIN-55,212-2, и 56.13 ± 5.12% у крыс, получивших AM251. Доля потребленной сахарозы была достоверно ниже у крыс группы AM251 по сравнению с контролем (тест Манна–Уитни, p = 0.008) (рис. 1 (а)). При этом среди крыс, перенесших ЭС, у части не было предпочтения сахарозы. За отсутствие вкусового предпочтения мы приняли потребление преимущественно воды или приблизительно равных объемов воды и сахарозы (менее 55% сахарозы). Ангедония наблюдалась у 33% крыс, получивших растворитель, 17% крыс, получивших WIN, и 71% крыс, получивших АМ251 (рис. 1 (б)). Таким образом, введение АМ251 привело к значительному увеличению доли крыс, демонстрирующих депрессивно-подобное поведение, в то время как у крыс, получивших WIN, доля таких крыс была снижена.
Рис. 1.
Тест на вкусовое предпочтение. а) Потребление сахарозы у контрольных крыс и крыс, перенесших ЭС и получивших растворитель, WIN-55,212-2, или АМ251. * – достоверное отличие от контрольной группы при р < 0.05, тест Манна–Уитни. б) Доля крыс с отсутствием предпочтения сахарозы (%). В таблице указаны n животных в каждой группе. Контроль – крысы без ЭС; растворитель – крысы, перенесшие ЭС и получившие растворитель (5% ДМСО + 1% твин-80); WIN – крысы, перенесшие ЭС и получившие агонист эндоканнабиноидных рецепторов WIN-55,212-2; АМ251 – крысы, перенесшие ЭС и получившие антагонист СВ1 рецепторов АМ251. * – достоверное отличие от контроля при p < 0.05, точный критерий Фишера.
Fig. 1. Taste preference test. a) Sucrose consumption in control rats and rats after SE received vehicle, WIN-55,212-2, or AM251. * – significant difference in comparison with the control group at p < 0.05, Mann–Whitney U test. б) The percentage of rats lacking the preference for sucrose (%). The table shows n animals in each group. Control – rats without SE; vehicle – rats received vehicle (5% DMSO + 1% Tween-80) after SE; WIN – rats received an agonist of endocannabinoid receptors WIN-55,212-2 after SE; AM251 – rats received an antagonist of CB1 receptors AM251. * – significant difference from control at p < 0.05, Fisher’s exact test.
Приподнятый крестообразный лабиринт
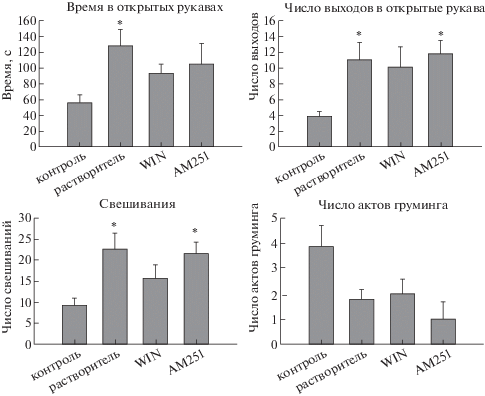
В тесте ПКЛ были получены следующие результаты у групп контроль, растворитель, WIN, AM251. Крысы, получившие растворитель, совершали больше выходов (ANOVA, F(3, 47) = 4.839, p = 0.005, Tukey post hoc) и проводили больше времени в открытых рукавах лабиринта по сравнению с контрольной группой (ANOVA, F(3, 47) = 3.433, p = 0.024, Tukey post hoc). Крысы, получившие WIN, не отличались от контроля; в группе крыс, получивших АМ251, наблюдался большой разброс по этому параметру (рис. 2). Также было увеличение числа свешиваний с открытых рукавов в группе с растворителем и в группе АМ251 (ANOVA, F(3, 47) = 4.057, p = 0.012, Tukey post hoc). Крысы WIN не отличались от контроля (рис. 2). Число актов груминга уменьшено во всех группах, хотя и статистически недостоверно. В группе АМ251 это уменьшение было наиболее выраженным (ANOVA, F(3, 47) = 3.109, p = 0.059, Tukey post hoc) (рис. 2).
Рис. 2.
Параметры поведения в тесте “приподнятый крестообразный лабиринт”. Контроль – крысы без ЭС (n = 16); растворитель – крысы, перенесшие ЭС и получившие растворитель (5% ДМСО + 1% твин-80) (n = 17); WIN – крысы, перенесшие ЭС и получившие агонист эндоканнабиноидных рецепторов WIN-55,212-2 (n = 12); АМ251 – крысы, перенесшие ЭС и получившие антагонист эндоканнабиноидных СВ1 рецепторов АМ251 (n = 7). * – достоверное отличие от контроля при p < 0.05, ANOVA.
Fig. 2. Parameters of behavior in the elevated plus maze. Control – no SE (n = 16); vehicle – rats received vehicle after SE (5% DMSO + 1% Tween-80) (n = 17); WIN – rats received an agonist of endocannabinoid receptors WIN-55,212-2 after SE (n = 12); AM251 – rats received an antagonist of CB1 receptors AM251 (n = 7). * – significant difference from control at p < 0.05, ANOVA.
Открытое поле
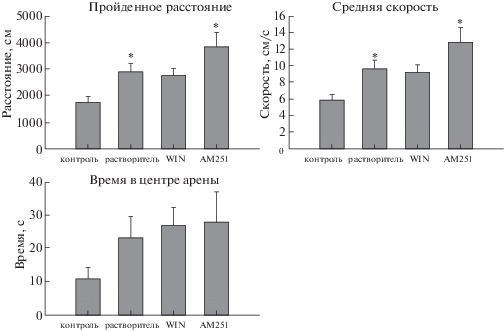
Тест ОП после ЭС показал, что у крыс, перенесших ЭС и получивших растворитель и АМ251, пройденное в арене расстояние было значительно больше, чем у крыс контрольной группы (ANOVA, F(3, 47) = 6.22, p = 0.001) (рис. 3). Средняя скорость также увеличена в этих группах (ANOVA, F(3, 47) = 6.185, p = = 0.001) (рис. 3). У крыс всех групп, перенесших ЭС, наблюдалось увеличение времени, проведенного в центре, но это увеличение статистически недостоверно (ANOVA, F(3, 47) = = 1.755, p = 0.169) (рис. 3). В числе случаев и продолжительности грумингов и стоек разница между группами найдена не была.
Рис. 3.
Параметры поведения в тесте “открытое поле”. Контроль – крысы без ЭС (n = 16); растворитель – крысы, перенесшие ЭС и получившие растворитель (5% ДМСО + 1% твин-80) (n = 17); WIN – крысы, перенесшие ЭС и получившие агонист эндоканнабиноидных рецепторов WIN-55,212-2 (n = 12); АМ251 – крысы, перенесшие ЭС и получившие антагонист СВ1 рецепторов АМ251 (n = 7). * – достоверное отличие от контроля при p < 0.05, ANOVA.
Fig. 3. Parameters of the behavior in the open field test. Control – no SE (n = 16); vehicle – rats received vehicle after SE (5% DMSO + 1% Tween-80) (n = 17); WIN – rats received an agonist of endocannabinoid receptors WIN-55,212-2 after SE (n = 12); AM251 – rats received an antagonist of CB1 receptors AM251 (n = 7). * – significant difference from control at p < 0.05, ANOVA.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
В нашей работе впервые изучены эффекты активации и ингибирования эндоканнабиноидной системы в ранний период после повреждающего воздействия на мозг (ЭС) на развитие поведенческих нарушений в хронический период. Были проведены тесты ПКЛ, ОП и ТСК для исследования тревожности и исследовательского поведения у крыс через 4 мес. после ЭС.
Крысы, перенесшие ЭС, проводили достоверно больше времени в открытых рукавах и совершали больше выходов в открытые рукава, а также больше свешиваний и меньше актов груминга, чем контрольные животные. Хорошо известно, что интактные крысы в тесте ПКЛ предпочитают меньше выходить в открытые рукава и проводить там меньше времени, а увеличение показателей этих параметров связывают с уменьшением тревожности [Pellow et al., 1985], поэтому такое поведение можно рассматривать как снижение тревожного и усиление исследовательского поведения. Это может быть обусловлено повышенной импульсивностью и нарушением оценки риска у крыс, перенесших ЭС [Detour et al., 2005]. В тесте ОП у крыс после ЭС была обнаружена выраженная гиперактивность. Сходные данные были получены в экспериментах на моделях ЭС и другими авторами [Brandt et al., 2006; Detour et al., 2005; Tchekalarova et al., 2017].
Введение агониста эндоканнабиноидной системы WIN в ранний период после ЭС незначительно уменьшило выраженность поведенческих изменений в ПКЛ и не повлияло на поведение в ОП. Введение АМ251 не оказало эффекта на поведение в ПКЛ, но привело к незначительному увеличению гиперактивности в ОП. Таким образом, модуляция эндоканнабиноидной системы оказала слабый эффект на отставленные изменения в тревожном и исследовательском поведении и не повлияла на развитие гиперактивности.
Помимо усиления исследовательского поведения и гиперактивности, у части крыс после ЭС были обнаружены признаки депрессивно-подобного поведения – ангедония, что согласуется с данными других авторов [Pineda et al., 2010]. Среди крыс группы АМ251 оказалась наибольшая доля животных с депрессивно-подобным поведением, а среди крыс, получивших агонист эндоканнабиноидных рецепторов, – наименьшая. Таким образом, активация эндоканнабиноидной системы могла уменьшить вероятность развития депрессивно-подобного поведения, а блокада этой системы, напротив, увеличить ее.
Показано, что агонисты рецепторов эндоканнабиноидной системы оказывают протекторный эффект на нейроны при эксайтотоксическом повреждении [Chiarlone et al., 2014]. Мы предполагаем, что активация рецепторов эндоканнабиноидной системы гиппокампа, неокортекса, стриатума и ряда других структур мозга, для которых у крыс показана высокая экспрессия этих рецепторов [McLaughlin et al., 2014], могла привести к уменьшению эксайтотоксического повреждения нейронов и запускаемых им нейродегенерации и реорганизации нейронных связей в этих областях мозга и предотвращению развития поведенческих нарушений. В нашей предыдущей работе было показано, что однократное введение агониста рецепторов эндоканнабиноидов WIN-55,212-2 через 4 ч после литий-пилокарпинового ЭС подавляло спонтанную эпилептиформную активность в коре и гиппокампе крыс, которая наблюдалась в течение двух недель после статуса [Suleymanova et al., 2016]. Таким образом, однократное введение агониста рецепторов эндоканнабиноидов может обладать достаточно длительным антиконвульсантным действием. Этим может объясняться отставленный протекторный эффект агониста, хотя и слабо выраженный.
Кроме того, известно, что активация рецепторов эндоканнабиноидной системы, в частности СВ2 рецепторов, может иметь противовоспалительный эффект [Maresz et al., 2005]. На многих моделях показано, что ЭС вызывает быстрый и мощный воспалительный ответ в мозге. Уже через 30–60 мин после начала ЭС в гиппокампе и коре крыс и мышей обнаруживаются повышенные уровни мРНК провоспалительных интерлейкинов [Vezzani et al., 2015]. Воспаление может являться одной из причин дегенерации нейронов и реорганизации нейрональных сетей после ЭС и эпилептических припадков и, следовательно, также иметь вклад в развитие функциональных нарушений [Vezzani et al., 2011]. Интересно, что для объяснения механизма развития депрессии становится все более популярной воспалительная гипотеза [Leonard, 2017]. Введение неселективного агониста рецепторов эндоканнабиноидных рецепторов в ранний период после ЭС могло ослабить вызванное длительными судорогами нейровоспаление, снизив таким образом вероятность развития депрессивно-подобного поведения в хронический период.
В нашей работе применение антагониста СВ1 рецепторов не предотвратило развитие поведенческих нарушений и даже скорее усугубило их. В ряде работ показано, что антагонисты СВ1 рецепторов могут оказывать проконвульсантный эффект [Kozan et al., 2009; Vinogradova et al., 2011; von Rüden et al., 2015]. Можно предположить, что при блокаде СВ1 рецепторов перестает действовать эндогенный механизм ограничения синаптической передачи, что приводит к усугублению патологического возбуждения и эксайтотоксического повреждения нейронов в острый период после ЭС. Также нарушение механизма терминации эпилептиформной активности может вызвать более выраженный воспалительный ответ и, следовательно, усугубление отставленных поведенческих изменений.
ЗАКЛЮЧЕНИЕ
В результате проведенной работы было обнаружено, что в хронический период после эпилептического статуса происходит значительное увеличение исследовательской и двигательной активности в тестах ПКЛ и ОП, у части животных наблюдается депрессивно-подобное поведение. Введение агониста рецепторов эндоканнабиноидной системы WIN-55,212-2 не повлияло значительно на эмоциональный ответ в тесте ПКЛ и на гипер-активное поведение в ОП. Введение АМ251 привело к увеличению доли крыс с депрессивно-подобным поведением.
Работа была поддержана грантом Российского фонда фундаментальных исследований, проект №16-34-01282 мол_а.
Список литературы
Казимирова Е.А., Гришкина М.Н., Лебедева Н.Н. Психофизиологические особенности больных депрессивным и тревожно-депрессивным расстройствами. Журн. высш. нерв. деят. 2017. 67 (3): 288–298.
Шубина Л.В., Кичигина В.Ф. Протекторное влияние агониста СВ1 рецепторов WIN 55.212-2 при развитии судорожной активности в мозге на моделях височной эпилепсии in vivo. Журн. высш. нерв. деят. 2011. 61 (1): 94–101.
Bocquillon P., Dujardin K., Betrouni N., Phalempin V., Houdayer E., Bourriez J.-L., Derambure P., Szurhaj W. Attention impairment in temporal lobe epilepsy: a neurophysiological approach via analysis of the P300 wave. Hum. Brain Mapp. 2009. 30: 2267–2277.
Brandt C., Gastens A.M., Sun M., Hausknecht M., Loscher W. Treatment with valproate after status epilepticus: effect on neuronal damage, epileptogenesis, and behavioral alterations in rats. Neuropharmacology. 2006. 51: 789–804.
Brandt C., Mula M. Anxiety disorders in people with epilepsy. Epilepsy & Behavior. 2016. 59: 87–91.
Chiarlone A., Bellocchio L., Blázquez C., Resel E., Soria-Gómez E., Cannich A., Ferrero J.J., Sagredo O., Benito C., Romero J., Sánchez-Prieto J., Lutz B., Fernández-Ruiz J., Galve-Roperh I., Guzmán M. A restricted population of CB1 cannabinoid receptors with neuroprotective activity. Proc. Natl. Acad. Sci. U. S. A. 2014. 111: 8257–62.
Cronin J., Dudek F.E. Chronic seizures and collateral sprouting of dentate mossy fibers after kainic acid treatment in rats. Brain Res. 1988. 474: 181–184.
Delorenzo R.J., Garnett L.K., Towne A.R., Waterhouse Y.E.J., Boggs J.G., Morton L., Choudhry A., Barnes T., Ko I.D. Comparison of status epilepticus with prolonged seizure episodes lasting from 10 to 29 minutes. 1999. Epilepsia. 40 (2): 164–9.
Detour J., Schroeder H., Desor D., Nehlig A. A 5-Month Period of Epilepsy Impairs Spatial Memory, Decreases Anxiety, but Spares Object Recognition in the Lithium-pilocarpine Model in Adult Rats. Epilepsia. 2005. 46 (4): 499–508.
Dham B.S., Hunter K., Rincon F. The epidemiology of status epilepticus in the United States. Neurocrit. Care. 2014. 20: 476–483.
Fiest K.M., Dykeman J., Patten S.B., Wiebe S., Kaplan G.G., Maxwell C. J., Bulloch A.G.M., Jette N. Depression in epilepsy a systematic review and meta-analysis. Neurology. 2013. 80 (6): 590–599.
Friedman D., Devinsky O. Cannabinoids in the treatment of epilepsy. New England Journal of Medicine. 2015. 373 (11): 1048–1058.
Fujikawa D.G., Itabashi H.H., Wu A., Shinmei S.S. Status epilepticus-induced neuronal loss in humans without systemic complications or epilepsy. Epilepsia. 2000. 41: 981–991.
Gorter J.A., van Vliet E.A., Aronica E. Status epilepticus, blood–brain barrier disruption, inflammation, and epileptogenesis. Epilepsy & Behavior. 2015. 49: 13–16.
Gröticke I., Hoffmann K., Löscher W. Behavioral alterations in the pilocarpine model of temporal lobe epilepsy in mice. Exp. Neurol. 2007. 207: 329–49.
Holmes G.L. Cognitive impairment in epilepsy: the role of network abnormalities. Epileptic Disorders. 2015. 17 (2): 101–116.
Kozan R., Ayyildiz M., Agar E. The effects of intracerebroventricular AM-251, a CB1-receptor antagonist, and ACEA, a CB1-receptor agonist, on penicillin-induced epileptiform activity in rats. Epilepsia. 2009. 50: 1760–1767.
Leitinger M., Höller Y., Kalss G., Rohracher A., Novak H.F., Höfler J., Dobesberger J., Kuchukhidze G., Trinka E. Epidemiology-based mortality score in status epilepticus (EMSE). Neurocritical care. 2015. 22 (2): 273–282.
Leonard B.E. Inflammation and depression: a causal or coincidental link to the pathophysiology? Acta neuropsychiatrica. 2017. 1–16.
Maia G.H., Quesado J.L., Soares J.I., do Carmo J.M., Andrade P.A., Andrade J.P., Lukoyanov N.V. Loss of hippocampal neurons after kainate treatment correlates with behavioral deficits. PLoS ONE. 2014. 9 (1): e84722.
Maresz K., Carrier E.J., Ponomarev E.D., Hillard C.J., Dittel B.N. Modulation of the cannabinoid CB2 receptor in microglial cells in response to inflammatory stimuli. Journal of neurochemistry. 2005. 95 (2): 437–445.
McLaughlin R.J., Hill M.N., Gorzalka B.B. A critical role for prefrontocortical endocannabinoid signaling in the regulation of stress and emotional behavior. Neurosci. Biobehav. Rev. 2014. 42: 116–31.
Pellow S., Chopin P., File S.E., Briley M. Validation of open: closed arm entries in an elevated plus-maze as a measure of anxiety in the rat. Journal of neuroscience methods. 1985.14 (3): 149–167.
Pineda E., Shin D., Sankar R., Mazarati A. M. Comorbidity between epilepsy and depression: experimental evidence for the involvement of serotonergic, glucocorticoid, and neuroinflammatory mechanisms. Epilepsia. 2010. 51 Suppl 3: 110–114.
Racine R.J. Modification of seizure activity by electrical stimulation. II. Motor seizure. Electroencephalogr Clin Neurophysiol. 1972. 32: 281–294.
Rowley S., Sun X., Lima I.V., Tavenier A., Oliveira A.C.P., Dey S.K., Danzer S.C. Cannabinoid receptor 1/2 double-knockout mice develop epilepsy. Epilepsia. 2017. 1–5.
Suleymanova E.M., Shangaraeva V.A., van Rijn C.M., Vinogradova L.V. The cannabinoid receptor agonist WIN55.212 reduces consequences of status epilepticus in rats. Neuroscience. 2016. 334: 191–200.
Tchekalarova J., Atanasova D., Nenchovska Z., Atanasova M., Kortenska L., Gesheva R., Lazarov N. Agomelatine protects against neuronal damage without preventing epileptogenesis in the kainate model of temporal lobe epilepsy. Neurobiol. Dis. 2017. 104: 1–14.
Vezzani A., French J., Bartfai T., Baram T.Z. The role of inflammation in epilepsy. Nature reviews neurology. 2011. 7 (1): 31–40.
Vezzani A., Dingledine R., Rossetti A.O. Immunity and inflammation in status epilepticus and its sequelae: Possibilities for therapeutic application. Expert Rev Neurother. 2015. 15: 1081–1092.
Vinogradova L.V., Shatskova A.B., Van Rijn C.M. Pro-epileptic effects of the cannabinoid receptor antagonist SR141716 in a model of audiogenic epilepsy. Epilepsy Res. 2011. 96: 250–256.
von Rüden E.L., Jafari M., Bogdanovic R.M., Wotjak C.T., Potschka H. Analysis in conditional cannabinoid 1 receptor-knockout mice reveals neuronal subpopulation-specific effects on epileptogenesis in the kindling paradigm. Neurobiol Dis. 2015. 73: 334–347.
Дополнительные материалы отсутствуют.
Инструменты
Журнал высшей нервной деятельности им. И.П. Павлова


